-
白蜡虫( Ericerus pela Chavannes)属于半翅目(Hemiptera)蜡介科(Coccidae)白蜡蚧属( Ericerus ),寄居于女贞( Ligustrum lucidum Ait)和白蜡树( Fraxinus chinensis Roxb)等植物,其二龄雄若虫分泌天然的脂类物质,在现代工业广泛的应用于化工、食品、医药、信息技术、化妆品等,是中国独有的具有重要经济价值的资源昆虫[1]。它在我国分布广泛,北至辽宁南至海南均有分布[2]。白蜡虫一龄若虫分布在寄主植物叶片上,二龄若虫分布在寄主植物枝条上。二龄雌若虫暴露在空气中,雄若虫会在枝条上分泌蜡层覆盖虫体,雄虫泌蜡消耗较多的能量。它们主要以吸食寄主植物的韧皮部汁液来获取生长发育所需的能量和营养,而刺吸式昆虫吸取的寄主植物汁液常常缺乏一些必须氨基酸等营养,其体共生菌在营养供给方面为宿主昆虫的生长发育提供了有力的支撑[3]。
昆虫体内存在着大量的共生菌,在昆虫的生长、发育中发挥着不可替代的作用。如布赫纳氏菌( Buchnera )可以为其宿主蚜虫提供多种必需氨基酸[4]和维生素[5],参与宿主昆虫的能量代谢[6]和嘌呤代谢[7];立克次氏体( Rickettsia )对宿主昆虫有杀雄作用、影响宿主孤雌生殖、发育速度、提高环境适合度等[8-11],还可以提高宿主对病原菌与天敌的抵抗力[12-13];沃尔巴克氏体菌属( Wolbachia )与立克次氏体同属立克次氏体目(Rickettsiales),它与立克次氏体有类似的功能,如通过诱导细胞质不亲和、孤雌生殖、雌性化和杀雄作用来影响后代雌雄比例[14-17],影响宿主昆虫的营养代谢[18],为宿主提供保护作用等[19]。研究还证明,蜜蜂的肠道共生菌可以合成一些酶帮助蜜蜂降解、消化碳水化合物[20]; 果蝇肠道共生菌群通过调节宿主激素信号来促进果蝇的系统增长和发育[21],提高宿主免疫力等[22]。
目前为止,关于白蜡虫共生菌的研究较少。刘魏魏等[23]与徐冬丽等[24]分别对白蜡虫体内杀雄菌属( Arsenophonus )和立克次氏体进行了分子检测,王雪庆等[25]研究了白蜡虫不同发育阶段分泌的蜡花中微生物的多样性,孙涛等[26]研究了长春与昆明白蜡虫越冬时共生菌多样性的异同[26]。白蜡虫二龄雄若虫分泌大量的白蜡,具有极高的经济价值,但目前为止还没有白蜡虫泌蜡期共生菌的研究。本研究利用DNA克隆文库法对二龄白蜡虫的共生菌进行测序、鉴定和统计,探明白蜡虫二龄雌雄虫中共生菌的种类和结构,比较二者多样性的异同,并对其中重要共生菌进行功能分析。
-
本实验使用的白蜡虫采自于云南省昆明市官渡区小哨村。采集时将白蜡虫二龄若虫连同枝条一并采下带回实验室,放入-80℃冰箱中速冻,将白蜡虫虫体作为待测样品。收集完成后,将以上虫体样品约300头送至诺禾致源公司,进行16S rRNA V3、V4区的测序,每个样品做3个生物学重复。
-
样品的基因组DNA使用CTAB方法提取,用琼脂糖凝胶电泳检测DNA的纯度和浓度,然后取一定量的样品置于离心管中,无菌水稀释至1 ng·μL-1。利用得到的该DNA模板,用引物341F:5′-CCTAYGGGRBGCASCAG-3′和806R:5′-GGACTACNNGGGTATCTAAT-3′扩增共生菌16S rRNA的V3和V4区。将得到的PCR产物用2%浓度的琼脂糖凝胶进行电泳检测,根据PCR产物浓度进行等量混样,并用Qiagen公司提供的胶回收试剂盒回收产物。最后, 利用TruSeq DNA PCR-Free Sample Preparation Kit建库试剂盒和HiSeq2500 PE250完成文库的构建和上机测序工作。
-
对下机数据中每个样品的reads进行拼接,得到原始Tags数据(Raw Tags)后过滤处理,最终获得高质量的Tags数据(Clean Tags),并使用Qiime(V1.9.1)对其进行质量控制。对以上的Tags数据与数据库进行比对,检测、去除嵌合体序列,最终得获取有效标签(Effective Tags)。
-
使用Uparse软件(Uparse v7.0.1001),以97%相似度作为一个OTU(Operational Taxonomic Unit)的划分标准,对有效标签进行聚类。用Mothur方法与SILVA的SSUrRNA数据库进行物种注释分析(设定阈值为0.8~1),获得分类学信息并分别在各个分类水平统计各样品中的群落组成。
-
使用Qiime软件(Version 1.9.1)alpha_rarefaction.py命令对Chao1,Shannon,Simpson,ACE指数进行计算,该命令包括single_rarefaction.py,alpha_diversity.py,collate_alpha.py,make_rarefaction_plots.py四个脚本。
-
白蜡虫细菌16S rRNA高通量测序信息处理后,所有样品共得到1 869 191个原始标签,拼接优化后有效标签为1 798 646条。以97%相似度为标准进行聚类分析,得到1 334个OTUs(表 1)。
表 1 白蜡虫二龄雌雄虫共生菌16S rDNA高通量测序基本信息
Table 1. Basic information of 16S rRNA high-throughput sequencingof symbiotic bacteria in the second-instar male and female of Ericerus pela
样品名称
Sample Name原始标签数
Raw tags拼接后标签数
Combined tags有效标签数
Qualified tagsOTU数
OTUsSF1 53 959 51 861 37 414 128 SF2 55 480 52 802 37 119 205 SF3 58 618 56 851 41 962 187 SM1 59 278 57 515 42 531 164 SM2 64 936 61 829 44 431 198 SM3 68 561 66 760 53 714 79 注:SF-白蜡虫二龄雌虫,SM-白蜡虫二龄雄虫;1、2、3分别表示该组3个重复的样品编号。
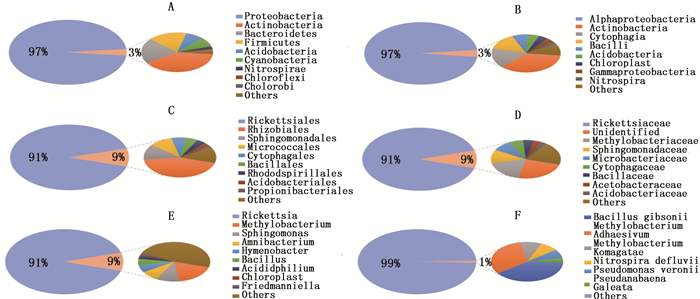
Notes: SF-second-instar female of Eracerus pela , SM-pela second-instar male of Eracerus ; 1, 2, 3 represent the three replicate sample numbers of the group.对白蜡虫二龄雌雄虫中全部OTUs进行注释后,进行统计分析。在门分类单元,共注释到了变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)等共14个门,其中, 变形菌门为优势菌,占97%(图 1A);在纲分类单元水平,共注释到了α-变形菌纲(Alphaproteobacteria)、放线菌纲(Actinobacteria)、纤维粘网菌纲(Cytophagia)、杆菌纲(Bacilli)、梭菌纲(Clostridia)等29个纲,优势菌为α-变形菌纲,占97%(图 1B),其中,还包括了与松树叶绿体部分基因相似度极高的一段序列;在目分类单元水平,共注释到立克次体目、根瘤菌目、鞘脂单胞菌目(Sphingomonadales)、Micrococcales、噬纤维菌目(Cytophagales)等60个目,其中,立克次体目为优势菌,占91%(图 1C);在科分类单元水平,共注释到了立克次氏体科(Rickettsiaceae)、未鉴定的某科、甲基杆菌科(Methylobacteriaceae)、鞘酯菌科(Sphingomonadaceae)、微杆菌科(Microbacteriaceae)等共109个科,其中,立克次氏体科为优势菌,占91%(图 1D);在属分类单元水平,共注释到了立克次体属( Rickettsia )、甲基杆菌属( Methylobacterium )、鞘氨醇单胞菌属( Sphingomonas )、 Amnibacterium 、薄层菌属( Hymenobacter )等165个属,其中,立克次体属为优势菌,占91%(图 1E);在种分类单元水平,共注释到了吉氏芽孢杆菌( Bacillus gibsonii Nielsen)、 Methylobacterium adhaesivum Gallego 、 Methylobacterium komagatae Kato 、 Nitrospira defluvii 、维氏假单胞菌( Pseudomonas veronii )、 Pseudanabaena galeata Bocher等55个种(图 1F )。
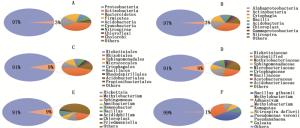
图 1 白蜡虫二龄雌雄若虫共生菌在不同分类等级上的物种比例
Figure 1. Species proportion of symbiotic bacteria in the second-instar male and femaleof Ericerus pela at different taxonomic levels
对二龄雌雄白蜡虫共生菌相对含量前30的OTU序列进行处理、统计后发现:在二龄若虫中,立克次氏体相对含量最高,其中,雌虫为85.740%(表 2),雄虫为95.462%(表 3)。此外,雌虫体内根瘤菌目(OTU 13、OTU 8)的含量也较高,分别为3.426%与1.891%,其次为 Amnibacterium 与鞘氨醇单胞菌属,分别为1.384%与1.058%。在雄虫中,次优势菌为芽孢杆菌纲的吉氏芽孢杆菌(0.747%),根瘤菌目(OTU13,含量0.708%;OTU8,含量0.600%)和鞘氨醇单胞菌(OTU21, 含量0.360%)。
表 2 白蜡虫二龄雌虫中共生菌前20含量及分类地位
Table 2. Content and taxonomic status of symbiotic bacteria in the second-instar female of Eracerus pela
OTU
No.分类地位 Taxonomic status 含量/%
Content纲 Class 目 Order 科 Family 属 Genus 种 Species 1 α-Proteobacteria Rickettsiales Rickettsiaceae Rickettsia 85.740 13 α-Proteobacteria Rhizobiales 3.426 8 α-Proteobacteria Rhizobiales Methylobacteriaceae Methylobacterium 1.891 22 Actinobacteria Micrococcales Microbacteriaceae Amnibacterium 1.384 21 α-Proteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas 1.058 31 Cytophagia Cytophagales Cytophagaceae Hymenobacter 0.630 11 α-Proteobacteria Rhizobiales Methylobacteriaceae Methylobacterium Methylobacterium adhaesivum 0.580 25 α-Proteobacteria Rhodospirillales Acetobacteraceae Acidiphilium 0.411 40 α-Proteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas 0.357 53 Actinobacteria Propionibacteriales Propionibacteriaceae Friedmanniella 0.250 75 Acidobacteria Acidobacteriales Acidobacteriaceae Bryocella 0.243 2 α-Proteobacteria Rickettsiales SRickettsiaceae Rickettsia 0.188 110 Acidobacteria Acidobacteriales Acidobacteriaceae Terriglobus 0.170 123 Actinobacteria Frankiales 0.159 127 Actinobacteria Micrococcales Dermacoccaceae 0.153 93 Nitrospira Nitrospirales Nitrospiraceae Nitrospiraceae Nitrospira defluvii 0.152 139 Cytophagia Cytophagales Cytophagaceae Hymenobacter 0.141 103 Cytophagia Cytophagales Cytophagaceae Hymenobacter 0.118 168 α-Proteobacteria Rhizobiales Methylobacteriaceae Methylobacterium Methylobacterium komagatae 0.117 115 α-Proteobacteria Sphingomonadales 0.102 表 3 白蜡虫二龄雄虫中共生菌前20含量及分类地位
Table 3. Content and taxonomic status of symbiotic bacteria in the second-instar male of Eracerus pela
OTU
No.分类地位 Taxonomic status 含量/%
Content纲 Class 目 Order 科 Family 属 Genus 种 Species 1 α-Proteobacteria Rickettsiales Rickettsiaceae Rickettsia 95.462 48 Bacilli Bacillales Bacillaceae Bacillus Bacillus gibsonii 0.747 13 α-Proteobacteria Rhizobiales 0.708 8 α-Proteobacteria Rhizobiales Methylobacteriaceae Methylobacterium 0.600 21 α-Proteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas 0.360 2 α-Proteobacteria Rickettsiales Rickettsiaceae Rickettsia 0.171 20 γ-Proteobacteria Pseudomonadales Pseudomonadaceae Pseudomonas Pseudomonas veronii 0.135 15 Bacilli Bacillales Bacillaceae Bacillus 0.132 422 α-Proteobacteria Rickettsiales Rickettsiaceae Rickettsia 0.084 22 Actinobacteria Micrococcales Microbacteriaceae Amnibacterium 0.071 103 Cytophagia Cytophagales Cytophagaceae Hymenobacter 0.065 40 α-Proteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas 0.062 168 α-Proteobacteria Rhizobiales Methylobacteriaceae Methylobacterium Methylobacteriumko magatae 0.061 115 α-Proteobacteria Sphingomonadales 0.050 147 α-Proteobacteria Rhizobiales 0.050 98 Actinobacteria Micrococcales Microbacteriaceae 0.040 319 β-Proteobacteria Burkholderiales Oxalobacteraceae Massilia 0.040 180 Bacilli Bacillales Planococcaceae Solibacillus Solibacillus silvestris 0.037 33 Chloroplast Chloroplast Chloroplast Chloroplast Cercis gigantea 0.035 190 Actinobacteria Micrococcales Microbacteriaceae Microbacterium 0.035 -
物种的多样性通常以环境中的物种数、Shannon、Simpson、Chao1、ACE进行描述,其值越高,说明样品的多样性越高。分析结果表明:无论物种个数、Chao1、ACE、Shannon、Simpson等指数,二龄雌虫均大于二龄雄虫(表 4),因此,认为二龄雌虫共生菌的多样性高于二龄雄虫。
表 4 白蜡虫二龄幼虫共生菌多样性分析
Table 4. Diversity analysis of symbiotic bacteria in the second instar larvae of Ericerus pela
分组
Group物种个数
Number of speciesChao1 ACE Shannon Simpson 二龄雌虫(SF) 265 168.361 173.844 1.228 0.262 二龄雄虫(SM) 255 153.173 166.651 0.473 0.088 -
本试验中,将白蜡虫共生菌的数据与其它已研究的昆虫数据做对比,发现白蜡虫共生菌群落结构与其它昆虫相比,存在着极大的差异,具有独特性。有14个门,29个纲,60个目,109个科,165个属,55个种在二龄雌雄白蜡虫中被注释。在门分类单元水平,优势菌是变形菌门,与已研究的大部分昆虫的优势菌相同; 在纲和目分类单元中,α-变形菌纲的立克次氏体目为优势菌,与泽兰实蝇( Procecidochares utilis Stone)相同[35],而在灰飞虱( Laodelphax striatellus Fallén)、烟粉虱( Bemisiatabaci Gennadius )、茶尺蠖( Ectropic oblique Prout)中作为次优势菌被发现[29-30, 38];当具体到下面的分类单元中(科与属)发现,即便在半翅目,白蜡虫与其它昆虫的共生菌也存在着巨大的差异:如豌豆长管蚜( Acyrthosiphon pisum Harris)与黑豆蚜( Aphis fabae Scopoli)的优势菌布赫纳氏菌,烟粉虱中的优势菌 Hamiltonella ,点蜂缘椿象( Riptortus clavatus Thunberg)与中华稻缘蝽( Leptocorisa chinensis Dallas)中的伯克氏菌属均没有在白蜡虫中被发现[27, 30-31];扶桑绵粉蚧( Phenacoccus solenopsis Tinsley)中的优势菌不动杆菌属、灰飞虱中的醋酸杆菌科(Acetobacteraceae)在白蜡虫中含量极低[28-29],其中,不动杆菌属在白蜡虫二龄雌虫中的相对含量约为万分之一,雄虫亿分之一,醋酸杆菌科在雌若虫中0.63%,雄若虫中0.04%。白蜡虫的次优势菌与其他昆虫相比也有巨大的差异,如根瘤菌目、芽孢杆菌目、鞘脂单胞菌目在其他的昆虫中均没有作为优势菌或次优势菌被发现。白蜡虫共生菌群落结构的独特,原因可能与其特殊的生活史、生活环境密不可分。
此外,孙涛等曾对昆明与长春的越冬白蜡虫的雌虫共生菌做过研究[26]。将本次实验得到的数据与之相比发现,它们之间既有相似,又有差异(图 2)。如在门分类单元,昆明与长春越冬雌虫变形菌门相对含量分别为41.57%、72.25%,为主要共生菌。在属分类单元,白蜡虫二龄若虫与长春越冬雌虫的优势菌均为立克次氏体,但后者的相对含量(55.77%)低于前者,然而昆明越冬雌虫的优势菌乳球菌属( Lactococcus )未在白蜡虫二龄若虫中发现;昆明越冬雌虫中的次优势菌假单胞菌属( Pseudomonas )、鞘氨醇单胞菌属、 Hymenobacter 在本实验中均被发现,且含量较高(表 2、3),长春越冬雌虫的次优势菌仅有假单胞菌属在白蜡虫二龄若虫中存在。白蜡虫二龄若虫与越冬虫态的内共生菌差异较大,推测这可能是白蜡虫不同的采集地点、不同的发育龄期、不同的生境等多方面原因造成的。
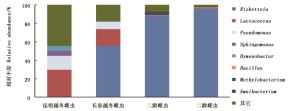
图 2 白蜡虫二龄若虫与昆明、长春越冬雌虫共生菌对比
Figure 2. Contrast of symbiotic bacteria between the second-instar nymphs of Ericerus pela and overwintering Ericerus pela in Kunming and Changchun
本研究中,立克次氏体属无论在雌虫还是雄虫中含量均最高,分别为85.740%和95.462%,处于绝对优势地位。立克次氏体常在脊椎动物中作为病原菌存在,后在豌豆蚜、烟粉虱等昆虫中相继被发现[40-41]。目前的研究发现,它对昆虫的作用主要有影响宿主的生殖、提高适合度和增加抵抗力三个方面。Majerus等[42]发现,立克次氏体对日本瓢虫( Propylea japonica Thunberg)有杀雄作用;Hagimori等[43]实验证明,立克次氏体可以影响芙新姬小蜂( Neochrysocharis formosa Westwood)卵母细胞的减数分裂,进而完成孤雌生殖[43];Elad等[41]和Himler等[44]的实验发现,立克次氏体对B型烟粉虱(MEAM1隐种)后代的存活率、产卵量以及发育速度都有不同程度的提高;同时,对烟粉虱的一些实验也表明,立克次氏体对宿主高温的忍耐性、对病原菌丁香假单胞菌( Pseudomonas syringae )和寄生蜂( Eretmocerus mundus Mercet)抵抗能力都有显著提升[11-13]。二龄白蜡虫雌虫生活在枝条上后终生不再移动,直至死亡,二龄白蜡虫雄虫也一直生活在枝条上,直至雄成虫羽化。这种不能移动的生长发育模式使得白蜡虫在抵御天敌方面处于天然的劣势地位,而立克次氏体可以提高宿主昆虫的环境适合度、增强对天敌和病原菌的可抵抗能力,这可能是白蜡虫体内立克次氏体含量异常高的原因之一。二龄雄若虫更是如此,它会在其体表分泌一层厚而致密的蜡层,虽然可以起到保温、保湿、防强光等作用,为白蜡虫提供一个有利于生存的微环境。但是其维持的微环境也有利于天敌的滋生,如白蜡虫花翅跳小蜂( Microterys ericeri Ishii)、白蜡虫啮小蜂( Tetrastichus kodaikandlensis Saraswa)、白蜡虫阔柄跳小蜂( Metaphycus ericeri Xuet Jiang)等时刻威胁着白蜡虫的生存[45]。与同时期的雌虫相比,雄虫缺乏高度角质化的甲壳素,使得立克次氏体对雄虫来说更为重要,这也可能是雄若虫立克次氏体含量高于雌若虫的原因之一。雌虫没有白蜡的覆盖,直接暴露在环境中,会受到风吹、阳光直射等自然环境的影响,相对多样的共生菌菌群可能提高对环境、天敌的适合度,保证雌虫的正常生长发育。
白蜡虫次优势菌方面,雌雄既有相似也存在着差异(表 2、3)。如根瘤菌目均在二者中被发现,且含量相对较高;但雄若虫中还存在芽孢杆菌属,其在短刀乳白蚁( Coptotermes acinaciformis Froggatt)、欧洲散白蚁( Reticulitermes lucifugus Rossi)中被报道具有固氮作用[46-47]。鞘氨醇单胞菌属在雌雄虫中也都被发现,它的代谢具有多样性,可以降解多种化合物,其中包括了除草剂和杀虫剂[48-49],它的存在可能提高白蜡虫对杀虫剂的抵抗力,而且没有致密蜡层包被、裸露在外、更容易受到杀虫剂影响的雌虫中含量(1.058%)高于雄虫(0.360%)也可以侧面印证这一观点;此外,该菌的生长会产生类胡萝卜素[50],类胡萝卜素既是一种天然的色素,又有抗氧化作用,还是维生素A的前体(β-胡萝卜素),因此,推测它与昆虫形成与树干相似的保护色、抗氧化、维生素A的合成等相关。除此之外,本次实验中还发现了与松树属叶绿体部分基因(Genebank序列号:NC_041108.1)相似度极高的一段序列,且含量较高,曾在茶尺蠖与白蜡虫幼虫肠道研究中出现类似现象[38, 24],被认为是昆虫取食污染所致。然而,二龄白蜡虫以韧皮部的汁液为食,造成样品污染的可能性较小,且在本实验室其它实验中发现白蜡虫虫卵中也有该片段的存在,所以基本排除样品污染的可能,该序列的鉴定与功能有待进一步的探索。
与大多数的昆虫共生菌不同,白蜡虫中缺乏可以提供营养、合成必须氨基酸的布赫纳氏菌,常见的沃尔巴克氏体菌也未被发现。与之相反的,白蜡虫体内立克次氏体相对含量高于85%,其功能可能不仅是提高宿主对环境适合度、天敌的防御能力,还可能存在其它的功能,如是否可以协助白蜡虫吸收或者提供营养?此外根瘤菌和芽孢杆菌是否可以通过体内固氮来满足白蜡虫生长发育和泌蜡的营养需求,还需要进一步研究。
-
白蜡虫二龄若虫共生菌种类丰富,共有14个门,29个纲,60个目,109个科,165个属得到注释。立克次氏体为白蜡虫雌雄二龄若虫的优势菌,且含量极高;雌雄若虫的次优势菌有所差异,二龄雌若虫的次优势菌按丰度排序依次为根瘤菌目、甲基杆菌、 Amnibacterium ,而雄虫为吉氏芽孢杆菌、根瘤菌目、甲基杆菌。此外,通过计算分析发现,白蜡虫二龄雌若虫α-多样性高于雄虫。
白蜡虫与其它昆虫的共生菌有很大差异,如立克次氏体在白蜡虫二龄若虫中占绝对优势,其它昆虫中常见的布赫纳氏菌和沃尔巴克氏体未在白蜡虫中发现。白蜡虫二龄若虫共生菌独特的现象可能与白蜡虫独特的生物习性、生态学特征和营养相关。
基于16S测序分析白蜡虫二龄雌雄若虫共生菌的多样性分析
Analysis on Structure and Diversity of Bacterial Community of the Second-instar Ericerus pela Nymph Based on 16S rRNA High-throughput Sequencing
-
摘要:
目的 探明白蜡虫二龄雌雄若虫共生菌的种类和结构。 方法 利用高通量测序技术,对白蜡虫二龄雌雄虫16S rRNA的V3-V4区进行高通量测序,使用Uparse软件对有效标签进行聚类,使用Mothur方法与SILVA的SSUrRNA数据库进行物种注释,分析雌雄间共生菌物种丰度及多样性的差异。 结果 共得到了1 798 646条有效标签,以97%相似度为标准进行聚类分析,得到1 334个OTUs,其中,有14个门,29个纲,60个目,109个科,165个属,55个种得到注释。与其他昆虫明显不同,白蜡虫二龄若虫中立克次氏体属为优势菌(雌85.740%,雄95.462%),缺乏布赫纳氏菌和沃尔巴克氏体。 结论 白蜡虫与其它昆虫的共生菌有很大差异,立克次氏体在白蜡虫二龄若虫中占绝对优势,具有固氮作用的根瘤菌目和芽孢杆菌目、能合成类胡萝卜素的鞘脂单胞菌目为次优势菌,在共生菌中占有一定比例。白蜡虫若虫共生菌独特的现象可能与白蜡虫独特的生物习性、生态学特征和营养相关。 Abstract:Objective To investigate the variation and diversity of symbiotic bacteria both in the second-instar male and female of Ericerus pela . Method The V3-V4 region of the 16S rRNA was performed using high-throughput sequencing technology. Uparse software was used to cluster the qualified labels. Species annotation was taken by using the Mothur and SILVA's SSUrRNA database to analysis the differences in species abundance and diversity between male and female symbiotic bacteria. Result There were 1798646 qualified labels identified in this experiment. Cluster analysis was performed with 97% similarity as the standard, and 1 334 OTUs (operational taxonomic unit) were obtained. After the annotation, 14 phylums, 29 classes, 60 orders, 109 families, 165 genera, and 55 species were obtained. E. pela is significantly different from the other insects. For the second-instar nymph, Rickettsia (85.740% in female, 95.462% in male) was the dominant bacteria while Buchnera and Wolbachia were absent. A total of 386 symbiotic bacteria were identified in the second-instar nymphs. Conclusion The endosymbiotic bacteria of E. pela are quite different from that of other insects. Rickettsia has an absolute advantage in the second-instar nymph of E. pela . Rhizobiales and Bacillales with nitrogen fixation, Sphingomonadales which can synthesize carotenoids, are the subdominant bacteria and occupy a certain proportion in symbiotic bacteria. The unique phenomenon of the E. pela symbiotic bacteria may be related to its unique biological habits, ecological characteristics and nutrition. -
Key words:
- Ericerus pela
- / second-instar nymph
- / 16S rRNA
- / symbiotic bacteria
- / Rickettsia
-
表 1 白蜡虫二龄雌雄虫共生菌16S rDNA高通量测序基本信息
Table 1. Basic information of 16S rRNA high-throughput sequencingof symbiotic bacteria in the second-instar male and female of Ericerus pela
样品名称
Sample Name原始标签数
Raw tags拼接后标签数
Combined tags有效标签数
Qualified tagsOTU数
OTUsSF1 53 959 51 861 37 414 128 SF2 55 480 52 802 37 119 205 SF3 58 618 56 851 41 962 187 SM1 59 278 57 515 42 531 164 SM2 64 936 61 829 44 431 198 SM3 68 561 66 760 53 714 79 注:SF-白蜡虫二龄雌虫,SM-白蜡虫二龄雄虫;1、2、3分别表示该组3个重复的样品编号。
Notes: SF-second-instar female of Eracerus pela , SM-pela second-instar male of Eracerus ; 1, 2, 3 represent the three replicate sample numbers of the group.表 2 白蜡虫二龄雌虫中共生菌前20含量及分类地位
Table 2. Content and taxonomic status of symbiotic bacteria in the second-instar female of Eracerus pela
OTU
No.分类地位 Taxonomic status 含量/%
Content纲 Class 目 Order 科 Family 属 Genus 种 Species 1 α-Proteobacteria Rickettsiales Rickettsiaceae Rickettsia 85.740 13 α-Proteobacteria Rhizobiales 3.426 8 α-Proteobacteria Rhizobiales Methylobacteriaceae Methylobacterium 1.891 22 Actinobacteria Micrococcales Microbacteriaceae Amnibacterium 1.384 21 α-Proteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas 1.058 31 Cytophagia Cytophagales Cytophagaceae Hymenobacter 0.630 11 α-Proteobacteria Rhizobiales Methylobacteriaceae Methylobacterium Methylobacterium adhaesivum 0.580 25 α-Proteobacteria Rhodospirillales Acetobacteraceae Acidiphilium 0.411 40 α-Proteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas 0.357 53 Actinobacteria Propionibacteriales Propionibacteriaceae Friedmanniella 0.250 75 Acidobacteria Acidobacteriales Acidobacteriaceae Bryocella 0.243 2 α-Proteobacteria Rickettsiales SRickettsiaceae Rickettsia 0.188 110 Acidobacteria Acidobacteriales Acidobacteriaceae Terriglobus 0.170 123 Actinobacteria Frankiales 0.159 127 Actinobacteria Micrococcales Dermacoccaceae 0.153 93 Nitrospira Nitrospirales Nitrospiraceae Nitrospiraceae Nitrospira defluvii 0.152 139 Cytophagia Cytophagales Cytophagaceae Hymenobacter 0.141 103 Cytophagia Cytophagales Cytophagaceae Hymenobacter 0.118 168 α-Proteobacteria Rhizobiales Methylobacteriaceae Methylobacterium Methylobacterium komagatae 0.117 115 α-Proteobacteria Sphingomonadales 0.102 表 3 白蜡虫二龄雄虫中共生菌前20含量及分类地位
Table 3. Content and taxonomic status of symbiotic bacteria in the second-instar male of Eracerus pela
OTU
No.分类地位 Taxonomic status 含量/%
Content纲 Class 目 Order 科 Family 属 Genus 种 Species 1 α-Proteobacteria Rickettsiales Rickettsiaceae Rickettsia 95.462 48 Bacilli Bacillales Bacillaceae Bacillus Bacillus gibsonii 0.747 13 α-Proteobacteria Rhizobiales 0.708 8 α-Proteobacteria Rhizobiales Methylobacteriaceae Methylobacterium 0.600 21 α-Proteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas 0.360 2 α-Proteobacteria Rickettsiales Rickettsiaceae Rickettsia 0.171 20 γ-Proteobacteria Pseudomonadales Pseudomonadaceae Pseudomonas Pseudomonas veronii 0.135 15 Bacilli Bacillales Bacillaceae Bacillus 0.132 422 α-Proteobacteria Rickettsiales Rickettsiaceae Rickettsia 0.084 22 Actinobacteria Micrococcales Microbacteriaceae Amnibacterium 0.071 103 Cytophagia Cytophagales Cytophagaceae Hymenobacter 0.065 40 α-Proteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas 0.062 168 α-Proteobacteria Rhizobiales Methylobacteriaceae Methylobacterium Methylobacteriumko magatae 0.061 115 α-Proteobacteria Sphingomonadales 0.050 147 α-Proteobacteria Rhizobiales 0.050 98 Actinobacteria Micrococcales Microbacteriaceae 0.040 319 β-Proteobacteria Burkholderiales Oxalobacteraceae Massilia 0.040 180 Bacilli Bacillales Planococcaceae Solibacillus Solibacillus silvestris 0.037 33 Chloroplast Chloroplast Chloroplast Chloroplast Cercis gigantea 0.035 190 Actinobacteria Micrococcales Microbacteriaceae Microbacterium 0.035 表 4 白蜡虫二龄幼虫共生菌多样性分析
Table 4. Diversity analysis of symbiotic bacteria in the second instar larvae of Ericerus pela
分组
Group物种个数
Number of speciesChao1 ACE Shannon Simpson 二龄雌虫(SF) 265 168.361 173.844 1.228 0.262 二龄雄虫(SM) 255 153.173 166.651 0.473 0.088 -
[1] 陈晓鸣, 王自力, 陈勇, 等.影响白蜡虫泌蜡主要气候因子及白蜡虫生态适应性分析[J].昆虫学报, 2007, 50(2):136-143. doi: 10.3321/j.issn:0454-6296.2007.02.007 [2] ShuH, Yang P, Qi Q, et al . Transcriptomic and proteomic analyses on the supercooling ability and mining of antifreeze proteins of the Chinese white wax scale insect[J]. Insect Science, 2016, 23(3):430-437. doi: 10.1111/1744-7917.12320 [3] Sandstrom J, Moran N. How nutritionally imbalanced is phloem sap for aphids[J]. Entomologia Experimentalis Et Applicata, 1999, 91(1):203-210. doi: 10.1046/j.1570-7458.1999.00485.x [4] Wilson A C C, Ashton P D, Calevro F, et al . Genomic insight into the amino acid relations of the pea aphid, Acyrthosiphon pisum , with its symbiotic bacterium Buchnera aphidicola [J]. Insect Molecular Biology, 2010, 19(Supplement s2):249-258. [5] Moran N A, Degnan P H. Functional genomics of Buchnera and the ecology of aphid hosts[J]. Molecular Ecology, 2006, 15(5):1251-1261. [6] Brinza L, Viñuelas J, Cottret L, et al . Systemic analysis of the symbiotic function of Buchnera aphidicola , the primary endosymbiont of the pea aphid Acyrthosiphonpisum [J]. Comptes Rendus Biologies, 2009, 332(11):1034-1049. doi: 10.1016/j.crvi.2009.09.007 [7] Thomas G H, Zucker J, Macdonald S J, et al . A fragile metabolic network adapted for cooperation in the symbiotic bacterium Buchnera aphidicola [J]. BioMed Central Systems Biology, 2009, 3(1):1-9. [8] Majerus T M, Majerus M E. Discovery and identification of a male-killing agent in the Japanese ladybird Propylea japonica (Coleoptera:Coccinellidae)[J]. BioMed Central Evolutionary Biology, 2010, 10(1):1-10. [9] Hagimori T, Abe Y, Date S, et al . The first finding of a Rickettsia bacterium associated with parthenogenesis induction among insects[J]. Current Microbiology, 2006, 52(2):97-101. [10] Elad C, Moshe I, Netta M D, et al . Assessments of fitness effects by the facultative symbiont Rickettsia in the Sweetpotato whitefly (Hemiptera:Aleyrodidae)[J]. Annals of the Entomological Society of America, 2009, 102(3):413-418. doi: 10.1603/008.102.0309 [11] Brumin M, Kontsedalov S, Ghanim M.Rickettsia influences thermotolerance in the whitefly Bemisiatabaci , B biotype[J]. Insect Science, 2011, 18(1):57-66. doi: 10.1111/j.1744-7917.2010.01396.x [12] Hendry T A, Hunter M S, Baltrus D A. The facultative symbiont Rickettsia protects an invasive whitefly against entomopathogenic Pseudomonas syringae strains[J]. Applied & Environmental Microbiology, 2014, 80(23):7161-7168. [13] Mahadav A, Gerling D, Gottlieb Y, et al .Parasitization by the wasp Eretmocerus mundus induces transcription of genes related to immune response and symbiotic bacteria proliferation in the whitefly Bemisiatabaci [J]. BioMed Central Genomics, 2008, 9(1):413-421. [14] Landmann, F, Orsi, G, Loppin B, Sullivan W. Wolbachia -mediated cytoplasmic incompatibility is associated with impaired histone deposition in the male pronucleus[J]. Plos Pathogens, 2009, 5(3):e1000343. doi: 10.1371/journal.ppat.1000343 [15] Russell J E, Stouthamer R. The genetics and evolution of obligate reproductive parasitism in Trichogramma pretiosum infected with parthenogenesis-inducing Wolbachia [J]. Heredity, 2011, 106(1):58-67. doi: 10.1038/hdy.2010.48 [16] Negri I, Pellecchia M, Mazzoglio P J, et al . Feminizing Wolbachia in Zyginidia pullulan (Insecta, Hemiptera), a leafhopper with an XX/X0 sex-determination system[J]. Proceedings Biological Sciences, 2006, 273(1599):2409-2416. doi: 10.1098/rspb.2006.3592 [17] Mitsuhashi W, Fukuda H, Nicho K, et al . Male-killing Wolbachia in the butterfly, Hypolimnas bolina [J]. Entomologia Experimentalis et Applicata, 2004, 112(1):57-64. doi: 10.1111/j.0013-8703.2004.00179.x [18] Kremer N, Voronin D, Charif D, et al . Wolbachia interferes with ferritin expression and iron metabolism in insects[J]. Plos Pathogens, 2009, 5(10):e1000630. doi: 10.1371/journal.ppat.1000630 [19] Moreira L A, Iturbeormaetxe I, Jeffery J A, et al . A Wolbachia symbiont in Aedes aegypti limits infection with dengue, Chikungunya, and Plasmodium[J]. Cell, 2009, 139(7):1268-1278. doi: 10.1016/j.cell.2009.11.042 [20] Engel P, Martinson V G, Moran N A. Functional diversity within the simple gut microbiota of the honey bee[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(27):11002-11007. doi: 10.1073/pnas.1202970109 [21] Shin S C, Kim S H, You H, et al . Drosophila microbiome modulates host developmental and metabolic homeostasis via insulin signaling[J]. Science, 2011, 334(6056):670-674. doi: 10.1126/science.1212782 [22] Glaser R L, Meola M A, Liu D X. The Native Wolbachia endosymbionts of Drosophila melanogaster and Culex quinquefasciatus increase host resistance to west nile virus infection[J]. Plos One, 2010, 5(8):e11977. doi: 10.1371/journal.pone.0011977 [23] 刘魏魏, 杨璞, 陈晓鸣, 等.白蜡虫体内杀雄菌属( Arsenophonus )共生菌的分子检测[J].微生物学报, 2012, 52(8):1002-1010. [24] 徐冬丽, 刘魏魏, 胡艳红, 等.白蜡虫肠道微生物分析及立克次氏体分子检测[J].林业科学研究, 2012, 25(6):780-783. doi: 10.3969/j.issn.1001-1498.2012.06.017 [25] 王雪庆, 于淑惠, 孙涛, 等.白蜡虫蜡花微生物多样性分析[J].昆虫学报, 2016, 59(10):1086-1092. [26] 孙涛, 王雪庆, 赵遵岭, 等.越冬白蜡虫微生物多样性分析[J].林业科学研究, 2017, 30(6):1009-1014. [27] Haynes S, Darby A C, Daniell T J, et al . Diversity of bacteria associated with natural aphid populations[J]. Applied and Environmental Microbiology, 2003, 69(12):7216-23. doi: 10.1128/AEM.69.12.7216-7223.2003 [28] 王震杰.扶桑绵粉蚧共生微生物的分子鉴定及分析[D].金华: 浙江师范大学, 2014. [29] 杨晓晴, 王正亮, 王天召, 等.基于16S rRNA高通量测序的灰飞虱体内细菌群落结构及多样性分析[J].昆虫学报, 2018, 61(2):200-208. [30] 薛延韬, 张毅波, 张焱, 等.烟粉虱及其优势寄生蜂共生菌的种类及系统发育分析[J].环境昆虫学报, 2017, 39(4):741-751. [31] Kikuchi Y, Meng X Y, Fukatsu T. Gut symbiotic bacteria of the genus Burkholderia in the broad-headed bugs Riptortusclavatus and Leptocorisa chinensis (Heteroptera:Alydidae)[J]. Applied and Environmental Microbiology, 2005, 71(7):4035-4043. doi: 10.1128/AEM.71.7.4035-4043.2005 [32] Sant'Anna M R, Darby A C, Brazil R P, et al . Investigation of the bacterial communities associated with females of Lutzomyia sand fly species from South America[J]. Plos One, 2012, 7(8):e42531. doi: 10.1371/journal.pone.0042531 [33] Shinzato N, Muramatsu M, Matsui T, et al . Phylogenetic analysis of the gut bacterial microflora of the fungus-growing termite Odontotermes formosanus [J]. Journal of the Agricultural Chemical Society of Japan, 2007, 71(4):906-915. [34] 郭军.蜜蜂肠道菌群多样性及其影响因素研究[D].北京: 中国农业科学院, 2015. [35] 张某, 杨璞, 朱家颖, 等.基于16S rDNA基因序列的泽兰实蝇幼虫肠道细菌多样性分析[J].昆虫学报, 2016, 59(2):200-208. [36] Schloss P D, Jr I D, Handelsman J, et al . Bacteria associated with the guts of two wood-boring beetles: Anoplophora glabripennis and Saperda vestita (Cerambycidae)[J]. Environmental Entomology, 2006, 35(3):625-629. doi: 10.1603/0046-225X-35.3.625 [37] Dillon R, Charnley K. Mutualism between the desert locust Schistocerca gregaria and its gut microbiota[J]. Research in Microbiology, 2002, 153(8):503-509. doi: 10.1016/S0923-2508(02)01361-X [38] 靳亮, 王金昌, 王洪秀, 等. 16S rRNA基因的PCR-DGGE技术分析茶尺蠖幼虫肠道细菌种群结构及多样性[J].江西科学, 2013, 31(6):759-763. doi: 10.3969/j.issn.1001-3679.2013.06.012 [39] Broderick N A, Raffa K F, Goodman R M, et al . Census of the bacterial community of the Gypsy moth larval midgut by using culturing and culture-independent methods[J]. Applied & Environmental Microbiology, 2004, 70(1):293-300. [40] Chen D Q, Campbell B C, Purcell A H. A new Rickettsia from a herbivorous insect, the pea aphid Acyrthosiphon pisum (Harris)[J]. Current Microbiology, 1996, 33(2):123-128. [41] Elad C, Moshe I, Netta M D, et al . Assessments of fitness effects by the facultative symbiont Rickettsia in the Sweetpotato whitefly (Hemiptera:Aleyrodidae)[J]. Annals of the Entomological Society of America, 2009, 102(3):413-418. doi: 10.1603/008.102.0309 [42] Majerus T M, Majerus M E. Discovery and identification of a male-killing agent in the Japanese ladybird Propylea japonica (Coleoptera:Coccinellidae)[J]. BioMed Central Evolutionary Biology, 10, 1(2010-02-11), 2010, 10(1):37. [43] Hagimori T, Abe Y, Date S, et al . The first finding of a Rickettsia bacterium associated with parthenogenesis induction among insects[J]. Current Microbiology, 2006, 52(2):97-101. [44] Himler A G, Adachi-Hagimori T, Bergen J E, et al . Rapid spread of a bacterial symbiont in an invasive whitefly is driven by fitness benefits and female bias[J]. Science, 2011, 332(6026):254-256. doi: 10.1126/science.1199410 [45] 赵杰军, 王自力, 王绍云, 等.昆明地区白蜡虫天敌寄生蜂种群结构与动态研究[J].林业科学研究, 2004, 17(6):746-750. doi: 10.3321/j.issn:1001-1498.2004.06.010 [46] Eutick M L, O'Brien R W, Slaytor M. Bacteria from the gut of Australian termites [J]. Applied & Environmental Microbiology, 1978, 35(5):823-828. [47] Vecherskii M V, Kostina N V, Gorlenko M V, et al . Specific features of nitrogen fixation in the termite Reticulitermes lucifugus [J]. Biology Bulletin, 2008, 35(5):466-451. doi: 10.1134/S1062359008050051 [48] Bending G D, Lincoln S D, Sorensen S R, et al . In-field spatial variability in the degradation of the phenyl-urea herbicide isoproturon is the result of interactions between degradative Sphingomonas spp. and soil pH[J]. Applied and Environmental Microbiology, 2003, 69(2):827-834. doi: 10.1128/AEM.69.2.827-834.2003 [49] Kumari R, Subudhi S, Suar M, et al . Cloning and characterization of lin genes responsible for the degradation of hexachlorocyclohexane isomers by Sphingomonas paucimobilis strain B90[J]. Applied and Environmental Microbiology, 2002, 68(12):6021-6028. doi: 10.1128/AEM.68.12.6021-6028.2002 [50] Silva C, Cabral J, Keulen F V. Isolation of a β-carotene over-producing soil Bacterium, Sphingomonas sp.[J]. Biotechnology Letters, 2004, 26(3):257-262. doi: 10.1023/B:BILE.0000013716.20116.dc -




 下载:
下载: