-
油菜素内酯(BRs)是一类多羟基甾醇类化合物,是除生长素、脱落酸、细胞分裂素、赤霉素和乙烯以外的第六种植物激素,在植物中已经鉴定出了70多种BR[1-2]。BR参与调节细胞伸长和分裂、花粉管发生、维管束分化、叶片发育、根系抑制、衰老、育性、植物对逆境的响应以及光形态发生等过程[3-6]。持续光形态建成与矮化基因( CPD )是BR生物合成过程中的关键酶基因之一,该基因编码的蛋白具有脯氨酸富集区域、氧和血红素结合区域和N端膜锚定区等细胞色素P450重要功能域[7],属于细胞色素P450单加氧酶。目前,拟南芥( Arabidopsis thaliana (L.) Heynh.)[8-9]、水稻( Oryza sativa L.)[10]、番茄( Lycopersicon esculentum Mill.)[11]中的 CPD 基因功能与表达模式已有相关研究,拟南芥中 AtCPD 的表达会受到外界光照以及昼夜节律的影响[4, 12],但竹子中相关 CPD 基因的研究尚未报道。
竹子是禾本科竹亚科植物,具有生长速度快、竹材好、用途广等优点[13]。竹子主要分布在低纬度的热带或亚热带地区,其生长会受到内源激素和外界环境的影响,其中,光是最重要的环境因素之一,能够控制竹子基本的生长发育过程,例如:萌发、昼夜节律和开花等。另外,低温、高温均会影响竹子的快速生长[14-18],多种植物激素参与竹子的生长调节过程,同时也参与竹子对逆境胁迫的适应过程。本研究以毛竹( Phyllostachys edulis (Carri.) H. deLehaie)为研究对象,从叶片中克隆 CPD 同源基因 PeCPD ,并对其进行系统的生物信息学分析以及组织特异性表达分析。另外,利用实时定量PCR技术定量分析 PeCPD 在竹笋发育不同阶段以及昼夜节律光照、干旱和低温条件下的表达变化情况,以期为揭示 PeCPD 在毛竹中的功能提供参考依据。
-
取毛竹种子(购买自广西桂林),在实验室条件下培养,土壤条件为泥炭:蛭石=1:1,温度控制在25℃左右,光照约为150 μmol·m-2·s-1,用1/3 B5培养液培养。对1年生实生苗进行处理,用于进一步实验。
-
选取生长良好、长势较一致的一年生毛竹实生苗,置于光照培养箱中,设定12 h光照(250~270 μmol·m-2·s-1)和12 h黑暗,培养1周后开始取样。分别在光照、黑暗10 min后取样,之后每隔6 h采集样品1次,光照和黑暗各采样3次。
-
用20%聚乙二醇(PEG6000)溶液进行浇灌,取处理1、3、6、12 h的叶片和根样本。
-
将盆栽毛竹实生苗于4℃条件下处理,分别取1、3、6、12 h的叶片和根样本。
干旱和低温胁迫处理均选择未处理实生苗叶片和根(0 h)作为对照。每个处理至少有10株毛竹实生苗,且每个处理3次重复。取上述处理的叶片和根样本于液氮中迅速淬冻并存放于-80℃冰箱用于RNA提取。
另外,采取江西南昌野外生长的毛竹样品,选取不同发育阶段的竹笋(0.2、1.0、3.0、6.7 m),取笋中部为样品,于液氮淬冻后用干冰运回实验室,存放于-80℃冰箱备用。
-
通过Trizol方法[19]提取笋样品的总RNA,按照Promega公司的反转录试剂盒操作说明书合成cDNA,存-20℃用于基因的克隆和表达模式分析。采用改良的CTAB法[20]提取笋样品的基因组DNA,用CDS对应的基因组序列扩增。
-
在毛竹基因组数据库(BambooGDB) (http://www.bamboogdb.org/)[21]中查找 CPD 的同源序列以及基因上游的启动子序列。根据序列利用Primer Premier 5分别设计扩增CDS序列的引物,PeCPD-F(5′-ATGGACGCGGACGCGGACGCGC-3′)和PeCPD-R(5′-GCAAATAGATTCCAATCGCTGCGTGATT-3′),以及扩增启动子序列的引物,PeCPD-pro-F(5′-TAAAGTGCATATGCTACTGGAG-3′)和PeCPD-pro-R(5′-GTGGCTGATAAAATAACGGA-3′),由上海生工技术有限公司合成。
分别以毛竹笋cDNA扩增编码区,以基因组DNA为模板扩增对应的基因组序列。PCR反应体系(20.0 μL):2.0 μL 5×Primer STAR Buffer (Mg2+ plus),2.0 μL dNTP Mixture (2.5 mmol·L-1 each),0.5 μL上游引物(10 μmol·L-1),0.5 μL下游引物(10 μmol·L-1),1.0 μL cDNA (40 ng· mL-1),12.8 μL ddH2O,0.2 μL Prime STAR酶(5 U·μL-1),1.0 μL DMSO。反应程序:95℃预变性4 min;按下列循环参数进行扩增反应:95℃1 min,60℃ 4 min,72℃ 1.5 min(cDNA)/ 3.0 min (基因组DNA),经过35个循环后,72℃10 min,4℃保存。PCR产物电泳分析后,用试剂盒(BIOMIGA,中国)回收目的条带,进行加A反应,反应体系(10.0 μL):1.0 μL 10×PCR Buffer,1.0 μL dATP(2.5 mmol· L-1),7.9 μL胶回收产物,0.1 μL LATaq酶。反应程序:72℃ 30 min,4℃保存。反应结束后按照pGEM-T easy载体快速连接试剂盒操作流程,将回收的片段连接到载体上,转化至大肠杆菌DH5α感受态细胞,经抗性筛选,挑取阳性克隆并经酶切图谱分析后,交由上海生工技术有限公司测序。
借助GSDS(http://gsds.cbi.pku.edu.cn/)分析克隆获得基因序列的结构,使用在线软件Plant CARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析目的基因上游序列中调控所含的作用元件,并用ProtParam (http://web.expasy.org/protparam/)分析目的基因编码蛋白的分子量、等电点等理化性质,利用DNAMAN软件进行同源序列的氨基酸比对,使用MEGA6.0软件的邻接法构建基于毛竹和其他植物CPD蛋白序列的系统发育进化树,利用毛竹共表达网络数据库(http://bioinformatics.cau.edu.cn/bamboo/)对 PeCPD 的共表达情况进行分析。
-
从NCBI的Short Read Archive (SRA)数据库中下载前期发表的毛竹不同组织(叶、鞭、根、20 cm笋、50 cm笋、早花期花序和晚花期花序)的转录组数据(SRX082501SRX082512)[22],利用毛竹 CPD 基因的RPKM值表示基因的表达丰度,利用Matrix 2 png绘制基因表达热图。
-
根据 PeCPD 的CDS序列设计定量引物qCPD-F(5′-GTGGTGGACCTCGGTTGTG-3′)和qCPD-R(5′-ATTGACAGGGTATCCTTTGAGA-3′)。以毛竹PeNTB(PeNTB-F:5′-TCTTGTTTGACACCGAAGAGGAG-3′, PeNTB-R:5′-AATAGCTGTCCCTGGAGGAGTTT-3′)[23]作为内参基因,分别以不同高度毛竹笋、不同光照处理下毛竹叶片以及干旱和低温胁迫处理下的叶片和根的cDNA为模板,对 PeCPD 进行定量分析。采用Roche Light Cycler RⓇR 480 SYBR Green I Master试剂盒在耶拿公司QTower仪器上进行qRT-PCR实验,反应体系(10 μL)为:5.0 μL的2×SYBR Green I Mastermix,0.8 μL cDNA,qCPD-F和qCPD-R各0.2 μL(10 μmol·L-1),加ddH2O至反应总体积为10.0 μL。qPCR程序:95℃10 min;95℃ 10 s;60℃10 s;共40个循环。应用2-△△CT算法[24]分析实验结果。
-
在毛竹数据库BambooGDB中查找得到毛竹同源基因(PH01003419G0030),cDNA全长为1 584 bp,包含5′和3′端非编码区分别为110 bp和64 bp,编码区为1 410 bp。扩增获得的CDS序列、上游启动子序列以及对应的基因组序列分别为1 410、1 999、2 796 bp,测序获得序列与数据库中完全一致,包含6个外显子和5个内含子(图 1),内含子完全符合GT-AG剪接原则[25]。
该基因编码469个氨基酸,氨基酸的相对分子量为52.2 kDa,理论等电点为9.063,属于细胞色素P450单加氧酶家族成员,命名为 PeCPD 。利用PlantCARE在线网站分析 PeCPD 基因上游1 999 kb的启动子序列,结果表明:除了包含启动子基本元件外,还含有多种与环境相关的作用元件,如参与低温应答的LTR、干旱响应的MBS、赤霉素应答的元件(GARE-motif、P-box)以及光响应调控元件(AE-box、TCT-motif)等(表 1),推测 PeCPD 可能参与光响应以及非生物胁迫调控。
表 1 PeCPD 启动子序列分析
Table 1. Analysis of PeCPD promoter
调控元件
Regulatory element序列(5′-3′)
Sequence(5′-3′)功能
Function数量/个
Number所在链
Strand位置
PositionCAAT-box CAAT 启动子和增强子区常见的顺式作用元件
Common cis-acting element in promoter and enhancer regions31 + - 23、109、116、147、175、183、248、367、392、394、450、596、621、842、944、946、958、1 130、1 149、1 150、1 152、1 163、1 197、1 285、1 339、1 342、1 480、1 599、1 695、1 938、1 940 TATA-box TATA
TATAA
TATAAA
TATACA
TATAAT
ATATAA
ATATAT
TATAAAT
TATAAAA
TACAAAA
TAAAGATT
ccTATAAAaa上游30 bp转录起始区的核心启动子元件
Core promoter element around -30 bp of transcription start34 + - 149、1 728、1 639、1 852、217、1 793、1 605、1 958、411、412、413、414、415、496、497、522、523、524、695、696、991、992、1 369、1 371、1 415、1 430、1 431、1 432、1 433、1 446、1 448、1 547、1 603、1 604 LTR CCGAAA 参与低温应答的顺式作用元件
Cis-acting element involved in low-temperature responsiveness1 + 1 899 MBS CAACTG 涉及干旱诱导的MYB结合位点
MYB binding site involved in drought- induction1 + 1 768 TC-rich repeats AAC
ATTCTCT参与防御和压力反应的顺式作用元件
Cis-acting element involved in defense and stress responsiveness2 + 558、1 783 ARE AAACCA 厌氧诱导必要的顺式作用元件
Cis-acting regulatory element essential for the anaerobic induction2 +, - 338、1 961 GCN4-motif TGAGTCA 参与胚乳表达的顺式作用元件
Cis-regulatory element involved in endosperm expression1 - 1 068 GARE-motif TCTGTTG 赤霉素应答元件
Gibberellin-responsive element2 - 300、1 267 P-box CCTTTTG 赤霉素应答元件
Gibberellin-responsive element1 + 1 402 AE-box AGAAACTT 光应答的组件
Part of a module for light response3 +, - 44、1 521、719 TCT-motif TCTTAC 部分光应答元件
Part of a light responsive element2 + 797、1 700 注+:正链;-:负链。Notes: +: Sense strand; -: Antisense strand. -
利用DNAMAN同源序列比对结果显示:PeCPD与单子叶植物水稻、玉米( Zea mays L.)、谷子( Setaria italic (L.) Beauv.)、二穗短柄草( Brachypodium distachyon (L.) Roem et Schult.)具有相似结构功能域,均包含脯氨酸富集区域(Proline)、氧结合区(Domain A)、类固醇结合区(Domain B)和血红素结合区(HEME-Binding)(图 2),进而推测PeCPD编码的蛋白可能与其他单子叶植物中CPD具有类似的功能,通过影响BR的生物合成来调控植物的生长发育。同时,保守域也进一步佐证了PeCPD属于细胞色素P450家族成员。
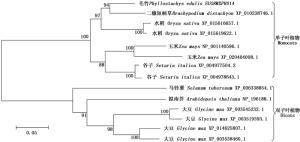
构建基于不同物种 CPD 同源基因编码氨基酸序列的进化树,结果表明:毛竹与二穗短柄草、水稻、玉米和谷子等单子叶植物聚类到一个大的分支,其中,毛竹与二穗短柄草的亲缘关系较近;而双子叶植物马铃薯( Solanum tuberosum L.)、拟南芥、大豆( Glycine max (Linn.) Merr.)聚类到另一分支(图 3),这与单子叶植物和双子叶植物的进化分类关系相一致。
-
对与 PeCPD 共表达的基因分析结果表明: PeCPD 与Myb结构域蛋白33(PH01000029G1950)、FAD/NAD(P)结合氧化还原酶家族蛋白(PH01003417G0090)、类LSD1转录因子(PH01001063G0080)、FAD/NAD(P)结合氧化还原酶家族蛋白(PH01003417G0070)、网状蛋白家族蛋白(PH01000581G0290)、NRAMP金属离子转运蛋白6(PH01006209G0030)、组蛋白超家族蛋白(PH01000016G1090)和PH01004334G0050等8个基因呈现正向共表达,与6-磷酸葡糖酸内酯酶1(PH01004456G0020)、甲基-CPG结合结构域9(PH01002436G0190)、DNA J热休克N末端结构域蛋白(PH01000002G3050)、海藻糖磷酸合成酶(PH01002176G0130)、丙氨酸氨基转移酶2(PH01000799G0060)、推定的核酸内切酶或糖基水解酶(PH01003187G0090)和PH01002872G0260等7个基因呈现负向共表达,且能与MAP激酶4(PH01000059G0730)发生蛋白互作(图 4)。
-
利用前期获得的毛竹转录组数据,对 PeCPD 的表达模式进行分析研究。从基因的表达谱热图明显可以看出, PeCPD 在叶、鞭、根、20 cm笋、50 cm笋、早花期花序和晚花期花序等毛竹7个组织中均有表达,但表达丰度存在着一定的差异,其中鞭、笋和早花期花序中的表达量较高,以20 cm笋中最高,而根中的表达量最低(图 5)。 PeCPD 在不同组织中和发育不同阶段的表达差异,表明在毛竹的发育过程中 PeCPD 的功能存在着一定的差异。
-
基于转录组数据的基因表达模式分析表明: PeCPD 在笋中的表达量最高,因此,以不同高度笋为材料,应用qRT-PCR方法对 PeCPD 的表达进行定量分析。结果显示:随着毛竹笋高度的增加, PeCPD 的表达量总体呈现升高的趋势,其中,笋高度从1.0 m增加到3.0 m的区间基因表达量变化最大,在3.0 m高笋中 PeCPD 的表达量约为1.0 m高笋中的2倍,而表达量在0.2 m到1.0 m之间以及3.0 m到6.7 m之间的升高趋势不明显(图 6)。
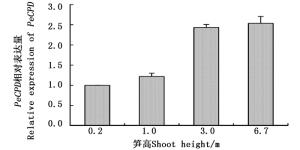
图 6 不同高度笋中 PeCPD 的表达分析
Figure 6. Expression analysis of PeCPD in different height moso bamboo shoots
在昼夜节律光照条件下,毛竹叶片中 PeCPD 的表达模式呈现节律变化,总体表现为光照条件下(1、2、3)的表达量高于黑暗(4、5、6)条件。随着光照时间的延长, PeCPD 表达量呈现上升趋势,约在光照12 h后达到最大值,约为光照开始时(10 min)的4.5倍;随着黑暗条件的开始, PeCPD 的表达量急剧下降,并随着黑暗时间的延长呈现了下降的趋势,并约在12 h后达到最小值,约为黑暗开始(10 min)的35%(图 7)。
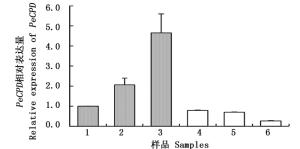
图 7 昼夜节律光照下毛竹叶片中 PeCPD 的表达分析
Figure 7. Expression analysis of PeCPD in moso bamboo leaves under circadian light
干旱胁迫条件下, PeCPD 在毛竹叶片和根中的表达模式均呈现先上升后下降的趋势,分别在3 h和1 h达到最大值,分别约为对照的3倍和14倍。在最大值之后,叶片中 PeCPD 的相对表达量迅速下降,6 h时的表达量仅为对照的20%,但至12 h时与6 h时的表达量几乎没有变化;而根中 PeCPD 的相对表达量则逐渐下降,但至12 h时 PeCPD 的相对表达量仍为对照的2倍(图 8)。

图 8 干旱胁迫条件下 PeCPD 在毛竹叶片(A)和根(B)中的表达分析
Figure 8. Expression analysis of PeCPD in mosobamboo leaves (A) and roots (B) under drought stress
低温胁迫条件下, PeCPD 在毛竹叶片和根中的相对表达量也均呈先上升后下降的趋势。根中的上升比叶片中更快,1 h时叶片和根中 PeCPD 的相对表达量分别约为对照的1.2倍和2.5倍;但都在3 h时达到最大值,分别约为对照的5倍和4倍;之后逐渐下降,至12 h时叶片中 PeCPD 的相对表达量约为对照的2倍,而根中的相对表达量与对照的基本持平(图 9)。
-
作为限速酶基因, CPD 的表达量变化直接影响BRs的含量,从而影响植物的生长发育。本研究从毛竹中同源克隆得到了一个细胞色素P450单加氧化酶基因 PeCPD ,氨基酸序列和系统进化树分析发现, PeCPD 编码蛋白与单子叶植物中的同源基因编码蛋白具有较高的相似性(85.5%),功能结构域保守;进化上与二穗短柄草的亲缘关系最近,说明 PeCPD 在进化过程中具有高度的保守性。基因的表达是反应其在体内发挥生物学功能的表现形式之一。定量表达分析结果表明, PeCPD 基因在毛竹的不同组织中具有明显的表达差异,在20 cm笋中的表达量最高,早期花序和鞭中表达也很高,而在根中的表达量最低,表明 PeCPD 在毛竹不同组织的生长发育中发挥着不同的功能。同时,本研究发现,随着笋高度的增加, PeCPD 表达量呈上升的趋势,这一期间也是笋伸长的关键时期[26],该基因的表达趋势变化与笋的高度变化一致,说明其在调节笋生长过程中发挥了重要作用。
环境是影响植物生长的重要因素。在昼夜节律光照条件下, PeCPD 表达量随着光照时间的增加而呈上升的趋势,而随之进入黑暗表达量迅速下降,且随着黑暗时间的延长仍然呈现继续下降的趋势,说明 PeCPD 的表达明显受到昼夜节律光照的影响,这与拟南芥光周期调控下 CPD 基因的表达量变化相一致[12]。在干旱和低温胁迫条件下,叶片和根中的 PeCPD 表达量均呈先上升后下降的趋势,这可能是在处理初期毛竹通过提高 PeCPD 的表达量来响应胁迫,随着时间的推移植物通过调节自身的代谢来适应胁迫的环境,但干旱和低温胁迫条件下叶片和根中 PeCPD 的表达随时间的变化及达到最大值的时间表明, PeCPD 对干旱胁迫更敏感。BRs对植物生长发育的调控是一个复杂的网络,涉及BRs的合成与信号转导。 PeCPD 是BRs生物合成中的关键酶基因,其功能的发挥除受到环境的影响外,内在的调控同样是一个复杂的网络。共表达分析结果表明, PeCPD 与多种类型的基因呈现正向和负向共表达,进一步说明 PeCPD 是和其它基因一起共同发挥着生物学功能,但具体情况和之间的作用机制均需要进一步实验验证。
-
本研究从毛竹中获得了1个细胞色素P450单加氧酶基因成员 PeCPD ,该基因是BRs合成通路基因,在毛竹中呈组成型表达模式,其在笋中的表达变化、随昼夜节律光照的变化以及干旱和低温胁迫条件下的变化,表明该基因可能参与毛竹的光形态建成,并在适应逆境胁迫中具有重要作用。
毛竹 PeCPD 基因克隆与表达分析
Cloning and Expression Analysis of PeCPD in Moso Bamboo ( Phyllostachys edulis )
-
摘要:
目的 通过对毛竹( Phyllostachys edulis (Carri.)H.deLehaie) CPD 基因的分子特征和表达模式进行研究分析,为揭示 CPD 在参与毛竹笋生长调控、光诱导以及响应胁迫过程中的作用提供参考依据。 方法 在毛竹基因组数据库(BambooGDB)中查找 CPD 的同源序列,设计引物并克隆 PeCPD 。通过生物信息学的方法分析 PeCPD 的基因结构、顺式调控元件、其编码蛋白的基本理化性质、保守结构域、进化关系以及该基因在不同组织中的表达模式等,利用实时定量PCR方法分析该基因在不同高度笋、昼夜节律光照条件下以及干旱、低温胁迫处理下叶片和根中的表达模式。 结果 获得了毛竹 CPD 同源基因 PeCPD (PH01003419G0030),cDNA全长为1 584 bp,包含5'和3'端非编码区分别为110 bp和64 bp,编码区为1 410 bp,对应的基因组长度为2 796 bp,外显子和内含子数量分别为6个和5个。克隆获得了 PeCPD 编码区,与BambooGDB中PH01003419G0030序列完全一致,编码一个470 aa的蛋白,分子量约为52.2 kDa,理论等电点为9.063。同时获得了 PeCPD 上游序列(1 999 bp),与数据库中序列完全一致,分析发现,其中除了启动子基本元件外,还含有多种与环境相关的作用元件,如参与低温应答的LTR、干旱响应的MBS和光响应元件AE-box、TCT-motif等。基于CPD氨基酸序列的系统进化分析表明,毛竹与水稻、玉米、谷子和二穗短柄草等单子叶植物聚类到一个大的分支,其中与二穗短柄草的亲缘关系最近。基于转录组数据的基因表达热图分析发现, PeCPD 在毛竹7个不同组织中的表达存在明显差异,其中在20 cm笋中的表达量最高,根中表达量最低。实时定量PCR分析表明,随着笋的增高, PeCPD 表达量呈上升趋势;在昼夜节律光照条件下, PeCPD 表达量随着光照时间延长而上升,随着黑暗时间延长而下降;干旱和低温胁迫条件下,叶片和根中 PeCPD 的表达量均呈先上升后下降的趋势。 结论 从毛竹中获取得到了 CPD 同源基因 PeCPD ,该基因为组成型表达,且随着笋的增高其表达量呈上升趋势,可能通过参与BRs的生物合成对竹笋的生长起调控作用; PeCPD 在叶片中的表达呈现昼夜节律变化,表明该基因可能会参与毛竹的光形态建成;干旱和低温胁迫条件下, PeCPD 表达量的变化有助于提高毛竹适应逆境胁迫的能力。 Abstract:Objective To study the molecular characteristics and expression pattern of constitutive photomorphogenesis and dwarf of Phyllostachys edulis ( PeCPD ), a kind of the key rate-limiting enzymes in biosynthesis of brasinosteroids, aiming at revealing the role of PeCPD in regulating the rapid growth of bamboo shoots and the response to light induction and stresses. Method Primers were designed based on the CPD homologous sequence of PH01003419G0030 in the Bamboo Genome Database (BambooGDB) and used for PeCPD cloning. The bioinformatics method was used for further analyses, including the gene structure, the cis-elements, the basic physicochemical properties and the conserved domains of the protein encoded by PeCPD , the evolutionary relationships, and the gene expression patterns in different tissues. Quantitative real-time PCR (qRT-PCR) method was used to analyze the gene expression in different height shoots and that in leaves and roots under the circadian rhythm light conditions and stresses of drought and cold. Result PeCPD , a homologous gene of CPD in Ph. edulis was obtained, which cDNA was 1 584 bp in full-length including 5' untranslated region (UTR) 110 bp, 3' UTR 64 bp and coding sequence (CDS) 1 410 bp. The corresponding genomic sequence to the CDS was 2 796 bp containing 6 exons and 5 introns. PeCPD encoded a 470 aa protein with a molecular weight of approximately 52.2 kDa and the theoretical isoelectric point of 9.063. At the same time, the upstream sequence of PeCPD (1 999 bp) was obtained, which was completely consistent with the sequence in the database. Besides the basic elements of the promoter, the upstream sequence of PeCPD also contained a variety of environmentally relevant action elements, such as LTR involved in low temperature response, MBS in response to drought, and light responsive elements (AE-box and TCT-motif). Phylogenetic analysis based on the CPD amino acid sequences showed that Ph. edulis was clustered together with the monocotyledon plants such as Oryza sativa, Zea mays, Setaria italica and Brachypodium distachyon , which was closed to B. distachyon . Expression pattern analysis based on the transcriptome data demonstrated that PeCPD expressed obviously different in the seven tissues of Ph. edulis , with the highest level in 20 cm shoot and the lowest in root. The result of qRT-PCR showed that the expression level of PeCPD in shoots increased with the increasing height of bamboo shoots, those in leaves under the circadian rhythm light conditions demonstrated an increasing trend in the daytime and a decreasing trend at night (darkness). Under both drought and cold stresses, the expression of PeCPD in leaves and roots all showed similar trends of rising at first and falling then. Conclusion CPD homologous gene ( PeCPD ) is obtained from Ph. edulis . The PeCPD is constitutively expressed in Ph. edulis . Moreover, its expression level in shoots increases with the increasing height of bamboo shoots, which suggests that PeCPD may regulate the growth of bamboo shoots by participating in the biosynthesis process of brasinosteroids. The expression of PeCPD in leaves shows circadian rhythm changes, indicating that it may be involved in the photomorphogenesis of Ph. edulis. The expression changes of PeCPD under drought and low temperature stresses indicate that PeCPD is helpful to improve the ability of bamboo to adapt to stresses. -
Key words:
- Phyllostachy edulis
- / brassinosteroids
- / PeCPD
- / gene cloning
- / expression analysis
-
表 1 PeCPD 启动子序列分析
Table 1. Analysis of PeCPD promoter
调控元件
Regulatory element序列(5′-3′)
Sequence(5′-3′)功能
Function数量/个
Number所在链
Strand位置
PositionCAAT-box CAAT 启动子和增强子区常见的顺式作用元件
Common cis-acting element in promoter and enhancer regions31 + - 23、109、116、147、175、183、248、367、392、394、450、596、621、842、944、946、958、1 130、1 149、1 150、1 152、1 163、1 197、1 285、1 339、1 342、1 480、1 599、1 695、1 938、1 940 TATA-box TATA
TATAA
TATAAA
TATACA
TATAAT
ATATAA
ATATAT
TATAAAT
TATAAAA
TACAAAA
TAAAGATT
ccTATAAAaa上游30 bp转录起始区的核心启动子元件
Core promoter element around -30 bp of transcription start34 + - 149、1 728、1 639、1 852、217、1 793、1 605、1 958、411、412、413、414、415、496、497、522、523、524、695、696、991、992、1 369、1 371、1 415、1 430、1 431、1 432、1 433、1 446、1 448、1 547、1 603、1 604 LTR CCGAAA 参与低温应答的顺式作用元件
Cis-acting element involved in low-temperature responsiveness1 + 1 899 MBS CAACTG 涉及干旱诱导的MYB结合位点
MYB binding site involved in drought- induction1 + 1 768 TC-rich repeats AAC
ATTCTCT参与防御和压力反应的顺式作用元件
Cis-acting element involved in defense and stress responsiveness2 + 558、1 783 ARE AAACCA 厌氧诱导必要的顺式作用元件
Cis-acting regulatory element essential for the anaerobic induction2 +, - 338、1 961 GCN4-motif TGAGTCA 参与胚乳表达的顺式作用元件
Cis-regulatory element involved in endosperm expression1 - 1 068 GARE-motif TCTGTTG 赤霉素应答元件
Gibberellin-responsive element2 - 300、1 267 P-box CCTTTTG 赤霉素应答元件
Gibberellin-responsive element1 + 1 402 AE-box AGAAACTT 光应答的组件
Part of a module for light response3 +, - 44、1 521、719 TCT-motif TCTTAC 部分光应答元件
Part of a light responsive element2 + 797、1 700 注+:正链;-:负链。Notes: +: Sense strand; -: Antisense strand. -
[1] Fujioka S, Yokota T. Biosynthesis and metabolism of brassinosteroids[J]. Physiologia Plantarum, 2010, 100(3):710-750. [2] Bajguz A. Metabolism of brassinosteroids in plants[J]. Plant Physiology Biochemistry, 2007, 45(2):95-107. doi: 10.1016/j.plaphy.2007.01.002 [3] Mandava N B. Plant growth-promoting brassinosteroids[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1988, 39(1):23-52. doi: 10.1146/annurev.pp.39.060188.000323 [4] Szekeres M, Nemeth K, Konczkalman Z, et al . Brassinosteroids rescue the deficiency of CYP90, a cytochrome P450, controlling cell elongation and de-etiolation in Arabidopsis [J]. Cell, 1996, 85(2):171-182. doi: 10.1016/S0092-8674(00)81094-6 [5] Krishna P. Brassinosteroid-mediated stress responses[J]. Journal of Plant Growth Regulation, 2003, 22(4):289-297. doi: 10.1007/s00344-003-0058-z [6] Divi U K, Rahman T, Krishna P, et al . Brassinosteroid-mediated stress tolerance in Arabidopsis shows interactions with abscisic acid, ethylene and salicylic acid pathways[J]. BMC Plant Biology, 2010, 10(1):151-160. doi: 10.1186/1471-2229-10-151 [7] Nehert D W, Gonzalez F J. P450 genes:Structure, evolution, and regulation[J]. Annual Review of Biochemistry, 1987, 56(1):945-993. doi: 10.1146/annurev.bi.56.070187.004501 [8] Mathur J, Molnár G, Fujioka S, et al . Transcription of the Arabidopsis CPD gene, encoding a steroidogenic cytochrome P450, is negatively controlled by brassinosteroids[J]. The Plant Journal, 1998, 14(5):593-602. doi: 10.1046/j.1365-313X.1998.00158.x [9] Ohnishi T, Godza B, Watanabe B, et al . CYP90A1/CPD , a brassinosteroid biosynthetic cytochrome P450 of Arabidopsis , catalyzes C-3 oxidation[J]. Journal of Biological Chemistry, 2012, 287(37):31551-31560. doi: 10.1074/jbc.M112.392720 [10] Sakamoto T, Matsuoka M. Characterization of constitutive photomorphogenesis and dwarfism homologs in rice ( Oryza sativa L.)[J]. Journal of Plant Growth Regulation, 2006, 25(3):245-251. doi: 10.1007/s00344-006-0041-6 [11] Koka C V, Cerny R E, Gardner R G, et al . A putative role for the tomato genes DUMPY and CURL-3 in brassinosteroid biosynthesis and response[J]. Plant Physiology, 2000, 122(1):85-98. [12] Bancos S, Szatmári A, Castle J, et al . Diurnal regulation of the brassinosteroid-biosynthetic CPD gene in Arabidopsis [J]. Plant Physiology, 2006, 141(1):299-309. doi: 10.1104/pp.106.079145 [13] 江泽慧.世界竹藤[M].沈阳:辽宁科学技术出版社, 2002:3-10. [14] 徐丽君, 包刚, 刘清平, 等.曙箣竹自然降温过程中生理特性的变化[J].世界竹藤通讯, 2015, 13(4):5-9. [15] 裴晶晶, 施拥军.高温干旱下毛竹林受灾状况和自恢复能力研究[J].世界竹藤通讯, 2017, 15(3):31-36. [16] 胡尚连, 卢学琴, 陈其兵, 等.四川雅安地区2种大型丛生竹耐低温能力[J].竹子研究汇刊, 2011, 30(2):43-47. doi: 10.3969/j.issn.1000-6567.2011.02.009 [17] 刘济明, 李鹏, 廖小锋, 等.干旱胁迫对小蓬竹生理化特性的影响[J].西北农业学报, 2013, 22(9):153-157. [18] 应叶青, 郭璟, 魏建芬, 等.干旱胁迫对毛竹幼苗生理特性的影响[J].生态学杂志, 2011, 30(2):262-266. [19] Gao Z M, Li X P, Li L B, et al . An effective method for total RNA isolation from bamboo[J]. Chinese Forestry Science and Technology, 2006, 5(3):52-54. [20] 高志民, 范少辉, 高健, 等.基于CTAB法提取毛竹基因组DNA的探讨[J].林业科学研究, 2006, 19(6):725-728. doi: 10.3321/j.issn:1001-1498.2006.06.009 [21] Zhao H, Peng Z, Fei B, et al . BambooGDB:a bamboo genome database with functional annotation and an analysis platform[J]. Database(Oxford), 2014, 2014(10):bau006. [22] Peng Z H, Lu Y, Li L B, et al . The draft genome of the fast growing non-timber forest species mosobamboo ( Phyllostachys heterocycla )[J]. Nature Genetics, 2013, 45(4):456-461. doi: 10.1038/ng.2569 [23] Fan C, Ma J, Guo Q, et al . Selection of reference genes for quantitative real-time PCR in bamboo ( Phyllostachys edulis )[J]. PLoS One, 2013, 8(2):e56573. doi: 10.1371/journal.pone.0056573 [24] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CTmethod[J]. Methods, 2001, 25(4):402-408. doi: 10.1006/meth.2001.1262 [25] Moore M J, Query C C, Sharp P A. Splicing of precursors to mRNA by the spliceosome[M]//Gesteland R F, Atkins J F.The RNA World. New York: Cold Spring Harbor Laboratory Press, 1993: 303-357. [26] 崔凯, 何彩云, 张建国, 等.毛竹茎秆组织速生的时空发育特征[J].林业科学研究, 2012, 25(4):425-431. doi: 10.3969/j.issn.1001-1498.2012.04.003 -





 下载:
下载: