-
杨树作为一种快速生长的木本植物,广泛分布在我国北方地区,具有易繁殖、生长快、适应性强等特性[1],其在造纸业、碳固定工程以及生物燃料生产等方面发挥着重要作用[2-5]。为了满足粮食需求,大量的土地被用来种植农作物,而大多数杨树则生长在氮素贫瘠地区[6]。但由于杨树本身对氮素的需求量很大,所以为了加快杨树的生长,往往需要施加大量的氮肥。
氮素是植物生长发育必需的大量元素之一,是植物体内氨基酸、蛋白质、核酸等的重要组成成分[7]。氮素会影响植物器官的形成和发育,如低氮可以促进植物主根的生长和侧根的伸长[8]。氮素是叶绿素的重要组成成分,外界环境中氮素的盈亏变化会影响到植物的光合作用,同时氮素还是催化植物体内大多数生理生化反应的酶蛋白的组成成分。碳氮代谢是植物体内生长发育最为重要的两个代谢途径,其在植物生长发育期间的动态变化会影响光合产物的合成、转运,矿物营养的吸收以及蛋白质的合成。碳代谢过程包括碳的固定、碳水化合物的合成与利用等过程,其中形成的中间产物蔗糖是高等植物进行光合作用产生的主要产物,亦是植物体内主要的碳运输形式[9]。氮代谢的过程包括氮的吸收、积累、氨基酸的合成与利用,最后用于植物的生长等过程。其中无机态的氮素NH4+、NO3-在一系列的氮代谢酶蛋白(硝酸还原酶(NR)、亚硝酸还原酶(NiR)、谷氨酰胺合成酶(GS)、谷氨酸合成酶(GOGAT)、谷氨酸脱氢酶(GDH))的作用下,形成谷氨酸[6]。谷氨酸再通过转氨基作用形成其他种类氨基酸,最后形成行使各种功能的蛋白质。游离氨基酸是植物体内氮素主要的存在和运输方式之一[10],能够反映植物体内的氮素供应能力和蛋白质的合成能力[11]。NR是植物体内氮代谢的起始酶和限速酶,催化着植物体内无机态氮素向有机态氮素转化的第一步反应,其酶活性的强弱直接影响植物氮代谢水平的高低[12]。碳代谢与氮代谢之间存在密切联系,氮代谢的进行需要碳代谢提供碳骨架和能量,而碳代谢则需要氮代谢提供酶和光合色素,所以碳氮代谢彼此之间相互依赖。植物体内的碳氮代谢反应对氮素水平变化的响应是多方面的,而目前关于氮素对植物体内碳氮代谢的研究多集中在玉米、谷类等农作物中。例如,随着氮素供应水平的降低,在马铃薯体内氮素浓度逐步降低,碳氮比(C/N)逐步增加,同时随着植株体内的C/N增加,马铃薯块茎形成提早,块茎重量和数量增加[13]。菠菜中的可溶性糖含量随着氮素水平的提高呈递减趋势,说明适当的供氮水平有利于提高菠菜的品质[14]。在谷类作物中,已有研究表明土壤缺氮导致根长发生改变,会降低可溶性蛋白含量和光合能力[15-16]。但是关于氮素水平变化对杨树等木本植物中碳氮代谢的研究甚少,已有研究表明低氮胁迫会促使小叶杨根系伸长,同时降低净光合速率,降低其体内NO3-、NH4+含量以及游离氨基酸的积累;而在高氮条件下则会出现相反的影响[7]。有研究结果表明充足的氮素供给能够使杨树具有更大的光合能力及生物量,以及加快杨树体内的碳氮代谢[5, 17-18]。这些研究结果表明在不同的氮素水平下植物体内会产生不同的碳氮代谢变化,但是植物体内不同氮素水平下碳氮代谢特征尚不清楚。
因此,明确杨树在不同氮素水平下生长特征和碳氮代谢特征,对提高林木产量和品质以及科学制定人工林养分管理策略具有重要意义。鉴于此,本文以速生杨84K杨(Populus alba × P.glandulosa)为研究对象,通过设计3个不同氮素水平下的室内砂培温室控制实验,测定84K杨幼苗的株高、地径、生物量、光合指标,并结合84K杨幼苗根和叶中的可溶性糖、淀粉、NH4+、NO3-和氨基酸等含量的变化以及NR、NiR、GS、GOGAT、GDH酶活性变化,综合分析并阐明84K杨在不同氮素水平下碳氮代谢的特征,为提高我国人工林的生产力提供科学依据。
-
试验材料为中国林业科学研究院林木遗传育种国家重点实验室保存并扩繁的速生杨84K杨的组培苗。
-
杨树幼苗在人工气候室(光强:105 μmol·m-2·s-1;光照时间:16 h;湿度:50%)中进行砂培盆栽,待幼苗株高达30~40 cm时,进行不同的氮素水平处理,即高氮供给(16 mmol·L-1 N素,HN)、正常氮素(4 mmol·L-1 N素,NN)、低氮供给(1 mmol·L-1 N素,LN),每个处理水平6个重复。每隔一天每次每盆浇50 mL修改后的hogland营养液,处理4个月后收获苗木。
-
收获前,取各处理最后形成的3片成熟叶(LPI=8~10)用于光合作用测定。净光合速率(A)、气孔导度(gs)以及蒸腾速率(E)。通过便携式光合仪(Li-6400)进行测定,测定时间为上午8:00—11:00,具体测定方法按仪器说明书进行。
光合色素含量的测定:称取100 mg左右的叶片鲜样,加入10 mL 80%的丙酮,黑暗条件下,室温浸提过夜。次日取出,当叶组织全部变白时表示光合色素浸提干净,然后离心后测定提取液在663 nm、646 nm和470 nm的波长下的吸光值。
计算公式为:C叶a=12.21×A663-2.81×A646;C叶b=20.13×A646-5.03×A663;
C类胡=(1 000×A470-3.27×C叶a-104×C叶b)/ 229。
株高的测定:在植株收获前,用米尺测定植株顶端到地面的距离记为株高;地径的测定:植株收获前,用游标卡尺测量距离地面1 cm处的茎段直径记为地径。
生物量的测定:收获后新鲜样品称好其鲜质量后,用锡箔纸包裹后在液氮里迅速冷冻,样品用液氮研磨成粉末后放在-80℃冰箱中保存。最后根据干湿比换算成植株的生物量。
干湿比的测定:大约100 mg的冷冻粉末样品在60℃烘箱中烘干至恒质量后,称量其干质量,用于干湿比测定,根据干湿比的计算公式:干湿比=干质量/鲜质量×100%。
-
NH4+、NO3-、NO2-等离子含量的测定采用分光光度法,具体方法参考罗杰的研究[6]。
NH4+含量的测定:100 mg左右的鲜样中加入1.5 mL提取液(1 mL 100 mmol·L-1 HCl,500 μL氯仿)4℃涡旋15 min后离心(10 000 g,4℃,10 min)。离心后,上清液移至2 mL离心管,并加入50 mg活性炭,混匀后继续离心(12 000 g,4℃,10 min)。然后取100 μL上清液与500 μL 1%(v/v)苯酚-0.005%(w/v)硝普钠溶液混合,随后加入500 μL 1%(v/v)次氯酸钠-0.5%(w/v)氢氧化钠溶液,然后37℃下反应30 min,在629 nm处测其吸光值。
NO3-含量的测定:100 mg左右的鲜样中加入1 mL去离子水后在45℃下水浴1 h,然后离心(5 000 g,20℃,15 min)。取0.2 mL上清液与0.8 mL5%(w/v)水杨酸(用浓硫酸配制)混合,室温下反应20 min,加入19 mL 2 mol·L-1 NaOH使pH>12。待溶液冷却到室温后测其在410 nm处的吸光值。
NO2-含量的测定:100 mg左右的鲜样中加入1 mL提取液(50 mmol·L-1 TRIS-HCL(pH 7.9),5 mmol·L-1半胱氨酸,2 mmol·L-1 EDTA),离心(10 000 g,4℃,20 min)后,取500 μL上清液和250 μL1%磺胺以及250 μL 0.02%[N-(1-苯胺)-四乙胺二乙酸盐酸盐(NED)]混合。显色后测定其在540 nm处的吸光值。
氮同化酶活性的测定:采用分光光度法测定硝酸还原酶、亚硝酸还原酶、谷氨酰胺合酶、谷氨酸合酶和谷氨酸脱氢酶活性,具体方法参考罗杰的研究[6]。
硝酸还原酶(NR)酶活的测定:200 mg左右鲜样中加入1 mL提取液(100 mmol·L-1 HEPES-KOH(pH 7.5),5 mmol·L-1 Mg(CH3COO)2,5 mmol·L-1 DTT,1 mmol·L-1 EDTA,0.5 mmol·L-1 PMSF,20 μmol·L-1 FAD,5 μmol·L-1 Na2MOO4,1%(v/v)甘油,1%(w/v)PVPP,0.5% BSA,0.1%(v/v)TritonX-100),以及25 μmol·L-1胰凝乳蛋白酶抑制剂(用于根)或25 μmol·L-1亮抑酶酞(用于叶、木材和皮),充分混匀后离心(5 000 r·min-1,4℃,5 min)。取上清液与反应液(100 mmol·L-1 HEPES-KOH(pH 7.5),6 mmol·L-1 KNO3,6 mmol·L-1 EDTA,0.6 mmol·L-1 NADH,12 mmol·L-1 FAD,6 mmol·L-1 Na2MOO4,3 mmol·L-1 DTT)以及25 μmol·L-1胰凝乳蛋白酶抑制剂(用于根)或25 μmol·L-1亮抑酶酞(用于叶、木材和皮)混合反应20 min。然后再加入0.6 mol·L-1 ZnAc和0.25 mol·L-1 5-甲基吩嗪硫酸甲酯终止反应,溶液中生成的NO2-测定其在540 nm处的吸光值。
亚硝酸还原酶(NiR)酶活的测定:500 μL测定NO2-的提取液用超滤管进行浓缩。先离心(14 000 g,4℃,20 min),然后超滤管倒置在新的收集管中继续离心(1 000 g,4℃,2 min)。浓缩的上清液加入50 mol·L-1 THIS-HCl(1 mol·L-1半胱氨酸,2 mol·L-1 EDTA)混合。取100 μL混合后的液体与800 μL反应液(50 mol·L-1 THIS-HCl,0.5 mol·L-1 NaNO2,1 mol·L-1甲基紫精)混合,然后加入100 μL Na2S2O4与NaHCO3起始反应,在30℃反应1 h。然后涡旋直至甲基紫精颜色完全消失终止反应。然后加入100 μL 1 mol醋酸锌,混合后离心(10 000 g,4℃,10 min)。上清液中的NO2-按照之前测定NO2-含量的方法进行测定。
谷氨酰胺合酶(GS)酶活的测定:100 mg左右的鲜样中加入2 mL提取液(提取液中包括10 mmol·L-1 pH 7.6的THIS-HCl,1 mmol·L-1 MgCl2,1 mmol·L-1 EDTA,1 mmol·L-1 β-巯基乙醇)后振荡混匀,然后离心(15 000 g,4℃,30 min)取上清液即粗酶液用于反应。在1 mL反应液(80 mmol·L-1 THIS-HCl,40 mmol·L-1 L-谷胱甘肽,8 mmol·L-1 ATP,24 mmol·L-1 MgSO4,16 mmol·L-1 NH2OH)中加入400 μL酶液提取液后在30℃温育30 min,随后加2 mL终止液(1.5 mol·L-1 HCl,2.5%(w/v)FeCl3,5%(w/v)三氯乙酸)终止反应。离心(3 000 g,10 min),测定上清液在540 nm处的吸光值。
谷氨酸合酶(GOGAT)酶活和谷氨酸脱氢酶(GDH)酶活的测定:首先制备粗酶液,过程同GS粗酶液制备过程。GOGAT的反应体系包括:1.7 mL 25 mmol·L-1 THIS-HCl(pH 7.6),100 μL 100 mmol·L-1 2-酮戊二酸,100 μL 10 mmol·L-1 KCl,200 μL 1.5 mmol·L-1 NADH以及500 μL的粗酶液。加入400 μL L-谷氨酰胺后5 min内每隔1 min记录在340 nm处的吸光值。GDH的反应体系包括:1.2 mL 100 mmol·L-1 THIS-HCl(pH 8.0),300 μL 1 mol·L-1 NH4Cl,200 μL 1.5 mmol·L-1 NADH,300 μL 0.1 mol·L-1 2-酮戊二酸以及1 mL酶液。加入酶液后5 min内每隔1 min记录在340 nm处的吸光值。
-
准确称量15 mg左右的冻干粉末,将其加入已有800 μL 80%甲醇/水的2 mL离心管中,并加入内标正缬氨酸,室温超声辅助提取约1 h,12 000 r·min-1室温离心10 min;将上清液转移至2 mL离心管。再加入800 μL 80%甲醇/水,超声室温提取约1 h;室温下离心(12 000 r·min-1,10 min),将上清转液移于之前的提取液合并。最后用HCl调pH值调至2。加入等体积的乙醚/石油醚=1:1萃取,纯化3次,保留水相。最后,将下层水相进行真空离心浓缩,转到内衬管中,干燥备用,随后利用GC-MS进行分析[20]。
-
植物样品干粉溶于Me2SO溶液中,与150 μL乙酸酐和30 μL 1-甲基咪唑混匀,在玻璃管中搅拌10 min。加入600 μL双蒸馏水(ddH2O),除去多余的乙酸酐。然后加入100 μL二氯甲烷以提取乙酰化衍生物。离心1 min,对有机相进行分离。最后,1 μL二氯甲烷层注入GC-MS进行分析,具体方法参考[19]。淀粉含量测定参考南京建成生物工程研究所淀粉含量测试盒说明书进行。
-
总C、总N的含量测定利用元素分析仪进行测定。样品在920℃下在填充有氧化铜的氧化管中氧化物烧。燃烧后形成的气体在填有还原铜的管内还原为N2、CO2(650℃)。气体通过氦载气流经水阱(五氧化二磷)。N2、CO2经过吸附与解吸附柱分离,然后再进入同位素质谱仪(IRMS)进行分析。利用一系列的同位素标样对标准气体进行校正,在分析过程中,每12个样品穿插一个实验室标样进行校正。
C/N =总碳含量/总氮含量
-
氮素利用效率的计算参考[21]的方法。定义为NUE=生物量/总氮含量。计算植株的氮素利用效率时,植株包括根系和地上部分。
-
数据的统计分析在Statgraphics软件中完成,统计分析前所有的数据均要进行正态分布检验。氮素处理作为单因素ANOVA的一个因子,当ANVOVA的F检验的P < 0.05时认为均值之间的差异显著。
-
植物可以通过调整自身的生长情况来适应环境中的氮素的盈亏变化。如表 1所示,84K杨的株高和地径随着氮素水平的降低而下降,其中低氮处理时,株高生长受到抑制,显著降低了30%。同时氮素处理也会显著影响植物根和叶的生物量的积累。与正常氮相比,高氮处理时,叶的生物量显著增加了58%;低氮处理时,根生物量增加了43%,叶的生物量降低了35%。总体而言,随着氮素水平的增加,84K杨地下部分的生长受到抑制,地上部分的生长则被促进,从而使84K杨的根冠比增加。
表 1 不同氮素水平对84K杨树高、地径和生物量的影响
Table 1. Height, diameter, biomass of root, biomass of leaves of Populus alba × P. glandulosa supplied with three levels NH4NO3
处理
Treatment株高
Height/cm地径
Diameter /cm根生物量
Biomass of root /g叶生物量
Biomass of leaves /g高氮HN 144.9±5.0 c 5.5±0.2 b 1.5±0.2 a 9.5±0.8 c 正常氮NN 130.6±4.9 b 5.1±0.2 ab 1.6±0.2 a 6.0±0.6 b 低氮HN 100.2±1.3 a 4.9±0.1 a 2.3±0.1 b 3.9±0.4 a P-valve **** * **** **** 注:*P < 0.05; ****:P < 0.000 1 -
外界环境中的氮素的盈亏变化会影响植物的光合作用,因此本研究测定了84K杨的光合指标。表 2中,与正常氮素相比,在高氮条件下,气孔导度与蒸腾速率分别显著增加了80%和42%;相反,在低氮条件下,净光合速率显著降低了45%。植物光合色素随着氮素处理水平降低而下降。与正常氮素相比,低氮条件下,叶绿素a、叶绿素b和类胡萝卜素含量分别显著降低了63%、67%和53%。
表 2 不同氮素水平下84K杨的光合作用和色素含量
Table 2. CO2 assimilation rate (A), stomatal conductance (gs), transpiration rate (E), photosynthetic pigments in the leaves of P. alba × P. glandulosa supplied with three levels NH4NO3
处理
Treatment净光合速率A/
(μmol ·m-2·s-1)气孔导度gs/
(mol·m-2·s-1)蒸腾速率E/
(mmol·m-2·s-1)叶绿素a Chl a/
(mg·g-1)叶绿素b Chl b/
(mg·g-1)类胡萝卜素Car/
(mg·g-1 )高氮HN 7.6±0.4 b 0.9±0.1 b 3.7±0.1 c 5.6±0.5 b 2.7±0.2 c 2.1±0.2 b 正常氮NN 6.8±0.5 b 0.5±0.2 a 2.6±0.5 a 4.8±0.5 b 2.1±0.2 b 1.9 ± 0.2 b 低氮LN 3.7±0.2 a 0.4±0.0 a 3.1±0.1 ab 1.8±0.2 a 0.7±0.1 a 0.9±0.0 a P-value **** * * **** **** *** 注:*P < 0.05; ***:P < 0.001; ****:P < 0.0001 -
在表 3中,根中葡萄糖、蔗糖和总糖的含量在高氮和低氮条件下都比正常氮条件下的含量增加。与正常氮素相比,在高氮处理时葡萄糖、蔗糖和总糖的含量分别显著增加了37%、136%、242%,低氮处理时葡萄糖、蔗糖和总糖的含量分别显著增加了22%、218%、182%。根中的果糖含量高氮和低氮条件下与正常氮相比含量均显著降低,分别显著降低了12%和15%。肌醇的含量随着氮素水平的降低而下降,高氮时含量增加了33%,低氮时含量减低了47%。根中的甘露醇的含量随着氮素水平的降低而极显著增加。淀粉的含量在低氮时,含量显著增加了56%。在叶中的大多数的可溶性糖(葡萄糖、果糖、半乳糖和肌醇)的含量都是随着氮素水平的降低而下降,其中在高氮时含量显著增加30%~56%,在低氮时显著降低36%~67%。
表 3 不同氮素水平下84K杨根和叶中可溶性糖和淀粉含量
Table 3. Concentrations of soluble sugars and starch in the roots and leaves of P. alba × P. glandulosa supplied with supplied with three levels NH4NO3
组织
Tissuse处理
Treatment葡萄糖
Glc/ (ng·mg-1)果糖
Fru/ (ng·mg-1)蔗糖
Suc/ (μg·mg-1)半乳糖
Gal/ (ng·mg-1)肌醇
Ins /(ng·mg-1)甘露醇
Man/ (ng·mg-1)总糖
Sum /(μg·mg-1)淀粉
Starch /(mg·mg-1)根Root HN 66.7±0.4b 153.0±2.2a 10.5±0.2c 0.7±0.0a 30.3±1.9c 2.4±0.1a 10.7±0.2b 3.5±0.5a NN 54.7±0.7a 173.7±2.6b 3.3±0.1a 1.2±0.0b 22.8±0.7b 259.1±0.9b 3.8±0.1a 5.0±1.0a LN 74.8±1.5c 147.6±6.0a 7.8±0.2b 9.7±0.1c 12.1±0.7a 4 942.6±276.7c 13.0±0.4c 7.8±0.5b P-value **** ** **** **** **** **** **** ** 叶Leaves HN 631.2±10.5c 914.3±12.8c 23.4±1.1a 253.0±14.7c 1 049.6±9.6c 82.6±1.5b 26.3±1.2a 13.2±0.8a NN 416.0±1.0b 585.4±8.0b 28.5±0.4b 166.6±3.2b 805.7±6.9b 87.9±1.7b 30.5±0.4b 11.1±1.8a LN 180.7±1.6a 234.4±9.8a 32.0±0.7c 54.0±1.5a 512.6±7.2a 55.2±2.1a 33.1±0.8b 9.8±1.0a P-value **** **** *** **** **** **** ** ns 注:**:P < 0.01; ***:P < 0.001; ****:P < 0.0001;ns:not significant. -
在图 1中,与正常氮相比,根中的NH4+含量在高氮时显著增加了121%,相反在低氮时显著降低了70%(图 1-a),而NH4+含量在叶中变化不显著(图 1-b)。根中的NO3-在高氮时含量显著增加111%(图 1-c),低氮时显著降低;而叶中的NO3-在高氮时无变化,低氮时其含量显著减低了74%(图 1-d)。NO2-在根和叶中的变化均不显著(图 1-e, f)。
-
在表 4中,可以看出氮素处理对根和叶中的游离氨基酸含量产生了显著的影响。在根中的游离氨基酸中,谷氨酸、天冬酰胺和精氨酸占总氨基酸的75%~95%。根中其他的氨基酸中,丙氨酸、甘氨酸和亮氨酸的含量在高氮处理都是降低的,与正常氮相比,在高氮时降低了31%~69%,在低氮时降低了42%~69%。脯氨酸、甲硫氨酸、丝氨酸、苏氨酸、苯丙氨酸、天冬氨酸和组氨酸在低氮条件下含量显著降低了50%~80%。在叶中,谷氨酸和天冬酰胺占总氨基酸含量的65%~75%。丙氨酸、甲硫氨酸、丝氨酸、半胱氨酸、赖氨酸随着氮素水平的降低而下降;在高氮时,含量显著增加了39%~113%,在低氮时,含量降低了48%~82%;甘氨酸、脯氨酸、苏氨酸、天冬氨酸低氮显著降低了54%~65%;缬氨酸、异亮氨酸等在正常氮时含量显著增加了57%~64%。
表 4 84K杨根和叶中的游离氨基酸含量
Table 4. Concentrations of free amino acids in the roots and new leaves of P. alba × P. glandulosa supplied with three levels NH4NO3
μg·g-1 组织
Tissues处理
Treatment丙氨酸
Ala甘氨酸
Gly缬氨酸
Val亮氨酸
Leu异亮氨酸
Ile脯氨酸
Pro甲硫氨酸
Met丝氨酸
Ser苏氨酸
Thr苯丙氨酸
Phe天冬氨酸
Asp半胱氨酸
Cys谷氨酸
Glu天冬酰胺
Asn赖氨酸
Lys精氨酸
Arg组氨酸
His酪氨酸
Tyr总氨基酸
Sum根Root 高氮(HN) 242.5±68.5a 27.7±3.7a 86.6±16.1a 66.9±5.2b 90.9±14.6ab 34.3±6.4b 26.2±3.5b 248.1±51.7ab 157.2±12.2ab 41.8±8.2b 686.5±44.4b 32.7±3.2a 1 253.2±96.0b 33 248.1±2 858.5b 69.0±3.0c 8 668.3±1 353.5c 175.2±15.4b 42.5±5.1a 45 239.1±2 810.8b 正常氮(NN) 426.9±61.7b 88.1±17.0b 130.7±19.4ab 96.9±21.3c 115.8±17.3b 39.1±5.0b 27.8±4.8b 475.6±102.7b 215.5±50.0b 36.8±7.9b 883.9±96.6b 31.0±4.6a 1 618.1±163.6b 32 677.1±7 907.3b 86.6±5.7b 838.4±142.9b 167.4±23.2b 39.5±0.1a 37 852.6±8 115.8b 低氮(LN) 246.0±60.6a 27.0±4.6a 66.0±18.9a 48.8±14.8a 49.6±14.2a 16.6±2.4a 11.3±4.2a 164.8±41.3a 53.0±15.7a 18.3±4.2a 171.9±51.3a 26.7±3.8a 475.6±156.1a 2 616.2±1 078.7a 24.7±4.4a 48.5±8.5a 43.8±1.5a 33.0±2.2a 4 141.8±1 421.2a P-value ** ** ns *** ns * *** ** * ** **** ns ** ** *** *** ** ns ** 叶Leaves 高氮(HN) 581.6±28.9c 29.2±2.9b 114.1±8.2b 101.2±6.2b 78.5±6.8b 81.9±9.9b 125.7±13.6c 810.5±174.9c 139.9±12.6b 148.7±32.9b 395.7±69.8b 62.8±5.1c 3 099.9±298.8c 6 316.7±1 196.1c 108.0±6.9c 180.4±21.4b 44.3±1.6b 52.2±2.8b 12 499.1±1 303.0c 正常氮(HN) 396.1±47.8b 22.3±2.5b 69.7±9.2a 56.0±15.5a 49.9±6.3a 61.4±10.9b 62.5±5.0b 584.8±130.2b 104.2±15.7b 82.4±23.0ab 347.9±55.7b 40.3±1.5b 2 330.3±336.3b 2 103.2±394.9b 50.5±10.3b 41.4±0.5a 43.7±1.6ab 45.1±9.3ab 6 537.7±1 024.0b 低氮(LN) 188.3±5.7a 7.6±1.4a 47.5±11.7a 38.2±9.7a 38.5±10.1a 28.2±0.8a 32.8±0.1a 106.1±10.3a 39.7±6.7a 56.6±2.1a 151.8±17.2a 22.5±1.4a 714.1±174.4a 971.2±695.9a 22.5±2.2a 32.5±0.8a 38.9±1.3a 31.5±0.2a 2 595.2±721.7a P-value *** ** ** ** * * *** **** ** ** * *** ** ** *** *** ns ** *** 注:*:P < 0.05;**:P < 0.01;***:P < 0.001;****:P < 0.000 1;ns:notsignificant. -
在氮代谢的过程中,NH4+和NO3-被植物根系吸收后转化氨基酸的过程中,相关的酶发挥了重要作用。因此本研究测定了84K杨中的相关的酶活性,包括NR、NiR、GS、GOGAT和GDH(图 2)。在根中,NR的活性在低氮时显著降低(图 2-a),NiR和GS的活性在各种氮素水平下变化不显著(图 2-c, e),GOGAT的活性在高氮时显著增加(图 2-g),GDH的活性在高氮或低氮时都显著提高(图 2-i);叶中NiR的活性在低氮时显著降低(图 2-d),GOGAT的活性在高氮或低氮时都显著提高(图 2-h),GDH的酶活性随着氮素水平的降低显著增加(图 2-j)。
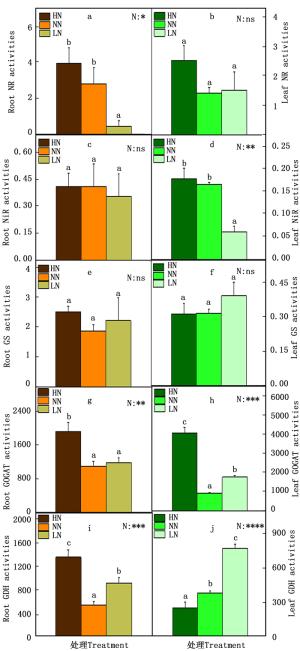
图 2 不同氮素水平对84K杨根和叶中氮代谢相关酶活性的影响
Figure 2. Activities of nitratereductase (NR, nmol·h-1·mg-1 protein), nitrite reductase (NiR, mmol·h-1·mg-1protein), glutamine synthetase (GS, h-1·mg-1 protein), glutamate synthase (GOGAT, nk at·g-1 protein), and glutamate dehydrogenase (GDH, nk at·g-1 protein) and in roots (a, c, e, g and i) and leaves (b, d, f, h and j) of P. alba × P. glandulosa supplied with three levels NH4NO3
-
不同的氮素水平不仅会影响植物根系和地上部分的生长,同时也会影响植物的氮素利用效率(nitrogen use efficiency, NUE)。随着氮素水平的升高,84K杨的NUE随之降低。高氮处理后,84K杨的NUE显著降低了21%;而低氮处理后,84K杨的NUE显著增加了96%(图 3)。
-
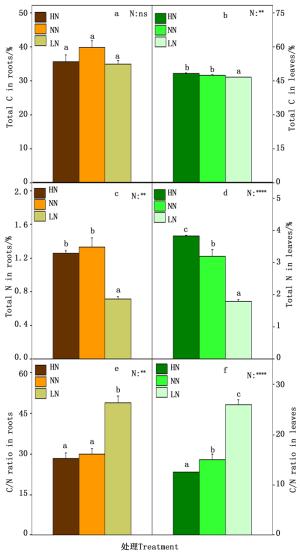
植物的碳氮含量以及碳氮比既是反映植物体碳氮代谢的诊断标准,也是反映植物碳氮代谢的相对强弱,对植物的生长有着极其重要的作用。因此本研究测定了84K杨根和叶中的总碳氮含量以及碳氮比。如图 4所示,在根中,总C含量在各个氮素处理之间变化不显著(图 4-a),在低氮时总N含量显著降低(图 4-c),因此根中的C/N在低氮时显著上升(图 4-c);在叶中,在低氮时总C含量显著降低(图 4-b),而总N含量在高氮时含量极显著升高,低氮时含量极显著降低(图 4-d),叶中的C/N随着氮素水平的下降而上升(图 4-f)。
-
植物体内的氮素资源大多数都是由根系从外界环境中获取,因此植物根系可以根据自身所处环境中的氮素水平快速调整它的生长和形态。本研究中,84K杨的根系在低氮处理下表现出促进生长,而高氮处理则抑制生长,此结果与前人的研究结果一致[6, 21]。因为在低氮条件下,杨树的氮素利用效率更高,同时会通过诱导侧根生长增加根系表面积,从而达到在氮素缺乏的环境下提高氮素的利用以及寻找更多养分的能力。与此一致,关于拟南芥的研究结果表明,低氮条件下拟南芥会采取一种“积极寻觅策略”来促进侧根生长,但是在氮素充足条件下,会采取一种“休眠策略”来抑制侧根的生长[22]。而前人的研究也证实氮素缺乏可以促进根系生长[23],而氮素充足则会抑制根系的生长[21, 24]。
氮素充足时,植物优先把资源分配给植物的地上部分有助于增强光合作用促进植物生长,有利于提高植物在高氮条件下的氮素利用率[21, 25]。本研究中,高氮处理下的84K杨表现出了更大的叶生物量,更高的植物色素含量和叶总氮含量以及更强的净光合速率。说明84K杨在高氮条件下会优先将资源分配给叶组织,促进叶片的发育,使之具有更大的叶表面积和更高的植物光合色素含量从而达到增强植物的光合速率,充分利用环境的丰富的氮素来加快自身生长的目的,从而来适应自身所处的高氮环境。
植物可以通过调整自身体内的碳氮代谢反应来适应不同的氮素环境,在不同的氮素水平呈现出不同的碳氮代谢特征。在本研究中,NH4+、NO3-的含量随着氮素的水平的降低而显著下降,这与氮代谢过程中氮代谢酶活性降低是相关的。而NR作为氮素代谢过程中的限速酶,对植物氮素的吸收和积累起到决定性作用。在本研究中根中NR的酶活性随之氮素水平的降低而显著降低,故而减少对氮素的吸收和利用,这与NH4+、NO3-的含量降低是相符的。NH4+、NO3-在一系列的氮代谢相关酶的作用下转化为氨基酸,而谷氨酸和天冬酰胺作为游离氨基酸中含量最高的两种氨基酸,其含量变化大体可以反映出植物体内游离氨基酸总量的变化[26]。在高氮处理时,根和叶中的谷氨酸和天冬酰胺的含量显著增加;在低氮处理时,根和叶中的谷氨酸和天冬酰胺显著降低,说明在不同的氮素水平下84K杨呈现出不同的游离氨基酸的积累效率,在氮素充足时,84K杨表现出更高的氮素积累能力。精氨酸作为植物体内N/C比最高的氨基酸之一,它可以以较少的碳结合较多的氮,所以往往精氨酸可以作为植物体内一种重要的氮素贮藏营养物[27]。而在本研究中84K杨的净光合速率随着氮素水平下的上升而提高,同时精氨酸的含量随着氮素水平的上升而显著增加,说明84K杨在光合作用制造的有限的碳含量下能够最大程度的利用环境中的氮素。NUE可以反映植物对环境中氮素利用效率,过高的氮素施加水平会导致植物NUE下降。在本研究中NUE随着氮素的水平的降低而增加,说明在低氮条件下植物的氮素利用效率更高,但是低氮条件下植物的生长会受到抑制;相反,过高的氮素水平下,植物的氮素利用效率会降低,也会造成资源浪费。所以为了达到既能促进植物生长也不会造成资源浪费的目的,应该合理对植物施加氮素营养。
葡萄糖在植物生长和呼吸作用中发挥着重要作用,植物会将葡萄糖优先运输到生长旺盛的部位用于植物自身的生长。本研究中低氮条件下根中葡萄糖的含量显著增加,叶中的葡萄糖含量随着氮素水平的增加而显著增加,这与低氮条件下根具有更大的生物量,叶的生物量随着氮素水平的增加而增加的实验结果一致。甘露醇作为一种渗透调节物质,在植物细胞的渗透压调节过程中发挥重要作用[28]。在根中,甘露醇的含量随着氮素水平的下降而显著增加,这可能与低氮条件下,植物通过增加甘露醇的含量增加根系中渗透压,从而提高对水分以及NH4+和NO3-等的吸收能力。碳代谢的中间产物蔗糖含量可以反映植物光合作用、碳输出和养分调动能力的强弱;蔗糖是光合作用的重要产物,也是碳水化合物从光合组织向非光合组织转运的主要形式[29]。本研究中,氮素缺乏时根中的蔗糖含量显著增加,同时蔗糖可以被水解磷酸化为6-磷酸葡萄糖,而6-磷酸葡萄糖则是植物体内糖酵解和呼吸作用的重要底物[30],表明氮素缺乏时光合作用产生的C代产物主要用于自身的生长发育,且优先用于自身根系的生长,这与本研究中84K杨在低氮时有更大的根系生物量相一致。低氮条件下,84K杨根中淀粉含量增加,叶中淀粉含量降低,这些结果表明氮素缺乏时,光合作用产物会优先向根中转运。
碳氮代谢是植物体内生长发育最主要的代谢反应,二者密不可分。氮代谢产物(例如氨基酸)的合成需要碳骨架[31],碳代谢过程需要氮代谢产物(例如酶)的促进。碳氮营养互相联系,在C/N高的情况,氮素不足会限制C素同化物的利用;在C/N低的情况下,C素的不足又会限制N素的利用。在本研究中,根和叶中在高氮时,C/N最低,在低氮时,C/N最高。研究结果表明在高氮处理后84K杨的碳代谢相对氮代谢明显加强,有利于光合产物的积累,从而加快自身的生长发育。
-
高氮处理增加84K杨的净光合速率和叶的生物量,抑制根系发育,增加了叶中的淀粉含量,降低根中的淀粉含量,促进了根中的NH4+和NO3-吸收和积累,增加了绝大多数的氨基酸含量和总N含量,植物体内的C/N减小;低氮处理促进了根系的生长,降低了净光合速率和光合色素含量,增加了根中的淀粉,降低了叶中的淀粉含量,降低了根中的NH4+和叶中的NO3-的含量,降低了根中NR的活性,降低了绝大多数的氨基酸含量以及总N含量,植物体内的C/N增大。这些结果表明84K杨中的碳代谢与氮代谢响应环境中的氮素的盈亏变化表现出很高的一致性,即外界环境中氮素充足时,碳代谢随着氮代谢的增加而增加;而外界环境中氮素亏缺时,碳代谢随着氮代谢的降低而降低。
不同氮素供给水平对84K杨幼苗碳氮代谢的影响
Effects of Nitrogen Supply Levels on Carbon and Nitrogen Metabolism of Populus alba×P. glandulosa Seedlings
-
摘要:
目的 解析不同氮素供给水平下杨树幼苗的生长与碳氮代谢特征,对提高木材产量和品质以及科学制定人工林养分管理策略具有重要意义。 方法 分别以高氮、正常氮和低氮供给处理84K杨(Populus alba×P. glandulosa),分析其生长特征与碳氮代谢变化特征。 结果 高氮处理增加了净光合速率、根中的蔗糖含量以及叶中的淀粉含量和生物量,促进84K杨的碳代谢;高氮处理促进了84K杨根中NH4+和NO3-吸收和积累,提高了谷氨酸合成酶的活性,增加了大多数氨基酸含量以及总氮含量,促进了84K杨的氮代谢。低氮处理降低了净光合速率、叶中的大多数可溶性糖含量和淀粉含量,抑制84K杨的碳代谢;低氮处理会降低植物体内NH4+、NO3-含量,降低根中的硝酸还原酶(NR)的活性,降低氨基酸含量以及总氮含量,抑制84K杨的氮代谢。 结论 这些结果表明84K杨中的碳代谢与氮代谢响应环境中的氮素的盈亏变化表现出很高的一致性,即外界环境中氮素充足时,碳代谢随着氮代谢的增加而增加;而外界环境中氮素亏缺时,碳代谢随着氮代谢的降低而降低。 Abstract:Objective To investigate the carbon and nitrogen metabolism of Populus seedlings under different nitrogen levels. Method Populus alba×P. glandulosa seedlings were treated with high (16 mmol/L N), normal (4 mmol/L N) and low (1 mmol/L N) nitrogen levels, respectively. The growth, carbon and nitrogen metabolism of Populus alba×P. glandulosa seedlings under the three nitrogen supply levels were analyzed. Result High nitrogen led to increased net photosynthetic rate, sucrose content in root, starch content and biomass in the leaves, promoted the carbon metabolism in P. alba×P. glandulosa. Meanwhile, the absorption and accumulation of NH4+ and NO3- in the roots, GOGAT activities in the roots and leaves, the amino acid contents and total N contents were elevated under high nitrogen levels compared with that under normal nitrogen supply, which resulted in enhanced nitrogen metabolism in P. alba×P. glandulosa. In contrast, low nitrogen treatment brought about reduced net photosynthetic rate and the contents of most soluble sugars and starch in leaves, inhibited the carbon metabolism in P. alba×P. glandulosa. Additionally, low nitrogen supply also induced the decreases of NH4+ and NO3- contents in the roots and leaves, decreased the nitrate reductase activities in the roots, and the contents of amino acid and total N in the roots and leaves, leading to inhibited nitrogen metabolism in P. alba×P. glandulosa. Conclusion The carbon metabolism of P. alba×P. glandulosa is highly linked with nitrogen metabolism in response to changing nitrogen levels in the environments. Carbon and nitrogen metabolism is enhanced when nitrogen supply is abundant, and both are inhibited under nitrogen deficiency condition. -
Key words:
- nitrogen
- / Populus alba×P. glandulosa
- / carbon and nitrogen metabolism
- / amino acid
- / sucrose
- / carbon nitrogen ratio
-
图 2 不同氮素水平对84K杨根和叶中氮代谢相关酶活性的影响
Figure 2. Activities of nitratereductase (NR, nmol·h-1·mg-1 protein), nitrite reductase (NiR, mmol·h-1·mg-1protein), glutamine synthetase (GS, h-1·mg-1 protein), glutamate synthase (GOGAT, nk at·g-1 protein), and glutamate dehydrogenase (GDH, nk at·g-1 protein) and in roots (a, c, e, g and i) and leaves (b, d, f, h and j) of P. alba × P. glandulosa supplied with three levels NH4NO3
表 1 不同氮素水平对84K杨树高、地径和生物量的影响
Table 1. Height, diameter, biomass of root, biomass of leaves of Populus alba × P. glandulosa supplied with three levels NH4NO3
处理
Treatment株高
Height/cm地径
Diameter /cm根生物量
Biomass of root /g叶生物量
Biomass of leaves /g高氮HN 144.9±5.0 c 5.5±0.2 b 1.5±0.2 a 9.5±0.8 c 正常氮NN 130.6±4.9 b 5.1±0.2 ab 1.6±0.2 a 6.0±0.6 b 低氮HN 100.2±1.3 a 4.9±0.1 a 2.3±0.1 b 3.9±0.4 a P-valve **** * **** **** 注:*P < 0.05; ****:P < 0.000 1 表 2 不同氮素水平下84K杨的光合作用和色素含量
Table 2. CO2 assimilation rate (A), stomatal conductance (gs), transpiration rate (E), photosynthetic pigments in the leaves of P. alba × P. glandulosa supplied with three levels NH4NO3
处理
Treatment净光合速率A/
(μmol ·m-2·s-1)气孔导度gs/
(mol·m-2·s-1)蒸腾速率E/
(mmol·m-2·s-1)叶绿素a Chl a/
(mg·g-1)叶绿素b Chl b/
(mg·g-1)类胡萝卜素Car/
(mg·g-1 )高氮HN 7.6±0.4 b 0.9±0.1 b 3.7±0.1 c 5.6±0.5 b 2.7±0.2 c 2.1±0.2 b 正常氮NN 6.8±0.5 b 0.5±0.2 a 2.6±0.5 a 4.8±0.5 b 2.1±0.2 b 1.9 ± 0.2 b 低氮LN 3.7±0.2 a 0.4±0.0 a 3.1±0.1 ab 1.8±0.2 a 0.7±0.1 a 0.9±0.0 a P-value **** * * **** **** *** 注:*P < 0.05; ***:P < 0.001; ****:P < 0.0001 表 3 不同氮素水平下84K杨根和叶中可溶性糖和淀粉含量
Table 3. Concentrations of soluble sugars and starch in the roots and leaves of P. alba × P. glandulosa supplied with supplied with three levels NH4NO3
组织
Tissuse处理
Treatment葡萄糖
Glc/ (ng·mg-1)果糖
Fru/ (ng·mg-1)蔗糖
Suc/ (μg·mg-1)半乳糖
Gal/ (ng·mg-1)肌醇
Ins /(ng·mg-1)甘露醇
Man/ (ng·mg-1)总糖
Sum /(μg·mg-1)淀粉
Starch /(mg·mg-1)根Root HN 66.7±0.4b 153.0±2.2a 10.5±0.2c 0.7±0.0a 30.3±1.9c 2.4±0.1a 10.7±0.2b 3.5±0.5a NN 54.7±0.7a 173.7±2.6b 3.3±0.1a 1.2±0.0b 22.8±0.7b 259.1±0.9b 3.8±0.1a 5.0±1.0a LN 74.8±1.5c 147.6±6.0a 7.8±0.2b 9.7±0.1c 12.1±0.7a 4 942.6±276.7c 13.0±0.4c 7.8±0.5b P-value **** ** **** **** **** **** **** ** 叶Leaves HN 631.2±10.5c 914.3±12.8c 23.4±1.1a 253.0±14.7c 1 049.6±9.6c 82.6±1.5b 26.3±1.2a 13.2±0.8a NN 416.0±1.0b 585.4±8.0b 28.5±0.4b 166.6±3.2b 805.7±6.9b 87.9±1.7b 30.5±0.4b 11.1±1.8a LN 180.7±1.6a 234.4±9.8a 32.0±0.7c 54.0±1.5a 512.6±7.2a 55.2±2.1a 33.1±0.8b 9.8±1.0a P-value **** **** *** **** **** **** ** ns 注:**:P < 0.01; ***:P < 0.001; ****:P < 0.0001;ns:not significant. 表 4 84K杨根和叶中的游离氨基酸含量
Table 4. Concentrations of free amino acids in the roots and new leaves of P. alba × P. glandulosa supplied with three levels NH4NO3
μg·g-1 组织
Tissues处理
Treatment丙氨酸
Ala甘氨酸
Gly缬氨酸
Val亮氨酸
Leu异亮氨酸
Ile脯氨酸
Pro甲硫氨酸
Met丝氨酸
Ser苏氨酸
Thr苯丙氨酸
Phe天冬氨酸
Asp半胱氨酸
Cys谷氨酸
Glu天冬酰胺
Asn赖氨酸
Lys精氨酸
Arg组氨酸
His酪氨酸
Tyr总氨基酸
Sum根Root 高氮(HN) 242.5±68.5a 27.7±3.7a 86.6±16.1a 66.9±5.2b 90.9±14.6ab 34.3±6.4b 26.2±3.5b 248.1±51.7ab 157.2±12.2ab 41.8±8.2b 686.5±44.4b 32.7±3.2a 1 253.2±96.0b 33 248.1±2 858.5b 69.0±3.0c 8 668.3±1 353.5c 175.2±15.4b 42.5±5.1a 45 239.1±2 810.8b 正常氮(NN) 426.9±61.7b 88.1±17.0b 130.7±19.4ab 96.9±21.3c 115.8±17.3b 39.1±5.0b 27.8±4.8b 475.6±102.7b 215.5±50.0b 36.8±7.9b 883.9±96.6b 31.0±4.6a 1 618.1±163.6b 32 677.1±7 907.3b 86.6±5.7b 838.4±142.9b 167.4±23.2b 39.5±0.1a 37 852.6±8 115.8b 低氮(LN) 246.0±60.6a 27.0±4.6a 66.0±18.9a 48.8±14.8a 49.6±14.2a 16.6±2.4a 11.3±4.2a 164.8±41.3a 53.0±15.7a 18.3±4.2a 171.9±51.3a 26.7±3.8a 475.6±156.1a 2 616.2±1 078.7a 24.7±4.4a 48.5±8.5a 43.8±1.5a 33.0±2.2a 4 141.8±1 421.2a P-value ** ** ns *** ns * *** ** * ** **** ns ** ** *** *** ** ns ** 叶Leaves 高氮(HN) 581.6±28.9c 29.2±2.9b 114.1±8.2b 101.2±6.2b 78.5±6.8b 81.9±9.9b 125.7±13.6c 810.5±174.9c 139.9±12.6b 148.7±32.9b 395.7±69.8b 62.8±5.1c 3 099.9±298.8c 6 316.7±1 196.1c 108.0±6.9c 180.4±21.4b 44.3±1.6b 52.2±2.8b 12 499.1±1 303.0c 正常氮(HN) 396.1±47.8b 22.3±2.5b 69.7±9.2a 56.0±15.5a 49.9±6.3a 61.4±10.9b 62.5±5.0b 584.8±130.2b 104.2±15.7b 82.4±23.0ab 347.9±55.7b 40.3±1.5b 2 330.3±336.3b 2 103.2±394.9b 50.5±10.3b 41.4±0.5a 43.7±1.6ab 45.1±9.3ab 6 537.7±1 024.0b 低氮(LN) 188.3±5.7a 7.6±1.4a 47.5±11.7a 38.2±9.7a 38.5±10.1a 28.2±0.8a 32.8±0.1a 106.1±10.3a 39.7±6.7a 56.6±2.1a 151.8±17.2a 22.5±1.4a 714.1±174.4a 971.2±695.9a 22.5±2.2a 32.5±0.8a 38.9±1.3a 31.5±0.2a 2 595.2±721.7a P-value *** ** ** ** * * *** **** ** ** * *** ** ** *** *** ns ** *** 注:*:P < 0.05;**:P < 0.01;***:P < 0.001;****:P < 0.000 1;ns:notsignificant. -
[1] Rennenberg H, Wildhagen H, Ehlting B. Nitrogen nutrition of poplar trees[J]. Plant Biol (Stuttg), 2010, 12(2):275-291. [2] Studer M H, Demartini J D, Davis M F, et al. Lignin content in natural Populus variants affects sugar release[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(15):6300-6305. [3] Luo Z B, Calfapietra C, Liberloo M, et al. Carbon partitioning to mobile and structural fractions in poplar wood under elevated CO2 (EUROFACE) and N fertilization.[J]. Global Change Biology, 2010, 12(2):272-283. [4] Luo Z B, Polle A. Wood composition and energy content in a poplar short rotation plantation on fertilized agricultural land in a future CO2 atmosphere.[J]. Global Change Biology, 2009, 15(1):38-47. [5] Novaes E, Luis O, Drost D R, et al. Quantitative genetic analysis of biomass and wood chemistry of Populus under different nitrogen levels[J]. New Phytologist, 2009, 182(4):878-890. [6] Luo J, Li H, Liu T, et al. Nitrogen metabolism of two contrasting poplar species during acclimation to limiting nitrogen availability[J]. Journal of Experimental Botany, 2013, 64(14):4207-4224. [7] Luo J, Zhou J, Li H, et al. Global poplar root and leaf transcriptomes reveal links between growth and stress responses under nitrogen starvation and excess[J]. Tree Physiology, 2015, 35(12):1283. [8] Lópezbucio J, Cruzramírez A, Herreraestrella L. The role of nutrient availability in regulating root architecture.[J]. Current Opinion in Plant Biology, 2003, 6(3):280-287. [9] Farrar J, Pollock C, Gallagher J. Sucrose and the integration of metabolism in vascular plants[J]. Plant Science, 2000, 154(1):1-11. [10] Oliveira I C, Brenner E, Chiu J, et al. Metabolite and light regulation of metabolism in plants:lessons from the study of a single biochemical pathway[J]. Brazilian Journal of Medical & Biological Research, 2001, 34(5):567-575. [11] 郭鹏旭, 熊淑萍, 杜少勇, 等.氮素形态对豫麦34地上器官游离氨基酸和籽粒蛋白质含量的影响[J].麦类作物学报, 2010, 30(2):326-329. [12] Zhi L I, Shi H Z, Liu G S, et al. Changes of Carbon-Nitrogen Metabolism of Flue-Cured Tobacco with Sweet Aroma in South Anhui Under Different Fertilization Rates[J]. Soils, 2010, 42(1):8-13. [13] 王迎男.不同氮素供应水平对马铃薯植株碳氮比及块茎形成的影响[D].呼和浩特, 内蒙古农业大学, 2017. [14] 孙兴祥, 王健, 周毅, 等.不同氮素水平对菠菜生长和品质的影响[J].南京农业大学学报, 2005, 28(3):126-128. [15] York L M, Galindocastañeda T, Schussler J R, et al. Evolution of US maize (Zea mays L.) root architectural and anatomical phenes over the past 100 years corresponds to increased tolerance of nitrogen stress[J]. Journal of Experimental Botany, 2015, 66(8):2347-2358. [16] Zhan A, Lynch J P. Reduced frequency of lateral root branching improves N capture from low-N soils in maize[J]. Journal of Experimental Botany, 2015, 66(7):2055-2065. [17] Euring D, Löfke C, Teichmann T, et al. Nitrogen fertilization has differential effects on N allocation and lignin in two Populus species with contrasting ecology[J]. Trees, 2012, 26(6):1933-1942. [18] Cooke J E K, Martin W. Nitrogen storage and seasonal nitrogen cycling in Populus: bridging molecular physiology and ecophysiology[J]. New Phytologist, 2010, 167(1):19-30. [19] Ke L, Shichang L, Yupeng T, et al. Optimized GC-MS method to simultaneously quantify acetylated aldose, ketose, and alditol for plant tissues based on derivatization in a methyl sulfoxide/1-methylimidazole system[J]. J Agric Food Chem, 2013, 61(17):4011-4018. [20] Deng C, Deng Y, Wang B, et al. Gas chromatography-mass spectrometry method for determination of phenylalanine and tyrosine in neonatal blood spots[J]. Journal of Chromatography B, 2002, 780(2):407-413. [21] Li H, Li M, Luo J, et al. N-fertilization has different effects on the growth, carbon and nitrogen physiology, and wood properties of slow-and fast-growing Populus species[J]. Journal of Experimental Botany, 2012, 63(17):6173-6185. [22] Ruffel S, Krouk G, Ristova D, et al. Nitrogen economics of root foraging:Transitive closure of the nitrate-cytokinin relay and distinct systemic signaling for N supply vs demand[J]. Proceedings of the National Academy of Sciences, 2011, 108(45):18524-18529. [23] Jie L, Jingjing Q, Fangfang H, et al. Net fluxes of ammonium and nitrate in association with H+ fluxes in fine roots of Populus popularis[J]. Planta, 2013, 237(4):919-931. [24] Cooke J E K, Martin T A, Davis J M. Short-term physiological and developmental responses to nitrogen availability in hybrid poplar[J].New Phytologist, 2005, 167:41-52. [25] Cooke J E, Weih M. Nitrogen storage and seasonal nitrogen cycling in Populus:bridging molecular physiology and ecophysiology[J]. New Phytologist. 2010, 167(1):19-30. [26] 今西三好, 无岛皓, 姚祥.以天冬酰胺含量为指标的桑树氮素营养状态简易诊断法[J].国外农学-蚕业, 1986(2):60-61. [27] 杨洪强, 高华君.植物精氨酸及其代谢产物的生理功能[J].植物生理与分子生物学学报, 2007, 33(1):1-8. [28] 王小乐, 迟天华, 刘颖鑫, 等.甘露醇和蔗糖对菊花低温离体保存的影响[J].核农学报, 2019, 33(01):60-68. [29] Zhao H, Su T, Huo L, et al. Unveiling the mechanism of melatonin impacts on maize seedling growth:sugar metabolism as a case[J]. Journal of Pineal Research, 2015, 59(2):255-266. [30] Rucha, Karve, Michael, et al. Evolutionary lineages and functional diversification of plant hexokinases[J]. Molecular Plant, 2010, 3(2):334-346. [31] Nunes-Nesi A, Fernie A R, Stitt M. Metabolic and signaling aspects underpinning the regulation of plant carbon nitrogen interactions[J]. Molecular Plant, 2010, 3(6):973-996. -





 下载:
下载: