-
杜仲(Eucommia ulmoides Oliv.)是杜仲科杜仲属落叶乔木,为我国特有名贵经济树种。杜仲皮是名贵中药材,具有补肝肾、强筋骨以及安胎等作用[1]。另外,杜仲是世界上适应范围最广的重要胶源树种[2-3],也是温带最具开发潜力的胶源树种[4]。杜仲胶不仅具有橡(胶)塑(料)二重性,可开发兼具热塑性、热弹性和高弹性的功能材料,如高质量的轮胎、高尔夫球、假肢套等产品[5],杜仲胶还具有绝缘性好,耐酸碱且不易腐蚀等特点,是制造海底电缆绝缘带的理想材料[6]。研究表明,杜仲的根、茎、叶、花、果实的韧皮部薄壁细胞中分布有细长、两端膨大、内部充满胶颗粒的特化丝状单细胞[7-9],它是杜仲植株体内合成和储藏硬性橡胶的场所[10]。研究发现,杜仲果实中含胶率高达12%以上,居杜仲树各部位含胶量之首,比杜仲叶片高46倍[11]。杜仲橡胶也称古塔波胶或巴拉塔胶[12],分子构象测定表明杜仲胶为反式-聚异戊二烯[13],与巴西橡胶树(Hevea brasiliensis Muell. Arg.),银胶菊(Parthenium aryentatuim L.)等合成的顺式-聚异戊二烯橡胶互为同分异构体[14]。早期研究者对巴西橡胶研究发现,橡胶树树皮韧皮部含有网络分布的乳汁管可分泌出胶乳,而胶乳中又含有大量包裹有几个到上千个橡胶分子的胶颗粒[15-16],胶颗粒的主要功能是合成和贮藏天然橡胶[17]。显微观察表明,胶颗粒是一类不连续的亚细胞器,内部由橡胶分子组成疏水核心区,外部则由脂类和蛋白质组成的“半单位膜”包裹[18-19]。与橡胶树不同,杜仲树皮韧皮部不含网络状乳汁管,胶颗粒主要存在于含胶细胞中,分离提取及纯化条件相对较为复杂。2003年,王敏杰等[20]采用反复漂洗/离心法对杜仲叶胶颗粒进行了提取纯化,并从杜仲叶胶颗粒上分离鉴定出两种丰度最高膜结合蛋白,EuRPP56和EuRPP30,之后更多参与杜仲胶合成的相关蛋白基因被报道[21-22]。王惠[23]通过改进提取方法,从叶中获得纯度更高的杜仲胶颗粒,但该法仅适用于胶含量累积最高时期的杜仲组织中胶颗粒的提取。因此,探索可适用于杜仲不同生长期各器官中胶颗粒的提取工艺条件,为深入研究杜仲胶颗粒的功能具有重要意义。本研究通过对已有杜仲胶颗粒提取工艺进行改良、优化,并结合胶颗粒形态观察,形成可适用于杜仲各生长期不同组织器官中杜仲胶颗粒的提取条件,进而为研究杜仲胶粒的分化形成机制、杜仲胶分子的累积规律以及杜仲胶合成的分子机制奠定基础。
-
植物材料于2018年取自种植于贵州大学农业生物工程研究院实验农场杜仲资源圃中的多年生杜仲植株的当年生叶片及翅果。
-
仪器:水平离心机(ThermoFisher Scientific Inc.),Allegra X-30R Centrifuge定角(45度)离心机(Beckman Coulter Inc.),BX43光学显微镜(OLYMPUS Inc.),S3400扫描电子显微镜(Hitachi Inc.),e-1010离子溅射仪(Hitachi Inc.),电子天平(北京丹佛仪器有限公司),PH计(上海洪纪仪器设备有限公司)等。
试剂:三羟甲基氨基甲烷(Tris)、苯甲基磺酰氟(PMSF)、聚乙烯吡咯烷酮(PVP)、β-巯基乙醇(BME)及抗坏血酸(Vc)购于Sigma-Aldrich(上海)贸易有限公司,氟化钾(KF)、硫酸镁(MgSO4),异丙醇(isopropanol)、盐酸(HCl)购于天津市科密欧化学试剂有限公司,2.5%戊二醛固定液购于Solarbio(北京)科技有限公司。
-
按照不同月份(6、7、8、9、10和11月)分别采收杜仲植株叶片(6—11月)及翅果(6—10月),擦去表面灰尘后置于自来水下冲洗干净,用干净的吸水纸吸干植物材料表面的水分后用液氮速冻,保存于-80℃超低温冰箱备用。
-
参照赵德刚博士后出站报告[4]及王惠[23]硕士论文中杜仲胶颗粒提取方法并略作修改。取-80℃超低温冰箱冻存的新鲜杜仲叶(或翅果)加入组织研磨杵中用液氮迅速研磨成粉,称取适量样品粉末至含有400 mL预冷提取缓冲液的1 L烧杯中,于冰上快速搅拌抽提1 min,之后将组织匀浆液在4℃条件下迅速过200目不锈钢筛网并收集滤液,滤液分装于6支4℃预冷的50 mL离心管中备用。滤液分别按以下2种方法进行离心操作:①离心管在4℃条件下以5 000 g水平离心10 min后,小心取出后利用20 mL干净注射器将6支离心管中上层悬浮物合并转移至3支洁净的10 mL离心管中备用;②离心管在4℃条件下以5 000 g定角(45度)离心10 min后,分别以注射器收集液面漂浮物和以移液枪收集贴附于临近液面上层管壁处的悬浮物,合并后转移至3支洁净的10 mL离心管中备用。分别将上述2种处理获得的合并悬浮物于冰上放置30 min,于4℃,5 000 g水平离心8 min,弃去下清液,加入8 mL预冷的漂洗缓冲液重悬后,4℃,5 000 g水平离心8 min,弃去漂洗液,再次以漂洗缓冲液重悬、离心,重复6~8次。提取缓冲液:100 mmol·L-1 Tris-HCl,50 mmol·L-1 KF,2%(W/V)Vc,5 mmol·L-1 MgSO4,pH=7.5),临用前加入2%(W/V)PVP,β-巯基乙醇(终浓度为5 mmol·L-1),0.1 mmol·L-1 PMSF异丙醇溶液。漂洗缓冲液:100 mmol·L-1 Tris-HCl,5 mmol·L-1 MgSO4,10 mmol·L-1 β-巯基乙醇。
-
准确称取-80℃冻存的、采摘于10月的杜仲叶(或翅果)100 g于组织研磨杵中加入液氮迅速研磨成粉,迅速转移至预冷的400 mL提取缓冲液中,于冰上快速搅拌抽提1 min,将组织匀浆液在4℃条件下过200目不锈钢筛网并收集滤液,滤液转移至50 mL离心管中,再按照1.2.2中第二种方法对样品进行杜仲胶颗粒提取。将第一次过滤所得植物样品分别按照不同次数(1、2、3、4、5和6次)再次研磨(无需加液氮研磨),每研磨一次约10 min,提取缓冲液浸提过滤2次,同时烘干提取纯化后的杜仲胶颗粒。计算出杜仲样品在不同研磨次数处理后杜仲胶颗粒得率。
-
精确称取-80℃冻存、取自不同月份的杜仲叶片(6—11月)和杜仲翅果(6—10月)各100 g,结合1.3.3方法中植物样品6次研磨10次过滤,滤液采用1.3.2方法中经4℃条件下5 000 g定角离心(45度)10 min提取杜仲胶颗粒;同时烘干提取纯化后的杜仲胶颗粒,计算杜仲胶颗粒在不同生长期杜仲叶或翅果中的含量,分析不同杜仲组织中胶颗粒含量随月份变化的动态积累规律。另外,利用OLYMPUS BX43光学显微镜对提取的胶颗粒大小进行观察,并以其自带测量工具对各生育期不同杜仲器官组织中胶颗粒大小进行测定,每组设3个重复。
-
取10月杜仲叶片和翅果提取纯化后的胶颗粒(约0.002 g)样品于干净的载玻片上,加1滴漂洗缓冲液悬浮胶颗粒,加盖盖玻片后置于OLYMPUS BX43光学显微镜(1 000×)下观察胶颗粒形态,同时以OLYMPUS BX43自带测量工具对采自10月的样品材料中的胶颗粒进行粒径测量,并对光镜观察拍摄的胶颗粒按粒径大小进行分类、统计。选取同一视野中3个等面积的区域进行分析,每组重复3次。另取同时期纯化的叶片和翅果胶颗粒各(0.1 g)于2 mL离心管中,加入1.8 mL 2.5%的戊二醛固定液于4℃冰箱固定4 h。取固定好的胶颗粒均匀涂布在干净盖玻片上室温过夜晾干,利用日立e-1010离子溅射仪镀金后直接用日立S3400扫描电子显微镜观察杜仲胶颗粒形态。
-
由图 1A可以看出,抽提滤液经4℃,5 000 g水平离心10 min后发现,杜仲叶及翅果提取液表层有少量乳白色漂浮物,且翅果(S)中乳白色漂浮物较叶片(L)中多;而抽提滤液以4℃,5 000 g定角离心(45度)10 min后无论杜仲叶片和翅果提取液表层和离心管壁均富集了大量乳白色颗粒物(图 1B)。镜检结果表明,该乳白色漂浮物即为杜仲胶颗粒,说明以45度定角离心有利于杜仲胶颗粒的提取。进一步利用光镜对粗提和纯化的胶颗粒观察发现,粗提杜仲胶颗粒含有较多细胞及组织碎片,经过纯化提取处理的杜仲胶颗粒纯度较高,杂质污染少。通过不同离心条件比较,确定杜仲胶颗粒提取的最佳离心条件为:4℃,45度定角,5 000 g离心10 min胶颗粒的得率最高。
-
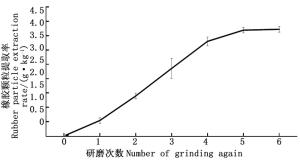
对液氮首次研磨过滤后的杜仲样品进行不同次数研磨提取发现,随着捣碎研磨次数的增加杜仲胶颗粒的提取得率也显著上升(图 2)。当研磨1次时,杜仲胶颗粒提取率仅为0.54 g·kg-1,研磨3~5次时,杜仲胶颗粒得率分别为2.36 g·kg-1、3.31 g·kg-1、3.70 g·kg-1,说明充分研磨植物材料有利于细胞壁的破碎进而释放出更多的杜仲胶颗粒。其中胶颗粒提取率在研磨次数达到第2、3、4次时增加最快。当研磨次数达到4次时,杜仲胶颗粒的提取率增幅不显著,趋于恒定。通过比较不同研磨次数对杜仲胶颗粒得率分析表明,过滤后的植物材料经6次研磨能充分破碎细胞并释放出大量的胶颗粒。
-
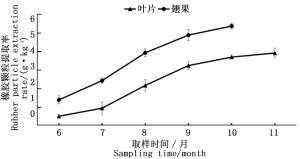
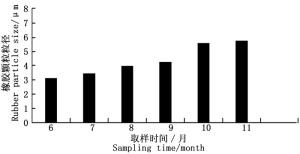
对不同生长期杜仲叶及翅果胶颗粒积累规律进行分析,结果如图 3所示。随着杜仲叶片和翅果生长发育的成熟其胶颗粒的积累量不断增多,当发育达到成熟后胶颗粒的含量趋于稳定。其中,6—10月份杜仲叶片胶颗粒积累量低于翅果。胶颗粒粒径测定结果表明,随着杜仲翅果生长发育的成熟,杜仲翅果胶颗粒粒径呈不断增大的趋势,到9月份以后杜仲翅果胶颗粒大小变化趋于恒定,如图 4所示。随着杜仲叶生长发育的成熟,杜仲叶片胶颗粒粒径呈不断增大的趋势,到10月以后杜仲叶片胶颗粒粒径大小趋于稳定,变化极小(图 5)。可能是6—7月份杜仲生长代谢旺盛,胶颗粒进行橡胶分子的合成速度较快,使胶颗粒粒径不断增大;9—10月温度和光照强度降低,杜仲叶果合成代谢速度减慢,导致胶颗粒粒径变化趋于稳定。
-
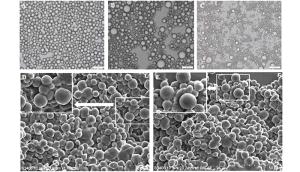
从图 6A、B、C可以看出,杜仲胶颗粒在光镜下呈球形,不同器官中胶颗粒形态差异较大。杜仲叶胶颗粒大小总体表现为均一化程度一致,两级分化较低,而杜仲翅果胶颗粒均一化程度较差,表现为小胶颗粒含量(粒径为1 4 μm)最多,中等大小胶颗粒含量(4 7 μm)次之,大胶颗粒(7 11 μm)含量最低。电镜对叶和果中的胶颗粒观察也发现两者中的胶颗粒形态存在一定差异(图 6D,E)。杜仲树皮胶颗粒主要以1 4 μm小胶颗粒数量最多,中等胶颗粒和大胶颗粒含量极少。进一步对各不同大小胶颗粒在胶颗粒中所占比例分析发现,杜仲叶中粒径为1 4 μm小胶颗粒占39%,粒径为4 7 μm中等胶颗粒占38%,粒径为7 11 μm大胶颗粒占23%;杜仲翅果中粒径为1 4 μm的小胶颗粒占53%,粒径为4 7 μm的中等胶颗粒占34%,粒径为7 11 μm的大胶颗粒占13%;杜仲树皮中粒径为1 4 μm的小胶颗粒占98.38%,粒径为4 7 μm的中等胶颗粒占0.12%,粒径为7 11 μm的大胶颗粒占0.05%。推测不同器官组织中胶颗粒大小差异可能各器官的特定功能或不同器官中杜仲胶分子量大小有一定关系。
-
杜仲胶颗粒是合成杜仲胶的重要细胞器,尽管杜仲胶颗粒广泛分布于杜仲叶片、果皮、树皮等多个器官组织中[24],相较巴西橡胶(H. brasiliensis Muell. Arg.)胶颗粒的分离及提取工艺,杜仲胶颗粒提取步骤复杂,进而限制了对于杜仲胶颗粒的深入研究。笔者在赵德刚[4]、王敏杰[20]及王惠[23]等研究者前期工作的基础上,建立了杜仲胶颗粒提取条件操作简捷、重复性好、提取率高,且适用于不同生长期(6—11月)杜仲叶、翅果及树皮等器官中杜仲胶颗粒的提取。研究结果表明,不同生长期的杜仲器官组织经多次研磨、抽提及定角离心后可获得较高含量杜仲胶颗粒。光镜和电镜观察结果表明,杜仲胶颗粒呈球形,组织碎片等杂质含量较少,胶颗粒纯度较高。进一步通过对不同杜仲器官中胶颗粒粒径大小分析发现,杜仲叶、翅果和树皮提取的小胶颗粒(1 4 μm)的比例依次增多(分别占39%,53%,98.38%),中等胶颗粒(4 7 μm)和大胶颗粒(7 11 μm)依次减少,相关研究报道杜仲叶、树皮及种皮中杜仲胶平均分子量分别为Mw=7.5×103,Mw=4.3×105和Mw=5.1×105[25],推测杜仲叶中尽管中等及大橡胶颗粒相对翅果较多,可能以低分子量杜仲胶分子为主,而杜仲翅果中尽管小橡胶颗粒相对叶片较多,可能以高分子量杜仲胶分子为主。对10月份采集的杜仲叶和翅果胶分子量进行测定,发现叶片中杜仲胶颗粒内部橡胶分子质量分布有5个峰值,杜仲胶平均分子量为Mw=1.83×104,翅果中杜仲胶颗粒内部橡胶分子质量分布有2~3个峰值,杜仲胶平均分子量为Mw=4.15×104,两者差异达到显著水平(P < 0.05)。同时,杜仲翅果中杜仲胶分子量分布(D=Mw/Mn)比叶片宽,杜仲叶和杜仲翅果的D值分别为6.76和40.61,表明尽管杜仲叶中不同大小分子量的胶分子含量较多,但分布较为集中,而杜仲翅果中不同大小分子量的胶分子含量较少,但分布较为分散(另文发表)。另外,通过对杜仲各生长期(6—11月)叶片及翅果中胶颗粒粒径及胶颗粒积累变化分析表明,胶颗粒粒径大小随杜仲叶和杜仲翅果的发育成熟而不断增大,胶颗粒积累量均呈先增加后稳定的变化趋势,其中杜仲翅果中胶颗粒含量在10月份时达到最大值,为5.37 g·kg-1,之后不再增加;而杜仲叶中胶颗粒含量在10月份时为3.70 g·kg-1,之后含量增加不显著。利用该法提取的杜仲胶颗粒纯度及得率相较赵德刚[4]、王敏杰[20]及王惠[23]有显著改善,且不受取材时期的限制。本研究提取的胶颗粒可为深入研究杜仲胶颗粒的膜质组分及杜仲胶合成相关研究提供基础。
-
本研究采用不同离心条件对杜仲胶颗粒进行提取,结果表明在4℃条件下,以5 000 g离心力45度定角离心杜仲胶颗粒的提取得率最高。进一步通过对粗研磨样品进行复研磨发现,当滤渣样品经5次复研磨后,杜仲样品中大量胶颗粒已被提取分离出来。通过对不同生长期(6—11月)、不同杜仲器官中胶颗粒含量分析表明,随着杜仲叶片和翅果随着发育的成熟杜仲胶颗粒的积累量和粒径呈先增大后稳定的变化趋势,其中翅果胶颗粒含量在各发育阶段均显著高于杜仲叶片;显微观察结果表明,利用此法提取的杜仲胶颗粒形态完整,细胞碎片等杂质较少,可为进一步分析胶颗粒组成、形态发生以及阐明胶颗粒与杜仲胶含量以及分子量大小提供理想的实验材料。
杜仲胶颗粒提取纯化及胶颗粒显微观察研究
Extraction, Purification and Microscopic Observation of Rubber Particles Extracted from Eucommia ulmoides
-
摘要:
目的 建立快速、简便、重复性好、得率高的杜仲胶颗粒提取技术,为进一步分析胶颗粒膜蛋白、脂肪酸、糖脂等组成及杜仲橡胶分子量奠定基础。 方法 以杜仲叶片和翅果为材料,利用不同离心条件及研磨次数探究杜仲胶颗粒得率,并结合光镜与电镜观察结果,探讨适合从不同杜仲组织器官中提取胶颗粒的最优条件。 结果 杜仲组织(叶片或翅果)液氮经速冻、反复研磨捣碎6次过滤10次,在4℃条件下以5 000 g离心力,45度定角离心10 min,并反复漂洗8次得到的杜仲胶颗粒含量最高。在此条件下,以10月采摘的杜仲叶和翅果为材料,提取的杜仲胶颗粒含量可分别达3.70 g·kg-1叶片、5.37 g·kg-1翅果。进一步观察发现,不论是杜仲叶片或翅果随着其发育的成熟,组织中胶颗粒粒径大小和积累量均呈现先增加后稳定的变化趋势。杜仲胶颗粒在光镜和电镜下呈球形,胶颗粒间粒径大小差异较大。以10月杜仲叶、翅果及树皮为例,小胶颗粒(1~4 μm)分别占39%,53%,98.38%,中等胶颗粒(4~7 μm)分别占38%,34%,0.12%,大胶颗粒(7~11 μm)分别占23%,13%,0.05%。 结论 本研究建立的杜仲胶颗粒提取技术较为快捷,得率高,可快速对不同时期不同组织器官的杜仲胶颗粒进行提取。 Abstract:Objective To establish a rapid, simple, reproducible and high yield extraction method of Eucommia ulmoides gum particle in order to investigate its plasma membrane components, including membrane protein, fatty acid, glycolipid and the molecular weight of E. ulmoides gum. Method The leaf and samara of E. ulmoides were selected as extracted materials for analyzing the extraction ratio of E. ulmoides gum particle by changing centrifugal condition and number of grinding, combining with the results of light microscope and electron microscope observation. Result The results showed that the liquid nitrogen quick-frozen E. ulmoides samples (leaf or samara) via 6 times grind, 10 times filter, 5 000 g centrifugal force (45°constant angle) at 4℃ for 10 minutes and 8 times rinse with washing buffer could produce higher extraction yield. Under this condition, the extraction ratios of gum particle from E. ulmoides leaf and samara collected in October, 2018 were 3.70 g·kg-1 and 5.37 g·kg-1, respectively. Further, the morphological observations indicated the size and accumulated content of E. ulmoides gum particle appeared the change rule of increasing at first and then stabilizing and there were significant difference in grain diameter between these gum particles. The results from electron microscopy observation found that small gum particles (1 4 μm) and medium gum particles (4 7 μm) respectively from E. ulmoides leaf, samara and bark (collected in October, 2018) accounted for 39%, 53%, 98.38% and 38%, 34%, 0.12%, while the content of the large gum particles (7 11 μm) were 23%, 13%, 0.05%, respectively. Conclusion A modified approach is proposed to improve the extract efficiency of E. ulmoides gum particles which could be extensively applicable to extraction of gum particles from different organs and tissues of E. ulmoides. -
-
[1] 梅蛟, 杨帆.杜仲治疗高血压研究进展[J].世界最新医学信息文摘, 2018, 18(81):35-36. [2] 杜红岩.杜仲优质高产栽培[M].北京:中国林业出版社, 1996:215-219. [3] 杜红岩, 赵戈, 卢绪奎.论我国杜仲产业化与培育技术的发展[J].林业科学研究, 2000, 13(5):554-561. doi: 10.3321/j.issn:1001-1498.2000.05.018 [4] 赵德刚, 韩玉珍, 傅永福, 等.杜仲胶生物合成相关蛋白质的研究[J].中国农业大学学报, 1999, 4(1):114. doi: 10.3321/j.issn:1007-4333.1999.01.032 [5] 严瑞芳.一种古老而又年轻的天然高分子——杜仲胶[J].高分子通报, 1989(2):39-41. [6] 傅玉成.杜仲胶记忆材料的性质与应用[J].高分子材料科学与工程, 1992(4):123-126. [7] 卢敏, 胡正海, 田兰馨.杜仲茎韧皮部超微结构的初步研究[J].浙江林学院学报, 1990, 7(4):316-321. [8] 田兰馨, 卢敏, 胡正海.杜仲含胶细胞发生和发育的研究[J].植物学报, 1990, 32(1):1-6. doi: 10.3321/j.issn:1000-4025.1990.01.001 [9] 杜兰英, 杜红岩, 乌云塔娜, 等.杜仲树皮含胶特性的个体变异规律[J].林业科学研究, 2005, 18(2):169-172. doi: 10.3321/j.issn:1001-1498.2005.02.012 [10] 杜红岩, 谢碧霞, 邵松梅.杜仲胶研究的进展与发展前景[J].中南林学院学报, 2003, 23(4):95-99. doi: 10.3969/j.issn.1673-923X.2003.04.009 [11] 杜红岩, 赵戈, 卢绪奎.论我国杜仲产业化与培训技术的发展[J].林业科学研究, 2000, 13(5):554-561. doi: 10.3321/j.issn:1001-1498.2000.05.018 [12] 马娟, 林永慧, 刘彪, 等.我国杜仲胶的发展现状与展望[J].安徽农业科学, 2012, 40(6):3396-3398. doi: 10.3969/j.issn.0517-6611.2012.06.070 [13] Tangpakdee J, Tanaka Y, Shiba K I, et al. Structure and biosynthesis of trans-polyisoprene from Eucommia ulmoides[J]. Phytochemistry, 1997, 45(1):75-80. [14] 朱峰, 岳红, 祖恩峰, 等.新型功能材料杜仲胶的研究与应用[J].安徽大学学报:自然科学版, 2005, 29(3):89-94. [15] Dickenson P B. Electron microscopical studies of latex vessel system of Hevea brasiliensis[J]. Rubber Research Institute of Malaya Journal, 1969, 21(1):543-559. [16] 段翠芳, 聂智毅, 曾日中.橡胶粒子膜蛋白双向电泳体系的建立和质谱初步分析[J].热带作物学报, 2006, 27(3):22-29. doi: 10.3969/j.issn.1000-2561.2006.03.005 [17] 史敏晶, 吴继林, 郝秉中, 等.橡胶树橡胶粒子起源的超微结构分析[J].林业科学, 2016, 52(2):114-119. [18] Siler D J, Goodrich T M, Konish K. Composition of rubber particles of Hevea brasiliensis, Parthenuim argertatum, Ficus elastica and Euphorbia lactiflua indicates unconventional surface structure[J]. Plant Physiology Biochemistry, 1997, 35:881-889. [19] Cornish K, Windle W J J. Rubber particles from four different species, examined by transmission electron microscopy and electron-paramagnetic-resonance spin labeling, are found to consist of a homogeneous rubber core enclosed by a contiguous, monolayer biomembrane[J]. Planta, 1999, 210(1):85-96. doi: 10.1007/s004250050657 [20] 王敏杰, 韩玉珍, 刘卫平, 等.杜仲胶颗粒结合蛋白的分离、纯化及抗体制备[J].林业科学, 2003, 39(4):23-29. doi: 10.3321/j.issn:1001-7488.2003.04.004 [21] Suzuki N, Uefuji H, Nishikawa T, et al. Construction and analysis of EST libraries of the trans-polyisoprene producing plant, Eucommia ulmoides Oliver[J]. Planta, 2012, 236(5):1405-1417. doi: 10.1007/s00425-012-1679-x [22] Wuyun T N, Wang L, Liu H, et al. The hardy rubber tree genome provides insights into the evolution of polyisoprene biosynthesis[J]. Molecular Plant, 2018, 11(3):429-442. doi: 10.1016/j.molp.2017.11.014 [23] 王惠.杜仲胶粒的分离纯化与胶粒结合蛋白的分析[D].北京: 北京林业大学, 2006. [24] 周莉英, 黎斌, 苏印泉.杜仲含胶细胞形态特征的研究[J].西北植物学报, 2001, 21(3):566-569, 619-620. doi: 10.3321/j.issn:1000-4025.2001.03.028 [25] Nakazawa Y, Bamba T, Takeda T, et al. Production of eucommia-rubber from Eucommia ulmoides Oliv. (hardy rubber tree)[J]. Plant Biotechnology, 2009, 26(1):71-79. doi: 10.5511/plantbiotechnology.26.71 -




 下载:
下载: