-
油茶(Camellia oleifera Abel.)属山茶科(Theaceae)山茶属(Camellia L.)植物,为灌木、小乔木或中乔木,雌雄同花,花果同期,是我国特有的木本食用油料树种[1-3]。目前,在生产栽培中,油茶自交可育性低,若花期遇到阴雨天气会严重影响授粉受精,导致落花落果严重,极大地影响油茶产业高产高效的发展[4]。在我国南方,低温霜冻严重,油茶幼果在树上过冬,不同品种与立地条件下的油茶产量差距很大[5]。因此,如何使油茶多花多果、提高坐果率、减少落果以促其丰产稳产,成为生产中亟待解决的问题。
植物生长发育的控制发生在3个层次上:胞内控制、胞间控制和胞外控制,其中,胞间控制主要受植物激素调控,协调不同组织和细胞间的生理活动。激素在控制植物生长发育过程中起着关键的调控作用。植物激素作为一种化学信号,介导细胞与细胞间、器官与器官间、环境与植物间的相互作用,贯穿在整个植物生长发育的全过程[6]。开花是植物生长发育过程中尤为重要的组成部分[7]。植物在开花结实过程中,激素水平与花器官发育以及植物坐果率息息相关[8-11]。油橄榄(Olea europaea L.)、库尔勒香梨(Pyrus brestschneideri Rehd.)、扁桃(Amygdalus communis L.)等果树花期喷施外源激素可显著提高其坐果率和产量[12-14]。赤霉素(GAs)是一种二萜酸类植物激素,能够防止植株花期落花,提高坐果率[15]。目前,通过喷施外源GA3来调控花卉作物开花坐果的研究较多[16-19],而喷施GA3对油茶花器官内源激素等影响的研究鲜有报道。本文以9年生‘长林4号’油茶为研究对象,探究不同浓度的外源GA3对油茶花器官内源激素及坐果率的影响,分析油茶花器官内源激素与坐果率间的相关性,为油茶高产栽培和科学管理提供技术依据。
-
试验于2017年在江西省分宜县中国林科院亚热带林业实验中心油茶繁育基地(114°29′ E,27°33′ N)进行。该地为低山丘陵地形,海拔100 m,亚热带季风性湿润气候,年平均气温17.2℃,年平均降水量1 600 mm,降水量主要集中在春夏季3—6月,全年无霜期270 d。试验林面积1.33 hm2,土壤为红壤土,每年3月份施有机肥。供试材料为9年生油茶优良无性系‘长林4号’,生长良好、长势一致,地径6.5~9.0 cm,树高1.8~2.5 m,冠辐1.8~2.5 m。
-
试验于2017年10月进行,采用单因素试验设计,每个处理设3个重复,每个重复6株,处理之间留1株作为保护株,留1行作为保护行,并设置1个空白对照组(CK),共6个处理(表1)。每隔7 d进行叶面喷施,分别于10月25日(未开花)、11月3日、11月10日、11月18日喷施外源GA3,对照组喷施清水,喷施至滴水状为止。
表 1 外源激素单因素试验设计
Table 1. Test factors level of hormone
试验因素 Test factors 浓度Concentration/(mg·L−1) GA3 100 200 300 400 500 对照CK 0(清水Clear water) -
在试验前期,将试验树编号标记挂牌,根据生长势、枝粗以及枝位等指标选出标准枝,分别标记。于2017年11月15日最后一次喷施外源激素前统计各处理中每株的花朵数。于2018年4月8日坐果后调查记录各处理中每株的坐果数,按照以下公式计算坐果率:坐果率=坐果数(个)/开花数(个)×100%。
-
分别于2017年11月2日、11月9日、11月17日和11月26日采集油茶开花的4种状态即含苞、半开、全开与初萎的样品,每个处理采取15朵,迅速将雌蕊、雄蕊分离,分别取样于锡箔纸内,各1 g,置于存有足量液氮的泡沫箱中速冻,超低温冰箱保存备用,用于植物内源激素的测定。花器官中内源激素生长素(IAA)、赤霉素(GA3)、细胞分裂素(ZR)与脱落酸(ABA)采用酶联免疫法(ELISA)测定,试剂盒来源于中国农业大学农学与生物技术学院。
-
试验数据采用Excel 2016、SPSS Statistics17.0软件进行Duncan多重比较与Kendall显著差异性分析,并用Origin7.5软件进行二阶指数线性回归。
-
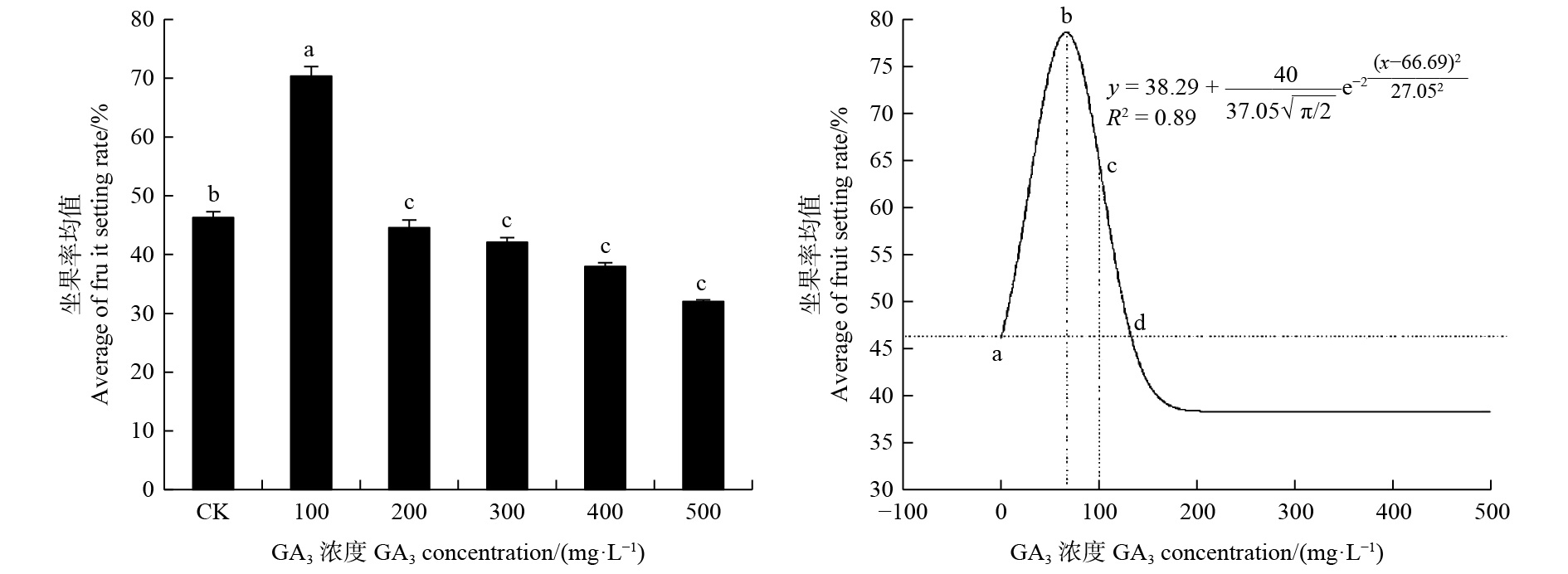
由图1可见:喷施低浓度的GA3可显著提高油茶坐果率;对照组CK坐果率为46.30%,喷施100 mg·L−1 GA3的油茶坐果率最高,为70.38%;200 mg·L−1 GA3处理的油茶坐果率低于对照组,为44.65%;300、400、500 mg·L−1 GA3处理的油茶坐果率依次降低,分别为42.10%、38.61%、32.48%,均低于对照。说明在试验水平范围内,低浓度的外源GA3处理有助于提高油茶坐果率,高浓度的外源GA3处理则起到抑制作用。
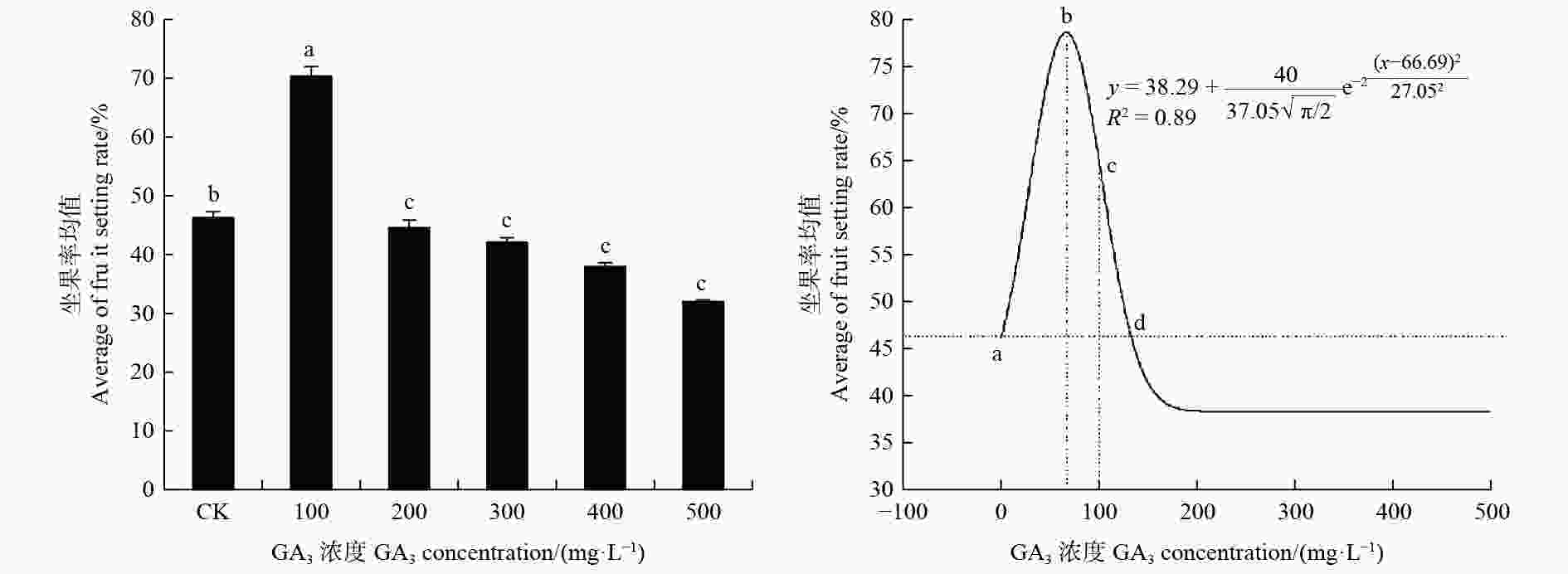
图 1 不同浓度GA3对油茶坐果率的影响
Figure 1. Effects of different concentrations of GA3 on the fruit setting rate of C. oleifera
对油茶坐果率(y)与外源GA3浓度(x)进行单因素回归分析,通过对单因素回归方程式求导可知,当x=0时,y=46.30,即a点代表对照组的坐果率;当x=xc=66.69±5.72时,y=77.05,此时b点y值达到最大,且坐果率增幅达到66.40%;当y=46.30时,可得d点外源GA3的浓度值x=132.63;当x=100时,c点坐果率增幅达40.00%;当33.03≤x≤100时,y≥64.98,才能达到油茶坐果率增幅大于或等于40.00%的效果。因此,提高油茶坐果率的最佳GA3浓度为66.69 mg·L−1,外源GA3浓度在33.03~100.00 mg·L−1能获得坐果率增幅大于或等于40.00%的效果,当外源GA3浓度超过132.63 mg·L−1时,对油茶坐果产生抑制作用。
-
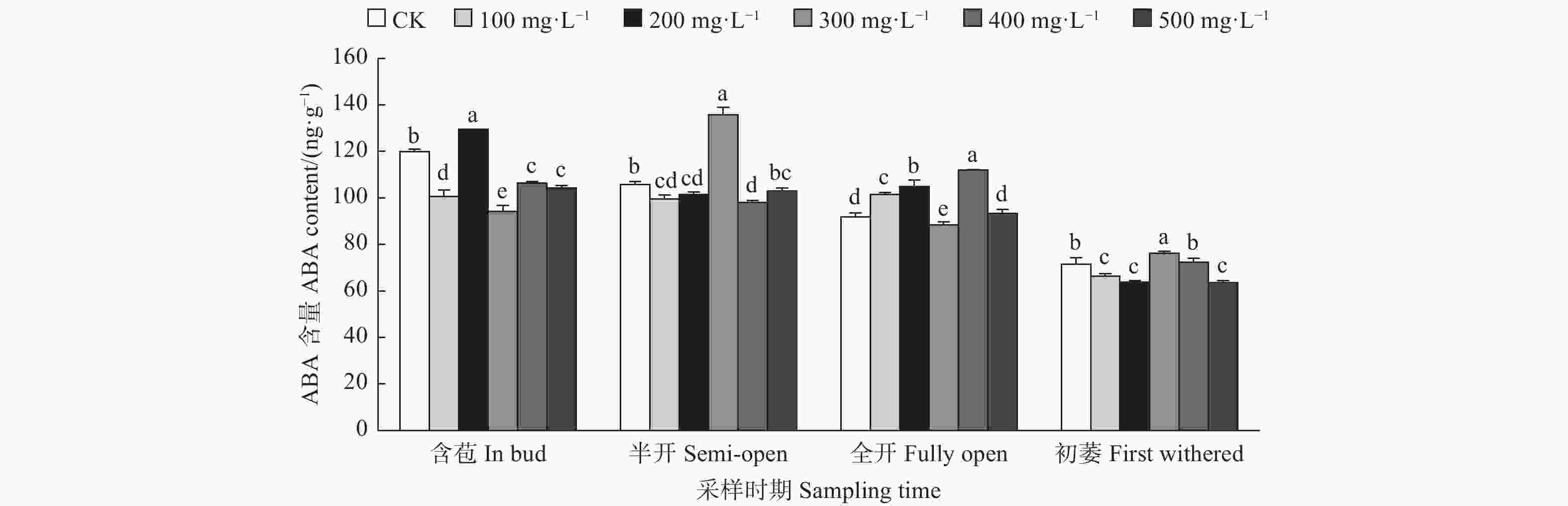
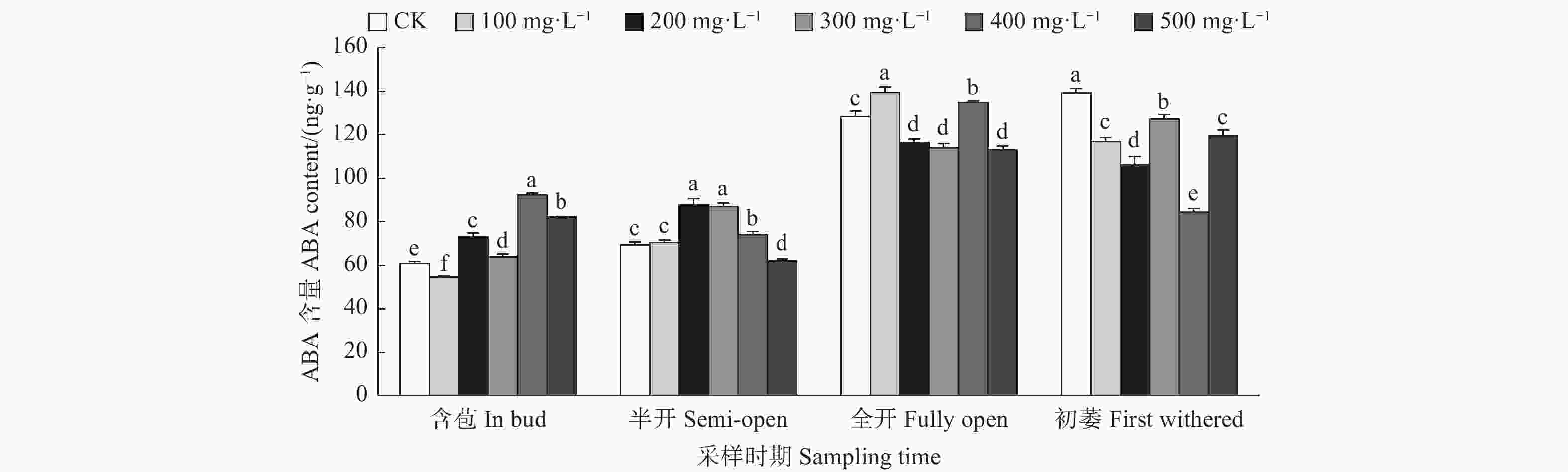
由图2可见:含苞时期,不同浓度GA3处理油茶雌蕊ABA含量与对照差异均显著,其中200 mg·L−1 GA3处理的雌蕊ABA含量显著高于对照,其它浓度GA3处理的雌蕊ABA含量均显著低于对照;半开时期,与对照相比,300 mg·L−1 GA3处理的雌蕊ABA含量显著高于对照,100、200、400 mg·L−1 GA3处理的雌蕊ABA含量显著低于对照;全开时期,与对照相比,400、200、100 mg·L−1 GA3处理的雌蕊ABA含量显著高于对照,300 mg·L−1 GA3处理的雌蕊ABA含量显著低于对照;初萎时期,与对照相比,300 mg·L−1 GA3处理的雌蕊ABA含量显著高于对照,100、500、200 mg·L−1 GA3处理的雌蕊ABA含量显著低于对照。
-
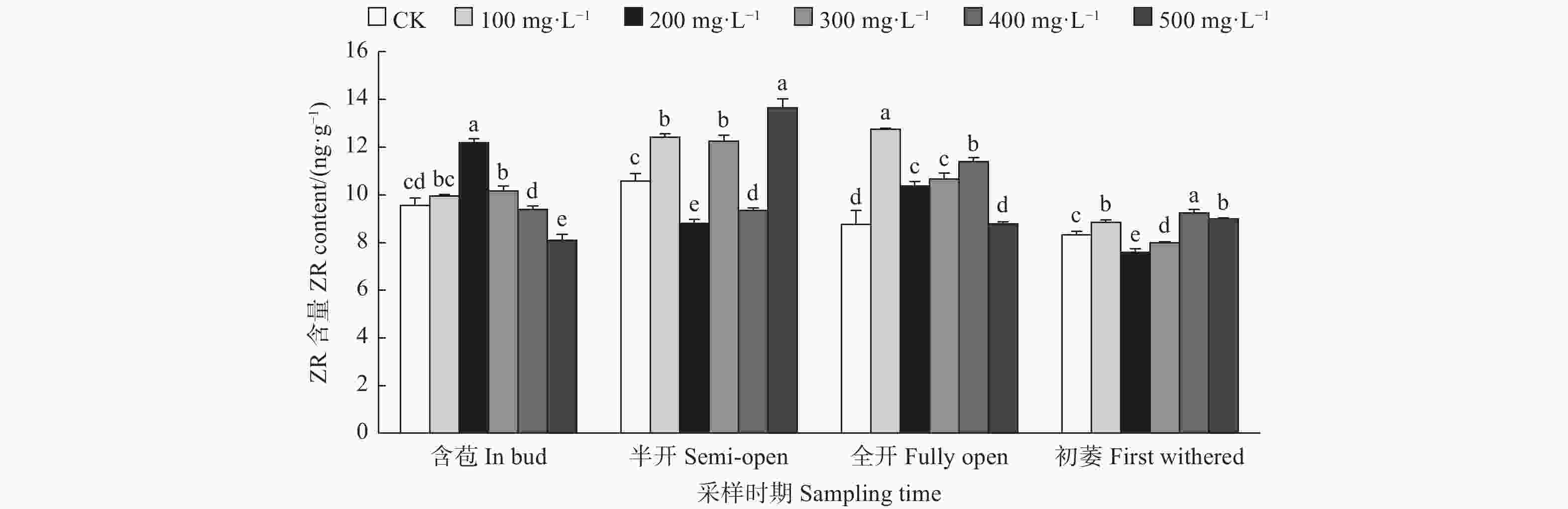
由图3可见:含苞时期,与对照相比,200、300 mg·L−1 GA3处理的雌蕊ZR含量显著高于对照,500 mg·L−1 GA3处理雌蕊ZR含量显著低于对照;半开时期,与对照相比,500、100、300 mg·L−1 GA3处理的雌蕊ZR含量显著高于对照,其它处理的雌蕊ZR含量显著低于对照;全开时期,与对照相比,100、400、300、200 mg·L−1 GA3处理的雌蕊ZR含量显著高于对照,500 mg·L−1 GA3处理的雌蕊ZR含量显著低于对照;初萎时期,与对照相比,400、500、100 mg·L−1 GA3处理的雌蕊ZR含量显著高于对照,其它处理的雌蕊ZR含量显著低于对照。
-
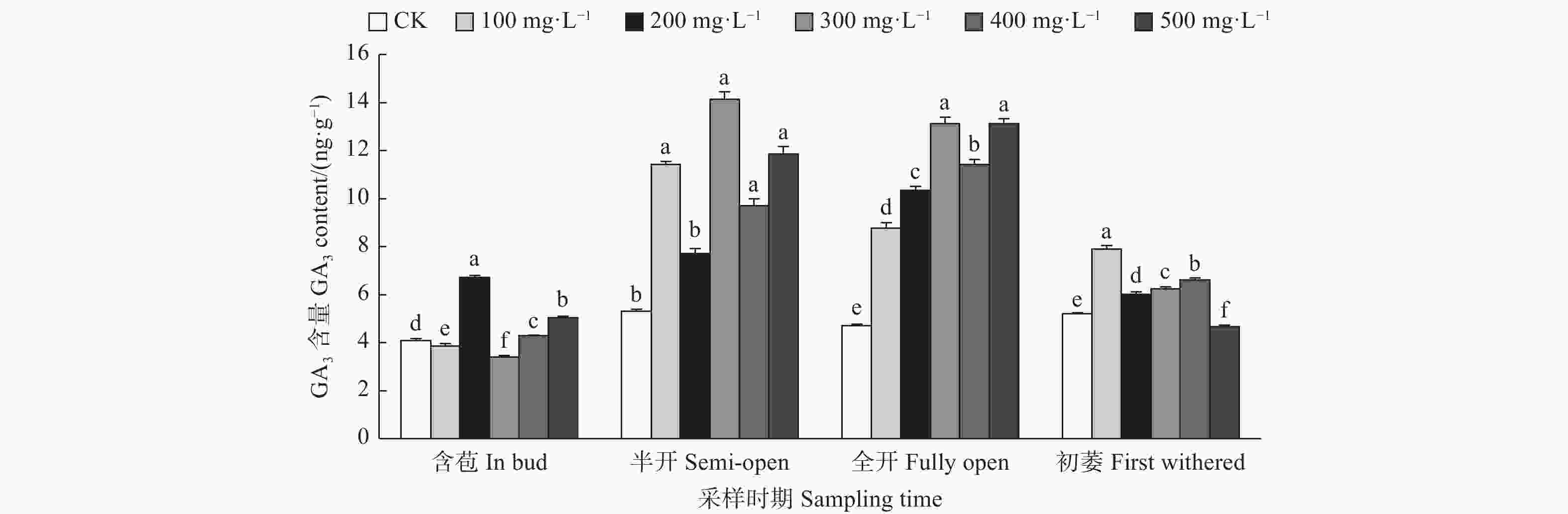
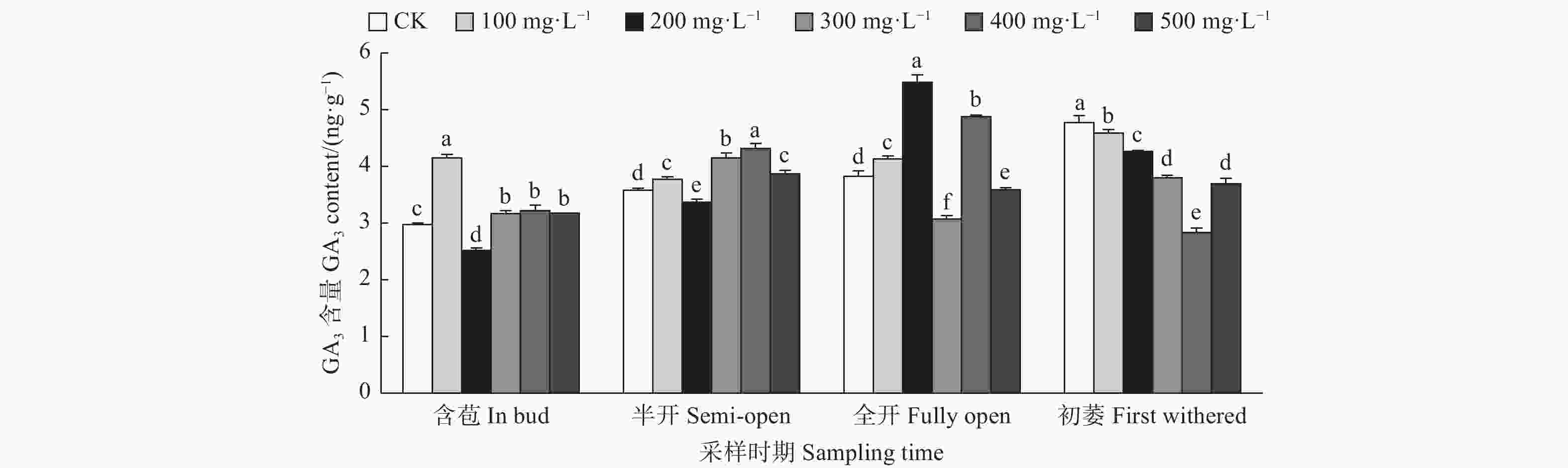
由图4可见:含苞时期,与对照相比,200、500、400 mg·L−1 GA3处理的雌蕊GA3含量显著高于对照,300、100 mg·L−1 GA3处理的雌蕊GA3含量显著低于对照;半开时期,300、100、500 、400 mg·L−1 GA3处理的雌蕊GA3含量显著高于对照;在全开时期,不同浓度GA3处理的雌蕊GA3含量均显著高于对照;初萎时期,与对照相比,100、400、300、200 mg·L−1 GA3处理的雌蕊GA3含量均显著高于对照,500 mg·L−1 GA3处理的雌蕊GA3含量显著低于对照。
-
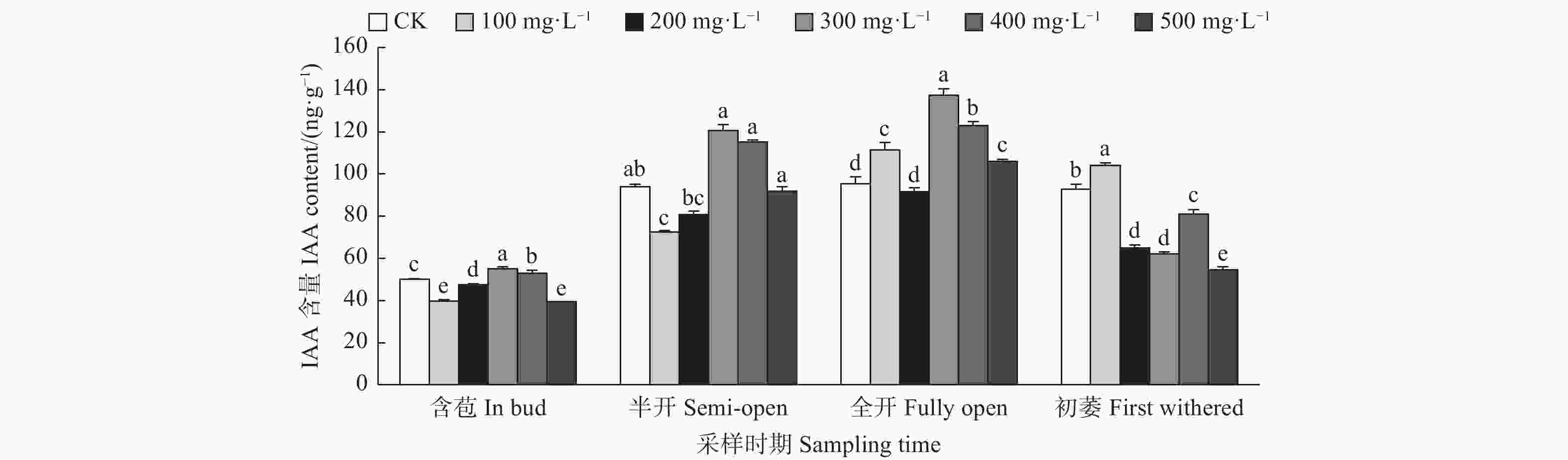
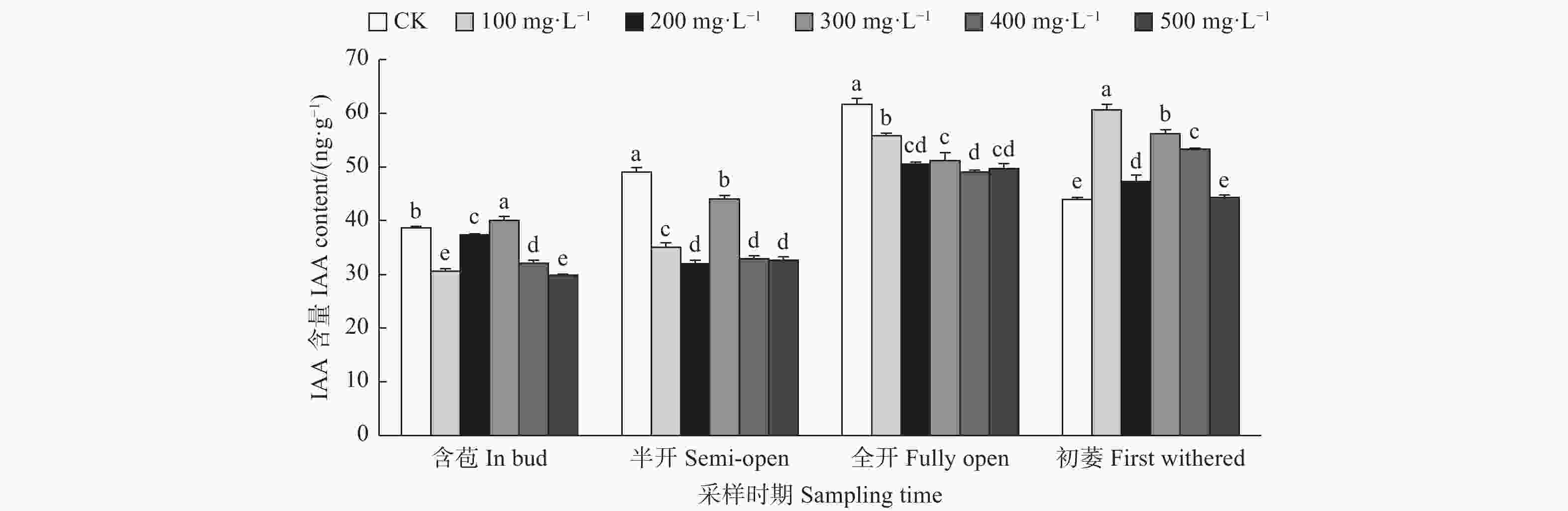
由图5可见:含苞时期,与对照相比,300、400 mg·L−1 GA3处理的雌蕊IAA含量显著高于对照,其它处理的雌蕊IAA含量显著低于对照;半开时期,与对照相比,100 mg·L−1 GA3处理的雌蕊IAA含量显著低于对照;全开时期,与对照相比,300、400、100、500 mg·L−1 GA3处理的雌蕊IAA含量显著高于对照;初萎时期,与对照相比,100 mg·L−1 GA3处理的雌蕊IAA含量显著高于对照,其它处理的雌蕊IAA含量显著低于对照。总体来看,随着采样时期的进行,喷施外源GA3使雌蕊IAA含量呈先上升后下降的变化趋势。
-
由图6可见:含苞时期,与对照相比,400、500、200、300 mg·L−1 GA3处理的雄蕊ABA含量显著高于对照,100 mg·L−1 GA3处理的雄蕊ABA含量显著低于对照;半开时期,与对照相比,200、300、400 mg·L−1 GA3处理的雄蕊ABA含量显著高于对照,500 mg·L−1 GA3处理的雄蕊ABA含量显著低于对照;全开时期,与对照相比,100、400 mg·L−1 GA3处理的雄蕊ABA含量显著高于对照,200、300、500 mg·L−1 GA3处理的雄蕊ABA含量显著低于对照;初萎时期,与对照相比,不同浓度GA3处理的雄蕊中ABA含量显著低于对照。
-
由图7可见:含苞时期,与对照相比,200、500、100、300 mg·L−1 GA3处理的雄蕊ZR含量显著高于对照;半开时期,与对照相比,不同浓度GA3处理的雄蕊ZR含量均显著低于对照;全开时期,与对照相比,200、400、100 mg·L−1 GA3处理的雄蕊ZR含量显著高于对照;初萎时期,与对照相比,100、500、300 mg·L−1 GA3处理的雄蕊ZR含量显著高于对照,200 mg·L−1 GA3处理的雄蕊ZR含量显著低于对照。
-
由图8可见:含苞时期,与对照相比,100、300、400、500 mg·L−1 GA3处理的雄蕊GA3含量显著高于对照,200 mg·L−1 GA3处理的雄蕊GA3含量显著低于对照;半开时期,与对照相比,400、300、500、100 mg·L−1 GA3处理的雄蕊GA3含量显著高于对照,200 mg·L−1 GA3处理的雄蕊GA3含量显著低于对照;全开时期,与对照相比,200、400、100 mg·L−1 GA3处理的雄蕊GA3含量显著高于对照,500、300 mg·L−1 GA3处理的雄蕊GA3含量显著低于对照;初萎时期,与对照相比,不同浓度GA3处理的雄蕊GA3含量均显著低于对照。
-
由图9可见:含苞时期,与对照相比,300 mg·L−1 GA3处理的雄蕊IAA含量显著高于对照,其它浓度GA3处理的雄蕊IAA含量显著低于对照;半开、全开时期,与对照相比,不同浓度GA3处理的雄蕊IAA含量均显著低于对照;初萎时期,与对照相比,100、300、400、200 mg·L−1 GA3处理的雄蕊IAA含量显著高于对照。总体来看,在初萎时期喷施外源GA3可显著提高雄蕊IAA的含量。
-
由表2可见:外源GA3与油茶雌蕊ABA在含苞时期呈极显著负相关(P<0.01),在半开时期呈显著负相关(P<0.05),在全开时期呈极显著正相关(P<0.01);外源GA3与油茶雌蕊ZR在半开、全开时期均呈极显著正相关(P<0.01),在初萎时期呈显著正相关(P<0.05);外源GA3与油茶雌蕊GA3在半开、全开与初萎时期均呈极显著正相关(P<0.01);外源GA3与油茶雌蕊IAA在含苞、半开时期均呈极显著负相关(P<0.01),外源GA3与油茶雌蕊IAA在全开、初萎时期均呈极显著正相关(P<0.01)。初萎时期雌蕊ABA与坐果率呈显著负相关(P<0.05)。外源GA3与油茶坐果率呈正相关,相关性不显著。在试验水平范围内,喷施较低浓度外源GA3可能通过调控不同时期油茶雌蕊内源ABA、ZR、GA3、IAA含量,影响油茶雌蕊内源激素间的平衡,从而降低初萎时期油茶雌蕊ABA含量,进而提高油茶坐果率。
表 2 外源GA3与油茶雌蕊内源激素和坐果率的相关性分析
Table 2. Correlation analysis between exogenous GA3 and pistil endogenous hormones,fruit setting rate of C. oleifera
变量 Variable GA3浓度
GA3 concentrationABA ZR 含苞
Stagnation半开
Half open全开
Fully open初萎
First fall含苞
Stagnation半开
Half open全开
Fully open初萎
First fallGA3浓度
GA3 concentration1.000 −0.979** −0.911* 0.963** −0.772 0.682 0.970** 0.978** 0.896* 坐果率 Fruit setting rate 0.536 −0.600 −0.571 0.370 −0.883* −0.229 0.528 0.519 0.412 -
由表3可知:外源GA3与油茶雄蕊ABA在含苞、初萎时期均呈极显著负相关(P<0.01),在全开时期呈极显著正相关(P<0.01);外源GA3与油茶雄蕊ZR在含苞时期呈显著正相关(P<0.05),在半开时期呈极显著负相关(P<0.01),在初萎时期呈极显著正相关(P<0.01);外源GA3与油茶雄蕊GA3在含苞、半开时期呈极显著正相关(P<0.01),在全开时期呈显著正相关(P<0.05);外源GA3与油茶雄蕊IAA在含苞、半开与全开时期均呈极显著负相关(P<0.01),在初萎时期呈极显著正相关(P<0.01)。
表 3 外源GA3与油茶雄蕊内源激素和坐果率的相关性分析
Table 3. Correlation analysis between exogenous GA3 and stamen endogenous hormones, fruit setting rate of C. oleifera
变量 Variable GA3浓度
GA3 concentrationABA ZR 含苞
Stagnation半开
Half open全开
Fully open初萎
First fall含苞
Stagnation半开
Half open全开
Fully open初萎
First fallGA3浓度
GA3 concentration1.000 −0.968** 0.409 0.921** −0.985** 0.849* −0.997** 0.786 0.995** 坐果率 Fruit setting rate 0.536 −0.552 0.023 0.474 −0.431 0.404 −0.563 0.573 0.468 -
赤霉素是一种重要的植物激素,在种子萌发、茎杆伸长、花粉成熟、开花诱导和花器官发育等方面具有重要作用[20-22]。开花作为植物由营养生长向生殖生长转变的关键环节,受光周期途径、春化途径、自主途径、环境温度途径以及赤霉素途径等多种途径调控[23]。已有研究证实,喷施低浓度的GA3对提高植物坐果率具有促进作用,如喷施浓度过大,易造成果实日灼、采前落果和耐贮性降低等问题[24-27]。本研究表明:在试验水平范围内,油茶花期喷施低浓度外源GA3有利于提高油茶坐果率;提高油茶坐果率的外源GA3最佳喷施浓度为66.69 mg·L−1。这与杜研[28]、董胜利等[29]的研究结果相似。
外源激素通过改变植物IAA、ABA、GA3、ZR等内源激素含量,影响内源激素间的平衡来调节自身的代谢水平,从而影响植株的开花和坐果[30]。脱落酸含量的升高将会加速植物果实离层的产生,从而导致植物果实的衰老脱落[31]。细胞分裂素可促进植物坐果和果实发育[6],生长素恰恰对离区水解酶含量的升高有抑制作用[32-33]。赤霉素作为植物内源激素与植物成花息息相关,具有促进细胞伸长,加速生长和发育,使作物提早成熟,减少器官脱落,提高果实的结实率等作用[34-35]。已有研究报道,喷施外源GA3使杜鹃(Rhododendron hybridum Planch)内源GA3含量上升[36-37];于冬枣(Zizyphus jujuba Mill. cv. Dongzao)花期喷施外源GA3可提高树体内GA3、IAA与ZR的含量。本研究表明:油茶花期喷施100 mg·L-1外源GA3使油茶雌蕊ABA含量降低,这与吴建明等[38]喷施外源GA3降低甘蔗(Saccharum officinarum)幼茎的内源ABA含量的研究结果相似;于油茶花期喷施100 mg·L-1外源GA3使油茶雌蕊GA3含量升高,与陈显[39]喷施低浓度的外源GA3可提高油茶内源GA3含量的研究结果相似。于油茶花期喷施100 mg·L−1外源GA3使油茶雌蕊ZR含量升高,IAA含量先降低后升高,这与李田等[40]研究结果相似,而内源IAA含量降低可能与油茶花苞片的脱落有关。油茶花期喷施100 mg·L−1外源GA3使雄蕊内源ABA含量先升高后降低,ZR、GA3含量升高,IAA含量先降低后升高,其中,内源ABA含量先升高后下降,这可能是由于随着油茶花的开放,雄蕊逐渐脱落造成的。由此可知,油茶花期喷施100 mg·L−1的外源GA3可能通过调节油茶花器官的内源激素含量,进而影响油茶坐果率。本研究通过对试验各测定指标进行相关性分析得出,100 mg·L−1的外源GA3可能通过调控油茶雌蕊内源激素ZR、IAA、ABA、GA3间的平衡来降低油茶初萎时期雌蕊的ABA含量,进而提高油茶坐果率,这与前述推论相印证。此外,油茶雄蕊各内源激素与坐果率相关性均不显著,这可能是由于油茶雄蕊在开花后期脱落造成的,而油茶雌雄蕊间内源激素的关系还有待进一步研究。本文仅对外源GA3对油茶开花过程中花器官内源激素与坐果率的影响进行初步研究,而外源GA3对油茶花器官其它内含物质是否存在影响还有待进一步试验和探讨。
-
本研究表明:在试验水平范围内,喷施低浓度外源GA3有利于提高油茶坐果率,提高油茶坐果率的外源GA3最佳喷施浓度为66.69 mg·L−1。油茶花期喷施低浓度的外源GA3使油茶雌蕊内源ABA含量降低,GA3含量升高,ZR含量升高,IAA含量先降低后升高,雄蕊内源ABA含量先升高后降低,ZR、GA3含量升高,IAA含量先降低后升高。通过相关性分析可知,在试验水平范围内,喷施低浓度外源GA3可能通过调节油茶花器官内源ZR、IAA、ABA、GA3含量来影响其ABA含量,进而影响油茶坐果率。
外源GA3对油茶花器官内源激素与坐果率的影响
Effects of Exogenous GA3 on Endogenous Hormones and Fruit Setting Rate of Camellia oleifera
-
摘要:
目的 研究不同浓度外源GA3对油茶开花过程中花器官内源激素及坐果率的影响,分析油茶花器官内源激素与坐果率的相关性,探究促进油茶坐果的最佳外源GA3浓度,为油茶高产栽培和科学管理提供技术依据。 方法 以9年生‘长林4号’油茶为试验材料,采用单因素试验设计,对植株叶面分别喷施100、200、300、400、500 mg·L−1外源GA3,以喷施清水为对照(CK),分析不同浓度外源GA3对油茶花器官内源激素及坐果率的影响。 结果 研究表明:在试验水平范围内,喷施低浓度外源GA3有利于提高油茶坐果率,最佳喷施浓度为66.69 mg·L−1。喷施低浓度的外源GA3使油茶雌蕊内源ABA含量降低,雄蕊ABA含量先升高后降低;雌雄蕊ZR、GA3含量升高,雌雄蕊IAA含量先降低后升高;初萎时期雌蕊ABA与坐果率呈显著负相关(P<0.05)。 结论 在试验水平范围内,提高油茶坐果率的外源GA3最佳喷施浓度为66.69 mg·L−1,喷施低浓度外源GA3可能通过调节油茶花器官内源ZR、IAA、ABA、GA3含量来影响其ABA含量,进而影响油茶坐果率。 Abstract:Objective To study the effect of exogenous GA3 concentrations on endogenous hormones of flower organ and fruit setting rate of Camellia oleifera, to analyze the correlation between endogenous hormones of flower organ and fruit setting rate of C. oleifera and to find the best exogenous GA3 concentration for promoting the fruit setting rate of C. oleifera. Method By using single factor test design, 9-year-old C. oleifera ‘Changlin-4’ was used as test material, 100, 200,300, 400 and 500 mg·L−1 GA3 were sprayed on the leaves of C. oleifera, and fresh water was served as control and sprayed in order to observe the effects of different concentrations of exogenous GA3 on the endogenous hormones and fruit setting rate of C. oleifera. Result Spraying low concentrations of exogenous GA3 in the test level was conducive to improving the fruit setting rate of C. oleifera. The optimal spraying concentration of exogenous GA3 for improving the fruit-tea setting rate was 66.69 mg·L−1. Spraying low concentration of exogenous GA3 reduced the ABA content of the pistil of C. oleifera, increased the content of ZR and GA3 of the pistil of C. oleifera. IAA content of the pistil of C. oleifera decreased at first and then increased. The content of endogenous ABA in the stamens increased at first and then decreased, the content of ZR and GA3 increased, and the content of IAA decreased at first and then increased by spraying low concentration of exogenous GA3. There was a significant negative correlation between pistillary ABA and fruit setting rate in the initial wilting stage (P<0.05). Conclusion In the test level range, the optimal spraying concentration of exogenous GA3 for improving the fruit setting rate of C. oleifera is 66.69 mg·L−1. To control the content of endogenous ABA, ZR, IAA, GA3 of flower organ of C. oleifera and regulate the content of ABA by spraying different concentrations of GA3 stretches out an arm in improving the fruit setting rate of C. oleifera. -
Key words:
- Camellia oleifera
- / GA3
- / fruit setting rate
- / endogenous hormone
-
表 1 外源激素单因素试验设计
Table 1. Test factors level of hormone
试验因素 Test factors 浓度Concentration/(mg·L−1) GA3 100 200 300 400 500 对照CK 0(清水Clear water) 表 2 外源GA3与油茶雌蕊内源激素和坐果率的相关性分析
Table 2. Correlation analysis between exogenous GA3 and pistil endogenous hormones,fruit setting rate of C. oleifera
变量 Variable GA3浓度
GA3 concentrationABA ZR 含苞
Stagnation半开
Half open全开
Fully open初萎
First fall含苞
Stagnation半开
Half open全开
Fully open初萎
First fallGA3浓度
GA3 concentration1.000 −0.979** −0.911* 0.963** −0.772 0.682 0.970** 0.978** 0.896* 坐果率 Fruit setting rate 0.536 −0.600 −0.571 0.370 −0.883* −0.229 0.528 0.519 0.412 表 3 外源GA3与油茶雄蕊内源激素和坐果率的相关性分析
Table 3. Correlation analysis between exogenous GA3 and stamen endogenous hormones, fruit setting rate of C. oleifera
变量 Variable GA3浓度
GA3 concentrationABA ZR 含苞
Stagnation半开
Half open全开
Fully open初萎
First fall含苞
Stagnation半开
Half open全开
Fully open初萎
First fallGA3浓度
GA3 concentration1.000 −0.968** 0.409 0.921** −0.985** 0.849* −0.997** 0.786 0.995** 坐果率 Fruit setting rate 0.536 −0.552 0.023 0.474 −0.431 0.404 −0.563 0.573 0.468 -
[1] 尹丹丹, 李珊珊, 吴 倩, 等. 我国6种主要木本油料作物的研究进展[J]. 植物学报, 2018, 53(1):110-125. doi: 10.11983/CBB17011 [2] Ye Z C, Yougen W U, Zhang J, et al. Anticancer activities of the extract fromoils and cakes of Camellia spp.[J]. Chinese Journal of Tropical Crops, 2017, 38(7): 1216-1223. [3] Zhang L L, Wang Y M, Wu D M, et al. Comparisons of antioxidant activity and total phenolics of Camellia oleifera Abel fruit hull from different regions of China[J]. Journal of Medicinal Plants Research, 2013, 4(14): 1420-1426. [4] 高 超, 袁德义, 袁 军, 等. 花期喷施营养元素及生长调节物质对油茶坐果率的影响[J]. 江西农业大学学报, 2012, 34(3):505-510. doi: 10.3969/j.issn.1000-2286.2012.03.017 [5] 胡玉玲, 姚小华, 任华东, 等. 油茶花发育转录组测序及相关基因表达分析[J]. 林业科学, 2014, 50(9):36-43. [6] 武维华. 植物生理学[M]. 2版. 北京: 科学出版社, 2008. [7] 沈卫平, 蔡 强, 周锋利, 等. 植物激素调控水稻花器官发育分子机制的研究进展[J]. 植物生理学报, 2015, 51(5):593-600. [8] 周 娟. 光皮树大小孢子发育及外源激素对其开花的影响[D]. 长沙: 中南林业科技大学, 2012. [9] 王丽萍, 李志刚, 谭乐和, 等. 植物内源激素研究进展[J]. 安徽农业科学, 2011, 39(4):1912-1914. doi: 10.3969/j.issn.0517-6611.2011.04.010 [10] Shalit A, Rozman A, Goldshmidt A, et al. The flowering hormone florigen functions as a general systemic regulator of growth and termination[J]. Proc Natl Acad Sci USA, 2009, 106(20): 8392-8397. doi: 10.1073/pnas.0810810106 [11] 刘 伦, 王 超, 姚改芳, 等. 外源生长调节剂处理对‘满天红’ב砀山酥梨’后代成花的影响[J]. 南京农业大学学报, 2015, 38(3):381-388. doi: 10.7685/j.issn.1000-2030.2015.03.005 [12] 肖千文, 金银春, 吴开志, 等. 叶面施肥对油橄榄坐果率的影响[J]. 安徽农业科学, 2009, 37(30):14670-14671. [13] 刚明慧, 齐曼·尤努斯, 覃伟铭, 等. 不同植物生长调节剂对库尔勒香梨坐果率、脱萼果率、果实形态及叶绿素含量的影响[J]. 新疆农业大学学报, 2009, 32(6):26-30. doi: 10.3969/j.issn.1007-8614.2009.06.006 [14] 李 胜, 李 唯, 杨德龙, 等. 扁桃花粉活力的测定及其提高坐果率研究[J]. 果树学报, 2004, 21(1):79-81. [15] 聂 琼, 康林峰, 张伟兰. 赤霉素对突尼斯软籽石榴坐果率及品质的影响[J]. 中国果菜, 2017, 37(8):21-23. [16] 孙红梅, 安 晶, 王春夏, 等. 激素和变温处理对百合鳞片扦插繁殖的影响[J]. 林业科学, 2011, 47(3):39-45. doi: 10.11707/j.1001-7488.20110307 [17] 张乐华, 王书胜, 单 文, 等. 基质、激素种类及其浓度对鹿角杜鹃扦插育苗的影响[J]. 林业科学, 2014, 50(3):45-54. [18] 孙颖, 陈显, 刘儒, 等. 不同浓度赤霉素处理对油桐花芽分化的影响[J]. 经济林研究, 2014, 32(1):97-100. doi: 10.3969/j.issn.1003-8981.2014.01.017 [19] 邓惠惠, 白龙强, 于贤昌, 等. 日光温室早春黄瓜叶片喷施赤霉素对生长和生理及产量的影响[J]. 园艺学报, 2016, 43(5):983-990. [20] 朱东煌, 黄日升, 蔡顺其, 等. 植物生长调节剂提高溪蜜柚坐果率的研究与应用综述[J]. 中国热带农业, 2015, 65(4):110-112. doi: 10.3969/j.issn.1673-0658.2015.04.034 [21] 魏志刚, 钱婷婷, 张凯旋, 等. 外源GA_3对白桦成花基因影响的定量PCR分析[J]. 林业科学, 2011, 47(7):187-192. doi: 10.11707/j.1001-7488.20110729 [22] Rademacher W. Growth retardants: effects on gibberellin biosynthesis and other metabolic pathways[J]. Annu Rev Plant Physiol Plant Mol Biol, 2000, 51(51): 501-531. [23] Srikanth A, Schmid M. Regulation of flowering time: all roads lead to Rome[J]. Cellular & Molecular Life Sciences, 2011, 68(12): 2013-2037. [24] 周 宇, 佟兆国, 张开春, 等. 赤霉素在落叶果树生产中的应用[J]. 中国农业科技导报, 2006, 8(2):27-31. doi: 10.3969/j.issn.1008-0864.2006.02.007 [25] 赵莲花, 王富河, 夏玉宝, 等. 4种植物生长调节剂对石榴坐果的影响[J]. 北方果树, 2009, 6(6):6-7. doi: 10.3969/j.issn.1001-5698.2009.06.003 [26] 李建伟. ‘红灯’甜樱桃(Prunus avium L.)果实内源激素年动态及外源激素效应研究[D]. 泰安: 山东农业大学, 2007. [27] 卢 龙. 赤霉素诱导葡萄单性结实与促进坐果分子机制的研究[D]. 北京: 中国农业大学, 2016. [28] 杜 研. 阿克苏富士苹果果形形成机理与调控研究[D]. 乌鲁木齐: 新疆农业大学, 2013. [29] 董胜利, 阿布来克·尼牙孜, 章世奎, 等. 硼酸和赤霉素对杏坐果率的影响[J]. 北方园艺, 2017, 6(1):28-32. [30] 齐飞艳, 彭镇华, 胡 陶, 等. 毛竹花期不同器官内源激素含量的变化[J]. 林业科学研究, 2013, 26(3):332-336. doi: 10.3969/j.issn.1001-1498.2013.03.011 [31] 王 雄, 陈金印, 等. 喷施GA3和2,4-D对留树保鲜脐橙落果和内源激素含量的影响[J]. 园艺学报, 2012, 39(3):539-544. [32] 马庆华, 续九如, 王贵禧, 等. 花期促果措施对冬枣内源激素和坐果率的影响[J]. 中国农学通报, 2010, 26(9):234-238. [33] Pullman G S, Bucalo K. Pine somatic embryogenesis: analyses of seed tissue and medium to improve protocol development[J]. New Forests, 2014, 45(3): 353-377. doi: 10.1007/s11056-014-9407-y [34] 彭向永, 程运河, 李振坚, 等. 蒿柳成花过程中内源激素和多胺含量变化特征[J]. 林业科学, 2018, 54(8):39-47. doi: 10.11707/j.1001-7488.20180805 [35] 张雅倩, 王宇婷, 曾 慧, 等. 不同激素处理对有斑渥丹扦插繁殖的影响[J]. 贵州农业科学, 2018, 46(9):108-111. [36] 吴月燕, 李 波, 朱 平, 等. 植物生长调节剂对西洋杜鹃花期及内源激素的影响[J]. 园艺学报, 2011, 38(8):1565-1571. [37] 李 波. 生长调节剂与光温处理对西洋杜鹃花期及内源激素的调控作用[D]. 杭州: 浙江大学, 2012. [38] 吴建明. 赤霉素诱导甘蔗节间伸长与内源激素变化的关系[J]. 热带作物学报, 2009, 30(10):1452-1457. doi: 10.3969/j.issn.1000-2561.2009.10.012 [39] 陈 显. 外源赤霉素对油茶成花调控机理的研究[D]. 长沙: 中南林业科技大学, 2013. [40] 李 田, 刘海河, 张彦萍, 等. 外源赤霉素对厚皮甜瓜坐果节位叶片早衰与内源激素含量的影响[J]. 农药学学报, 2018, 20(5):618-624. -




 下载:
下载: