-
联合国政府间气候变化专门委员会(IPCC)第五次评估报告明确指出,人类活动所产生的温室气体排放导致全球范围内温度升高,显著改变了自然生态系统的碳水循环格局,导致如干旱、强降雨等极端气候事件发生的强度和频率不断增加[1-3]。有关研究表明,极端干旱事件会对生态系统功能产生明显的负面影响,并且随着干旱的持续,可能会对生态系统造成更加严重且无法恢复的破坏,并可能导致区域生态系统碳储量减少,反过来又显著影响全球气候变化的趋势和强度[4-6],已成为人类社会面临的紧迫挑战之一[7-9]。因此,准确评估极端干旱事件对生态系统碳源汇功能的影响将为提高人类适应气候变化的能力提供重要的科学依据。
目前,关于极端干旱对生态系统碳固持和碳排放影响的研究已取得了一定成果。生态系统碳的吸收与释放会在极端干旱事件的影响下而降低[10],这种响应模式与极端干旱事件所引起的降水量减少、土壤水分胁迫及土壤碳氮组成变化等密切相关[11],而土壤水分条件及理化性质的改变又会显著影响植物的生长和有机质的分解[12],进而对生态系统总初级生产力(GPP)和生态系统呼吸(Re)产生影响。郝彦宾等[13]通过对比干旱年和总降水量接近该地区多年平均降水量年份的GPP和Re,发现干旱胁迫降低了生态系统的GPP和Re。此外,极端干旱下水分条件的改变会影响土壤中酶的活性发生变化[14-15],而土壤酶在有机质的分解和土壤养分的有效性中起着关键作用[16],并可能会影响酚类物质向生物可利用有机碳的转变[17-18],进一步影响土壤向大气中CO2的排放。然而,目前有关生态系统碳收支对极端干旱事件酶学响应机制的定量研究还相对较少。
作为世界上分布最广泛的湿地类型,泥炭地储存着全球约三分之一的土壤碳,在全球碳循环和气候变化研究中起着非常重要的作用[19-21]。已有研究表明,泥炭地尤其是高原泥炭地很容易受到环境因子的影响而导致其碳源汇功能发生改变,而极端干旱事件能够显著改变生态系统的水热条件,影响植物生理状态和土壤微生物活动,进而破坏泥炭地生态系统原有的碳收支平衡[22-23]。目前,很多极端干旱的研究大部分集中在草原及荒漠生态系统,而有关高原泥炭地的极端干旱控制实验研究还鲜有报道[24-28]。因此,定量研究极端干旱下高原泥炭地碳通量的变化及其对环境的响应机制具有重要意义。基于此,本研究以对气候变化非常敏感的若尔盖高原泥炭地为研究对象,在野外模拟极端干旱事件,研究高原泥炭地生态系统CO2通量对极端干旱事件的响应机理,为更好地了解和评估极端气候对陆地碳循环的影响,提高我国减缓和适应气候变化的能力提供重要的科学依据。
-
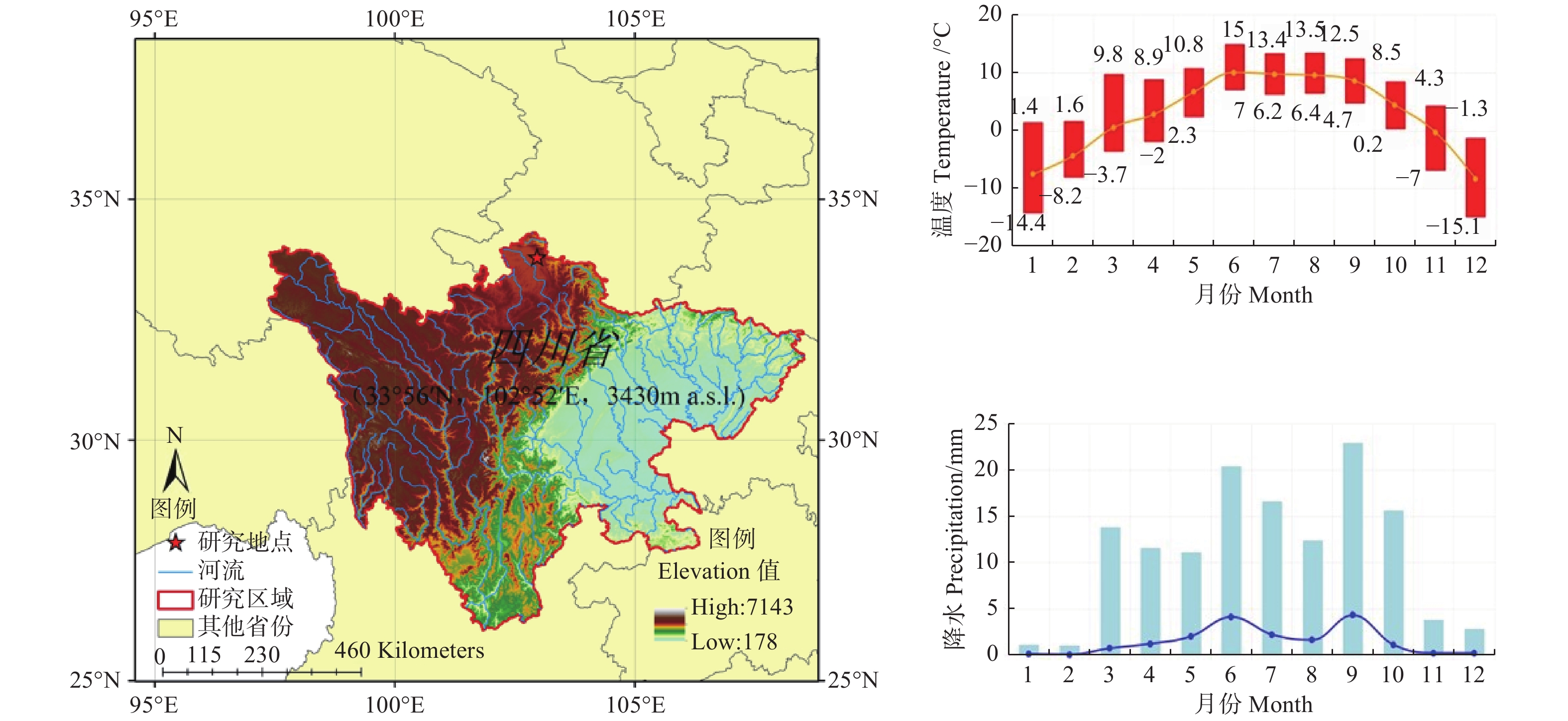
若尔盖高原泥炭地位于青藏高原东北隅地区(图1),地处四川、甘肃两省交界处,涵盖了若尔盖、久治、玛曲、红原等县约16 000 km2的区域,是世界上面积最大的高原泥炭沼泽,泥炭厚度达4.0~5.3 m[29]。研究区属寒温带湿润气候区,分别受冷空气和季风控制,四季不分,霜冻期极长,年平均气温−0.7~1.1℃,最热月(7月)和最冷月(1月)平均气温分别为11℃和−10.5℃(图1),气温年较差为21.5℃,历年极端最高气温24.6℃,极端最低气温−33.7℃。年均降水量650~750 mm,主要集中在6—9月(图1),相对湿度78%[30]。本研究样地(33.79° N,102.95° E)位于若尔盖县行政管辖内,海拔3 430 m,低位草本沼泽植被是区域内典型植被类型,主要包含西藏嵩草(Kobresia tibetica,Kükenthal)、木里苔草(Carex muliensis)、蕨麻(Potentilla ansrina)、花葶驴蹄草(Caltha scaposa)、矮火绒草(Leontopodium nanum)等[31]。植株地上和地下生物量分别为(473.65±50.65)和(2845.92±225.35)g·m−2。广泛发育了以高原泥炭土为主的土壤类型[32]。
-
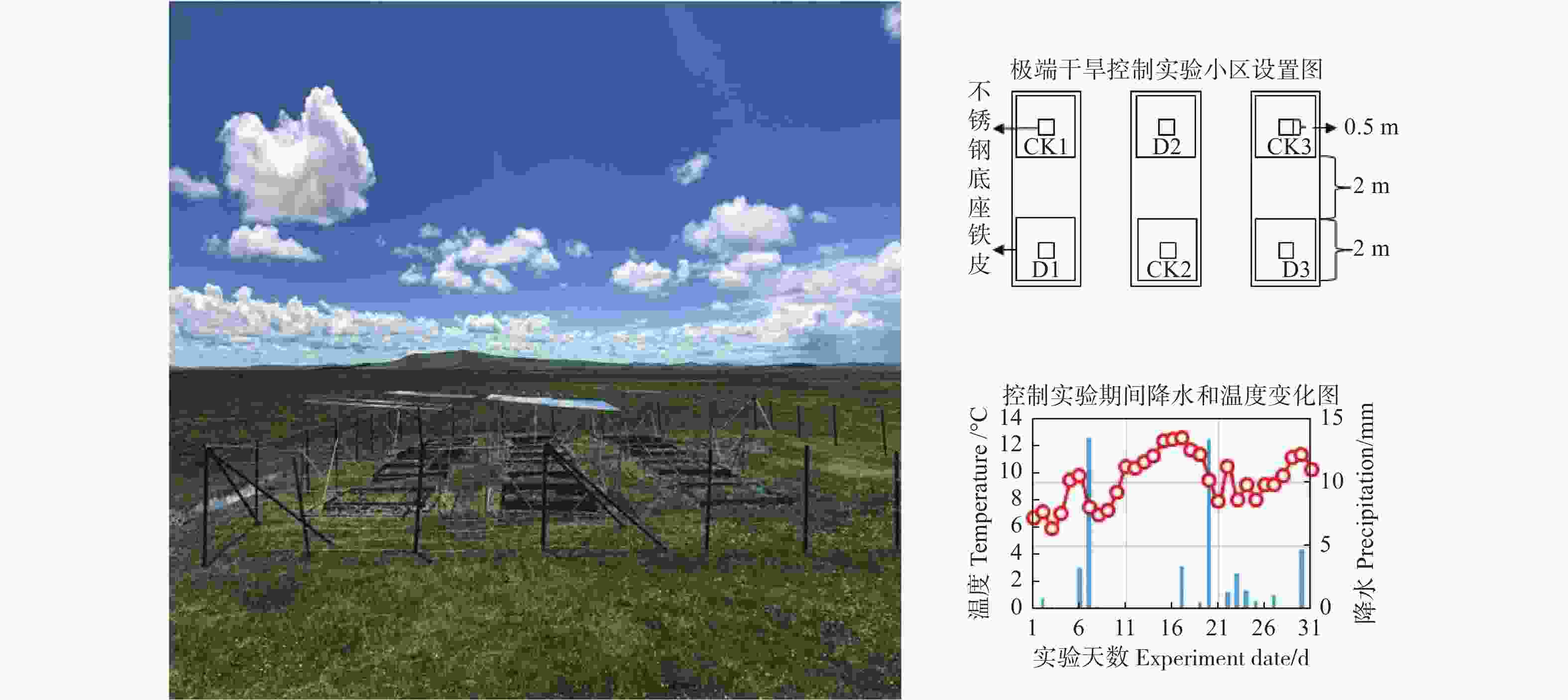
本研究样地于2014年建立,面积为400 m2,样地内禁止放牧(图2)。根据当地50年的降雨统计数据,在植物生长盛期模拟极端干旱事件,定义日降雨量≥3 mm为生态有效降雨[33],设置极端干旱事件即无生态有效降水持续期为32 d[34]。2015年控制实验期间若尔盖辖区内共有13次降水事件,日降水量为0.2~12.6 mm,其中,生态有效降水事件(≥3 mm)天数为5 d。试验期间降水量共计44.4 mm,即对照处理小区降水量为44.4 mm,而极端干旱处理小区降水量为0 mm(图2)。实验期间日均最高温度、日均最低温度以及总平均温度分别为13.5、6.4、10.2℃ (图2)。控制实验设极端干旱(D)和对照(CK)2个处理,各3个重复,每个重复小区面积为2 m×2 m,小区周围埋入铁皮以防止土壤水分的横向流动(图2)。将不锈钢底座(50 cm×50 cm×20 cm)插入小区中央地下10 cm,每次测试前将底座凹槽注满水,进行水封,保证测量密闭性。极端干旱处理小区采用镁铝合金遮雨棚(长×宽×高=2.5 m×2.5 m×1.8 m)进行极端干旱处理,遮雨棚材料透光率>90%,对照处理小区在无遮雨条件下进行气体监测。
-
通量观测采用静态箱法,利用便携式温室气体分析仪(UGGA,Los Gatos Research,USA)测定CO2通量,数据采集频率为1 Hz。极端干旱控制时间为2015年7月17日 至2015年8月15日,选择晴朗天气的上午9点至11点进行测量。用自制的长宽高均为50 cm的透明静态箱与快速温室气体分析仪相连接。箱子顶部中央有2个直径2 cm的小圆孔,分为进气孔和出气孔2部分,使用橡胶塞保证箱体密闭性,其中,进气孔橡胶塞插入TZS-5X温度计用于测量箱内空气温度(Ta),并通过20 m长的进气管连通到温室气体分析仪,气体完成分析后经过另一根20 m长的出气管返回到静态箱中。静态箱顶部设有直径10 cm的2个小风扇,以保证箱内气体的快速流动与混合均匀。每个小区分别在透明和遮光状态下持续封闭测量2 min,然后对2 min内的测量数据进行计算,求得光合和呼吸状态下的CO2通量。
-
测量CO2通量过程中使用TZS-5X温度计同步监测样点5 、10、20 cm 土壤温度(Ts),使用TDR300土壤水分仪测定土壤含水量(SWC)。采用土钻多点取样混合的方法取样,土壤全碳(TC)使用元素分析仪法测定[35],土壤全氮(TN)使用半微量凯氏法测定[36],土壤有机碳(SOC)采用重铬酸钾氧化-外加热法测定[37]。土壤酶活性在CO2通量变化中具有重要作用,木糖苷酶、葡萄糖苷酶和纤维素酶对土壤中的纤维素和半纤维素具有分解作用,可提供微生物活动所需的碳源,而多酚氧化酶和过氧化物酶则参与了腐殖质的形成,为微生物活动提供所需的养分[38]。因此,本文对以上几种酶进行了测定,以探讨酶活性对CO2通量变化的影响。具体测定方法如下:采用改进的荧光96孔微孔板酶检测技术测定木糖苷酶(XYL)、β-葡萄糖苷酶(BG)、α-葡萄糖苷酶(AG)及纤维素外切酶(CB)活性;同时采用改进的紫外分光光度计法对土壤多酚氧化酶(PPO)和过氧化物酶(PEO)活性进行测定,样品酶活性使用每小时每克的基质(μmol)转化率来表示[39](表1)。
表 1 土壤酶活性测定及应用的底物名称
Table 1. Names of substrates used in the determination of soil enzyme activity
酶种类 Enzyme 底物名称 Substrate 木糖苷酶 β-Xylosidase 4-MUB-B-D-xylopyranoside β-葡萄糖苷酶 β-Glucosidase 4-MUB-β-D-glucopyranoside α-葡萄糖苷酶 α-Glucosidase 4-MUB-α-D-glucopyranoside 纤维素外切酶 β-D-cellubiosidase 4-MUB- β -D-cellobioside 氧化还原酶 Polyphenol oxidase L-DOPA 过氧化物酶 Peroxidase L-DOPA and H2O2 -
本研究中,温室气体通量主要采用以下公式计算:
${F_c} = \frac{{\partial C'}}{{\partial t}} \times \frac{M}{{{V_0}}} \times \frac{P}{{{P_0}}} \times \frac{{{T_0}}}{{{T_0} + t}} \times \frac{H}{{100}} \times 3\;600$
(1) 式中:Fc为气体通量(mg·(m2·h)−1);əC’/ət为气体浓度线性回归直线斜率;M和V0分别为气体摩尔质量(g·mol−1)和标准摩尔体积22.4 L·mol−1;P/P0是测量大气压与标准大气压的比值;T0和
t分别为 绝对温度和箱内实测空气温度的平均值(℃);H为静态箱高度(cm)。 净生态系统二氧化碳交换(NEE)、Re和GPP之间的关系可表示为:
$GPP=Re-NEE$
(2) NEE正值代表碳源,负值代表碳汇,正负值仅代表CO2通量的方向,不代表大小。 本研究使用ArcGIS 10.5对样地地理位置进行标注,底图采用四川省DEM高程影像和全国的矢量图相叠加(Esri,USA)。使用Origin软件对观测期间CO2通量进行折线图和柱状图的绘制(Origin 2017,USA)。使用SPSS软件对每天观测的CO2通量进行显著性分析,并对整个观测期间的CO2通量和水热因子进行重复测量方差分析,测量结果分别标示在图表中(SPSS,Chicago,IL,USA)[40]。使用R语言进行散点图相关矩阵和相关系数矩阵图的绘制(R v3.6.1,USA)[41]。
-
极端干旱实验期间,若尔盖高原泥炭地CO2通量(NEE、Re和GPP)变化见图3。极端干旱处理和对照处理下,NEE在整个控制实验期间均表现为先降低后略微升高的趋势,泥炭地NEE的最大值和最小值分别出现在7月17日和8月5日,Re的变化趋势与NEE相反,在8月5日达到最大,在实验初期的7月17日最小;极端干旱处理下的GPP与NEE变化趋势相同,在对照处理下则表现为随时间延长逐渐降低的趋势。通过对同一测定日期不同处理下的NEE、Re和GPP进行方差分析,发现极端干旱处理下Re和GPP均略低于对照处理,而NEE高于对照处理,其中,7月24日的NEE、Re和GPP差异均达到统计学显著水平(P<0.05)。对整个控制实验期间NEE、Re和GPP进行重复测量方差分析,结果显示,极端干旱使若尔盖泥炭地的NEE、Re和GPP分别显著降低了17.44%、20.56%、18.70%(P<0.05),若尔盖高原泥炭地生态系统在极端干旱处理和对照处理下都表现为碳汇。通过对2处理下不同深度 Ts和SWC测量结果进行重复测量方差分析(表2),结果表明:极端干旱显著升高了深层土壤(20 cm)的温度(Ts)(P<0.05)(表3),但对表层土壤(5、10 cm)的Ts影响不显著,且极端干旱使5、10、20 cm的SWC均显著降低(P<0.05)(表3)。
表 2 研究样地的重复测量方差分析结果
Table 2. Analysis of variance of repeated measurements of study plots
项目 Item NEE Re GPP Ts5 Ts10 Ts20 SWC5 SWC10 SWC20 区组 0.38 0.97 0.58 0.76 0.31 0.46 0.17 0.58 0.15 日期 <0.01** <0.01** 0.015* <0.01** 0.14 <0.01** <0.01** 0.07 <0.01** 干旱处理 0.048* 0.036* 0.038* 0.75 0.11 0.02* 0.03* 0.04* 0.048* 日期×干旱处理 0.26 0.67 0.18 0.72 0.23 0.99 0.44 0.29 0.78 日期×区组 0.02* 0.34 0.04* 0.63 0.70 0.63 0.03* 0.10 0.02* 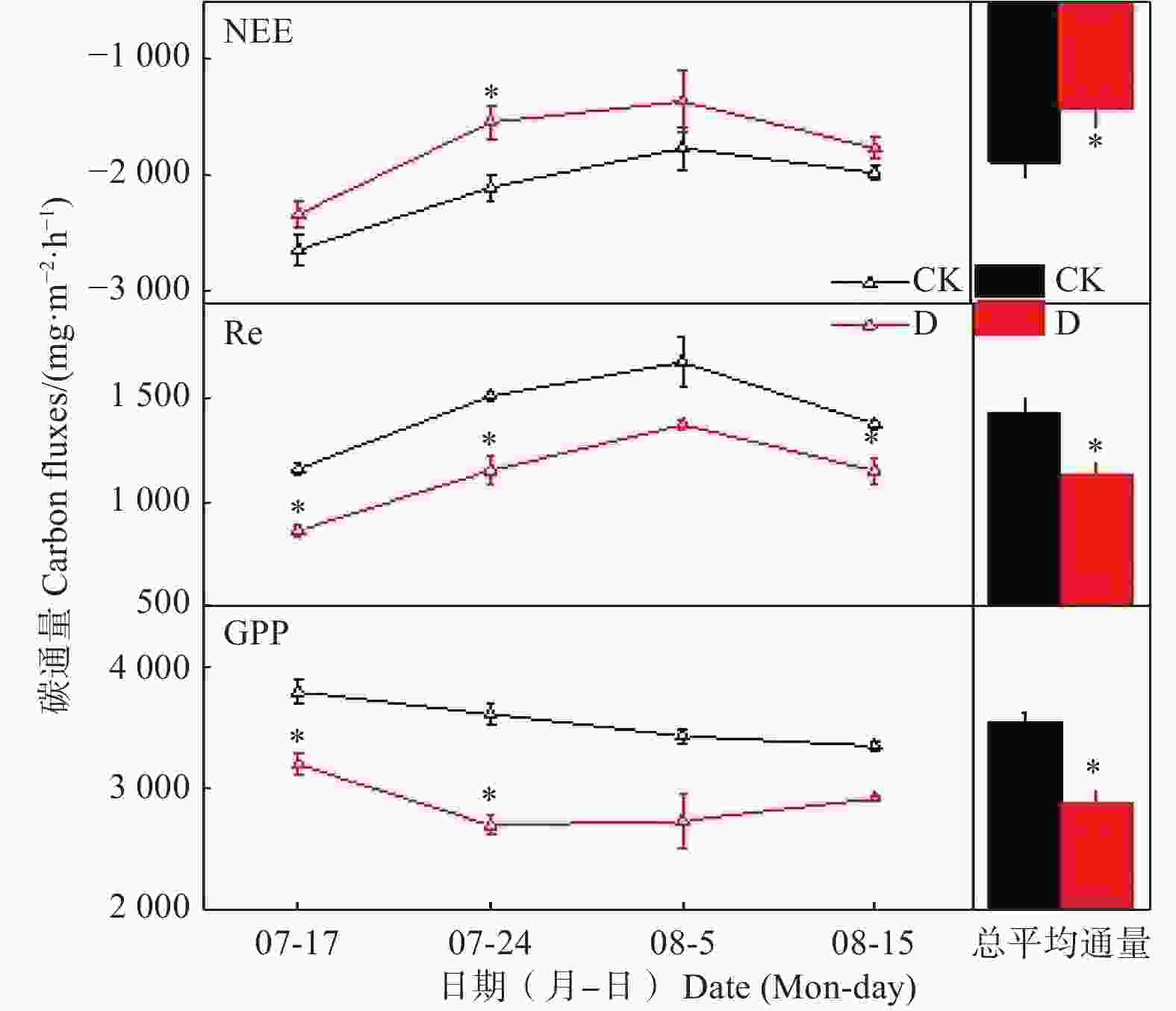
图 3 2015年极端干旱对高原泥炭地生态系统CO2通量的影响
Figure 3. Effects of extreme drought on CO2 fluxes of alpine peatland in 2015
表 3 研究样地的土壤环境水热因子
Table 3. Study on soil environmental water and heat factors of sample plots
处理 Treatment Ts5/℃ Ts10/℃ Ts20/℃ SWC5/% SWC10/% SWC20/% CK 16.17±0.66 13.33±0.27 12.30±0.26 67.75±1.97 64.60±1.11 59.70±1.16 D 15.83±0.59 14.53±0.37 13.15±0.29* 62.68±1.98* 56.65±0.81* 55.18±1.21* 注:*:0.05水平上显著相关。
Note:*: significant correlated at 0.05 level. -
图4为对照和极端干旱处理下环境水热因子和若尔盖泥炭地CO2通量的相关性拟合结果,在对照处理下,NEE与Ta呈显著负相关,相关系数为0.58(P<0.05),随着Ta增加,CO2吸收减少,而极端干旱处理下NEE与Ta相关性并不显著(P>0.05),由此说明极端干旱降低了NEE与Ta的相关性。对照处理和极端干旱处理下,Re与Ta均呈现显著正相关,相关系数分别为0.62(P<0.05)和0.78(P<0.01),即随着Ta增加,CO2排放显著增加,而极端干旱处理下Re与Ta的相关系数高于对照处理,说明极端干旱增强了Re与Ta之间的相关性。以上可以得出,极端干旱降低了CO2吸收过程对空气温度的相关性,而增强了CO2的排放过程对空气温度的相关性。
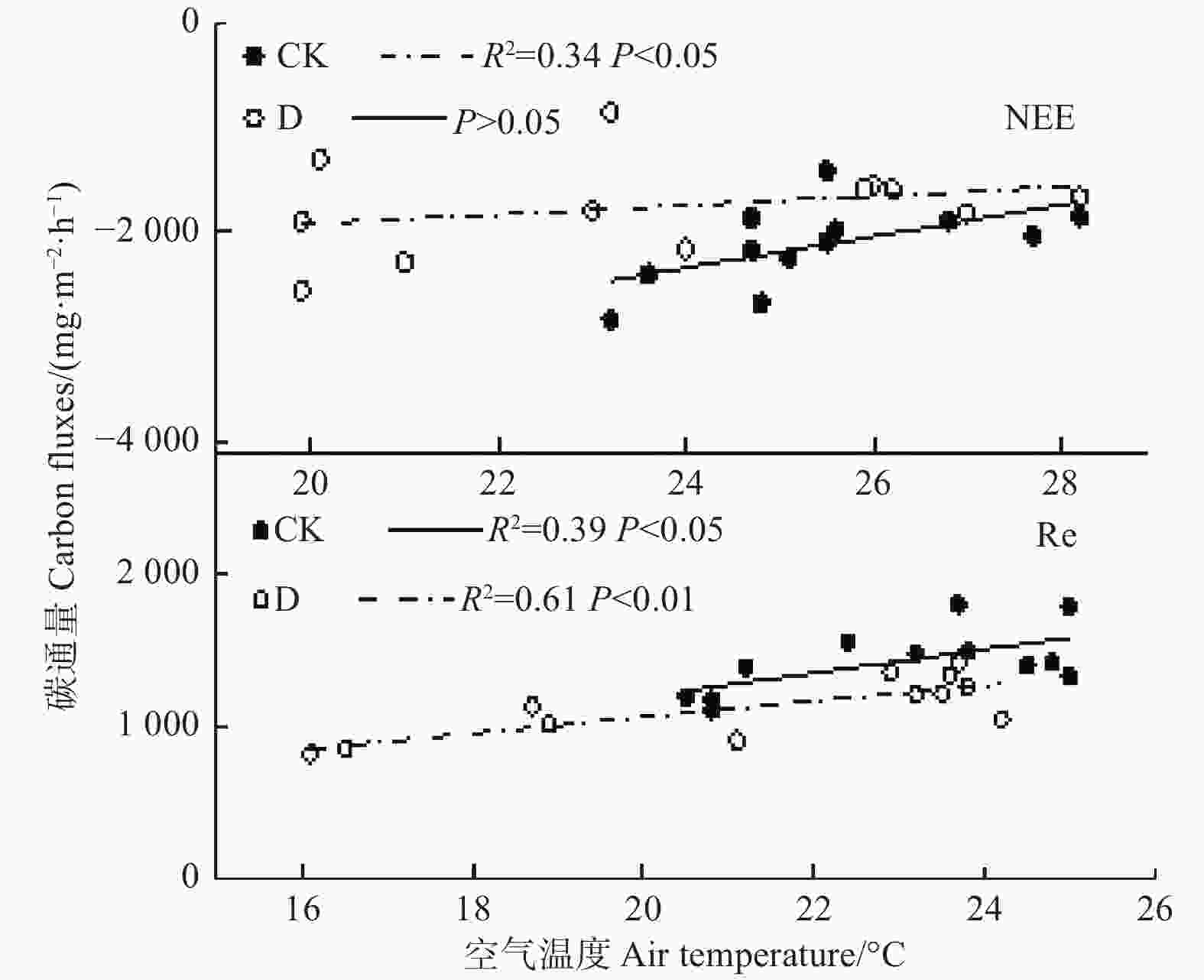
图 4 不同处理下CO2通量与空气温度的关系
Figure 4. Relationships of CO2 fluxes with air temperature in different treatments
不同深度土壤温度和水分对CO2通量的影响见图5所示,在极端干旱和对照处理下,NEE与Ts呈正相关,其相关性随土壤深度增加而不断增强,NEE与对照处理下20 cm 深Ts的相关性最显著,相关系数为0.60(P<0.05)。在极端干旱和对照处理下,NEE与SWC呈负相关,其相关性随着土壤深度增加而逐渐减小,且NEE与对照和极端干旱处理下的5 cm SWC呈显著负相关,相关系数分别为−0.64(P<0.05)和−0.67(P<0.05)。在极端干旱和对照处理下,Re与Ts呈正相关,且深层相关性低于浅层,仅对照处理下5 cm和10 cm Ts与Re呈显著正相关,相关系数分别为0.71(P<0.05)和0.67(P<0.05),而极端干旱处理下并不显著,极端干旱降低了Re与Ts的相关性。极端干旱和对照处理下,Re与SWC均呈不显著负相关,并且随着深度增加,相关性降低。无论是极端干旱处理还是对照处理下,GPP与5 cm Ts均呈正相关,但随着土壤深度增加,相关关系发生了较大转变,在20 cm深度时,GPP与Ts呈负相关;对照处理下,GPP与不同深度的SWC均呈显著正相关,且随着土壤深度增加相关性逐渐降低,相关系数按土壤深度增加依次为0.70、0.61、0.60(P<0.05)。对照处理下GPP与SWC的相关性高于极端干旱处理,极端干旱处理降低了GPP与SWC的相关性。
-
选取极端干旱事件结束日期的通量观测数据与土壤碳转化相关的酶活性数据进行相关性分析,结果(图6)表明:NEE与BG、AG活性显著正相关,相关系数分别为0.80、0.85(P<0.05),与其他土壤酶活性相关不显著;Re与XYL、CB活性显著负相关,相关系数分别为−0.83、−0.84(P<0.05),与其他土壤酶活性相关不显著;NEE和Re与土壤酶活性的相关性并不相同,具体表现为随着土壤酶活性增强,净生态系统碳交换量有所增加,而生态系统呼吸作用逐渐降低。GPP与BG显著负相关,相关系数为−0.82(P<0.05)。PPO和PEO活性与NEE、Re和GPP均不显著相关。通过对极端干旱事件结束日期的土壤碳氮含量进一步分析得出:极端干旱显著降低了土壤中的SOC(P<0.05),而TC略有下降,TN则略有升高,但这种影响并不显著(P>0.05)(表4)。
表 4 不同处理下研究样地的土壤TC、TN、SOC和C/N含量
Table 4. Specific content of total carbon, total nitrogen, organic carbon and C/N in soil of study plot under different treatments
处理 Treatment TC(g/kg) SOC/(g·kg−1) TN/(g·kg−1) C/N CK 295.27±12.99 275.85±12.80 20.95±0.41 14.10±0.87 D 288.55±20.56 267.75±13.23* 21.13±0.63 13.65±0.63 注:*表示显著相关(P<0.05)。
Note:*: significant correlated at 0.05 level. -
植被在演化进程中达到了与环境动态的平衡,而极端干旱显著改变了植被所赖以生存的环境,影响植物生长及生态系统组成,并进一步影响区域乃至全球生态系统的碳源汇功能[42]。有研究表明,极端干旱事件会显著降低植被CO2固定效率,减少生态系统碳累积能力,甚至使生态系统发生由碳汇到碳源的转变[13, 43-44]。上述研究大都集中在干旱、半干旱草原[24-25],本研究则选取了对气候变化非常敏感的高原泥炭沼泽,并且在探究环境水热因子对于CO2通量变化的影响基础上进一步探究了高原泥炭地CO2通量对极端干旱响应的土壤酶活性调控机理。本研究发现,极端干旱显著降低了若尔盖高原泥炭地生态系统的总初级生产力和碳汇能力(图3)。这是因为植物气孔控制着植被与大气之间的CO2和水的交换,水分胁迫迫使植物气孔关闭,植被光合作用所需的CO2和水分进出减少,导致植物叶片的净光合速率降低,生态系统碳汇功能降低[6, 45-46]。Ciais等[7]发现,2003年欧洲经历的极端干旱使生态系统碳源强度达到该生态系统此前4年所固定碳的总和。本研究进一步发现,极端干旱显著降低了若尔盖高原泥炭地生态系统呼吸(图3)。土壤中有机质含量会因水分胁迫而显著改变,使植物根系呼吸所需的养分条件发生改变,进而对植物根系呼吸产生影响,并且微生物活动与土壤碳氮等有机质含量密切相关,对土壤水分变化十分敏感,土壤中微生物和酶的活性在极端干旱的影响下受到限制,从而减弱生态系统呼吸[47-49]。
环境胁迫在短期内增加生态系统的代谢消耗用以维持自身碳的动态平衡,是促使生态系统碳收支变化的重要影响因子[50-52]。土壤含水量是表征土壤对植被根系以及土壤微生物供水能力的指标,土壤含水量过低,植物生理活动受阻,会导致植被光合能力以及呼吸强度下降[53]。本文研究发现,极端干旱条件使泥炭地生态系统呼吸显著降低(图4、5),这与伏玉玲等的研究结果一致[54]。伏玉玲等认为,极端干旱通过影响植物活性和微生物活动显著影响生态系统自养和异养呼吸,植被光合、呼吸作用的酶活性以及地下微生物各类酶反应过程受到抑制,从而减弱了温度变化对生态系统呼吸的影响[54]。Reichestein等研究也发现,极端干旱下导致的水分胁迫打破了泥炭土壤正常水分波动规律,导致物种多样性和植物碳、氮分布发生改变,影响了植物的生理功能,降低了植物呼吸作用的温度敏感性[55]。
本研究通过对比2种处理下NEE、Re与不同深度土壤含水量的相关性,发现NEE、Re与深层土壤含水量的相关性均小于浅层土壤(图5)。这可能是由于植被根系主要分布在土壤浅层区域,而NEE主要受到植被光合作用调控,随着土壤深度增加,根系与土壤水分含量逐渐减少,促使NEE与深层土壤含水量的相关性降低[53, 56-57],并且随着含水量的减少,微生物和酶所需的水分条件也发生变化,导致土壤呼吸减弱,Re与深层土壤含水量的相关性降低[58]。本研究还发现,NEE与深层土壤温度的相关性大于浅层,而Re的响应则与之相反,随着深度增加,相关性逐渐降低(图5)。NEE与2种葡萄糖苷酶显著相关(图6),随着深度增加,土壤温度和含水量均逐渐减少,微生物和酶活动所需的温度及水分条件变化导致呼吸产生的CO2减少[59-62]。Re与纤维素外切酶和木糖苷酶显著相关,随着深层土壤温度降低,纤维素外切酶活性也随之降低[63],进一步导致Re与深层土壤温度的相关性降低。由于土壤异养呼吸关键过程或步骤的调控是通过微生物产生的特定酶来实现的,其种类和数量与微生物群落结构和活性密切相关,并受到水分有效性的影响[64]。因此,未来的研究工作将进一步从“植物土壤界面的碳通量-土壤酶-微生物”综合系统的不同层次入手,通过土壤酶、微生物结构、功能及活性深入研究高原泥炭地生态系统碳收支对极端干旱事件的响应机制。
-
(1)极端干旱显著降低了若尔盖高原泥炭地生态系统NEE、Re和GPP,导致泥炭地生态系统在极端干旱状态下固碳能力减弱。
(2)对照处理下Re与空气温度和土壤温度呈显著正相关,极端干旱增强了Re对空气温度和土壤温度的相关性。
(3)极端干旱处理和对照处理下,NEE与土壤温度的相关性随着土壤深度的增加而增大,Re变化趋势与NEE相反,并且,随着土壤深度增加,NEE、Re与土壤含水量的相关性逐渐降低。
(4)NEE与BG、AG活性显著相关,Re与XYL、CB活性显著相关。
高原泥炭地CO2通量对极端干旱的响应机理研究
Response Mechanism of CO2 Flux to Extreme Drought on An Plateau Peatland
-
摘要:
目的 探明极端干旱事件对高原泥炭地二氧化碳(CO2)通量的影响机制。 方法 以若尔盖高原泥炭地为研究对象,采用野外控制实验和静态箱法,利用快速温室气体分析仪测定极端干旱下高原泥炭地CO2通量变化,并结合环境因子及土壤酶活性的测定,分析其变化机制。 结果 (1)极端干旱显著降低了若尔盖高原泥炭地生态系统的净生态系统CO2交换(NEE)、生态系统呼吸(Re)和总初级生产力(GPP)(P<0.05)。(2)高原泥炭地生态系统Re对于空气温度和土壤温度的相关性在极端干旱的影响下增强。(3)NEE与β-葡萄糖苷酶(BG)、α-葡萄糖苷酶(AG)显著相关(P<0.05),Re与木糖苷酶(XYL)、纤维素外切酶(CB)显著相关(P<0.05),GPP与BG显著相关(P<0.05)。 结论 高原泥炭地生态系统CO2通量在极端干旱的影响下将显著降低,其对环境因子的相关性也有所增强; NEE和Re变化分别受到不同土壤酶活性的影响,随着土壤深度的增加,与不同深度土壤温度相关性表现出相反的变化趋势。 Abstract:Objective To study the mechanism of extreme drought on carbon dioxide (CO2) flux on plateau peatland. Method The field control experiment and static box method were used to measure the CO2 flux change on Zoige plateau peatland under extreme drought by using the fast greenhouse gas analyzer, and the change mechanism was analyzed combining with the measurement of environmental factors and soil enzyme activity. Result (1) Extreme drought significantly reduced the net ecosystem CO2 exchange (NEE), ecosystem respiration (Re) and gross primary productivity (GPP) of peatland ecosystem on Zoige plateau (P<0.05). (2) The sensitivity of Re to air temperature and soil temperature decreased under the influence of extreme drought. (3) The NEE was significantly correlated with β-glucosidase (BG), α-glucosidase (P<0.05), the Re was significantly correlated with β-xylosidase, β-D-cellobiosidase (P<0.05), and the GPP was significantly correlated with BG (P<0.05). Conclusion Under extreme drought, the CO2 flux of plateau peatland ecosystem will decrease significantly, and its sensitivity to environmental factors will also be weakened. The changes of NEE and Re are affected by different soil enzyme activities. With the increase of soil depth, the correlation of soil temperature with NEE and Re shows an opposite trend. -
Key words:
- Extreme drought
- / peatland
- / CO2 flux
- / soil enzyme activity
-
表 1 土壤酶活性测定及应用的底物名称
Table 1. Names of substrates used in the determination of soil enzyme activity
酶种类 Enzyme 底物名称 Substrate 木糖苷酶 β-Xylosidase 4-MUB-B-D-xylopyranoside β-葡萄糖苷酶 β-Glucosidase 4-MUB-β-D-glucopyranoside α-葡萄糖苷酶 α-Glucosidase 4-MUB-α-D-glucopyranoside 纤维素外切酶 β-D-cellubiosidase 4-MUB- β -D-cellobioside 氧化还原酶 Polyphenol oxidase L-DOPA 过氧化物酶 Peroxidase L-DOPA and H2O2 表 2 研究样地的重复测量方差分析结果
Table 2. Analysis of variance of repeated measurements of study plots
项目 Item NEE Re GPP Ts5 Ts10 Ts20 SWC5 SWC10 SWC20 区组 0.38 0.97 0.58 0.76 0.31 0.46 0.17 0.58 0.15 日期 <0.01** <0.01** 0.015* <0.01** 0.14 <0.01** <0.01** 0.07 <0.01** 干旱处理 0.048* 0.036* 0.038* 0.75 0.11 0.02* 0.03* 0.04* 0.048* 日期×干旱处理 0.26 0.67 0.18 0.72 0.23 0.99 0.44 0.29 0.78 日期×区组 0.02* 0.34 0.04* 0.63 0.70 0.63 0.03* 0.10 0.02* 表 3 研究样地的土壤环境水热因子
Table 3. Study on soil environmental water and heat factors of sample plots
处理 Treatment Ts5/℃ Ts10/℃ Ts20/℃ SWC5/% SWC10/% SWC20/% CK 16.17±0.66 13.33±0.27 12.30±0.26 67.75±1.97 64.60±1.11 59.70±1.16 D 15.83±0.59 14.53±0.37 13.15±0.29* 62.68±1.98* 56.65±0.81* 55.18±1.21* 注:*:0.05水平上显著相关。
Note:*: significant correlated at 0.05 level.表 4 不同处理下研究样地的土壤TC、TN、SOC和C/N含量
Table 4. Specific content of total carbon, total nitrogen, organic carbon and C/N in soil of study plot under different treatments
处理 Treatment TC(g/kg) SOC/(g·kg−1) TN/(g·kg−1) C/N CK 295.27±12.99 275.85±12.80 20.95±0.41 14.10±0.87 D 288.55±20.56 267.75±13.23* 21.13±0.63 13.65±0.63 注:*表示显著相关(P<0.05)。
Note:*: significant correlated at 0.05 level. -
[1] Richard W, Katz B G, Brown. Extreme events in a changing climate: Variability is more important than averages[J]. Climatic Change, 1992, 21(3): 289-302. doi: 10.1007/BF00139728 [2] Milagros A, Jiménez, Jaksic F M,<italic> et al</italic>. Extreme climatic events change the dynamics and invasibility of semi-arid annual plant communities[J]. Ecology letters, 2011, 14(12): 1227-1235. doi: 10.1111/j.1461-0248.2011.01693.x [3] IPCC. Climate Change 2013: the Physical Science Basis: Working Group I Contribution to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change [R]. Cambridge University Press, 2014, pp: 159-254 . [4] Easterling D R, Meehl G A, Parmesan C,<italic> et al</italic>. Climate extremes: observations, modeling, and impacts[J]. Science, 2000, 289(5487): 2068-2074. doi: 10.1126/science.289.5487.2068 [5] Smith M D. The ecological role of climate extremes: current understanding and future prospects[J]. Journal of Ecology, 2011, 99(3): 651-655. doi: 10.1111/j.1365-2745.2011.01833.x [6] Reichstein M, Bahn M, Ciais P,<italic> et al</italic>. Climate extremes and the carbon cycle[J]. Nature, 2013, 500(7462): 287-295. doi: 10.1038/nature12350 [7] Ciais P, Reichstein M, Viovy N, et al. Europe-wide reduction in primary productivity caused by the heat and drought in 2003[J]. Nature, 437(7058): 529-533 . [8] Zeng N, Yoon J H, Marengo J A,<italic> et al</italic>. Causes and impacts of the 2005 Amazon drought[J]. Environmental Research Letters, 2008, 3(1): 014002. [9] Lewis S L,Brando P M,Phillips O L,<italic> et al</italic>. The 2010 Amazon Drought[J]. Science, 2011, 331(6017): 554. [10] Schwalm C R, Williams C A, Schaefer K,<italic> et al</italic>. Assimilation exceeds respiration sensitivity to drought: A fluxnet synthesis[J]. Global Change Biology, 2010, 16(2): 657-670. doi: 10.1111/j.1365-2486.2009.01991.x [11] 王 丹, 吕瑜良, 徐 丽, 等. 水分和温度对若尔盖湿地和草甸土壤碳矿化的影响[J]. 生态学报, 2013, 33(20):6436-6443. [12] Van S O, Veldkamp E, KiHler M,<italic> et al</italic>. Spatial and temporal effects of drought on soil CO<sub>2</sub> efflux in a cacao agroforestry system in Sulawesi, Indonesia[J]. Biogeosciences, 2010, 7(4): 1223-1235. [13] 郝彦宾, 王艳芬, 崔骁勇. 干旱胁迫降低了内蒙古羊草草原的碳累积[J]. 植物生态学报, 2010, 34(8):898-906. doi: 10.3773/j.issn.1005-264x.2010.08.002 [14] Cox P M, Betts R A,<italic> et al</italic>. Acceleration of global warming due to carbon-cycle feedbacks in a coupled climate model[J]. Nature, 2000, 408(6809): 184-187. [15] Harper C W, Blair J M, Fay P A,<italic> et al</italic>. Increased rainfall variability and reduced rainfall amount decreases soil CO<sub>2</sub> flux in a grassland ecosystem[J]. Global Change Biology, 2005, 11(2): 322 − 334. [16] Meng C, Tian D, Zeng H,<italic> et al</italic>. Global meta-analysis on the responses of soil extracellular enzyme activities to warming[J]. Science of The Total Environment, 2019, 705: 135992. [17] Freeman C, Evans C D, Monteith D T,<italic> et al</italic>. Export of organic carbon from peat soils[J]. Nature, 2011a, 412: 785-785. [18] Freeman C, Ostle N J, Kang H. An enzymic 'latch' on a global carbon store[J]. Nature, 2001b, 409(6817): 149. [19] Mcnamara N P, Plant T, Oakley S,<italic> et al</italic>. Gully hotspot contribution to landscape methane (CH<sub>4</sub>) and carbon dioxide (CO<sub>2</sub>) fluxes in a northern peatland[J]. Science of the Total Environment, 2008, 404(2-3): 354-360. doi: 10.1016/j.scitotenv.2008.03.015 [20] Turetsky M R, Wieder R K, Vitt D H. Boreal peatland C fluxes under varying permafrost regimes[J]. Soil Biology & Biochemistry, 2002, 34(7): 907-912. [21] Wright W J, Comas X, Slater L D, et al. Autonomous ground penetrating radar (GPR) measurements for exploring biogenic gas dynamics of peat soils in a northern peatland[A]. AGU Fall Metting Abstract [C]. 2011: B21A248 . [22] Hao B Y, Cui X Y, Wang Y F,<italic> et al</italic>. Predominance of Precipitation and Temperature Controls on Ecosystem CO<sub>2</sub> Exchange in Zoige Alpine Wetlands of Southwest China[J]. Wetlands, 2011, 31(2): 413-422. doi: 10.1007/s13157-011-0151-1 [23] 张 远, 郝彦宾, 崔丽娟, 等. 极端干旱对若尔盖高原泥炭地生态系统CO<sub>2</sub>通量的影响[J]. 中国科学院大学学报, 2017, 34(4):462-470. [24] 李明峰, 董云社, 齐玉春, 等. 极端干旱对温带草地生态系统CO<sub>2</sub>、CH<sub>4</sub>、N<sub>2</sub>O通量特征的影响[J]. 资源科学, 2004 , 26(3):89-95. doi: 10.3321/j.issn:1007-7588.2004.03.014 [25] 李新荣, 谭会娟, 何明珠, 等. 阿拉善高原灌木种的丰富度和多度格局对环境因子变化的响应: 极端干旱荒漠地区灌木多样性保育的前提[J]. 中国科学. D辑: 地球科学, 2009 , 39(4):114-125. [26] 张继义, 赵哈林. 短期极端干旱事件干扰下退化沙质草地群落抵抗力稳定性的测度与比较[J]. 生态学报, 2009, 30(20):5456-5465. [27] 木巴热克•阿尤普, 陈亚宁, 郝兴明, 等. 极端干旱环境下的胡杨木质部水力特征[J]. 生态学报, 2012 , 32(9):2748-2758. [28] 刘殿君, 吴 波, 李永华, 等. 极端干旱区增雨加速泡泡刺群落土壤碳排放[J]. 生态学报, 2012, 32(17):5396-5404. [29] 高 燕. 地下水位和土壤温度对若尔盖泥炭地CH4排放的影响[D]. 西北农林科技大学, 2016, 219(4): 56-61. [30] 王智平, 段 毅, 杨居荣, 等. 青藏高原若尔盖沼泽潜在CH<sub>4</sub>氧化与生成的分布特征[J]. 植物生态学报, 2003 , 27(6):786-791. doi: 10.3321/j.issn:1005-264X.2003.06.009 [31] 周文昌, 索郎夺尔基, 崔丽娟, 等. 围栏禁牧与放牧对若尔盖高原泥炭地CO<sub>2</sub>和CH<sub>4</sub>排放的影响[J]. 生态环境学报, 2015, 24(2):183-189. [32] 王长科, 吕宪国, 蔡祖聪, 等. 若尔盖高原草甸土与泥炭土氧化CH<sub>4</sub>研究[J]. 冰川冻土, 2007 , 29(4):584-588. doi: 10.3969/j.issn.1000-0240.2007.04.011 [33] Hao Y B, Kang X M, Cui X Y,<italic> et al</italic>. Verification of a threshold concept of ecologically effective precipitation pulse: From plant individuals to ecosystem[J]. Ecological Informatics, 2012, 12: 23-30. doi: 10.1016/j.ecoinf.2012.07.006 [34] Anke J, Juergen K, Michael, et al. Climate extremes initiate ecosystem-regulating functions while maintaining productivity[J]. Journal of Ecology, 99(3): 689-702 [35] 王巧环, 任玉芬, 孟 龄, 等. 元素分析仪同时测定土壤中全氮和有机碳[J]. 分析试验室, 2013, 32(10):41-45. [36] 戴宏林, 吴小骏. 用凯氏定氮法测定植物干样品中的氮含量[J]. 江苏农学院学报, 1995, 16(3):70. [37] 王瑞永, 刘莎莎, 王成章, 等. 不同海拔高度高寒草地土壤理化指标分析[J]. 草地学报, 2009, 17(5):621-628. [38] 陈 伟, 杨 洋, 崔亚茹, 等. 低氮对苦荞苗期土壤碳转化酶活性的影响[J]. 干旱地区农业研究, 2019, 37(4):132-138. [39] 何建州, 杨金燕, 田丽燕, 等. 用紫外-荧光微孔板酶检测技术测定两种土壤的酶活性[J]. 四川农业大学学报, 2012 , 30(2):60-64. [40] Warton D I, Wright I J, Falster D S,<italic> et al</italic>. Bivariate line-fitting methods for allometry[J]. Biological Reviews, 2006, 81(2): 259-291. doi: 10.1017/S1464793106007007 [41] Sinsabaugh R L, Lauber C L, Weintraub M N,<italic> et al</italic>. Stoichiometry of soil enzyme activity at global scale[J]. Ecology Letters, 2008, 11(11): 1252-1264. [42] Piao S L, Zhang X P, Chen A P,<italic> et al</italic>. The impacts of climate extremes on the terrestrial carbon cycle: A review[J]. Science China(Earth Sciences), 2019, 62(10): 1551-1563. doi: 10.1007/s11430-018-9363-5 [43] Rajan, Nithya, Ma as,<italic> et al</italic>. Extreme drought effects on carbon dynamics of a semiarid pasture[J]. Agronomy Journal, 2013, 105(6): 1749-1760. doi: 10.2134/agronj2013.0112 [44] Zhang L, Guo H D, Jia G S,<italic> et al</italic>. Net ecosystem productivity of temperate grasslands in northern China: An upscaling study[J]. Agricultural and Forest Meteorology, 2014, 184: 71-81. doi: 10.1016/j.agrformet.2013.09.004 [45] Rytter R C. Water use efficiency, carbon isotope discrimination and biomass production of two sugar beet varieties under well watered and dry conditions[J]. Journal of Agronomy and Crop Science, 2005, 191(6): 426-438. [46] Niu S, Wu M, Han Y,<italic> et al</italic>. Water-mediated responses of ecosystem carbon fluxes to climatic change in a temperate steppe[J]. New Phytologist, 2008, 177(1): 209-219. [47] Shi Z, Thomey M L, Mowll W,<italic> et al</italic>. Differential effects of extreme drought on production and respiration: synthesis and modeling analysis[J]. Biogeosciences, 2014, 11(3): 621-633. doi: 10.5194/bg-11-621-2014 [48] Frank H, Ottmar J. Experimental summer drought reduces soil CO<sub>2</sub> effluxes and DOC leaching in Swiss grassland soils along an elevational gradient[J]. Biogeochemistry, 2014, 117(2-3): 395-412. doi: 10.1007/s10533-013-9881-x [49] 康晓明, 崔丽娟, 郝彦宾, 等. 极端干旱对内蒙古羊草草原水分平衡的影响[J]. 应用与环境生物学报, 2015, 21(4):700-709. [50] 张法伟, 刘安花, 李英年, 等. 青藏高原高寒湿地生态系统CO<sub>2</sub>通量[J]. 生态学报, 2008 , 28(2):453-462. doi: 10.3321/j.issn:1000-0933.2008.02.001 [51] 李英年, 孙晓敏, 赵新全, 等. 青藏高原金露梅灌丛草甸净生态系统CO<sub>2</sub>交换量的季节变异及其环境控制机制[J]. 中国科学. D辑: 地球科学, 2006, 36(S1):163-173. [52] 李 博, 赵 斌, 彭容豪. 陆地生态系统生态学原理(中文版)[M]. 北京: 高等教育出版社 , 2005: 334-339. [53] Van D M M K, Dolman A J P, Ciais T,<italic> et al</italic>. Drought and ecosystem carbon cycling[J]. Agricultural and Forest Meteorology, 2011, 151(7): 765-773. [54] 伏玉玲, 于贵瑞, 王艳芬, 等. 水分胁迫对内蒙古羊草草原生态系统光合和呼吸作用的影响[J]. 中国科学. D辑: 地球科学, 2006, 36(S1):183-193. [55] Reichstein M, Tenhunen J D, Roupsard O,<italic> et al</italic>. Severe drought effects on ecosystem CO<sub>2</sub> and H<sub>2</sub>O fluxes at three Mediterranean evergreen sites: revision of current hypotheses[J]. Global Change Biology, 2002, 8(10): 999-1017. doi: 10.1046/j.1365-2486.2002.00530.x [56] Jonathan L, Pitchford, Wu C J,<italic> et al</italic>. Climate Change Effects on Hydrology and Ecology of Wetlands in the Mid-Atlantic Highlands[J]. Wetlands, 2012, 32(1): 21-33. doi: 10.1007/s13157-011-0259-3 [57] 于昊天, 黄时豪, 刘亚军, 等. 鄱阳湖湿地土壤酶及微生物生物量的剖面分布特征[J]. 环境科学研究, 2017, 30(11):1715-1722. [58] Lefi E, Medrano H, Cifre J. Water uptake dynamics, photosynthesis and water use efficiency in field‐grown Medicago arborea and medicago citrina under prolonged mediterranean drought conditions[J]. Annals of Applied Biology, 2004, 144(3): 299-307. doi: 10.1111/j.1744-7348.2004.tb00345.x [59] Creamer C A, De Menezes A B, Krull E S,<italic> et al</italic>. Microbial community structure mediates response of soil C decomposition to litter addition and warming[J]. Soil Biology and Biochemistry, 2015, 80: 175-188. doi: 10.1016/j.soilbio.2014.10.008 [60] 秦纪洪, 张文宣, 王 琴, 等. 亚高山森林土壤酶活性的温度敏感性特征[J]. 土壤学报, 2013, 50(6):1241-1245. [61] 潘新丽, 林 波, 刘 庆. 模拟增温对川西亚高山人工林土壤有机碳含量和土壤呼吸的影响[J]. 应用生态学报, 2008 , 19(8):1637-1643. [62] Trasar-Cepeda C, Gil-Sotres F, Leirós M C. Thermodynamic parameters of enzymes in grassland soils from Galicia, NW Spain[J]. Soil Biology and Biochemistry, 2006, 39(1): 311-319. [63] 韩 玮, 孙晨曦, 苏 敬. 模拟增温和酸雨对水稻土酶活性及温度敏感性的影响[J]. 生态与农村环境学报, 2017, 33(12):1117-1124. doi: 10.11934/j.issn.1673-4831.2017.12.008 [64] Bardgett R D, Freeman C, Ostle N J. Microbial contributions to climate change through carbon cycle feedbacks[J]. ISME Journal, 2008, 2: 805-814. doi: 10.1038/ismej.2008.58 -





 下载:
下载: