-
大多数访花昆虫对某些特定颜色、气味会表现出偏好,在寻找蜜源时,常以此作为识别、选择信号。昆虫气味物质大致包括2大类:昆虫自身产生的气味物质和植物产生的气味物质。通常,植物产生的气味物质多作为昆虫觅食、产卵的信号物质,而昆虫产生的气味物质则多被用于种群内部交流[1]。
蝶类是重要的访花传粉昆虫,在访花觅食过程中,远距离定位蜜源植物主要依靠花朵颜色提供的各种视觉信号,而嗅觉、触觉信号被认为在蜜源植物的近距离识别中发挥作用[2-4]。尤其是花色对蝴蝶搜寻蜜源相当重要,然而不同蝶种对颜色和气味的趋性有较大的区别[5-6]。目前关于蝴蝶成虫复眼的结构和功能方面已经进行过广泛的研究[7-11]。白天活动的蝴蝶光感受器多样化,不同蝶种光谱感受器种类不同[12-13]。白带锯蛱蝶(Cethosia cyane)与金斑蝶(Danaus chrysippus)在访花过程中偏爱红色、橙色和黄色[6]。而达摩凤蝶(Papilio demoleus)偏爱紫色和蓝色[14]。暗脉粉蝶(Pieris napi)在觅食时主要利用视觉[15]。除了视觉,蝴蝶还具有发达的嗅觉系统[16-17],花的气味则作为嗅觉信号影响蝴蝶的访花行为[18-19],如荨麻蛱蝶(Aglais urticae)、黄蛱蝶(Polygonia calbum)、枯叶蛱蝶(Kallima inachus)和红锯蛱蝶(Cethosia bibis)主要利用嗅觉信号进行觅食及搜寻寄主植物[6, 20-21]。
不仅如此,蝶类在求偶过程中,也需通过视觉、嗅觉和触觉等信号来进行配偶的识别[22]。其中有些蝶类以视觉为主[23-24],有些以嗅觉[25-26]或触觉为主[27-28],有的蝶类综合利用视觉和嗅觉信号[17]进行配偶识别。目前已有研究表明,暴露在蝴蝶翅膀腹面的色彩信号有助于躲避捕食者[29-30],物种识别[31],而隐藏在翅膀背面的色彩信号,包括紫外线信号,则在寻找配偶中起作用[32-33],如菜粉蝶(Pierisrapae)雌蝶对背部翅膀颜色较深的雄性表现出明显的偏好,这些雄蝶的翅膀背面颜色在长波较亮,紫外波长较暗,并且含有大量的蝶呤色素[34]。当把蝶呤从雄性翅膀上去除后,雄蝶的求偶成功率降低[35]。而在近距离求偶时,蝴蝶利用虫体挥发物提供的嗅觉信号对配偶进行精准识别,这种嗅觉信号,被认为是对蝶类视觉信号的补充[36]。成虫虫体挥发物可以确保雌雄蝶交流具有高度的私密性[20]。如雄性信息素MSP在偏瞳蔽眼蝶(Bicyclus anynana)的配偶选择中起关键作用[37-38]。
鹤顶粉蝶(Hebomoia glaucippe)又名赤顶粉蝶、红襟粉蝶,隶属于鳞翅目(Lepidoptera)粉蝶科(Pieridae)襟粉蝶族(Anthocharidini)鹤顶粉蝶属(Hebomoia)[39]。国内分布于福建、广东、海南、四川、云南、香港等地[40]。不同蝶种觅食求偶过程中的视觉嗅觉信号识别机制不同,有关鹤顶粉蝶觅食求偶过程中视觉嗅觉利用系统研究尚未见报道。本研究通过对鹤顶粉蝶觅食求偶过程中识别行为的观察,探索鹤顶粉蝶在觅食和求偶过程中的视觉和嗅觉选择,以期了解鹤顶粉蝶觅食求偶过程中对视觉嗅觉信息利用机制,为开展鹤顶粉蝶的规模化人工繁育提供理论和实用依据,为其它蝴蝶的研究提供参考。本研究亦为进一步探索蝴蝶进化过程中视觉嗅觉利用提供基础资料。
-
试验在中国林业科学研究院高原林业研究所禄丰试验站进行,试验站海拔高度为1 382 m。该地区年平均气温16.2 ℃,年均降水量930~950 mm,年无霜期322 d。行为学观察测试在网室(9 m × 5 m × 5 m)进行,常温网室通风透光良好,并且光照均匀。
-
从云南省元江县昆明中林昆虫观赏有限公司获得鹤顶粉蝶蛹,带回室内挂置于自然变化光周期、温度25±2 ℃、湿度50%~70%条件下。蛹羽化后,取新羽化健康的蝴蝶成虫进行试验。将待试蝴蝶(羽化2 d用于觅食试验,羽化5 d用于求偶试验)放于网室内让其适应24 h。试验前放入少量清水供成虫吸食补充水分,求偶过程中假花上喷洒10%蜂蜜水供蝴蝶取食。
-
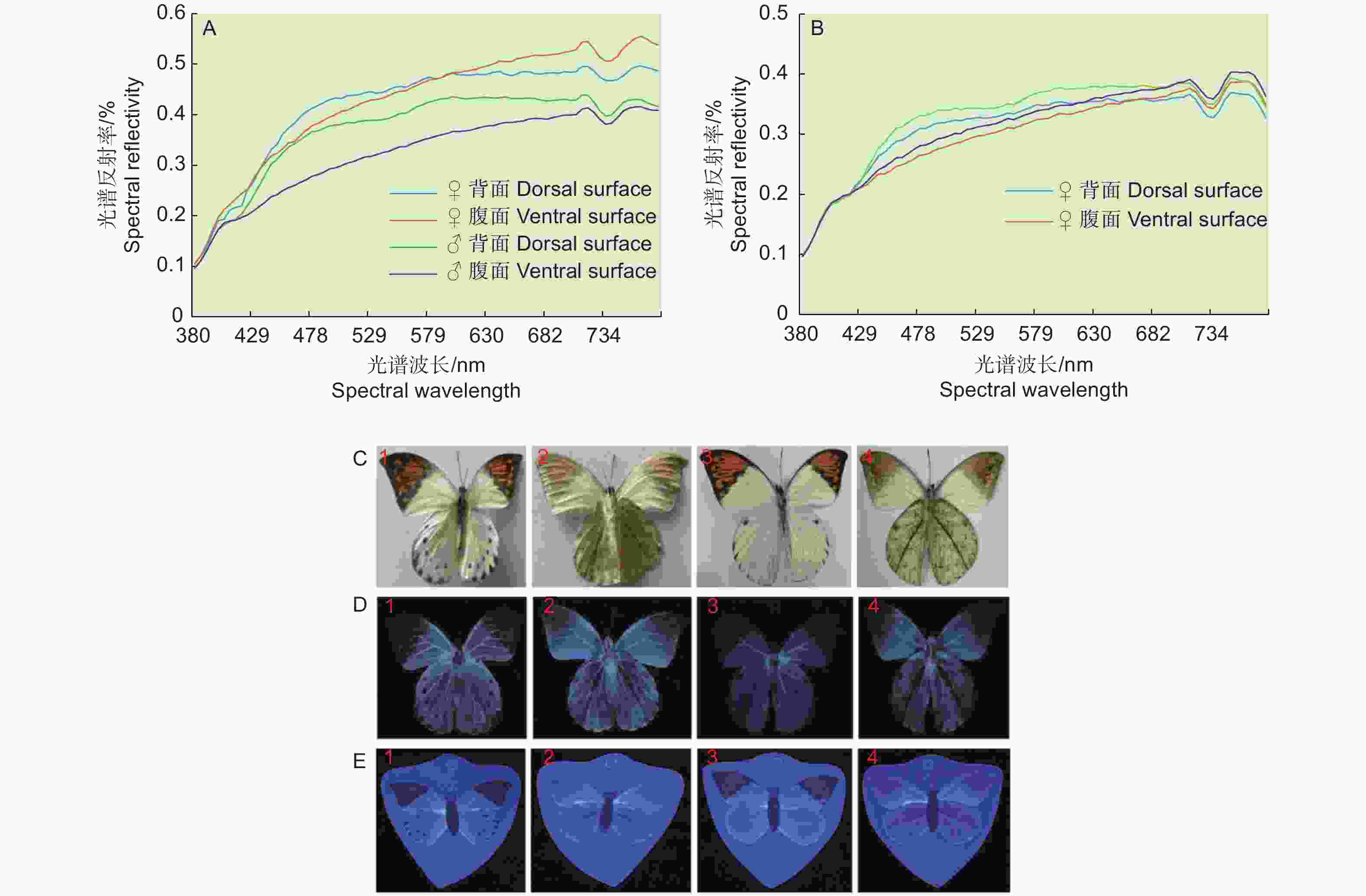
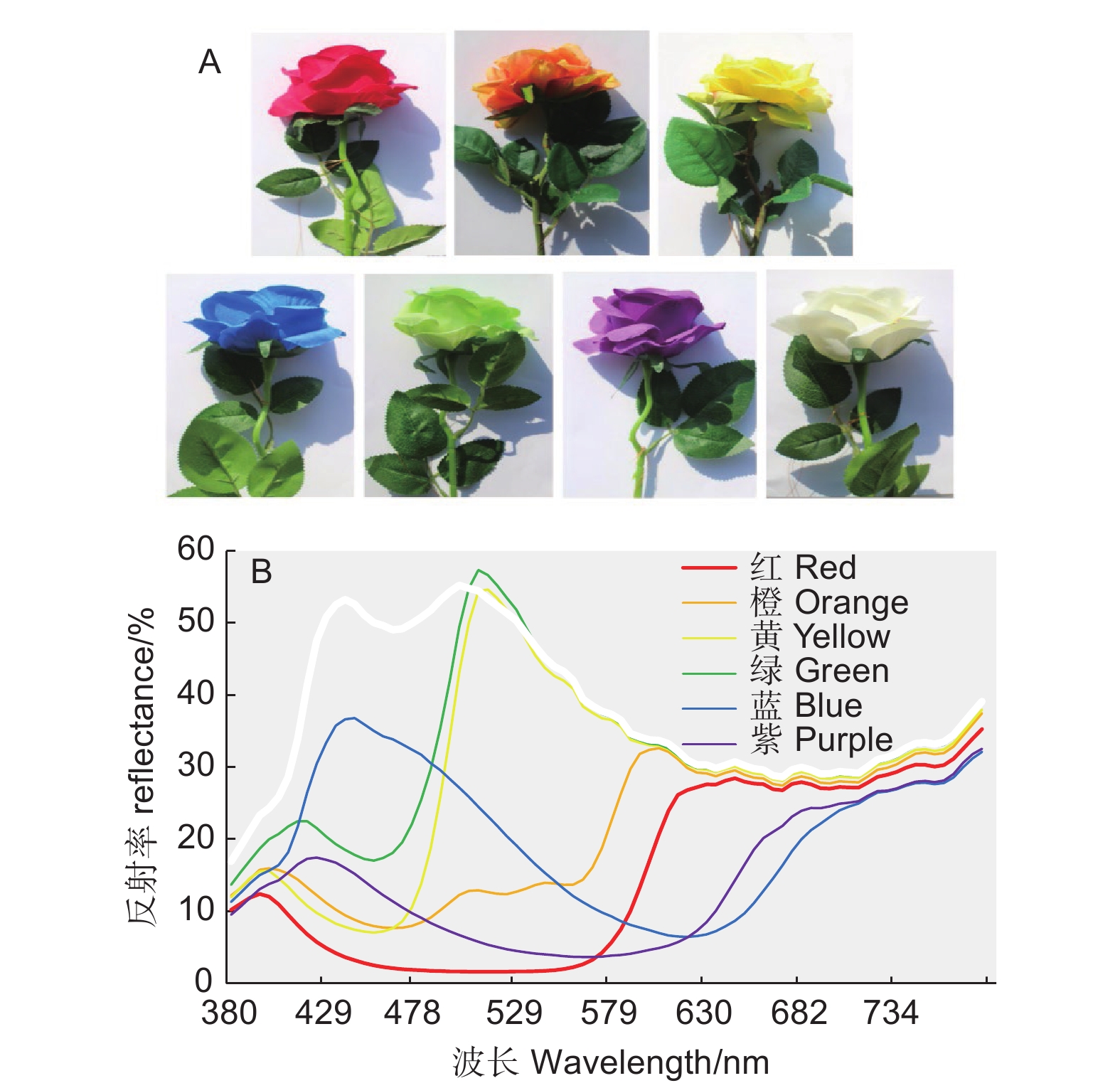
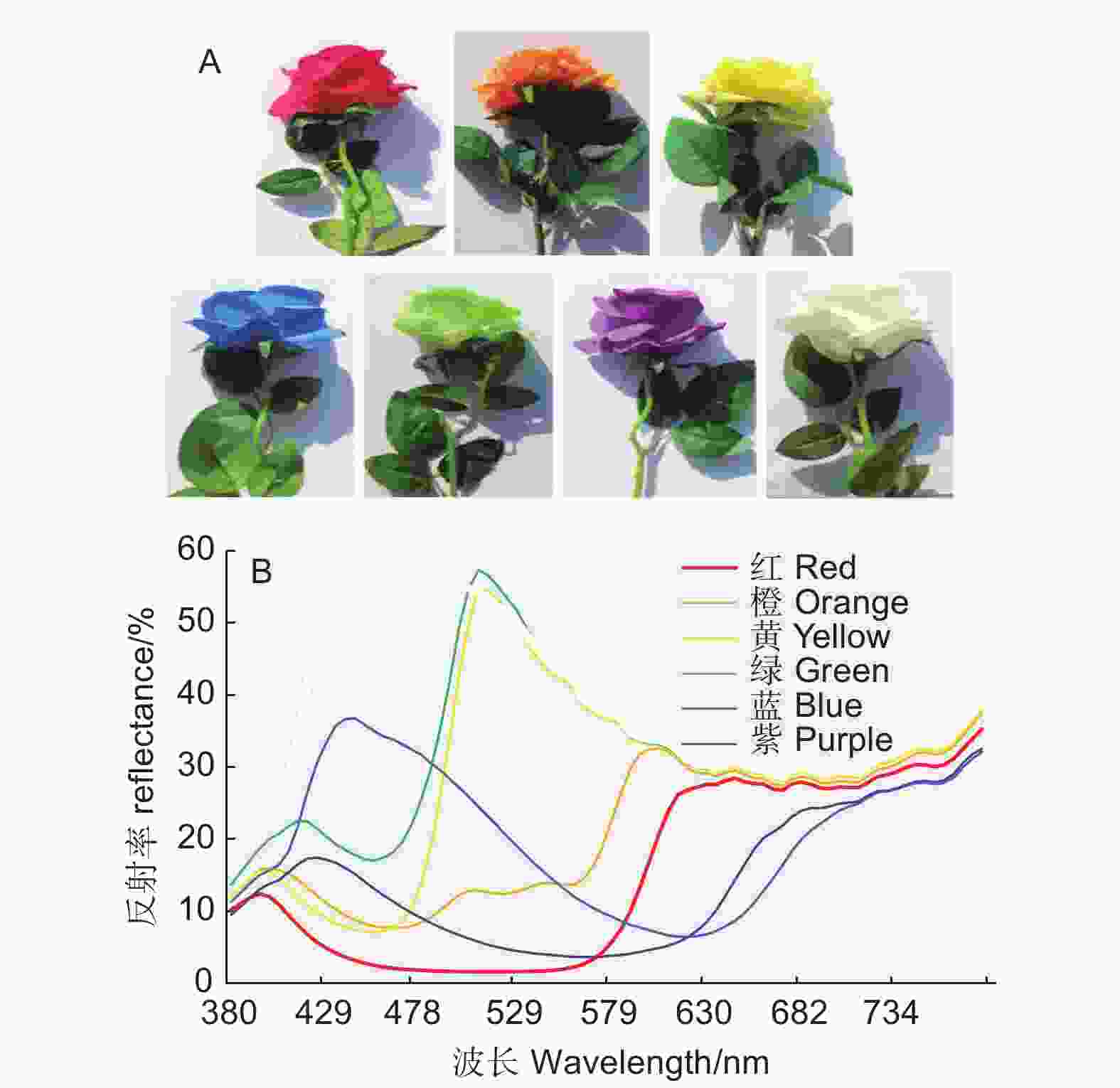
选择花冠为红色、橙色、黄色、绿色、蓝色、紫色和白色7种颜色的假花(图1A)。用于成虫访花测试。假花由棉布制成,除颜色不同外,形状基本相同。测试前,利用光谱仪(USB200+,Ocean Optics,Inc.,USA)测量7种颜色假花的反射光谱(图1B),用于校准蝴蝶访花行为的颜色趋性。
-
以槐花蜂蜜(桂林周氏顺发食品有限公司)为原料,用纯净水稀释配制为10%浓度的蜂蜜水。
-
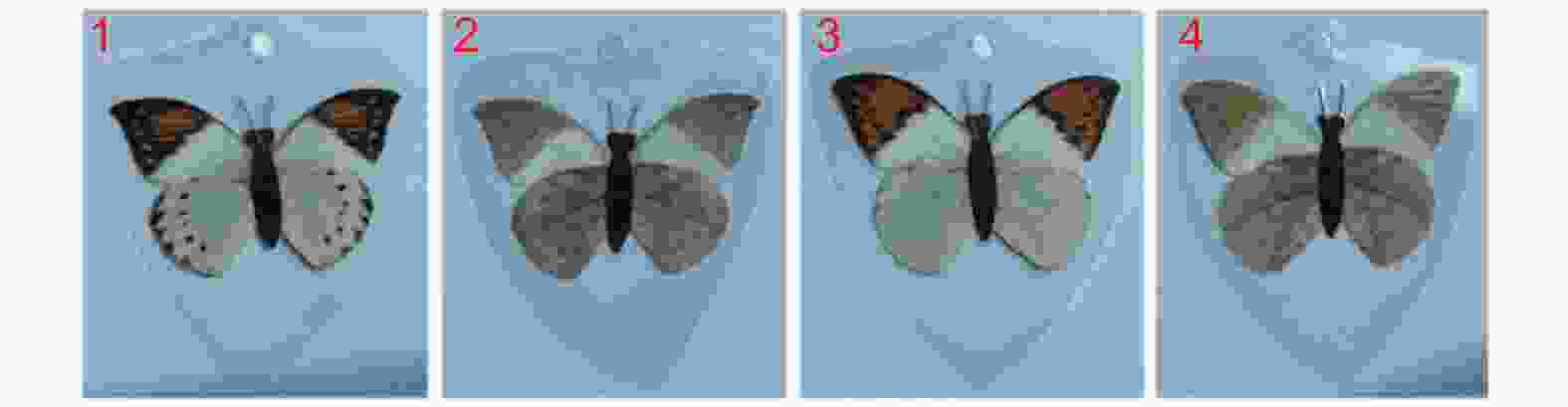
将黑色木条作为蝴蝶成虫躯体,将鹤顶粉蝶成虫翅膀粘于木条躯体后,粘上黑色假触角(类似毛刷),再用PVC塑料塑封制成仿真塑封蝴蝶模型(图2)。按照前翅、后翅、翅正面、翅反面组合制成4种塑封模型:1、♀翅膀背面;2、♀翅膀腹面;3、♂翅膀背面;4、♂翅膀腹面,用于蝴蝶求偶过程中模型访问行为测试。
-
将红、橙、黄、蓝、紫、绿和白色7种颜色的假花分别按相同颜色各自集中在一起[4],花朵距地面约0.5~0.7 m,相邻花束间距为80 cm。在天气晴朗、光照充足,温度18~30 ℃,相对湿度60%~80%的环境条件下,放入鹤顶粉蝶雌雄蝶各10只,观察时间为9:30—11:30,14:30—17:30,7种颜色的假花位置每1 h按顺时针方向移动1次,避免位置带来的误差。每隔40 min在7种假花花束上分别补喷清水10 mL。重复试验3 d(下同)。
取食:鹤顶粉蝶停落在假花上,探食后伸出喙管并开始吸食假花上的蜂蜜水或清水,记录为取食。
访花次数:从鹤顶粉蝶着落在花朵上伸出喙管探食,至鹤顶粉蝶卷曲喙管飞离花朵记为1次访花。若同1只蝴蝶飞离后,在不超过1 m距离内又折回到同1花朵上,则仅记为1次访花。
-
为了明确气味对鹤顶粉蝶的诱集效果,试验将假花花冠去掉,剩下花枝和叶片,将10%蜂蜜水喷洒在无花冠的花托上,观察并记录鹤顶粉蝶对无花冠花托的访问次数。
-
在7种假花花束上用喷壶分别均匀喷洒等量的10%的蜂蜜水10 mL,为了有效避免因水分蒸发而影响试验结果,每隔40 min在7种假花花束上分别补喷10%的蜂蜜水10 mL。观察并分别记录鹤顶粉蝶对不同颜色花束的访问次数。
-
在网室放入处于求偶期但未交配的雌、雄成虫各10只,观察雌雄蝶的求偶追逐行为。观察时间为9:30—11:30,14:30—17:30。当某一雌/雄成虫对异性个体表现出明显趋向行为,并出现尾随追求,记为1次求偶行为。为便于区分雌雄,雌蝶前翅用红色记号笔标记。
-
在观察网室内3条横线上垂直悬挂12只模型,雌蝶模型、雄蝶模型和空白模型均为4只(模型的悬挂顺序依次为雌、雄和空白模型)。12只模型距地面垂直高度约1.8 m,模型间距为1 m。分别将处于求偶期雌蝶10只和雄蝶10只放入网室进行模型访问的观察,观察过程中每间隔2 h交换1次模型位置,观察并记录雌雄蝶访问模型的次数。
模型访问次数:蝴蝶接近移动模型时,观察到蝴蝶减速,快速震动翅膀,并做出求偶姿势,此时,将绕模型飞行或停在模型上记为访问1次。若1只蝴蝶访问模型后,在不超过1 m距离内或时间不超过10 s又返回到同一模型上,则仅记为访问1次[41]。
-
将前述鹤顶粉蝶标本及模型翅膀平展开后,用光谱仪(USB200+,Ocean Optics,Inc,USA)拍照,然后通过SRAnal、ENVI软件进行光谱数据的转换处理,最后利用Excel绘图。使用紫外仪(型号WD-9403C,反射影像波长365 nm)拍照。
通过光谱分析表明,自然种群与塑封模型的光谱特征相似,虽然塑封模型反射率低于自然种群,但是在重要的反射率高峰阶段相似(图3A-B)。试验观察发现,在自然光下,鹤顶粉蝶雌雄翅面颜色和翅脉存在差别,雌蝶后翅背面比雄蝶多1列黑色斑点。另外,雌雄蝶前后翅腹面的颜色有明显区别(图3C)。在紫外光下,蝴蝶模型与标本比较,虽然有一定差异,但塑封模型反射率更强,蝴蝶更容易识别(图3D-E)。
-
使用IBM SPSS25.0统计分析软件,对鹤顶粉蝶觅食过程中的访花数据和自然种群求偶的数据进行单因素ANOVO检验,然后用Duncan进行多重比较。喷洒10%蜂蜜水前后鹤顶粉蝶访花数据采用独立样本t检验。
-
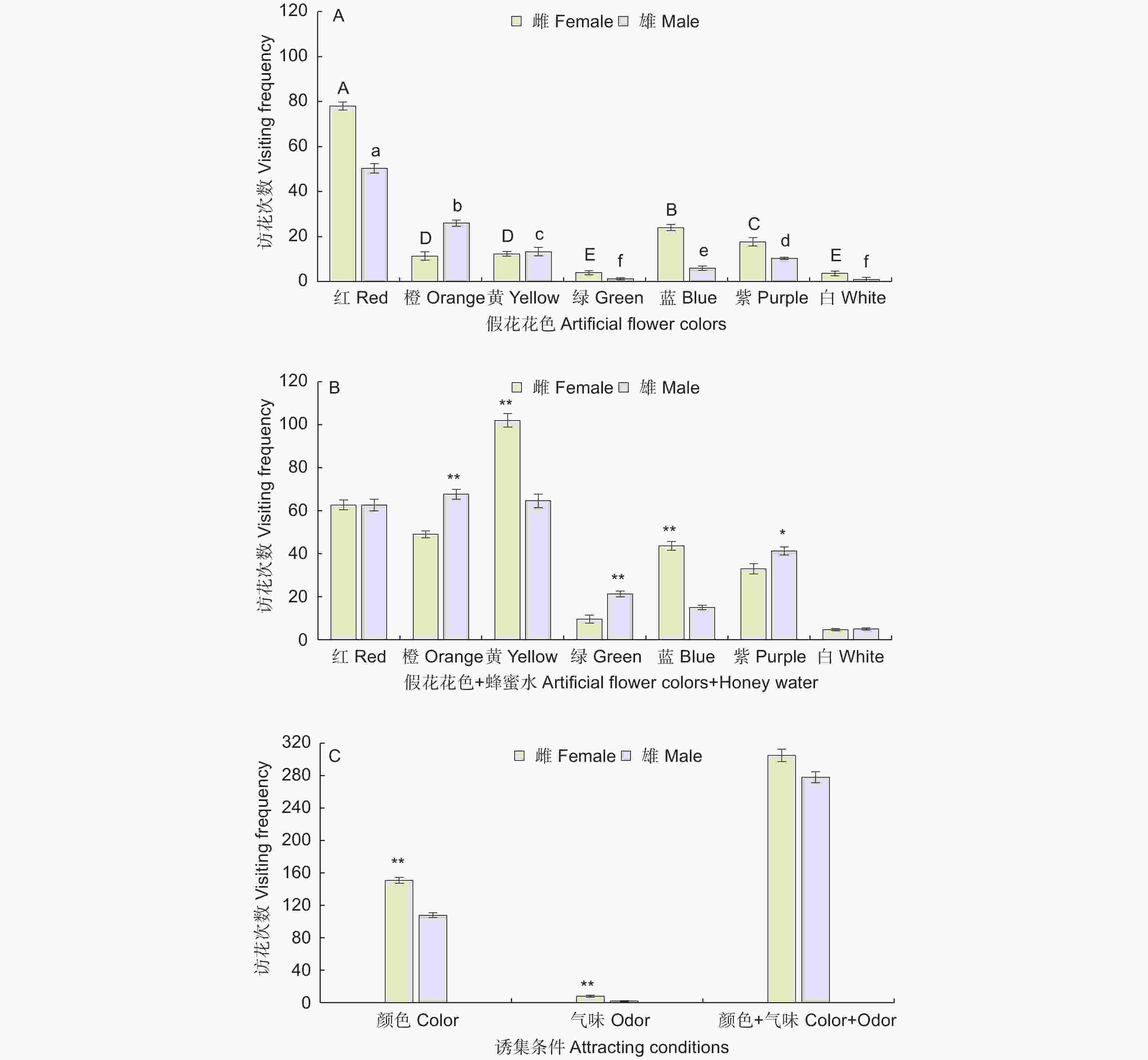
观察结果表明,雌雄蝶对7种颜色的访问次数存在差异,雌蝶对除黄色和橙色外的颜色响应高于雄蝶(P<0.05)。雌雄蝶对7种颜色假花均有访问,访问总次数为259次,雌雄蝶分别为151次和108次,分别占访问总次数58.3%和41.83%。雌雄蝶均对红色(620~750 nm)假花访问次数最多,访问次数分别78次和50次,占访问总次数的51.66%和46.60%。雌蝶对蓝色(450~475 nm)和紫色(380~450 nm)访问次数次之,访问次数分别为24次和18次,雌蝶对蓝色和紫色访问次数分别占雌蝶访问总次数15.89%和11.70%,而雄蝶对橙色(590~620 nm)和黄色(570~590 nm)假花的访问次数次之,分别为26次和13次,雄蝶对橙色和黄色访问次数分别占雄蝶总访问次数24.07%和12.35%,雌雄蝶均对绿色(595~570 nm)和白色的假花访问相对较少(图4A)。
-
在无花冠的花托上喷洒10%的蜂蜜水后,鹤顶粉蝶对单一气味的反应不活跃,雌雄蝶总访问次数为10次,雌雄蝶分别为8次和2次(图4C)。
-
在无气味的假花上喷洒10%蜂蜜水后,访问总次数为583次,雌雄蝶分别为305次和278次,占访问总次数52.32%和47.68%。雌蝶对黄色(570~590 nm)访问次数最多(102次),占雌蝶访问总次数33.44%,其次是红色(620~750 nm)和橙色(590~620 nm)假花分别是63次和49次,占雌蝶总访问次数20.55%和16.07%。雄蝶对橙色(590~620 nm)假花访问最多(68次),占雄蝶访问总次数24.34%,其次是红色(620~750 nm)和黄色(570~590 nm)假花,访问次数分别为63次和65次,占雄蝶访问总次数22.54%和23.26%,雌雄蝶均对白色的假花访问相对较少,均为5次(图4B)。
颜色 + 蜂蜜水诱集与单一颜色诱集相比,雌雄蝶对7种颜色假花的访问次数有不同程度的增加,并且在不同花色组合中蝴蝶访花次数增加的比例不一样,蝴蝶颜色趋性发生了变化,雌雄蝶访花总次数增加2.25倍,雌雄蝶分别增加2.02倍和2.57倍(图4C)。颜色 + 蜂蜜水诱集与单一气味诱集相比,雌雄蝶访花总次数增加58.30倍,雌雄蝶分别增加38.13倍和139.00倍(图4C)。
-
在鹤顶粉蝶求偶过程中存在2种情况,即同性之间的驱逐及异性之间的追逐4种行为,4种行为总次数为55次,其中雄追雄(11次,20.00%)、雄追雌(27次,49.09%),雌追雄(11次,20.61%),和雌追雌(5次,9.70%)。雄追雌的次数显著高于雌追雄的次数(P<0.01),表明在求偶中雄蝶占主动地位,而雌蝶处于被动地位。雄蝶驱逐同性行为的次数较雌蝶驱逐同性的次数多(P<0.05),雄蝶同性之间的竞争较强烈(图5)。
-
在鹤顶粉蝶对无气味的蝴蝶标本模型求偶中,同样存在同性之间的驱逐及异性之间的追逐现象,总访问次数为36次。其中雄追雄(5次,13.89%)、雄追雌(7次,18.75%)、雌追雄(10次,28.47%)、雌追雌(12次,31.94%)、雄蝶访问空白模型(1次,2.78%)和雌蝶访问空白模型(1次,3.47%)(图5)。模型访问次数与自然种群求偶比较,虽然也存在4种相同的求偶模式,但鹤顶粉蝶对缺乏气味的标本模型的访问次数低于自然种群(P<0.05)。
-
访花蝶类成虫通过取食花蜜补充营养,以便于完成求偶、交配和产卵等生命活动。蝶类在飞行过程中首先通过花色来远距离搜寻、发现蜜源植物[42-43],靠近后再利用嗅觉信号精准定位蜜源植物[44]。虽然不同蝶种的蜜源植物种类有很大差异,但仍有很多蝶种偏好访问相同颜色的花朵[45]。本研究中,无气味7色花诱集时,鹤顶粉蝶对不同花色均有访问,但对长波长红色(620~750 nm)趋性最强,显示出其觅食过程中的色觉偏好。许多研究在凤蝶及粉蝶科蝴蝶中发现了红色视觉色素[11, 46],结合前人的研究结果,推测鹤顶粉蝶复眼存在感觉红光波段的视觉色素。雌蝶对色觉的响应高于雄蝶,这可能由于雌蝶肩负产卵繁衍后代的使命,需要补充更多的营养,植物的花色可能驱动了雌蝶以红色为主的视觉系统的发育。单一气味诱集时,鹤顶粉蝶访花次数较少,说明没有颜色的指引,单一气味对鹤顶粉蝶引诱作用有限,可能因为气味较复杂、不稳定、受干扰较大。7种不同颜色假花 + 10%蜂蜜水诱集时,雌雄蝶均对黄色(570~590 nm)、红色(620~750 nm)和橙色(590~620 nm)访问最多,结合鹤顶粉蝶翅面色彩特征(橙黄色、橙红色),考虑到昆虫和植物之间的生态互作,初步推测鹤顶粉蝶在进化过程中存在与植物花色的协同进化。
视觉和嗅觉作为一个信号组合,不同蝶种对其信号利用机制存在差别,进而影响蝴蝶的访花行为[47]。如玉带凤蝶Papilio polytes在其觅食过程中,视觉为主嗅觉为辅[4],而虎斑蝶Danaus genutia在访花时仅依靠嗅觉[44]。本研究所测试的鹤顶粉蝶经试验可以归到蝴蝶觅食过程中视觉为主,嗅觉为辅[44]。另外,添加10%蜂蜜水后与单一颜色相比,雌雄蝶的颜色趋性发生了变化,由红色转变为黄色和橙色,表明除了视觉,鹤顶粉蝶的觅食行为在一定程度上受嗅觉的影响,嗅觉在促进鹤顶粉蝶蜜源植物的精准识别和觅食行为方面具有一定的作用。访花昆虫为了节省觅食的时间,充分利用视觉嗅觉信号,本研究结果表明鹤顶粉蝶也遵循这一机制。
在求偶过程中,为减少被天敌捕食的风险及提高求偶效率,蝴蝶利用多种信号识别配偶[26]。蝴蝶自然种群求偶过程中有4种追逐行为[48],同样,鹤顶粉蝶在求偶过程中也存在这4种行为,其中异性追逐时雄追雌远多于雌追雄,说明雄蝶在求偶时处于主动地位,雄蝶能精准识别雌蝶。同性驱逐时雄追雄的次数多于雌追雌的次数,可能是雄蝶为了争夺交配的主动权而激烈竞争,驱逐同类。在模型求偶试验中,雌雄蝶对标本模型访问较多,表明雌雄蝶对其同类翅膀的色彩有识别能力,且该色彩对雌雄蝶具有吸引作用,说明鹤顶粉蝶可以通过翅膀色彩识别同类。雌雄蝶对仅有蝴蝶翅膀的形状而缺少色彩的空白模型追逐次数仅各有1次,进一步说明蝴蝶依靠视觉信号进行最初的配偶及同性的识别。本研究的结果支持蝴蝶可以通过翅面特征(如颜色、斑点等)、翅面鳞片反射的紫外光等来定位并识别同种异性[48]。雌追雌的次数最多,说明排除挥发物的嗅觉干扰,单一的视觉识别可加剧雌蝶之间的竞争。模型访问与自然种群追逐相比,鹤顶粉蝶对模型访问总次数明显低于自然种群。虽然视觉有助于远距离识别同类[48-49],但仍需要嗅觉进行精准识别。鹤顶粉蝶雌雄翅面颜色和图案存在一定差别,雌蝶的紫外反射比雄蝶的强,推测这种模式更有利于鹤顶粉蝶适应自然环境、配偶选择及个体交流活动。
-
本研究初步证明了鹤顶粉蝶觅食求偶时的视觉嗅觉利用。本研究结果表明,鹤顶粉蝶在觅食过程中以视觉为主,嗅觉为辅,具有明显的色觉偏爱,偏爱红色。在求偶过程中,虽然鹤顶粉蝶具有视觉识别能力,仍需要通过嗅觉信号精确识别配偶及同性。
鹤顶粉蝶觅食求偶过程中的视觉嗅觉信号识别
Recognition of Visual and Olfactory Signal Functions in Hebomoia glaucippe Adults During Their Foraging and Courtship
-
摘要:
目的 研究鹤顶粉蝶(Hebomoia glaucippe)成虫觅食、求偶时的视觉、嗅觉信号利用机制。 方法 通过行为观察分别测定不同花色和蜂蜜水及塑封模型对鹤顶粉蝶的引诱效应。 结果 在无气味的7种不同颜色假花诱集试验中,雌雄蝶对长波长红色(620~750 nm)表现出明显的颜色倾向,雌雄蝶访花总次数为259次,雌雄蝶分别为151次和108次。而在假花上喷洒蜂蜜水后,雌雄蝶访花总次数为583次,雌雄蝶分别为305次和278次。单一蜂蜜水诱集时,雌雄蝶访花总次数仅10次,雌雄蝶访花次数分别为8次和2次。颜色-气味组与气味组和颜色组相比,访花次数分别提高58.30倍和2.25倍。在鹤顶粉蝶求偶过程中,雌雄蝶对模型的访问和自然种群的追逐规律不一致,鹤顶粉蝶对缺乏气味的标本模型的访问次数显著低于自然种群(P<0.05)。雌雄蝶翅膀的色彩与图案存在差别。 结论 鹤顶粉蝶在觅食过程中,以视觉为主,嗅觉为辅,具有明显的色觉偏爱;在求偶过程中,视觉和嗅觉均参与求偶识别,虽然鹤顶粉蝶可以通过视觉信号进行最初的配偶识别,但仍需要通过嗅觉信号精确识别配偶及同性。 Abstract:Objective To study the mechanism of visual and olfactory signal utilization in the foraging and courtship of Hebomoia glaucippe. Method The attractive effects of different colors of flowers and artificial flowers sprayed with honey water and artificial models on H. glaucippe were verified by behavioral studies. Result In the odorless attractive experiment of 7 different colors of artificial flowers, the male and female butterflies showed an obvious color tendency towards long-wavelength red (620-750 nm). The total number of visits to flowers by the male and female butterflies was 259, 151 and 108 respectively. After spraying honey water on the artificial flowers, the male and female butterflies visited the flowers for 583 times, 305 times and 278 times respectively. In the case of using honey water only, the total number of female and male butterfly visits was only 10, in which the numbers of female and male butterfly visit were 8 and 2 respectively. Compared to the odor group and color groups, the butterfly visiting times of color + odor group increased by 58.3 and 2.25 times, respectively. During the courtship, the chasing of the model by the H. glaucippe was inconsistent with the chasing law of the natural population. The visit to the scentless specimen model was significantly lower than that of the natural population (P<0.05). There were differences in the colors and patterns of the wings of female and male butterflies. Conclusion H. glaucippe butterfly is mainly visual and supplemented by olfaction when foraging, and it has obvious preference for color vision. Both vision and olfaction participate in courtship recognition during courtship, using visual signals for initial spouse recognition, and then precise recognition through olfactory signals. -
Key words:
- Hebomoia glaucippe
- / foraging behavior
- / courtship behavior
- / visual response
- / olfactory response
-
-
[1] Primož Pirih, Marko Ilić, Jerneja Rudolf, et al. The giant butterfly-moth Paysandisia archon has spectrally rich apposition eyes with unique light-dependent photoreceptor dynamics[J]. Journal of Comparative Physiology A, 2018, 204(7): 639-651. doi: 10.1007/s00359-018-1267-z [2] 唐宇翀. 蝴蝶成虫访花行为及其访花活动规律[J]. 安徽农业科学, 2015, 43(34):18-19. [3] 李承哲. 基于蝴蝶成虫行为学的两性求偶识别机制及蝴蝶飞舞景观构建[D]. 北京: 中国林业科学研究院, 2017. [4] 李明涛, 刘 杰, 陈顺安, 等. 玉带凤蝶访花及求偶过程中的视觉及嗅觉识别行为[J]. 林业科学研究, 2020, 33(6):39-48. [5] Honda K, Ômura H, Hayashi N. Identification of floral volatiles from Ligustrum japonicum that stimulate flower-visiting by cabbage butterfly, Pieris rapae[J]. Journal of Chemical Ecology, 1998, 24(12): 2167-2180. doi: 10.1023/A:1020750029362 [6] Tang, Y C, Zhou C L, Chen X M, et al. Visual and olfactory responses of seven butterfly species during foraging[J]. Journal of Insect Behavior, 2013, 26(3): 387-401. doi: 10.1007/s10905-012-9358-0 [7] Qiu X, Vanhoutte K, Stavenga D G, et al. Ommatidial heterogeneity in the compound eye of the male small white butterfly, Pieris rapae crucivora[J]. Cell and Tissue Research, 2002, 307(3): 371-379. doi: 10.1007/s00441-002-0517-z [8] Ogawa Y, Kinoshita M, Stavenga D G, et al. Sex-specific retinal pigmentation results in sexually dimorphic long-wavelength-sensitive photoreceptors in the eastern pale clouded yellow butterfly, Colias erate[J]. Journal of Experimental Biology, 2013, 216(10): 1916-1923. [9] Stewart F J, Kinoshita M, Arikawa K. The butterfly Papilio xuthus detects visual motion using chromatic contrast[J]. Biology Letters, 2015, 11(10): 20150687. doi: 10.1098/rsbl.2015.0687 [10] Chen P J E, Eawata H, Ematsushita A, et al. Extreme spectral richness in the eye of the common bluebottle butterfly, Graphium sarpedon[J]. Frontiers in Physiology, 2016, 4(10): 107. [11] Arikawa K. The eyes and vision of butterflies[J]. Journal of Physiology, 2017, 595(16): 5457-5464. doi: 10.1113/JP273917 [12] Francesca D. Frentiu G D. Bernard M P, et al. Gene duplication is an evolutionary mechanism for expanding spectral diversity in the long-wavelength photopigments of butterflies[J]. Molecular Biology and Evolution, 2007, 24(9): 2016-2028. doi: 10.1093/molbev/msm132 [13] Marshall J, Arikawa K. Unconventional colourvision[J]. Current Biology, 2014, 24(24): R1150-R1154. doi: 10.1016/j.cub.2014.10.025 [14] Ilse D, Vaidya V G. Spontaneous feeding response to colours in Papilio demoleus L.[J]. Plant Sciences, 1956, 43(1): 23-31. [15] Goulson D, Cory J S. Flower constancy and learning in foraging preferences of the green-veined white butterfly Pleris napi[J]. Ecological Entomology, 1993, 18(4): 315-320. doi: 10.1111/j.1365-2311.1993.tb01107.x [16] Carlsson M A, Bisch-Knaden S, Schäpers A, et al. Odour maps in the brain of butterflies with divergent host-plant preferences[J]. PLoS ONE, 2011, 6(8): e24025. doi: 10.1371/journal.pone.0024025 [17] Carlsson, M A, et al. Organization of the olfactory system of Nymphalidae butterflies[J]. Chemical Senses London, 2013, 38(4): 355-367. doi: 10.1093/chemse/bjt008 [18] Andersson S. Floral scent and butterfly pollinators [M]// Dudareva N, Pichersky E (eds). Biology of Floral Scent. CRC Press, 2006, 199-217. [19] Ômura H. Foraging behavior of adult butterflies and its semiochemicals as olfactory signals[J]. Comparative Physiology and Biochemistry, 2006, 23(3): 134-142. [20] Schäpers A, Carlsson M A, Gamberale-Stille G, et al. The role of olfactory cues for the search behavior of a specialist and generalist butterfly[J]. Journal of Insect Behavior, 2015, 28(1): 77-87. doi: 10.1007/s10905-014-9482-0 [21] 王 华. 蝴蝶觅食和求偶中视觉和嗅觉利用-两种蝴蝶为例[D]. 北京: 中国林业科学研究院, 2017. [22] Scott J A. Mating of butterflies[J]. Journal of Research on the Lepidoptera, 1972, 11(2): 99-127. [23] Obara Y, Majerus M E N. Initial mate recognition in the British cabbage butterfly, Pieris rapae[J]. Zoological Science, 2000, 17(6): 725-730. doi: 10.2108/zsj.17.725 [24] Mega N O, Araújo A M. Analysis of the mating behavior and some possible causes of male copulatory success in Dryas iulia alcionea (Lepidoptera, Nymphalidae, Heliconiinae)[J]. Journal of Ethology, 2010, 28(1): 123-132. doi: 10.1007/s10164-009-0163-y [25] Wiklund C, Fagerström T. Why do males emerge before females?[J]. Oecologia, 1977, 31(2): 153-158. doi: 10.1007/BF00346917 [26] Costanzo K, Monteiro A. The use of chemical and visual cues in female choice in the butterfly Bicyclus anynana[J]. Proceedings of the Royal Society B:Biological Sciences, 2007, 274(1611): 845-851. doi: 10.1098/rspb.2006.3729 [27] Myers J. Pheromones and courtship behavior in butterflies[J]. American Zoologist, 1972, 12(3): 545-551. doi: 10.1093/icb/12.3.545 [28] Hidaka T, Yamashita K. Wing color pattern as the releaser of mating behavior in the swallowtail butterfly, Papilio xuthus L. (Lepidoptera: Papilionidae)[J]. Applied Entomology and Zoology, 1975, 10(4): 263-267. doi: 10.1303/aez.10.263 [29] Prudic K L, Stoehr A M, Wasik B R, et al. Eyespots deflect predator attack increasing fitness and promoting the evolution of phenotypic plasticity[J]. Proceedings of the Royal Society B Biological Sciences, 2015, 282(1798): 20141531. doi: 10.1098/rspb.2014.1531 [30] Ho S, Schachat S R, Piel W H, et al. Attack risk for butterflies changes with eyespot number and size[J]. Royal Society Open Science, 2016, 3(1): 150614. doi: 10.1098/rsos.150614 [31] Fordyce J A, Nice C C, Forister M L, et al. The significance of wing pattern diversity in the Lycaenidae: mate discrimination by two recently diverged species[J]. Journal of Evolutionary Biology, 2002, 15(5): 871-879. [32] Maria T, Arja K, Rutowski R L. Females show greater changes in wing colour with latitude than males in the green -veined white butterfly, Pieris napi (Lepidoptera: Pieridae)[J]. Biological Journal of the Linnean Society, 2012, 107(4): 899-909. [33] Hurb M, Shivam B, Antónia M. Male Bicyclus anynana butterflies choose females on the basis of their ventral UV-reflective eyespot centers[J]. Journal of Insect Science, 2019, 19(1): 1-8. [34] Morehouse N I, Vukusic P, Rutowski R. Pterin pigment granules are responsible for both broadband light scattering and wavelength selective absorption in the wing scales of pieridbutterflies[J]. Proceedings:Biological Sciences, 2007, 274(1608): 359-366. [35] Morehouse N I, Rutowski R L. In the eyes of the beholders: Female choice and avian predation risk associated with an exaggerated male butterfly color[J]. American Naturalist, 2010, 176(6): 768-784. doi: 10.1086/657043 [36] Vane-Wright R I, Boppré M. Visual and chemical signalling in butterflies: functional and phylogenetic perspectives[J]. Philosophical Transactions of the Royal Society of London. Series B:Biological Sciences, 1993, 340(1292): 197-205. doi: 10.1098/rstb.1993.0058 [37] Nieberding C M, Vos H D, Schneider M V, et al. The male sex pheromone of the butterfly bicyclus anynana: towards an evolutionary analysis[J]. Plos One, 2008, 3(7): e2751. doi: 10.1371/journal.pone.0002751 [38] Van B E, Brakefield P M, Heuskin S, et al. The scent of inbreeding: a male sex pheromone betrays inbred males[J]. Proceedings of the Royal Society B:Biological Sciences, 2013, 280(1758): 20130102. doi: 10.1098/rspb.2013.0102 [39] 伍杏芳. 岭南绿洲蝴蝶[M]. 北京: 学术期刊出版社, 1988, 43-44. [40] 周 尧. 中国蝶类志[M]. 郑州: 河南科学技术出版社, 2000, 262-263. [41] Li C Z, Wang H, Chen X M, et al. Role of visual and olfactory cues in sex recognition in butterfly Cethosia cyane [J]. scientific reports, 2017, 7(1): 5033. doi: 10.1038/s41598-017-04721-6 [42] Corbet S A. Butterfly nectaring flowers: butterfly morphology and flower form[J]. Entomologia Experimentaliset et Applicata, 2000, 96(3): 289-298. [43] Goyret J, Markwell P M, Raguso R A. The effect of decoupling olfactory and visual stimuli on the foraging behavior of Manduca sexta[J]. Journal of Experimental Biology, 2007, 210(8): 1398-1405. doi: 10.1242/jeb.02752 [44] 唐宇翀, 蝴蝶觅食过程中的嗅觉和视觉行为反应研究[D]. 北京: 中国林业科学研究院, 2013. [45] Tudor O, Dennis R L H, Greatorex-Davies J N, et al. Flower preferences of woodland butterflies in the UK: nectaring specialists are species of conservation concern[J]. Biological Conservation, 2004, 119(3): 397-403. doi: 10.1016/j.biocon.2004.01.002 [46] Wakakuwa M, Stavenga D G, Kurasawa M, et al. A unique visual pigment expressed in green, red, and deep-red receptors in the eye of the small white butterfly, Pieris rapaecru civora[J]. The Journal of Experimental Biology, 2004, 207(16): 2803-2810. doi: 10.1242/jeb.01078 [47] Ômura H, Honda K. Priority of color over scent during flower visitation by adult Vanessa indica butterflies[J]. Oecologia, 2005, 142(4): 588-596. doi: 10.1007/s00442-004-1761-6 [48] 王翻艳. 大帛斑蝶成虫行为学观察及其求偶机制研究[D]. 北京: 中国林业科学研究院, 2015. [49] Dinesh A S, Venkatesha M G. Analysis of the territorial, courtship and coupling behavior of the Hemipterophagous butterfly, Spalgis epius, (Westwood) (Lepidoptera: Lycaenidae)[J]. Journal of Insect Behavior, 2013, 26(2): 149-164. doi: 10.1007/s10905-012-9341-9 -




 下载:
下载: