-
种子由休眠阶段转换到萌发阶段,涉及非常复杂的生物学过程[1]。两阶段相比对,常存在较多的差异表达基因(DEGs)[2]。与种子休眠相关的基因功能研究主要集中在拟南芥(Arabidopsis thaliana (L.) Heynh)[3]、烟草(Nicotiana tabacum L.)[4]及水稻(Oryza sativa L.)[5]等模式植物中。近年来,有关重楼(Paris polyphylla Smith)等中草药[6- 7]、杉木(Cunninghamia lanceolata (Lamb.) Hook.)和湖北梣(Fraxinus hupehensis Chu)等林木[8- 9]以及桃(Amygdalus persica L. Spp.)[10-11]和芍药(Paeonia lactiflora Pall.)[12]等观赏植物的种子休眠相关的基因功能研究也陆续被报道。
种子休眠解除涉及复杂的调控网络。华重楼(P. polyphylla Sm. var chinensis (Franch.) Hara)种子在发育与休眠解除过程中,差异表达基因主要富集在次生代谢产物合成、碳代谢、磷酸戊糖途径、多糖分解、蛋白质合成以及激素信号转导等通路[7]。人参(Panax ginseng C. A. Mey.)后熟发育时期的DEGs主要富集到代谢过程、次生代谢合成和植物激素信号转导等通路[13]。具有形态生理休眠的辽东楤木(Aralia elata L.)种子在破眠起始阶段的呼吸代谢途径主要以糖酵解和三羧酸循环为主[14];而油菜(Brassica napus L.)种子休眠性则与脂肪酸代谢密切相关[15]。
内源激素在调控植物种子休眠与萌发过程中有十分重要的作用。近年来,在种子休眠与萌发过程中有关激素的合成与分解、信号转导等基因的表达调控机制研究取得了较大进展,其中,脱落酸(ABA)、赤霉素(GA)、生长素(auxin)和乙烯(ETH)等是研究最多的内源激素。三七(Panax notoginseng Wall.)种子中共筛选出78个与其休眠释放有关的DEGs,其中,15个与ABA和GA相关(如ABI5、GAI、KS、GA2ox等)[16]。拟南芥种子中的AtCYP707A2基因参与ABA水平的调节,其休眠释放也与该基因的表达有关[17]。催化GA生物合成的基因GA20ox1、GA活性转化的关键酶基因GA3ox2与GA分解代谢的关键基因GA2ox1[18]在西洋参(Panax quinquefolius L.)种子休眠解除过程中表达量显著变化[19]。拟南芥的GA受体GID1基因突变后,突变体种子中α-淀粉酶的活性被抑制,从而导致种子不能萌发[20]。花生(Arachis hypogaea L.)种子休眠解除过程中除了与GA和ABA相关的unigenes显著差异表达以外,与auxin和ETH相关的DEGs也较多[21]。ACO1基因转录调控乙烯生成,在打破山毛榉属(Fagus L.)植物种子休眠过程中起主要作用[22]。
金丝李(Garcinia paucinervis Chun et How)为藤黄科(Clusiaceae)藤黄属(Garcinia L.)乔木,主要分布于广西西部和云南东南部喀斯特山地,集经济、生态、观赏和药用价值于一身。因其木材名贵,金丝李曾遭受过度采伐,成为了珍稀濒危树种。前期研究表明,金丝李种子萌发缓慢且不整齐,被归为具有生理休眠的低度顽拗性种子[23-24],其休眠主要是由于胚和胚乳中存在内源抑制物的同时缺乏萌发促进物质。以外源6-BA或GA3处理,亦或32℃条件下均可加快金丝李种子萌发的进程,在一定程度上可打破种子休眠。但处理后的种子平均萌发时间均大于100 d,萌发仍较为缓慢[25-26],这并不利于金丝李的育苗栽培和资源的保护利用。目前,有关金丝李的分子生物学研究有限,仅有关于其不同种群遗传多样性的报道[27],而藤黄属植物种子休眠机理的分子方面研究几乎空白。为了获得更有效地打破金丝李种子休眠的方法,需探索其休眠的分子机理,分析其休眠解除与种子萌发过程中参与调控的基因及其调控方式。
转录组学(transcriptomics)属于功能基因组学的研究范畴,可从整体水平上研究基因功能和基因结构,揭示不同转录组样本中基因表达水平的变化,挖掘特定生物学过程中的分子机理[28]。种子能否解除休眠取决于种子休眠程度与胚胎克服休眠能力之间的相互博弈。然而,科学界对种子休眠解除和萌发启始阶段的界定十分困难[29]。金丝李种子萌发缓慢且不规律,很难把握其从休眠状态转为休眠解除状态的关键时间,故本研究预设以种子萌发为其休眠解除的判断标准。通过将新鲜成熟的金丝李种子、播种后同一时间未萌发和已萌发种子的种胚和胚乳进行无参考基因组转录组测序,找出种子从休眠向萌发转化过程中的差异表达基因,挖掘调控其休眠解除的候选基因,以期为后续开展金丝李种子的休眠功能基因研究及分子育种实践提供有益参考,为藤黄属植物种子,甚至具有休眠属性的顽拗性种子的基因组学研究奠定基础,也为探讨其分子调控网络提供有价值的信息。
-
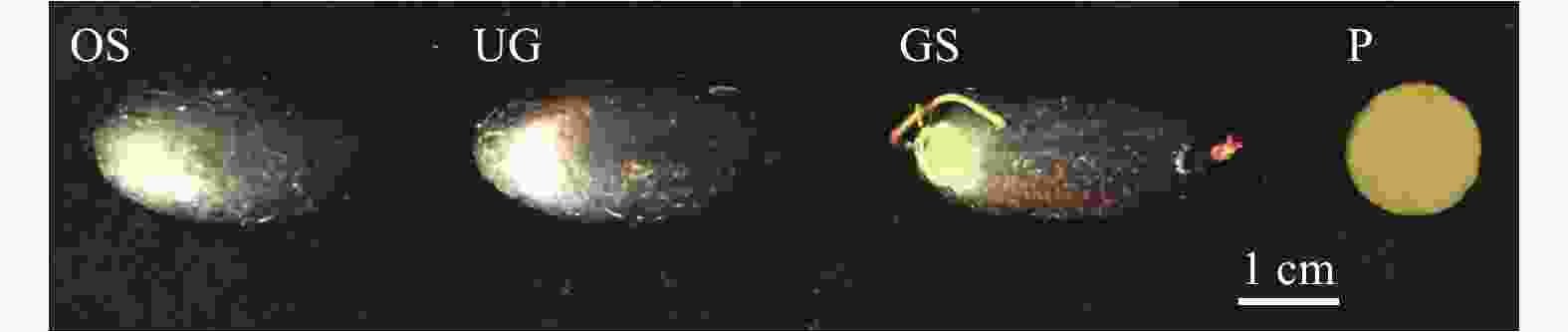
成熟金丝李种子于2017年7月采集自广西龙州县弄岗国家级自然保护区,经0.1%的K2MnO4溶液消毒并洗净后,选取饱满且无病虫害的种子(经TTC法测试其生活力达98.00%),一部分种子去除种皮后用灭菌刀片切取中部(包含胚和胚乳)约3 mm部分,迅速用锡箔纸包裹放入液氮速冻,存于−80℃冰箱作为原种子,记为OS(original seeds);另一部分种子参照张俊杰等[25]的播种条件,以河沙为基质播种于25℃的培养箱中,经过60 d取出种子(萌发率为(28.33 ± 2.36)%),未萌发的种子记为UG(ungerminated seeds);已萌发的种子记为GS(germinated seeds),去除种皮后取种子中部(包含胚和胚乳)约3 mm部分(图1),迅速用锡箔纸包裹放入液氮速冻,于−80℃冰箱保存(种皮不是其休眠的主要原因[23],故本研究采用了去种皮操作)。
-
使用广州艾基生物技术有限公司的IPure TRizol植物RNA提取试剂盒(K417-S)分别对OS、UG和GS 3组材料进行种胚和胚乳(混合)的RNA提取。经超微量核酸蛋白测定仪(ScanDrop 100)测定提取的RNA纯度及浓度(选择A260/280 ≈ 1.8~2.1,A260/230 > 1.8),再经过1.2%琼脂糖凝胶电泳检测所提取的RNA完整性,合格后存于−80℃冰箱以备下一步试验。
-
将OS、UG和GS 3组材料各5粒种子作为1组混池处理,3个生物学重复。在上机前分别对总RNA的纯度、浓度及完整度用Nanodrop、Qubit及Agilent 2100进行检测,选用评定等级为A的样品。样品RNA经DNase I处理后,用带有Oligo(dT)的磁珠富集真核生物mRNA,加入打断试剂将mRNA打断成短片段,并以打断后的mRNA为模板用六碱基随机引物(random hexamers)合成一链cDNA,然后加入缓冲液、dNTPs和DNA polymerase I合成cDNA第二链,经QiaQuick PCR试剂盒纯化回收、粘性末端修复、3′末端加上碱基“A”和连接测序接头,得到的片段进行大小选择后,PCR扩增富集。构建好的文库经Agilent 2100 Bioanalyzer和ABI StepOnePlus Real-Time PCR System质检合格后使用Illumina HiSeqTM 2500测序平台进行测序。
-
为减少测序错误对后续分析的影响,用FastaQC软件进行质量评估。测序得到的原始raw reads中,将含有低质量的和带接头的reads进行过滤(去掉包含adapter,不确定碱基N比例超过5%及低质量碱基(Q ≤ 10),含量大于50%的reads)后得到clean reads。之后使用组装软件Trinity(version: trinityrnaseq_r20140717)对去重复的clean reads进行组装。然后使用Tgicl v2.1去其冗余并进一步拼接,再对这些序列进行同源转录本聚类,获得最终的unigenes。
-
通过Blast比对数据库获得功能注释,使用Blast2GO对unigenes集进行GO注释。采用FPKM法来衡量基因的表达量。采用DESeq2 R package进行unigenes的差异表达分析,对金丝李3个比较组合的DEGs进行筛选,条件为:|Log2Ratio| ≥1且错误发生率(FDR)≤0.01。在KOBAS2.0网站上进行DEGs的KEGG的pathway富集分析。对于激素合成与降解及信号转导的相关DEGs,在转录组测序数据中找到对应注释,将其对应的CDS序列分别在NCBI上进行Blast比对分析以确认。
-
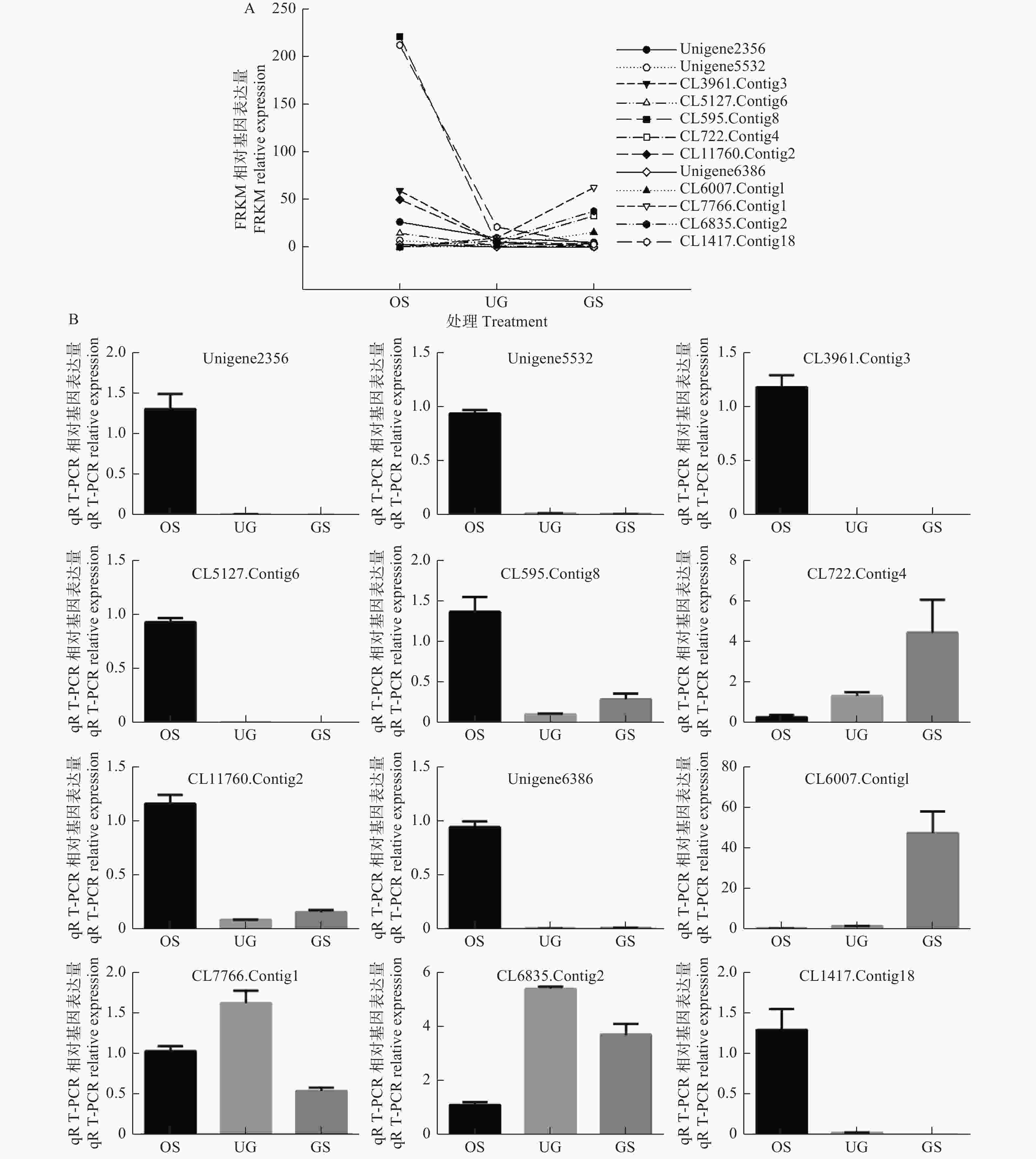
采用qRT-PCR技术验证此次转录组测序数据的可靠性,测试3个比较组合中12个DEGs的表达量变化。以Actin3做为参照基因,采用Primer Premier v5.0设计引物,由生工生物工程(上海)有限公司合成(表1)。采用Aidlab公司反转录试剂盒(TUREscript 1st Strand cDNA SYNTHESIS Kit)进行反转录操作。反应程序:95℃,3 min;95℃,10 s;58℃,30 s;72℃,20 s;39个循环。以2−△△CT方法计算基因相对表达水平[30]。每个样品进行3次生物学重复与3次技术重复,统计值以平均值 ± 标准误(Mean ± SE)表示。使用Graphpad Prism 6与SigmaPlot 11.0软件绘图。
表 1 荧光定量引物列表
Table 1. List of primers sequence of selected genes
基因序列ID
Gene ID基因
Gene引物序列
Primer sequence (5′-3′)— Actin3 F: GGTCGTGACCTCACAGATGCTC R: GCTCCTGCTCATAGTCAAGAGC Unigene2356 ZEP F: CCCTCCTACTATTATTGC R: CTCTCTACAACATTCACA Unigene5532 GA2ox F: GGAGTTCACATGGTGTGAATACA R: GCTCTTTTCTCAAACATCCCAAG CL3961.Contig3 GA2ox3 F: CCTTCCATTAGTCATAAC R: CCTTCAAATCTGTCTTAG CL5127.Contig6 GAI F: GTGACATTAATGTACTCG R: CCTACTGTGTTCAATTAC CL595.Contig8 ACO1 F: GAGCAAATGGGATAGGAA R: CTCCAATGAAAGCATCTC CL722.Contig4 — F: TCACCACATAACATCATC R: ACGAGTTCATATATCTTCC CL11760.Contig2 — F: GGTAGGAATAGTCAACCCTC R: CGGGGATAACCAGCTTTA Unigene6386 — F: TTGGCTGGAAGAGAAAAG R: TAGGGATTGCATGTGAGA CL6007.Contig1 — F: AGGACTAACAAGCAACTC R: GGATGACCTTATGTGTGA CL7766.Contig1 — F: CGACAAGACACCCATTTTC R: TCCTCACTAACCCCATCA CL6835.Contig2 — F: GAGACTTCATAGCATGGA R: ATGGGAGGATGGATTATG CL1417.Contig18 — F: GGTGACAAACCTCTTCTA R: GGCTAAGTTCGTTGATGA -
通过对金丝李种胚和胚乳的转录组测序,获得了OS、UG和GS 3组样品共9个样本转录本信息,共超过120 G的数据量;9个样本的GC含量均在45.70%~47.49%间,Q20、Q30 的范围分别为96.08%~96.56%、90.81%~92.38%(表2)。表明构建的3个转录组文库测序质量较好,可以满足后续分析要求。
表 2 转录组测序的组装质量统计表
Table 2. Summary of the sequence assembly after Illumina sequencing
类型 Type OS1 OS2 OS3 UG1 UG2 UG3 GS1 GS2 GS3 总原始读序
Total Raw Reads79177304 86450202 40641518 84853156 63800684 59290094 59796216 58193988 66797080 总有效读序
Total Clean Reads68520564 76487390 40513070 75147324 57069130 54341546 54324762 52485156 58454902 总接头读序
Total Adapter Reads10596520 9896860 6127006 9641386 6683204 4901530 5424568 5664038 8292988 GC有效读序占比
Clean Reads GC/%46.72 47.28 45.70 47.34 47.25 47.22 47.49 47.44 46.95 Q20有效读序占比
Clean Reads Q20/%96.56 96.14 96.10 96.35 96.08 96.28 96.19 96.14 96.12 Q30有效读序占比
Clean Reads Q30/%92.38 91.62 90.81 91.97 91.48 91.83 91.67 91.56 91.55 组装结果显示:9个样本共获得了120 040个unigenes,平均长度为1 104.92 nt,N50为1 874。所有样品转录组的Unigenes的长度有26.68%都在200~300 bp的范围内,3 000 bp以上的Unigenes占5.95%。
-
荧光定量PCR验证过程中发现,除CL7766.Contig1与CL6835.Contig2外,随机挑选DEGs的qRT-PCR的相对表达量与转录组测序(RNA-Seq)的数据基本呈相似的变化趋势(图2),说明RNA-Seq分析的基因表达谱数据结果在qRT-PCR分析中有较高的再现性,从而解释RNA-Seq分析具有较高的可信度。
-
对金丝李种胚和胚乳的OS、UG和GS 3组样本进行两两比较,筛选出一些DEGs,其中,GS相对OS有1 174个unigenes上调表达,2 232个下调表达;UG相对OS有849个unigenes上调表达,1 926个下调表达;GS相对UG有814个unigenes上调表达,670个下调表达(图3A),表明金丝李种胚和胚乳在播种后涉及复杂的生物过程。OS_VS_GS、OS_VS_UG和UG_VS_GS 3个比较组合的共同与特有的DEGs分布图见图3B。
-
依据KEGG数据库注释信息可以进一步获得unigenes的pathway注释,共56 224个注释到该基因库。≥3%的pathway名称及其包含的基因数量见表3,其中,13 020个代谢途径(Metabolic pathways)的相关基因数量第一,占比23.16%,其次为6 727个占比11.96%的次生代谢产物的生物合成(Biosynthesis of secondary metabolites)的相关基因。
表 3 金丝李种子的转录组unigene的KEGG代谢途径注释(≥ 3%)
Table 3. KEEG pathway annotation of unigenes of transcriptome for G. paucinervis seeds (≥ 3%)
编号
Serial number通路
Pathway数目(比率)
Count (ratio/%)通路标识号
Pathway ID1 代谢途径(Metabolic pathways) 13 020 (23.16) ko01100 2 次生代谢产物的生物合成(Biosynthesis of secondary metabolites) 6 727 (11.96) ko01110 3 抗生素的生物合成(Biosynthesis of antibiotics) 3 533 (6.28) ko01130 4 不同环境中的微生物代谢(Microbial metabolism in diverse environments) 3 492 (6.21) ko01120 5 碳代谢(Carbon metabolism) 2 176 (3.87) ko01200 6 氨基酸的生物合成(Biosynthesis of amino acids) 1 915 (3.41) ko01230 7 EB病毒感染(Epstein-Barr virus infection) 1 904 (3.39) ko05169 8 肺结核(Tuberculosis) 1 787 (3.18) ko05152 9 弓形虫病(Toxoplasmosis) 1 753 (3.12) ko05145 10 麻疹(Measles) 1 688 (3.00) ko05162 -
利用KEGG数据库将3个比较组合文库筛选得到的DEGs进行pathway富集分析,以Qvalue ≤ 0.05为标准。在3个比较组合中注释到的前4条途径一致,以代谢通路(Metabolic pathway)中的DEGs最多,分别达709、533、256个;其次是次生代谢产物的生物合成(Biosynthesis of secondary metabolites)途径,分别有480、359、160个DEGs被分别注释到该途径。说明金丝李种子从休眠到萌发过程中,其基因表达差异多集中在这些途径中。
-
OS_VS_GS和UG_VS_GS 2个比较组合牵涉到金丝李种子休眠的解除和萌发,笔者从中挑选出差异量较大的122个基因(阈值log 2 |Fold Change| > 2,且FDR < 0.01)做热图,其富集到的pathway及其表达情况见图4。从播种到萌发阶段,富集到钙信号通路(Calcium signaling pathway)、次生代谢产物合成(Biosynthesis of secondary metabolites)(包括萜类化合物、黄酮类化合物等)、核糖体(Ribosome)、植物激素信号转导(Plant hormone signal transduction)等相关基因的表达量显著升高;而富集到糖酵解/糖异生(Glycolysis/Gluconeogenesis)、脂肪酸合成与降解(Fatty acid biosynthesis and degradation)、内质网中的蛋白质加工(Protein processing in endoplasmic reticulum)、氨基酸合成(Biosynthesis of amino acids)等相关基因的表达量则显著降低。
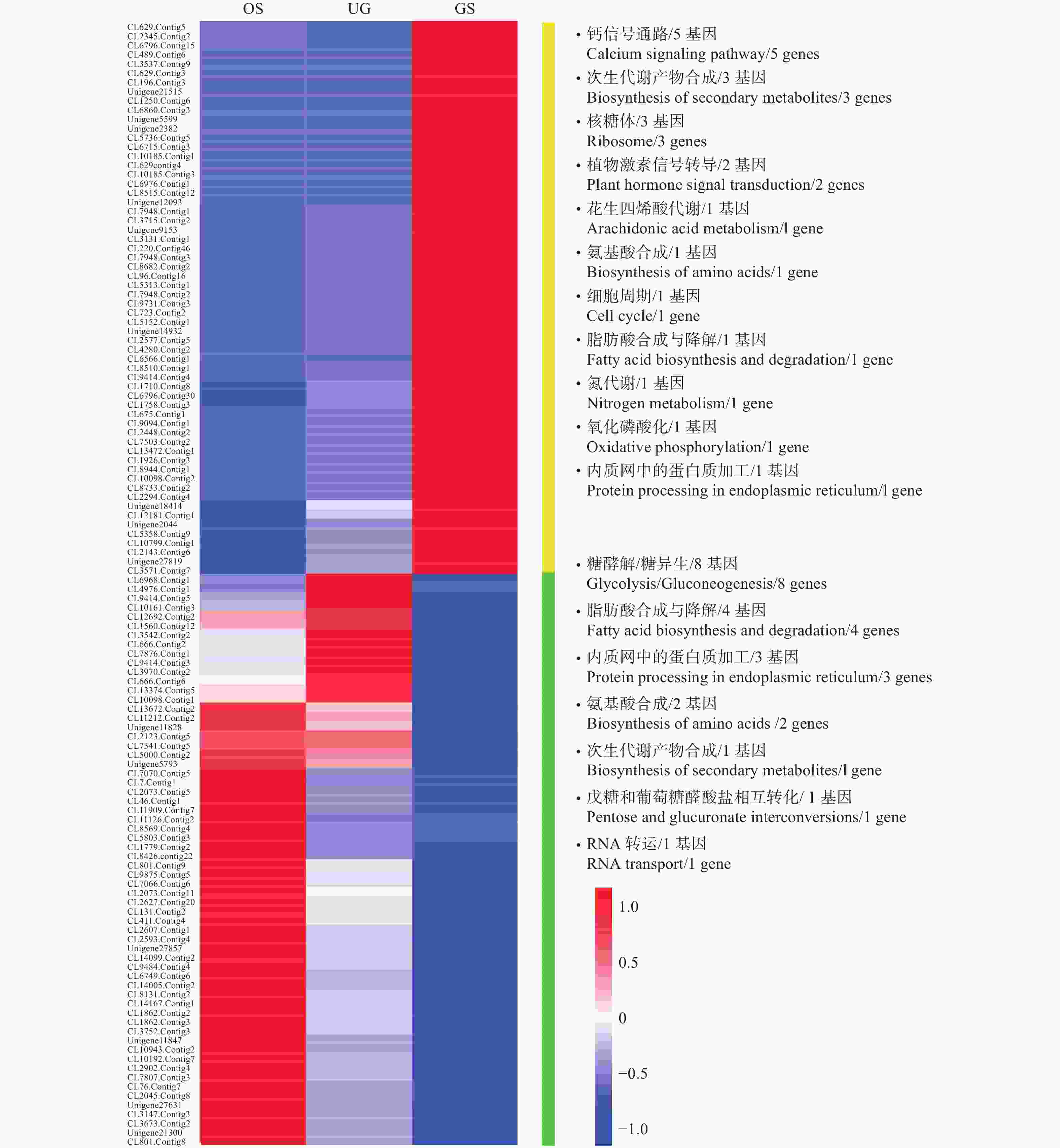
图 4 OS_VS_GS与UG_VS_GS比较组合中共有的部分差异表达显著的基因的表达情况
Figure 4. Expression profile analysis of common DEGs in OS_VS_GS and UG_VS_GS comparison groups of samples
分析可知:在种子休眠解除的过程中,信号传导、激素作用、蛋白质合成、细胞分裂与代谢、次生代谢产物合成等比较活跃,且从原种子到种子吸胀过程中糖、脂肪和蛋白质分解代谢也较旺盛,当种子开始萌发后,这些代谢相关基因逐渐关闭。
-
在3个比较的组合中筛选出40个在种子休眠至萌发过程中与激素相关的基因,根据功能注释可知,涉及到ABA、GA、auxin和ETH等相关的基因,其中,与激素合成、分解或衍生相关的基因有7个,涉及ABA、GA及ETH 共3种植物激素;受体3个,仅涉及GA 1种植物激素;与信号转导相关的基因有17个,涉及到ABA、GA、auxin和ETH 4种激素;转录因子12个,涉及ABA和ETH 2种激素,以ERF家族成员最多;其他基因1个。
与植物激素相关的DEGs的表达情况见图5,其中ZEP、GA2ox1、GA2ox3、GAI、GID1、SnRK2.2和ACO1在种子休眠解除时显著下调表达,以ACO1下调最显著,而CYP707A2、GA20ox1和GA3ox2在此过程中显著上调表达。这些调控ABA、GA、auxin和ETH等相关基因的表达量发生显著的变化,很可能导致对应激素的含量发生变化,促进种子休眠的解除。
-
转录因子(transcription factor,TF)在种子发育、休眠与萌发等植物生命周期中起着非常重要的作用。从3个比较组合中共发现375个差异表达的TFs,分属于57个转录因子家族。OS_VS_GS样本间有170个差异表达的TFs,其中,ERF和WRKY家族各有20个差异表达的TFs,MYB和NAC家族也均含14个;OS_VS_UG样本间有147个差异表达的TFs,其中,ERF和NAC家族各有20个差异表达的TFs,MYB和WRKY家族也均含16个;UG_VS_GS样本关系到种子从吸胀阶段到萌发阶段,它们间有75个差异表达的TFs,其中,ERF家族有14个,HD-ZIP和C3H家族也均含6个。
通过注释发现,与结合蛋白、含结构域的家族蛋白、ABA和乙烯有关的TFs表达量变化较大,其中,与乙烯有关的差异表达的TFs达10个。说明有较多的转录因子家族和转录因子参与了金丝李种子由休眠到萌发的过程,推测它们在种子破眠的过程中也起着一定作用。
-
糖酵解途径是三条最基本的呼吸代谢途径之一,为种子萌发提供所需能量[31]。Simmonds等对野燕麦(Avena fatua L.)种子休眠过程中糖代谢途径研究证明,由糖酵解途径/三羧酸循环向磷酸戊糖途径转变是解除其休眠的主要原因[32]。萌发前期的天女木兰(Magnolia sieboldii K. Koch)种子主要通过糖酵解途径为种子萌发提供能量,定位于糖酵解/糖异生通路的5种差异蛋白质均在种子萌发前期高峰度表达[33]。本研究中发现8个与糖酵解/糖异生合成或分解相关DEGs在播种到种子吸胀、萌发过程中逐渐下调表达,说明糖酵解途径为种子萌发提供能量后,这些糖酵解/糖异生代谢相关基因逐渐关闭。
在营养物质合成与代谢相关基因中,脂肪酸是一些植物种子的主要能量来源之一。巫山淫羊藿(Epimedium wushanense Ying)种子休眠解除过程中各脂肪酸含量变化显著[34]。水曲柳(Fraxinus mandshurica Ruprecht)种子在休眠解除过程中,脂肪酶活性和脂肪酸质量分数快速增加,脂肪酸合成或分解的相关基因在休眠解除过程中差异表达,将贮藏物质转化为营养物质,可为细胞分裂及胚根、胚轴和子叶的分化提供能量,为种子的萌发作准备[35]。脂肪酸合成与降解相关的5个基因CL5358.Contig3、CL6410.Contig10、CL5358.Contig9、CL3542.Contig2和CL3542.Contig1在金丝李种子休眠解除时表达量显著变化,表明种子在破眠过程中脂肪酸代谢活跃。
钙离子(Ca2+)作为第二信使参与调节植物的多种生理过程,参与许多胞内信息或胞外刺激的接收和传递[36]。Somyong等从水稻中鉴定出与钙信号转导有关的候选基因,涉及ABA信号转导以及对萌发至关重要的功能蛋白关联网络[37]。此外,Ca2+信号参与GA信号的转导作用[38],Ca2+-CaM(Calmodulin,钙调蛋白)信号系统参与乙烯生成,以间接方式调节乙烯生成中ACC合酶向乙烯转化[39]。5个钙信号通路相关基因CL629.Contig5、CL6715.Contig3、CL629.Contig3、CL7156.Contig2和CL629.Contig4均在种子吸胀且未萌发时(UG)表达量变化不大,但在萌发时均显著上调,说明钙信号通路相关基因在休眠解除过程中可能起到一定的调控作用,可能参与了ABA、GA和乙烯等激素有关基因的信号转导或合成。
-
种子休眠解除受多种植物内源激素调控[40]。Qi等利用高通量胚胎转录组测序技术挖掘出重楼在种子层积过程中的11个激素相关的DEGs[6]。此外,植物激素与植物的玩拗性密切相关[41],而金丝李种子为较特殊的具有休眠属性的玩拗性种子,故本文重点分析3个比较组合中激素调控相关基因的差异表达。
GA和ABA的相关基因在种子休眠和萌发中的作用是通过合成、分解代谢与信号转导的平衡来实现的[42]。杉木[8]、桃[10, 12]等植物种子的休眠解除过程中,调控GA和ABA的相关基因表达量差异较大。金丝李种子在休眠解除过程中,ABA和GA合成途径上的一些相关基因表达也有显著差异,如ZEP是催化ABA生物合成的关键酶基因[40],从播种到萌发,ZEP表达显著下调,表明ABA合成的关键步骤受阻。CYP707A家族编码ABA 8′-羟化酶,其影响种子从休眠到萌发的过程[17],CYP707A2作用于ABA的分解代谢[43],在金丝李种子播后60 d,无论萌发与否,CYP707A2表达量均显著上升。因此,CYP707A2与ZEP可能共同参与调控ABA含量的降低。SnRk2.2主要参与ABA的信号转导,正调控ABA信号[44]。SnRk2.2在OS_VS_GS比较组合中表达量显著下调。CL3120.Contig6为一种RNA结合蛋白,对ABI3、ABI4和ABI5起抑制作用,ABI3隶属于bZIP转录因子家族,正向调控种子休眠,种子播后60 d,CL3120.Contig6的表达量上调,说明ABI3的表达受到抑制。因此,推断ABA调控金丝李种子萌发是多基因协同作用的结果,通过控制基因的表达量调控ABA的合成或者改变ABA信号转导过程,使得ABA含量在种子萌发过程中发生变化。
GA20ox1与GA3ox2为GA合成途径中的关键调控基因,而GA2ox1的高表达能够导致GA失活,从而调控GA降解代谢。拟南芥种子在吸胀过程中,GA合成的相关基因GA20ox1和GA3ox表达量均显著增加[45]。本研究发现,GA20ox1在播后60 d已萌发种子中表达量显著上调,而GA3ox2在播后60 d有无萌发的种子中表达量均显著上调,推测GA20ox1与GA3ox2在金丝李种子休眠解除过程中有一定作用;而GA2ox1则在3个比较组合中均下调表达。类似的,西洋参种子在经过层积处理的休眠解除过程中,其GA20ox3逐渐上调表达,不同的是,西洋参种子GA2ox3和ZEP的表达量变化不显著[46]。GAI属于DELLA家族的基因,负调控GA信号转导途径[47]。本研究发现,播后60 d GAI的表达量均下调,说明对GA信号的抑制作用减弱。GID1通过蛋白质间的相互作用,增强DELLA对GA的阻遏反应[48]。GID1在播后60 d均下调表达,使得GA的阻遏反应减弱。因此,GA控制金丝李种子休眠解除也是一个多基因协同的复杂过程,通过控制基因的表达量使得GA含量在种子休眠解除时发生变化。结合张俊杰等所测量的金丝李种子从休眠到萌发进程中内源激素的变化情况分析[23],其种子可能通过抑制ABA的合成或促进其分解,加强GA的合成同时减弱其降解,与激素信号转导有关基因和有关转录因子相配合,使萌发促进物与抑制物的比例趋于促进以打破休眠。
ACO控制种子萌发过程中乙烯的演化,是乙烯合成途径中的关键酶。本研究播种后60 d的种子中,ACO1的表达量均下调,且乙烯信号转导相关基因和大部分乙烯应答转录因子均下调表达,很可能导致乙烯的合成降低。推测乙烯很可能参与调控了金丝李种子的休眠与萌发。一些研究表明,乙烯作用于ABA代谢降低ABA含量,负调控ABA信号途径[49],在休眠解除过程中含量逐渐升高[21, 50]。但在本研究中,乙烯含量变化趋势与之相反,具体原因有待进一步研究。
转录因子是调控靶基因在特定的时间、空间和适当的强度进行表达的一类蛋白质分子。本研究发现,bZIP转录因子家族的CL9649.Contig2和CL9649.Contig4涉及到ABI5,而ABI5通过与ABA应答元件(ABA-responsive-element, ABRE)结合来激活种子中ABA介导的基因转录,在种子萌发阶段加强种子对外源ABA的应答[51]。在金丝李种子休眠解除时,与ABA和乙烯有关的TFs表达量变化较大,其中,与乙烯有关的差异表达的TFs达10个。无休眠的同属植物山竹(G. mangostana L.)种子在萌发过程中乙烯应答转录因子的表达量变化也较大[52],推测乙烯在藤黄属植物种子中的作用具有更深入的研究意义。而金丝李种子休眠解除过程中各激素之间的互作机制,及其在种子休眠和萌发中的信号网络、蛋白互作的体内证据及更多调控基因位点的发现都值得深入研究。
-
本研究推测,金丝李种子休眠解除过程是通过上调钙信号、次生代谢产物合成、核糖体和植物激素信号转导等基因相关的通路,下调糖酵解/糖异生、脂肪酸合成与降解、内质网中的蛋白质加工和氨基酸合成等基因相关的通路,同时伴随着上调GA合成或ABA分解的相关基因,下调ABA的合成或GA分解的相关基因,与有关转录因子等调控网络相配合以打破休眠。乙烯很可能也参与调控其种子的休眠与萌发。
珍稀濒危植物金丝李种子休眠解除的转录组分析
Transcriptomic Analysis of the Seed of Garcinia paucinervis, a Rare and Endangered Plant Species, During Dormancy Releasing
-
摘要:
目的 探讨珍稀濒危植物金丝李种子休眠解除的分子机理,挖掘其休眠解除相关的候选基因,以期为金丝李的育种、保护和利用提供有益参考。 方法 以新鲜成熟种子(OS)、播种60 d未萌发的种子(UG)及播种60 d已萌发的种子(GS)的胚和胚乳为材料进行转录组测序。 结果 (1)从3组样本中得到120 040个unigenes,其中,56 224个unigenes在KEGG数据库中获得注释;(2)GS相对OS有1 174个unigenes上调表达,2 232个下调,UG相对OS有849个unigenes上调,1 926个下调,GS相对UG有814个unigenes上调,670个下调;(3)筛选出差异量较大的122个基因中,显著上调的基因涉及钙信号、次生代谢产物合成、核糖体和植物激素信号转导等通路,显著下调的基因涉及糖酵解/糖异生、脂肪酸合成与降解、内质网中的蛋白质加工和氨基酸合成等通路;(4)筛选出40个涉及到与ABA、GA、生长素和乙烯等激素相关的DEGs,其中,ZEP、GA2ox1、GA2ox3、GAI、GID1、SnRK2.2和ACO1在种子休眠解除时显著下调表达,而CYP707A2、GA20ox1和GA3ox2显著上调表达。 结论 推测金丝李种子休眠解除过程中,通过上调钙信号、次生代谢产物合成等通路,下调糖酵解/糖异生、脂肪酸合成与降解等通路,同时伴随着上调GA合成及ABA分解的相关基因,下调ABA合成及GA分解的相关基因,与有关转录因子等调控网络相配合以打破休眠。 Abstract:Objective The objective of this study is to provide references for breeding, protection and utilization of Garcinia paucinervis through studying the molecular mechanisms of dormancy release and gaining the candidate genes associated with dormancy release. Method Transcriptome sequencing was carried out on three groups of samples: fresh mature seeds (OS), the ungerminated seeds after sowing for 60 days (UG) and the germinated seeds after sowing for 60 days (GS). Result (1) 120 040 unigenes were obtained from the three groups of samples, among which 56 224 were annotated in KEGG databases. (2) Compared with the OS, 1 174 up-regulated unigenes and 2 232 down-regulated unigenes were obtained in the GS. Compared with the OS, 849 up-regulated unigenes and 1926 down-regulated unigenes were obtained in the UG. Compared with the UG, 814 up-regulated unigenes and 670 down-regulated unigenes were obtained in the GS. (3) Among the 122 genes which were screened to be significantly differentially expressed, the significantly up-regulated genes involved pathways including calcium signal, biosynthesis of secondary metabolites, ribosome and plant hormone signal transduction, while the significantly down-regulated genes involved pathways including glycolysis/gluconeogenesis, fatty acid biosynthesis and degradation, protein processing in endoplasmic reticulum and biosynthesis of amino acids. (4) Forty DEGs were screened involving ABA, GA, auxin, ethylene and other hormones, among which ZEP, GA2ox1, GA2ox3, GAI, GID1, SnRK2.2, and ACO1 were significantly down-regulated during the dormancy release of seeds, while CYP707A2, GA20ox1, and GA3ox2 were significantly up-regulated. Conclusion The dormancy of G. paucinervis seeds might be broken by up-regulating pathways including calcium signal and biosynthesis of secondary metabolites, and down-regulating pathways including glycolysis/gluconeogenesis, fatty acid biosynthesis and degradation, etc., followed by up-regulating of related genes of GA synthesis and ABA decomposition, coupled with down-regulating of related genes of ABA synthesis and GA decomposition to interact with the regulatory networks of transcription factors during the dormancy release of G. paucinervis seeds. -
Key words:
- seed dormancy
- / breaking dormancy
- / plant hormone
- / recalcitrant seed
- / RNA-Seq
-
表 1 荧光定量引物列表
Table 1. List of primers sequence of selected genes
基因序列ID
Gene ID基因
Gene引物序列
Primer sequence (5′-3′)— Actin3 F: GGTCGTGACCTCACAGATGCTC R: GCTCCTGCTCATAGTCAAGAGC Unigene2356 ZEP F: CCCTCCTACTATTATTGC R: CTCTCTACAACATTCACA Unigene5532 GA2ox F: GGAGTTCACATGGTGTGAATACA R: GCTCTTTTCTCAAACATCCCAAG CL3961.Contig3 GA2ox3 F: CCTTCCATTAGTCATAAC R: CCTTCAAATCTGTCTTAG CL5127.Contig6 GAI F: GTGACATTAATGTACTCG R: CCTACTGTGTTCAATTAC CL595.Contig8 ACO1 F: GAGCAAATGGGATAGGAA R: CTCCAATGAAAGCATCTC CL722.Contig4 — F: TCACCACATAACATCATC R: ACGAGTTCATATATCTTCC CL11760.Contig2 — F: GGTAGGAATAGTCAACCCTC R: CGGGGATAACCAGCTTTA Unigene6386 — F: TTGGCTGGAAGAGAAAAG R: TAGGGATTGCATGTGAGA CL6007.Contig1 — F: AGGACTAACAAGCAACTC R: GGATGACCTTATGTGTGA CL7766.Contig1 — F: CGACAAGACACCCATTTTC R: TCCTCACTAACCCCATCA CL6835.Contig2 — F: GAGACTTCATAGCATGGA R: ATGGGAGGATGGATTATG CL1417.Contig18 — F: GGTGACAAACCTCTTCTA R: GGCTAAGTTCGTTGATGA 表 2 转录组测序的组装质量统计表
Table 2. Summary of the sequence assembly after Illumina sequencing
类型 Type OS1 OS2 OS3 UG1 UG2 UG3 GS1 GS2 GS3 总原始读序
Total Raw Reads79177304 86450202 40641518 84853156 63800684 59290094 59796216 58193988 66797080 总有效读序
Total Clean Reads68520564 76487390 40513070 75147324 57069130 54341546 54324762 52485156 58454902 总接头读序
Total Adapter Reads10596520 9896860 6127006 9641386 6683204 4901530 5424568 5664038 8292988 GC有效读序占比
Clean Reads GC/%46.72 47.28 45.70 47.34 47.25 47.22 47.49 47.44 46.95 Q20有效读序占比
Clean Reads Q20/%96.56 96.14 96.10 96.35 96.08 96.28 96.19 96.14 96.12 Q30有效读序占比
Clean Reads Q30/%92.38 91.62 90.81 91.97 91.48 91.83 91.67 91.56 91.55 表 3 金丝李种子的转录组unigene的KEGG代谢途径注释(≥ 3%)
Table 3. KEEG pathway annotation of unigenes of transcriptome for G. paucinervis seeds (≥ 3%)
编号
Serial number通路
Pathway数目(比率)
Count (ratio/%)通路标识号
Pathway ID1 代谢途径(Metabolic pathways) 13 020 (23.16) ko01100 2 次生代谢产物的生物合成(Biosynthesis of secondary metabolites) 6 727 (11.96) ko01110 3 抗生素的生物合成(Biosynthesis of antibiotics) 3 533 (6.28) ko01130 4 不同环境中的微生物代谢(Microbial metabolism in diverse environments) 3 492 (6.21) ko01120 5 碳代谢(Carbon metabolism) 2 176 (3.87) ko01200 6 氨基酸的生物合成(Biosynthesis of amino acids) 1 915 (3.41) ko01230 7 EB病毒感染(Epstein-Barr virus infection) 1 904 (3.39) ko05169 8 肺结核(Tuberculosis) 1 787 (3.18) ko05152 9 弓形虫病(Toxoplasmosis) 1 753 (3.12) ko05145 10 麻疹(Measles) 1 688 (3.00) ko05162 -
[1] Finch-Savage W E, Leubner-Metzger G. Seed dormancy and the control of germination[J]. New Phytologist, 2006, 171(3): 501-523. doi: 10.1111/j.1469-8137.2006.01787.x [2] Cadman C S C, Toorop P E, Hilhorst H W M, et al. Gene expression profiles of Arabidopsis Cvi seeds during dormancy cycling indicate a common underlying dormancy control mechanism[J]. The Plant Journal, 2006, 46(5): 805-822. doi: 10.1111/j.1365-313X.2006.02738.x [3] Chiwocha S D S, Cutler A J, Abrams S R, et al. The etr1‐2 mutation in Arabidopsis thaliana affects the abscisic acid, auxin, cytokinin and gibberellin metabolic pathways during maintenance of seed dormancy, moist‐chilling and germination[J]. Plant Journal, 2005, 42(1): 35-48. doi: 10.1111/j.1365-313X.2005.02359.x [4] Li Z, Zhang J, Liu Y, et al. Exogenous auxin regulates multi-metabolic network and embryo development, controlling seed secondary dormancy and germination in Nicotiana tabacum L.[J]. BMC Plant Biology, 2016, 16(1): 1-15. doi: 10.1186/s12870-015-0700-5 [5] Magwa R A, Zhao H, Xing Y. Genome-wide association mapping revealed a diverse genetic basis of seed dormancy across subpopulations in rice (Oryza sativa L.)[J]. BMC genetics, 2016, 17(1): 28. doi: 10.1186/s12863-016-0340-2 [6] Qi J, Zheng N, Zhang B, et al. Mining genes involved in the stratification of Paris polyphylla seeds using high-throughput embryo Transcriptome sequencing[J]. BMC genomics, 2013, 14(1): 358. doi: 10.1186/1471-2164-14-1 [7] 张成才, 张子璇, 张文静, 等. 利用转录组测序分析与华重楼种子休眠解除相关差异基因[J]. 中国中药杂志, 2020, 45(8):1893-1900. [8] Cao D, Xu H, Zhao Y, et al. Transcriptome and degradome sequencing reveals dormancy mechanisms of Cunninghamia lanceolata seeds[J]. Plant physiology, 2016, 172(4): 2347-2362. doi: 10.1104/pp.16.00384 [9] Song Q, Cheng S, Chen Z, et al. Comparative transcriptome analysis revealing the potential mechanism of seed germination stimulated by exogenous gibberellin in Fraxinus hupehensis[J]. BMC plant biology, 2019, 19(1): 1-17. doi: 10.1186/s12870-018-1600-2 [10] Kanjana W, Suzuki T, Ishii K, et al. Transcriptome analysis of seed dormancy after rinsing and chilling in ornamental peaches (Prunus persica (L.) Batsch)[J]. BMC genomics, 2016, 17(1): 575. doi: 10.1186/s12864-016-2973-y [11] Wang D, Gao Z, Du P, et al. Expression of ABA metabolism-related genes suggests similarities and differences between seed dormancy and bud dormancy of peach (Prunus persica)[J]. Frontiers in Plant Science, 2016, 6: 1-17. [12] Ma Y, Cui J, Lu X, et al. Transcriptome analysis of two different developmental stages of Paeonia lactiflora seeds[J]. International Journal of Genomics, 2017, 2017(2): 1-10. [13] 冷 容, 胡彦婷, 周艳丽, 等. 人参种胚不同后熟发育阶段比较转录组学分析[J]. 分子植物育种, 2020, 18(17):5638-5649. [14] 宁 伟, 范文丽, 李宏博, 等. 变温及GA3处理对辽东楤木种子解除休眠过程中代谢调控的影响[J]. 园艺学报, 2006, 33(3):649-652. doi: 10.3321/j.issn:0513-353X.2006.03.041 [15] 王昊一, 李宇玲, 朱 乐, 等. 油菜种子休眠性对脂肪酸积累的影响及其分子机制[J]. 浙江大学学报(农业与生命科学版), 2017, 43(4):397-403. [16] Yang K, Yang L, Fan W, et al. Illumina‐based transcriptomic analysis on recalcitrant seeds of Panax notoginseng for the dormancy release during the after‐ripening process[J]. Physiologia plantarum, 2019, 167(4): 597-612. doi: 10.1111/ppl.12904 [17] Masanori O, Ayuko K, Mistunori S, et al. CYP707A1 and CYP707A2, which encode abscisic acid 8′-Hydroxylases, are indispensable for proper control of seed dormancy and germination in Arabidopsis[J]. Plant Physiology, 2006, 141(1): 97-107. doi: 10.1104/pp.106.079475 [18] Hauvermale A L, Ariizumi T, Steber C M. Gibberellin signaling: a theme and variations on DELLA repression[J]. Plant Physiology, 2012, 160(1): 83-92. doi: 10.1104/pp.112.200956 [19] 孙同玉. 西洋参种子休眠解除与萌发分子机理研究[D]. 北京: 北京协和医学院, 2015. [20] Griffiths J, Murase K, Rieu I, et al. Genetic characterization and functional analysis of the GID1 gibberellin receptors in Arabidopsis[J]. Plant Cell, 2006, 18(12): 3399-3414. doi: 10.1105/tpc.106.047415 [21] 陈 静, 江 玲, 王春明, 等. 花生种子休眠解除过程中相关基因的表达分析[J]. 作物学报, 2015, 41(6):845-860. [22] Calvo A P, Nicolás C, Lorenzo O, et al. Evidence for positive regulation by gibberellins and ethylene of ACC oxidase expression and activity during transition from dormancy to germination in Fagus sylvatica L. seeds[J]. Journal of Plant Growth Regulation, 2004, 23(1): 44-53. [23] 张俊杰, 韦 霄, 柴胜丰, 等. 珍稀濒危植物金丝李种子的休眠机理[J]. 生态学杂志, 2018, 37(5):1371-1381. [24] 张俊杰, 柴胜丰, 王满莲, 等. 珍稀濒危植物金丝李种子脱水耐性和贮藏特性[J]. 广西植物, 2019, 39(2):199-208. doi: 10.11931/guihaia.gxzw201802027 [25] 张俊杰, 柴胜丰, 韦 霄, 等. 珍稀濒危植物金丝李种子的萌发特性[J]. 林业科学, 2018, 54(4):174-185. doi: 10.11707/j.1001-7488.20180420 [26] 张俊杰, 韦 霄, 吴少华, 等. 金丝李果实、种子形态分化及外源物质对种子萌发和幼苗生长的影响[J]. 广西植物, 2018, 38(4):509-520. doi: 10.11931/guihaia.gxzw201708007 [27] Zhang J, Wei X, Chai S, et al. Genetic diversity and population structure of Garcinia paucinervis, an endangered species using microsatellite markers[J]. Conservation Genetics, 2019, 20(4): 837-849. doi: 10.1007/s10592-019-01176-2 [28] 刘 伟, 郭光艳, 秘彩莉. 转录组学主要研究技术及其应用概述[J]. 生物学教学, 2019, 44(10):2-5. doi: 10.3969/j.issn.1004-7549.2019.10.001 [29] Bentsink L, Koornneef M. Seed dormancy and germination[J]. The Arabidopsis Book/American Society of Plant Biologists, 2008, e0119: 1-18. [30] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2− ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. doi: 10.1006/meth.2001.1262 [31] Hiroyuki N, Georgew B, Jderek B. Germination—still a mystery[J]. Plant Science, 2010, 179(6): 574-581. doi: 10.1016/j.plantsci.2010.02.010 [32] Simmonds J A, Simpson G M. Regulation of the Krebs cycle and PPP activities in the control of dormancy in Avena fatua[J]. Canadian Journal of Botany, 1972, 50(5): 1041-1048. doi: 10.1139/b72-127 [33] Zhang X, Liu G, Li T, et al. Differential proteome analysis of mature and germinated seeds of Magnolia sieboldii K. Koch[J]. Trees, 2014, 28(3): 859-870. doi: 10.1007/s00468-014-0998-x [34] 苏 贺, 詹延廷, 李 昊, 等. GC-FID技术分析巫山淫羊藿种子休眠解除过程中脂肪酸含量变化[J]. 中国农业大学学报, 2017, 22(1):19-28. doi: 10.11841/j.issn.1007-4333.2017.01.03 [35] 代玉荣, 吴灵东, 张 鹏. 等. 水曲柳种子次生休眠解除过程中的物质转化与内源激素变化[J]. 东北林业大学学报, 2011, 39(5):17-19. doi: 10.3969/j.issn.1000-5382.2011.05.006 [36] Lindberg S, Kader M A, Yemelyanov V. Calcium signalling in plant cells under environmental stress[J]. International Journal of Technology & Human Interaction, 2012, 8(3): 46-53. [37] Somyong S, Munkvold J D, Tanaka J, et al. Comparative genetic analysis of a wheat seed dormancy QTL with rice and Brachypodium identifies candidate genes for ABA perception and calcium signaling[J]. Functional & integrative genomics, 2011, 11(3): 479-490. [38] Leckie C P, Mcainsh M R, Allen G J, et al. Abscisic acid-induced stomatal closure mediated by cyclic ADP-ribose[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(26): 15837-15842. doi: 10.1073/pnas.95.26.15837 [39] 许 涛, 李天来, 齐明芳. 钙处理对乙烯诱导的番茄离体花柄脱落的抑制作用[J]. 园艺学报, 2007, 34(2):366-370. doi: 10.3321/j.issn:0513-353X.2007.02.019 [40] Schwarz N, Armbruster U, Iven T, et al. Tissue-specific accumulation and regulation of zeaxanthin epoxidase in Arabidopsis reflect the multiple functions of the enzyme in plastids[J]. Plant and Cell Physiology, 2015, 56(2): 346-357. doi: 10.1093/pcp/pcu167 [41] Elizabeth F. The ecology and physiology of viviparous and recalcitrant seeds[J]. Annual Review of Ecology and Systematics, 2000, 31: 107-138. doi: 10.1146/annurev.ecolsys.31.1.107 [42] Argyris J, Dahal P, Truco M J, et al. Genetic analysis of lettuce seed thermoinhibition[J]. Acta Horticulturae, 2008, 782: 23-34. [43] Eiji N, Masanori O, Kiyoshi T, et al. Abscisic acid and the control of seed dormancy and germination[J]. Seed Science Research, 2010, 20(2): 55-67. doi: 10.1017/S0960258510000012 [44] Wang X, Wang L, Wang Y, et al. Arabidopsis PCaP2 plays an important role in chilling tolerance and aba response by activating CBF- and SnRK2-mediated transcriptional regulatory network[J]. Frontiers in Plant Science, 2018, 9: 1-13. doi: 10.3389/fpls.2018.00001 [45] Ogawa M, Hanada A, Yamauchi Y, et al. Gibberellin biosynthesis and response during Arabidopsis seed germination[J]. Plant Cell, 2003, 15(7): 1591-1604. doi: 10.1105/tpc.011650 [46] Qi J, Sun P, Liao D, et al. Transcriptomic analysis of American ginseng seeds during the dormancy release process by RNA-Seq[J]. PLoS One, 2015, 10(3): e0118558. doi: 10.1371/journal.pone.0118558 [47] Dill A, Jung H S, Sun T P. The DELLA motif is essential for gibberellin-induced degradation of RGA[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(24): 14162-14167. doi: 10.1073/pnas.251534098 [48] Wu J, Kong X, Wan J, et al. Dominant and pleiotropic effects of a GAI gene in wheat results from a lack of interaction between DELLA and GID1[J]. Plant Physiology, 2011, 157(4): 2120-2130. doi: 10.1104/pp.111.185272 [49] Kucera B, Cohn M A, Leubnermetzger G. Plant hormone interactions during seed dormancy release and germination[J]. Seed Science Research, 2005, 15(4): 281-307. doi: 10.1079/SSR2005218 [50] Hermann K, Meinhard J, Dobrev P, et al. 1-Aminocyclopropane-1-carboxylic acid and abscisic acid during the germination of sugar beet (Beta vulgaris L.): a comparative study of fruits and seeds[J]. Journal of Experimental Botany, 2007, 58(11): 3047-3060. doi: 10.1093/jxb/erm162 [51] Lopez-Molina L, Mongrand S, Chua N H. A Postgermination developmental arrest checkpoint is mediated by abscisic acid and requires the ABI5 transcription factor in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(8): 4782-4787. doi: 10.1073/pnas.081594298 [52] Goh H H, Bakar S A, Azlan N D K, et al. Transcriptional reprogramming during Garcinia-type recalcitrant seed germination of Garcinia mangostana[J]. Scientia Horticulturae, 2019, 257: 108727. doi: 10.1016/j.scienta.2019.108727 -




 下载:
下载: