-
果色是果实品质的重要指标和影响商品价值的重要因素,是育种者和消费者共同关注的一个重要性状[1];同时,对于以食果动物为传播媒介的植物来说,果色还是影响物种分布和演化的重要因素之一[2-4]。鉴于果色及其物质基础在植物生长发育、果实品质、膳食营养和疾病健康等方面的重要性,植物果色的形成机制及调控始终备受关注和重视,对植物果色性状的改良也是育种者始终追求的目标之一。
植物呈色的物质基础是植物色素,主要包括叶绿素、类黄酮、类胡萝卜素和甜菜素。叶绿素的主要功能体现在通过光合作用促进植物生长发育,后三者则在植物体中以次生代谢物形式存在,结构和功能多样[5],其中,类胡萝卜素是自然界广泛存在的一类脂溶性萜类化合物,是人类和动物食物营养的重要来源,是维生素A合成的前体物质[6-7],其自由基清除能力和抗氧化活性有助于预防和治疗各类癌症、心血管疾病、呼吸系统疾病和眼病等[8-10]。在植物中,类胡萝卜素作为次生代谢物参与植物生命过程,具有重要的生物学功能[11-13]。在植物绿色组织中,类胡萝卜素作为基础性代谢物其成分和积累量相对稳定[11],在植物非绿色组织中,类胡萝卜素作为特化性代谢物在物种间甚至物种内存在巨大差异,其大量积累使许多花、果实和根呈现鲜艳的橙色、黄色和红色[14]。研究表明,许多重要经济作物的果色形成均与类胡萝卜素大量积累有关[5, 14-17]。在过去10年里,超过40个涉及类胡萝卜素生物合成的功能基因和转录调控因子已经从不同的物种和组织类型中被鉴定出来[18],但几乎每个研究物种、每类组织类型都利用了不同的转录调节组来进行类胡萝卜素的生物合成[19]。
花楸属(Sorbus L.)隶属蔷薇科(Rosaceae)苹果亚科(Maloideae),广泛分布于北温带,全球有260余种[20-25],有较高的观赏、食用和药用价值[23, 26-32]。花楸属植物果色变异丰富,有学者认为花楸果实颜色是最重要的形态学分类性状[20, 23],因此,花楸属非常适合用于研究植物果实颜色多样性的形成机制。一些花楸属植物及品种果实中富含大量类胡萝卜素,主要成分为β-胡萝卜素[33-34],果实的着色程度通常与β-胡萝卜素的积累量正相关[35-36],但关于花楸果色形成机制的研究鲜有报道。
我国花楸属植物有70余种[22-23, 25],是全球该属资源最丰富的国家之一[37-38]。花楸树(S. pohuashanensis (Hance) Hedl.)和北京花楸(S. discolor (Maxim.) Maxim.)分别为花楸属复叶组(Sect. Sorbus)百华系(Ser. Pohuashanenses Yü)和两色系(Ser. Discolores Yü)乔木,是我国北方分布范围较广的两个花楸属物种[22],二者有重叠分布[22, 39]。花楸树是一种极具观赏、食用及药用等开发利用价值的乡土树种[40-41],北京花楸则可做为改良花楸耐日灼性的优良育种材料。笔者前期对花楸树和北京花楸成熟果实所含营养物质和药用成分进行了比较分析,发现果色为红色或桔红色的花楸树中类胡萝卜素积累量显著高于果色为白色的北京花楸[41],但对类胡萝卜素主要成分及其积累模式与果色关系并不清楚。
液相色谱串联质谱(LC-MS/MS)能精确定量类胡萝卜素,被广泛应用于检测植物果实类胡萝素与植物果色形成相关性等方面的研究[16-17, 42]。因此,本研究利用LC-MS/MS的方法,对花楸树和北京花楸果实发育不同阶段的类胡萝卜素成分进行定性定量检测,分析花楸树和北京花楸果实中类胡萝卜素积累模式差异及其与果色形成的关系,有助于揭示花楸果色形成机理。
-
选择天然共同分布于河北驼梁山的花楸树(简称SP)和北京花楸(简称SD)为研究对象。为了分析果实不同发育阶段果色的变化与类胡萝卜素积累模式的关系,需分别对类胡萝卜素积累量的时序差异和种间差异水平进行比较分析,具体比较分组设计为:分别对每种花楸各自果实发育3个不同阶段的样本进行两两比较分析;再分别对每个果实发育时期2种花楸进行种间比较分析。因此,依据果色变化,分别在2018年9月1、14、30日对花楸树和北京花楸3个不同发育阶段的果实进行采样,每次分别随机选择花楸树和北京花楸各9株生长良好的植株,每株树均采集向阳面无明显病虫害的果实10个,分别将每种花楸每3个随机组合的植株果实进行混合作为1个检测样本重复,每个阶段每种花楸各3个生物学重复,3个阶段2种花楸共计18份果实供试样本。采集的果实材料快速用无菌水清洗、擦干并立即投入液氮保存以备后续试验使用。
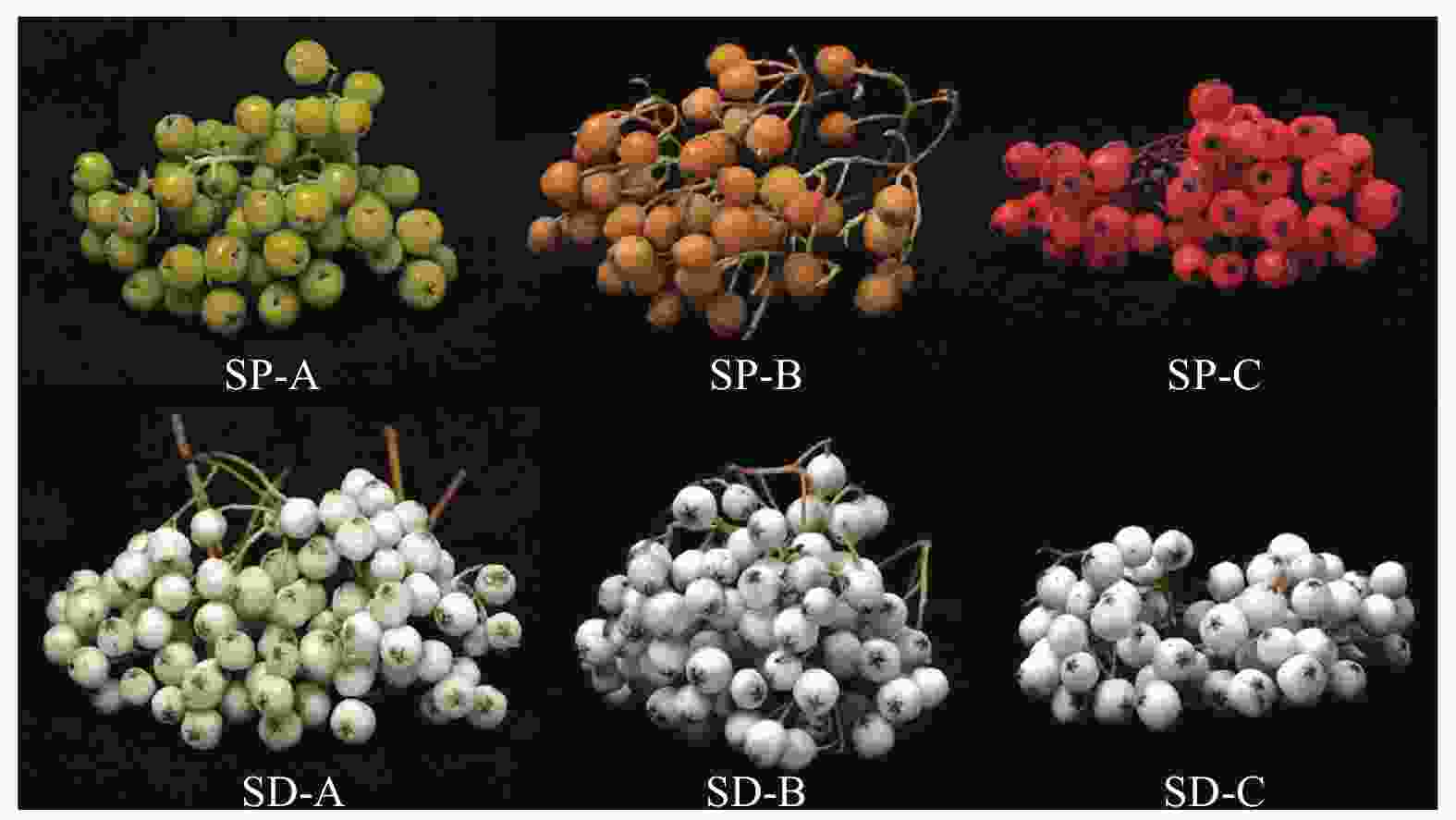
采集的果实样本果色时序变化(图1)表明:发育阶段A的2种花楸果实均没有完全褪绿,花楸树果实为黄绿色,北京花楸果实为浅白绿色;发育阶段B的2种花楸果实均已褪绿,花楸树果实为浅橙黄色,还未呈现为成熟的颜色,北京花楸果实为白色,已经是成熟的颜色;发育阶段C的花楸树果实基本成熟,果实为桔红色,北京花楸果实维持白色。
-
采用改良Xiong等[43]的方法提取18个供试的花楸果实样本及对照番茄果实样本的类胡萝卜素,抽提时间为20 min,重复抽提1次,复溶后过0.22 μm滤膜,保存于棕色进样瓶,用于LC-MS/MS分析。
-
采用高效液相色谱仪(HPLC, Shim-pack UFLC140 SHIMADZU CBM30A system; Shimadzu,Kyoto,Japan)串联质谱仪(MS, 6500 Q TRAP; Applied Biosystems, Foster City,CA,USA)的方法对植物中主要的18种类胡萝卜素进行定性和定量分析,其中,八氢番茄红素和六氢番茄红素为无色类胡萝卜素,其余16种为显色类胡萝卜素。液相色谱条件根据Geyer等[44]的方法进行优化。回收率验证该方法符合国家标准GB/T 27404—2008《实验室质量控制规范 食品理化检测》和GB/T 27417—2017《合格评定化学分析方法确认和验证指南》。
色谱柱,YMC C30(3 μm,2 mm×100 mm);流动相A:甲醇和乙腈体积比3:1加入0.01%BHT,加入0.1%甲酸;流动相B:甲基叔丁基醚加入0.01%BHT;洗针液:甲醇;洗脱梯度:0 min 100∶0(V/V),3 min 100∶0(V/V),6 min 58∶42(V/V),8 min 20∶80(V/V),9 min 5∶95(V/V),10 min 100∶0(V/V),11 min 100∶0(V/V);流速0.8 mL·min−1;柱温28℃;进样量2 μL。
质谱条件主要为:大气压化学离子源(Atmospheric pressure chemical iosziaa-lion,APCI)温度350℃,帘气(Curtain gas,CUR)25 psi。在Q-Trap 6500中,根据优化的去簇电压(Declustering potential,DP)和碰撞能(Collision energy,CE)对每个离子对进行扫描检测。
-
本研究采用外标法进行定性定量分析。分别配制不同浓度的类胡萝卜素标准品(色谱纯,BioBioPha,Sigma-Aldrich)溶液,根据1.2色谱质谱采集条件,获取各个浓度标准品对应的质谱峰出峰条件和信号强度等信息,构建类胡萝卜素定性分析数据库,绘制不同类胡萝卜素的标准曲线,用于定量分析[45]。
-
依据1.2色谱质谱采集条件对全部样本进行LC-MS/MS分析。利用软件Analyst 1.6.3分析质谱数据[45]。根据类胡萝卜素保留时间与离子对的信息,对每种类胡萝卜素在不同样本中检测到的质谱峰进行校正,以确保定性定量的准确。通过对每个样本质谱检测分析的总离子流图进行重叠展示分析,判断类胡萝卜素检测的可重复性。
根据类胡萝卜素标准品离子对数据库,对质谱检测的数据进行定性分析。根据标准曲线得到线性方程,将类胡萝卜素的积分峰面积代入标准曲线线性方程进行计算,得到测定样本中类胡萝卜素的绝对含量数据,并分析类胡萝卜素主要成分。
-
采用差异倍数(fold change, FC)和t检验结合的方法对类胡萝卜素积累量的时序和种间差异分别进行分析。类胡萝卜素的差异显著性筛选标准为FC≥2或≤0.5,并且P≤0.05[16-17, 42]。当FC>1时,表明vs后的样本比vs前的样本中类胡萝卜素积累量增加;当FC<1时,表明vs后的样本比vs前的样本中类胡萝卜素积累量减少。结合样本果色性状,进一步分析类胡萝卜素积累模式与花楸果色变化的关系。
-
对18种类胡萝卜素的定性分析表明,花楸树与北京花楸果实中类胡萝卜素成分分别为12种和7种(表1),六氢番茄红素、ε-胡萝卜素、花药黄质、虾青素、辣椒红素以及辣椒玉红素这6种类胡萝卜素在2种花楸果实发育的3个阶段中均未检测到。在花楸树果实发育3个阶段均检测到10种类胡萝卜素:八氢番茄红素、β-胡萝卜素、β-隐黄质、玉米黄质、紫黄质、γ-胡萝卜素、α-胡萝卜素、α-隐黄质、叶黄素和β-阿朴胡萝卜素醛。在北京花楸果实发育3个阶段均检测到6种类胡萝卜素:β-胡萝卜素、β-隐黄质、玉米黄质、紫黄质、八氢番茄红素和叶黄素。新黄质仅在花楸树果实发育阶段A中检测到,番茄红素仅在花楸树果实发育阶段C中检测到;γ-胡萝卜素仅在北京花楸果实发育阶段B中检测到。
表 1 花楸树(SP)与北京花楸(SD)类胡萝卜素定性定量检测结果统计表(鲜质量)
Table 1. Statistical table of qualitative and quantitative detection results of carotenoids of S. pohuashanensis (SP)and S. discolor (SD)(FW)
mg·kg−1 成分
Components树种
Species阶段A
Stage A阶段B
Stage B阶段C
Stage Cα-胡萝卜素 α-Carotene SP 1.35 ± 0.07 2.18 ± 0.12 2.79 ± 0.19 SD — — — α-隐黄质 α-Cryptoxanthin SP 0.06 ± 0.01 0.17 ± 0.01 0.16 ± 0.01 SD — — — β-阿朴胡萝卜素醛 β-Apocarotenal SP 0.01 ± 0.00 0.01 ± 0.00 0.02 ± 0.00 SD — — — β-胡萝卜素 β-Carotene SP 33.40 ± 1.35 51.93 ± 1.94 81.40 ± 2.27 SD 1.38 ± 0.06 0.60 ± 0.02 0.33 ± 0.00 β-隐黄质 β-Cryptoxanthin SP 1.58 ± 0.04 6.04 ± 0.42 8.28 ± 0.55 SD 0.07 ± 0.01 0.05 ± 0.00 0.01 ± 0.00 γ-胡萝卜素 γ-Carotene SP 0.10 ± 0.01 0.27 ± 0.01 1.25 ± 0.04 SD — 0.01 ± 0.00 — 番茄红素 Lycopene SP — — 0.10 ± 0.00 SD — — — 新黄质 Neoxanthin SP 0.76 ± 0.08 — — SD — — — 叶黄素 Lutein SP 17.93 ± 1.66 5.35 ± 0.25 1.67 ± 0.06 SD 3.55 ± 0.17 1.33 ± 0.06 0.78 ± 0.04 玉米黄质 Zeaxanthin SP 1.81 ± 0.09 1.81 ± 0.11 0.83 ± 0.02 SD 0.10 ± 0.00 0.12 ± 0.01 0.01 ± 0.00 紫黄质 Violaxanthin SP 0.75 ± 0.07 0.15 ± 0.00 0.17 ± 0.01 SD 0.18 ± 0.02 0.10 ± 0.00 0.02 ± 0.00 八氢番茄红素 (E/Z)-Phytoene SP 3.33 ± 0.08 5.25 ± 0.24 5.89 ± 0.38 SD 1.34 ± 0.08 2.32 ± 0.15 1.52 ± 0.08 合计 Total SP 61.08 ± 0.31 73.67 ± 0.28 103.82 ± 0.36 SD 6.61 ± 0.06 4.52 ± 0.03 2.68 ± 0.02 注:平均值 ± 标准差;n = 3;“-”为未检测到。下同。
Notes: average value ± standard error (SE); n = 3; “-”: not detected.The same below. -
花楸树果实发育3个阶段显色的类胡萝卜素比例较高(图2),其中,β-胡萝卜素在果实发育阶段A、B、C的积累量分别为33.40、51.93、81.40 mg·kg−1(表1),其比例也逐渐升高(图2),分别为54.68%,70.97%和79.36%。FC(表2)和t检验(表3)分析表明:积累量随果实发育时序性显著增加的β-胡萝卜素是花楸树果实类胡萝卜素的主要成分,其次是β-隐黄质,其积累量分别为1.58、6.04、8.28 mg·kg−1(表1),比例分别为2.59%、8.26%和8.07%(图2),时序性增加显著(表2);叶黄素、玉米黄质和紫黄质积累量(表1)和比例(图2)时序性下降,其中叶黄素积累量从17.93 mg·kg−1下降到1.67 mg·kg−1(表1),比例从29.36%下降到1.63%(图2),时序差异显著(表2),对花楸树果实发育初期果色可能有一定影响;花楸树果实发育3个阶段,其它8种类胡萝卜素积累量和比例均较低(表1),对果色影响较小。无色的八氢番茄红素积累量时序性显著增加(表2),其比例先升高后降低(图2)。因此,花楸树果实中类胡萝卜素主要成分为β-胡萝卜素,同时还富含β-隐黄质,花楸树果实显色程度主要与β-胡萝卜素积累模式显著正相关。

图 2 花楸树(SP)与北京花楸(SD)果实3个生长阶段类胡萝卜素成分比例
Figure 2. Composition ratio of carotenoids in the sampled fruits of S. pohuashanensis (SP)and S. discolor (SD) at three developmental stages
表 2 花楸树(SP)与北京花楸(SD)类胡萝卜素积累量时序及种间差异倍数统计表
Table 2. Timing and species fold changes of carotenoid accumulation in fruits of S. pohuashanensis (SP)and S. discolor (SD)
类胡萝卜素
CarotenoidSP SD SD-A vs SP-A SD-B vs SP-B SD-C vs SP-C A vs B B vs C A vs C A vs B B vs C A vs C α-胡萝卜素 α-Carotene 1.61 1.28 2.06 — — — — — — α-隐黄质 α-Cryptoxanthin 2.85 0.94 2.68 — — — — — — β-阿朴胡萝卜素醛 β-Apocarotenal 2.85 0.94 2.68 — — — — — — β-胡萝卜素 β-Carotene 1.55 1.57 2.44 0.44 0.54 0.24 24.26 86.12 248.17 β-隐黄质 β-Cryptoxanthin 3.82 1.37 5.23 0.68 0.30 0.20 22.87 127.95 588.63 γ-胡萝卜素 γ-Carotene 2.69 4.58 12.30 — — — — 30.10 — 番茄红素 Lycopene — 30.94 — — — — — — — 叶黄素 Lutein 0.30 0.31 0.09 0.37 0.59 0.22 5.06 4.04 2.13 玉米黄质 Zeaxanthin 1.00 0.46 0.46 1.14 0.12 0.14 17.38 15.21 56.26 紫黄质 Violaxanthin 0.20 1.17 0.23 0.57 0.20 0.11 4.22 1.45 8.55 八氢番茄红素 Phytoene 1.58 1.12 1.77 1.73 0.66 1.14 2.49 2.27 3.87 -
北京花楸果实中每一种显色类胡萝卜素的积累量(表1)和比例(图2)均随果实发育时序性显著下降(表2),无色的八氢番茄红素比例则逐渐升高。北京花楸果实发育3个阶段八氢番茄红素积累量分别为1.34、2.32、1.52 mg·kg−1(表1),比例分别为20.26%、51.23%和56.74%;而显色类胡萝卜素积累量逐渐减少,比例从79.74%下降到43.26%,其中,叶黄素积累量分别为3.55、1.33、0.78 mg·kg−1,比例分别为53.62%、29.34%和29.22%,是北京花楸果实显色类胡萝卜素的主要成分;β-胡萝卜素次之,积累量分别1.38、0.60、0.33 mg·kg−1,比例分别为20.81%、13.33%和12.22%。其它4种显色类胡萝卜素积累量则较低。因此,北京花楸果实中类胡萝卜素主要成分为叶黄素,而北京花楸果色褪绿后持续显现为白色,可能与显色类胡萝卜素积累量时序性降低有关。
-
花楸树果实发育3个阶段类胡萝卜素和显色类胡萝卜素积累量均高于北京花楸。随着果实生长发育,花楸树总类胡萝卜素及显色类胡萝卜素积累量均逐渐增加,显色类胡萝卜素比例均较高;而北京花楸则相反,总类胡萝卜素和显色类胡萝卜素积累量均逐渐减少,显色类胡萝卜素比例较低且逐渐降低。花楸树果实发育3个阶段类胡萝卜素总积累量分别为61.08、73.67、103.82 mg·kg−1,其中,显色的类胡萝卜素总积累量分别为57.75、68.42、97.93 mg·kg−1,比例分别为94.55%、92.87%和94.33%。北京花楸果实发育3个阶段类胡萝卜素总积累量分别为6.61、4.52、2.68 mg·kg−1,其中,显色的类胡萝卜素总积累量分别为5.27、2.20、1.16 mg·kg−1,比例分别为79.73%、48.67%和43.28%。花楸树果实发育3个阶段类胡萝卜素及显色类胡萝卜素积累量分别是北京花楸的9、16、39倍和11、30、83倍。FC(表2)和t检验(表3)分析表明:果实发育3个阶段,花楸树果实中的β-胡萝卜素、β-隐黄质、叶黄素、玉米黄素、紫黄质以及无色的八氢番茄红素积累量均分别显著高于北京花楸。
表 3 花楸树(SP)与北京花楸(SD)类胡萝卜素积累量时序及种间差异t检验(P值)统计表
Table 3. T testing(P value) for timing and species differences of carotenoid accumulation in fruits of S. pohuashanensis (SP)and S. discolor (SD)
类胡萝卜素
CarotenoidSP SD SD-A vs SP-A SD-B vs SP-B SD-C vs SP-C A vs B B vs C A vs C A vs B B vs C A vs C α-胡萝卜素 α-Carotene 0.007 0.063 0.009 — — — — — — α-隐黄质 α-Cryptoxanthin 0.005 0.544 0.001 — — — — — — β-阿朴胡萝卜素醛 β-Apocarotenal 0.021 0.126 0.032 — — — — — — β-胡萝卜素 β-Carotene 0.002 0.001 0.000 0.002 0.006 0.003 0.00 0 0.00 β-隐黄质 β-Cryptoxanthin 0.008 0.036 0.006 0.043 0.002 0.008 0.00 0 0.00 γ-胡萝卜素 γ-Carotene 0.000 0.001 0.000 — — — — 0 — 番茄红素 Lycopene — 0.001 — — — — — — — 叶黄素 Lutein 0.015 0.003 0.010 0.003 0.002 0.003 0.01 0 0.00 玉米黄质 Zeaxanthin 0.982 0.011 0.007 0.308 0.009 0.000 0.00 0 0.00 紫黄质 Violaxanthin 0.011 0.102 0.011 0.042 0.000 0.011 0.01 0 0.00 八氢番茄红素 Phytoene 0.010 0.236 0.017 0.010 0.018 0.170 0.00 0 0.01 -
花楸树果实中类胡萝卜素主要成分为β-胡萝卜素,在与花楸树亲缘关系较近且果色相似的北欧花楸(S. aucuparia)中类胡萝卜素主要成分也为β-胡萝卜素[33-34]。花楸树果实显色程度与β-胡萝卜素积累模式显著正相关,而北京花楸果实中β-胡萝卜素以及其他显色类胡萝卜素积累量显著低于花楸树,并随北京花楸果实发育时序性下降。由此推测,花楸属植物果实的着色程度主要与β-胡萝卜素积累模式显著正相关。该结果在Mikulic-Petkovsek等[35]和Zymone等[36]研究中也得到了验证,在花楸品种‘Konzentra’(橙色)、‘Alaja krupnaja’(亮橙色)和‘Fructo Lutea’(黄色)果实中含有大量的β-胡萝卜素等类胡萝卜素物质,而在3个北欧花楸与北京花楸的杂交品种‘Kirsten Pink’(粉色)、‘Red Tip’(局部浅红)和‘White Swan’(白色)中类胡萝卜素积累量均较低。
六氢番茄红素和番茄红素是类胡萝卜素生物合成路径上游主链物质[11, 14],γ-胡萝卜素是β-胡萝卜素底物[11, 14],但这些物质未被检测到或仅在花楸树或北京花楸果实发育某些阶段检测到少量积累,这可能与相关功能基因或调控因子表达量模式有关,因此,需从转录水平展开进一步研究。
除了类胡萝卜素, 花楸树和北京花楸及其他花楸属植物果实中的植物色素还包含花青苷等类黄酮物质[35-36, 41, 46],花楸属植物果实果色形成可能同时受类胡萝卜素和花青苷影响,因此,还应对花楸树和北京花楸果实中花青苷积累模式展开分析,结合本研究结果,共同阐明花楸树和北京花楸果色形成的关键植物色素物质。此外,类胡萝卜素和花青苷等天然植物色素均属代谢产物,是果实颜色表型的基础和基因组下游的产物。目前,表型、代谢组、蛋白质组、转录组、基因组的多组学研究成为基础科学研究的趋势,并已应用于多种植物果色形成机理研究中[15-17, 42]。因此,基于多组学的相关研究和联合分析将更有助于揭示花楸属植物果色形成机理。
-
花楸树果实中类胡萝卜素种类和积累量均高于北京花楸。花楸树果实中类胡萝卜素主要成分为β-胡萝卜素,其积累量随果实发育时序显著增加,花楸树果实显色程度与其积累量的增加显著正相关;北京花楸果实中类胡萝卜素积累量显著低于花楸树,并随果实发育时序性下降,是其果实为白色而不显其他颜色的主要原因之一。
致谢:
本项研究的试验样本采集得到张涛和孙佳伟的协助,在此表示感谢。
2种花楸果实类胡萝卜素成分与果色关系
Relationship between Carotenoid Component and Fruit Color of Two Sorbus Species
-
摘要:
目的 对花楸树与北京花楸果实发育3个阶段类胡萝卜素成分进行代谢组学分析,为揭示花楸果实显色机理奠定基础。 方法 利用高效液相色谱串联质谱法对花楸树和北京花楸果实类胡萝卜素进行定性和定量检测,对类胡萝卜素成分和积累量的种内时序性差异和同时序的种间差异及其与果色的关系进行分析。 结果 定性分析表明:花楸树和北京花楸果实分别含12种和7种类胡萝卜素。定量分析表明:花楸树果实发育3个阶段类胡萝卜素积累量均显著高于北京花楸,花楸树类胡萝卜素积累量随果实发育时序变化显著升高。β-胡萝卜素是花楸树类胡萝卜素的主要成分,积累量从33.40 mg·kg−1增至81.40 mg·kg−1,比例从54.68%增至79.36%。北京花楸果实中各种类胡萝卜素物质积累量均随果实发育显著降低。 结论 花楸树中类胡萝卜素主要成分为β-胡萝卜素,果实显色程度与其积累量增加显著正相关;北京花楸果实中类胡萝卜素积累量显著低于花楸树,并随果实发育时序性显著下降,是其果实为白色而不显其他颜色的主要原因之一。 Abstract:Objective To analyze the metabolomic characteristics of carotenoid components in the fruits of Sorbus pohuashanensis and S. discolor in three developmental stages of fruit for the purpose of studying the mechanism of fruit coloration of Sorbus trees. Method The carotenoid components in fruits of the two Sorbus species were qualitatively and quantitatively determined by liquid chromatography tandem mass spectrometry (LC-MS/MS) to compare the differences between the two species, and to analyze the relationship between carotenoid component of fruit and the color of pericarp. Result Qualitative analysis showed there was a total of twelve carotenoids in S. pohuashanensis and seven in S. discolor. Quantitative analysis indicated that carotenoid accumulation of S. pohuashanensis were higher significantly than that of S. discolor at three developmental stages of fruit. As the fruit ripening, the carotenoid accumulation of S. pohuashanensis increased significantly, β-carotene was the main component, the accumulation of β-carotene increased from 33.40 mg·kg−1 to 81.40 mg·kg−1, and the percentage increased from 54.68% to 79.36%, while the carotenoid accumulation of S. discolor decreased significantly during fruit development. Conclusion β-carotene is the main carotenoid compound in the fruit of S. pohuashanensis, and the coloration of fruit was significantly and positively correlated with the accumulation of β-carotene. The accumulation of carotenoid in S. discolor is significantly lower compared with S. pohuashanensis, and the carotenoid content reduces significantly within the development process which is one of the factors leading to white pericarp of the fruit without other colors. -
Key words:
- Sorbus pohuashanensis
- / Sorbus discolor
- / fruit color
- / carotenoid
-
表 1 花楸树(SP)与北京花楸(SD)类胡萝卜素定性定量检测结果统计表(鲜质量)
Table 1. Statistical table of qualitative and quantitative detection results of carotenoids of S. pohuashanensis (SP)and S. discolor (SD)(FW)
mg·kg−1 成分
Components树种
Species阶段A
Stage A阶段B
Stage B阶段C
Stage Cα-胡萝卜素 α-Carotene SP 1.35 ± 0.07 2.18 ± 0.12 2.79 ± 0.19 SD — — — α-隐黄质 α-Cryptoxanthin SP 0.06 ± 0.01 0.17 ± 0.01 0.16 ± 0.01 SD — — — β-阿朴胡萝卜素醛 β-Apocarotenal SP 0.01 ± 0.00 0.01 ± 0.00 0.02 ± 0.00 SD — — — β-胡萝卜素 β-Carotene SP 33.40 ± 1.35 51.93 ± 1.94 81.40 ± 2.27 SD 1.38 ± 0.06 0.60 ± 0.02 0.33 ± 0.00 β-隐黄质 β-Cryptoxanthin SP 1.58 ± 0.04 6.04 ± 0.42 8.28 ± 0.55 SD 0.07 ± 0.01 0.05 ± 0.00 0.01 ± 0.00 γ-胡萝卜素 γ-Carotene SP 0.10 ± 0.01 0.27 ± 0.01 1.25 ± 0.04 SD — 0.01 ± 0.00 — 番茄红素 Lycopene SP — — 0.10 ± 0.00 SD — — — 新黄质 Neoxanthin SP 0.76 ± 0.08 — — SD — — — 叶黄素 Lutein SP 17.93 ± 1.66 5.35 ± 0.25 1.67 ± 0.06 SD 3.55 ± 0.17 1.33 ± 0.06 0.78 ± 0.04 玉米黄质 Zeaxanthin SP 1.81 ± 0.09 1.81 ± 0.11 0.83 ± 0.02 SD 0.10 ± 0.00 0.12 ± 0.01 0.01 ± 0.00 紫黄质 Violaxanthin SP 0.75 ± 0.07 0.15 ± 0.00 0.17 ± 0.01 SD 0.18 ± 0.02 0.10 ± 0.00 0.02 ± 0.00 八氢番茄红素 (E/Z)-Phytoene SP 3.33 ± 0.08 5.25 ± 0.24 5.89 ± 0.38 SD 1.34 ± 0.08 2.32 ± 0.15 1.52 ± 0.08 合计 Total SP 61.08 ± 0.31 73.67 ± 0.28 103.82 ± 0.36 SD 6.61 ± 0.06 4.52 ± 0.03 2.68 ± 0.02 注:平均值 ± 标准差;n = 3;“-”为未检测到。下同。
Notes: average value ± standard error (SE); n = 3; “-”: not detected.The same below.表 2 花楸树(SP)与北京花楸(SD)类胡萝卜素积累量时序及种间差异倍数统计表
Table 2. Timing and species fold changes of carotenoid accumulation in fruits of S. pohuashanensis (SP)and S. discolor (SD)
类胡萝卜素
CarotenoidSP SD SD-A vs SP-A SD-B vs SP-B SD-C vs SP-C A vs B B vs C A vs C A vs B B vs C A vs C α-胡萝卜素 α-Carotene 1.61 1.28 2.06 — — — — — — α-隐黄质 α-Cryptoxanthin 2.85 0.94 2.68 — — — — — — β-阿朴胡萝卜素醛 β-Apocarotenal 2.85 0.94 2.68 — — — — — — β-胡萝卜素 β-Carotene 1.55 1.57 2.44 0.44 0.54 0.24 24.26 86.12 248.17 β-隐黄质 β-Cryptoxanthin 3.82 1.37 5.23 0.68 0.30 0.20 22.87 127.95 588.63 γ-胡萝卜素 γ-Carotene 2.69 4.58 12.30 — — — — 30.10 — 番茄红素 Lycopene — 30.94 — — — — — — — 叶黄素 Lutein 0.30 0.31 0.09 0.37 0.59 0.22 5.06 4.04 2.13 玉米黄质 Zeaxanthin 1.00 0.46 0.46 1.14 0.12 0.14 17.38 15.21 56.26 紫黄质 Violaxanthin 0.20 1.17 0.23 0.57 0.20 0.11 4.22 1.45 8.55 八氢番茄红素 Phytoene 1.58 1.12 1.77 1.73 0.66 1.14 2.49 2.27 3.87 表 3 花楸树(SP)与北京花楸(SD)类胡萝卜素积累量时序及种间差异t检验(P值)统计表
Table 3. T testing(P value) for timing and species differences of carotenoid accumulation in fruits of S. pohuashanensis (SP)and S. discolor (SD)
类胡萝卜素
CarotenoidSP SD SD-A vs SP-A SD-B vs SP-B SD-C vs SP-C A vs B B vs C A vs C A vs B B vs C A vs C α-胡萝卜素 α-Carotene 0.007 0.063 0.009 — — — — — — α-隐黄质 α-Cryptoxanthin 0.005 0.544 0.001 — — — — — — β-阿朴胡萝卜素醛 β-Apocarotenal 0.021 0.126 0.032 — — — — — — β-胡萝卜素 β-Carotene 0.002 0.001 0.000 0.002 0.006 0.003 0.00 0 0.00 β-隐黄质 β-Cryptoxanthin 0.008 0.036 0.006 0.043 0.002 0.008 0.00 0 0.00 γ-胡萝卜素 γ-Carotene 0.000 0.001 0.000 — — — — 0 — 番茄红素 Lycopene — 0.001 — — — — — — — 叶黄素 Lutein 0.015 0.003 0.010 0.003 0.002 0.003 0.01 0 0.00 玉米黄质 Zeaxanthin 0.982 0.011 0.007 0.308 0.009 0.000 0.00 0 0.00 紫黄质 Violaxanthin 0.011 0.102 0.011 0.042 0.000 0.011 0.01 0 0.00 八氢番茄红素 Phytoene 0.010 0.236 0.017 0.010 0.018 0.170 0.00 0 0.01 -
[1] Dar J A, Wani A A, Ahmed M, et al. Peel colour in apple (malus × domestica borkh.): An economic quality parameter in fruit market[J]. Scientia Horticulturae, 2019, 244: 50-60. doi: 10.1016/j.scienta.2018.09.029 [2] Gagetti B L, Piratelli A J, Pina-Rodrigues F C M. Fruit color preference by birds and applications to ecological restoration[J]. Brazilian Journal of Biology, 2016, 76(4): 955-966. doi: 10.1590/1519-6984.05115 [3] Lu L, Fritsch P W, Matzke N, et al. Why is fruit colour so variable? Phylogenetic analyses reveal relationships between fruit-colour evolution, biogeography and diversification[J]. Global Ecology and Biogeography, 2019, 28(7): 891-903. doi: 10.1111/geb.12900 [4] Nevo O, Valenta K, Razafimandimby D, et al. Frugivores and the evolution of fruit colour[J]. Biology Letters, 2018, 14(9): 20180377. doi: 10.1098/rsbl.2018.0377 [5] Chen C. Overview of plant pigments[M]//Chen C (Ed.). Pigments in Fruits and Vegetables: Genomics and Dietetics. New York: Springer, 2015. [6] Grune T, Lietz G, Palou A, et al. β-carotene is an important vitamin A source for humans[J]. The Journal of Nutrition., 2010, 140(12): 2268S-2285S. doi: 10.3945/jn.109.119024 [7] Von Lintig J. Provitamin A metabolism and functions in mammalian biology[J]. The American Journal of Clinical Nutrition, 2012, 96(5): 1234S-1244S. doi: 10.3945/ajcn.112.034629 [8] Eggersdorfer M, Wyss A. Carotenoids in human nutrition and health[J]. Archives of Biochemistry and Biophysics, 2018, 652: 18-26. doi: 10.1016/j.abb.2018.06.001 [9] Fraser P D, Bramley P M. The biosynthesis and nutritional uses of carotenoids[J]. Progress in Lipid Research, 2004, 43(3): 228-265. doi: 10.1016/j.plipres.2003.10.002 [10] Giordano E, Quadro L. Lutein, zeaxanthin and mammalian development: Metabolism, functions and implications for health[J]. Archives of Biochemistry and Biophysics, 2018, 647: 33-40. doi: 10.1016/j.abb.2018.04.008 [11] Hashimoto H, Uragami C, Cogdell R J. Carotenoids and photosynthesis[M]//Stange C (Ed.). Carotenoids in Nature: Biosynthesis, Regulation and Function. Cham: Springer International Publishing, 2016. [12] Jia K P, Baz L, Al-Babili S. From carotenoids to strigolactones[J]. Journal of Experimental Botany, 2017, 69(9): 2189-2204. [13] Tian L. Recent advances in understanding carotenoid-derived signaling molecules in regulating plant growth and development[J]. Frontiers in Plant Science, 2015, 6: 790. [14] Yuan H, Zhang J, Nageswaran D, et al. Carotenoid metabolism and regulation in horticultural crops[J]. Horticulture Research, 2015, 2: 15036. doi: 10.1038/hortres.2015.36 [15] He C, Zhang G, Zhang J, et al. Integrated analysis of multiomic data reveals the role of the antioxidant network in the quality of seabuckthorn berry[J]. The FASEB Journal, 2017, 31(5): 1929-1938. doi: 10.1096/fj.201600974R [16] Liu Y, Lv J, Liu Z, et al. Integrative analysis of metabolome and transcriptome reveals the mechanism of color formation in pepper fruit (Capsicum annuum L.)[J]. Food Chemistry., 2020, 306: 125629. doi: 10.1016/j.foodchem.2019.125629 [17] Yu Y, Chen X, Zheng Q. Metabolomic profiling of carotenoid constituents in Physalis peruviana during different growth stages by LC-MS/MS technology[J]. Journal of Food Science, 2019, 84(12): 3608-3613. doi: 10.1111/1750-3841.14916 [18] Sun T, Li L. Toward the 'golden' era: The status in uncovering the regulatory control of carotenoid accumulation in plants[J]. Plant Science, 2020, 290: 110331. doi: 10.1016/j.plantsci.2019.110331 [19] Stanley L, Yuan Y. Transcriptional regulation of carotenoid biosynthesis in plants: So many regulators, so little consensus[J]. Frontiers in Plant Science, 2019, 10: 1017. doi: 10.3389/fpls.2019.01017 [20] Phipps J, Robertson K R, Smith P G, et al. A checklist of the subfamily Maloideae (Rosaceae)[J]. Canadian Journal of Botany, 1990, 68(10): 2209-2269. doi: 10.1139/b90-288 [21] Aldasoro J J, Aedo C, Navarro C, et al. The genus Sorbus (Maloideae, Rosaceae) in Europe and in North Africa: morphological analysis and systematics[J]. Systematic Botany, 1998, 23(2): 189-212. doi: 10.2307/2419588 [22] Lu L T, Spongberg S A. Sorbus L.[M]//Wu Z Y, Raven P H, Hong D Y. Flora of China Volume 9. Beijing: Science Press & Saint Louis: Missouri Botanical Garden Press, 2003: 144-170. [23] McAllister H, Hague J, Mathew B. The genus Sorbus - mountain ash and other rowans[M]. Kew: The Royal Botanic Gardens, 2005. [24] Zika P F, Bailleul S M. Sorbus L. [M]//Committee F O N A E (Ed.). Flora of North America, North of Mexico. Volume 9. New York: Oxford University Press, 2015: 445. [25] Li M, Tetsuo O T, Gao Y, et al. Molecular phylogenetics and historical biogeography of Sorbus sensu stricto (Rosaceae)[J]. Molecular Phylogenetics and Evolution, 2017, 111: 76-86. doi: 10.1016/j.ympev.2017.03.018 [26] Gil-Izquierdo A, Mellenthin A. Identification and quantitation of flavonols in rowanberry (Sorbus aucuparia) juice[J]. European Food Research and Technology, 2001, 213: 12-17. doi: 10.1007/s002170100328 [27] Hukkanen A T, Polonen S S, Karenlampi S O, et al. Antioxidant capacity and phenolic content of sweet rowanberries[J]. Journal of Agricultural and Food Chemistry, 2006, 54(1): 112-119. doi: 10.1021/jf051697g [28] Vyviurska O, Pysarevska S, Janoskova N, et al. Comprehensive two-dimensional gas chromatographic analysis of volatile organic compounds in distillate of fermented Sorbus domestica fruit[J]. Open Chemistry, 2015, 13(1): 96-104. [29] 孙姝慧. 俄罗斯餐饮文化述评[J]. 西伯利亚研究, 2018, 45(2):89-91, 95. doi: 10.3969/j.issn.1008-0961.2018.02.016 [30] Rutkowska M, Olszewska M A, Kolodziejczyk-Czepas J, et al. Sorbus domestica leaf extracts and their activity markers: antioxidant potential and synergy effects in scavenging assays of multiple oxidants[J]. Molecules, 2019, 24(12): 2289. doi: 10.3390/molecules24122289 [31] Bujor A, Anca M, Simon V L, et al. Metabolite profiling, arginase inhibition and vasorelaxant activity of Cornus mas, Sorbus aucuparia and Viburnum opulus fruit extracts[J]. Food and Chemical Toxicology, 2019, 133: 110764. doi: 10.1016/j.fct.2019.110764 [32] Akkol K, Dereli E G, Taştan F T, et al. Effect of Sorbus domestica and its active constituents in an experimental model of colitis rats induced by acetic acid[J]. Journal of Ethnopharmacology, 2020, 251: 112521. doi: 10.1016/j.jep.2019.112521 [33] Valadon L R, Mummery R S. Carotenoids of rowan berries[J]. Annals of Botany, 1972, 36(146): 471. [34] Deren’ko S A. Carotenoids from Sorbus aucuparia fruits[J]. Khim Prir Soedin, 1978(4): 528. [35] Mikulic-Petkovsek M, Krska B, Kiprovski B, et al. Bioactive components and antioxidant capacity of fruits from nine Sorbus Genotypes[J]. Journal of Food Science, 2017, 82(3): 647-658. doi: 10.1111/1750-3841.13643 [36] Zymone K, Raudone L, Raudonis R, et al. Phytochemical profiling of fruit powders of twenty Sorbus L. cultivars[J]. Molecules, 2018, 23(10): 2593. doi: 10.3390/molecules23102593 [37] 俞德浚. 蔷薇科植物的起源和进化[J]. 植物分类学报, 1984, 22(6):431-445. [38] 吴征镒, 周浙昆, 李德铢, 等. 世界种子植物科的分布区类型系统[J]. 云南植物研究, 2003, 25(3):245-257. doi: 10.3969/j.issn.2095-0845.2003.03.001 [39] 汤 薇, 于雪丹, 张川红, 等. 粉色果实花楸母本起源的分子证据[J]. 林业科学研究, 2016, 29(6):834-838. [40] 郑勇奇, 郑 健, 张川红. 花楸树-城市绿化的新贵[J]. 城乡植物, 2008, 6(2):74-76. [41] 徐嫚嫚, 于雪丹, 郑勇奇, 等. 花楸树(Sorbus pohuashanensis)营养物质与药用成分探究[J]. 林业科学研究, 2020, 33(2):154-160. [42] Hadjipieri M, Georgiadou E C, Marin A, et al. Metabolic and transcriptional elucidation of the carotenoid biosynthesis pathway in peel and flesh tissue of loquat fruit during on-tree development[J]. BMC Plant Biology, 2017, 17(1): 1-12. [43] Xiong C, Luo D, Lin A. et al. A tomato B-box protein SlBBX20 modulates carotenoid biosynthesis by directly activating phytoene synthase 1, and is targeted for 26S proteasome-mediated degradation[J]. New Phytologist, 2019, 221(1): 279-294. [44] Geyer R, Peacock A D, White D C, et al. Atmospheric pressure chemicalionization and atmospheric pressure photoionization forsimultaneous mass spectrometric analysis of microbial respiratory ubiquinones and menaquinones[J]. Journal of Mass Spectrometry, 2004, 39(8): 922-929. [45] Petry F C, Mercadante A Z. New method for carotenoid extraction and analysis by HPLC-DAD-MS/MS in freeze-dried Citrus and Mango pulps[J]. Journal of the Brazilian Chemical Society, 2018, 29(1): 205-215. [46] 宋伟新, 汪爱群, 赵美威. 东北花楸树果实红色素的提取及稳定性研究[J]. 安徽农业科学, 2008, 36(20):8863-8864. doi: 10.3969/j.issn.0517-6611.2008.20.018 -




 下载:
下载:


