-
杉木(Cunninghamia lanceolata(Lamb.)Hook.)是我国南方重要的速生用材树种,凭借出材率高、材质优良、适应性广和经济效益高等优点,在我国南方地区广泛种植。然而,随着杉木纯林面积的不断扩大,多代连栽等不合理的营林措施导致了土壤中养分含量的减少,从而引起地力衰退等问题。杉木连栽是指原有林分皆伐后用实生苗在原处进行重新造林的过程。连栽导致林地生产力逐代降低,土壤微生物群落结构多样性下降[1],土壤酶活性[2]和氮、磷等元素有效性下降。当前研究普遍认为,植物对不同形态氮素的利用具有一定的偏好性。张彦东等[3]研究发现,多数针叶树种偏好吸收 NH4+-N ;李常诚等[4]利用 15N 同位素示踪法研究不同林龄杉木的养分吸收偏好时也发现,3 种林龄的杉木均表现出对 NH4+-N 的较强吸收偏好;但也有研究表明,杉木对 NO3−-N 的偏好性大于 NH4+-N[5-6]。植物吸收和利用氮素的过程很复杂,即使是在同一生态系统,环境条件相同,同一植物亦会在林龄、栽植代数不同时采用不同的氮素获取策略。目前部分学者已从多个角度探究了杉木连栽对土壤硝态氮含量的影响,但尚未达成一致结论。刘先等[7]发现,杉木人工林硝态氮含量并未随着连栽代数增加而减少;而陈郑洪等[8]研究表明,随着连栽代数的增加,连栽杉木人工林土壤硝态氮含量呈现降低趋势。目前关于杉木连栽林硝态氮相关研究的不足,限制了人们对硝态氮转化过程随多代连栽变化的认知。
微生物活动与土壤氮循环密切相关,可以说氮循环的本质就是微生物驱动的氮素转化、利用及循环的过程[9],需要植物、真菌、细菌和古菌等共同参与。土壤氮素在微生物作用下最终成为植物可直接吸收利用的有效氮,其中,硝化作用是氮循环的核心环节,此过程能够提高土壤氮的有效性。氨氧化过程被认为是硝化作用的限速步骤,主要由氨氧化古菌(AOA)和氨氧化细菌(AOB)完成,它们能将氨(NH3)氧化成亚硝态氮(NO2−),进而推动硝化反应的进程。氨氧化古菌是酸性土壤氨氧化反应的主要催化者[10],如贺纪正等[11]对长期施肥处理引起的土壤性质变化研究中发现,酸性条件下氨氧化古菌的丰度和群落组成变化比氨氧化细菌更明显。Lu 等[12]通过稳定性同位素示踪实验证明,氨氧化古菌类群主导了森林土壤氨氧化过程。然而,以往研究多聚焦于不同生态环境、条件处理下氨氧化古菌群落结构和物种丰度变化以及氨氧化古菌在人工给水和污水处理系统中群落分布和所起作用,关于自然条件下多代连栽杉木纯林土壤中的氨氧化古菌群落组成和有效氮素形态转变规律的研究较为罕见。
土壤酶是氮循环过程中关键的催化剂,对土壤物化性质的改变极其敏感。前人研究表明,不同栽植代数会改变杉木林的氮循环特征[13]。土壤微生物是土壤氮循环过程的主要驱动力,直接调节土壤有机质和氮素养分的供给和转化。土壤酶能够表征微生物活性,不同的土壤酶参与土壤氮循环,将土壤中不同形态 N 分解为有效 N 供植物吸收[14]。目前对杉木人工林酶活性的研究主要关注脲酶、过氧化氢酶等,且大部分结果表明,随杉木连栽代数增加酶活性逐代下降[15-16],但对于参与土壤氮循环过程,尤其是参与土壤硝化、氨氧化过程的酶如氨单加氧酶(AMO)则较少涉及。因此,研究不同栽植代数的杉木人工林土壤氮循环过程中酶活性变化及其影响因子,对提高土壤N素利用率和人工林生态恢复管理有重要意义。
鉴于此,本研究选择不同栽植代数的杉木人工林土壤为研究对象,利用高通量测序技术研究杉木连栽对土壤有效态氮形态特征的影响,通过分析连栽杉木土壤中的氨氧化古菌群落组成及多样性,以揭示氨氧化古菌群落结构和多样性随连栽代数演变的规律及有效氮素与氨氧化古菌群落的相关性,最终确定影响连栽杉木林土壤氮有效性的因素,旨在为我国杉木人工林的可持续经营提供实践指导。
-
研究林分位于福建省南平市王台镇(118° ~ 119° E,26°40′ ~ 27°20′ N),属武夷山系南伸支脉,是我国杉木中心产区之一。平均海拔200 m左右,地处亚热带季风气候区,年均气温19.3 ℃,相对湿度83%,年均降水量1 700 mm,主要集中在春夏季。土壤是由燕山晚期白云母化中细粒花岗岩发育的山地暗红壤,土层厚度在100 cm以上。该地栽植有4个不同代数的杉木人工林,其中,1代林林龄18 a;2代林林龄18 a;3代林林龄19 a;4代林林龄16 a。该林分乔木层主要以杉木为主,1 代林土地植被覆盖度较高,灌木层植物主要有山苍子(Litsea cubeba (Lour.) Pers.)、毛冬青(Ilex pubescens Hook. et Arn.)、盐肤木(Rhus chinensis Mill.)等;草本层植物主要有芒萁(Dicranopterisdichotoma (Thunb. ) Berhn.)、乌毛蕨(Blechnum orientale Linn.)、狗脊(Cibotium barometz (L.) J.Sm.)、观音莲座蕨(Angiopteris fokiensis Hieron)等。2 代林灌木层植物主要有粗叶榕(Ficus hirta Vahl)、草珊瑚(Sarcandra glabra(Thunb.)Nakai)等,草本层植物主要有狗脊(Cibotium barometz (L.) J.Sm.)、双盖蕨(Diplazium donianum (Mett.) Tard.-Blot)、扇叶铁线蕨(Adiantum flabellulatum L. Sp.)等。3 代与 4 代植被丰富度则显著下降,灌木层植物主要有粗叶榕(Ficus hirta Vahl)、毛冬青(Ilex pubescens Hook. et Arn.)等;草本层植物主要有芒萁(Dicranopterisdichotoma (Thunb. ) Berhn.)、狗脊(Cibotium barometz (L.) J.Sm.)等。通过以空间代时间的方法,于2021年10月,选择立地条件相似、林龄为18 a左右的中林龄、代数分别为1~4代(G1 ~ G4)的杉木人工林进行采样,样地基本理化性质见表1。每片林地选择3个坡度在30°~40°,海拔、坡向相近的土坡。每个土坡上划分20 m × 20 m的采样地,沿着S型采集6份样品,去除枯枝落叶后,用土钻钻取深度为20 cm的表层土壤,并将6份样品等量混合为一份。每片人工林采集3份样品,每份土壤过20目筛后放入4 ℃冰箱内冷藏保存,一部分用于土壤理化性质测定,另一部分用于氨氧化古菌群落结构与多样性测定。
代数 Planting generation 1代 First generation 2代 Second generation 3代 Third generation 4代 Fourth generation pH 4.66 ± 0.02 a 4.73 ± 0.03 ab 4.77 ± 0.03 ab 4.87 ± 0.11 b 碳氮比 C/N 13.88 ± 0.85 a 13.31 ± 0.31 a 14.00 ± 0.62 a 13.15 ± 0.14 a 全碳 TC/ (g·kg−1) 19.32 ± 0.81 b 18.37 ± 0.23 b 18.89 ± 1.67 b 30.30 ± 0.13 a 全氮 TN/ (g·kg−1) 1.39 ± 0.05 b 1.38 ± 0.01 b 1.35 ± 0.08 b 2.31 ± 0.02 a 可溶性有机碳 DOC/(mg·kg−1) 178.00 ± 7.51 ab 205.57 ± 10.78 a 178.07 ± 6.00 ab 157.33 ± 6.32 b 总可溶性氮 TSN/(mg·kg−1) 13.75 ± 1.41 bc 17.41 ± 1.63 ab 19.55 ± 0.48 a 12.68 ± 1.02 c 可溶性有机氮 SON/(mg·kg−1) 2.61 ± 1.21 ab 4.88 ± 0.79 ab 6.75 ± 1.86 a 1.60 ± 0.91 b 注:表中数值为平均值 ± 标准误,同行数据后的不同小写字母表示同一形态氮素含量在不同代数之间差异显著 (P<0.05);下同
Notes: The data in the table is the mean ± standard error. Different lowercase letters after the same column of data indicate that the nitrogen content of the same form is significantly different between different stand ages (P<0.05), the same belowTable 1. Soil physical and chemical properties of the sample plot
-
土壤pH值采用pH计(ST3100-F Ohaus, New Jersey,美国)测定:称取10 g风干土倒入50 mL烧杯,加入25 mL水(去CO2纯水,水土比2.5:1),混合搅拌静置30 min后用pH计测定;土壤硝态氮(NO3−-N)、铵态氮(NH4+-N)含量使用全自动连续流动分析仪(AA3 SEAL Analytical, 荷兰)测定,土壤样品经过2 mol·L−1 KCl溶液浸提后上机测定;土壤微生物量氮(MBN)含量采用氯仿熏蒸浸提法[17]测定,未熏蒸土样加入120 mL 0.5 mol·L-1 K2SO4溶液(水土比4:1)浸提,直接震荡过滤,熏蒸土样在真空干燥器中加入氯仿熏蒸,培养24 h后浸提,过滤膜后上总有机碳分析(TOC-LCPH, Shimadzu, Japan)测定,直接得出未熏蒸样品的总可溶性氮(TSN)含量,计算熏蒸与未熏蒸样品的总可溶性氮(TSN)含量差值,得到土壤微生物量氮(MBN)含量,转换系数为0.54。
-
土壤酶活性使用试剂盒进行测定,每个处理设置3个重复。酶活性均使用酶标仪(SpectraMax M4,美国)测定。
土壤氨单加氧酶(S-AMO):测定原理为氨单加氧酶与HRP标记的抗体结合,形成抗体-抗原-酶标抗体复合物,再经洗涤、显色、酸化,用酶标仪在450 nm波长下测定吸光度值,即可反应样品氨单加氧酶活性[18]。
土壤脲酶(S-UE):测定原理为脲酶水解尿素所产生的NH3在强碱性介质中能够与次氯酸钠和苯酚反应,生成水溶性蓝色染料靛酚蓝,在630 nm处具有特征吸收峰,通过吸光值的变化可表征土壤脲酶的活性[19]。
土壤过氧化氢酶(S-CAT):测定原理为H2O2在 240 nm处具有特征吸收峰,土壤过氧化氢酶分解H2O2 使反应溶液在240 nm处吸光值随反应时间而下降,通过测定吸光值的变化率即可表征土壤过氧化氢酶的活性[20]。
-
完成基因组 DNA 抽提后,利用 1% 琼脂糖凝胶电泳检测抽提的基因组DNA,采用引物Arch-amoAF(GACTACATMTTCTAYACWGAYTGGGC)、Arch-amoAR(GGKGTCATRTATGGWGGYAAYGTTGG)[21]对土壤中amoA(26-417) 区域进行 PCR 扩增,PCR 产物使用 1% 琼脂糖凝胶电泳检测扩增目的条带大小,并用Agencourt AMPure XP核酸纯化试剂盒纯化,随后完成Miseq文库构建。将符合要求的测序文库在Illumina Miseq平台上进行双末端测序(Paried-End),对基因进行物种注释后得到各分类水平上的氨氧化古菌的相对丰度[22]。
-
数据经过正态分布检验,通过SPSS 25.0软件对组间土壤氮素含量和氨氧化古菌Alpha多样性指数分别进行单因素方差分析,以0.05的显著性水平为样品均值比较的最小显著差异检验。土壤氮素含量、酶活性及氨氧化古菌群落相对丰度冗余分析(RDA)使用Canoco5完成。叠加热图的Mantel_r分析和中性群落模型使用在线作图平台完成。利用R Studio软件完成随机森林模型和偏最小二乘路径模型以探究土壤氨氧化古菌、酶活性与硝态氮之间的响应关系。
-
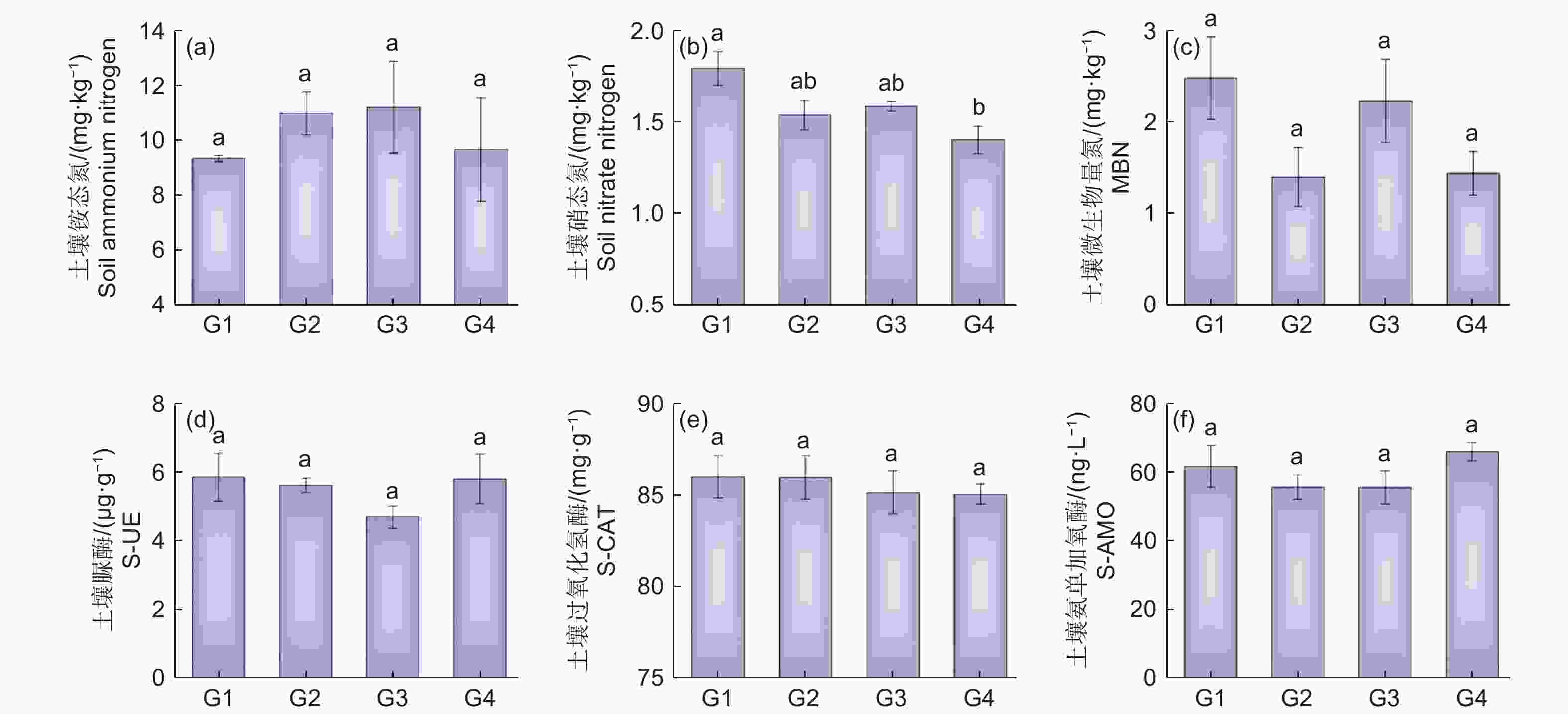
由图1 可知:代数对杉木林土壤理化性质影响显著,不同土壤理化性质随连栽代数的变化趋势不同。随代数增加,土壤硝态氮(NO3−-N)呈显著下降趋势(图1b),而土壤铵态氮(NH4+-N)和土壤微生物量氮(MBN)含量变化趋势并不明显且各代之间差异不显著(图1a、c)。对不同代数杉木林土壤酶活性进行分析,过氧化氢酶(S-CAT)在不同代数杉木林土壤中基本呈降低趋势(图1e),G1 时 3 种酶活性均最高,G3 时脲酶(S-UE)和氨单加氧酶(S-AMO)均为最低值(图1d、图1f),除了过氧化氢酶,测定的脲酶和氨单加氧酶随代数增加均表现出先降后升的趋势,表明土壤酶活性的高低与杉木连栽有密切关系。
-
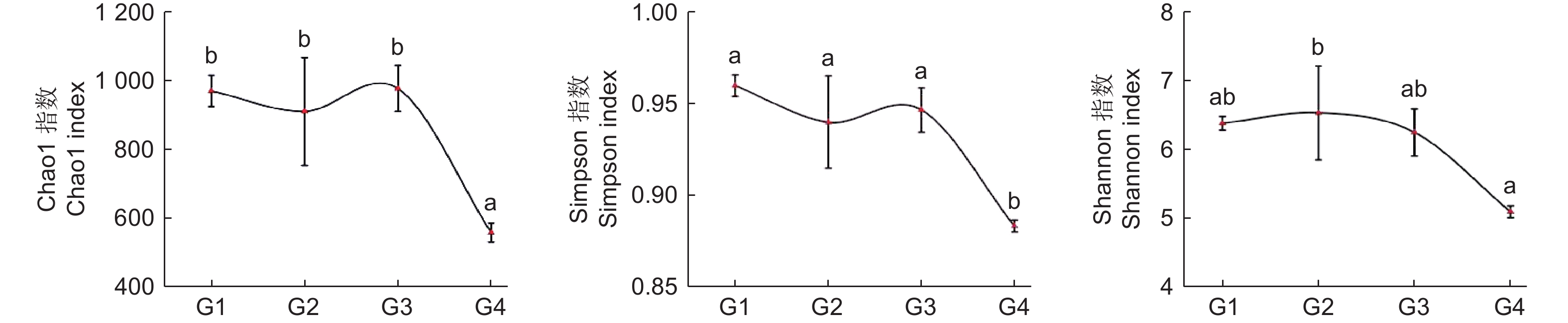
通过Alpha多样性指数可以反映微生物群落的丰度和多样性,其中,物种丰度变化能通过丰富度指数(Chao1)变化体现,群落多样性能通过多样性指数(Shannon、Simpson)变化体现。从图2 氨氧化古菌 Alpha 多样性指数变化可知:随连栽代数增加,Chao1 指数和 Simpson 指数总体表现为先降再升再降趋势,在G1、G3时最高,G4时最低,且G1~3和G4之间差异显著;而Shannon 指数总体表现为先升后降趋势,G2时最高,G4时显著降低。综上,土壤中氨氧化古菌丰富度和多样性指数总体表现为随代数下降趋势。
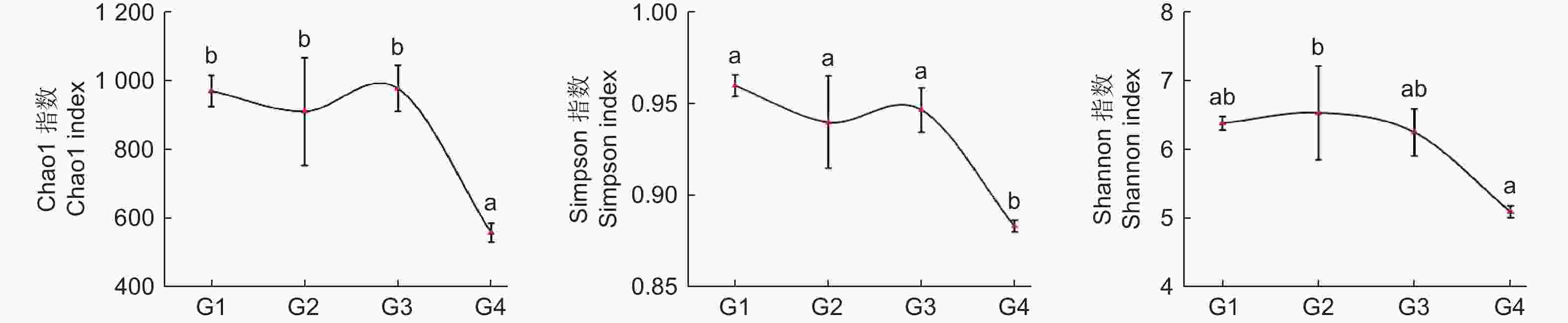
Figure 2. The Alpha diversity index of Soil ammonia-oxidizing archaea in Chinese fir forests of different generations
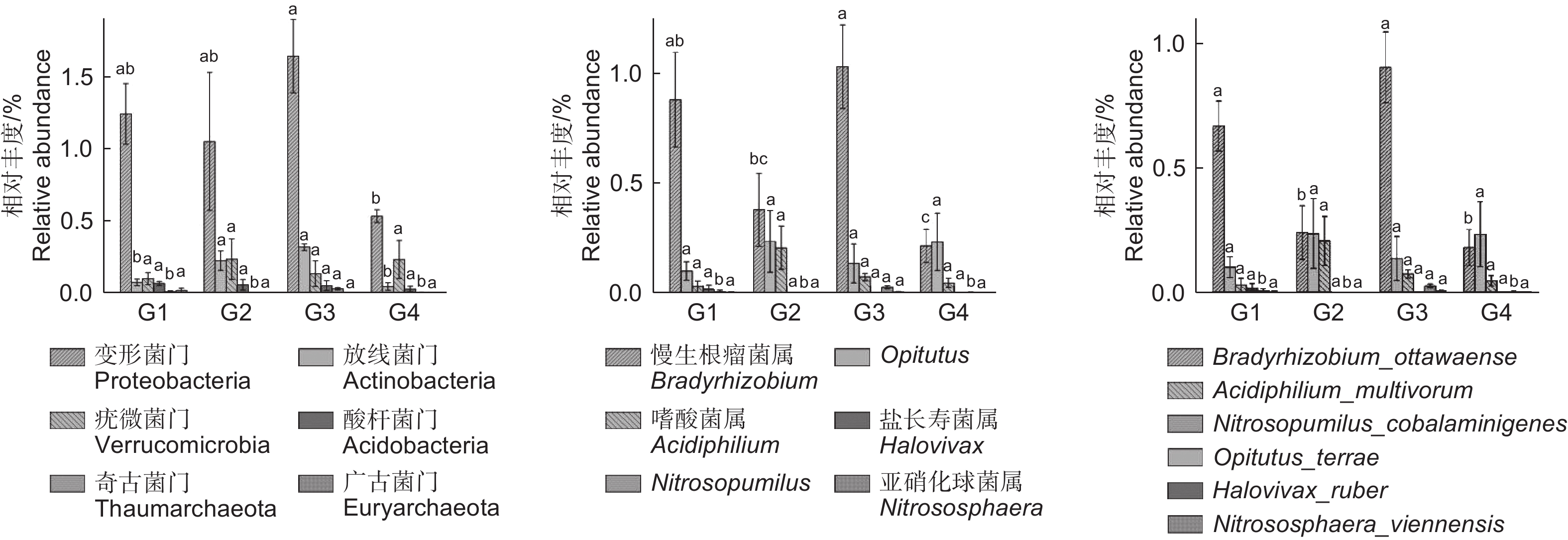
不同代数杉木林土壤样本中共检测出 14 个菌门,如图3 所示,土壤氨氧化古菌在门类水平上,相对含量较高的为变形菌门(Proteobacteria),随代数的增加呈先升后降趋势,从G1(1.24%)到G3(1.64%)时升高,G4(0.53%)时最低 ;属分类水平上,优势类群为慢生根瘤菌属(Bradyrhizobium)、Opitutus、嗜酸菌属(Acidiphilium)、盐长寿菌属(Halovivax)、Nitrosopumilus、亚硝化球菌属(Nitrososphaera)。慢生根瘤菌属呈现先降再升再降的趋势,G3(1.03%)时升高,G4(0.21%)时最低,与Opitutus(G3:0.14%;G4:0.23%)先升再降再升的趋势相反;种分类水平上,Bradyrhizobium_ottawaense相对含量在 G2(0.24%)和 G4(0.18%)时显著降低;Opitutus_terrae 则在G2(0.24%)和G4(0.23%)时升高。随代数增加,亚硝化球菌属(G3:0.005%;G4:0)、嗜酸菌属(G2:0.21%;G4:0.05%)和Nitrosopumilus(G3:0.03%;G4:0.002%)变化趋势相同,均呈先升高后降低趋势,在G2、G3时升高,G4时降低。盐长寿菌属则呈逐代降低趋势,G1 (0.02%)时最大,G2后无丰度值。本研究还发现,放线菌门(Actinobacteria)相对含量在 G3(0.32%)时最高,G4(0.05%)时最低;酸杆菌门(Acidobacteria)从 G1(0.07%)到 G4(0.03%)明显降低;Acidiphilium_multivorum(G2:0.21%;G4:0.05%)、Nitrosopumilus_cobalaminigenes(G3:0.03%;G4:0.002%)和Nitrososphaera_viennensis(G3:0.005%;G4:0)的变化趋势基本一致,均在 G2、G3 时升高,G4时降低。
由于本次高通量测序是将amoA基因作为标记从分子水平上进行探究,采用引物Arch-amoAF(GACTACATMTTCTAYACWGAYTGGGC)、Arch-amoAR(GGKGTCATRTATGGWGGYAAYGTTGG)对土壤中 amoA(26-417) 区域进行 PCR 扩增,与同是 amoA 基因作为标记的氨氧化细菌的引物 amoA-1F(GGGGTTTCTACTGGTGGT)、amoA-2R(CCCCTCKGSAAAGCCTTCTTC)相似,本次土壤氨氧化古菌测定结果在不同分类水平上也检测出部分细菌。
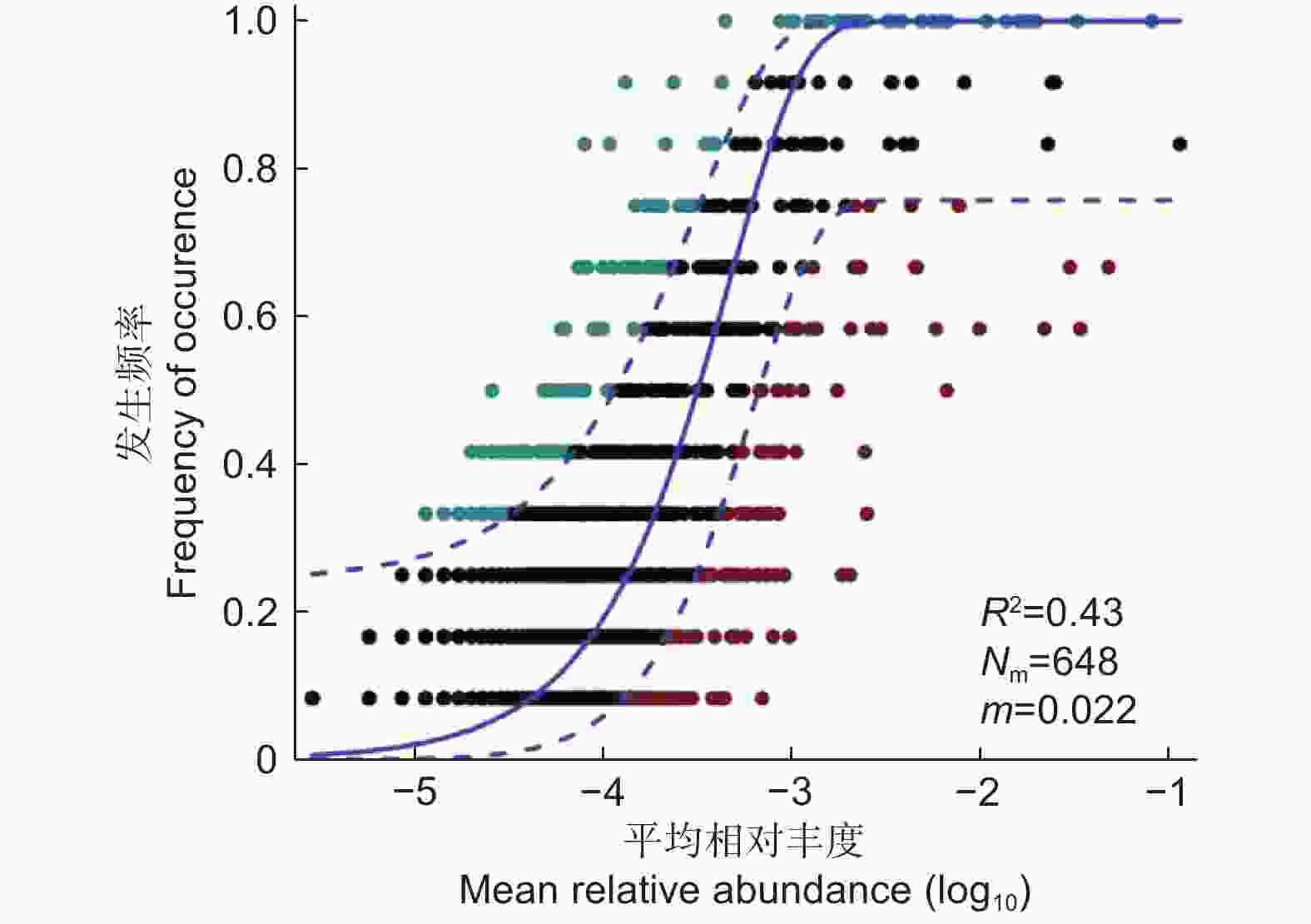
为了明确随机过程对不同栽植代数杉木人工林氨氧化古菌群落组装的潜在重要性,通过中性群落模型(NCM)评估群落中OTU出现频率与相对丰度之间的关系。如图4所示,蓝色实线表示中性群落模型的最适拟合值,蓝色虚线代表模型的95%置信区间,出现频率高于或低于中性群落模型预测的OTU以不同颜色显示。结果显示:中性群落模型能够估计OTU的出现频率与相对丰度变化之间的一部分关系,R2值(R2=0.43)在氨氧化古菌群落中具有合理的解释率(R2>0.4),较小的m值说明在群落中物种扩散受限制。总的来说,随机过程在不同栽植代数杉木人工林氨氧化古菌群落的空间分布较为重要,但也受扩散限制。
-
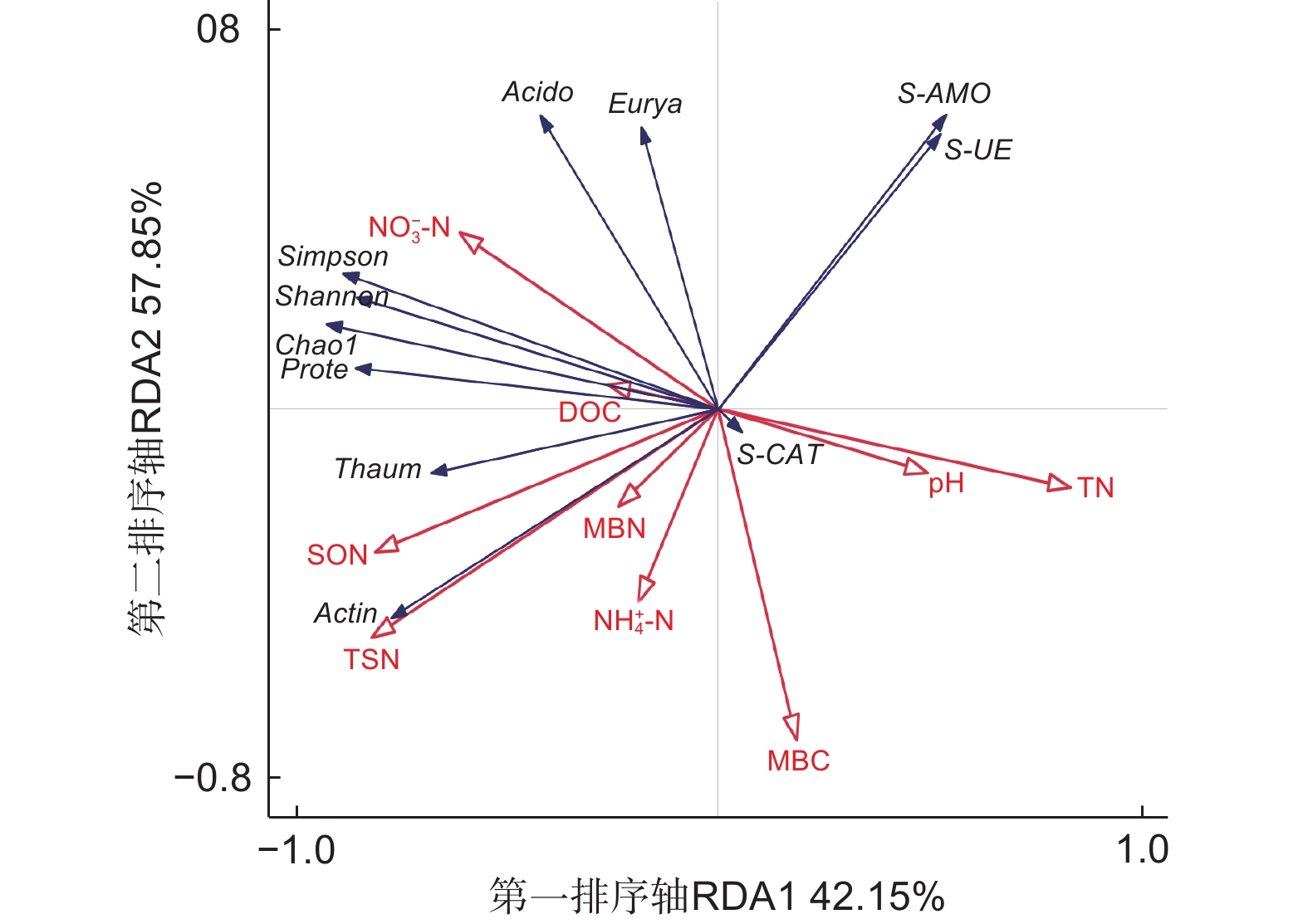
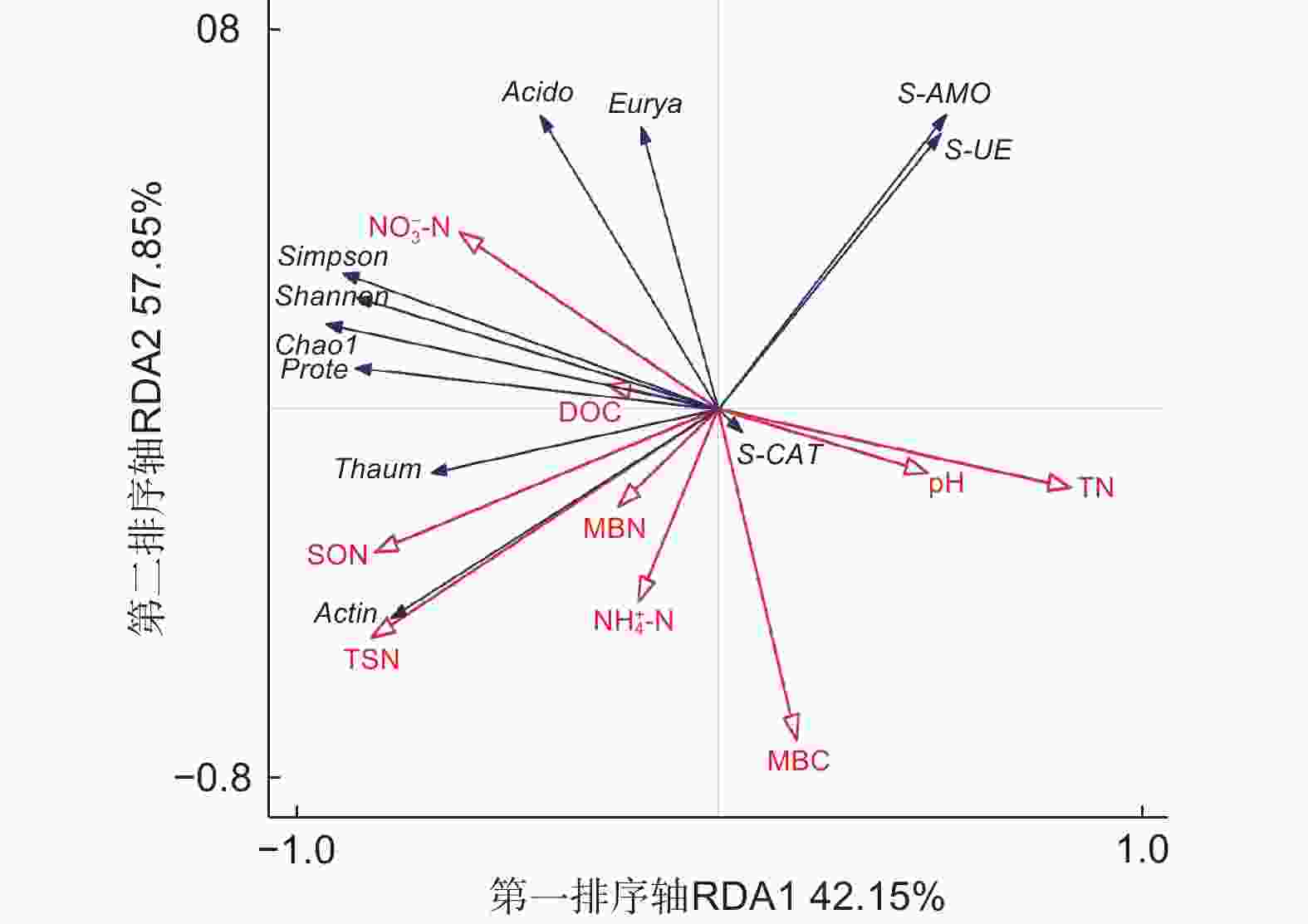
对不同代数杉木林土壤理化性质、酶活性与氨氧化古菌丰度和多样性进行冗余分析,如图5所示,箭头线段越长,表示研究对象影响程度越高,反之则相反;箭头间的夹角表示二者之间的相关关系,夹角越接近0°,二者越呈正相关关系,夹角越接近180°,二者越呈负相关关系。第一排序轴(RDA1)解释群落变化的42.15% ,第二排序轴(RDA2)解释群落变化的57.85% 。在所有土壤理化性质中,NO3−-N对Chao1指数、Simpson指数以及Shannon指数影响最大,呈正相关关系,而pH、TN与之呈负相关;TSN、SON与Chao1指数呈正相关。S-AMO与pH、TN呈正相关,与TSN呈负相关;S-UE与 NH4+-N呈负相关;S-CAT与pH呈正相关。酸杆菌门和广古菌门(Euryarchaeota)与NO3−-N 呈正相关,与NH4+-N 呈负相关;变形菌门和奇古菌门(Thaumarchaeota)与NO3−-N呈正相关,与pH、TN呈负相关;放线菌门与TSN呈正相关,与S-AMO呈负相关。
-
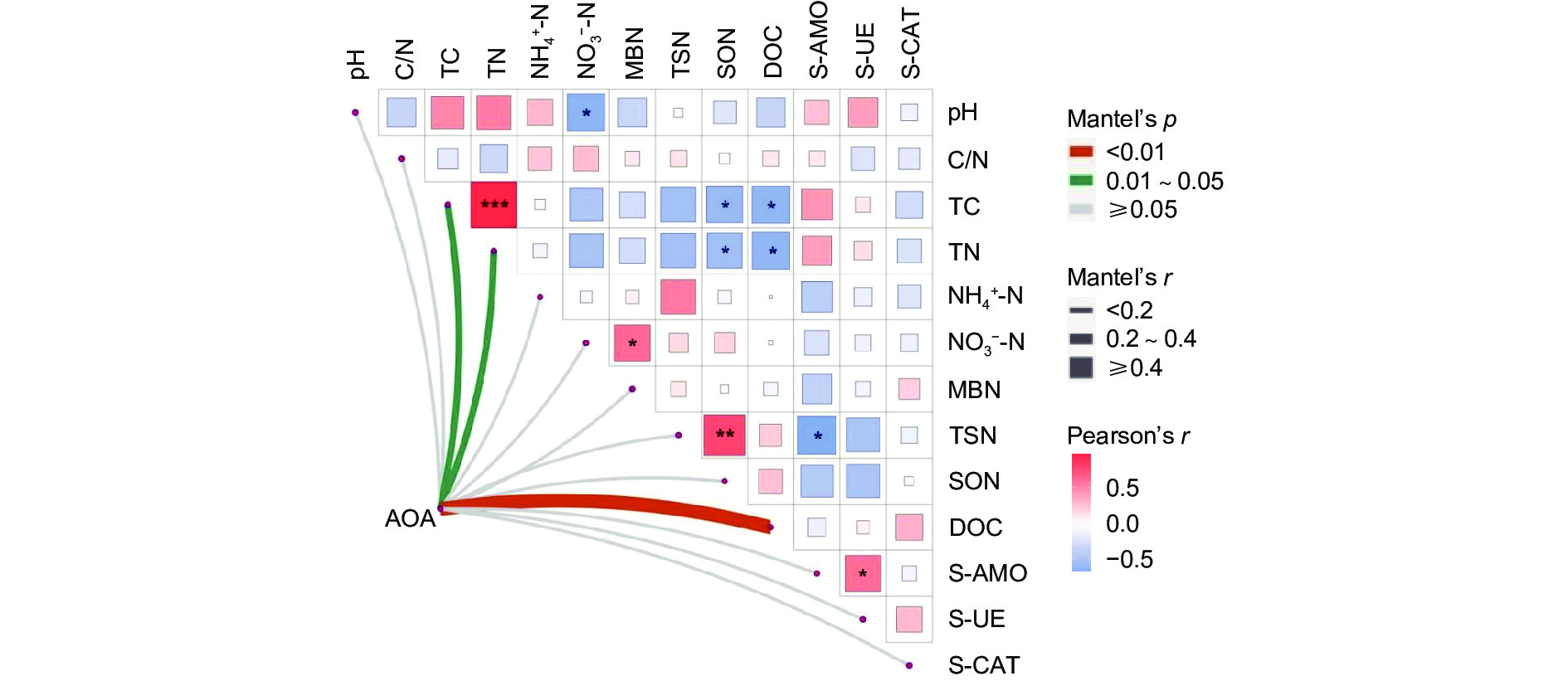
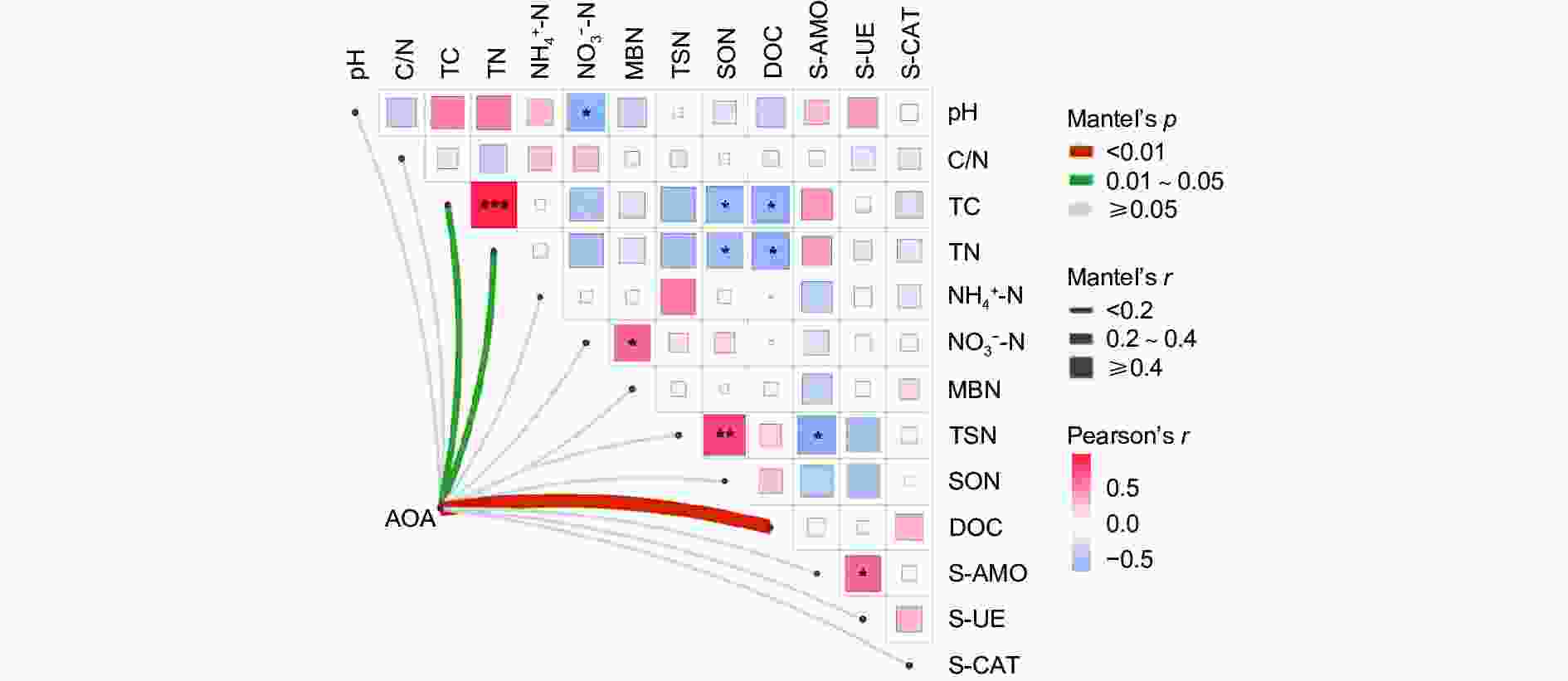
以Mantel_r对2个矩阵相关性进行检验。p值越小,Mantel_r的相关性系数越大,说明环境因子对微生物群落的影响越大,且它的偏分析可以排除环境因子之间自相关的干扰。结果(图6)表明:AOA对 DOC的影响最大,呈极显著正相关(p<0.01),AOA与 TC、TN呈显著正相关(p<0.05)。TC与TN呈强显著正相关(p<0.001),TSN与SON呈极显著正相关(p<0.01),与S-AMO呈显著负相关(p<0.05); NO3−-N与MBN呈显著正相关(p<0.05),与pH呈显著负相关(p<0.05),SON、DOC与TC、TN呈显著负相关(p<0.05)。
-
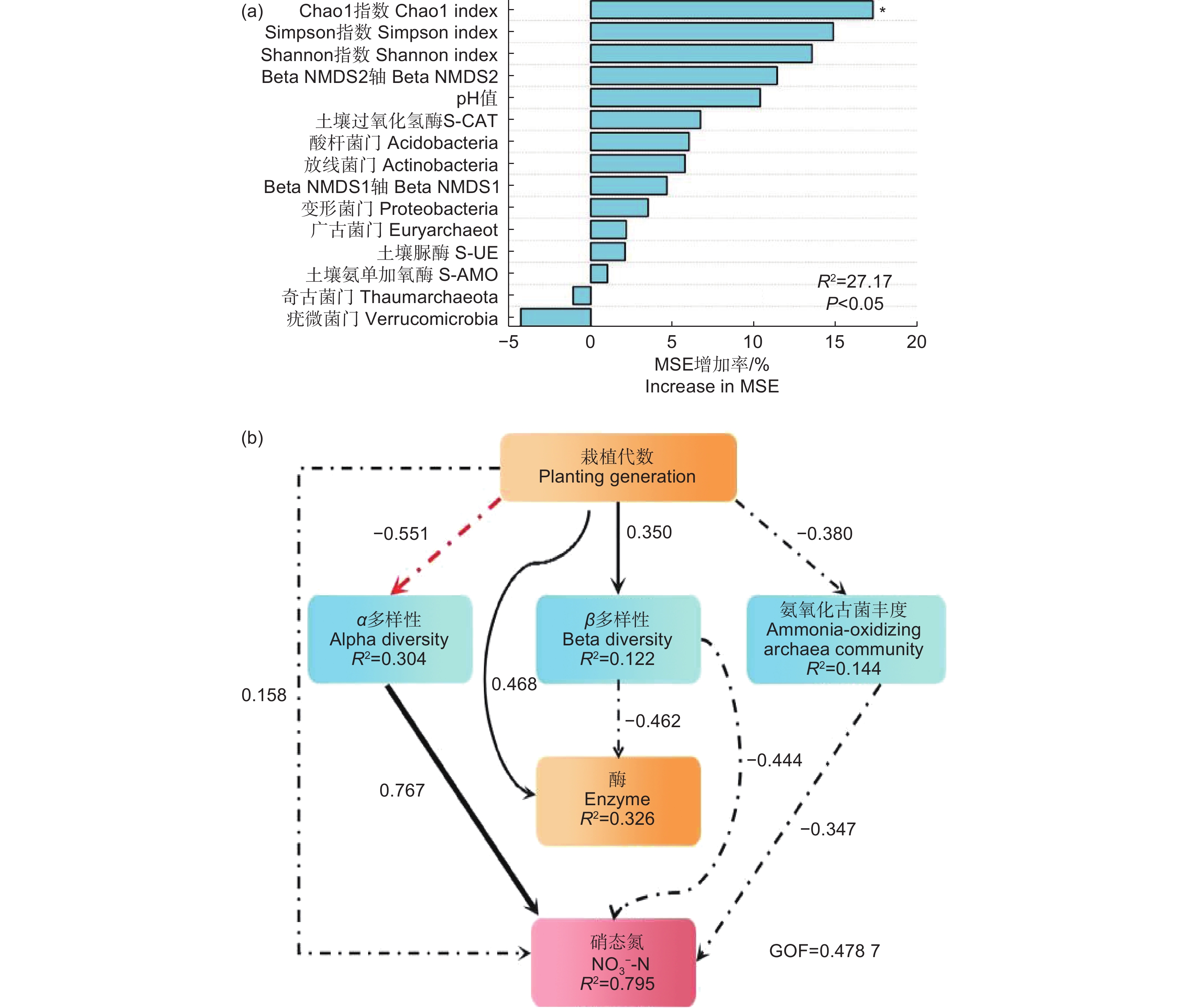
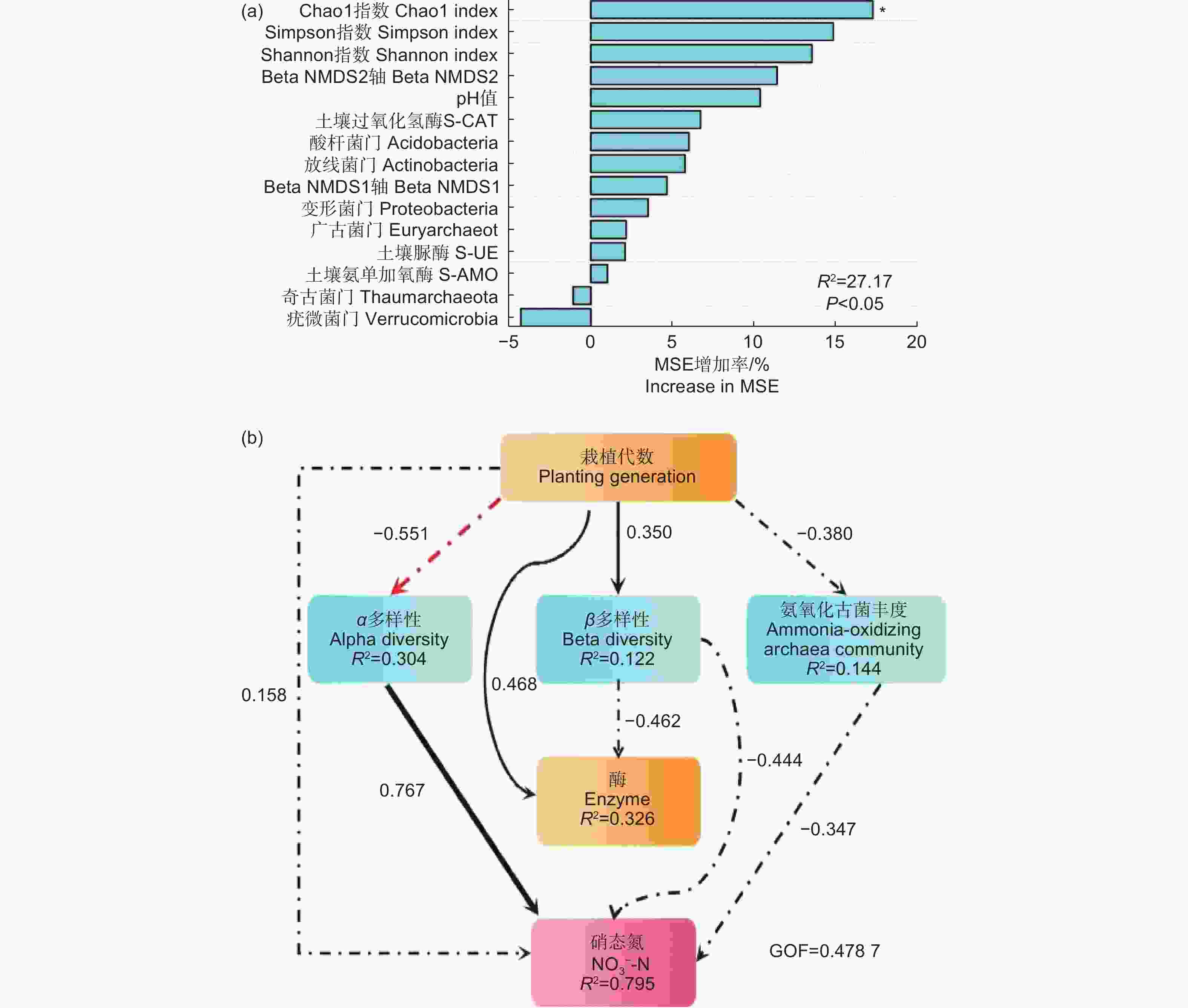
利用随机森林模型(RF)和偏最小二乘路径模型(PLS-PM)分析氨氧化古菌丰度与多样性各因素对土壤硝态氮的相对重要性,图7表明:各指标对硝态氮均有一定影响。随机森林模型(图7a)表明:氨氧化古菌Alpha多样性指数对硝态氮影响最大,其中,Chao1指数是影响硝态氮的最重要因素。偏最小二乘路径模型(图7b)表明:对硝态氮的直接影响最明显的是氨氧化古菌 Alpha 多样性指数(0.767),其次是群落相对丰度(−0.347)。
-
硝态氮与铵态氮是土壤有效氮存在的2种主要形式,是植物可直接利用的氮源。本研究中,随栽植代数增加,土壤中NO3−-N含量逐渐降低,NH4+-N含量变化不明显,这与Chen等[23]的研究结果相似。一方面是土壤NH4+-N带正电,容易被土壤胶体吸附留存于土壤中,而NO3−-N带负电,移动性强,在酸性土壤中容易流失,且更易于被植物利用。另一方面可能反应出土壤为适应氮素匮乏而采取的保氮机制,尽管土壤全氮未见明显下降,但土壤矿化率升高,硝化率降低,能够减少土壤氮流失的风险,这与Chen等[24]的研究结果相似。土壤氮有效性很大程度上是通过氮矿化过程来调控,该过程在微生物参与下将土壤有机氮转化为无机氮。有报道表明,随着连栽代数增加,杉木林土壤中氨氧化古菌的数量和种类有所下降[25],这可能是导致土壤NO3−-N含量降低的原因。土壤微生物量氮是土壤有机氮中最活跃的组分,也是土壤氮循环和转化过程中的重要参数[26]。本研究相关分析表明,土壤MBN与土壤NO3−-N呈显著正相关,表明硝化过程是影响土壤微生物量氮的一个重要因素,这与刘金炽等[27]的研究结果相似。由于多代连栽抑制了土壤的硝化作用,土壤中微生物可利用的物质减少,微生物量氮矿化分解步骤减少,从而降低了土壤微生物量氮含量[28]。
其次,土壤酶是促进土壤氮循环过程的催化剂。酶活性高低不仅能够反应微生物化学过程的强度和方向,还可表征土壤养分元素的动态变化。土壤过氧化氢酶在微生物代谢过程中起着重要作用,它参与土壤中许多重要的生物化学过程,其活性与土壤氮素关系密切[29]。土壤脲酶是有机氮矿化和氮动态调节的重要指标,它能促进尿素水解生成氨,是林木氮素营养的直接来源[30]。本研究中,土壤脲酶、过氧化氢酶活性均随代数增加呈降低趋势,这与张威等[31]的研究结果一致。由于杉木连栽代数的增加,土壤中有机残体分解速度及腐殖质合成能力明显下降,这可能与酶促作用底物浓度降低有关。因为土壤有机质和腐殖质数量减少,使土壤黏粒含量和微生物数量下降,这些变化导致了土壤酶活性下降[32]。胡亚林等[33]研究证实,杉木凋落物的数量与土壤酶活性呈显著正相关,杉木属常绿针叶树种,枝叶常年不易掉落,林下凋落物总类和数量较少,因此,不同连栽代数杉木人工林地凋落物可能也是影响土壤酶活性的原因之一。氨单加氧酶(AMO)是参与土壤氨氧化过程的关键功能酶[34],包含amoA、amoB、amoC三个亚基。氨氧化古菌和氨氧化细菌都含有氨单加氧酶基因,amoA亚基常作为研究氨氧化微生物的分子标记,来研究自然环境中氨氧化微生物的丰度和多样性。本研究中,土壤AMO活性随代数增加呈先降低后升高的趋势。由于AMO是驱动土壤中氨氧化微生物向有效氮养分转化的关键酶,随着栽植代数的增加,土壤微生物活性逐渐降低,矿化速率逐渐减慢,影响着AMO的活性,更对杉木多代连栽过程土壤养分的活化、周转和积累产生显著影响[35]。
-
微生物群落在土壤中处于一个动态平衡的过程,任何影响土壤理化性质的因子都会干扰土壤微生物群落的变化,进而影响微生物的活性、生态功能及土壤肥力[36]。本研究中,土壤AOA丰度与多样性大致呈现逐代降低趋势,杉木多代连栽抑制了AOA的生长。前人研究表明,森林土壤微生物中存在一种“杉木连栽土壤存在中毒物质”的观点,由Mikola、Mazzola等研究者确立起来[37],证实了森林土壤比耕作土壤具有更强的毒性,并认为这种森林土壤中毒的现象可能来自于土壤微生物。同时,冯宗炜等[38]也在湖南会同森林生态实验中证实,杉木连栽土壤存在毒性物质,杉木的凋落物便是杉木自毒物质的来源之一,主要是一些酚醛类化合物影响了土壤微生物的数量和分布。本研究Mante_r 分析表明,土壤AOA和DOC、TC、TN均呈显著相关性。不同代数连栽意味着不同的林分养分状况和微生态条件,因此,氨氧化古菌群落形成了对各连栽代数土壤环境的反应。对于连栽人工林来说,凋落物是林地的主要养分来源,森林土壤的毒性(镰刀菌属真菌作为主要病原菌)和多种土壤养分含量的变化,对AOA群落结构和多样性产生了复杂的影响,进而影响到土壤硝态氮含量[39]。也有研究认为,土壤AOA的丰度与多样性由它们的生态特征决定,一定程度上,微生物群落结构与地上种群有关,林下植被的变化对土壤微生物群落的组成也有显著影响[40],从G1到G4,林下植被种类逐渐单一、生物多样性降低,杉木细根生物显著减少,根系分泌物发生改变[41],导致AOA群落丰度与多样性逐代下降。说明AOA丰度与多样性变化会受到土壤理化性质的影响。
本研究中,氨氧化古菌测定结果在不同分类水平上也检测出部分细菌的存在。典型氨氧化过程被认为是一个由变形菌纲中的一小部分细菌类群所进行的专性好氧的化能自养过程[42],而氨氧化古菌和氨氧化细菌的功能类似,都利用amoA基因作为标记从分子水平上进行氨氧化作用。有研究表明[43],16S rRNA基因由于多拷贝和基因组内部异质性,因此,导致对氨氧化微生物多样性分析的偏差。土壤铵态氮含量对氨氧化古菌的奇古菌门和广古菌门有直接影响作用,铵态氮含量变化与之密切相关[44]。根据土壤理化性质的分析,铵态氮含量随代次呈现先升后降趋势,第3代时最高,这与奇古菌门及亚硝化球菌属相对丰度变化一致。其次,相关分析结果显示,NH4+-N与奇古菌门呈正相关,与广古菌门呈负相关,这与Zhalnina等[45]的研究结果一致。Jiao等[44]在玉米和水稻土壤古菌试验中发现,亚硝化球菌属为奇古菌门的优势种,同时也是硝化过程的氨氧化剂,从1代至3代,由于土壤吸附住的铵态氮含量的升高,导致NH3对氨氧化剂的可用性增大,从而提高了奇古菌门及亚硝化球菌属相对丰度。变形菌门、放线菌门、酸杆菌门等为氨氧化过程的主要优势菌群,与魏志超等[46]研究结果相似。由于变形菌门是典型的R策略菌,有机质含量高,pH低的环境会加速促进R策略菌生存和繁殖,从第1代到第4代,pH值升高,这也解释了变形菌门相对丰度减小的原因。变形菌门需要消耗有机质来供应代谢活动所需要的能量,因此,变形菌门与土壤TN呈负相关。但也有研究认为,土壤变形菌门含量对土壤氮素是起到正向促进作用的,如李艳春等[47]研究发现,变形菌门代谢活动是土壤中最主要的细菌活动,随着土壤氮素含量增加,变形菌门的丰度增加。由于在酸性土壤中,不同林地凋落物的组成成分、数量与植被根系分布状况和数量的不同,森林土壤的空间异质性及林分类型的差异也是群落结构差异的原因。本研究中,放线菌门与总可溶性氮和可溶性有机氮呈正相关,这与Sekaran等[48]的研究结果相似。本研究样品采集地为南方典型酸性壤土,土壤酸杆菌门呈显著下降趋势,由于酸杆菌具有嗜酸性,随连栽代数增加,pH略微升高,导致土壤酸杆菌逐代减少。放线菌为K对策者,在资源有限的条件下,选择可维持长期生存状态的繁殖策略[49]。综上,变形菌门、放线菌门、酸杆菌门对促进氮素形态转化过程发挥重要作用。
-
不同连栽代数杉木人工林土壤中硝态氮与AOA有密切联系。 AOA主要通过控制硝化关键步骤的氨氧化过程速度及编码氨单加氧酶2种机制影响土壤中硝态氮的含量和转化。一方面, AOA丰度和多样性特征与土壤环境因子的响应会影响土壤硝态氮的变化,另一方面AOA编码AMO能够影响酶和底物的构象及酶对土壤的吸附性等,进而影响土壤硝态氮的转化[9]。Guo等[50]在杉木林转化过程对微生物群落和氮功能基因研究中发现,变形菌门、酸杆菌门等为优势类群,这与本研究结果相同,变形菌门和酸杆菌门在森林土壤中具有广泛的代谢和生理途径,对土壤氮循环起重要作用。
在对门水平下的氨氧化古菌类群与土壤酶活性进行冗余分析中发现,NO3−-N与奇古菌门、广古菌门呈正相关,与氨单加氧酶呈负相关。Stein等[51]在研究含有铵或亚硝酸盐的欧洲猪笼草孵化实验中发现,一定浓度下的氨氧化作用所产生的亚硝酸盐会对AMO的活性有削弱作用。本研究中,硝态氮含量随代数逐渐降低, AMO活性在G1~G3时降低,在G4时升高,为此一种可能的机制是,第1代至第3代土壤进行的氨氧化作用所生成的亚硝酸盐不足以抑制AMO活性,第4代亚硝酸盐的减少使土壤AMO的活性升高。
长期以来,微生物丰度与多样性一直被认为是调节生态系统功能的关键因素。土壤微生物群落丰度与多样性的降低将严重影响到土壤养分的分解、循环和保留。通过构建随机森林模型和偏最小二乘路径模型分析氨氧化古菌丰度与多样性各因素对土壤硝态氮的相对重要性,结果显示,氨氧化古菌丰度与多样性是影响硝态氮的最重要因素,这与郑有坤等[52]研究结果一致。Zhou等[53]在连栽C. equisetifolia种植园试验表明,连栽种植会降低土壤pH值、有机质含量、 C/N比和P素,这也显著改变了土壤微生物群落的组成和多样性,使得土壤氮有效性降低。考虑到土壤微生物群落是土壤养分循环过程(凋落物分解、矿化)的关键驱动力,同时它本身也是养分有效性的来源和汇。因此在不同栽植代数的林分中,逐代林下凋落物数量和分解速率显著下降,降低了AOA微生物群落丰度及多样性[54],从而间接降低了土壤硝态氮(杉木偏好吸收的有效氮素)的含量。
-
随杉木连栽代数增加,铵态氮变化不明显,硝态氮含量显著下降,除第四代土壤脲酶和氨氮加氧酶酶活性略有上升,土壤氮循环相关酶活性基本呈现降低趋势。氨氧化古菌群落丰度与多样性总体呈现降低趋势,表明连栽对氨氧化古菌微生物群落产生显著影响。不同代数杉木林AOA群落结构有较大差异,其中变形菌门、放线菌门为优势类群,随代数呈现降低趋势。本研究证实了土壤养分含量与AOA微生物群落以及土壤酶活性之间联系密切, AOA对杉木人工林土壤氮素循环硝化过程起着重要的作用,对有效评判杉木林土壤质量变化有重要意义。
Relationship between Ammonia-Oxidizing Archaea Community Structure and Nitrate Nitrogen Content in Chinese Fir Plantations at Different Generations
- Received Date: 2022-07-18
- Accepted Date: 2022-11-29
- Available Online: 2023-04-20
Abstract:





 DownLoad:
DownLoad: