-
油菜素内酯(BRs)作为一种重要的植物激素,存在于植物的各个器官中[1]参与植物幼苗生长、细胞伸长、细胞壁形成等许多生长发育过程[2-3],并且参与了植物对干旱、低温、高盐等逆境胁迫的响应[4]。
目前,关于BRs的生物合成途径已研究的较为清楚。Fujioka等人通过悬浮培养的长春花(Catharanthus roseue (Linn.) G.Don)细胞系统,以油菜甾醇(CR)作为BRs合成的起始物阐明了BRs合成的基本途径[5-6]。通过对拟南芥突变体的研究表明,在BRs的合成过程中有几个比较重要的基因参与。DET2(DEETIOLATED2)基因表达合成一个5α-还原酶(5α-reductase),可以将油菜甾醇((24R)-24-methylcholest-4-En-3-one)转变为油菜甾烷醇((24R)-24-methyl-5alpha-cholestan-3-one)[7-8]。拟南芥DET2基因功能缺失突变体det2-1中,植物无法合成BRs,表现出植株矮小、叶色深绿、根明显缩短等表型[9]。DWF4(DWARF4)基因和BR6ox(BR-6-oxidase1)基因也被认为是BRs合成的关键基因,在拟南芥突变体中具有和det2-1相似的表型[10-11]。
杨树作为研究木本植株生长发育的模式树种,研究BRs在杨树生长发育中的作用和机制对于BRs的研究和分子育种都有重要的理论指导意义。目前,在杨树中过量表达BR6ox基因和DWF4基因已有报道,均有引起杨树增高增粗等表型[12-13]。关于杨树DET2基因功能的研究,此前已有一些报导。邓伟等人、谭玉朋、严飞通过在杨树中异源表达棉花GhDET2基因,分析了对杨树生长发育的影响[14-16]。目前,关于在杨树中过量表达其自身DET2基因的研究还未见报导,关于过量DET2基因是否可以提高植物内源油菜素内酯的研究也未见报导。本研究从银腺杨84K(Populus alba×P. glandulosa,‘84K’)中分离出拟南芥AtDET2同源基因PagDET2,构建PagDET2过量表达载体,并通过遗传转化获得过量表达PagDET2的转基因杨树,对其生长、发育进行分析,为研究DET2在杨树生长发育中的功能奠定基础。
-
本研究使用的杨树材料均为银腺杨84K,为中国林业科学研究院林木遗传育种国家重点实验室保存。实验所用杨树均由组培苗扩繁而来,并由组培苗移栽至营养土中继续培养。将带有顶端的组培苗嫩茎(约2.5 cm)扦插到生根培养基(1/2MS基础培养基,0.05 mg·L−1 IBA和0.02 mg·L−1 NAA,0.5%琼脂粉,pH 5.8~6.0),培养于人工气候室(温度为23~25 ℃,光周期为14 h/10 h光照/黑暗,光照强度为 50 μmol·m−2·s−1)。生长20天后,将其移栽到营养土中,在22 ℃长日照(14 h/10 h光照/黑暗)培养室中继续培养。
本研究所使用的Gateway入门载体pDNOR207、过表达载体pMDC32、GUS组织表达分析载体pMDC164、大肠杆菌(Escherichia coli)DH5α及农杆菌(Agrobacterium tumefaciens)GV3101菌种均由本实验室保存。PCR引物合成和序列测序由Invitrogen公司完成。PCR反应用的2倍浓度的Premix高保真酶Primer STAR HS、普通扩增酶PCR-Mix、DNA marker、胶回收试剂盒(TaKaRaAgarose Gel DNA Purification Kit)均为Takara公司产品。
-
采用QIAGEN公司RNA提取试剂盒(RNeasy mini kit),并按照说明书提取RNA。RNA浓度和质量分别用Nanodrop8000(Thermo Fisher Scientific)和琼脂糖凝胶电泳检测。使用反转录试剂盒PrimeScriptTM RT reagent Kit(TaKaRa)并按照说明书操作,进行反转录合成cDNA。
在Roche 480定量仪器,使用SYBR Premix ExTaqTMⅡ试剂盒(TaKaRa)上进行RT-qPCR分析,ACTIN基因作为内参,每个样品进行4个技术重复。
-
以拟南芥AtDET2基因为目的基因,在毛果杨(Populus trichocarpa)基因组数据库(http://phytozome.jgi.doe.gov/pz/portal.html)中Blast获取AtDET2同源基因PtDET2(Potri.016G110600)序列。使用引物设计软件Primer设计PtDET2基因蛋白质编码区(CDS区)特异引物(PagDET2-F和PagDET2-R)(表1),以84K杨cDNA为模板,利用高保真聚合酶Prime STAR进行PCR扩增,得到目的基因PagDET2,并进行测序验证。
引物名称Primer name 序列(5′→3′)Sequence(5′→3′) 用途Application PagDET2-F ATGGCCCTATTAGATCAGAGCCTCT CDS区扩增 PagDET2-R TCAACACAGAAAAGGGATCACTGCT CDS sequence amplification DET2-RT-F ATGGCCCTATTAGATCAGAGCCT 半定量引物 DET2-RT-R CAGGTGCGGTGGAAGTAGTGGAAGA Primers for quantitative analysis PtPP2A-RT-F ACCGCATACAAGAGGTTCCACAT 定量引物 PtPP2A-RT-R GTAACCACATTCTTTTCCTGACACC Primers for quantitative analysis Actin-F AAACTGTAATGGTCCTCCCTCCG 内参引物 Actin-R GCATCATCACAATCACTCTCCGA Internal reference primers Table 1. Primer sequences used for PCR
-
使用ProtParam(http://web.expasy.org/protparam/)在线分析84K杨DET2蛋白的基本理化性质。利用NCBI蛋白结构分析网站(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析PagDET2蛋白结构和功能。利用NCBI网站(https://www.ncbi.nlm.nih.gov/)和植物基因组网站(https://phytozome.jgi.doe.gov/pz/portal.html)查找获取不同物种中DET2氨基酸序列。使用DNAMAN软件比对不同物种中DET2蛋白氨基酸序列,并分析保守结构域[17]。使用软件MEGA 6利用N-J法构建不同物种的DET2蛋白序列系统发育进化树。
-
利用半定量PCR方法对DET2在84K杨各组织中的表达情况进行分析。以84K杨各组织的cDNA为模板,用特异引物进行PCR扩增,并对PCR产物进行1%琼脂糖凝胶电泳。根据条带亮度判断DET2基因在各组织中的表达情况。
-
利用Gateway技术,将PagDET2基因连接至入门载体pDNOR207上,转化大肠杆菌并测序验证后,重组至过表达载体pMDC32中,转化大肠杆菌并测序验证。
将构建好的过表达载体pMDC32-DET2电击转化农杆菌GV3101感受态细胞,利用农杆菌介导的叶盘转化法转化84K杨。具体遗传转化方法见文献[18]。得到的转基因株系进行PCR检测,并提取RNA对PagDET2基因进行RT-qPCR定量分析。选择表达量较高的3个过表达转基因株系进行试验。
-
每个株系各选3株在营养土中生长2月的杨树苗,取其1至3节间,迅速放入液氮冻存,冷冻研磨后按比例加入PBS(磷酸缓冲液,pH 7.4)。使用植物(Plant)油菜素内酯(BR)ELISA检测试剂盒(绿源伯德生物公司,北京)测定油菜素内酯含量,每个样本进行3次技术重复,并按照说明操作[13]。
-
在不同年份不同批次分别选取野生型84K杨和PagDET2-OE转基因杨#1各9株,在营养土中培养75天,测量株高,并重复3次。
选取野生型84K杨和PagDET2-OE转基因杨#1各10株,在营养土中培养2个月用于耐盐性和抗旱性分析,其中高盐实验各使用5株,干旱实验各使用5株,并重复3次。在耐盐实验中,以300 mmol·L−1的NaCl水溶液处理植物,连续处理10天,持续观察;在抗旱实验中,首先给予充足水分,随后进行持续干旱处理6天,持续观察。以正常浇水的植株作为对照组。过氧化氢检测使用过氧化氢检测试剂盒(碧云天,上海),并按照说明书操作。
-
使用SPSS Statistics 24软件进行数据统计分析,并用t检验法检验差异显著水平。
-
以84K杨cDNA为模板,使用特异引物PagDET2-F和PagDET2-R通过PCR扩增获得84K杨DET2基因编码区序列,并命名为PagDET2基因。序列分析表明,PagDET2基因与毛果杨PtDET2核酸序列相似度达97.93%,蛋白序列相似度达96.89%。PagDET2基因编码区全长774 bp,编码一个长度为257个氨基酸的蛋白质,蛋白分子量约为29.84 kDa,理论等电点(pI)为9.49。PagDET2蛋白序列中含有两个5α-还原酶(5α-reductase)必需的谷氨酸[19],分别为Glu(56)和Glu(199)[20-21](图1),利用NCBI进行蛋白结构分析表明为一种固醇类还原酶DET2(steroid reductase DET2)。
利用DNAMAN软件进行多重序列比对分析表明,84K杨DET2蛋白序列与毛果杨(Populus trichocarpa Torr. & Gray)、拟南芥(Arabidopsis thaliana (L.) Heynh.)、水稻(Oryza sativa L.)、棉花(Gossypium hirsutum Linn.)、大豆(Glycine max (Linn.) Merr.)、番茄(Lycopersicon esculentum Mill)DET2蛋白序列具有较高的相似度(图1)。一些区域存在着明显的保守序列,可能是重要的功能结构域。
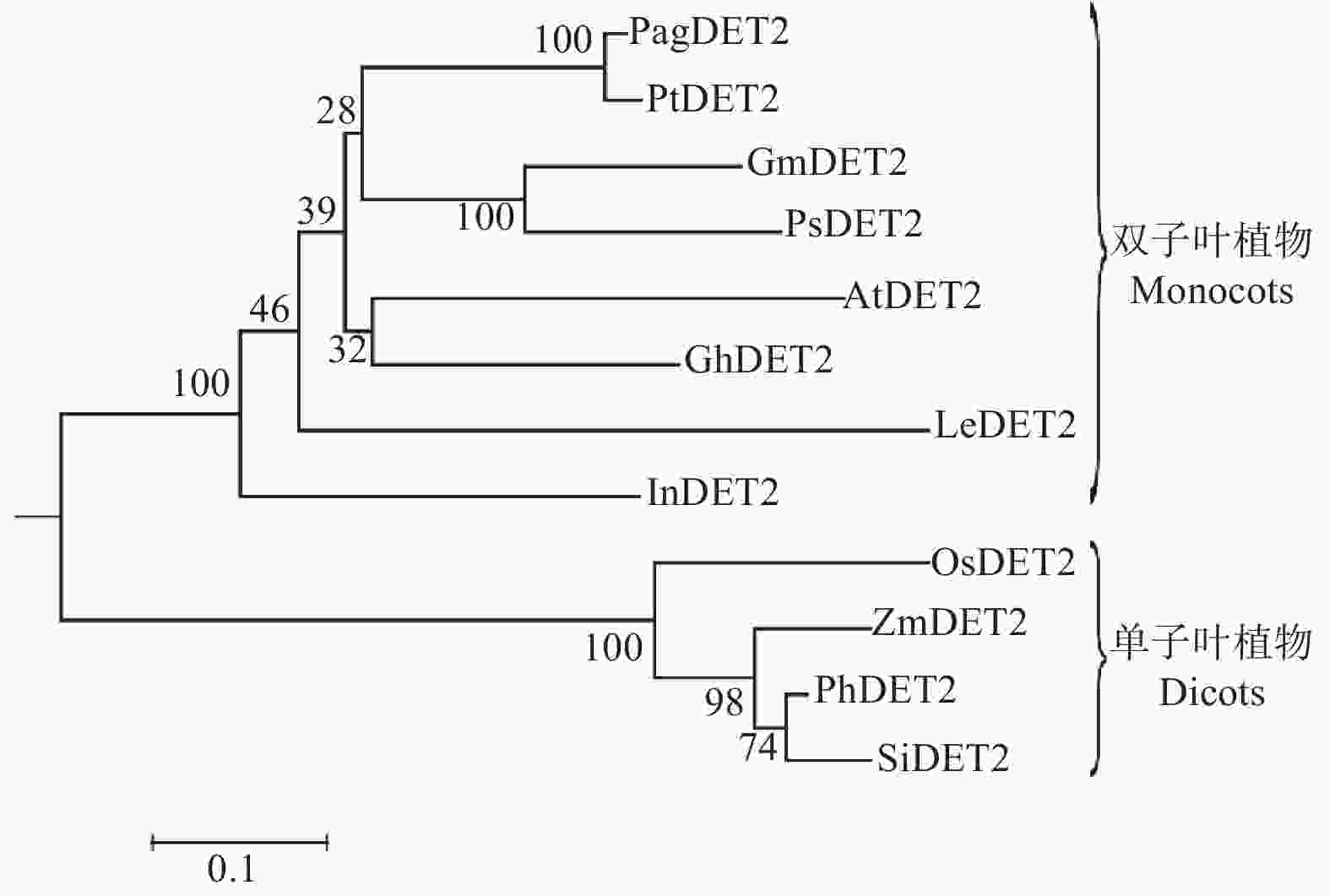
构建基于84K杨、毛果杨、拟南芥、水稻等植物DET2蛋白氨基酸序列的系统发育进化树(图2)。结果显示,DET2蛋白的进化在高等植物中主要分为单子叶植物和双子叶植物两个类群。84K杨DET2与毛果杨、拟南芥等双子叶植物DET2同属于一个系统发育分支,亲缘关系较近,而与水稻、玉米等单子叶植物DET2亲缘关系较远,这与形态学分类相一致。
-
为了研究PagDET2基因的组织表达情况,分别取84K杨根、未完全展开的嫩叶、成熟叶、中间节间和正在伸长的1至3节间提取总RNA,反转录后进行半定量PCR检测。结果表明,PagDET2基因在84K杨各个组织中均有表达,且在1至3节间(In1-3)、中间节间(S)和嫩叶(YL)表达量较高,在根(R)和成熟叶片(ML)中表达量较低。PagDET2基因作为油菜素内酯合成的必须基因,参与了植物顶端生长、叶片成熟、木材形成等生长发育过程(图3)。
-
为了进一步研究PagDET2基因在杨树生长发育中的作用,构建了由CaMV 35S启动子驱动的PagDET2过表达载体PagDET2-OE Vector,采用农杆菌侵染叶盘法,获得了过量表达PagDET2基因的转基因株系PagDET2-OE。通过PCR克隆和RT-qPCR检测后,选取3个表达量较高(图4)的株系(命名为#1、#2、#3)进行试验。
-
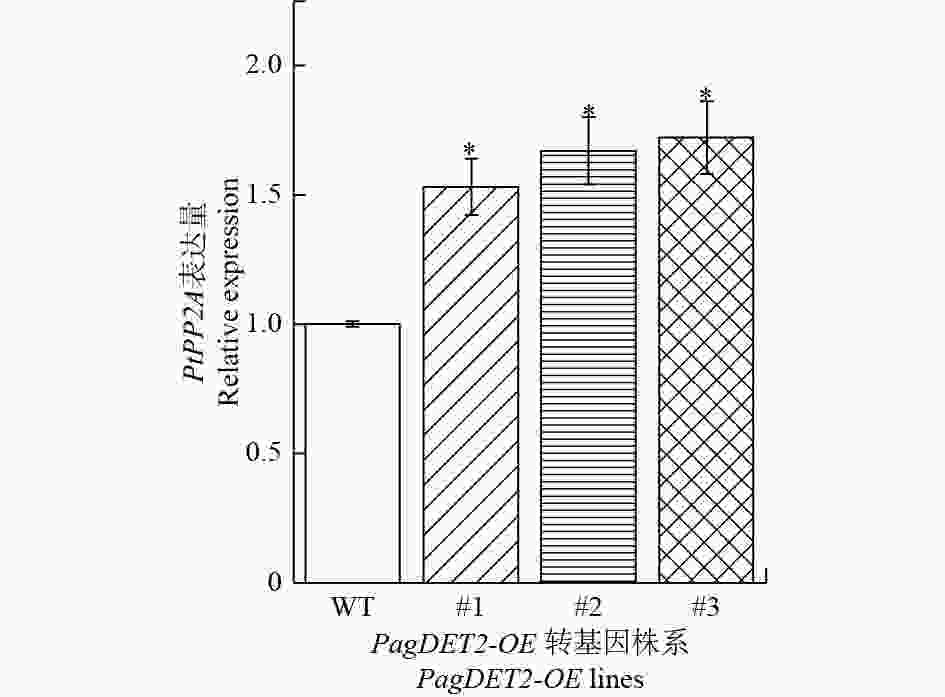
DET2基因作为油菜素内酯合成过程中的关键限速基因,为了研究DET2基因在杨树中的过量表达后对植物体内油菜素内酯含量的影响,通过RT-qPCR检测了油菜素内酯信号通路关键基因PtPP2A基因在PagDET2-OE株系中的表达量。结果显示:PagDET2-OE转基因杨中的PtPP2A基因显著高于野生型84K(图5)。
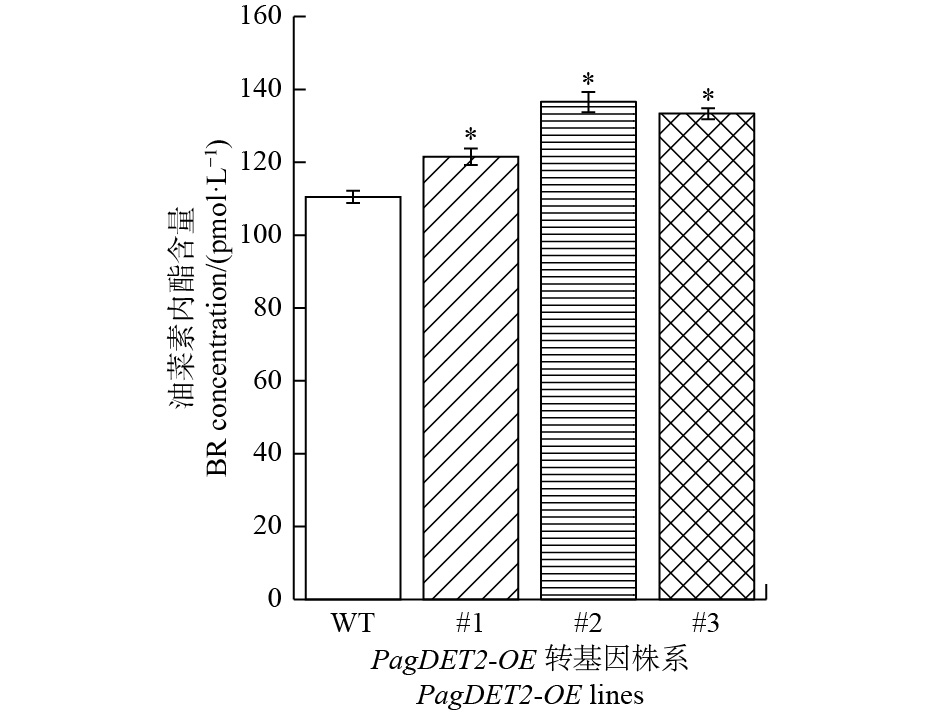
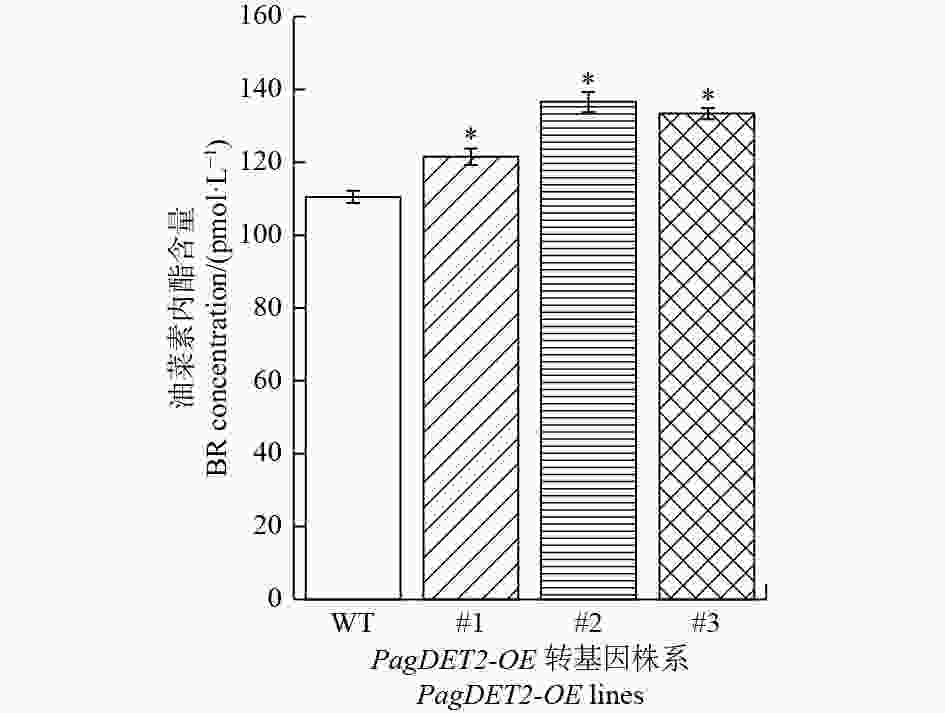
进一步通过ELISA检测杨树体内油菜素内酯的含量,结果显示:与野生型84K杨对比,PagDET2-OE株系中油菜素内酯含量显著升高(图6)。
-
在人工气候室培养室同时培养野生型84K杨和PagDET2-OE转基因杨,生长75天的PagDET2-OE转基因杨高生长明显高于野生型84K杨(图7)。
为了研究PagDET2基因对于植物抗盐、耐旱的影响,对野生型84K和PagDET2-OE转基因杨进行干旱和盐胁迫。结果显示:在未胁迫的情况之下,转基因杨树和野生型84K杨都能正常生长;在干旱胁迫6天后,野生型84K杨和PagDET2-OE转基因杨都出现了萎蔫、叶片卷曲、枯黄的现象,无明显差别;在盐处理8天后,野生型84K杨还能正常生长,但是PagDET2-OE转基因杨出现了蔫蔫、叶片卷曲、枯黄的现象(图8)。对野生型84K杨和PagDET2-OE转基因杨进行过氧化氢含量检测,取正常生长、干旱处理3天和盐处理4天后的叶片,液氮研磨后使用过氧化氢检测试剂盒检测其过氧化氢含量,结果显示:未处理时,过氧化氢含量基本相同,干旱处理和盐处理均会导致过氧化氢含量升高,但是干旱处理3天后两者没有明显差别,盐处理4天后,PagDET2-OE转基因杨的叶片过氧化氢含量显著高于相同处理的野生型84K杨。
-
植物激素在调节植物生长发育方面具有不可替代的作用,DET2基因作为BRs合成过程中的关键限速基因,对于BRs的合成有重要作用,改变其在植物体内的表达,对于研究BRs对于植物的功能和机制有重要意义。
基因表达模式的组织分析表明,正在伸长生长的茎和已经完成伸长生长的茎中DET2基因均有较高的表达,说明DET2可能影响茎的生长发育。过量表达杨树DET2有增高表型,这一结果与在杨树中异源表达棉花GhDET2基因的结果相似[14-16]。PtPP2A是AtPP2A基因的同源基因,有研究表明AtPP2A调控着BRZ1的磷酸化,BZR1是油菜素内酯信号通路的核心,所以AtPP2A被认为是油菜素内酯信号通路的开关,在油菜素内酯信号传导中有重要的积极作用[1,22]。PagDET2-OE转基因杨中的PtPP2A基因显著高于野生型84K,说明转基因杨中油菜素内酯下游信号通路可能得到了加强。
通过ELISA检测植物体内BRs的含量表明,PagDET2-OE植株中的BRs含量明显高于野生型。且前人研究表明拟南芥DET2基因功能缺失突变体det2-1中,植物无法合成BRs[9],说明改变DET2基因的表达量可以改变植物内源BRs的含量,这对于进一步研究油菜素内酯在植物生长发育中的调控机制有重要意义。DET2过量表达对于茎生长发育和油菜素内酯信号通路基因表达量的影响可能是通过改变油菜素内酯含量实现的。这一功能与BRs合成的另一关键基因DWF4相似,在杨树中过量表达DWF4基因,可以促进杨树增高,提高BRs含量[13]。关于DET2等BRs合成中的关键基因的研究对利用转基因技术增加杨树生物量,从而进行定向分子育种有潜在应用价值。
杨树中过量表达PagDET2基因可使植株对高盐的耐受性明显下降。盐处理4天后,PagDET2-OE转基因杨的叶片过氧化氢含量显著高于相同处理的野生型84K杨,这从生理上明确了高表达转基因杨树抗性降低的机制。雷雨婷等研究了过量表达杨树PtDET2基因对烟草在干旱、高盐等处理下的影响[23],通过在烟草中过量表达PtDET2基因,可以提高烟草抗旱、耐盐能力。这与本研究结果有些不同,可能是由于烟草和杨树的生长特性不同导致的。84K杨作为木本植物速生树种,对分水需求很大,对高盐和干旱更敏感。本研究观察到的高生长转基因植株的抗逆性降低,预示着培育速生林木品种需要精细的管理,尽量避免其处于胁迫状态。
-
本研究通过转基因技术,分析了DET2基因作为BRs合成的关键基因在杨树生长中的作用。结果表明,过量表达可以显著提高内源BRs含量,促进植株增高,对速生品种的定向培育提供了基础。但高生长植株对高盐胁迫更具有敏感性,在林木培育中应尽量避免逆境胁迫。
Cloning and Characterization of Brassinosteriod Biosynthesis-related Gene DET2 in Poplar
- Received Date: 2019-06-26
- Accepted Date: 2019-09-11
- Available Online: 2020-03-01
Abstract:











 DownLoad:
DownLoad: