-
杨树是林木遗传研究的模式树种[1],是北半球种植面积最广,适应性最强的落叶阔叶树种[2],在我国生态建设中发挥着巨大的作用。近年来,我国杨树转基因已取得重大进展,主要集中在其重要的经济及生态价值的基因功能研究上。小黑杨(Populus simonii×P. nigra)是小叶杨(Populus simonii Carr)与欧洲黑杨(Populus nigra L.)的杂交品种,其生长迅速、抗寒、抗旱性强,生态潜力巨大,在中国北方得到了广泛种植[3]。近年来,对于小黑杨的研究主要集中在利用转基因技术来增强抗病性[4]、抗虫性[5]、耐盐性[6-7]以及基因功能的研究[8-9]等方面,利用蛋白质组学对小黑杨进行研究的报道相对较少。然而,蛋白质作为生命活动的主要承担者[10],执行大多数的生物功能,通过蛋白质组学的研究可以获取在遗传层面无法获得的信息,因此,进行蛋白质组学的研究具有很高的价值。
蛋白质组学的概念最初是由澳大利亚科学家Wilkins等[11]提出的,蛋白质组学研究中最常用的技术之一是双向电泳(two-dimensional electrophoresis,2-DE)[12],双向电泳技术与质谱技术相结合,已成为蛋白质组学中分离蛋白质的有效方法[13]。双向电泳技术已经被广泛应用于植物的蛋白质组学研究中,如Romeo等[14]通过双向电泳技术分析意大利杨根部响应锌胁迫的关键因素,Liu等[15]利用双向电泳技术分析了毛果杨早期茎从初生生长到次生生长的蛋白质组学的变化。尽管双向电泳体系优化已有广泛研究,但由于植物的生物学特性、生理生化特性不尽相同,对于不同植物物种,最适的电泳条件不同[16]。因此,必须针对植物的不同特点进行双向电泳体系的优化以进行蛋白质组学的研究。杨树叶片富含色素、多酚、多糖、有机酸等次生代谢物质,对电泳过程干扰很大,导致双向电泳图谱背景高、蛋白质不清晰,从而使杨树叶片双向电泳技术和蛋白质组学的研究受到很大的限制。因此,在进行杨树叶片蛋白质组学的研究之前,对杨树叶片蛋白质的双向电泳体系进行优化是十分重要的。
目前,关于杨树叶片蛋白质双向电泳体系优化相关的研究尚未见报道。本研究以小黑杨叶片为材料,对双向电泳技术中的主要影响因素进行探讨,探究出了适用于小黑杨叶片蛋白质组学研究的双向电泳体系;该体系同样适用于大青杨与84 K杨叶片的蛋白质双向电泳,因此,该双向电泳体系可用于杨树叶片蛋白质组学的分析,并为其他木本植物叶片的蛋白质组学的研究提供参考资料。
HTML
-
本实验以东北林业大学林木遗传育种国家重点实验室温室内种植的小黑杨、大青杨和84 K杨为材料。从植株上剪下长20.0 cm,径0.5~1.0 cm的枝条,并将枝条插入装有草炭土、蛭石和珍珠岩(体积比为5:3:2)的塑料盆中。培养条件:温度25~30℃,湿度70%~80%,光照16 h·d−1。扦插苗培养3个月后,采集自茎尖起的第3~5片叶片,将采摘下来的叶片立刻放入液氮中速冻处理,装入样品袋,将叶片碾碎后混合,存放于-80 ℃冰箱备用。
-
使用的主要药品有二硫苏糖醇、碘乙酰胺、硫脲、尿素、十二烷基硫酸钠、Tris base、甘氨酸均购自Sigma公司;IPG buffer、固相pH梯度IPG干胶条、矿物油均购于美国GE Helthcare公司;乙二胺四乙酸、氯化钠、丙三醇、苯甲咪盐酸水合物、β-甘油磷酸二钠水合物、三氯乙酸、β-巯基乙醇、四甲基乙二胺、无水乙醇、冰乙酸、硝酸银、无水乙酸钠、硫代硫酸钠、无水碳酸钠、甲醛、戊二醛、考马斯亮蓝R250均购自国药集团化学试剂有限公司;TritonX-100、溴酚蓝、过硫酸铵、丙烯酰胺、N,N’一甲叉双丙烯酰胺均购自Biotopped公司;标准分子量蛋白Marker购自Thermo公司;Bradford蛋白浓度测定试剂盒购自上海生工生物工程有限公司;其他常规试验试剂均为国产分析级试剂。
使用的主要仪器有冷冻离心机(Eppendorf,德国),超声波细胞粉碎机(兰仪,上海),万分之一天平(Sartorius,德国),高速冷冻离心机离心机(Eppendorf,德国),漩涡混合器(Crystaln,美国),制冰机(Scotaman,意大利),酶标仪(永创,上海),水浴锅(中兴伟业,北京),Ettan IPGphor3 (GE Helthcare,美国),EttanDALTsix (GE Helthcare,美国),ImageScanner Ш (GE Helthcare,美国),ImageMasterTM 2D Platinum 7.0 (GE Helthcare,美国)。
-
本研究以小黑杨叶片为材料,对小黑杨叶片蛋白质双向电泳体系的2D裂解液、蛋白的纯化、IPG胶条的pH范围、蛋白上样量、等电聚焦时间和SDS平衡时间进行优化。
-
蛋白样品提取后需要用2D裂解液重新溶解再进行双向电泳实验。本实验选择了2种2D裂解液溶解小黑杨叶片蛋白质,即:2D裂解液Ⅰ(9.8 mol·L−1Urea,4% CHAPS,10% DTT)和2D裂解液Ⅱ(7 mol·L−1 Urea,2 mol·L−1Thiourea,4% CHAPS,10% DTT),比较2种2D裂解液对小黑杨叶片蛋白质分离的影响。
-
小黑杨叶片蛋白质提取后含有较多的多糖、多酚等非蛋白类物质,影响双向电泳图谱的分辨率。为了获得高纯度的蛋白质样品,提高蛋白质的分离效果,笔者对小黑杨叶片蛋白质样品进行纯化。本实验采用TCA-丙酮法和2D clean-up kit法对小黑杨叶片蛋白质进行纯化,采用纯化后的蛋白样品进行双向电泳实验,比较2种方法对小黑杨叶片蛋白质的纯化效果。
三氯乙酸—丙酮(TCA-丙酮)法:取280 μL蛋白上清液于1.5 mL离心管中,加入1.4 mL −20℃保存的蛋白提取液I(含0.07% β-巯基乙醇,10% 三氯乙酸),上下颠倒混匀,−80℃存放2 h。12 000 g,4℃,离心20 min。弃除上清,用蛋白提取液II(含0.07% β-巯基乙醇)洗涤沉淀3次,直至沉淀呈白色。将沉淀真空干燥3~5 min,取适量2D裂解液(7 mol·L−1尿素,2 mol·L−1硫脲,1%DTT,4%CHAPS)溶解蛋白样品。将样品进行液氮冷冻处理,–80℃冰箱保存。
2D clean-upkit(GE,美国)法:取100 μL蛋白上清液加入300 μL沉淀剂,混匀,冰上培育15 min;再加入300 μL共沉淀剂,混匀;4℃,12 000 g离心5 min;离心后弃去上清液,在离心管中加入40 μL共沉淀剂,冰浴5 min;4℃,12 000 g离心5 min;弃上清,加入25 μL去离子水,振荡5~10秒;加入1 mL预冷的洗涤缓冲液和5 μL洗涤添加剂,振荡直至沉淀完全散开,置于−20℃冰箱保存30 min;4℃,12 000 g离心5 min,将上清液移走弃去,用适量的2D裂解液溶解沉淀,4℃,12 000 g离心5 min,留取上清,将蛋白样品液氮冷冻,放−80℃冰箱中保存以备日后分析。
-
进行等电聚焦前需要选择合适的pH范围的IPG胶条,使用不同pH范围的IPG胶条分离小黑杨叶片蛋白质得到的双向电泳图谱的分辨率不同。为了找到适用于小黑杨叶片蛋白质分离的IPG胶条的pH范围,本实验分别采用24 cm、pH 3~10和pH 4~7的线性IPG胶条进行双向电泳实验,比较2种不同范围的IPG胶条对小黑杨叶片蛋白质的分离效果。
-
进行等电聚焦前笔者对蛋白上样量进行选择。为了获得能够呈现更多的蛋白质信息且分辨率较高的双向电泳图谱,本实验分别取600 μg和1 mg蛋白样品进行双向电泳实验,比较2种蛋白上样量可检测到的蛋白质的数目和蛋白质的分离效果。
-
在等电聚焦程序的设定中,10 000 V的等电聚焦时间会影响蛋白质的分离效果。为了获得背景清晰,分辨率较高的双向电泳图谱,本实验对10 000 V的等电聚焦时间进行优化,比较6、11、13 h对小黑杨叶片蛋白质的分离效果。
-
等电聚焦结束后需要对胶条进行平衡,平衡时间的长短会影响双向电泳图谱的分辨率。为了找到合适的平衡时间,本实验设定了3个平衡时间,分别为:40、50、60 min,将平衡好的胶条进行SDS-PAGE(Sodium Dodecyl sulfate-Polyacrylamide gel electrophoresis)电泳,分析不同平衡时间对双向电泳图谱分辨率的影响。
-
参考索慧英等[17]方法。分别取小黑杨、大青杨和84 K杨叶片,每种叶片取3份,每份 1 g,分别加入液氮研磨至细粉。将样品分别转移至15 mL离心管中,每份加入1.5 mL蛋白裂解液(2 mmol·L−1 EDTA,137 mmol·L−1 NaCl,40 mmol·L−1 Tris-HCl (pH 6.8),1 mol·L−1 DTT,1%TritonX-100,10%Glycerol,0.5 mmol·L−1 benzamidine,50 mmol·L−1 β-glycerophosphate),充分混匀,冰浴条件下超声破碎处理6 min(φ2,26℃,3/9sec);12 000 g,4℃,离心20 min;留取上清,分别将每种叶片提取出的蛋白上清液转移至一个离心管中,充分混合均匀后进行液氮冷冻处理,存放于−80℃冰箱保存备用。
-
采用2D clean-upkit法对小黑杨、大青杨和84 K杨叶片总蛋白质进行纯化,操作步骤见1.3.1.2,其中,获得的蛋白沉淀用2D裂解液Ⅱ进行溶解。将蛋白样品液氮冷冻,放−80℃冰箱中保存。
-
本实验采用改良型Bradford蛋白浓度测定试剂盒(生工,上海)测定蛋白浓度,使用牛血清蛋白(BSA)作为标准样品,分别取浓度为1 mg·mL−1的BSA标准溶液0、4、8、12 μL于0.5 mL的离心管中,用去离子水分别添加至终体积为40 μL,旋涡振荡混合均匀。分别从每管中取出20 μL溶液加入到酶标板中,在每个孔中分别加入200 μL的Bradford工作液,吸打混匀,室温反应5 min。使用酶标仪读取波长为595 nm的吸光值,以不同BSA含量(mg)为横坐标,吸光值为纵坐标,绘制标准曲线。
将待测蛋白样品稀释至合适浓度,按照上述操作步骤测定蛋白样品的吸光值,记录吸光值。根据所测样品的吸光值,在标准曲线上即可查得相应的蛋白含量,除以样品稀释液的总体积,乘以样品稀释倍数即为样品的实际浓度。每个样品重复测定3次,取平均值做为该样品的浓度值。
-
第一向等电聚焦(Isoelectric focusing,IEF),取1 mg蛋白样品加入水化液(9.8 mol·L−1 Urea,0.002%BPB,2%IPG buffer,2%CHAPS)至总体积为450 μL,充分混匀,将样品自左而右线性加入到水化槽中,将24 cm、pH 4~7线性IPG胶条保护膜去除,胶面朝下缓慢的置于样品溶液上并覆盖矿物油,将水化槽置于等电聚焦仪中。在20℃条件下进行等电聚焦,等电聚焦参数设置见表1。
步骤Steps 电压Voltage/V 升压模式Boosting mode 时间Time/h Step1 50 快速Rapid 24 Step2 500 快速Rapid 5 Step3 1 000 线性Linear 1 Step4 8 000 线性Linear 3 Step5 8 000 快速Rapid 3.75 Step6 10 000 线性Linear 3 Step7 10 000 快速Rapid 13 Table 1. The program of isoelectric focusing electrophoresis
等电聚焦结束后将胶条进行两步平衡。第一步:将胶条置于平衡缓冲液I(75 mmol·L−1 Tris-HCl (pH 8.8),6 mol·L−1 Urea,30% Glycerol,2% SDS,1% DTT)中平衡40 min。第二步:将胶条转移到平衡缓冲液II(75 mmol·L−1 Tris-HCl (pH 8.8),6 mol·L−1 Urea,30% Glycerol,2% SDS,2.5%碘乙酰胺)中平衡40 min。平衡结束后进行第二向SDS-PAGE电泳,分离胶的浓度为13%,电泳条件为1 W·gel−1,电泳30 min后调整为13 W·gel−1,至溴酚蓝指示剂到达距凝胶底部1 cm处停止电泳,将凝胶取出,进行银染染色。
-
参考严冬等[18]方法。固定30 min,致敏30 min,漂洗3次,每次10 min;染色20 min后立即水洗2次,每次1 min;显色至蛋白质点清晰后终止5 min。染色后的凝胶利用ImageScanner Ш扫描仪与ImageMasterTM 2D Platinum 7.0分析软件进行图像的采集与分析,分辨率为300 dpi。
1.1. 试验材料
1.2. 试剂和仪器
1.3. 方法
1.3.1. 小黑杨叶片蛋白质双向电泳体系的优化
1.3.1.1. 双向电泳裂解液的选择
1.3.1.2. 小黑杨叶片蛋白样品的纯化
1.3.1.3. IPG胶条pH范围的选择
1.3.1.4. 蛋白上样量的选择
1.3.1.5. 等电聚焦时间的选择
1.3.1.6. SDS平衡时间的选择
1.3.2. 小黑杨、大青杨和84 K杨叶片蛋白质双向电泳图谱的建立
1.3.2.1. 小黑杨、大青杨和84 K杨叶片总蛋白质的提取
1.3.2.2. 小黑杨、大青杨和84 K杨叶片总蛋白质的纯化
1.3.2.3. 蛋白质含量的测定
1.3.2.4. 双向凝胶电泳
1.3.2.5. 银染及图像的扫描与分析
-
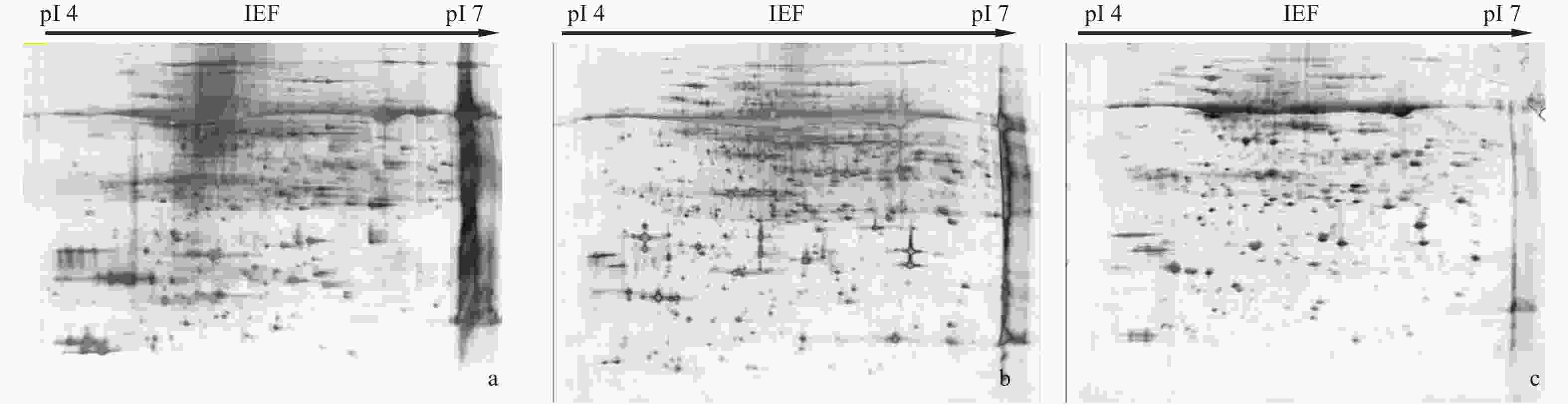
本研究比较了2D裂解液Ⅰ和2D裂解液Ⅱ对蛋白质分离的影响。选用24 cm、pH 3~10的线性IPG胶条,蛋白上样量为300 μg,进行双向电泳。图1表明:使用2D裂解液Ⅰ的图谱(图1a)中可检测到117个蛋白质,图中蛋白质的溶解性差,碱性端蛋白质个数少,且蛋白质的聚焦效果不好,未能有效分离;使用2D裂解液Ⅱ的图谱(图1b)分辨率高,可检测到326个蛋白质。实验结果表明:选用2D裂解液Ⅱ溶解小黑杨叶片蛋白质可获得分辨率较高的2-DE图谱。
-
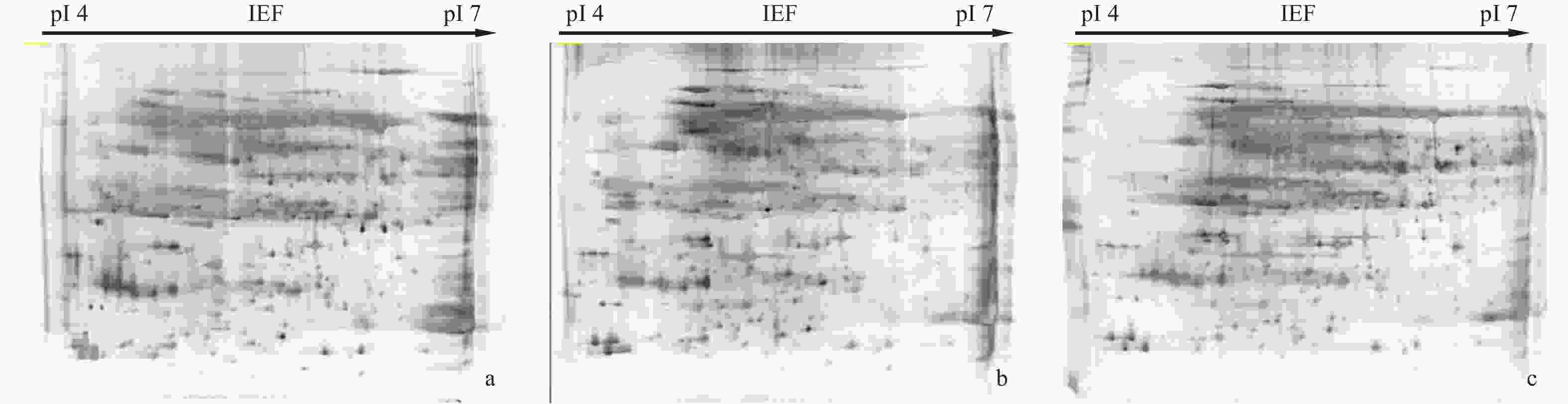
本研究比较了TCA-丙酮法和2D clean-up kit法对小黑杨叶片总蛋白质纯化的效果。选用24 cm、pH 3~10的线性IPG胶条,蛋白上样量为600 μg,进行双向电泳。图2表明:采用TCA-丙酮法(图2a)纯化的蛋白样品,可检测到364个蛋白质,其双向电泳图谱有较高的背景,蛋白质未能有效分离且大分子量的蛋白聚焦效果较差;采用2D clean-up kit法(图2b)纯化的蛋白样品,其双向电泳图背景清晰,图谱分辨率较高,蛋白质的整体聚焦效果好,可检测到的蛋白质个数为450个。实验结果表明:2D clean-up kit法适用于小黑杨叶片双向电泳蛋白样品的纯化。
-
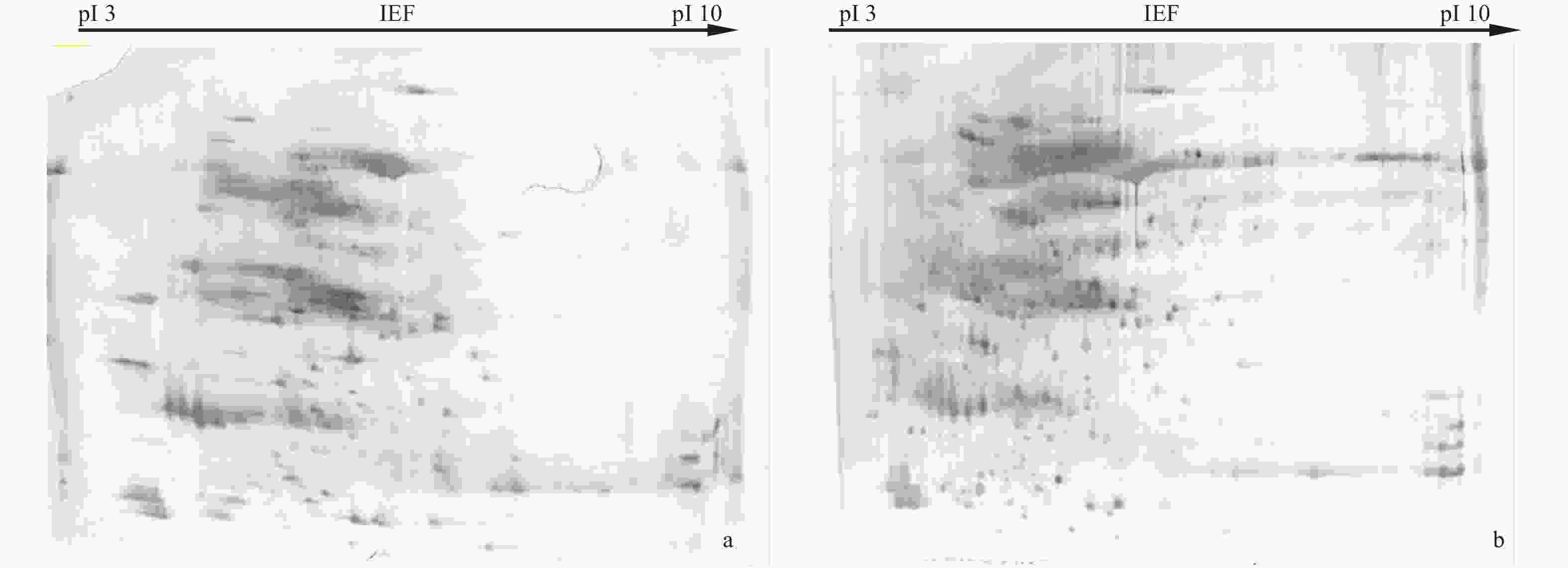
本研究比较了pH 3~10和pH 4~7的线性IPG胶条对蛋白质分离的效果。选用24 cm的IPG胶条,蛋白上样量为600 μg进行双向电泳。图3表明:采用pH 3~10的IPG胶条的双向电泳图谱(图3a)中,小黑杨叶片蛋白主要分布在酸性端至中性区域,碱性端分布较少,可检测到354个蛋白质;采用pH 4~7的IPG胶条(图3b)分离所得蛋白在凝胶上分布比较均匀,可检测到393个蛋白质,分离效果明显优于前者,更有利于蛋白质组学研究中差异蛋白质的分离和鉴定。该实验结果表明:小黑杨叶片中的碱性蛋白较少,主要集中在酸性端且主要分布在pH 4~7范围内,所以pH 4~7的IPG胶条适用于小黑杨叶片蛋白质的分离。
-
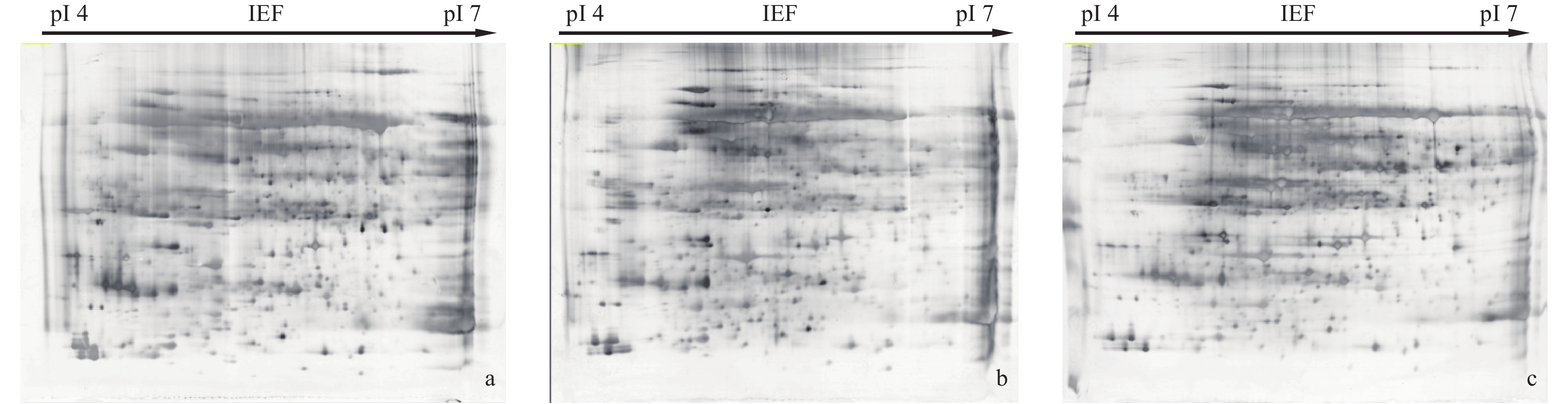
本研究对蛋白上样量600 μg和1 mg进行比较,选用24 cm、pH4~7的线性IPG胶条进行双向电泳。图4表明:蛋白上样量为600 μg的图谱(图4a)可检测到393个蛋白质;蛋白上样量提高到1 mg(图4b)可检测到蛋白质的个数明显增加,低丰度蛋白得以显现,可检测到454个蛋白质。实验结果表明:本研究的双向电泳体系可以对1 mg的小黑杨叶片蛋白质进行很好的分离。
-
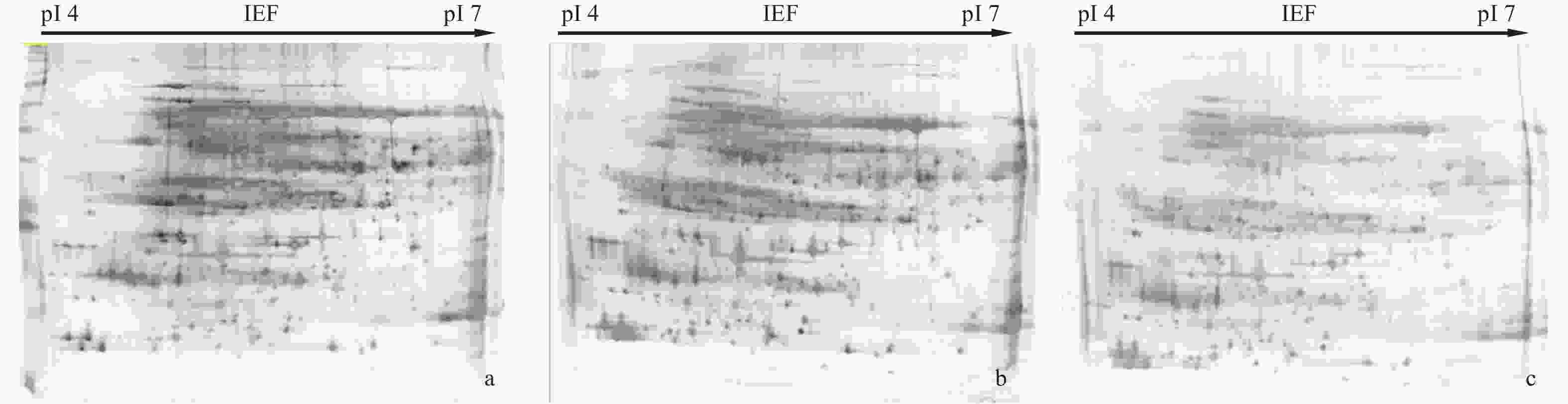
本研究对10 000 V的等电聚焦时间进行了优化,比较了6、11、13 h条件下等电聚焦的效果。本研究选用24 cm、pH 4~7的胶条,蛋白上样量为1 mg进行双向电泳。图5表明:聚焦时间为6 h的电泳图谱(图5a)中,蛋白质的聚焦不充分有水平拖带,且蛋白质未能有效分离,通过软件分析可检测到的蛋白质的个数为454个;聚焦时间为11 h的图谱(图5b)中,可分辨的蛋白质的个数明显增加,可检测到510个蛋白质,聚焦效果明显增强,但仍存在水平拖尾;聚焦时间为13 h的图谱(图5c)中,图像背景清晰,横向拖带较少,可检测到539个蛋白质,且胶图中各蛋白质圆滑清晰,聚焦情况良好。实验结果表明:蛋白上样量达到1 mg,10 000 V的等电聚焦时间为13 h时胶图中蛋白点的聚焦效果好,所获得的图谱分辨率较高。
-
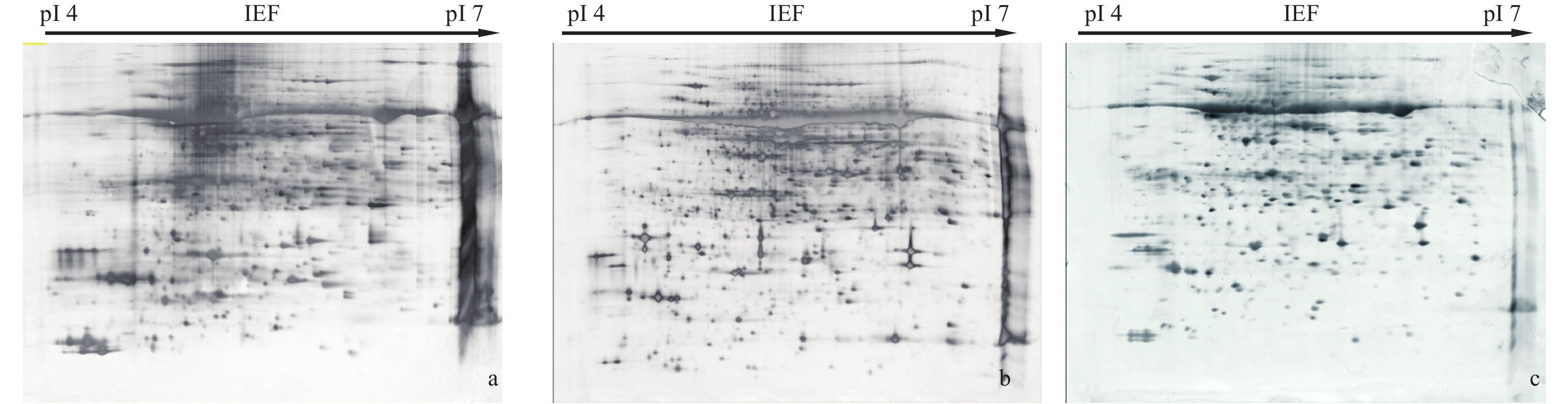
本研究对平衡时间40、50、60 min进行比较分析。本实验采用pH 4~7,24 cm的胶条,蛋白上样量为1 mg进行双向电泳。图6表明:平衡时间为40 min时,可检测的蛋白质的个数为539个(图6a);平衡时间延长至50 min时,蛋白质的个数减少,可检测到436个蛋白质(图6b);当平衡时间延长至60 min时,随着胶条中蛋白损失量的逐渐增加,蛋白质的显色程度逐渐降低,可检测到的蛋白质为363个(图6c)。结果表明:在小黑杨叶片蛋白质的分离中,适宜的平衡时间为40 min。
-
本研究采用优化后的双向电泳体系对小黑杨(图7a)、大青杨(图7b)和84 K杨(图7c)的叶片蛋白质进行双向电泳实验,选用2D裂解液Ⅱ溶解蛋白样品,2D clean-up kit法纯化蛋白样品,使用24 cm、pH 4~7的IPG胶条,蛋白上样量为1 mg,10 000 V的等电聚焦时间为13 h,平衡时间为40 min进行双向电泳。获得的图谱分别可检测到531、828和525个蛋白质,且蛋白质的分离效果较好,图谱的分辨率较高。结果表明:本研究优化的双向电泳体系适用于杨树叶片蛋白质组学的研究。
2.1. 小黑杨叶片蛋白质双向电泳体系的优化
2.1.1. 双向电泳裂解液的选择
2.1.2. 小黑杨叶片蛋白样品的纯化
2.1.3. IPG胶条pH范围的选择
2.1.4. 蛋白上样量的选择
2.1.5. 等电聚焦时间的选择
2.1.6. SDS平衡时间的选择
2.2. 小黑杨、大青杨和84 K杨叶片蛋白质双向电泳图谱的建立
-
目前,蛋白质组学技术在白桦(Betula platyphylla Suk.)[19]、旱柳(Salix matsudana Koidz)[20]、茶树(Camellia sinensis (L.)O. Kuntze)[21]及杨树[15]等植物的蛋白质组学研究中进行了广泛的应用,在推动木本植物蛋白功能的研究与发展中起到了重要的作用。如宁德利[22]利用蛋白质组学技术分析了小黑杨顶芽进入休眠、保持休眠及解除休眠3个阶段的蛋白质的变化,获得了74个差异蛋白质;张小玲等[23]利用蛋白质组学技术分析了杨树不同种质成熟花粉萌发的特性及致敏蛋白的差异,发现不同种质间杨树的花粉活力、致敏蛋白的数量及表达量存在明显差异。对于杨树叶片蛋白质组学的研究也有一些报道,如Kieffer等[24]研究了镉胁迫对杨树叶片蛋白质表达的影响,获得了125个差异表达蛋白质,对118个差异蛋白进行了鉴定与分析,阐明了碳代谢与氧化胁迫机制参与杨树叶片镉胁迫的应答;岳宁等[25]对胡杨(Populus euphratica Oliv.)异形叶锯齿阔卵型以及披针形叶片蛋白质分别进行双向电泳实验,对图谱比较分析后发现了73个差异表达蛋白质,揭示了胡杨为了适应生存环境,叶片中蛋白质的表达发生了变化,形成了不同形状的叶片;金鑫[26]对小黑杨叶片参与H2O2胁迫应答的蛋白质进行了分析,获得了81个小黑杨叶片响应H2O2胁迫的差异表达蛋白质。由于杨树叶片中含有较多的多糖、酚类及核酸等物质,对蛋白质的分离产生了较大的影响,导致在杨树叶片蛋白质组学的研究中获得的差异蛋白质的个数较少,图谱的背景较高,图谱不够清晰。为了进一步获得更多的差异蛋白质,对蛋白质的功能进行全面的研究与分析,对杨树叶片蛋白质双向电泳体系进行优化是十分必要的。迄今为止,杨树叶片蛋白质双向电泳体系优化相关的研究尚未见报道。在蛋白质组学的研究中,获得高质量的双向电泳图谱,在2-DE凝胶展示更多的蛋白质是进行后续分析的前提,因此,对杨树叶片蛋白质进行双向电泳体系的优化可为后续的杨树叶片蛋白质组学的研究奠定基础。
-
在双向电泳体系中,蛋白样品制备的好坏直接关系到图谱质量的好坏。在进行等电聚焦前需要将蛋白样品重新溶解,确保样品在2D裂解液中有良好的溶解性,这对获得分辨率高且蛋白质个数多的二维凝胶图谱是至关重要的。尿素是一种常用的离液剂,在蛋白质的溶解中应用较多,它可以改变或破坏蛋白质内部的氢键、疏水键等次级键的结构,使蛋白质变性及蛋白酶失活[27]。硫脲是一种增溶剂,在膜蛋白的提取中应用较多[28],但由于其不溶于水,溶于高浓度尿素的特性,需与尿素混合使用[29];硫脲可提高蛋白的溶解性,增强2-DE的效果。本研究采用尿素与硫脲联用的2D裂解液Ⅱ溶解小黑杨叶片蛋白质获得了蛋白质个数多、聚焦效果较好的双向电泳图谱。
小黑杨叶片中富含多糖、色素、核酸等物质,在胶图中呈现出较高的背景,影响蛋白质的识别。本研究采用TCA-丙酮沉淀法与2D clean-up kit法对获得的蛋白样品进行纯化,TCA-丙酮沉淀法是基于蛋白在酸和/或疏水条件下变性使蛋白浓缩并去除污染物的原理[30],最早用于小麦蛋白的提取,是目前提取植物蛋白的常用方法之一。TCA能有效地抑制蛋白酶对蛋白质的水解作用,保证在制样过程中蛋白质不被降解[31];然而,该方法的最大的缺点是样品中的非蛋白成分很难去除[32],导致双向电泳图谱有较高的背景,从而掩盖部分蛋白质,影响蛋白质组学的分析。2D clean-up kit法可通过定量沉淀蛋白质去除核酸、盐类、脂类和酚类等干扰物质,在苜蓿细胞壁[33]和豌豆种子[34]的蛋白质样品制备中已有使用报道;同时,该方法可以有效的浓缩蛋白样品,特别适用于上样量大的样品。本研究通过比较2种蛋白纯化方法发现,对于小黑杨叶片蛋白而言,采用2D clean-up kit对蛋白样品进行纯化可有效去除杂质和干扰物质,获得背景清晰,分辨率较高的双向电泳图谱,可满足小黑杨蛋白质组学研究的要求。
-
双向电泳对蛋白质的分离效果主要受IPG胶条的pH范围、蛋白上样量和等电聚焦条件等因素的影响。选择合适的pH范围的胶条能提高图谱的分辨率,通常情况下选择pH 3~10的胶条进行分离蛋白质,选用较宽pH范围的胶条,可以使双向电泳图谱中呈现更多的蛋白质,更能全面反映植物组织细胞内蛋白质的表达情况;但如果胶条的pH范围与蛋白样品中蛋白的等电点范围相差较大,则会使蛋白过于集中无法完全分离,造成部分蛋白点重合影响分析效果[35]。Görg等[36-37]研究表明,使用窄pH范围的IPG胶条分离蛋白质样品,可提高图谱的分辨率,并可提高该pH范围内所检测到的蛋白质的数量。在本研究中,与pH 3~10的IPG胶条相比,采用pH 4~7的IPG胶条可以分离出更多的蛋白质。
合适的蛋白上样量可以提高双向电泳图谱的分辨率。上样量过低,低丰度蛋白难以检测,可检测到的蛋白质少。提高上样量有利于低丰度蛋白的检测,但上样量过高会产生横纵条纹,高丰度蛋白会影响其他蛋白的分离和分析[29],蛋白质容易凝聚或沉淀而造成损失。在胶条的长度及染色方法确定的前提下,优化上样量对提高蛋白质的分离效果和增加低丰度蛋白的检测均具有重要意义。本研究中,小黑杨叶片蛋白质的上样量为1 mg时可以检测到更多的蛋白质,获取更多的蛋白质信息。
等电聚焦程序的设置会影响蛋白质的分离效果,聚焦时间与胶条的长度、pH范围、两性电解质载体及蛋白样品的上样量有关[28]。聚焦不完全会造成图谱中有大量的横向拖尾、蛋白质不能有效分离,蛋白质的等电点难以确定。聚焦过度会造成横条纹、蛋白质的损失和蛋白质漂移。在本研究中,采用10 000 V的等电聚焦时间为13 h对小黑杨叶片蛋白质进行分离,可以获得分辨率较高的双向电泳图谱。
SDS平衡的主要目的是促使SDS与蛋白分子充分结合,保证蛋白分子在第二向中能够进行有效的迁移;平衡时间过短,蛋白没有结合足够的SDS,易产生纵向拖尾;平衡时间过长大量蛋白会从IPG胶条中出来进入平衡液中,造成蛋白的损失。
3.1. 蛋白质组学在木本植物研究中的应用
3.2. 适用于双向电泳的杨树叶片总蛋白质的制备
3.3. 杨树叶片总蛋白质双向电泳图谱分辨率的提高
-
本研究优化后的双向电泳体系为:采用2D裂解液Ⅱ溶解总蛋白质,用2D clean-up kit法对总蛋白质进行纯化,选用24 cm、pH 4~7的线性IPG胶条,蛋白上样量为1 mg,10 000 V的等电聚焦时间为13 h,SDS平衡时间为40 min。利用优化后的双向电泳体系对小黑杨、大青杨和84 K杨叶片蛋白质进行双向电泳实验,分别可检测到531、828、525个蛋白质,得到的蛋白质分离效果好,双向电泳图谱背景清晰,分辨率高,重复性好。本研究成功的建立了小黑杨、大青杨与84 K杨叶片蛋白质的双向电泳图谱,该体系可满足小黑杨、大青杨与84 K杨蛋白质组学的分析和研究,为杨树叶片蛋白质组学的研究奠定了基础。









 DownLoad:
DownLoad: