-
枫香(Liquidambar formosana Hance)系金缕梅科(Hamamelidaceae)枫香树属的高大乔木,是我国重要的乡土树种,主要分布于淮河、长江流域以南地区。由于其生长迅速,抗逆性强,木材优良,秋叶红色鲜艳,成为我国亚热带地区重要的用材林、生态林造林树种和秋色叶观赏树种。播种是枫香繁殖的一种重要方法。枫香种子一般于10—11月成熟,由于种子较小,多进行春播繁殖。为保障种子发芽率和苗木质量,采种后多需要进行贮藏,以保持种子活力与品质[1-2]。已有研究表明,种子含水量与贮藏温度对其耐贮性有较大的影响,且种子类型不同,适宜的含水量与贮藏温度亦有所不同[3-4]。如油脂含量高的花生和大豆种子,含水量为5%时在−18℃的环境下贮藏效果较好;淀粉类种子(如玉米),当含水量为8%时适合超低温贮藏[5-7]。目前,关于枫香种子的形态特征、成熟性状[8]、种子成分[9]、种子萌发特性[10]、播种育苗技术[11-13]等已有较多的报道,但涉及枫香种子贮藏方面的研究还较少,其耐贮性及适宜的贮藏条件尚不明晰。鉴于此,本文以枫香种子为材料,研究不同贮藏温度对种子活力的影响,以期了解枫香种子的耐贮性,为枫香种子的科学贮藏提供理论依据。
HTML
-
供试枫香种子于2017年12月初采于江西庐山。采种时,随机选择生长健壮、结实量大、无明显病虫害的优良单株作为采种母树。采种母树共15株(胸径20~30 cm),将其球果曝晒4 d后收集种子。种子去除杂质,均匀混合后作为试验材料。
-
种子采集后,首先测定新鲜种子的千粒质量。然后,将种子于室内自然阴干至含水量为10.54%。12月中旬开始种子贮藏试验。将种子随机分为12份,分别置于4个不同温度条件下进行贮藏。贮藏温度设置为室温(25±2)℃、4℃、−20℃和−70℃,每个温度3份种子(即3次重复)。于贮藏0、60、180、300、360、520、730 d时分别测定种子的丙二醛含量和相对电导率,并将种子于室内播种,测定发芽势、发芽率及播种1个月后萌发幼苗的苗高和根长。各指标的具体测定方法如下:
-
采用四分法取样,测定100粒种子质量(百粒质量),然后换算成千粒质量,4次重复[14]。
-
称取一定量的种子(湿质量),105℃杀青2 h,然后65℃烘干至恒质量,称质量(干质量),4次重复。种子含水量=(种子湿质量−种子干质量)/种子湿质量×100%。
-
贮藏过的种子在播种前于室温下在饱和水蒸汽中(100%相对湿度 RH)回湿2 h。随后,用0.3%高锰酸钾消毒2 h,清水漂洗3次,然后于室温下浸泡24 h,去除浮粒后采用培养皿进行发芽试验[15]。首先,在培养皿内垫5层滤纸,将滤纸用蒸馏水润湿,但无明显积水。随后,将其置于(25±2)℃培养,每天16 h光照,8 h黑暗,3次重复,每重复50粒种子,培养皿完全随机排列。发芽试验第5天,统计种子发芽势。发芽势=培养5 d后的发芽种子数/播种种子数×100%[16]。发芽试验第15天(此时种子萌发全部结束),统计种子发芽率。发芽率=培养15 d后的发芽种子数/播种种子数×100%。
-
自发芽试验第15天开始,给萌发的幼苗浇1/2MS营养液,每周3次,至第30天时用直尺测定幼苗的苗高与根长。苗高为根茎至幼苗顶芽之间的长度;根长为根茎至主根根尖的长度。
-
贮藏期间,测定种子的丙二醛(MDA)含量,评价种子膜脂过氧化程度和劣变程度。具体方法如下:分别取种子0.5 g(W),加入5 mL 0.9 g·L−1 NaCl溶液,研磨后所得匀浆在3 000 r·min−1下离心10 min。取上清液1 mL,加入2 mL 0.67%TBA,充分混合后在100℃水浴上煮沸30 min,冷却后再离心1次,分别测定上清液在450、532、600 nm处的吸光度, 以0.67%TBA为对照,计算MDA浓度(µmol·g−1),3次重复。
MDA浓度=(6.45×(OD532−OD600)−0.56×OD450)×0.03/W[17]
-
贮藏期间,测定种子的相对电导率,评价细胞膜受损程度和种子劣变程度。试验方法如下:称取种子2 g,用蒸馏水快速清洗3次,用滤纸吸干种子表面水分。随后,将清洗过的种子放入50 mL离心管中,添加20 mL蒸馏水,于25℃下浸种24 h后测定电导率EC1。随后,将种子置于100℃沸水浴15 min,自然冷却10 min后再测定电导率EC2,3次重复。
相对电导率= EC1/ EC2×100%[17]
-
对发芽势、发芽率、MDA含量、相对电导率、苗高与根长等指标进行方差分析(ANOVA)与多重比较(Duncan’s),评价不同处理间的差异显著性,其中,发芽率、发芽势、相对电导率的数据经过反正弦转换后再用于方差分析。
1.1. 试验材料
1.2. 试验方法
1.2.1. 千粒质量
1.2.2. 含水量
1.2.3. 发芽势与发芽率
1.2.4. 苗高与根长
1.2.5. 丙二醛含量
1.2.6. 相对电导率
1.2.7. 数据分析
-
试材枫香种子的千粒质量为39.6 g。贮藏试验开始时(0 d),含水量为10.54%,发芽率为77.0%。
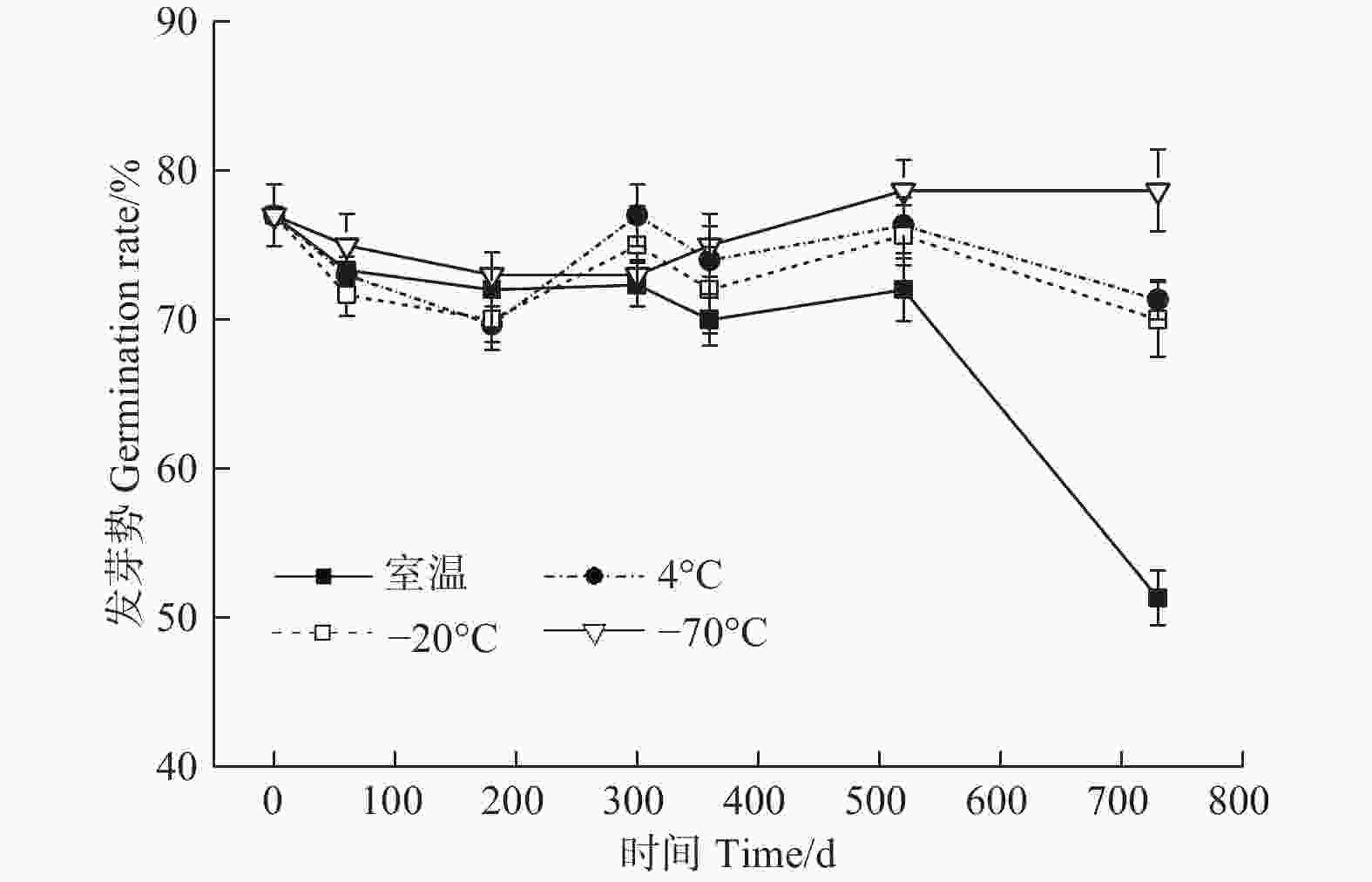
方差分析显示,贮藏温度(ANOVA,3 df,F=3.17,p<0.05)、时间(ANOVA,6 df,F=5.77,p<0.05)及其交互作用(ANOVA,18 df,F=6.19,p<0.05)均对种子的发芽率有显著影响(图1)。贮藏180 d时,4种温度下种子发芽率的变化幅度均较小,不同温度相互之间差异不显著;随着贮藏时间的延长,不同温度之间发芽率的差异逐渐加大;至520 d时,室温下的发芽率最低,−70℃最高,4℃与−20℃介于中间,二者之间差异不明显;至730 d时,4种温度下发芽率的排序与520 d时一致,但不同温度之间的差异进一步增加。此时,室温、4℃、−20℃和−70℃条件下的发芽率分别为51.33%、71.33%、70.0%和78.67%,相比于0 d时的发芽率,分别降低25.67%、5.67%、7.00%和−1.67%。可见,枫香种子在含水量为10.54%时,低温(4℃、−20℃)和超低温(−70℃)的贮藏效果明显优于室温,其中,−70℃的贮藏效果最好。
-
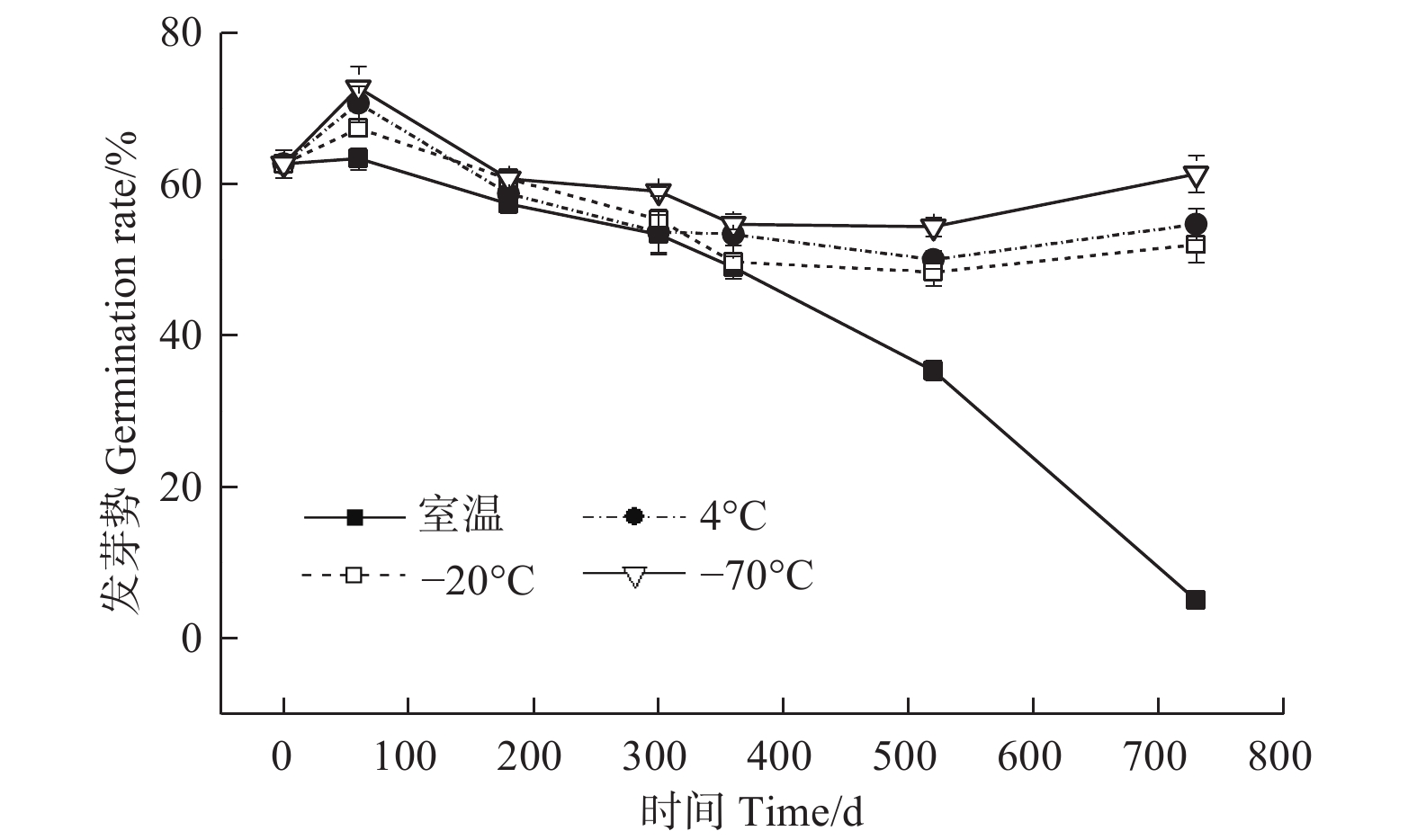
贮藏温度(ANOVA,3 df,F=161.39,p<0.05)、时间(ANOVA,6 df,F=38.83,p<0.05)及其交互作用(ANOVA,18 df,F=49.75,p<0.05)均对枫香种子的发芽势有显著影响(图2)。贮藏0 d时,种子的发芽势为62.67%;至360 d时,4个温度下种子的发芽势均无明显变化,且不同温度之间的差异不明显;贮藏至520 d时,−70℃、−20℃和4℃条件下种子的发芽势变化仍不明显,而室温条件下的发芽势明显降低;至730 d时,−70℃、−20℃和4℃条件下种子的发芽势略低于0 d时的发芽势,而室温条件下的发芽势显著降低。此时,室温、4℃、−20℃和−70℃的发芽势分别为5.0%、54.67%、52.00%和61.33%,与0 d相比分别降低57.67%、8.00%、10.67%和1.34%,这与发芽率的结果一致。
-
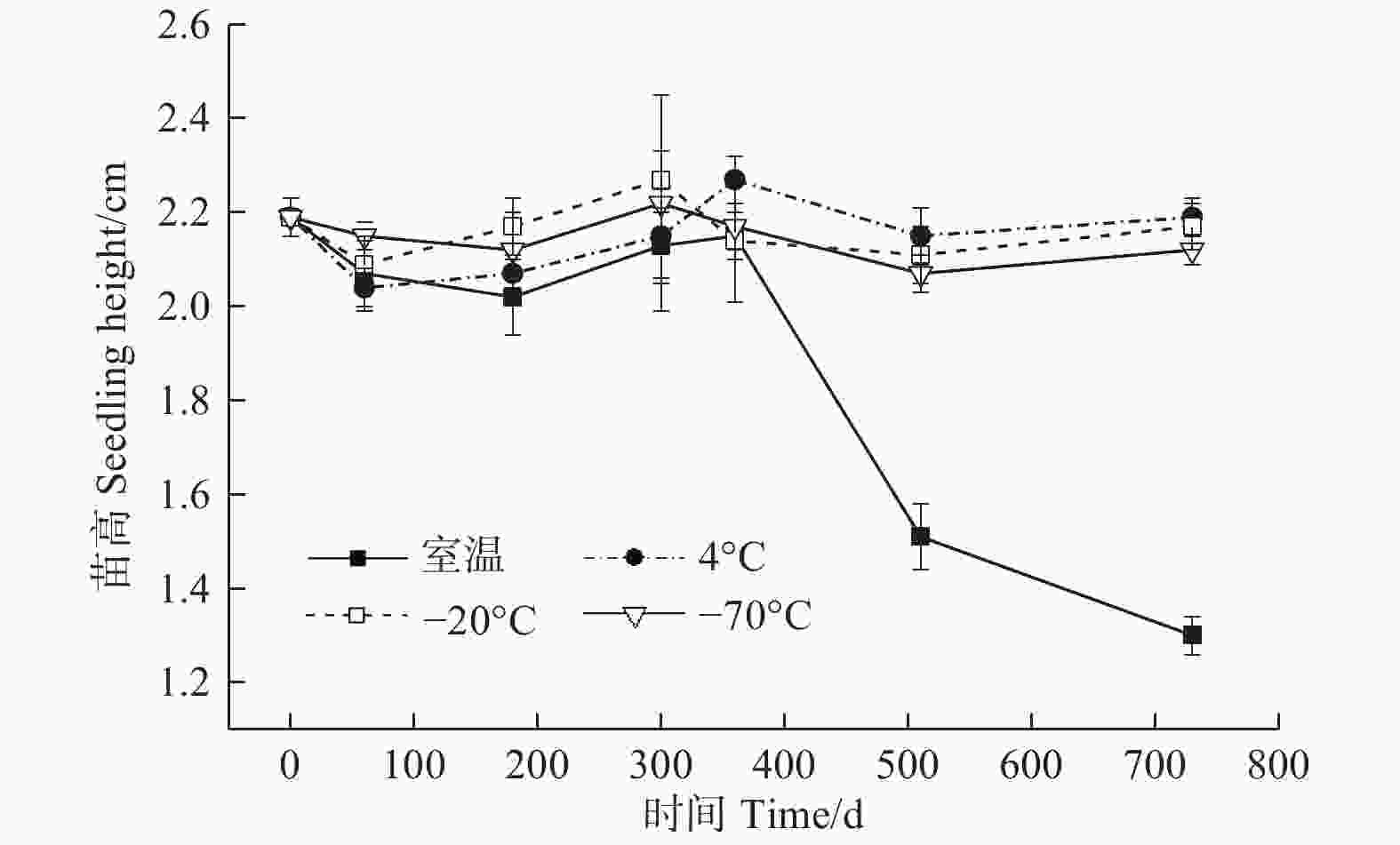
贮藏温度(ANOVA,3 df,F=4.31,p<0.05)、时间(ANOVA,6 df,F=6.39,p<0.05)及其交互作用(ANOVA,18 df,F=11.25,p<0.05)均对幼苗的苗高有显著影响(图3)。贮藏0 d时,幼苗的苗高为2.19 cm;至360 d时,4种贮藏温度下幼苗的苗高均无明显变化,与0 d时的苗高基本相同,不同温度之间差异不明显(图3);随着贮藏时间的延长,不同温度之间苗高的差异逐渐加大;至520 d时,−70℃、−20℃和4℃条件下的苗高仍与0 d时相似,无明显变化,而室温条件下的苗高显著降低;贮藏至730 d时,−70℃、−20℃和4℃条件下的苗高与0 d时差异不显著,而室温条件下的苗高再次大幅下降。此时,室温、4℃、−20℃和−70℃条件下的苗高分别为1.30、2.19、2.17、2.12 cm,相比于0 d时的苗高,分别降低40.64%、0.00%、0.91%和3.20%。
-
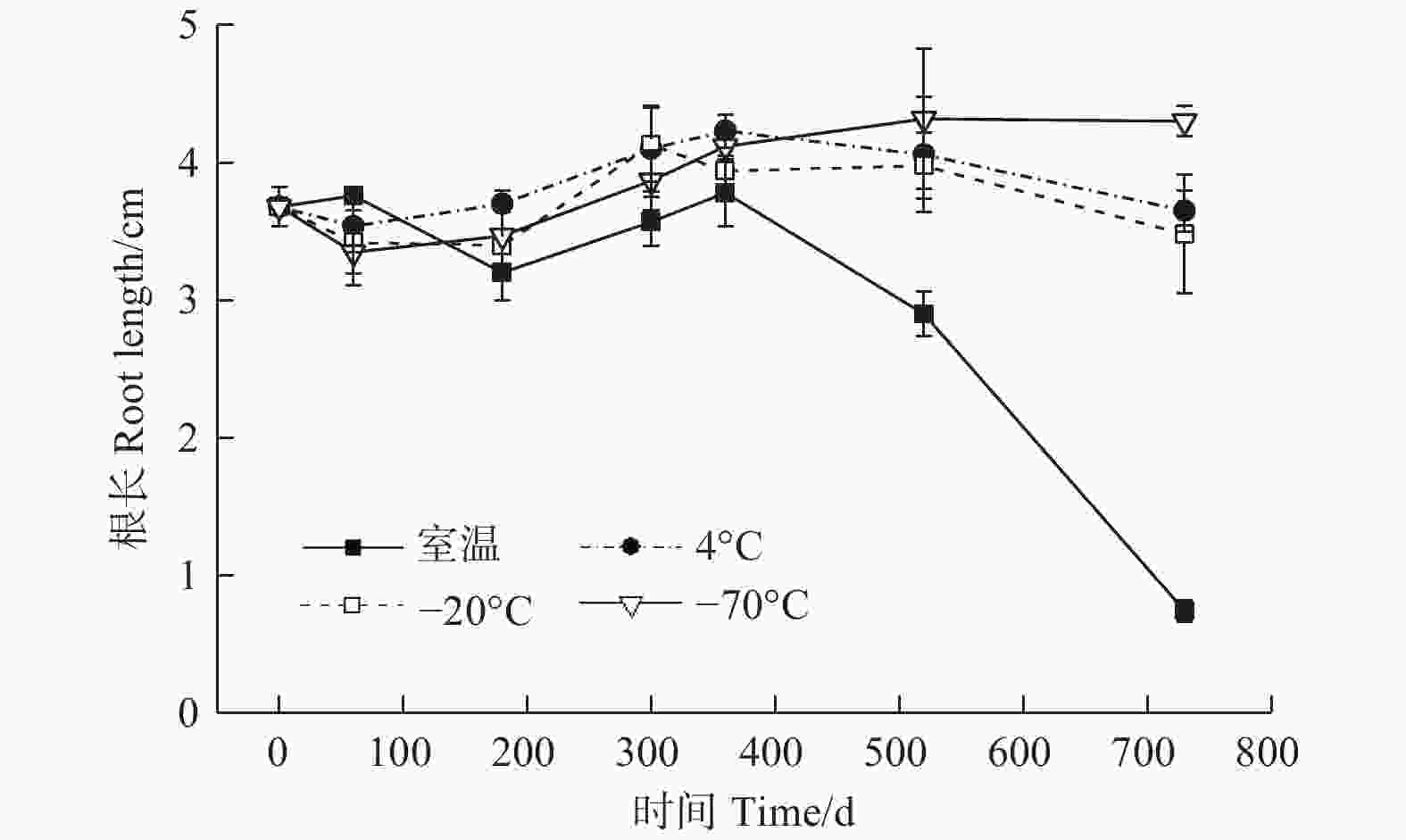
贮藏温度(ANOVA,3 df,F=3.06,p<0.05)、时间(ANOVA,6 df,F=5.83,p<0.05)及其交互作用(ANOVA,18 df,F=9.41,p<0.05)均对幼苗的根长有显著影响(图4)。贮藏0 d时,幼苗的根长为3.68 cm;至360 d时,4种温度下幼苗的根长变化不明显,与0 d时的根长差异不显著,4种温度之间差异亦不显著;随着贮藏时间的延长,不同温度之间根长的差异逐渐加大;贮藏至520 d时,室温下的根长最短,−70℃最长,4℃与−20℃介于中间,二者之间差异不显著;至730 d时,4种温度下根长的排序与520 d时一致,但不同温度之间的差异进一步增加,室温、4℃、−20℃和−70℃条件下的根长分别为0.74、3.65、3.48、4.30 cm,相比于0 d时的根长分别降低79.89%、0.82%、5.43%和−16.85%。
-
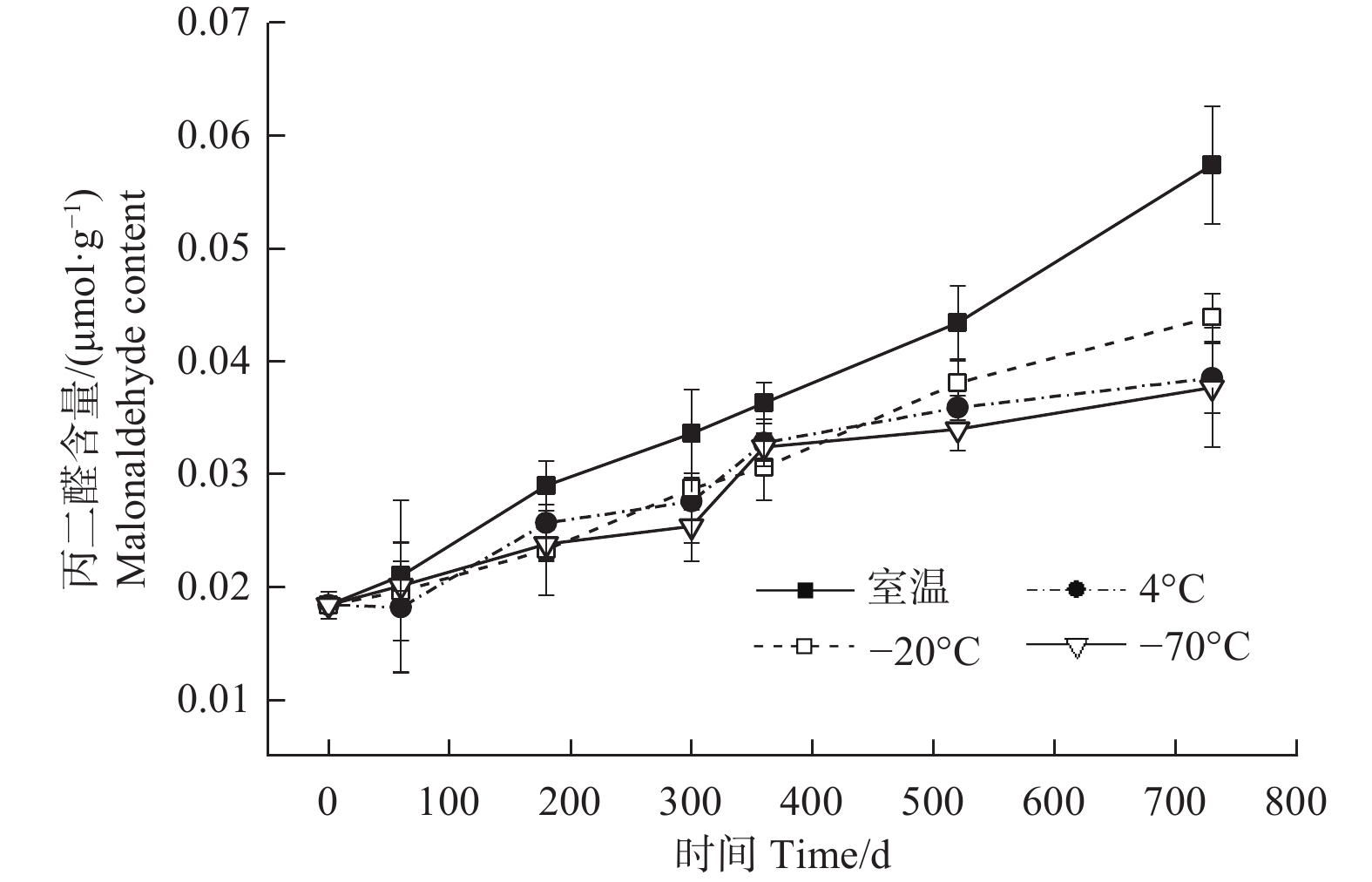
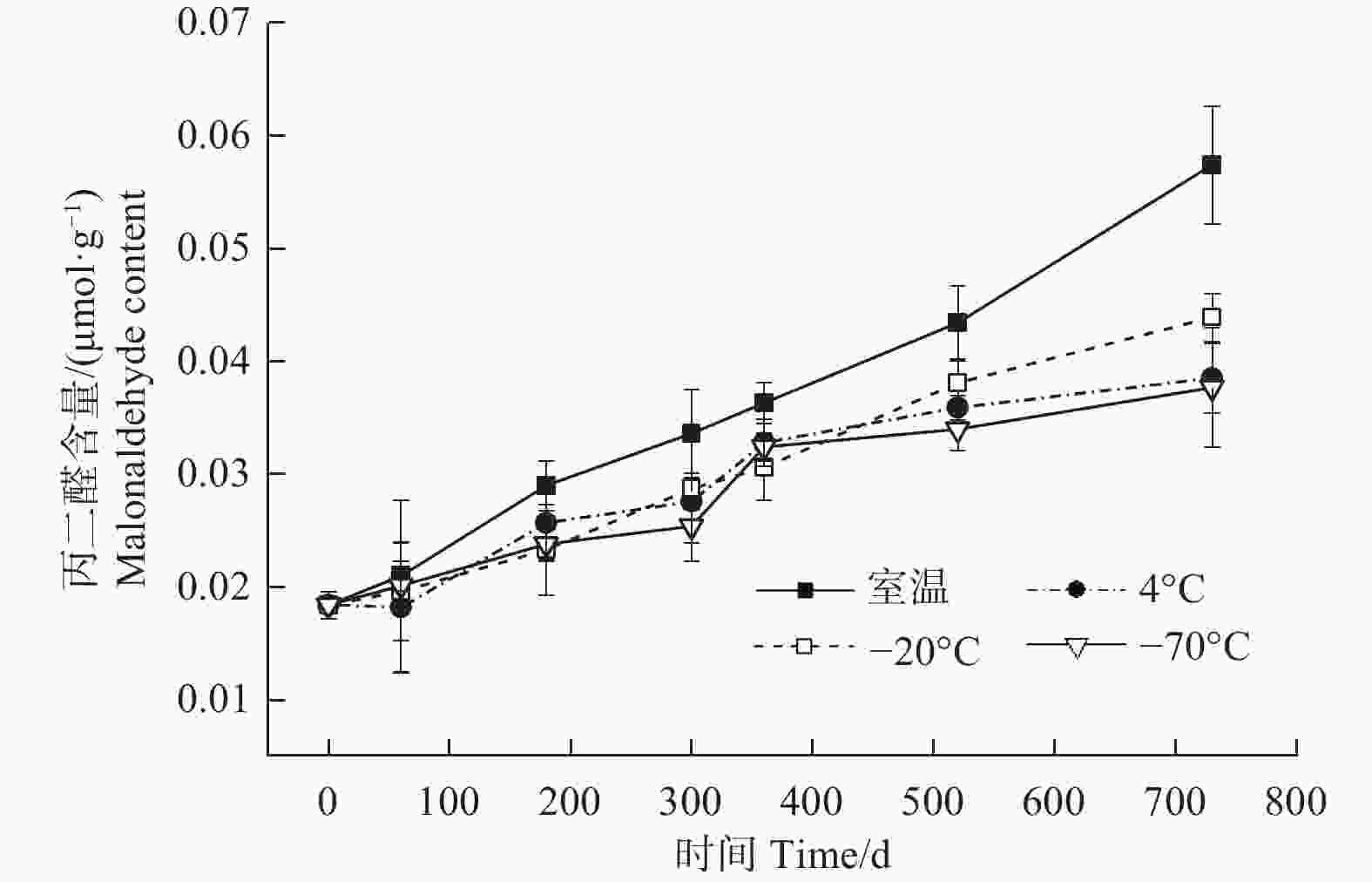
贮藏温度(ANOVA,3 df,F=56.25,p<0.05)、时间(ANOVA,6 df,F=2.70,p<0.05)及其交互作用(ANOVA,18 df,F=2.75,p<0.05)均对种子的丙二醛含量有显著影响(图5)。4种温度条件下,种子中丙二醛的含量均随着贮藏时间的延长逐渐升高,尤以室温条件下的上升速度最快;贮藏至360 d时,4个温度之间种子丙二醛含量差异不明显;至520 d时,室温条件下丙二醛的含量明显高于4℃、−20℃和−70℃,后三者之间差异不明显;贮藏至730 d时,室温条件下丙二醛的含量进一步大幅增加,−20℃居中,略高于4℃和−70℃。此时,室温、4℃、−20℃和−70℃条件下的丙二醛含量分别是0 d时的3.12、2.09、2.39、2.05倍。
-
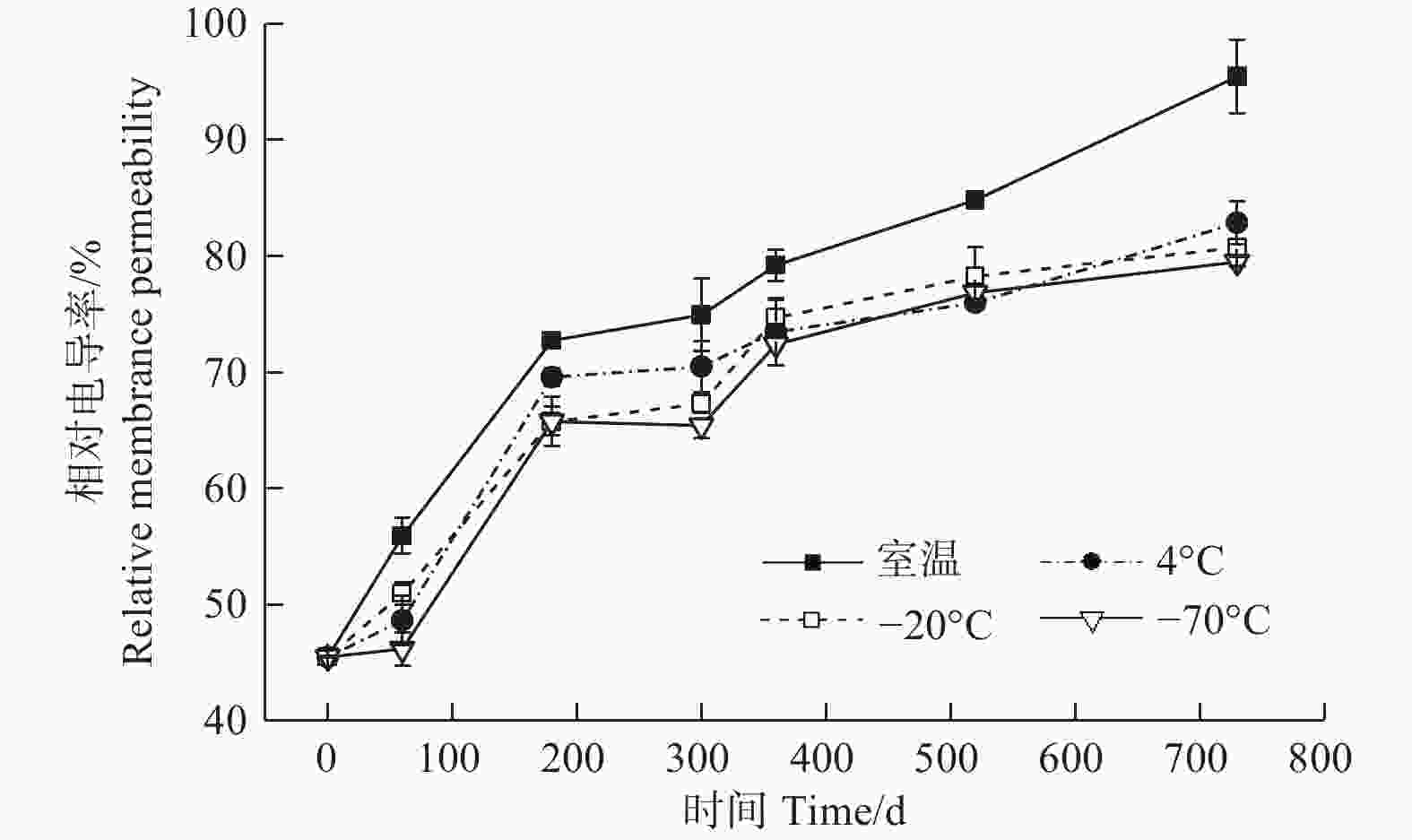
贮藏温度(ANOVA,3 df,F=2255.75,p<0.05)、时间(ANOVA,6 df,F=127.12,p<0.05)及其交互作用(ANOVA,18 df,F=80.96,p<0.05)均对种子的相对电导率有显著影响(图6)。贮藏0 d时,种子的相对电导率最低,随着时间的延长,相对电导率呈上升趋势,以贮藏60~180 d上升速度最快(图6);贮藏至520 d时,相对电导率与0 d相比显著升高(p<0.05),且室温的相对电导率明显高于另外3种温度的;至730 d时,室温与另外3种温度之间的相对电导率差异进一步增加,此时,室温、4℃、−20℃和−70℃条件下的相对电导率分别为95.45%、82.87%、80.75%和79.51%,分别是0 d时相对电导率的2.10、1.82、1.77和1.75倍。可见,室温条件下相对电导率最高,4℃、−20℃、−70℃之间的差异不明显,与丙二醛含量的结果基本一致。
2.1. 贮藏温度对种子发芽率的影响
2.2. 贮藏温度对种子发芽势的影响
2.3. 贮藏温度对幼苗苗高的影响
2.4. 贮藏温度对幼苗根长的影响
2.5. 贮藏温度对丙二醛含量的影响
2.6. 贮藏温度对相对电导率的影响
-
种子萌发是一个动态过程,受播种环境和种子活力的综合影响[18]。在适宜的播种环境下,种子活力是决定种子发芽和出苗期间活力强度等特性的综合表现[19]。高活力种子具有明显的生长优势和生产潜力,对生产具有重要的意义[20]。种子采收后进行科学贮藏是保持其活力的重要方面。贮藏温度、湿度、基质和时间等因素均会对种子活力的保持产生重要影响[21]。
本研究中,贮藏温度和时间均对枫香种子的发芽率和发芽势有显著影响。室温、4℃、−20℃和−70℃贮藏的种子在360 d时发芽率和发芽势较0 d略有降低,且不同温度之间差异并不明显;至520 d时,室温种子的发芽率和发芽势开始明显低于4℃、−20℃和−70℃的种子;至730 d时,这种差异进一步增加。可见,低温和超低温条件下贮藏的枫香种子始终保持着较高的活力,以−70℃贮藏效果最佳,这与其它植物种子的贮藏试验结果相似。如独活(Heracleum hemsleyanum Diels)种子的贮藏温度以−15℃最佳[22];桃叶卫矛(Euonymus bungeanus Maxim)的种子在−20℃条件下贮藏可有效保持种子活力[23]。这可能是由于低温影响了种子内部酶的活性、代谢物质的转运和气体交换,降低了呼吸强度,减少了胚活性物质的消耗[24]。不同植物种子适宜的贮藏温度也存在一定的差异。张雪娟等[25]通过对4个居群的马缨杜鹃(Rhododendron delavayi Franch.)种子的贮藏研究,发现贮藏310 d时,4℃种子的发芽势和发芽率高于常温和−20℃,但不同种群之间的差异显著性有所不同。
幼苗的生长速度与质量是评价种子活力的另一个重要指标[26]。本试验中,幼苗苗高与根长的变化趋势与种子的发芽率和发芽势的变化趋势一致。贮藏360 d时,4种温度之间幼苗苗高与根长的差异并不明显;至520 d时,室温种子的苗高与根长开始明显低于4℃、−20℃和−70℃种子,并随着贮藏时间的延长,差异逐渐变大。4℃、−20℃和−70℃条件下贮藏的种子始终保持着较高的苗高与根长生长量,以−70℃贮藏效果最佳。这与杜克兵等[27]对辽宁杨(Populus liaoningensis Z.Wang et H.D.Chen cv.nov)种子(含水量10.52%)贮藏的研究结果一致,该研究认为,辽宁杨种子在进行短、中期(<56 d)贮藏时,4℃及以下低温即可有效保持幼苗的苗高与根长生长量,而更长期(110 d)的贮藏则以−70℃更适合。可见,当种子的含水量适宜时,低温贮藏可以延缓种子的老化,有效保持种子的活力和幼苗生长的潜能[28]。
丙二醛含量与相对电导率常被用作种子活力的鉴定指标,指示种子劣变的程度[29-30]。丙二醛是脂质过氧化的终产物之一,可以反映细胞膜系统的受损程度[31]。当植物组织受到逆境胁迫时,往往产生细胞膜功能受损或结构破坏,导致其透性增大,细胞内的盐类或有机物渗出,引起组织浸泡液电导率发生变化[32]。随着种子劣变程度的加深,其丙二醛含量和相对电导率逐渐上升,细胞膜完整性逐渐丧失[33-35]。本研究中,枫香种子的丙二醛含量和相对电导率均随贮藏时间的延长而逐渐升高,但贮藏温度不同,变化幅度有所差异,以室温条件下上升最快,−70℃最慢,4℃和−20℃介于中间。这一结果与水稻(Oryza sativa L.)[30]、大豆(Glycine max (Linn.) Merr.)[6]等种子的贮藏试验结果一致。产生这一结果的原因可能与种子膜脂过氧化作用、染色体及基因的畸变以及胚蛋白的降解等有关[36]。
-
当枫香种子的含水量为10.54%时,不同温度条件下的种子随着贮藏时间的延长,其发芽率、发芽势、幼苗苗高与根长逐渐降低,丙二醛含量和相对电导率逐渐升高。对于4种贮藏温度之间,其种子活力的相关指标(发芽率、发芽势、幼苗苗高与根长)以及种子受损程度的相关指标(丙二醛含量、相对电导率)在360 d时仍无明显差异,至520 d时差异逐渐显现,730 d时差异进一步增加。总体而言,贮藏360 d时,室温即可取得较好的贮藏效果;当时间进一步延长时,4℃、−20℃、−70℃更有利于保持种子活力,其贮藏效果明显优于室温,其中,以−70℃的贮藏效果最佳。







 DownLoad:
DownLoad: