-
近年来,随着工业废弃物的排放和化肥等使用的不断增多,重金属污染已经成为一个严重的环境问题,影响人类健康和农业生产[1]。McCallum[2]研究表明,锑(Sb)和锑的化合物是一类具有潜在毒性的重金属物质,具有致癌作用。我国锑资源丰富,储量和产量均为世界第一位,主要分布在湖南、广西和贵州等南方省区[3-5]。由于长年的开采和冶炼造成当地土壤严重的锑污染,何孟常等[6]研究表明,位于湖南省的锡矿山锑矿区土壤中锑含量的最高浓度达5 045 mg·kg−1。因此,锑污染土壤的治理成为迫切需要解决的问题。植物修复具有绿色、成本低和适合大面积修复的特点,被广泛应用。目前,报道的锑矿区具有修复潜力的草本植物主要有芒(Miscanthus sinensis Anderss.)[7]、狗牙根(Cynodon dactylon (L.) Pers.)、蜈蚣草(Eremochloa ciliaris L.)、长叶车前草(Plantago depressa L.)、大叶井口边草(Pteris cretica var. nervosa)[8];木本植物有臭椿(Ailanthus altissima (Mill.) Swingle)、构树(Broussonetia papyrifera (Linn.) L'Hér. ex Vent.)、大叶黄杨(Buxus megistophylla Levl.)和紫穗槐(Amorpha fruticosa Linn.)[9],其中,高大乔木尤其是珍贵树种较少,因此,寻求一种既具有修复作用,且经济价值高的树种显得尤为重要。楸树(Catalpa bungei C. A. Mey.)为中国特有的珍贵树种,木材可用作高档家具、地板、特种设备的材料[10-11]。楸树也具有较强的耐污染能力,已有研究表明,楸树对锑具有较好的吸收和转运能力[12]。作为一个生长快且经济价值高的乔木树种,其产品不会进入食物链,对人类健康没有风险,因此,利用楸树来修复锑污染土壤具有广阔的前景。有报道证实,不同无性系植物对重金属的累积和吸收具有差异[13-14],如柳树(Salix spp.) [15]、栓皮栎(Quercus variabilis Bl.)[16]。本研究旨在运用因子分析法对不同无性系楸树耐锑能力进行综合评价,以期选择出较强耐锑能力的无性系,为锑污染土壤提供具有修复潜力的植物材料。
-
供试材料为中国林业科学研究院选育的10个楸树优良无性系,分别为8402、20-01、5-8、63、5-2、0、1、2-8、1-1和72。
-
试验地点位于湖南省林业科学院龙伏科研基地(28°24′0″ N,113°29′35″ E),属于亚热带季风湿润气候,年平均气温17.5 ℃,年平均降水量1 467 mm,土壤为第四纪红壤。参试无性系均为组培苗,移植成活后1个月选取长势基本一致的幼苗进行锑胁迫试验,培养基质为当地无污染的红壤,土壤pH值为4.8,土壤的化学元素背景值:锑1.94 mg·kg−1、全氮0.74 g·kg−1、全磷0.15 g·kg−1、全钾11.3 g·kg−1、有机质10.5 g·kg−1、有效磷0.51 mg·kg−1、速效钾39.2 mg·kg−1、水解性氮63.7 mg·kg−1。2020年6月15日进行锑胁迫处理,采用土培盆栽的方法,塑料盆规格为30 cm × 18 cm(直径 × 高,盆底带有5个约1 cm2的透水孔),土壤过2 mm塑料筛,每盆装土5 kg。根据Li等[17]对湖南省娄底市冷水江锑矿区土壤重金属锑检测的含量(185.6~2 081.3 mg·kg−1),设置4个处理浓度(以锑计):0、600、1 200 、2 000 mg·kg−1,采用浇灌的方式进行土壤胁迫处理。用酒石酸锑钾(KSbC4H4O7·1/2H2O,分析纯,国药集团化学试剂有限公司)配置相应的水溶液3 L,在6月15日、6月18日、6月21日分3批次进行浇灌,每批次浇灌1 L,每次以溶液不渗透出盆底为准。试验采取随机区组设计,每个盆中栽植4株幼苗,3次重复,每个处理3盆,共12株。为保持与外界气候条件一致性,盆栽植物置于仅具有遮雨功能的透光通风遮阴棚中,6月21日以后每隔3 d浇1次水,以保持土壤湿润即可。
-
培养90 d后,每个处理每盆中随机选取1株,共3株,用去离子水冲洗3次,将根系等部位的泥土冲洗干净,测定株高和地径后按根、茎和叶三部分收获,每个处理选取5 g鲜叶置于液氮中用于测定抗逆相关酶与非酶物质;另选取5 g鲜叶置于干冰上用于测定叶绿素及石蜡切片;其余105 ℃烘箱中杀青30 min,然后80 ℃下烘干至恒质量,分别测定各处理根、茎和叶生物量。各处理的根、茎、叶分别用粉碎机粉碎,过100目筛备用。
-
称取0.5 g各部位烘干样品置于微波消解仪(CEM Mars6)中加入10 mL浓硝酸进行硝化,硝化完定容至50 mL,采用ICP-MS(Thermo ICAP7000)测定各部分锑含量。
-
采用丙酮乙醇浸提法[18]测定叶片中叶绿素含量。
-
过氧化氢(H2O2)含量、超氧阴离子(O2−·)含量、过氧化氢酶(CAT)活性、还原型谷胱甘肽(GSH)活性、过氧化物酶(POD)和抗坏血酸过氧化物酶(APX)活性选用Solarbio公司试剂盒测定。
-
采用石蜡切片法,用FAA固定48 h-脱水-透明-包埋-切片-番红、固绿染色-中性树胶封片。在光学显微镜下观察拍照测量。
-
所有试验结果都以3个重复的均值 ± 标准误表示,每个重复有3株。数据分析采用Spss 17.0 统计软件进行单因素方差分析(ANOVA), 因子分析参照张连金等[19]方法。
-
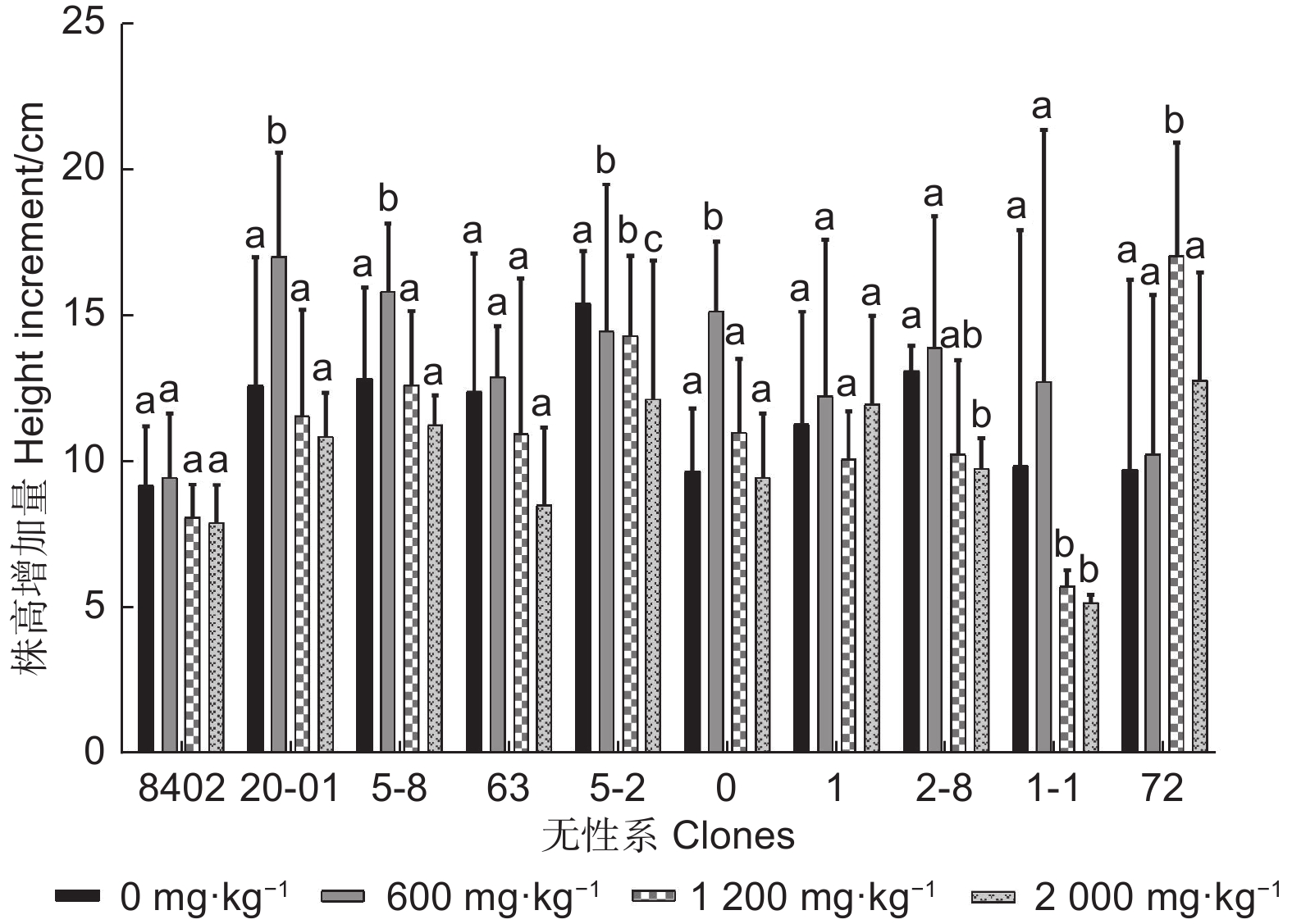
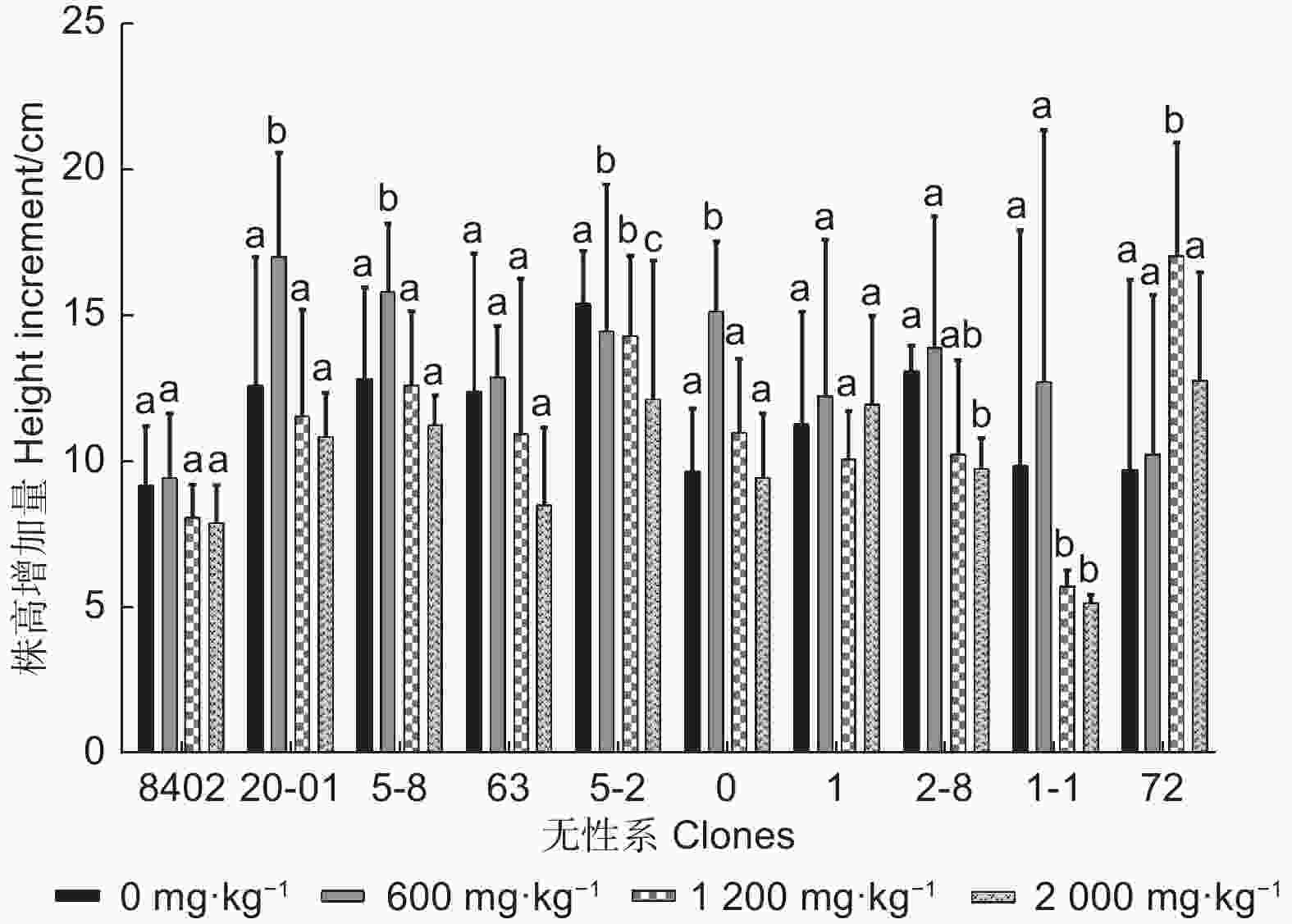
图1、2表明:随锑浓度的增加,大部分无性系株高、地径增长量均表现为先升高后降低的趋势。方差分析表明:不同浓度锑胁迫下,8402、63、1无性系的株高增长量差异不显著,5-8、5-2、0、2-8、72无性系的地径增长量差异不显著,其他均存在差异。0 mg·kg−1锑胁迫下,株高和地径增长最大的分别为5-2和0无性系,最小的分别为8402和20-01;600 mg·kg−1锑胁迫下,株高和地径增长最大的均为20-01,最小的分别为8402和72;1 200 mg·kg−1锑胁迫下,株高和地径增长最大的分别为72和63无性系,最小的分别为1-1和8402;2 000 mg·kg−1锑胁迫下,株高和地径增长最大的分别为72和5-2无性系,最小的分别为1-1和8402无性系。
-
由表1可知:不同胁迫处理下,除8402无性系根生物量差异不显著外,其余无性系地上部分和根生物量在不同锑浓度间存在差异;2 000 mg·kg−1锑胁迫下,除8402和72无性系,根生物量比对照高外,其余无性系根生物量均小于对照。5-2和63无性系地上生物量随胁迫浓度升高逐渐降低,2-8无性系地上生物量随胁迫浓度升高先降低再升高后降低,其它无性系在锑胁迫未超过600 mg·kg−1促进了地上生物量的增加,超过1 200 mg·kg−1生物量逐渐减少。600 mg·kg−1锑胁迫下,根和地上生物量最大的均为5-8,最小的分别为20-01和72;1 200 mg·kg−1锑胁迫下,根和地上生物量最大的分别为5-8和2-8,最小的均为1-1;2 000 mg·kg−1锑胁迫下,根和地上生物量最大的分别为8402和5-8,最小的均为1-1。
不同部位
Different parts胁迫浓度
Stress concentration/
(mg·kg−1)无性系生物量
Biomass of different clones/g8402 20-01 5-8 63 5-2 根 Root 0 8.62 ± 0.64 a 4.16 ± 0.14 b 9.01 ± 0.50 c 5.86 ± 0.54 b 7.99 ± 0.22 a 600 9.24 ± 0.38 a 4.74 ± 0.22 a 11.22 ± 0.35 a 7.38 ± 0.17 a 7.28 ± 0.13 b 1 200 8.62 ± 0.80 a 3.70 ± 0.24 c 10.03 ± 0.45 b 6.33 ± 0.21 b 6.62 ± 0.15 c 2 000 9.24 ± 1.32 a 3.32 ± 0.15 d 7.12 ± 0.22 d 5.09 ± 0.34 c 5.44 ± 0.12 d 地上部分
Aboveground0 16.08 ± 1.72 a 18.21 ± 1.09 a 23.69 ± 1.76 b 18.99 ± 2.12 a 22.46 ± 2.78 a 600 18.15 ± 0.61 a 19.48 ± 1.62 a 34.21 ± 1.37 a 16.26 ± 0.72 b 19.76 ± 1.90 ab 1 200 15.82 ± 1.95 ab 18.18 ± 1.29 a 18.31 ± 1.72 c 15.59 ± 0.72 bc 18.61 ± 1.76 b 2 000 12.86 ± 1.97 b 15.20 ± 1.24 b 15.51 ± 1.84 c 13.48 ± 0.91 c 13.37 ± 1.39 c 不同部位
Different parts胁迫浓度
Stress concentration/
(mg·kg−1)无性系生物量
Biomass of different clones/g0 1 2-8 1-1 72 根 Root 0 7.02 ± 0.15 b 8.88 ± 0.95 a 5.65 ± 0.23 b 2.20 ± 0.06 b 4.27 ± 0.26 b 600 8.45 ± 0.56 a 9.10 ± 0.53 a 7.95 ± 0.27 a 5.49 ± 0.17 a 5.87 ± 0.05 a 1 200 7.35 ± 0.51 ab 8.94 ± 0.38 a 6.13 ± 0.37 b 1.89 ± 0.21 c 5.84 ± 0.22 a 2 000 6.54 ± 0.53 c 6.98 ± 0.42 b 4.70 ± 0.13 c 1.72 ± 0.14 c 4.82 ± 0.17 b 地上部分
Aboveground0 11.75 ± 1.17 b 18.89 ± 1.00 a 18.56 ± 1.99 a 9.83 ± 0.12 b 11.52 ± 1.02 b 600 14.28 ± 0.86 a 20.61 ± 1.96 a 15.48 ± 0.69 b 14.10 ± 0.68 a 13.65 ± 0.96 a 1 200 14.17 ± 0.30 a 14.01 ± 0.47 b 19.23 ± 1.39 a 4.25 ± 0.24 c 10.61 ± 1.40 bc 2 000 9.56 ± 0.97 c 10.18 ± 0.77 c 12.58 ± 2.05 b 3.86 ± 0.10 c 9.28 ± 1.04 c 注:同列不同小写字母代表同一无性系不同胁迫浓度间差异显著(p<0.05)。
Note: Different lowercase letters indicate significant differences amongdifferent stress concentrations of the same clonein the same column at 0.05 level (n = 3).Table 1. The biomass of different clones of Catalpa bungei under Antimony stress
-
由表2可知:锑主要积累在楸树的根部,600 mg·kg−1锑胁迫下,63无性系根、叶中的锑含量最高,8402无性系茎中的锑含量最高;1 200 mg·kg−1锑胁迫下,5-2无性系根中的锑含量最高,1-1无性系茎和叶中的锑含量均最高;2 000 mg·kg−1锑胁迫下,5-8无性系根中的锑含量最高,8402无性系茎中的锑含量最高,72无性系叶中的锑含量最高。
器官
Organs胁迫浓度
Stress concentration/(mg.kg−1)无性系 Clones 8402 20-01 5-8 63 5-2 根
Root0 0.33 ± 0.02 d 0.56 ± 0.02 a 0.18 ± 0.01 f 0.24 ± 0.01 e 0.37 ± 0.01 c 600 983.00 ± 13.22 h 1 764.00 ± 12.00c 1 547.00 ± 13.89 d 2 701.00 ± 9.50 a 1 833.00 ± 17.00 b 1 200 2 335.00 ± 15.52 f 2 014.00 ± 3.00 h 3 176.00 ± 15.00 b 3 066.00 ± 3.61 c 3 648.00 ± 22.71 a 2 000 3 508.00 ± 13.00 c 2 405.00 ± 29.00 g 5 799.00 ± 33.18 a 3 278.00 ± 9.40 e 3 346.00 ± 14.11 d 茎 Stem 0 0.43 ± 0.01 e 0.54 ± 0.03 d 0.15 ± 0.00 g 0.28 ± 0.01 f 0.75 ± 0.02 c 600 183.00 ± 7.55 a 29.10 ± 1.50 g 93.70 ± 2.20 c 112.00 ± 3.30 b 74.60 ± 1.30 d 1 200 142.00 ± 3.64 c 29.90 ± 1.18 h 109.00 ± 1.44 d 146.87 ± 5.50 b 86.70 ± 1.65 e 2 000 164.00 ± 0.90 a 68.90 ± 2.00 h 156.00 ± 2.20 b 150.00 ± 3.20 c 82.70 ± 1.30 f 叶 Leaf 0 0.40 ± 0.02 d 1.33 ± 0.04 a 0.44 ± 0.03 c 0.22 ± 0.01 g 0.43 ± 0.01 cd 600 61.10 ± 2.46 g 9.46 ± 0.21 i 71.60 ± 2.70 f 117.00 ± 1.60 a 62.20 ± 1.50 g 1 200 96.20 ± 0.30 d 67.60 ± 2.43 g 89.60 ± 2.81 e 136.00 ± 2.35 b 81.10 ± 2.01 f 2 000 121.00 ± 2.17 c 82.20 ± 2.09 f 108.00 ± 4.30 d 142.00 ± 5.60 b 116.00 ± 2.90 c 器官
Organs胁迫浓度
Stress concentration/(mg.kg−1)无性系 Clones 0 1 2-8 1-1 72 根 Root 0 0.51 ± 0.04 b 0.35 ± 0.01 cd 0.26 ± 0.01 e 0.13 ± 0.01 g 0.17 ± 0.01 f 600 1 208.00 ± 11.14 e 2 690.00 ± 11.50 a 1 055.00 ± 6.56 g 1 204.00 ± 8.51 e 1 145.00 ± 7.40 f 1 200 1 782.00 ± 15.39 i 2 792.00 ± 9.15 d 2 622.00 ± 4.36 e 2 175.00 ± 8.30 g 1 504.00 ± 6.40 j 2 000 2 018.00 ± 18.52 h 5 249.00 ± 14.40 b 2 651.00 ± 36.37 f 3 460.00 ± 89.09 c 1 539.00 ± 9.30 i 茎 Stem 0 0.14 ± 0.02 g 1.73 ± 0.09 a 0.25 ± 0.01 f 1.46 ± 0.15 b 0.43 ± 0.02 e 600 72.40 ± 3.32 d 71.60 ± 1.10 d 23.00 ± 1.15 h 38.10 ± 2.20 f 46.20 ± 1.25 e 1 200 85.00 ± 3.91 e 67.10 ± 2.25 f 69.10 ± 1.51 f 386.00 ± 5.30 a 41.70 ± 1.20 g 2 000 109.00 ± 3.89 d 102.00 ± 2.50 e 66.80 ± 4.25 g 99.60 ± 2.38 e 103.00 ± 1.67 e 叶
Leaf0 0.54 ± 0.03 b 0.12 ± 0.00 h 0.33 ± 0.02 f 0.34 ± 0.01 e 0.39 ± 0.01 d 600 78.10 ± 2.83 e 99.40 ± 2.00 b 52.10 ± 0.70 h 90.00 ± 1.45 c 82.10 ± 1.60 d 1 200 83.30 ± 4.80 f 101.00 ± 1.65 c 88.80 ± 3.01 e 163.87 ± 2.70 a 100.00 ± 2.42 c 2 000 94.60 ± 2.90 e 111.00 ± 3.20 cd 51.50 ± 1.81 g 89.37 ± 2.90 e 165.00 ± 2.30 a 注:同行不同小写字母代表同一胁迫浓度下不同无性系差异显著(p<0.05)。
Note: Different lowercase letters in the same line indicatesignificant differences among different clones under the same stress concentrationat 0.05 level (n = 3).Table 2. Antimony content in organs of different clones of Catalpa bungei under Antimony stress
mg·kg−1 -
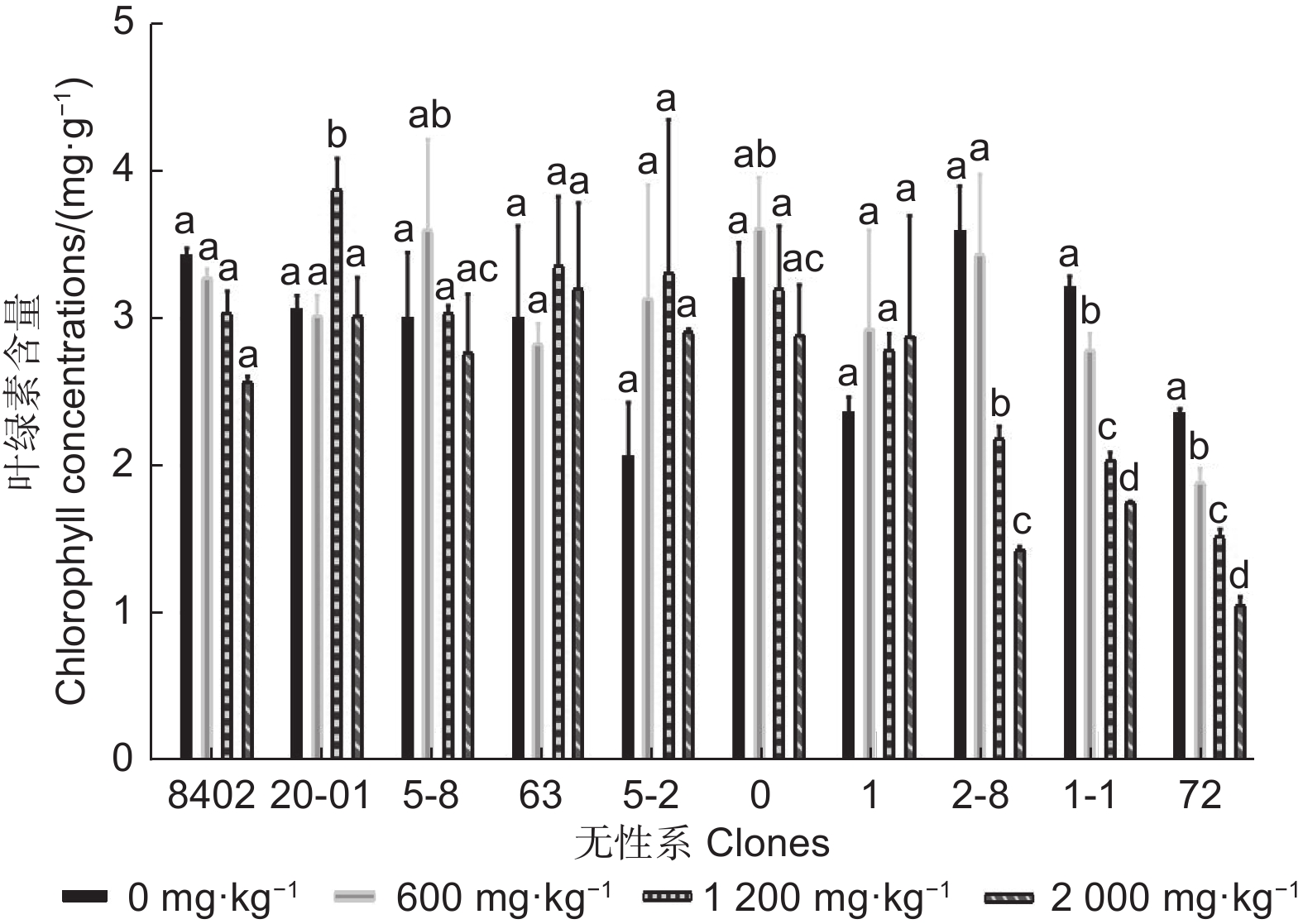
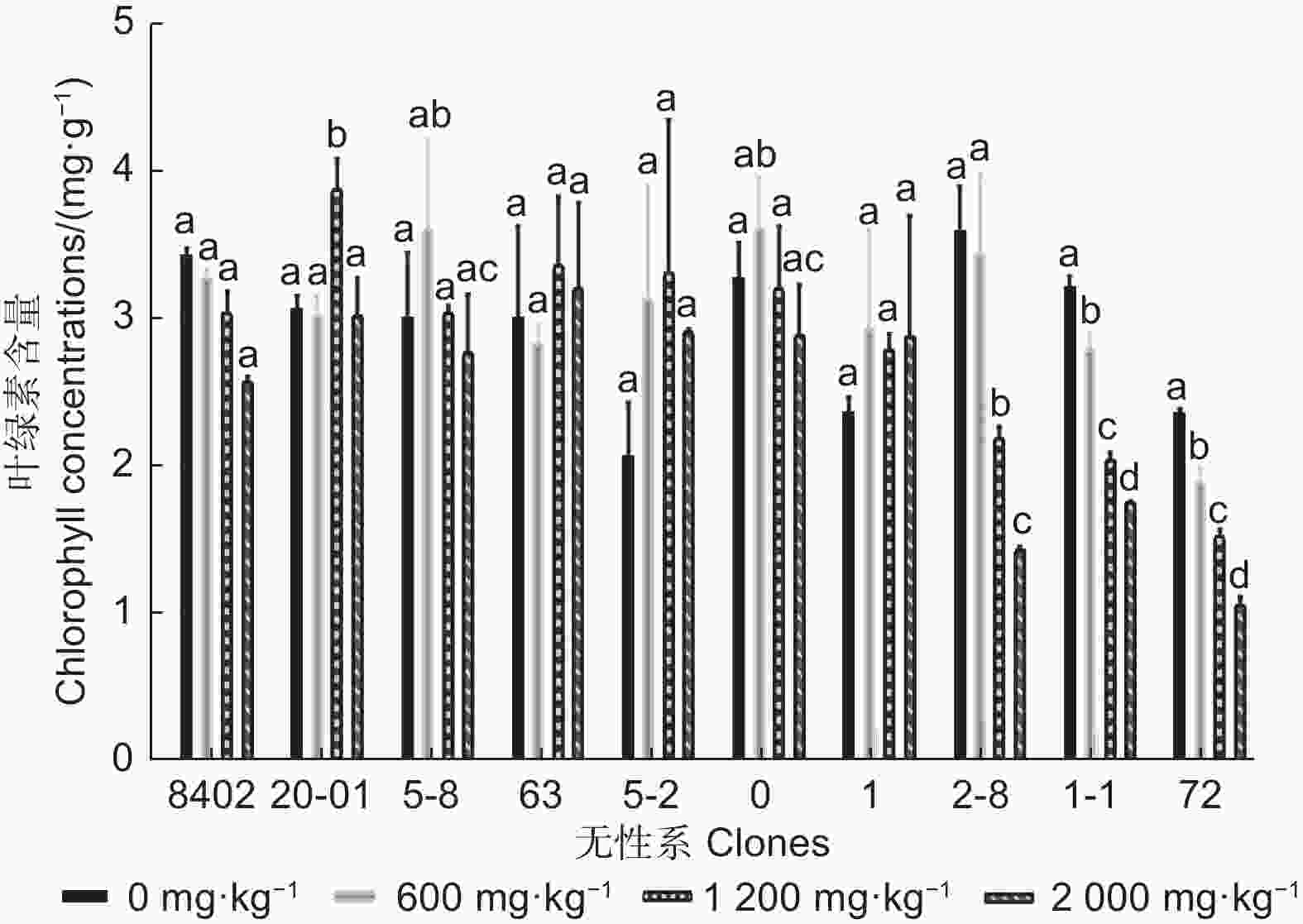
由图3可知:随锑胁迫浓度的增加,8402、2-8、1-1和72无性系的叶绿素含量呈下降趋势,20-01和63无性系叶绿素含量呈下降-上升-再下降趋,5-8、5-2和0无性系叶绿素含量呈先上升后下降的趋势,1无性系叶绿素含量呈先上升后下降再上升趋势。在锑胁迫下,5-2和1无性系叶片的叶绿素含量均大于对照,5-8无性系在600、1 200 mg·kg−1锑胁迫下,叶绿素含量均大于对照,2 000 mg·kg−1锑胁迫下,叶绿素含量小于对照,20-01在锑胁迫浓度2 000 mg·kg−1时,叶绿素含量与对照相当。
-
表3表明:随锑胁迫浓度的增加,各无性系体内的O2−·产生速率逐渐增大;600 mg·kg−1锑胁迫下,20-01无性系的O2−·产生速率最大,8402无性系的最小;1 200 mg·kg−1锑胁迫下,72无性系的O2−·产生速率最大,8402无性系的最小;2 000 mg·kg−1锑胁迫下,2-8无性系的O2−·产生速率最大,5-8无性系的最小。各无性系体内的H2O2含量,600 mg·kg−1锑胁迫下,5-8无性系的最大,20-01无性系的最小;1 200 mg·kg−1锑胁迫下,20-01无性系的最大,0无性系的最小;2 000 mg·kg−1锑胁迫下,20-01无性系的最大,5-8无性系的最小。
无性系
Clones胁迫浓度
Stress concentration/
(mg·kg−1)超氧阴离子
O2−·/(μmol·g−1)抗坏血酸过氧化物酶
APX/(U·mg−1)谷胱甘肽
GSH/(μg·g−1)过氧化氢
H2O2/(μmol·g−1 )过氧化氢酶
CAT/(U·mg−1)过氧化物酶
POD/(U·mg−1)8402 0 0.000 050 ± 0.000 004 0.004 7 ± 0.001 5 1.37 ± 0.37 0.59 ± 0.10 0.45 ± 0.05 0.45 ± 0.03 600 0.000 068 ± 0.000 002 0.078 8 ± 0.009 2 4.42 ± 0.16 5.99 ± 0.38 2.23 ± 0.18 3.96 ± 0.04 1200 0.000 097 ± 0.000 029 0.093 4 ± 0.003 6 6.24 ± 0.82 7.45 ± 0.49 5.38 ± 0.18 5.27 ± 0.19 2000 0.000 211 ± 0.000 004 0.071 7 ± 0.004 6 5.70 ± 0.33 9.25 ± 0.16 8.54 ± 0.41 4.92 ± 0.07 20-01 0 0.000 065 ± 0.000 009 0.006 4 ± 0.001 7 1.48 ± 0.21 0.53 ± 0.14 0.59 ± 0.42 0.56 ± 0.13 600 0.000 140 ± 0.000 042 0.060 2 ± 0.003 3 4.63 ± 0.25 3.56 ± 0.20 3.12 ± 0.13 4.73 ± 0.10 1 200 0.000 221 ± 0.000 006 0.100 4 ± 0.005 5 6.12 ± 0.09 8.18 ± 0.46 6.65 ± 0.28 5.57 ± 0.32 2 000 0.000 254 ± 0.000 008 0.076 5 ± 0.001 9 3.96 ± 0.32 10.74 ± 0.25 7.50 ± 0.32 4.28 ± 0.15 5-8 0 0.000 038 ± 0.000 005 0.007 6 ± 0.001 3 1.50 ± 0.17 0.64 ± 0.18 0.74 ± 0.10 0.31 ± 0.02 600 0.000 114 ± 0.000 003 0.102 0 ± 0.005 4 6.27 ± 0.26 8.31 ± 0.50 6.30 ± 0.19 5.46 ± 0.35 1 200 0.000 148 ± 0.000 007 0.174 2 ± 0.009 3 8.45 ± 0.15 5.30 ± 0.08 8.30 ± 0.32 8.66 ± 0.21 2 000 0.000 183 ± 0.000 009 0.099 1 ± 0.005 5 4.59 ± 0.29 5.38 ± 0.21 9.37 ± 0.67 5.41 ± 0.13 63 0 0.000 060 ± 0.000 006 0.006 7 ± 0.002 8 1.34 ± 0.14 0.72 ± 0.15 0.43 ± 0.08 0.40 ± 0.01 600 0.000 135 ± 0.000 008 0.060 3 ± 0.006 7 5.38 ± 0.15 5.47 ± 0.24 3.31 ± 0.30 4.57 ± 0.19 1 200 0.000 173 ± 0.000 007 0.146 3 ± 0.006 6.54 ± 0.74 6.48 ± 0.45 6.09 ± 0.53 5.31 ± 0.18 2 000 0.000 257 ± 0.000 01 0.061 8 ± 0.005 2 10.19 ± 0.64 7.10 ± 0.24 6.96 ± 0.72 3.81 ± 0.14 5-2 0 0.000 040 ± 0.000 007 0.009 2 ± 0.002 7 1.28 ± 0.26 0.55 ± 0.11 0.87 ± 0.06 0.63 ± 0.08 600 0.000 132 ± 0.000 004 0.040 2 ± 0.002 9 5.25 ± 0.27 6.33 ± 0.16 3.40 ± 0.37 3.64 ± 0.26 1 200 0.000 177 ± 0.000 003 0.110 7 ± 0.005 7 7.42 ± 0.33 6.95 ± 0.57 6.25 ± 0.26 5.79 ± 0.17 2 000 0.000 237 ± 0.000 015 0.058 2 ± 0.007 8 7.34 ± 0.60 7.15 ± 0.09 8.10 ± 0.36 3.35 ± 0.24 0 0 0.000 037 ± 0.000 014 0.005 9 ± 0.001 1 1.50 ± 0.30 0.66 ± 0.11 0.39 ± 0.08 0.66 ± 0.05 600 0.000 082 ± 0.000 005 0.061 4 ± 0.004 4 5.89 ± 0.25 4.62 ± 0.15 4.87 ± 0.30 4.66 ± 0.22 1 200 0.000 112 ± 0.000 006 0.149 6 ± 0.004 6.35 ± 0.20 5.08 ± 0.13 6.68 ± 0.23 5.44 ± 0.31 2 000 0.000 184 ± 0.000 011 0.085 2 ± 0.004 4 6.02 ± 0.08 5.99 ± 0.26 8.89 ± 0.28 3.57 ± 0.35 1 0 0.000 039 ± 0.000 014 0.006 6 ± 0.000 7 1.91 ± 0.06 0.74 ± 0.13 0.42 ± 0.07 0.56 ± 0.04 600 0.000 129 ± 0.000 006 0.041 6 ± 0.006 5 4.57 ± 0.44 3.79 ± 0.21 3.66 ± 0.22 4.55 ± 0.35 1 200 0.000 182 ± 0.000 002 0.126 5 ± 0.008 5.32 ± 0.09 5.65 ± 0.26 5.55 ± 0.27 5.84 ± 0.19 2 000 0.000 229 ± 0.000 013 0.051 6 ± 0.003 1 4.79 ± 0.42 8.02 ± 0.57 7.13 ± 0.62 2.75 ± 0.15 2-8 0 0.000 035 ± 0.000 003 0.003 2 ± 0.001 2 1.11 ± 0.16 0.53 ± 0.15 0.53 ± 0.15 0.63 ± 0.09 600 0.000 120 ± 0.000 006 0.069 7 ± 0.007 2 4.75 ± 0.34 4.49 ± 0.33 4.49 ± 0.33 3.44 ± 0.25 1 200 0.000 144 ± 0.000 009 0.122 7 ± 0.003 6.66 ± 0.25 5.19 ± 0.20 5.19 ± 0.20 5.81 ± 0.83 2 000 0.000 280 ± 0.000 011 0.089 8 ± 0.006 3 7.10 ± 0.61 5.98 ± 0.36 5.98 ± 0.36 3.01 ± 0.14 1-1 0 0.000 027 ± 0.000 008 0.009 4 ± 0.000 9 1.57 ± 0.28 0.41 ± 0.07 0.53 ± 0.07 0.62 ± 0.03 600 0.000 109 ± 0.000 007 0.053 8 ± 0.005 5.43 ± 0.41 5.11 ± 0.10 4.34 ± 0.11 4.71 ± 0.07 1 200 0.000 184 ± 0.000 008 0.125 8 ± 0.006 5.93 ± 0.30 5.68 ± 0.56 5.79 ± 0.43 6.14 ± 0.07 2 000 0.000 250 ± 0.000 013 0.048 3 ± 0.003 8 4.44 ± 0.43 6.28 ± 0.10 7.26 ± 0.56 5.43 ± 0.42 72 0 0.000 025 ± 0.000 012 0.004 3 ± 0.002 4 1.01 ± 0.14 0.63 ± 0.04 0.71 ± 0.10 0.69 ± 0.11 600 0.000 074 ± 0.000 008 0.063 7 ± 0.002 4.57 ± 0.17 5.17 ± 0.20 2.50 ± 0.27 5.18 ± 0.57 1 200 0.000 236 ± 0.000 01 0.120 1 ± 0.005 5 5.11 ± 0.09 6.71 ± 0.14 4.23 ± 0.11 6.77 ± 0.29 2 000 0.000 273 ± 0.000 012 0.071 3 ± 0.007 6 3.41 ± 0.28 9.20 ± 0.39 7.62 ± 0.15 3.61 ± 0.37 Table 3. Contents of oxidants substances and activity of antioxidant enzymes in leaves of different clones of Catalpa bungei under Antimony stress
在锑胁迫浓度小于2 000 mg·kg−1时,各无性系体内的谷胱甘肽(GSH)活性随锑胁迫浓度的升高而升高,在锑胁迫浓度2 000 mg·kg−1时,除63和2-8无性系外,其它无性系叶片中的GSH活性均降低,这可能是锑浓度过高,GSH的合成受到了影响。H2O2等活性氧物质的产生诱导了过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)和过氧化氢酶(CAT)活性的增加,而增加的酶活性用以清除大量产生的活性氧物质。在锑胁迫浓度小于2 000 mg·kg−1时,各无性系体内的APX活性随锑胁迫浓度的增加而升高;在2 000 mg·kg−1锑胁迫浓度时,APX活性比1 200 mg·kg−1胁迫时低。POD活性和APX活性具有相似的变化趋势,CAT活性随锑胁迫浓度的增加而升高。
-
图4表明:10个无性系楸树栅海比均随锑胁迫浓度的增加呈先升后降的趋势。600 mg·kg−1锑胁迫下,所有无性系的栅海比均比对照的高;1 200 mg·kg−1锑胁迫下,除0和72无性系的栅海比均比对照低外,其余无性系的栅海比均比对照的高;2 000 mg·kg−1锑胁迫下,除5-2无性系的栅海比比对照高外,其余无性系的均比对照的低。
-
对 15 个因素作 KMO和Bartlett,判断是否适合做因子分析。当KMO统计量>0.5,说明可利用因子分析方法进行分析。本研究的效度分析中,KMO 值为 0.649>0.5,P 值为 0.000,远小于显著性水平。因此,所选用的变量适合做因子分析。通过因子分析共提取了4个特征值大于 1 的因子,其特征值分别为4.981、2.341、1.920、1.127,其方差累积贡献率为69.132%。因此,这4个因子包含了指标体系中的绝大部分信息,说明将这4个因子作为综合变量来评价不同无性系楸树耐锑能力是可行的。以各公因子方差贡献率占累计方差贡献率的权重作为系数,分别乘以因子的得分数(C),从而获得一个楸树不同无性系耐锑综合评价得分模型:
S=23.926/69.132 × C1 + 18.479/69.132 × C2 + 13.488/69.132 × C3 + 13.239/69.132 × C4
通过因子分析可知:10个楸树无性系在锑胁迫下的平均得分情况见表4。在0~2 000 mg·kg−1锑胁迫下,10个楸树无性系耐锑能力综合评价为5-8>0>20-01>2-8>5-2>63>8402>1>72>1-1。
无性系
Clones锑处理浓度
Stress concentration/(mg·kg−1)因子 Factor 总分
Total score平均得分
Average scoreC1 C2 C3 C4 8402 600 2.37 −1.13 0.32 −0.93 0.40 −0.14 1 200 0.81 −1.33 0.29 0.00 −0.02 2 000 −1.03 −1.30 −0.06 −0.43 −0.80 20-01 600 0.54 2.88 −0.25 0.09 0.93 0.19 1 200 −0.25 0.45 0.61 0.27 0.21 2 000 −1.12 0.03 −0.01 −0.97 −0.57 5-8 600 0.60 0.26 1.16 0.23 0.55 0.34 1 200 −0.22 0.40 0.78 3.18 0.79 2 000 −1.06 −0.34 0.30 0.49 −0.30 63 600 0.19 0.08 0.22 −0.68 0.00 −0.03 1 200 −0.65 −0.31 1.71 0.63 0.14 2 000 −1.00 −0.75 2.38 −0.77 −0.23 5-2 600 0.64 0.37 −0.01 −1.30 0.07 0.03 1 200 −0.21 0.44 0.48 0.81 0.29 2 000 −0.70 −0.11 0.64 −0.70 −0.28 0 600 1.49 0.42 1.13 −0.49 0.75 0.31 1200 0.14 0.31 0.73 0.93 0.45 2000 −0.74 −0.06 0.64 −0.65 −0.27 1 600 0.88 0.39 −0.72 −0.44 0.18 −0.18 1 200 −0.16 0.24 −0.73 1.07 0.07 2 000 −0.86 −0.61 −0.28 −1.48 −0.80 2-8 600 0.67 1.06 0.24 −0.88 0.39 0.05 1 200 −0.05 0.37 0.00 1.29 0.33 2 000 −1.31 0.68 −1.07 −0.42 −0.56 1-1 600 1.28 0.55 −1.34 −0.45 0.24 −0.33 1 200 1.40 −3.21 −1.14 1.44 −0.32 2 000 −1.33 −0.31 −1.60 −0.29 −0.91 72 600 1.55 0.67 −0.97 −0.12 0.50 −0.25 1 200 −0.71 0.50 −1.85 1.29 −0.23 2 000 −1.14 −0.64 −1.59 −0.72 −1.02 Table 4. Comprehensive Evaluation score table of Antimony tolerance of different clones of Catalpa bungei
-
重金属通过植物根系吸收后转运至地上部分对植物产生毒害作用[20],地上生物量大可以降低植物单位面积中重金属的含量,从而降低重金属对植物的毒害作用。本研究中,除8402无性系根生物量差异不显著外,其余无性系地上和根生物量在不同锑浓度间存在差异,这说明不同无性系对重金属的响应有差异,这与施翔等[16]和Yang等[21]的研究结果相似。所有处理的地上生物量均大于根生物量,地上部分分散了锑的积累,这可能是楸树耐锑的一个原因。植物叶片中叶绿素含量是衡量植物耐重金属的重要生理指标,植物遭受重金属毒害会导致叶片中叶绿素含量降低,进而抑制光合作用导致生物量降低。有研究表明,锑破坏了植物光合系统(叶绿体、酶系统等)[22]。芥菜(Brassica juncea (Linnaeus) Czernajew)和玉米(Zea mays L.)进行高浓度锑处理,芥菜的叶片变黄,玉米的叶绿素合成受阻[4]。本研究结果表明,10个无性系楸树叶绿素含量在锑胁迫下影响不大,有的处理甚至出现叶绿素含量有所提高,说明在锑浓度2 000 mg·kg−1以下锑胁迫对楸树无性系的叶绿素合成影响较小,这与上述研究结果不一致,锑胁迫尚未破坏叶绿体膜结构,没有造成叶绿体不可逆损伤[23],更高浓度的锑胁迫对楸树叶绿素合成的影响还需要进一步研究。
本研究中,不同无性系楸树体内锑含量主要集中在根部,向地上部分转运少,这一结果与水稻(Oryza sativa L.)[24]、构树(Broussonetia papyrifera (Linnaeus) L'Heritier ex Ventenat)、臭椿、大叶黄杨和紫穗槐[9]等锑胁迫下的研究结果相似。已有研究表明,重金属可以通过抑制养分吸收和细胞分裂等来抑制根系的生长,耐性强的植物或者无性系表现出根的生物量大[25]。参试楸树无性系根中富集锑最多的为5-8无性系,在2 000 mg·kg−1锑胁迫下,锑含量为5 799 mg·kg−1;茎中锑含量最高的为无性系1-1,在1 200 mg· kg−1锑胁迫下,锑含量为386 mg·kg−1;叶片中锑含量最高的为无性系72,在2 000 mg·kg−1锑胁迫下,锑含量为165 mg·kg−1。有研究表明,大叶黄杨地上部分最高锑含量为35.37 mg·kg−1,根中含量最高为85.6 mg·kg−1;构树地上部分锑含量最高为108.33 mg·kg−1,根中含量最高为196.53 mg·kg−1;紫穗槐地上部分锑含量最高为55.97 mg·kg−1,根中含量最高为418.27 mg·kg−1 [9];而狗牙根根中锑含量为2 209.3 mg·kg−1,芒根中锑含量为177.29 mg·kg−1,地上部分锑含量最高为75.81 mg·kg−1,苎麻(Boehmeria nivea (L.) Gaudich.)地上部分锑含量为 748.7 mg·kg−1 [4]。本研究中,楸树根内锑含量远高于目前已经报道植物根锑的含量,茎与叶片中锑的含量也高于大部分已报道植物地上部分锑的含量,楸树具有生长快、生物量大的特点,即使没有达到超富集植物的标准,但是地上部分较大的生物量也能够吸收较多的锑。楸树萌芽能力强,也可以通过收获地上部分生物量,让其萌发新的地上部分,再转运根系中吸收的锑,通过多次采集地上部分,减少因为根系的分解,锑重新回到土壤的风险。楸树生物量大、生长快、观赏价值高、耐锑能力强和具有较高的经济价值,利用转运系数较高的楸树无性系对锑污染土壤修复具有重要的现实意义。
植物在正常生活条件下,体内的自由基等氧化物质的产生和消除处于平衡,并且含量很低,不会对植物生长造成影响。一旦植物处于逆境条件下,细胞内的自由基等氧化物质的产生和消除打破平衡,氧化物质积累过多就会影响植物生长发育。本研究结果表明,在逆境条件下,植物体内产生大量的超氧阴离子和H2O2,随着胁迫浓度的增加,各个无性系体内的O2−·产生速率逐渐增大,在一定胁迫压力内抗氧化酶(CAT、POD、APX)活性和植物体内的非酶抗氧化物质(GSH)的浓度呈正相关性,这与李聪等[26]的研究结果相似。这说明抗氧化酶活性增强和非酶抗氧化物质GSH含量的增加是楸树耐锑的一个重要原因。
-
在不同锑浓度胁迫下,大部分无性系随着锑胁迫浓度的升高,株高增长量和地径增长量均表现为先升高后降低的趋势;除8402和72无性系,在2 000 mg·kg−1锑胁迫下根生物量比对照高外,其它无性系在较低浓度锑胁迫下促进了生物量增加,到了一定浓度随着锑浓度的增加,生物量逐渐减少。
锑主要积累在楸树的根部,在不同浓度锑胁迫下,各无性系各器官中锑浓度和耐锑能力具有差异。因子分析结果表明:在0~2 000 mg·kg−1锑胁迫下,10个楸树无性系耐锑能力综合评价为5-8>0>20-01>2-8>5-2>63>8402>1>72>1-1。但受条件和材料的限制,笔者仅对苗期的不同无性系楸树进行了分析评价,还需要后期的试验进行验证和筛选,以获得适应性较强的耐锑楸树品种,提高锑污染土壤的修复效果。植物修复是一种具有绿色、成本低和相对安全的重金属污染土壤修复技术,具有广阔的应用前景。
Comprehensive Evaluation of Antimony Tolerance of Different Catalpa bungei Clones based on Factor Analysis
- Received Date: 2021-04-28
- Accepted Date: 2021-10-21
- Available Online: 2022-12-20
Abstract:







 DownLoad:
DownLoad: