-
森林土壤是森林生态系统的重要组成部分,是林木赖以生存的物质基础。林木生长所形成的郁闭环境、枯落物的输入、有机物质的分解等对土壤性质具有重要影响[1]。森林采伐是根据林木生长发育和人类经济需要而进行的营林措施。森林采伐后,尤其是皆伐导致枯落物输入减少、光照增强、温度升高、树冠对降水的截留量降低、土壤水分增加[2]。水、热性质的变化改变了有机质的分解条件,势必会对土壤中微生物的种类、数量、活性及土壤物理、化学性质产生影响[3],进而影响由微生物参与的土壤氮转化过程[4]。目前,已有不少研究探讨了不同采伐方式对林地土壤基本理化性质和微生物性质的影响[2,5-6],但针对采伐方式影响林地土壤氮初级转化速率和净氮转化速率的研究鲜见报道。土壤中有机氮的矿化可以提供林木生长所需的无机氮,对森林系统生产力具有重要影响,而矿化产生的无机氮在土壤中的微生物固定和硝化等转化过程影响了氮在土壤中的固持和损失。因此,研究采伐后林地土壤的氮素转化特征,对于深入了解森林生态系统氮素营养循环及其合理经营具有重要意义。
黑龙江省地处寒温带,地域辽阔,森林资源丰富,是我国重要的木材生产基地。近年来由于森林砍伐导致林区生态环境遭到严重破坏,土壤性质发生了显著改变[6-7]。因此,本研究以黑龙江省哈尔滨市阿城区的阔叶混交林地土壤为对象,选择择伐和皆伐10年后的林地土壤,以未经砍伐的保留带林地土壤为对照,采用室内培养试验研究土壤氮初级矿化速率、铵态氮固定速率、硝态氮固定速率和初级硝化速率等氮初级转化速率及净矿化速率、净硝化速率等净氮转化速率的变化对采伐方式的响应,旨在明确不同采伐方式下土壤中氮素的释放和保存能力,揭示采伐方式对森林土壤氮素营养循环的影响,为建立合理的采伐方式,保证森林生态系统的可持续发展提供科学依据。
-
试验林地选择黑龙江省哈尔滨市阿城区的阔叶混交林,该地区位于45°10′~45°50′ N、126°40′~127°39′ E之间,属寒温带大陆性季风气候,冬季寒冷干燥,夏季高温多雨。阿城区年平均降雨量530 mm,年平均气温1.5 °C,年有效积温2 450 °C,年日照时数2 600~2 800 h,无霜期125 d。阔叶混交林主要树种为紫椴(Tilia amurensis Rupr.)、大青杨(Populus ussuriensis Kom.)、桦树(Betula platyphylla Suk.)、裂叶榆(Ulmus laciniata Mayr.)、胡桃楸(Juglans mandshurica Maxim.)和水曲柳(Fraxinus mandschurica Rupr.)等。林下灌木主要有东北鼠李(Rhamnus schneideri Levl.)、毛榛子(Corylus mandshurica Maxim.)、暴马丁香(Syringa reticulate (Blume) H. Hara var. amurensis (Rupr.) J. S. Pringle)、金银忍冬(Lonicera maackii (Rupr.) Maxim.)等,主要采伐作业方式为择伐和皆伐。
于2020年10月选择采伐年限为10年的择伐和皆伐迹地以及相同条件下未采伐的保留带对照地,每种采伐类型样地设置3个空间重复样区,每个空间重复样区设置5个采样点,每个采样点去除表层枯枝落叶后各采集2个0~20 cm土壤环刀样,将10个样品混匀后作为1个空间重复样品。将此新鲜混合土样过2 mm筛,部分用于培养试验,其余土样风干后用于测定土壤理化性质,3种采伐类型土壤的理化性质见表1。
表 1 供试土壤的基本理化性质(平均值 ± 标准差)
Table 1. Physico-chemical properties of the studied soils (means ± SD)
土壤性质
Soil properties保留带
Reserved belt择伐
Selective cutting皆伐
Clear cuttingpH (H2O) 5.05 ± 0.14 a 4.91 ± 0.11 a 4.55 ± 0.21 b 有机碳 SOC/% 4.64 ± 0.12 a 4.06 ± 0.25 b 2.51 ± 0.36 c 全氮 TN/% 0.352 ± 0.022 a 0.304 ± 0.018 a 0.227 ± 0.035 b 碳氮比 C/N 13.2 ± 1.11 a 13.4 ± 0.99 a 11.1 ± 0.78 b 水溶性有机碳 SOCw/(mg·kg−1) 515 ± 21.6 a 458 ± 15.5 b 221 ± 11.4 c 水溶性有机氮 SONw/(mg·kg−1) 39.3 ± 3.51 a 32.7 ± 2.11 b 19.5 ± 3.47 c 铵态氮 NH4+-N/(mg·kg−1) 11.2 ± 0.95 a 9.83 ± 1.54 a 3.26 ± 0.26 b 硝态氮 NO3−-N/(mg·kg−1) 4.27 ± 0.10 a 3.45 ± 0.24 b 2.89 ± 0.21 c 最大持水量 WHC/% 81.8 ± 2.87 a 76.6 ± 2.66 a 69.5 ± 4.64 b 注:同行不同小写字母表示土壤间差异显著(p<0.05)
Note: Different lowercase letters in the same row indicate significant difference among the studied soils at 0.05 level -
本研究采用室内培养试验。试验设置分别添加15NH4NO3和NH415NO3的15N标记处理,标记丰度均为5 atom%,每个处理3次重复。对于每种采伐方式土壤,称取30 g新鲜土样(干基)至30个250 mL三角瓶中,将三角瓶分为两组(每组15瓶),向其中一组三角瓶中均匀加入2 mL 15N标记的15NH4NO3溶液,另外一组加入等量NH415NO3溶液,使得所添加NH4+-N和NO3−-N浓度达到20 mg∙kg−1。添加氮溶液的同时补水至60%WHC(最大持水量)。将三角瓶用锡箔封口,并扎4~5个洞以利于通气。将所有三角瓶置于恒温培养箱中25 ℃下黑暗培养7 d,培养期间每天打开锡箔通气30 min,用称重法补充蒸发损失的水分。分别在培养后的0、1、3、5、7 d采取破坏性采样方式每次每个处理随机选取3瓶,加入2 mol∙L−1的KCl溶液(液土比为2.5∶1)震荡提取,滤液收集至100 mL塑料瓶中用于分析NH4+和NO3−浓度及其15N丰度。过滤后的土壤样品用去离子水淋洗去除残留的KCl后于烘箱中60 ℃下烘干,磨细,用于土壤有机氮含量及其15N丰度分析。
-
土壤pH用DMP 2 mV/pH计(Quark, Ltd, Nanjing, China)测定,水土比2.5∶1;土壤最大持水量参照Fierer和Schimel的方法测定[8];土壤有机碳采用重铬酸钾容量法测定;土壤全氮采用半微量开氏法测定;水溶性有机碳和水溶性有机氮用水浸提后采用有机碳氮元素分析仪测定;土壤铵态氮和硝态氮用2 mol∙L−1 KCl浸提后(液土比2.5∶1)采用流动分析仪测定(Skalar, Breda, Netherlands),培养过程中提取的土壤无机氮采用MgO-定氮合金蒸馏法测定;土壤铵态氮、硝态氮和有机氮的15N丰度采用稳定性同位素质谱仪(Optima-EA; Micromass, Crewe, UK)测定。
-
文中氮初级转化速率采用FLUAZ模型拟合得出[9]。该模型采用15N同位素成对标记法,通过测定不同培养时间土壤中NH4+和NO3−浓度及其15N丰度的变化,即可同时计算出土壤中6种氮初级转化速率,分别是有机氮初级矿化速率(gm)、NH4+固定速率(ia)、NO3−固定速率(in)、初级硝化速率(gn)、初级反硝化速率(gd)和氨挥发速率(v)。该模型结合了数值方法(Runge-Kutta算法,4阶)和非线性拟合方程(Haus-Marquardt算法),以最小平均加权误差(MWE,mean weighed error)为标准拟合数据,优化氮转化过程速率参数,能够更加准确的反映速率之间的变异,模拟的土壤氮转化过程速率与实测值之间有很好的一致性,而且操作简便快捷。该模型可以拟合出不同时间段的氮转化过程速率,能够反映氮转化过程的动态变化趋势。文中整个培养期间的平均氮初级转化速率通过加权平均法计算得出[9]。
净氮转化速率采用以下公式计算:
nn=[(NO3−)t−(NO3−)t0]/(t−t0)
nm=[(NH4 ++NO3−)t−(NH4++NO3−)t0]/(t−t0)
式中,nn为净硝化速率(以N计,mg∙kg−1∙d−1),nm为净氮矿化速率(mg∙kg−1∙d−1);t为培养结束时间(7 d);t0为培养开始时间(0 d);(NO3−)t和(NO3−)t0分别为培养结束后和培养初始时间的NO3−-N含量(mg∙kg−1);(NH4+)t和(NH4+)t0分别为培养结束后和培养初始时间的NH4+-N含量(mg∙kg−1)。
采用Origin软件作图,采用SPSS软件进行数据处理与统计分析。
-
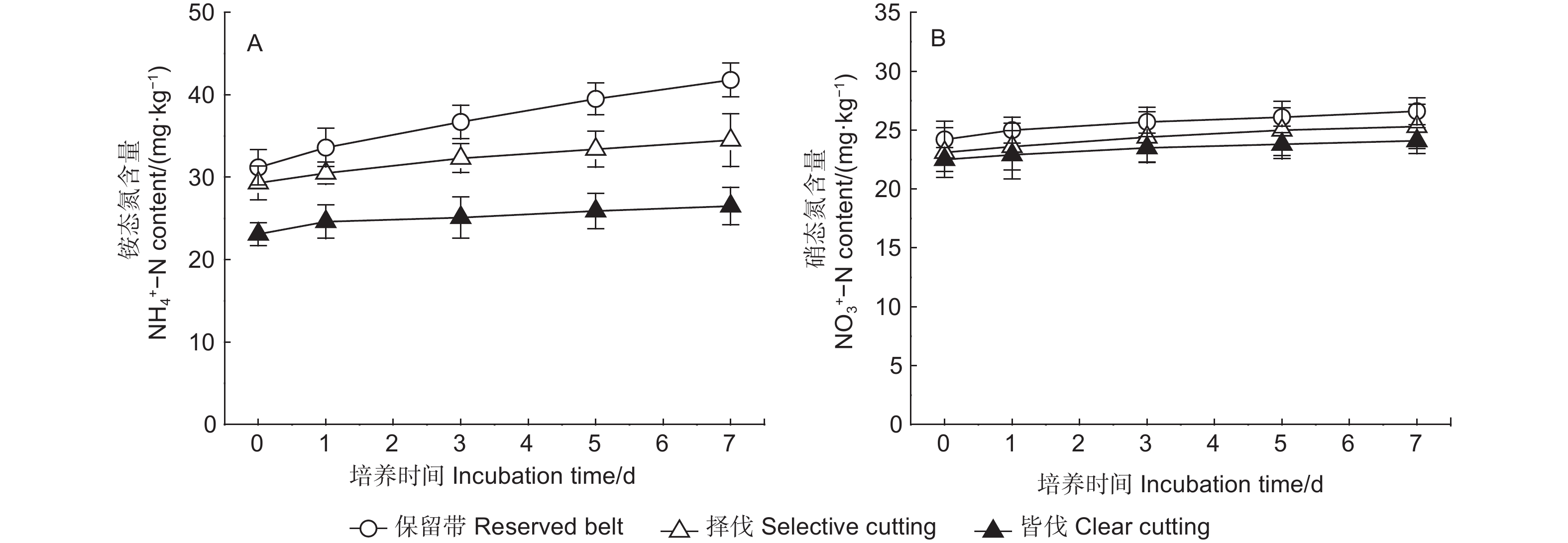
从图1可以看出,随着培养的进行,3种采伐方式下土壤铵态氮含量均逐渐增加(图1A),但增幅有所不同。与保留带处理相比,择伐和皆伐处理土壤铵态氮增加速率有所下降,各取样时间土壤铵态氮含量大小顺序为保留带>择伐>皆伐。培养期间各处理土壤硝态氮含量均表现为随培养的进行缓慢增加的变化趋势(图1B),各取样时间土壤硝态氮含量大小顺序为保留带>择伐>皆伐。
-
在15NH4NO3标记处理中,3种采伐方式下土壤铵态氮的15N丰度逐渐下降,保留带处理的15N丰度下降速率最快,其次为择伐处理,皆伐处理最慢(图2A)。在15NH4NO3处理中,硝态氮的15N丰度呈缓慢增加趋势,保留带处理的增加速率相对较快(图2B)。在NH415NO3标记处理中,3种采伐方式土壤铵态氮的15N丰度接近自然丰度,没有显著差异(图2C);而土壤硝态氮的15N丰度随着培养的进行逐渐下降(图2D),其下降速率为保留带>择伐>皆伐。
-
采伐显著降低了森林土壤氮初级转化速率(图3)和净氮转化速率(图4)。与保留带处理相比,择伐和皆伐处理土壤氮初级矿化速率分别显著降低了32.2%和61.8%(p<0.05),净氮矿化速率分别显著降低了43.1%和61.5%(p<0.05),氮初级固定速率分别显著降低了23.3%和63.4%(p<0.05),铵态氮固定速率分别显著降低了25.9%和66.2%(p<0.05)。不同采伐方式下土壤中氮的固定以铵态氮固定为主,硝态氮固定速率很低且各处理之间没有显著差异(p>0.05)。择伐对土壤初级硝化速率和净硝化速率没有显著影响,其gn/ia值与保留带处理相比也没有显著差异(p>0.05)。皆伐显著降低了土壤初级硝化速率和净硝化速率(p<0.05),但同时也显著增加了gn/ia值(p<0.05)。

图 3 不同采伐方式下土壤平均氮初级转化速率及gn/ia值
Figure 3. Average gross N transformation rates and gn/ia ratio in soils under different cutting methods

图 4 不同采伐方式下土壤平均净氮转化速率
Figure 4. Average net N transformation rates in soils under different cutting methods
3种采伐方式下土壤理化性质的差异显著影响土壤氮转化速率(表2),土壤氮初级矿化速率、初级固定速率、铵态氮固定速率、净硝化速率与pH、WHC、SOC、TN、C/N、SOCw、SONw、NH4+-N和NO3−-N含量均呈显著正相关,净氮矿化速率与除C/N比外的其他土壤性质也呈显著正相关,而初级硝化速率与pH、SOC、TN、SOCw、SONw、NH4+-N和NO3−-N含量均呈显著正相关。
表 2 氮初级转化速率和净氮转化速率(mg·kg−1·d−1)与土壤性质的相关系数(n=9)
Table 2. The correlation coefficients between gross or net N transformation rates and soil properties
土壤性质
Soil propertiesgm gn gi ia in nm nn pH 0.778* 0.668* 0.891** 0.887** −0.349 0.801** 0.757* 有机碳 SOC 0.919** 0.722* 0.983** 0.981** −0.445 0.853** 0.840** 全氮 TN 0.854** 0.815** 0.914** 0.917** −0.501 0.812** 0.762* 碳氮比 C/N 0.716* 0.359 0.780* 0.771* −0.164 0.615 0.678* 水溶性有机碳 SOCw 0.931** 0.711* 0.966** 0.961** −0.362 0.823** 0.914** 水溶性有机氮 SONw 0.946** 0.680* 0.965** 0.963** −0.409 0.873** 0.893** 铵态氮 NH4+−N 0.874** 0.776* 0.930** 0.920** −0.224 0.816** 0.964** 硝态氮 NO3−−N 0.962** 0.749* 0.945** 0.955** −0.689* 0.934** 0.743* 最大持水量 WHC 0.905** 0.629 0.870** 0.870** −0.422 0.832** 0.810** 注:gm,有机氮初级矿化速率;gn,初级硝化速率;gi,氮初级固定速率;ia,NH4+固定速率;in,NO3−固定速率;nm,净氮矿化速率;nn,净硝化速率;**表示p<0.01;*表示p<0.05
Notes: gm,gross N mineralization rate;gi,gross N immobilization rate;ia,NH4+ immobilization rate;in,NO3− immobilization rate;gn,gross nitrification rate;nm, net N mineralization rate; nn, net nitrification rate; ** indicates p<0.01; * indicatesp<0.05 -
有机氮的矿化过程是将各种有机氮化合物转化为可被植物吸收利用的铵态氮的过程,此过程速率大小对森林生态系统生产力具有重要影响[10]。我们的结果表明,森林采伐显著影响了土壤氮素矿化过程。相比保留带处理,择伐和皆伐都显著降低了土壤氮初级矿化速率和净氮矿化速率,皆伐处理的下降程度大于择伐处理(图3、图4)。Hasset和Zak[11]基于加拿大白杨林地土壤的研究也发现,无论是择伐还是皆伐,采伐8年后土壤氮初级矿化速率均显著降低,他们认为是因为采伐后土壤中微生物的数量、活性以及胞外酶的活性显著下降所致。Forge和Simard[3]也曾报道,加拿大不列颠哥伦比亚省白杨林地皆伐9年后,土壤净氮矿化速率显著降低,这与我们的研究结果一致。本研究发现,土壤氮初级矿化速率与土壤有机碳和水溶性有机碳呈显著正相关。土壤有机碳是土壤微生物生存的基质,能够为微生物的生长和繁殖提供能量和底物,通常土壤有机碳含量越高,微生物活性越强,氮初级矿化速率越高[12-13]。因此,我们推测本研究中择伐和皆伐处理土壤氮初级矿化速率的降低是由于有机碳含量的下降导致。森林土壤有机碳含量取决于两个方面,一是枯落物输入的数量和组成,二是降水和温度等环境条件[14-15]。森林采伐后,林地光照明显增加[16],地表温度升高[17],这为有机质的分解提供了适宜的条件。研究指出,皆伐地表温度变化最大,其次为择伐处理,保留带由于环境没有发生任何变化,避免了由于太阳直射而导致的升温,温度变化最小[2]。因此,皆伐迹地微生物数量和酶活性增加,促进了凋落物层和遗留下来的大量采伐剩余物的分解;同时枯落物输入来源减少,导致有机碳含量显著降低。而择伐迹地温度变化相比皆伐迹地较小,有机质分解缓慢,而且每年仍然有相当数量的枯枝落叶输入,从而使得有机碳含量下降比皆伐少[11]。另外,树冠截留能减弱降雨强度,延缓地表径流的形成,降低土壤侵蚀和水土流失[2]。择伐处理虽然尚存一部分林木,但是已经形成较大林窗,林下植被遭到严重破坏,很大程度上降低了林冠对降雨的截留消能作用,导致降水产生的坡面径流增大,有机质易遭受淋失和流失。而皆伐后林地乔木、亚乔木和林下灌木荡然无存,表层土壤裸露,土壤紧实度增加,地表径流和淋溶作用增强,而且伐后并未进行人工造林,从而导致有机碳含量降低程度大于择伐处理[2]。这可能是皆伐迹地土壤氮初级矿化速率比保留带处理的降低程度大于择伐处理的主要原因。值得注意的是,前人研究也曾报道,森林皆伐后的最初1~4年内,土壤氮初级矿化速率和净氮矿化速率比采伐前显著增加[4,18-19],这可能是因为采伐初期抑制微生物分解活动的含酚类物质输入减少,地表温度升高,采伐迹地的水热条件有利于枯落物的分解及有机质的矿化作用,有效养分溢出,土壤养分循环速率加快[19]。本研究中林地采伐后时间长达10年,整个过程中土壤有机质持续矿化分解,且受淋溶作用和地表冲刷的影响,养分流失导致土壤贫瘠,微生物活性降低,因此土壤氮初级矿化速率显著降低。
土壤氮初级固定速率对采伐方式的响应与土壤氮初级矿化速率相似,表现为皆伐处理显著低于择伐处理,择伐处理显著低于保留带处理。土壤中微生物对无机氮的生物固定受土壤有机碳(尤其是易分解有效碳)含量影响[20],因为土壤中参与氮矿化过程的微生物可以利用一系列复杂的有机碳化合物,不受碳源质量的影响,而参与氮固定过程的微生物对碳底物的质量要求较高,只能利用简单的易分解有效碳[21]。本研究也表明,土壤氮初级固定速率与水溶性有机碳含量呈极显著正相关(表2)。水溶性有机碳是最容易被微生物分解利用的碳组分,虽然其在土壤中的数量少,但却对微生物活性具有重要影响[22]。本研究中皆伐和择伐处理土壤氮初级固定速率显著低于保留带处理,这可能是因为森林采伐后土壤中枯枝落叶输入量减少,使得土壤有机碳含量和水溶性有机碳含量随之显著降低所致(表1)。Bradley等[23]研究也发现,加拿大不列颠哥伦比亚省的林地在皆伐4年后土壤有效碳含量显著降低,对无机氮的固定也显著减少。微生物既可以利用土壤中的铵态氮,也能利用硝态氮,但是对于铵态氮的固定比例远远大于硝态氮,因为微生物固定铵态氮所需的能量少于硝态氮[24]。有研究指出,土壤中铵态氮含量大于0.1 μg·g−1就可以显著抑制对硝态氮的固定[25]。本研究结果也表明,不同采伐方式下土壤中微生物对氮的固定以铵态氮为主,对硝态氮的固定速率很低,可以忽略不计。Hasset等[11]研究了采伐8年和10年的白杨林地土壤,发现择伐和皆伐处理土壤微生物数量和活性以及胞外水解酶的活性均显著下降,导致土壤氮初级固定速率也显著降低。由此可见,不同采伐方式可以通过影响土壤碳输入量而影响土壤中与氮转化相关微生物的数量和活性,进而影响土壤无机氮的固定速率。
与保留带处理相比,择伐处理土壤初级硝化速率和净硝化速率的下降幅度未达显著水平,而皆伐处理土壤初级硝化速率和净硝化速率显著降低(图3、图4),这可能与土壤pH的变化有关。前人研究指出,硝化细菌适宜在中性到微碱性的土壤中生存,在一定范围内,硝化细菌的数量和活性与土壤pH呈显著正相关[26]。本研究结果也发现,土壤初级硝化速率和净硝化速率均与土壤pH呈显著正相关(表2),与Hasset等[10]的结果一致。土壤酸碱性的变化比较复杂,不仅与枯落物的组成和有机质分解速度有关,同时还受气候环境等因素的影响[15]。本研究中,择伐10年后土壤pH与保留带处理相比没有显著变化,这可能是因为择伐后光照增强,水、气、热条件的变化促进了枯落物加速分解,产生大量酸性物质,土壤胶体盐基离子被氢离子取代导致土壤pH降低。但是随着伐后时间的延长,大量酸性物质被淋溶掉,同时大量杂草入侵,土壤中灰分元素不断增加,使得择伐迹地土壤酸度逐渐下降,pH值又恢复到接近采伐前的数值[5]。择伐处理土壤pH先下降后上升的动态变化,使得土壤初级硝化速率和净硝化速率也没有显著变化(图3、图4)。与择伐处理不同,皆伐迹地枯落物输入来源相比保留带和择伐迹地显著减少,土壤灰分元素含量低,且因降水产生的地表径流和土壤侵蚀导致灰分元素流失大,释放出来的盐基物质少,中和量小,故皆伐迹地土壤pH显著降低[5,15],土壤初级硝化速率和净硝化速率也随之显著下降。
室内培养条件下,酸性森林土壤中铵态氮的主要去向有硝化和微生物固定两个途径。因此,初级硝化速率与铵态氮固定速率比值(gn/ia)可以用来衡量土壤中硝态氮的淋溶风险[27]。本研究结果表明,不同采伐方式对土壤氮循环的影响不同。皆伐处理的土壤初级氮矿化速率和固定速率显著低于保留带处理,说明实施皆伐措施后森林土壤氮素的释放和固持能力下降,但土壤有机氮矿化速率仍然大于固定速率,土壤中盈余的铵态氮主要发生硝化作用,使得gn/ia值显著增加(图3),最终导致土壤中NO3−/NH4+值相比保留带处理显著提高(表1),当降雨发生时也增加了土壤中硝态氮的淋溶风险。而实施择伐措施后,虽然土壤中氮素周转速率也比保留带处理显著下降,但其下降幅度远小于皆伐处理,且择伐处理的土壤初级硝化速率没有发生显著改变,gn/ia值与保留带处理没有显著差异(图3),因此没有显著改变土壤中NO3−/NH4+值(表1)。综上所述,在进行森林采伐时,最好选用择伐措施,以减少林地土壤硝态氮的淋溶风险,维持森林生态系统的可持续发展。
-
采伐方式影响森林土壤的氮转化过程。与不采伐的保留带处理相比,实施择伐和皆伐措施显著降低了土壤有机碳和水溶性有机碳含量,进而导致土壤氮初级矿化速率、净氮矿化速率和铵态氮固定速率显著降低,且皆伐处理的下降幅度显著大于择伐。实施皆伐措施后土壤pH显著下降,土壤初级硝化速率和净硝化速率也随之显著降低。择伐对土壤gn/ia值和NO3−/NH4+值没有显著影响,而皆伐则显著提高土壤gn/ia值和NO3−/NH4+值,同时也增加了土壤硝态氮的淋溶风险。
采伐方式对森林土壤氮初级转化速率和净氮转化速率的影响
Effects of Cutting Methods on Gross and Net N Transformation Rates in Forest Soils
-
摘要:
目的 为探明不同采伐方式下森林土壤氮素的释放和保存能力,揭示采伐对森林土壤氮素循环的影响。 方法 本研究通过室内培养试验,采用15N同位素成对标记技术和FLUAZ数值优化模型研究了择伐和皆伐方式下寒温带阔叶混交林土壤氮初级转化速率和净氮转化速率特征。 结果 保留带处理土壤氮初级矿化速率、净氮矿化速率、氮初级固定速率、初级硝化速率和净硝化速率分别为4.16、1.86、2.32、0.368和0.343 mg∙kg−1∙d−1。与保留带处理相比,择伐和皆伐处理土壤氮初级矿化速率分别显著降低了32.2%和61.8%,净氮矿化速率分别显著降低了43.1%和61.5%,氮初级固定速率分别显著降低了23.3%和63.4%。择伐对土壤初级硝化速率和净硝化速率没有显著影响,但皆伐处理土壤初级硝化速率和净硝化速率分别显著降低了23.6%和33.3%。相关分析结果表明,土壤有机碳和水溶性有机碳含量的变化是影响氮初级矿化速率和初级固定速率的主要因素,pH是影响硝化速率的主要因素。 结论 皆伐后土壤铵态氮固定速率的下降程度大于初级硝化速率,导致gn/ia和NO3−/NH4+值显著提高,增加了硝态氮淋溶风险。而择伐处理的gn/ia和NO3−/NH4+值与保留带处理没有显著差异,是一种相对可取的森林采伐方式。 Abstract:Objective To explore the nitrogen release and conservation capacity of forest soil under different cutting methods, and reveal the impact of cutting methods on forest soil N nutrient cycle. Method A laboratory incubation experiment was conducted to study the effects of selective cutting and clear cutting on gross and net N transformation rates in broad-leaved mixed forest soil in cold temperate zone, using 15N paired isotope labeling technique and FLUAZ numeric model. Result In the reserved belt without any cutting, soil gross N mineralization, net N mineralization, gross N immobilization, gross nitrification, and net nitrification rates were 4.16, 1.86, 2.32, 0.368, and 0.343 mg∙kg−1∙d−1, respectively. In comparison with the treatment of reserved belt, soil gross N mineralization rates of the selective cutting and clear cutting treatments significantly decreased by 32.2% and 61.8%, respectively, soil net N mineralization rates significantly decreased by 43.1% and 61.5%, respectively, and soil gross N immobilization rates significantly decreased by 23.3% and 63.4%. Selective cutting had no significant effects on gross and net nitrification rates in soil, while clear cutting significantly decreased soil gross and net nitrification rates by 23.6% and 33.3%, respectively. The correlation analysis indicated that soil organic C and water soluble organic C were the main factors influencing gross and net N mineralization and immobilization rates in soil, and pH was the main factor influencing gross and net nitrification rates in soil. Conclusion Our results indicate that the decrease of gross ammonium immobilization rate is greater than that of gross nitrification rate after clear cutting, leading to the significant increase of ratio of gn/ia and NO3−/NH4+ in soil, which increases the risk of NO3− leaching. However, the ratio of gn/ia and NO3−/NH4+ in soil under selective cutting is not significantly different from that of the reserved belt, which is a desirable way of forest harvesting. -
Key words:
- 15N trace
- / N transformation rates
- / selective cutting
- / clear cutting
- / broad-leaved mixed forest
-
表 1 供试土壤的基本理化性质(平均值 ± 标准差)
Table 1. Physico-chemical properties of the studied soils (means ± SD)
土壤性质
Soil properties保留带
Reserved belt择伐
Selective cutting皆伐
Clear cuttingpH (H2O) 5.05 ± 0.14 a 4.91 ± 0.11 a 4.55 ± 0.21 b 有机碳 SOC/% 4.64 ± 0.12 a 4.06 ± 0.25 b 2.51 ± 0.36 c 全氮 TN/% 0.352 ± 0.022 a 0.304 ± 0.018 a 0.227 ± 0.035 b 碳氮比 C/N 13.2 ± 1.11 a 13.4 ± 0.99 a 11.1 ± 0.78 b 水溶性有机碳 SOCw/(mg·kg−1) 515 ± 21.6 a 458 ± 15.5 b 221 ± 11.4 c 水溶性有机氮 SONw/(mg·kg−1) 39.3 ± 3.51 a 32.7 ± 2.11 b 19.5 ± 3.47 c 铵态氮 NH4+-N/(mg·kg−1) 11.2 ± 0.95 a 9.83 ± 1.54 a 3.26 ± 0.26 b 硝态氮 NO3−-N/(mg·kg−1) 4.27 ± 0.10 a 3.45 ± 0.24 b 2.89 ± 0.21 c 最大持水量 WHC/% 81.8 ± 2.87 a 76.6 ± 2.66 a 69.5 ± 4.64 b 注:同行不同小写字母表示土壤间差异显著(p<0.05)
Note: Different lowercase letters in the same row indicate significant difference among the studied soils at 0.05 level表 2 氮初级转化速率和净氮转化速率(mg·kg−1·d−1)与土壤性质的相关系数(n=9)
Table 2. The correlation coefficients between gross or net N transformation rates and soil properties
土壤性质
Soil propertiesgm gn gi ia in nm nn pH 0.778* 0.668* 0.891** 0.887** −0.349 0.801** 0.757* 有机碳 SOC 0.919** 0.722* 0.983** 0.981** −0.445 0.853** 0.840** 全氮 TN 0.854** 0.815** 0.914** 0.917** −0.501 0.812** 0.762* 碳氮比 C/N 0.716* 0.359 0.780* 0.771* −0.164 0.615 0.678* 水溶性有机碳 SOCw 0.931** 0.711* 0.966** 0.961** −0.362 0.823** 0.914** 水溶性有机氮 SONw 0.946** 0.680* 0.965** 0.963** −0.409 0.873** 0.893** 铵态氮 NH4+−N 0.874** 0.776* 0.930** 0.920** −0.224 0.816** 0.964** 硝态氮 NO3−−N 0.962** 0.749* 0.945** 0.955** −0.689* 0.934** 0.743* 最大持水量 WHC 0.905** 0.629 0.870** 0.870** −0.422 0.832** 0.810** 注:gm,有机氮初级矿化速率;gn,初级硝化速率;gi,氮初级固定速率;ia,NH4+固定速率;in,NO3−固定速率;nm,净氮矿化速率;nn,净硝化速率;**表示p<0.01;*表示p<0.05
Notes: gm,gross N mineralization rate;gi,gross N immobilization rate;ia,NH4+ immobilization rate;in,NO3− immobilization rate;gn,gross nitrification rate;nm, net N mineralization rate; nn, net nitrification rate; ** indicates p<0.01; * indicatesp<0.05 -
[1] 刘 涛, 王家妍, 李万年, 等. 杉木 × 观光木异龄复层混交对林木生长及土壤理化性质的影响[J]. 西北林学院学报, 2022, 37(1):125-130. [2] 张荣瑛. 森林采伐对生态环境的影响[J]. 亚热带水土保持, 2006, 18(4):15-18. [3] FORGE T A, SIMARD S W. Trophic structure of nematode communities, microbial biomass, and nitrogen mineralization in soils of forests and clearcuts in the southern interior of British Columbia[J]. Canadian Journal of Soil Science, 2000, 80(3): 401-410. doi: 10.4141/S99-112 [4] CARMOSINI N, DEVITO K J, PREPAS E E. Gross nitrogen transformations in harvested and mature aspen-conifer mixed forest soils from the Boreal Plain[J]. Soil Biology and Biochemistry, 2002, 34(12): 1949-1951. doi: 10.1016/S0038-0717(02)00172-4 [5] 郝广明, 许忠学, 杨 帆, 等. 采伐林地土壤养分研究[J]. 北华大学学报(自然科学版), 2002, 3(5):441-444. [6] 杜秀娟. 森林采伐对土壤养分的影响[J]. 内蒙古林业调查设计, 2013, 36(5):28-30. [7] 董希讧, 杨学春, 杨桂香. 采伐对落叶松人工林土壤性质的影响[J]. 东北林业大学学报, 2007, 35(10):7-10. [8] FIERER N, SCHIMEL J P. Effects of drying-rewetting frequency on soil carbon and nitrogen transformations[J]. Soil Biology and Biochemistry, 2002, 34(6): 777-787. doi: 10.1016/S0038-0717(02)00007-X [9] MARY B, RECOUS S, ROBIN D. A model for calculating nitrogen fluxes in soil using 15N tracing[J]. Soil Biology and Biochemistry, 1998, 30(14): 1963-1979. doi: 10.1016/S0038-0717(98)00068-6 [10] 左倩倩, 王邵军. 生物与非生物因素对森林土壤氮矿化的调控机制[J]. 浙江农林大学学报, 2021, 38(3):613-623. [11] HASSETT J E, ZAK D R. Aspen harvest intensity decreases microbial biomass, extracellular enzyme activity, and soil nitrogen cycling[J]. Soil Science Society of America Journal, 2005, 69(1): 227-235. doi: 10.2136/sssaj2005.0227 [12] CHI Q D, WANG J, LIU Y Q,et al. Varying interactive effects of climate, soil properties, and gross nitrogen dynamics on biomass production between the topsoil and the subsoil in natural grassland ecosystems[J]. European Journal of Soil Biology, 2021, 104: 103299. doi: 10.1016/j.ejsobi.2021.103299 [13] LANG M, LI P, LONG G Q,et al. Grazing rest versus no grazing stimulates soil inorganic N turnover in the alpine grasslands of the Qinghai-Tibet plateau[J]. Catena, 2021, 204: 105382. doi: 10.1016/j.catena.2021.105382 [14] 杜 雪, 王海燕. 中国森林土壤有机碳活性组分及其影响因素[J]. 世界林业研究, 2022, 35(1):76-81. [15] 周 莉, 代力民, 谷会岩, 等. 长白山阔叶红松林采伐迹地土壤养分含量动态研究[J]. 应用生态学报, 2004, 15(10):1771-1775. [16] BARG A K, EDMONDS R L. Influence of partial cutting on site microclimate, soil nitrogen dynamics, and microbial biomass in Douglas-fir stands in western Washington[J]. Canadian Journal of Forest Research, 1999, 29(6): 705-713. doi: 10.1139/x99-045 [17] KIM C, SHARIK T L, JURGENSEN M F. Canopy cover effects on soil nitrogen mineralization in northern red oak (Quercus rubra) stands in northern lower Michigan[J]. Forest Ecology and Management, 1995, 76(1-3): 21-28. doi: 10.1016/0378-1127(95)03563-P [18] LORENZ K, PRESTON C M. Characterization of high-tannin fractions from humus by carbon-13 cross-polarization and magic-angle spinning nuclear magnetic resonance[J]. Journal of Environmental Quality, 2002, 31(2): 431-436. doi: 10.2134/jeq2002.4310 [19] GRENON F, BRADLEY R L, JOANISSE G,et al. Mineral N availability for conifer growth following clearcutting: responsive versus non-responsive ecosystems[J]. Forest Ecology and Management, 2004, 188(1-3): 305-316. doi: 10.1016/j.foreco.2003.08.008 [20] REN X, ZHANG J, BAH H,et al. Soil gross nitrogen transformations in forestland and cropland of Regosols[J]. Scientific Reports, 2021, 11(1): 223. doi: 10.1038/s41598-020-80395-x [21] HOYLE F C, MURPHY D V, FILLERY I R P. Temperature and stubble management influence microbial CO2-C evolution and gross N transformation rates[J]. Soil Biology and Biochemistry, 2006, 38(1): 71-80. doi: 10.1016/j.soilbio.2005.04.020 [22] CHEN Z X, ELRYS A S, ZHANG H M,et al. How does organic amendment affect soil microbial nitrate immobilization rate?[J]. Soil Biology and Biochemistry, 2022, 173: 108784. doi: 10.1016/j.soilbio.2022.108784 [23] BRADLEY R L, TITUS B D, HOGG K. Does shelterwood harvesting have less impact on forest floor nutrient availability and microbial properties than clearcutting?[J]. Biology and Fertility of Soils, 2001, 34(3): 162-169. doi: 10.1007/s003740100389 [24] MARIANO E, JONES D L, HILL P W,et al. Mineral nitrogen forms alter 14C-glucose mineralisation and nitrogen transformations in litter and soil from two sugarcane fields[J]. Applied Soil Ecology, 2016, 107: 154-161. doi: 10.1016/j.apsoil.2016.05.019 [25] RICE C W, TIEDJE J M. Regulation of nitrate assimilation by ammonium in soils and in isolated soil microorganisms[J]. Soil Biology and Biochemistry, 1989, 21(4): 597-602. doi: 10.1016/0038-0717(89)90135-1 [26] ELYRS A S, WANG J, METWALLY M A S,et al. Global gross nitrification rates are dominantly driven by soil carbon-to-nitrogen stoichiometry and total nitrogen[J]. Global Change Biology, 2021, 27(24): 6512-6524. doi: 10.1111/gcb.15883 [27] ZHANG Y S, PAN B B, LAM S K,et al. Predicting the ratio of nitrification to immobilization to reflect the potential risk of nitrogen loss worldwide[J]. Environmental Science and Technology, 2021, 55(11): 7721-7730. doi: 10.1021/acs.est.0c08514 -





 下载:
下载: