-
野杏(Prunus armeniaca L.)是天山野果林原始植物区系组成物种之一,对维持稳定的野果林生态系统起着重要作用[1]。近年来,由于人类活动、病虫害大面积发生等原因,导致野果林受损严重,野杏也受害较重,未能幸免。其中,病害以真菌性穿孔病对野杏叶片和果实的为害最为严重。通过前期研究发现引起野杏真菌性穿孔病的病原为嗜果刀孢菌(Wilsonomyces carpophilus),属于子囊菌门(Ascomycota),座囊菌纲(Dothideomycetes),格孢菌亚纲(Pleosporomycetidae),格孢腔菌目(Pleosporales),科(Dothidotthiaceae),嗜果刀孢菌属(Wilsonomyces)[2-3],该属仅包含嗜果刀孢菌一个种。由该菌引起的穿孔病是危害核果类果树的一类重要病害,最早于1843年在法国发现,随后在美国、伊朗、澳大利亚、阿富汗、意大利、希腊、新西兰、葡萄牙、前苏联、印度以及中国[4-7]等国家均有为害。中国甘肃省自上世纪九十年代记录了由嗜果刀孢菌引起杏果斑点病的病果率高达80%[5]、桃果实褐斑病的病果率达71%[8]。2019年,程元等调查发现新疆巩留县超过50%的杏树果实受到嗜果刀孢菌的为害[9]。2020年,叶双华等在新疆伊犁的新源、巩留、霍城和伊宁县调查发现,野杏叶片和果实平均发病率达79.33%和53.17%[10],严重影响杏果实的产量和品质。目前,我国的甘肃、新疆、河北、河南、安徽、江苏、四川、吉林等省份及自治区有该菌的为害记录[8-12]。
嗜果刀孢菌不仅分布广,而且危害的寄主种类也较多。该菌在全球范围内可以危害壳斗科(Fagaceae)栎属(Quercus)的冬青栎(Quercus ilex L.)[13]和蔷薇科(Rosaceae)李属(Prunus)、樱属(Cerasus)、稠李属(Padus)、桃属(Amygdalus)、梨属(Pyrus)、花楸属(Sorbus)、榅桲属(Cydonia)、苹果属(Malus)[4-8,12-13]等的多种植物,如:杏(Prunus armeniaca L.)、桃(Prunus persica L.)、李(Prunus salicina Lindl.)、桂樱(Prunus laurocerasus L.)[14]、美洲李(Prunus americana Marshall.)[15]、扁桃(Amygdalus communis L.)、稠李(Padus avium Mill.)、西洋梨(Pyrus communis L.)、欧亚花楸(Sorbus aucuparia Maxim.)、榅桲(Cydonia oblonga Mill.)、苹果(Malus pumila Mill.)等[16]。嗜果刀孢菌在我国主要为害杏、桃、李、东北杏(Prunus mandshurica (Maxim.) Koehne)、欧洲李(Prunus domestica L.)、梅(Prunus mume Siebold et Zucc.)和山樱花(Cerasus serrulata (Lindl.) G. Don)等造成叶片穿孔或果实表面形成褐斑。新疆目前仅在野杏和野生樱桃李上有嗜果刀孢菌的为害记录[5,8-10],但新疆多数城市绿化树种和主要的经济林树种都隶属于蔷薇科[17],嗜果刀孢菌能否对其它树种造成危害尚不明确。因而,开展该菌的寄主范围测定,对于由嗜果刀孢菌引起的穿孔病的风险评估和病害的预防具有重要意义。
国内外关于嗜果刀孢菌的研究主要集中在种类鉴定[5,8]、生物学性状[18]、病理生理[19-21]及防治等[5]。对于嗜果刀孢菌引起的穿孔病的诊断主要通过传统的组织分离法,基于形态学特征结合多片段分子生物学完成,费时费力、诊断效率低,建立嗜果刀孢菌的快速检测技术对于病害的快速、准确诊断至关重要。常规PCR技术在植物病原菌的种类鉴定及多样性分析等方面得到广泛应用[22-23],但其灵敏度有限。实时荧光定量PCR技术具有高效、高特异性、高灵敏度和定量分析等特点,在植物病原物检测及流行学方面的研究得到了广泛应用[24]。王瑜等基于腐皮镰刀菌的tef1(translation elongation factor 1-alpha)基因建立了该菌的实时荧光定量PCR快速检测方法,提高了中药材根腐病的检出率[25]。谢学文等根据三磷酸甘油醛脱氢酶(GAPDH)基因序列设计引物,建立了茄匍柄霉菌的qRT-PCR检测体系,能快速准确定量检测土壤病残体中茄匍柄霉菌的含量[26]。段维军等基于向日葵黑茎菌及其近似种的ITS序列差异构建了TaqMan-MGB探针实时荧光快速检测方法,可用于疑似携带向日葵黑茎菌的样品检测[27]。任海英等利用杨梅凋萎病原菌异色拟盘多毛孢和小孢拟盘多毛孢的ITS1-5.8S rDNA-ITS2序列设计了特异性引物对,成功建立了杨梅凋萎病的常规PCR检测方法用于该病害的检疫及防控[28]。
鉴于当前野杏嗜果刀孢穿孔病菌的潜在寄主范围尚不明确、快速检测技术较为缺乏,本研究拟通过离体叶片接种法测定该病菌在新疆乌鲁木齐常见园林绿化植物上的致病性,并设计筛选特异性引物,建立嗜果刀孢菌的分子快速检测技术体系,从而提高病害的诊断效率,为野杏真菌性穿孔病的早期检测和制定科学精准的防治措施提供理论依据。
-
通过调查和资料记载[17]筛选了6科19种乌鲁木齐常见的园林绿化树种作为供试植物范围进行测定,树种详细信息见表1。
表 1 待测寄主植物列表
Table 1. List of plants used in the host range study of Wilsonomyces carpophilus
序号
Number科
Family植物种类
Plant species1 蔷薇科Rosaceae 野苹果Malus sieversii、黄太平Malus micromalus、山荆子Malus baccata 北美海棠Malus 'American'、野杏Prunus armeniaca、山桃Prunus davidiana 野生樱桃李Prunus divaricata、榆叶梅Prunus triloba、毛樱桃Prunus tomentosa、紫叶矮樱Prunus cistena、秋子梨Pyrus ussuriensis、杜梨Pyrus betulaefolia、黄果山楂Crataegus chlorocarpa 2 杨柳科Salicaceae 新疆杨Populus alba var.pyrmidalis、垂柳Salix babylonica 3 榆科Ulmaceae 金叶榆Ulmus pumila 'Jinye' 4 卫矛科Celastraceae 丝绵木Euonymus bungeanus 5 木犀科Oleaceae 新疆小叶白蜡Fraxinus sogdiana 6 桑科Moraceae 鞑靼桑Morus alba var. tatarica 本试验中选取菌株YA21作为供试菌株。该菌株来源于野杏穿孔叶片的病组织,为通过单孢纯化法获取的纯培养菌株,并基于形态学和分子生物学明确了该菌为嗜果刀孢菌(GenBank:OQ547194)。将菌株YA21在PDA培养基上,28 ℃全黑暗的条件下培养5 d,在菌落边缘选取生长一致的直径为5 mm的菌饼作为接种体,备用。
本研究采用离体叶片刺伤接种法,即每个树种选取生长一致的健康叶片10片,无菌水冲洗后再用75%的酒精进行表面消毒,自然晾干后再用无菌的5号昆虫针刺穿叶片,形成大小均匀的单个伤口。然后将制备的菌饼有菌丝面朝向伤口,以接种空白PDA培养基为对照,每个处理3个重复[10,29-30]。接种的叶片叶柄处用湿润的灭菌脱脂棉覆盖保湿,随后放入无菌的培养皿内并置于底层铺有无菌纱布的不锈钢托盘中。托盘中加入适量无菌水,保证湿度,托盘表面用保鲜膜封口,置于25 ℃培养箱中。接种48 h后拆除接种体,于第3 d开始每天拍照记录病斑扩展情况,用游标卡尺采用十字交叉法测量病斑长度和宽度,并按圆的面积计算病斑面积,病斑面积=π×[(长度 + 宽度)/2]2(π取3.14),实验数据利用Microsoft Excel 2019进行整理,利用SPSS 20.0软件进行单因素方差分析第5 d的病斑面积大小,比较差异显著性。在第13 d将发病部位通过常规组织分离法进行病原菌再分离,通过形态学结合分子方法完成种类鉴定,以确认是否为所接种的嗜果刀孢菌。
-
根据翻译延伸因子(tef1)基因序列(GenBank:KY905684.1)[2],基于引物设计原则通过primer premier 5.0软件设计并筛选出一对引物W0404-14-F(5′-GGGCATTTTTGGATGGTGGG-3′),W0404-14-R(5′-TGCCCAAAGGGATCATGGAC-3′),引物由生工生物工程(上海)股份有限公司合成。以菌株YA21的DNA作为标准品,通过核酸检测仪检测其DNA浓度为5.99 × 102 ng·μL−1,OD260/OD280为1.88,表明模板DNA纯度较好,可作为标准品用于后续PCR扩增。
从新源县、霍城县和巩留县的野杏、野生樱桃李和桃的芽、叶片和果实上共收集到76株嗜果刀孢菌,从其他6种寄主上收集到22株其他真菌,共计98株真菌菌株,信息见表2,所有菌株保藏在新疆农业大学林学与风景园林学院森林保护学实验室。采用CTAB法提取上述98株供试菌株的DNA[31],并用于特异性引物的检测,以ddH2O为空白对照(CK)进行常规PCR扩增,检测引物的特异性。常规PCR扩增总体系为25 μL,包括2 × Taq PCR Master Mix 12.5 μL,模板DNA 1.0 μL,10 μmol·L−1上下游引物各0.5 μL,ddH2O 10.5 μL。反应程序:95 ℃预变性8 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,35个循环;最后72 ℃延伸7 min。PCR产物经1%琼脂糖凝胶电泳(120 V,25~30 min)检测后,凝胶成像系统分析结果。
表 2 供试菌株及来源
Table 2. The species and sources of strains in this study
序号
Number寄主
Host危害部位
Hazardous site采集地点
Collection site菌株种类
The species of strains菌株编号
Strain No1 野杏 芽 新疆伊犁霍城县 Corynascus sepedonium YA38 2 野杏 芽 新疆伊犁霍城县 Aureobasidium pullulans YA48 3 野杏 芽 新疆伊犁霍城县 Didymella glomerata YA99 4 野杏 芽 新疆伊犁新源县 Wilsonomyces carpophilus YA5、YA7、YA21、YA23、YA31 5 野杏 叶片 新疆伊犁霍城县 Didymella heteroderae HC1-W-3m3 6 野杏 叶片 新疆伊犁霍城县 Wilsonomyces carpophilus Y035 5m1、Y048 5m2、Y049 7m1、
Y052 7m1、Y0124、Y0125、Y0126、
Y0128、HC-Y-17 野杏 叶片 新疆伊犁巩留县 Metarhizium robertsii DMH-1-5m1 8 野杏 叶片 新疆伊犁巩留县 Chaetomium bostrychodes 19-30s 9 野杏 叶片 新疆伊犁巩留县 Wilsonomyces carpophilus Y057 7m3、Y093、Y094、Y095、Y096、Y097、Y098、Y099、Y0100、Y0101、Y0102、Y0103、Y0104、Y0105、Y0106、Y0148、Y0152、Y0154、Y0155 10 野杏 叶片 新疆伊犁新源县 Monilinia laxa XHG-1-3m2 11 野杏 叶片 新疆伊犁新源县 Alternaria infectoria ZWY2-W-3m3 12 野杏 叶片 新疆伊犁新源县 Wilsonomyces carpophilus Y037 7m2、Y038 7m2、Y039 3m3、
Y040 7m2、Y068、Y069、Y070、Y071、Y072、Y073、Y074、Y075、Y0144、Y014713 野杏 叶片 新疆伊犁伊宁县 Wilsonomyces carpophilus Y043 7m1、Y045 5m2-2、Y046 7m2 14 野杏 果实 新疆伊犁霍城县 Wilsonomyces carpophilus G048 3m3、G048 5m2、G048 5m3、
G048 7m1、G049 7m1、G052 5m2、
G052 5m3、G053 5m1、G053 7m315 野杏 果实 新疆伊犁新源县 Wilsonomyces carpophilus G059 5m2、G068、G069、G070、
G071、G072、G073、G07416 野生樱桃李 叶片 新疆伊犁霍城县 Wilsonomyces carpophilus Y0121、Y0122、Y0123 17 野生樱桃李 果实 新疆伊犁霍城县 Wilsonomyces carpophilus G004 5m2、G004 7m2、G010 5m2 18 欧洲李 叶片 新疆伊犁霍城县 Wilsonomyces carpophilus Y0127 19 欧洲李 叶片 新疆伊犁新源县 Wilsonomyces carpophilus Y0146 20 桃 叶片 新疆伊犁新源县 Wilsonomyces carpophilus Y0145 21 苹果 枝条 新疆伊犁新源县 Botryosphaeria dothidea 2749-1 22 苹果 枝条 新疆伊犁巩留县 Cytospora parasitica 3416-1 23 榆树 枝条 新疆伊犁新源县 Nectria dematiosa 3142-2 24 榆树 枝条 新疆伊犁新源县 Nectria berberidis 3355-1-1 25 榆树 枝条 新疆伊犁新源县 Nectria nigrescens 3456-2 26 榆树 枝条 新疆伊犁新源县 Cytospora donetzica 3410-1 27 榆树 枝条 新疆伊犁新源县 Cytospora pruinopsis 3336-1 28 榆树 枝条 新疆伊犁霍城县 Cytospora ulmi 3336-2 29 腺齿蔷薇 果实 新疆伊犁巩留县 Didymella aliena XB170 30 金丝桃叶绣线菊 叶片 新疆伊犁巩留县 Phaeosphaeria avenaria GL314-1 31 金丝桃叶绣线菊 叶片 新疆伊犁霍城县 Ascochyta nigripycnidia TET305 32 金丝桃叶绣线菊 叶片 新疆伊犁霍城县 Didymella maydis GL323-1 33 金丝桃叶绣线菊 枝条 新疆伊犁巩留县 Cytospora elaeagnicola 3160-2-1 34 苦豆子 叶片 新疆伊犁新源县 Chaetomium elatum HC271-3 -
以表2中供试菌株的基因组DNA为模板,实时荧光PCR扩增总体系为20 μL,包括2 × SYBR Abstart Master Mix 10.0 μL,模板DNA 1~3 μL,10 μmol·L−1上下游引物各0.3~0.5 μL,ddH2O 补充至20.0 μL。反应程序:95 ℃ 2.5 min,94 ℃ 15 s,60 ℃ 30 s,40个循环。为建立适合嗜果刀孢菌的实时荧光检测体系,优化模板DNA浓度及引物浓度,设置模板DNA用量分别为1、2、3 μL,引物用量分别为0.3、0.4、0.5 μL进行扩增,根据熔解曲线稳定性确定最适用量。
-
将模板DNA进行10倍梯度稀释,设置5.99 × 10−5 ~5.99 × 102 ng·μL−1共8个梯度,以不同浓度的DNA为模板,利用筛选的特异性引物进行普通PCR扩增反应,根据琼脂糖凝胶电泳检测有无扩增片段,评价特异性引物W0404-14-F/W0404-14-R对不同来源嗜果刀孢菌的敏感性。
-
于2022年5月,在新疆伊犁哈萨克自治州新源县杏花沟(83°26′2.1336″~83°26′9.8124″ E,43°32′17.9952″~43°32′24.9180″ N)随机采集自然发病且具有典型病症的野杏穿孔病叶片和果实样品各2份。取100 mg新鲜病害样本,加入液氮充分研磨成粉末,然后转移至1.5 mL离心管中,使用Ezup柱式植物基因组DNA抽提试剂盒(生工生物工程(上海)股份有限公司)提取植物基因组总DNA。产物加入Loading Buffer混匀,经1%琼脂糖凝胶电泳,凝胶成像系统观察并分析扩增结果。
将菌株YA21活化培养后接种在健康的野杏苗木叶片上,接种方法同1.1,以接种无菌PDA作为空白对照,接种好的叶片表面覆盖无菌脱脂棉,每隔1 h喷施无菌水保湿,每个处理6个重复。根据前期研究结果设置接种后7、10、13、16、19、21、24和48 h共计8个时间梯度取样,样品检测同1.2。
-
结果表明:将嗜果刀孢菌通过有伤接种至19种植物叶片上,其中新疆小叶白蜡、山桃、榆叶梅、毛樱桃、野杏、山荆子、野生樱桃李、秋子梨、黄太平、野苹果、北美海棠、杜梨、垂柳、金叶榆及丝绵木共15种寄主植物叶片出现不同程度的病斑,且病斑大小呈现显著性差异(表3),黄果山楂、新疆杨、紫叶矮樱、鞑靼桑和对照组未表现任何症状。对接种发病的病组织再分离,所获菌株与接种菌株种类一致。
表 3 嗜果刀孢菌接种不同植物离体叶片5 d后所产生的病斑面积
Table 3. The area of necrotic lesions on detached leaves of different plants inoculated by Wilsonomyces carpophilus after five days
序号
Number植物种类
Plant species5 d病斑面积/mm2
Lesion size after 5 d序号
Number植物种类
Plant species5 d病斑面积/mm2
Lesion size after 5 d1 新疆小叶白蜡 F. sogdiana 28.99 ± 6.03 a 11 北美海棠 M. 'American' 4.34 ± 0.14 d 2 山桃 P. davidiana 19.82 ± 3.27 b 12 杜梨 P. betulaefolia 3.35 ± 0.95 d 3 榆叶梅 P. triloba 19.09 ± 3.50 b 13 垂柳 S. babylonica 3.29 ± 0.24 d 4 毛樱桃 P. tomentosa 13.62 ± 2.28 bc 14 金叶榆 U. pumila ' Jinye' 1.30 ± 0.37 d 5 野杏 P. armeniaca 8.53 ± 1.23 cd 15 丝绵木 E. bungeanus 1.05 ± 0.31 d 6 山荆子 M. baccata 7.86 ± 1.04 cd 16 黄果山楂 C. chlorocarpa 0 e 7 野生樱桃李 P. divaricata 7.75 ± 1.71 cd 17 新疆杨 P. alba var. pyrmidalis 0 e 8 秋子梨 P. ussuriensis 6.74 ± 0 cd 18 紫叶矮樱 P. cistena 0 e 9 黄太平 M. micromalus 6.61 ± 2.53 cd 19 鞑靼桑 M. alba var. tatarica 0 e 10 野苹果 M. sieversii 5.06 ± 1.27 d 注:图中数据为为平均数 ± 标准差。不同小写字母表示经Duncan氏新复极差法检验在P<0.01水平差异极显著
Notes: Data are mean ± SD. Different lowercase letters indicate extremely significant difference at P<0.01 level by Duncan’s new multiple range test通过对发病的叶片病斑扩展情况进行统计分析发现,嗜果刀孢菌对新疆小叶白蜡的致病力最强,接种5 d后平均病斑面积高达28.99 mm2;对山桃、榆叶梅、毛樱桃致病力较强,平均病斑面积 ≥13.62 mm2;对野杏、山荆子、野生樱桃李、秋子梨、黄太平致病力一般,平均病斑面积介于6~10 mm2;对野苹果、北美海棠、杜梨、垂柳、金叶榆、丝绵木致病力弱,平均病斑面积≤5.06 mm2。
-
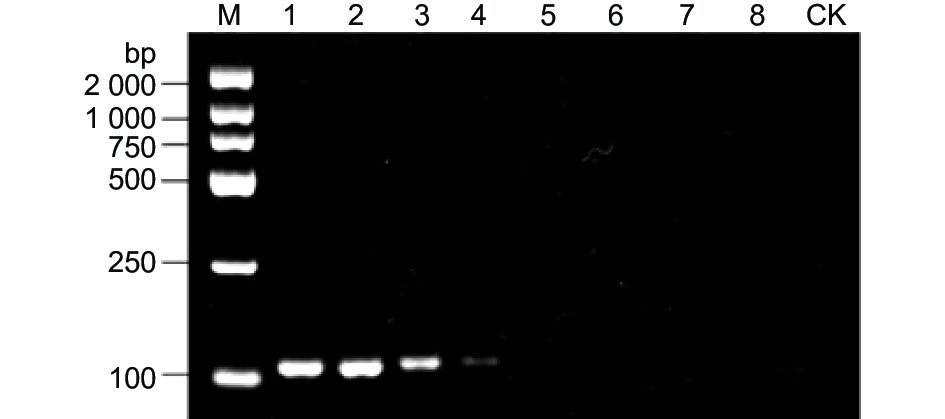
嗜果刀孢菌属(Wilsonomyces)仅包含嗜果刀孢菌1个种,将76株(表2)来源于伊犁野果林4种寄主植物发病叶片及果实上的嗜果刀孢菌和其它22种病原真菌基于特异性引物W0404-14F/W0404-14R进行普通PCR扩增。结果表明,仅76株嗜果刀孢菌能扩增出113 bp的目的片段(图1),其它22株真菌与CK均未扩增出条带。
-
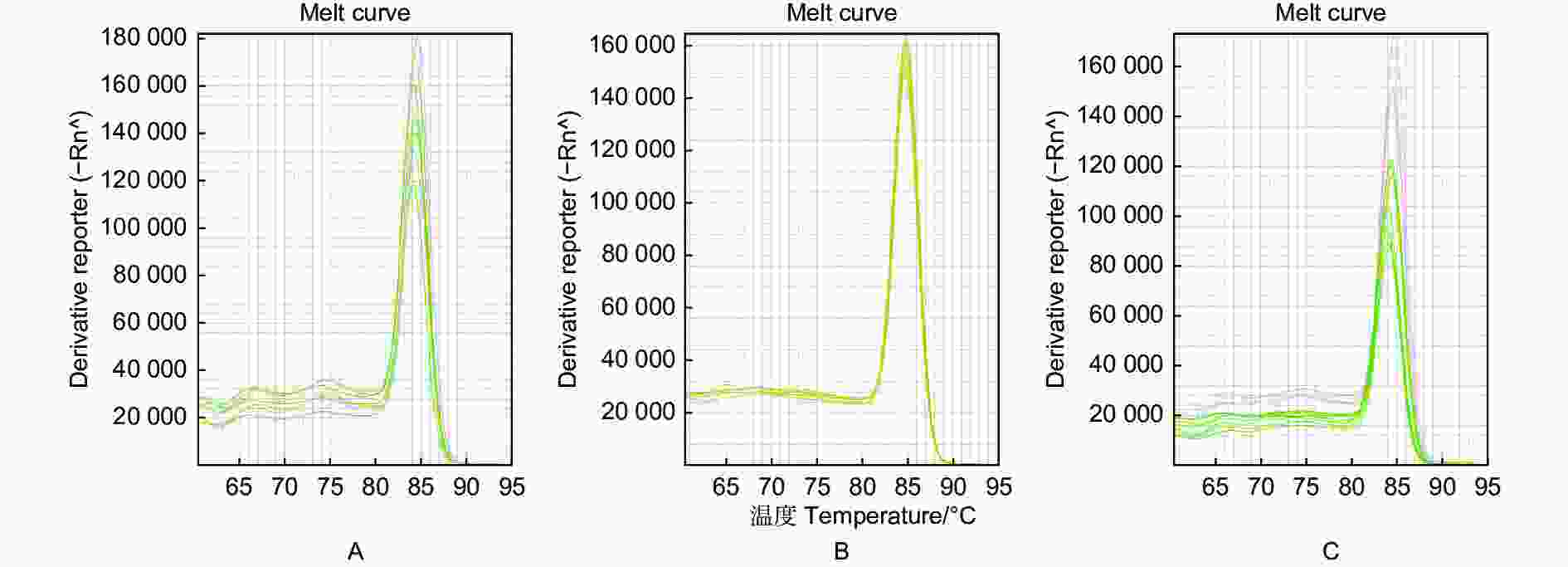
利用实时荧光PCR对嗜果刀孢菌及其它菌株进行检测,结果表明:嗜果刀孢菌YA21有扩增曲线,其它22株菌株均无扩增曲线(图2)。
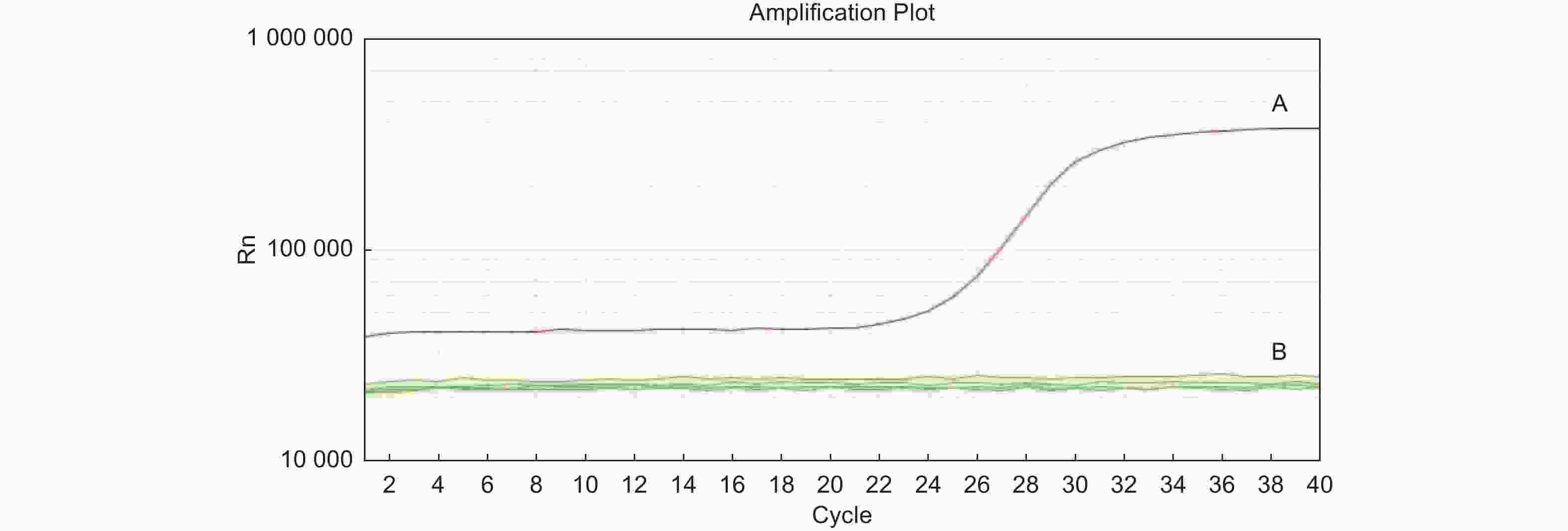
图 2 基于实时荧光PCR技术对嗜果刀孢菌特异性引物的检测结果
Figure 2. Specific primers for Wilsonomyces carpophilus based on real-time PCR
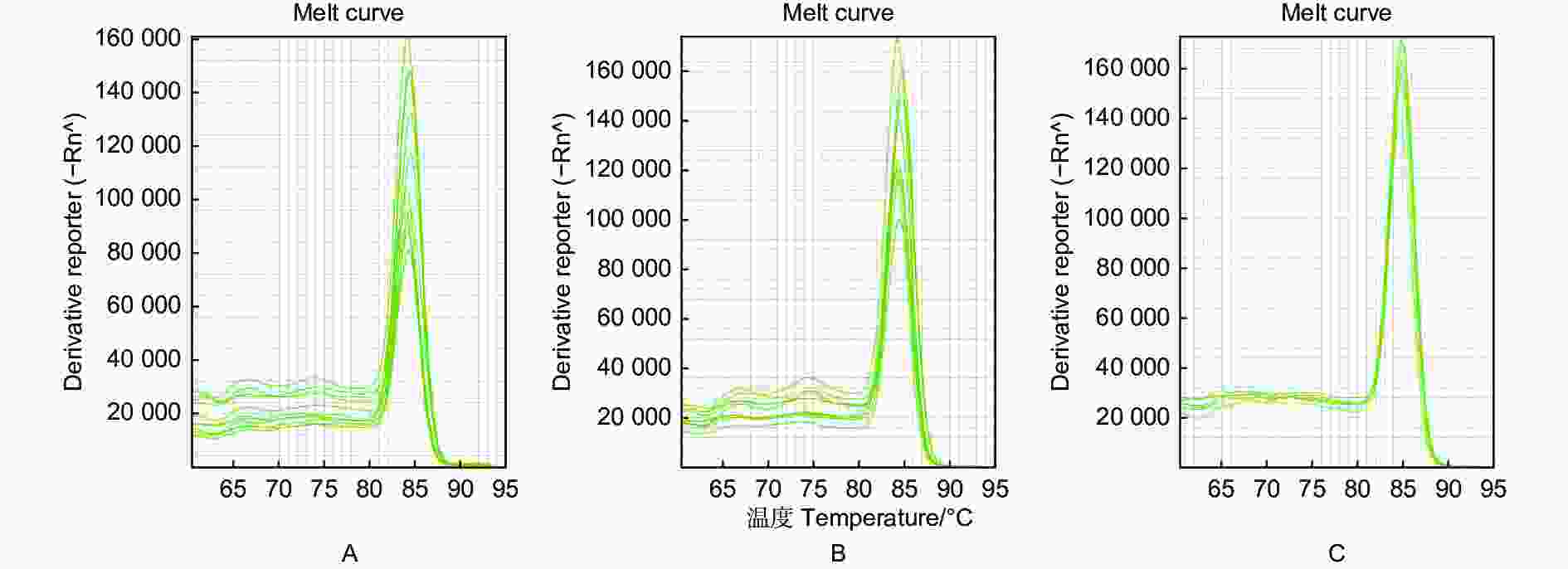
实时荧光PCR的扩增曲线在不同的引物用量和模板DNA用量不同时存在差异,筛选得出当模板DNA量为2 μL、引物量为0.5 μL时,曲线总体稳定,多条熔解曲线峰值趋近一致(图3~4)。从而,优选出最佳反应体系为:反应总体积20 μL,其中2 × SYBR Abstart Master Mix 10.0 μL,模板DNA 2.0 μL,10 μmol·L−1上下游引物各0.5 μL,ddH2O补充至20.0 μL。
-
用特异性引物W0404-14F/W0404-14R对稀释后的模板DNA进行常规PCR扩增,结果表明,随着模板DNA浓度的降低,扩增出的片段条带亮度逐渐变弱,直至浓度为5.99 × 10−2 ng·μL−1时无扩增片段出现,因此常规PCR灵敏度检测下限为5.99 × 10−1 ng·μL−1(图5)。
-
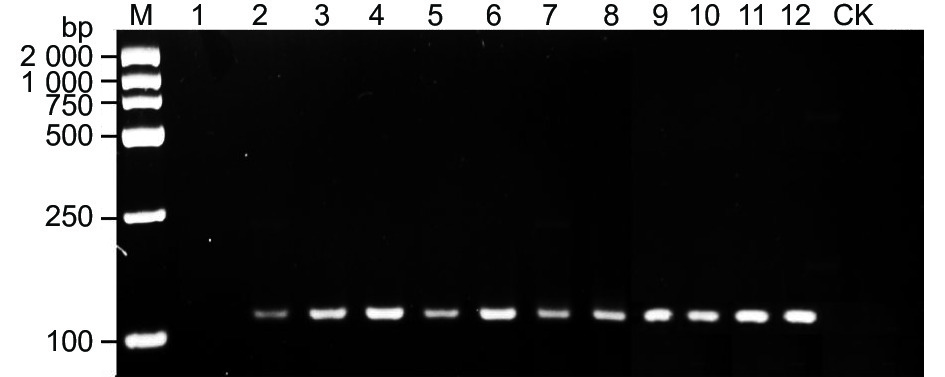
将田间采集的自然发病的野杏叶片和果实样本基于特异性引物W0404-14F/W0404-14R进行常规PCR扩增,均能够扩增出特异性条带,大小为113 bp,CK未能扩增出目标片段(图6)。人工在健康的野杏苗木叶片上接种嗜果刀孢菌10、13、16、19、21、24和48 h后的样本DNA基于特异性引物W0404-14F/W0404-14R进行常规PCR扩增,均扩增出113 bp的目标片段,接种后7 h的样本和接种空白PDA培养基的对照均未扩增出目标条带(图6)。
-
目前在伊犁地区野果林野杏上记载的穿孔病有细菌性穿孔病和真菌性穿孔病[32],然而野杏的叶片和果实在两种不同病原菌侵染后所形成的病斑相似,在田间难以根据发病症状确定病原菌类型,通过传统的柯赫氏法则开展种类鉴定耗时较长。本研究针对嗜果刀孢菌筛选出的特异性引物能够快速准确的从野杏的叶片、果实中检测出该菌,能够有效开展病害的早期诊断。与常规PCR扩增检测相比,实时荧光定量PCR技术具有更高的灵敏度,且能通过标准曲线对未知模板进行定量分析,从而进一步研究病害的发展趋势与严重程度。孙柄剑等人利用小麦纹枯病的实时荧光定量体系对人工接种的小麦进行检测,发现在接种60 d后实时荧光定量PCR检测结果与病情指数和接种量都呈显著正相关[33]。张艳菊等人构建了黄瓜棒孢叶斑病菌的实时荧光定量PCR体系,可检测黄瓜叶片在接种棒孢叶斑病菌后叶片中的病菌动态变化,从而了解发病情况[34]。本研究中根据嗜果刀孢菌的tef1基因序列设计特异性引物,建立了嗜果刀孢菌常规PCR与实时荧光PCR检测技术,灵敏度高且特异性强,常规PCR最低可检测出样本中DNA浓度5.99 × 10−1 ng·μL−1的嗜果刀孢菌,但实时荧光定量PCR技术研究尚有不足,仅能对未知样本内病原菌的有无及类型进行检测,后续将建立标准曲线用于嗜果刀孢菌的定量分析,为该病害的侵染程度监测提供理论依据。
实时荧光定量PCR技术是在常规PCR反应体系的基础上加入荧光染料或荧光标记探针,通过荧光信号的累积实现对PCR过程的实时监测。本研究首次尝试从发病植株中检测嗜果刀孢菌,建立了利用SYBR Green染料法检测嗜果刀孢菌的快速检测体系。TaqMan探针法特异性高且减少了背景荧光和假阳性,但针对不同的靶序列需设计合成不同的探针,成本花费高。SYBR Green染料法可对任何DNA双链进行定量分析,相对探针法操作难度及成本更低,适合大批量样本分析[35]。本研究中建立的常规PCR和实时荧光PCR检测体系适用于发病样本及分离纯化后的嗜果刀孢菌的检测,且具有成本低廉,检测速度快等优点,在生产实践中可用于病害诊断、苗木的调运检疫检验等。
嗜果刀孢菌可侵染蔷薇科、壳斗科等多种植物,在我国多为害桃、杏等植物引发穿孔病,但有关其寄主范围测定的相关报道较少,可侵染寄主的植物种类尚不明确。本研究通过离体叶片接种测定发现嗜果刀孢菌能够侵染野苹果、黄太平、山荆子、野杏、野生樱桃李、北美海棠、榆叶梅、山桃、毛樱桃、秋子梨、杜梨、垂柳、金叶榆、丝绵木和新疆小叶白蜡15种植物,其中嗜果刀孢菌在新疆小叶白蜡和山桃上形成的病斑面积较大,而新疆小叶白蜡是新疆各地广泛栽植的绿化树种,潜在的致病风险较大。新疆杨和黄果山楂在接种嗜果刀孢菌后未发病,这两种树种也是常见的绿化树种之一,在园林绿化植物配置时可与其它感病植物搭配,也许将有利于避免或减轻嗜果刀孢菌的发生与流行。本研究采用人工刺伤离体接种的方法对嗜果刀孢菌菌丝的致病性和寄主范围进行测定,在48 h左右能观察到刺伤处有明显病斑。本研究在PCR检测特异性引物试验中,在野杏活体苗木健康叶片上有伤接种嗜果刀孢菌48 h后叶片发病,离体叶片和健康苗木叶片在刺伤接种嗜果刀孢菌后均在48 h左右发病,接种结果一致。不同的接种方法和接种体对嗜果刀孢菌侵染待测寄主的结果可能会产生影响,本研究仅探讨了以菌饼作为接种体通过有伤接种待测寄主的结果,采用孢子悬浮液接种的方法测定嗜果刀孢菌的寄主范围有待进一步研究。值得注意的是此结果仅为室内接种测定研究,而病害的发生在田间会受到多种因素的影响,因此本研究寄主范围测定结果仅作为参考,为嗜果刀孢菌的寄主范围研究提供基础理论数据。
-
本研究初步测定了嗜果刀孢菌对乌鲁木齐常见绿化树种的致病性,表明该菌对新疆主要林木具有较大的致病风险。本研究首次针对嗜果刀孢菌设计并筛选出1对特异性强、灵敏度高的引物,能够在自然发病样本及室内接种样本中成功检测出嗜果刀孢菌,为嗜果刀孢菌引起的穿孔病的科学诊断和快速检测提供了科学依据。
嗜果刀孢菌寄主范围的测定及PCR快速检测
Host Determination of The Wilsonomyces Carpophilus of Wild Apricot Forest of Tianshan and Establishment of a Rapid Detection System
-
摘要:
目的 探讨嗜果刀孢菌对新疆其他主要树种的潜在危害,提高该病害的诊断和检测效率。 方法 本文将嗜果刀孢菌通过离体叶片接种至6科19种植物的健康叶片上,初步测定其致病性和寄主范围;参考tef1序列设计了嗜果刀孢菌的特异性引物;通过常规PCR和实时荧光PCR对76株嗜果刀孢菌和22株其它真菌进行特异性和灵敏度检测,并优化实时荧光PCR的反应体系;另外,应用所设计的特异性引物对田间自然发病样本和人工接种7、10、13、16、19、21、24、48 h后的野杏叶片样品进行常规PCR检测。 结果 15种植物叶片在接种嗜果刀孢菌5 d后出现明显病斑,不同寄主的病斑大小存在极显著性差异(P<0.01),其中新疆小叶白蜡的病斑面积最大,达28.99 mm2,而紫叶矮樱、黄果山楂、新疆杨、鞑靼桑等4种植物叶片未发病。本研究设计的特异性引物W0404-14-F/W0404-14-R扩增出的特异性条带为113 bp,对照及其它真菌无扩增条带。常规PCR检测的灵敏度为5.99 × 10−1 ng·μL−1。在野杏叶片接种10 h后通过常规PCR可在叶片内检测到嗜果刀孢菌。 结论 嗜果刀孢菌可为害15种其他树种,具有潜在危害性;PCR快速检测方法检测嗜果刀孢菌速度快、特异性强,本研究首次探索了嗜果刀孢菌潜在寄主范围及PCR快速检测方法,为由嗜果刀孢菌引起的穿孔病的诊断及检测提供了理论依据。 Abstract:Objective To explore the potential hazard of W. carpophilus on other major tree species in Xinjiang, and to improve the diagnosis and detection efficiency of this disease, Method in this paper, W. carpophilus was inoculated into healthy leaves of 19 plants in six families by ex vivo leaf inoculation, and its pathogenicity and host range were preliminarily determined; Specific primers for W. carpophilus were designed with reference to the tef1 sequence; 76 strains of W. carpophilus and 22 other fungi were specifically and sensitively detected by conventional PCR and real-time PCR, and the reaction system of real-time PCR was optimized; In addition, the designed specific primers were used to perform conventional PCR on natural onset samples in the field. Samples and wild apricot leaf samples 7, 10, 13, 16, 19, 21, 24 and 48 h after artificial inoculation were used for routine PCR detection. Result The leaves of 15 plants inoculated showed obvious lesions after 5 d of inoculation, with extremely significant differences (P<0.01) in lesion size between different hosts, with the largest lesion size of up to 28.99 mm2 in Xinjiang leaflet white wax, and only four plants, namely, Prunus. cistena, Crataegus chlorocarpa, Populus alba var. pyrmidalis, Morus alba var. tatarica, were not involved. The specific primers W0404-14-F/ W0404-14-R designed in this study were able to amplify a specific band at 113 bp for W. carpophilus but not for other fungi. The sensitivity of the conventional PCR assay was 5.99 × 10−1 ng·μL−1. W. carpophilus could be detected within the leaves 10 h after inoculation of Wild Apricot Leaves by conventional PCR. Conclusion W. carpophilus can harm 15 other tree species and is potentially harmful; PCR assay is rapid and specific for the detection of W. carpophilus. This study is the first time to explore the potential host range of W. carpophilus and a rapid PCR assay for the diagnosis and detection of porokeratosis caused by W. carpophilus. -
Key words:
- Shot-hole disease
- / Wilsonomyces carpophilus
- / Host range determination
- / Real-time PCR
- / Specific primer
- / Sensitivity
-
表 1 待测寄主植物列表
Table 1. List of plants used in the host range study of Wilsonomyces carpophilus
序号
Number科
Family植物种类
Plant species1 蔷薇科Rosaceae 野苹果Malus sieversii、黄太平Malus micromalus、山荆子Malus baccata 北美海棠Malus 'American'、野杏Prunus armeniaca、山桃Prunus davidiana 野生樱桃李Prunus divaricata、榆叶梅Prunus triloba、毛樱桃Prunus tomentosa、紫叶矮樱Prunus cistena、秋子梨Pyrus ussuriensis、杜梨Pyrus betulaefolia、黄果山楂Crataegus chlorocarpa 2 杨柳科Salicaceae 新疆杨Populus alba var.pyrmidalis、垂柳Salix babylonica 3 榆科Ulmaceae 金叶榆Ulmus pumila 'Jinye' 4 卫矛科Celastraceae 丝绵木Euonymus bungeanus 5 木犀科Oleaceae 新疆小叶白蜡Fraxinus sogdiana 6 桑科Moraceae 鞑靼桑Morus alba var. tatarica 表 2 供试菌株及来源
Table 2. The species and sources of strains in this study
序号
Number寄主
Host危害部位
Hazardous site采集地点
Collection site菌株种类
The species of strains菌株编号
Strain No1 野杏 芽 新疆伊犁霍城县 Corynascus sepedonium YA38 2 野杏 芽 新疆伊犁霍城县 Aureobasidium pullulans YA48 3 野杏 芽 新疆伊犁霍城县 Didymella glomerata YA99 4 野杏 芽 新疆伊犁新源县 Wilsonomyces carpophilus YA5、YA7、YA21、YA23、YA31 5 野杏 叶片 新疆伊犁霍城县 Didymella heteroderae HC1-W-3m3 6 野杏 叶片 新疆伊犁霍城县 Wilsonomyces carpophilus Y035 5m1、Y048 5m2、Y049 7m1、
Y052 7m1、Y0124、Y0125、Y0126、
Y0128、HC-Y-17 野杏 叶片 新疆伊犁巩留县 Metarhizium robertsii DMH-1-5m1 8 野杏 叶片 新疆伊犁巩留县 Chaetomium bostrychodes 19-30s 9 野杏 叶片 新疆伊犁巩留县 Wilsonomyces carpophilus Y057 7m3、Y093、Y094、Y095、Y096、Y097、Y098、Y099、Y0100、Y0101、Y0102、Y0103、Y0104、Y0105、Y0106、Y0148、Y0152、Y0154、Y0155 10 野杏 叶片 新疆伊犁新源县 Monilinia laxa XHG-1-3m2 11 野杏 叶片 新疆伊犁新源县 Alternaria infectoria ZWY2-W-3m3 12 野杏 叶片 新疆伊犁新源县 Wilsonomyces carpophilus Y037 7m2、Y038 7m2、Y039 3m3、
Y040 7m2、Y068、Y069、Y070、Y071、Y072、Y073、Y074、Y075、Y0144、Y014713 野杏 叶片 新疆伊犁伊宁县 Wilsonomyces carpophilus Y043 7m1、Y045 5m2-2、Y046 7m2 14 野杏 果实 新疆伊犁霍城县 Wilsonomyces carpophilus G048 3m3、G048 5m2、G048 5m3、
G048 7m1、G049 7m1、G052 5m2、
G052 5m3、G053 5m1、G053 7m315 野杏 果实 新疆伊犁新源县 Wilsonomyces carpophilus G059 5m2、G068、G069、G070、
G071、G072、G073、G07416 野生樱桃李 叶片 新疆伊犁霍城县 Wilsonomyces carpophilus Y0121、Y0122、Y0123 17 野生樱桃李 果实 新疆伊犁霍城县 Wilsonomyces carpophilus G004 5m2、G004 7m2、G010 5m2 18 欧洲李 叶片 新疆伊犁霍城县 Wilsonomyces carpophilus Y0127 19 欧洲李 叶片 新疆伊犁新源县 Wilsonomyces carpophilus Y0146 20 桃 叶片 新疆伊犁新源县 Wilsonomyces carpophilus Y0145 21 苹果 枝条 新疆伊犁新源县 Botryosphaeria dothidea 2749-1 22 苹果 枝条 新疆伊犁巩留县 Cytospora parasitica 3416-1 23 榆树 枝条 新疆伊犁新源县 Nectria dematiosa 3142-2 24 榆树 枝条 新疆伊犁新源县 Nectria berberidis 3355-1-1 25 榆树 枝条 新疆伊犁新源县 Nectria nigrescens 3456-2 26 榆树 枝条 新疆伊犁新源县 Cytospora donetzica 3410-1 27 榆树 枝条 新疆伊犁新源县 Cytospora pruinopsis 3336-1 28 榆树 枝条 新疆伊犁霍城县 Cytospora ulmi 3336-2 29 腺齿蔷薇 果实 新疆伊犁巩留县 Didymella aliena XB170 30 金丝桃叶绣线菊 叶片 新疆伊犁巩留县 Phaeosphaeria avenaria GL314-1 31 金丝桃叶绣线菊 叶片 新疆伊犁霍城县 Ascochyta nigripycnidia TET305 32 金丝桃叶绣线菊 叶片 新疆伊犁霍城县 Didymella maydis GL323-1 33 金丝桃叶绣线菊 枝条 新疆伊犁巩留县 Cytospora elaeagnicola 3160-2-1 34 苦豆子 叶片 新疆伊犁新源县 Chaetomium elatum HC271-3 表 3 嗜果刀孢菌接种不同植物离体叶片5 d后所产生的病斑面积
Table 3. The area of necrotic lesions on detached leaves of different plants inoculated by Wilsonomyces carpophilus after five days
序号
Number植物种类
Plant species5 d病斑面积/mm2
Lesion size after 5 d序号
Number植物种类
Plant species5 d病斑面积/mm2
Lesion size after 5 d1 新疆小叶白蜡 F. sogdiana 28.99 ± 6.03 a 11 北美海棠 M. 'American' 4.34 ± 0.14 d 2 山桃 P. davidiana 19.82 ± 3.27 b 12 杜梨 P. betulaefolia 3.35 ± 0.95 d 3 榆叶梅 P. triloba 19.09 ± 3.50 b 13 垂柳 S. babylonica 3.29 ± 0.24 d 4 毛樱桃 P. tomentosa 13.62 ± 2.28 bc 14 金叶榆 U. pumila ' Jinye' 1.30 ± 0.37 d 5 野杏 P. armeniaca 8.53 ± 1.23 cd 15 丝绵木 E. bungeanus 1.05 ± 0.31 d 6 山荆子 M. baccata 7.86 ± 1.04 cd 16 黄果山楂 C. chlorocarpa 0 e 7 野生樱桃李 P. divaricata 7.75 ± 1.71 cd 17 新疆杨 P. alba var. pyrmidalis 0 e 8 秋子梨 P. ussuriensis 6.74 ± 0 cd 18 紫叶矮樱 P. cistena 0 e 9 黄太平 M. micromalus 6.61 ± 2.53 cd 19 鞑靼桑 M. alba var. tatarica 0 e 10 野苹果 M. sieversii 5.06 ± 1.27 d 注:图中数据为为平均数 ± 标准差。不同小写字母表示经Duncan氏新复极差法检验在P<0.01水平差异极显著
Notes: Data are mean ± SD. Different lowercase letters indicate extremely significant difference at P<0.01 level by Duncan’s new multiple range test -
[1] 林培钧. 天山伊犁野果林在人类生态和果树起源上的地位[J]. 农业考古, 1993(1):133-137+146+271. [2] MARIN-FELIX Y, GROENEWALD J Z, CAI L, et al. Genera of phytopathogenic fungi: GOPHY 1[J]. Studies in Mycology, 2017, 86: 99-216. doi: 10.1016/j.simyco.2017.04.002 [3] PHILLIPS A J, ALVES A, PENNYCOOK S R, et al. Resolving the phylogenetic and taxonomic status of dark-spored teleomorph genera in the Botryosphaeriaceae[J]. Persoonia, 2008, 21(6): 29-55. [4] NABI A, SHAH M-U-D, PADDER B A, et al. Morpho-cultural, pathological and molecular variability in Thyrostroma carpophilum, causing shot hole of stone fruits in India[J]. European Journal of Plant Pathology, 2017, 151(3): 613-627. [5] 王吉奎, 王 勇, 冯启收, 等. 杏果实斑点病的发生与防治[J]. 山西果树, 1995(4):27-28. [6] WILSON E E. Coryneum blight of stone fruits[M]. Yearbook of Agriculture. Washington D C: United States Department of Agriculture, 1953: 705-710.3 [7] AHMADPOUR A, GHOSTA Y, JAVAN-NIKKHAH M, et al. Isolation and pathogenicity tests of Iranian cultures of the shot hole pathogen of Prunus species, Wilsonomyces carpophilus[J]. Australasian Plant Disease Notes, 2009, 4(1): 133-134. [8] 何苏琴, 白 滨, 文朝慧, 等. 甘肃省桃果实褐斑病病原鉴定[J]. 植物保护, 2016, 42(5):53-57. doi: 10.3969/j.issn.0529-1542.2016.05.008 [9] 程 元, 淮稳霞, 姚艳霞, 等. 新疆巩留县杏果实斑点病病原菌鉴定[J]. 林业科学研究, 2019, 32(2):117-122. doi: 10.13275/j.cnki.lykxyj.2019.02.017 [10] YE S H, JIA H Y, CAI G F, TIAN C M AND MA R. Morphology, DNA phylogeny and pathogenicity of Wilsonomyces carpophilus isolate causing shot-hole disease of Prunus divaricata and Prunus armeniaca in Wild-Fruit Forest of Western Tianshan Mountains, China[J]. Forests, 2020, 11(3): 319. doi: 10.3390/f11030319 [11] 戴芳澜. 中国真菌总汇[M]. 北京: 科学出版社, 1979: 914-934. [12] ZHUANG W Y. Fungi of northwestern China[M]. Ithaca: Mycotaxon, Ltd. , 2005: 158. [13] VENTURELLA G. A check-list of Sicilian fungi[J]. Bocconea, 1991(2): 165-166. [14] BRAUN U. Miscellaneous notes on some micromycetes[J]. Schlechtendalia, 2000, 5: 31-56. [15] GADGIL P. D. Fungi on Trees and Shrubs in New Zealand[J]. Fungi of New Zealand, 2005, 4: 437. [16] SHAMSI M M, AKBARINIA M, MIRABOLFATHY M, et al . Dieback and decline of wild almond (Amygdalus scoparia Spach) in the Harat protected forest of Yazd Province, Iran[J]. Forest Pathology, 2019(2): e12538. [17] 古丽巴衣那. 乌鲁木齐市园林树种初步调查[J]. 安徽农业科学, 2008(22):9500-9501. doi: 10.3969/j.issn.0517-6611.2008.22.065 [18] 朱建兰, 常永义, 陈德荣, 等. 杏果实斑点病菌生物学性状的研究[J]. 甘肃农业大学学报, 1990(2):165-169. [19] 赵军营, 常永义, 朱建兰. 杏树受嗜果刀孢菌侵染后叶片内苯丙氨酸解氨酶活性的变化[J]. 果树科学, 2000(4):277-281. [20] 朱建兰, 常永义, 陈德蓉, 等. 杏果实斑点病研究[J]. 甘肃农业科技, 1995(9):38-40. [21] 赵军营, 常永义, 程 弘. 杏不同品种叶片抗嗜果刀孢菌生化特性的初步研究[J]. 甘肃农业科技, 2000(10):35-37. [22] 王晓杰, 康振生, 黄丽丽. PCR技术在植物病害检测中的应用[J]. 云南农业大学学报, 2005(2):179-182. [23] 孙 倩, 张 玮, 燕继晔, 等. 草莓根腐病的Dactylonectria病原菌鉴定[J]. 植物病理学报, 2022, 52(2):276-280. [24] 郑亚明, 骆 勇, 周益林, 等. 实时荧光定量PCR在植物病害流行学中的应用[J]. 植物保护, 2011, 37(4):18-22. doi: 10.3969/j.issn.0529-1542.2011.04.004 [25] 王 瑜, 马建忠, 张伟杰, 等. 腐皮镰刀菌SYBR Green实时荧光定量PCR快速检测方法的建立[J]. 微生物学免疫学展, 2018, 46(2):34-39. [26] 谢学文, 陈利达, 曹金强, 等. 茄匍柄霉菌实时荧光定量PCR检测方法的建立及应用[J]. 植物病理学报, 2021, 51(4):618-625. [27] 段维军, 段丽君, 吕 燕, 等. 向日葵黑茎病菌TaqMan-MGB探针实时荧光快速检测方法[J]. 植物病理学报, 2021, 51(6):975-986. doi: 10.13926/j.cnki.apps.000734 [28] 任海英, 戚行江, 梁森苗, 等. 利用常规PCR和实时荧光定量PCR检测杨梅凋萎病菌[J]. 植物病理学报, 2016, 46(1):1-10. doi: 10.13926/j.cnki.apps.2016.01.001 [29] 杨 迪, 郑雪玲, 黎 鹏, 等. 女贞褐斑病病原菌的生物学特性及寄主范围测定[J]. 南方农业学报, 2021, 52(9):2482-2488. [30] 彭 坤, 王士良, 刘 富, 等. 烟草赤星病病原菌生物学特性及致病性研究[J]. 现代农业科技, 2021(2):78-80. [31] 王关林, 方宏筠. 植物基因工程[M]. 北京: 科学出版社, 2002: 744- 746 [32] 徐方媛, 魏佳乐, 汪晓艺, 等. 新疆野杏细菌性穿孔病发生的影响因素研究[J]. 新疆农业大学学报, 2021, 44(4):300-306. doi: 10.3969/j.issn.1007-8614.2021.04.010 [33] 孙炳剑, 陈清清, 袁虹霞, 等. SYBR Green I实时荧光定量PCR检测小麦纹枯病菌体系的建立和应用[J]. 中国农业科学, 2015, 48(1):55-62. [34] 张艳菊, 刘齐月, 张 笛, 等. 黄瓜棒孢叶斑病菌实时荧光定量PCR方法的建立与应用[J]. 东北农业大学学报, 2020, 51(3):8-17. doi: 10.3969/j.issn.1005-9369.2020.03.002 [35] 衡 静, 梁芳芳, 于晓莹. 实时荧光定量PCR技术及其在植物中的应用[J]. 河南农业, 2013(16):55-56. -





 下载:
下载: