-
随着木材需求的日益增加、生态文明建设推进及国际木材保护性贸易政策实施力度的不断加强,木材供应与需求间矛盾日趋严峻,可持续经营已成为我国林业发展的重要要求[1-2]。尾巨桉(Eucalyptus urophylla × E. grandis),是尾叶桉(Eucalyptus urophylla S. T. Blake)与巨桉(Eucalyptus grandis W. Mill ex Maiden)的杂交种,融合了亲本速生丰产、树干通直等特点,还具有适应性好、抗逆性强、病虫害少等优点,在我国南方已广泛作为纸浆、造纸、纤维板等生产原材料[3]。良种尾巨桉的大面积种植,可以降低本土木材在市场供应上的压力,减少我国对进口木材的依赖性,对我国森林资源的培育、木材供应的安全均具有保障作用[4]。
我国桉树新品种的开发主要采用“有性改良,无性利用”的模式,即在获得优异的有性改良个体后,通过组织培养来扩繁、利用。组织培养(组培)具有诸多优点,但作为决定其成败的分化、增殖及生根等过程均受多种因素影响,由各种因素导致的无法分化出根或生根质量差等,直接影响后续移栽存活率[5-7]。植物生根过程中细胞需经历脱分化、再分化等阶段,部分植物由于细胞内信号传递限制,相关转录因子基因表达受阻,次生代谢物质抑制等问题导致生根率低、生根质量差、移栽难以成活等问题[8]。因此,提升组培苗生根率,提高不定根质量在植株无性繁殖方面具有十分重要的意义。目前对尾巨桉生根已有较多研究,主要是通过改变外源生长调节剂来促进其脱分化与再分化,常用到的生长调节剂有吲哚乙酸(IBA)、萘乙酸(NAA)及ABT1。研究表明:DH32-26、DH32-28、DH32-29等尾巨桉的最适生根培养基中添加的生长素以IBA与ABT1为主,当IBA的浓度在0.2~0.3 mg·L−1,ABT1浓度为0.3~1.5 mg·L−1时,诱导获得的最佳生根率均在95%以上[9-11]。以IBA及NAA为主的常规生长调节剂诱导生根研究中,当IBA与NAA的浓度分别为1 mg·L−1与 0.2 mg·L−1时生根率最高可达82.5% [12],然而,尽管许多研究中试验材料及生长调节剂种类相同,最佳配方的浓度及成分却不尽相同。此外,ABT1生根粉作为复合配方,目前仅清楚NAA含量20%,IBA含量30%,其余成分未知,难以定量分析各成分对生根影响。
植物难以生根应主要受自身基因与代谢物影响,不同浓度的生长调节剂及培养基也会对其造成不同程度的影响。以几种表型较优但生根能力不同的尾巨桉无性系为材料,通过研究不同生长调节剂种类、浓度、无性系、培养基类型对4个尾巨桉无性系组培苗生根的影响程度,判断这几个因素对其不同生根阶段的影响大小,分析其中的主效因子,为难生根木本植物的根系发育调控研究提供理论和实践参考。
-
试验的尾巨桉无性系均由中国林科院速生树木所遗传育种团队自主研发,为对5年生杂交子代测定林中长势优良的个体环割、组培而成。取来自同一杂交组合的4个无性系(EC262、EC264、EC269和EC272)继代增殖瓶苗,进行不同培养基、生长调节剂处理,以研究其生根差异。
-
选取生长调节剂种类、浓度、培养基及无性系为4个因素,设计4因素4水平正交试验(表1)。预实验中IBA与NAA浓度超过5 mg·L−1时4个无性系均无法生根,故设浓度范围1~4 mg·L−1。其中试验组合中的A、B、C、D分别代表培养基类型、IBA浓度、NAA浓度、无性系4个因素,1、2、3、4代表各因素不同处理水平。
表 1 正交试验设计的因素与水平
Table 1. Factors and levels for orthogonal design
处理
Treatment试验组合
Experiment combined培养基类型
Medium type激素浓度
Hormone concentration/(mg·L−1)无性系
cloneIBA NAA T1 A1B1C1D1 1/2MS 1 1 EC262 T2 A1B2C2D2 1/2MS 2 2 EC264 T3 A1B3C3D3 1/2MS 3 3 EC269 T4 A1B4C4D4 1/2MS 4 4 EC272 T5 A2B1C2D3 大量元素 1 2 EC269 T6 A2B2C1D4 大量元素 2 1 EC272 T7 A2B3C4D1 大量元素 3 4 EC262 T8 A2B4C3D2 大量元素 4 3 EC264 T9 A3B1C3D4 N6 1 3 EC272 T10 A3B2C4D3 N6 2 4 EC269 T11 A3B3C1D2 N6 3 1 EC264 T12 A3B4C2D1 N6 4 2 EC262 T13 A4B1C4D2 WPM 1 4 EC264 T14 A4B2C3D1 WPM 2 3 EC262 T15 A4B3C2D4 WPM 3 2 EC272 T16 A4B4C1D3 WPM 4 1 EC269 -
选取1/2 MS培养基、大量元素培养基、WPM、N6培养基为基础培养基,大量元素培养基配方参照王楚彪[13]提出的根诱导最适配方。培养基中添加15 g·L−1蔗糖、0.5 mg·L−1的半胱氨酸及7 g·L−1的卡拉胶,pH值为5.8,121 ℃、20 min高压灭菌后取出加滤膜过滤后的植物生长调节剂。
-
选取继代培养20~25 d,高度在4 ± 0.5 cm,生长健壮的丛生苗,剪取2 cm以上带顶芽部分进行生根诱导试验[14]。暗培养7 d后转光照培养,培养环境为光照强度为2 000~2 500 lx,光照时长12 h,温度28 ℃,湿度80%~90%。
-
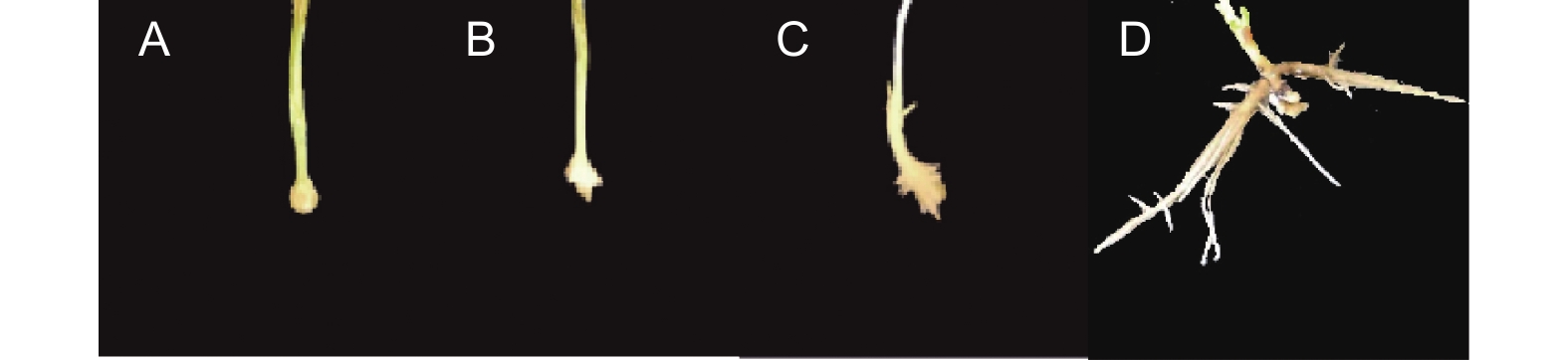
每周对植物的生长情况进行一次检测,以评估根系的生长状态。培育30 d后,参考张沛建[15]的分析方法,统计各个试验组生根情况,以生根率、平均根长、最长根长与根数等作为评价标准。生根性状评分参考王艺[16]等方法评估,基部只有一级根及二级根,根系生长局限明显的(图1A),评定为1分;基部一级根数少于3,存在二级及以上根的(图1B),评定为2分;基部一级根数大于3,有二级根及以上根,根系发育较好的(图1C),评定为3分;基部根系发育较为完善,存在三级以上侧根,扎入培养基基质较为扎实的(图1D),评定为4分。公式计算获得最终分数,
$ X=\frac{N 1+N 2 \times 2+N 3 \times 3+N 4 \times 4}{(N 1+N 2+N 3+N 4) \times 4} \times 100 {\text{%}} $
(1) 其中:N1、N2、N3、N4均为相应评分的苗数。
-
利用Microsoft Excel 2016对获得的不同试验数据进行汇总,并利用SPSS 21.0进行方差分析,进行多重对比研究(Duncan法)[17]。
-
4个尾巨桉无性系组培苗均属于综合生根类型,总生根数为158株,其中皮质生根数为114(72.2%),愈伤生根数为44(27.8%)。大量元素培养基中皮质生根植株比例最高,达到86%,相对而言,皮质生根的幼苗叶片及植株生长更健壮(图1C),而愈伤生根的根系通常侧根发育更加健全,根系的扩展能力强,与培养基基质结合更加紧密,但与茎段的连接性较差,叶片及植株生长受限(图1D)。
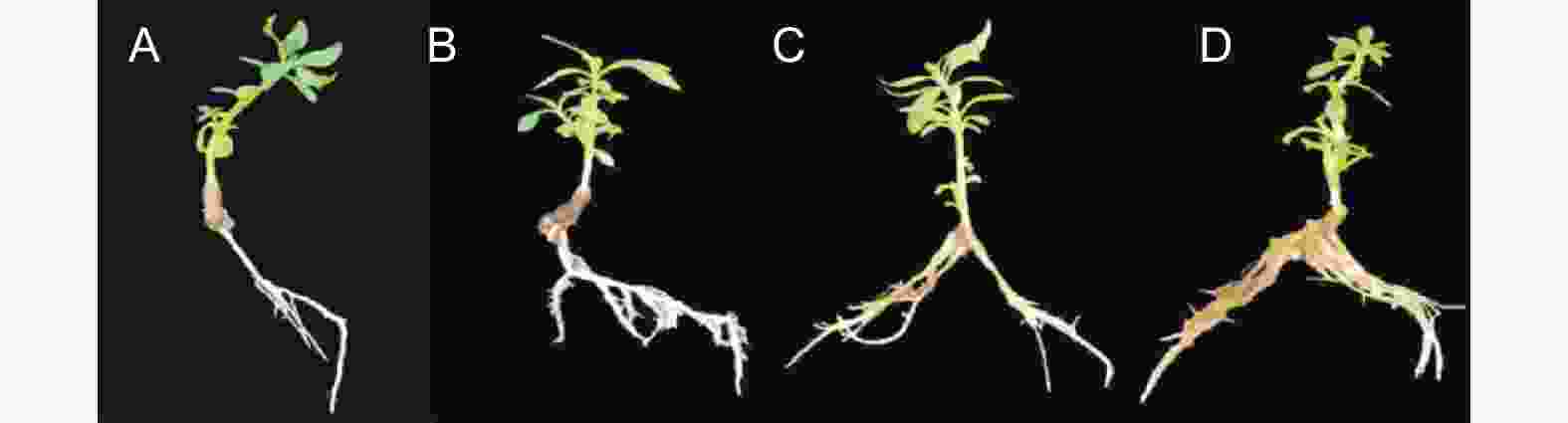
尾巨桉无性系生根大致分为4个阶段:(1)0~7 d,茎末端出现小型愈伤团(图2A);(2)7~10 d,愈伤组织陆续出现小根点(图2B );(3)10~15 d,小根点不断膨大且数量不断增加(图2C);(4)15~30 d ,不定根长度快速抽长,出现二级及以上侧根(图2D);(5)30 d以上,不定根数量趋于稳定,根长持续伸长,侧根持续生长 。
愈伤生根过程的主要差异体现于7~15 d,愈伤组织不出现小根点,而是持续膨大约3~5倍,形成愈伤球。在此阶段,从愈伤球中抽出根的组培苗最终会形成愈伤生根,剩余停留在愈伤阶段的植株则会缓慢至停止生长。
-
4个尾巨桉无性系的根系发育情况如下表(表2),不同处理组合对无性系的生根情况影响不同,方差分析结果表明:植物生长调节剂种类和浓度、培养基类型及无性系均对植株生根的效果均具有极显著影响。4个无性系在不同处理下均可生根,生根率在7.5%~55%之间,其中,T2及T6的生根率显著高于其它处理,其根数也同样高于大部分处理,然而根长与生根性状却与这两种生根情况的关联性不大。各处理下4个尾巨桉的平均根数介于1~3.27之间,平均根长在1.95~5.02 cm之间,最长根长在2.17~7.03 cm之间, 生根性状评分介于27.78%~75.75%之间。
表 2 各因素对尾巨桉生根的影响
Table 2. Effects of different treatments on rooting of E. urophylla × E.grandis
试验组合
Experiment
combined培养基类型
Medium
type激素浓度
Hormone
concentration/
(mg·L−1)无性系
clone生根率
rooting
rate/%平均根数
Average number
of rooting平均根长
Mean root
length/cm最长根长
Longest root
length/cm生根性状评分率
Root effective
traits score/%IBA NAA T1 A1B1C1D1 1/2MS 1 1 EC262 40.0 ± 8.16Bb 3.00 ± 1.50ABa 2.90 ± 0.99BCDbcd 3.60 ± 0.74CDEFcde 57.81 ± 1.56CDde T2 A1B2C2D2 1/2MS 2 2 EC264 55.0 ± 5.77Aa 2.90 ± 1.57ABa 3.11 ± 0.9BCDbcd 3.23 ± 0.74CDEbcd 60.23 ± 1.14CDcd T3 A1B3C3D3 1/2MS 3 3 EC269 7.5 ± 5.00Ed 1.30 ± 0.57Dd 1.95 ± 0.39Dd 2.18 ± 0.04Fef 27.78 ± 4.81Eh T4 A1B4C4D4 1/2MS 4 4 EC272 20.0 ± 8.16CDEcd 2.00 ± 1.07BCDbc 2.96 ± 0.96BCDbcd 3.55 ± 0.89CDEFcde 52.08 ± 1.80DEe T5 A2B1C2D3 大量元素 1 2 EC269 27.5 ± 5.00BCDbc 2.55 ± 1.13BCb 3.92 ± 1.23BCab 5.47 ± 0.62BCbc 69.70 ± 5.25ABab T6 A2B2C1D4 大量元素 2 1 EC272 55.0 ± 12.90Aa 3.27 ± 1.67Aa 3.96 ± 1.48BCab 5.05 ± 1.15ABCab 65.53 ± 0.66BCabc T7 A2B3C4D1 大量元素 3 4 EC262 30.0 ± 8.16BCbc 2.67 ± 1.43Bb 5.02 ± 1.67Aa 6.62 ± 1.35ABa 75.00 ± 2.08Aa T8 A2B4C3D2 大量元素 4 3 EC264 10.0 ± 8.16Ed 1.75 ± 0.96CDc 2.50 ± 0.75CDcd 2.90 ± 0.34DEFdef 68.75 ± 6.25ABab T9 A3B1C3D4 N6 1 3 EC272 27.5 ± 5.00BCDbc 2.45 ± 1.04BCb 3.95 ± 1.13BCab 4.29 ± 0.85CDbc 75.75 ± 1.31Aa T10 A3B2C4D3 N6 2 4 EC269 7.5 ± 5.00Ed 1.00Dd 2.24 ± 0.32CDd 2.25 ± 0.32Fef 69.44 ± 4.81ABab T11 A3B3C1D2 N6 3 1 EC264 40.0 ± 8.16Bb 2.75 ± 1.44Bb 4.90 ± 1.74Aa 7.03 ± 2.24Aa 73.44 ± 2.70ABab T12 A3B4C2D1 N6 4 2 EC262 27.5 ± 5.00BCDbc 3.27 ± 1.49Aa 4.44 ± 1.76ABab 5.29 ± 1.54ABa 70.45 ± 4.55ABab T13 A4B1C4D2 wpm 1 4 EC264 10.0 ± 8.16Ed 1.50 ± 0.58CDd 2.10 ± 0.66Dd 2.29 ± 0.75EFef 31.25 ± 6.25Egh T14 A4B2C3D1 wpm 2 3 EC262 17.5 ± 9.57CDEcd 2.00 ± 0.82BCDbc 2.31 ± 0.53CDd 2.61 ± 0.30EFdef 34.52 ± 2.06Egh T15 A4B3C2D4 wpm 3 2 EC272 12.5 ± 5.00DEd 1.80 ± 0.84CDd 1.95 ± 0.61Dd 2.44 ± 0.24EFef 36.67 ± 2.89Eh T16 A4B4C1D3 wpm 4 1 EC269 7.5 ± 5.00Ed 1.33 ± 0.58Dd 2.02 ± 0.33Dd 2.17 ± 0.15Fef 27.78 ± 4.81Eh 注:表中每列数据后不同大写字母表示在 0.01水平上存在极显著差异,不同小写字母表示 0.05 水平上存在显著差异,下同
Notes: In the table, different uppercase letters after each column of data indicate highly significant differences at the 0.01 level, and lowercase letters indicate significant differences at the 0.05 level. The same below -
结合4个尾巨桉无性系的生根率(表3)及平均根数极差分析(表4)表明,无性系间差异是这两种生根效果的最主要差异来源。其中,通过生根率的极差分析结果可见,无性系对生根的影响远大于其余3种因素,其极差达到24.5,而其余3种因素均在7~8之间;此外,这4种因素在处理水平间均存在极显著差异,其中,无性系的4个处理中的K3(EC269)的生根率(3.5)在极显著水平低于其余无性系(11.5~28.0)。
表 3 尾巨桉生根率极差分析
Table 3. Range analysis of the rooting rate of rooting for E. urophylla × E. grandis
试验号
ExperimentA 培养基类型
Medium typeB IBA浓度
IBA concentration/(mg·L−1)C NAA浓度
NAA concentration/(mg·L−1)D 无性系
clonal lineK1 12.25Aa 10.50ABab 14.25Aa 11.50Ab K2 12.25 Aa 13.50Aa 12.25ABa 28.00Aa K3 10.25ABa 9.00ABab 6.25Cb 3.50Bb K4 4.75Bb 6.50Bb 6.75BCb 11.50Ab 极差 R 7.50 7.00 8.00 24.50 注:K代表不同处理的4个水平,下同
Notes: K represents the four levels of different treatments. The same below表 4 尾巨桉平均根数极差分析
Table 4. Range analysis of the mean number of rooting for E. urophylla × E. grandis
试验号
ExperimentA 培养基类型
Medium typeB IBA浓度
IBA concentration/(mg·L−1)C NAA浓度
NAA concentration/(mg·L−1)D 无性系
clonal lineK1 7.83Aa 8.50a 8.83Aa 9.75a K2 9.25Aa 9.08a 8.75ABab 7.50b K3 8.08Aa 7.33a 7.83Cb 6.25b K4 7.08Bb 7.33a 6.83BCab 8.75a 极差 R 2.17 1.75 2.00 3.50 平均根数中几种因素的极差较为接近,极差的范围在1.75~3.50间。从结果而言无性系的影响最大(3.50),其次是培养基类型(2.17)及NAA浓度(2.00)。此外,培养基类型、NAA浓度的不同处理水平间存在0.01水平的极显著差异,无性系间存在0.05水平的显著差异,IBA各处理间则无显著差异。
-
对4个尾巨桉无性系平均根长(表5)、最长根长(表6)及生根性状评分率(表7)的极差分析结果表明,所有因素的影响都达到显著或极显著水平,但各因素的重要性与生根率、平均根数中不尽相同。平均根长的极差结果显示,培养基类型对平均根长的影响最大,极差为7.15,且处理K2(大量元素)及K3(N6)在极显著水平上均高于其余处理。而无性系、NAA浓度、IBA浓度的极差分别为4.55、3.07和2.20,重要性依次递减;同时,在平均根长中,除无性系间存在显著差异外,其余均为极显著差异。
表 5 尾巨桉平均根长极差分析
Table 5. Range analysis of the longest root length of rooting for E. urophylla × E. grandis
试验号
ExperimentA 培养基类型
Medium typeB IBA浓度
IBA concentration/(mg·L−1)C NAA浓度
NAA concentration/(mg·L−1)D 无性系
clonal lineK1 10.92Bb 12.87Bb 13.78Aa 14.68a K2 15.42Aa 11.64Bb 13.43ABab 12.62 b K3 15.53Aa 13.84Aa 10.71Bb 10.13b K4 8.38Cc 11.91 Bb 12.33Aa 12.82b 极差 R 7.15 2.20 3.07 4.55 表 6 尾巨桉最长根长极差分析
Table 6. Range analysis of the longest root length of rooting for E. urophylla × E. grandis
试验号
ExperimentA 培养基类型
Medium typeB IBA浓度
IBA concentration/(mg·L−1)C NAA浓度
NAA concentration/(mg·L−1)D 无性系
clonal lineK1 12.75Bb 14.83 Bb 16.81Aa 18.21Aa K2 18.48Aa 13.69Bb 16.88Aa 15.43Aa K3 18.75Aa 16.68Aa 11.79Bb 10.95Bb K4 9.69Cc 14.46Bb 14.18Aa 15.08ABa 极差 R 9.06 3.17 5.09 7.26 表 7 尾巨桉生根性状评分率极差分析
Table 7. Range analysis of the root effective traits rate of rooting for E. urophylla × E. grandis
试验号
ExperimentA 培养基类型
Medium typeB IBA浓度
IBA concentration/(mg·L−1)C NAA浓度
NAA concentration/(mg·L−1)D 无性系
clonal lineK1 1.98Bb 2.35a 2.25a 2.38a K2 2.79Aa 2.30a 2.37a 2.34a K3 2.89Aa 2.13a 2.07a 1.95a K4 1.3Cc 2.19a 2.28a 2.30a 极差R 1.59 0.22 0.30 0.43 对于最长根长,各因素的影响大小排序与平均根长的相同(表6),也是培养基类型影响最大,极差为9.06,且处理K2(大量元素)及K3(N6)的平均值分别为18.48和18.75,极显著地高于其余处理。而无性系、NAA浓度、IBA浓度的极差分别为7.26、5.09和3.17,重要性依次递减。
生根性状评分率(表7)也是判定植株根系发育的重要指标。极差分析结果表明,培养基类型是在这个方面影响最大的因素,其极差为1.59,显著大于无性系的0.43、NAA浓度的0.30、IBA浓度的0.22。4个因素中,也仅培养基类型间的差异达到极显著水平,其他因素内的差异均不显著。
-
影响桉树生根的原因有很多,无性系、生长调节剂浓度及培养基等均会对生根造成影响。本研究综合考虑了这几种因素对4个尾巨桉无性系组培苗生根效果的影响,结果表明,植株生根不同阶段的主要影响因子不同,在生根初始阶段,主要是遗传因素(无性系间差异)决定其生根差异,而在根系发育的后续阶段,环境因素(培养基类型)的影响超过了遗传因素。有研究表明,生长素与细胞分裂素是植株脱分化的必备条件,在前期预实验中,无生长素、细胞分裂素或极高浓度(5 mg·L−1)的生长素和细胞分裂素均导致植株难以生根,说明一定浓度的生长素及细胞分裂素确是植物生根不可或缺的因素[18]。在本研究中,生长素及细胞分裂素虽是生根必须但其对植株生根的影响小于无性系或培养基类型。研究还发现,4个尾巨桉无性系生根生长调节剂浓度及培养基适应范围较大,1~4 mg·L−1生长调节剂浓度及4种培养基培育下均有生根现象,生根植株均从类根愈伤组织开始生长,皮质生根在10 d左右从茎侧端生长出不定根幼根,剩余则发展为愈伤团,部分可形成愈伤生根,剩余则会逐渐褐化后死亡。
-
植物的基因控制着植物内源激素、信号传导,次生代谢产物的水平,而这些产物又反过来控制基因重编程,进而控制如细胞分裂,扩大和分化等细胞过程,以此来影响植物根系的生长[19]。有研究表明,生长素IAA(Indole acetic acid)与其受体蛋白TIR1/AFB(Transport Inhibitor Response 1/Auxin Signaling F-Box)及ARF(Auxin Response Factor)互作,在调节植物根部分生区大小及早期胚胎根形成阶段,发挥了极为重要的作用[19-22]。ARF还参与控制生长素外排因子PIN(PIN-FORMED)的活性[23],该蛋白通过极性运输改变细胞间生长素流动的方向[24-26],参与介导生长素转运的其它3种转录因子PLT(PLETHORA),SHR(Short-Root)及SCR(SCARECROW),同样被证实在影响细胞分裂,控制细胞增殖及大小等方面发挥重要作用[27-30]。在本研究中,生根率及根数受到遗传因素的影响最大,因此,无法生根的植株可能在基因调控的某个模块存在问题影响植株的脱分化或再分化过程,从而阻碍后续胚胎根的形成。此外,NAA在生根阶段的影响大于除无性系外的其余因素,研究表明:细胞分裂素通过表达水平和信号通路的修饰导致PIN家族中几种生长素外排载体基因的转录发生特异性变化,从而影响生长素外排和生长素在根尖的分布以此来调节生长素极性转运控制根分生组织的活性和大小[27-28]。以此推测,生根受阻可能与生长素的转运或与生长素转运相关的几种转录因子PIN、PLT、SHR、SCR等有关,外源添加细胞分裂素在一定程度上弥补遗传因素缺陷,但补救能力有限。
-
在后续根伸长及生根性状方面培养基占据了更为重要的地位,大量元素培养基及N6培养基更适合尾巨桉生长,对比4种培养基配方后发现,大量元素培养基及N6培养基内的大量元素KH2PO4高于其它两种培养基约3倍,微量元素MnSO4·4H2O及ZnSO4·7H2O含量低于其它两种培养基约4倍。
磷和钾是植物生长过程中不可缺少的重要物质[29],有研究表明:磷缺乏对拟南芥(Arabidopsis thaliana (L.) Heynh.)初生根的生长具有抑制作用,而对水稻(Oryza sativa L.)及番茄(Solanum lycopersicum Mill)的初生根生长却有促进作用。GRAS家族成员DELLA及SCARECROW-LIKE 3(SCL3)均被证实在下胚轴和根伸长过程中发挥重要作用[30-31]。DELLA可通过抑制光敏色素互作因子(Phytochrome-Interacting Factors,PIF)家族丰度阻止PIF靶基因的表达来抑制下胚轴伸长[32],赤霉素通过参与的GA-GID1-DELLA途径参与控制根系细胞及组织伸长[31],磷缺乏导致拟南芥中赤霉素(Gibberellin,GA)水平下降,GA-DELLA信号通路的核心DELLA蛋白累积,进一步导致编码其代谢酶的基因转录物水平发生相关变化,抑制拟南芥初生根生长[33]。而在番茄中,赤霉素在其根系处于低磷环境中时起积极作用,推测GA - PRO(PRO为番茄中DELLA家族成员)系统可能在响应番茄磷缺乏时发挥重要作用[33]。而磷元素缺乏会导致苹果分生细胞外质体中铁离子积累,导致铁毒性从而抑制初生根生长[34-35]。
此外,赤霉素信号调节在拟南芥侧根分生组织的侧根萌发率,密度及初生根生长等方面也同样发挥重要作用,外源施用GA可挽救侧根(LR)短表型,K + 缺乏同样通过调控GA信号和DELLAs相关转录因子调控LR生长[36-37]。本研究推测,大量培养基及N6培养基中充足的钾离子及磷酸盐可能通过赤霉素所介导的GA-DELLA途径及铁离子累积方面,影响尾巨桉根的生长。
研究表明:在硫缺乏的情况下,水稻根能够识别并诱导根产生独脚金内脂,而在其它情况则不会[38]。独脚金内脂被证实通过降低PIN蛋白在木质部薄壁组织细胞质膜上的积累从而阻碍生长素的运输,并以此影响初生根的伸长及细胞增殖[39-40]。独脚金内脂的缺失促进了侧根的形成,说明独脚金内脂对根毛伸长也有一定影响[41]。这或许为本研究中,硫酸根缺乏的培养基反而在根系的生长上更具优势提供一定理论参考。综上所述,环境因素在4个尾巨桉无性系的发育过程中发挥极为重要的作用,高浓度的磷酸根离子和钾离子,低浓度的硫酸根离子环境更适合4个尾巨桉无性系组培苗不定根的产生,这或许与赤霉素及独脚金内脂两种生长调节剂的功能相关。
-
尾巨桉的生根大致分为4个阶段:0~7 d,茎末端出现小型愈伤团;7~10 d,愈伤组织陆续出现小根点;10~15 d,小根点不断膨大且数量不断增加;15~30 d ,不定根长度快速抽长,出现二级及以上侧根;30 d以上,不定根数量趋于稳定,根长持续伸长,侧根持续生长。不同激素及培养基组合对不同无性系的生根情况影响不同,方差分析结果表明:植物生长调节剂种类和浓度、培养基类型及无性系均对植株生根的效果均具有极显著影响。此外,极差分析结果表明:无性系是造成4个尾巨桉的生根率及平均根数这两种生根效果差异的最主要来源,而平均根长、最长根长及生根性状等生根效果则受到培养基类型的影响更大。
不同培养基、生长调节剂浓度对4个尾巨桉无性系组培生根的影响
Effects of Different Medium and Hormone Concentration on the Rooting of Eucalyptus urophylla × E. grandis Clones
-
摘要:
目的 通过不同种类培养基及不同浓度生长调节剂对4个尾巨桉无性系幼苗进行处理,以了解各因素对其生根的影响,为尾巨桉的离体快繁及栽培提供理论依据和技术支持。 方法 以来自尾巨桉同一杂交组合,亲本相同但生根能力不同的4个无性系(EC262、EC264、EC269和EC272)为试验材料,设4因素4水平16个处理的正交试验,培养30 d时对其生根率、生根量、平均根长、最长根长等生长指标进行测量,并评估其生根性状,最后利用极差分析对这些数据进行进一步评价。 结果 方差分析结果表明:植物生长调节剂种类和浓度、培养基类型及无性系均对植株生根的效果具有极显著影响。4个无性系在不同处理下均可生根,生根率在7.5%~55%之间,平均根数介于1~3.27之间,平均根长在1.95~5.02 cm之间,最长根长在2.18~7.03 cm之间, 生根性状评分介于27.78%~75.75%之间。极差分析表明:代表生根前期的根系发生能力的生根率及生根根数,主要受无性系的影响;而代表后续根系质量的平均根长、最长根长及生根性状评价,培养基的作用超过了无性系起了更重要的作用。 结论 在尾巨桉4个无性系生根初始阶段,遗传因素是其生根差异的主导因素,而在根系发育的后续阶段,环境因素的影响更大。本研究的结果可为桉树及其它树种的组培扩繁技术体系优化提供理论支持与技术参考。 Abstract:Objective To understand the influence of various factors on the rooting rate of Eucalyptus urophylla × E. grandis, by using different types of culture media and different concentrations of hormones treated with four E. urophylla × E. grandis clones and to provide the theoretical support for the rapid propagation and cultivation of E.urophylla × E. grandis. Method In this study, based on the four clones (EC262, EC264, EC269 and EC272) of E.urophylla × E. grandis from the same parents but with different rooting , the experiment with 4 factors and 4 levels having total 16 treatments was designed. Rooting rate, rooting number, average root length, longest root length were investigated on 30 days. the rooting traits were evaluated and the rooting effect of each treatment combination was analyzed using the range analysis method. Results The type and concentration of plant growth regulators, the type of culture medium and the clones all had a significant impact on the rooting effect. The four clones were all able to take root under different treatments. The rooting rates ranged from 7.5% to 55%; average number of roots ranged from 1 to 3.27; average root length ranged from 1.95 to 5.02 cm; average root length ranged from 2.18 to 7.03 cm; and the rooting traits score ranged from 27.78 to 75.75%. In addition, range analysis showed that the root rate and root number, representing the root generation ability in the early rooting stage, were mainly affected by clones, while the average root length, the longest root length and the evaluation of rooting traits representing the quality of the subsequent root system, the role of the medium More than the clones played a more important role. Conclusion In the initial stage of rooting of the four clones of Eucalyptus urophylla × E. grandis, genetic factors are the dominant factor in the rooting differences, while in the subsequent stages of root development, environmental factors have a greater influence than genetic factors. The results of this study can provide theoretical support and technical reference for the optimization of the tissue culture propagation technology system of Eucalyptus and other trees. -
Key words:
- Eucalyptus urophylla × E. grandis
- / tissue culture
- / clone
- / rooting rate
- / root morphology
-
表 1 正交试验设计的因素与水平
Table 1. Factors and levels for orthogonal design
处理
Treatment试验组合
Experiment combined培养基类型
Medium type激素浓度
Hormone concentration/(mg·L−1)无性系
cloneIBA NAA T1 A1B1C1D1 1/2MS 1 1 EC262 T2 A1B2C2D2 1/2MS 2 2 EC264 T3 A1B3C3D3 1/2MS 3 3 EC269 T4 A1B4C4D4 1/2MS 4 4 EC272 T5 A2B1C2D3 大量元素 1 2 EC269 T6 A2B2C1D4 大量元素 2 1 EC272 T7 A2B3C4D1 大量元素 3 4 EC262 T8 A2B4C3D2 大量元素 4 3 EC264 T9 A3B1C3D4 N6 1 3 EC272 T10 A3B2C4D3 N6 2 4 EC269 T11 A3B3C1D2 N6 3 1 EC264 T12 A3B4C2D1 N6 4 2 EC262 T13 A4B1C4D2 WPM 1 4 EC264 T14 A4B2C3D1 WPM 2 3 EC262 T15 A4B3C2D4 WPM 3 2 EC272 T16 A4B4C1D3 WPM 4 1 EC269 表 2 各因素对尾巨桉生根的影响
Table 2. Effects of different treatments on rooting of E. urophylla × E.grandis
试验组合
Experiment
combined培养基类型
Medium
type激素浓度
Hormone
concentration/
(mg·L−1)无性系
clone生根率
rooting
rate/%平均根数
Average number
of rooting平均根长
Mean root
length/cm最长根长
Longest root
length/cm生根性状评分率
Root effective
traits score/%IBA NAA T1 A1B1C1D1 1/2MS 1 1 EC262 40.0 ± 8.16Bb 3.00 ± 1.50ABa 2.90 ± 0.99BCDbcd 3.60 ± 0.74CDEFcde 57.81 ± 1.56CDde T2 A1B2C2D2 1/2MS 2 2 EC264 55.0 ± 5.77Aa 2.90 ± 1.57ABa 3.11 ± 0.9BCDbcd 3.23 ± 0.74CDEbcd 60.23 ± 1.14CDcd T3 A1B3C3D3 1/2MS 3 3 EC269 7.5 ± 5.00Ed 1.30 ± 0.57Dd 1.95 ± 0.39Dd 2.18 ± 0.04Fef 27.78 ± 4.81Eh T4 A1B4C4D4 1/2MS 4 4 EC272 20.0 ± 8.16CDEcd 2.00 ± 1.07BCDbc 2.96 ± 0.96BCDbcd 3.55 ± 0.89CDEFcde 52.08 ± 1.80DEe T5 A2B1C2D3 大量元素 1 2 EC269 27.5 ± 5.00BCDbc 2.55 ± 1.13BCb 3.92 ± 1.23BCab 5.47 ± 0.62BCbc 69.70 ± 5.25ABab T6 A2B2C1D4 大量元素 2 1 EC272 55.0 ± 12.90Aa 3.27 ± 1.67Aa 3.96 ± 1.48BCab 5.05 ± 1.15ABCab 65.53 ± 0.66BCabc T7 A2B3C4D1 大量元素 3 4 EC262 30.0 ± 8.16BCbc 2.67 ± 1.43Bb 5.02 ± 1.67Aa 6.62 ± 1.35ABa 75.00 ± 2.08Aa T8 A2B4C3D2 大量元素 4 3 EC264 10.0 ± 8.16Ed 1.75 ± 0.96CDc 2.50 ± 0.75CDcd 2.90 ± 0.34DEFdef 68.75 ± 6.25ABab T9 A3B1C3D4 N6 1 3 EC272 27.5 ± 5.00BCDbc 2.45 ± 1.04BCb 3.95 ± 1.13BCab 4.29 ± 0.85CDbc 75.75 ± 1.31Aa T10 A3B2C4D3 N6 2 4 EC269 7.5 ± 5.00Ed 1.00Dd 2.24 ± 0.32CDd 2.25 ± 0.32Fef 69.44 ± 4.81ABab T11 A3B3C1D2 N6 3 1 EC264 40.0 ± 8.16Bb 2.75 ± 1.44Bb 4.90 ± 1.74Aa 7.03 ± 2.24Aa 73.44 ± 2.70ABab T12 A3B4C2D1 N6 4 2 EC262 27.5 ± 5.00BCDbc 3.27 ± 1.49Aa 4.44 ± 1.76ABab 5.29 ± 1.54ABa 70.45 ± 4.55ABab T13 A4B1C4D2 wpm 1 4 EC264 10.0 ± 8.16Ed 1.50 ± 0.58CDd 2.10 ± 0.66Dd 2.29 ± 0.75EFef 31.25 ± 6.25Egh T14 A4B2C3D1 wpm 2 3 EC262 17.5 ± 9.57CDEcd 2.00 ± 0.82BCDbc 2.31 ± 0.53CDd 2.61 ± 0.30EFdef 34.52 ± 2.06Egh T15 A4B3C2D4 wpm 3 2 EC272 12.5 ± 5.00DEd 1.80 ± 0.84CDd 1.95 ± 0.61Dd 2.44 ± 0.24EFef 36.67 ± 2.89Eh T16 A4B4C1D3 wpm 4 1 EC269 7.5 ± 5.00Ed 1.33 ± 0.58Dd 2.02 ± 0.33Dd 2.17 ± 0.15Fef 27.78 ± 4.81Eh 注:表中每列数据后不同大写字母表示在 0.01水平上存在极显著差异,不同小写字母表示 0.05 水平上存在显著差异,下同
Notes: In the table, different uppercase letters after each column of data indicate highly significant differences at the 0.01 level, and lowercase letters indicate significant differences at the 0.05 level. The same below表 3 尾巨桉生根率极差分析
Table 3. Range analysis of the rooting rate of rooting for E. urophylla × E. grandis
试验号
ExperimentA 培养基类型
Medium typeB IBA浓度
IBA concentration/(mg·L−1)C NAA浓度
NAA concentration/(mg·L−1)D 无性系
clonal lineK1 12.25Aa 10.50ABab 14.25Aa 11.50Ab K2 12.25 Aa 13.50Aa 12.25ABa 28.00Aa K3 10.25ABa 9.00ABab 6.25Cb 3.50Bb K4 4.75Bb 6.50Bb 6.75BCb 11.50Ab 极差 R 7.50 7.00 8.00 24.50 注:K代表不同处理的4个水平,下同
Notes: K represents the four levels of different treatments. The same below表 4 尾巨桉平均根数极差分析
Table 4. Range analysis of the mean number of rooting for E. urophylla × E. grandis
试验号
ExperimentA 培养基类型
Medium typeB IBA浓度
IBA concentration/(mg·L−1)C NAA浓度
NAA concentration/(mg·L−1)D 无性系
clonal lineK1 7.83Aa 8.50a 8.83Aa 9.75a K2 9.25Aa 9.08a 8.75ABab 7.50b K3 8.08Aa 7.33a 7.83Cb 6.25b K4 7.08Bb 7.33a 6.83BCab 8.75a 极差 R 2.17 1.75 2.00 3.50 表 5 尾巨桉平均根长极差分析
Table 5. Range analysis of the longest root length of rooting for E. urophylla × E. grandis
试验号
ExperimentA 培养基类型
Medium typeB IBA浓度
IBA concentration/(mg·L−1)C NAA浓度
NAA concentration/(mg·L−1)D 无性系
clonal lineK1 10.92Bb 12.87Bb 13.78Aa 14.68a K2 15.42Aa 11.64Bb 13.43ABab 12.62 b K3 15.53Aa 13.84Aa 10.71Bb 10.13b K4 8.38Cc 11.91 Bb 12.33Aa 12.82b 极差 R 7.15 2.20 3.07 4.55 表 6 尾巨桉最长根长极差分析
Table 6. Range analysis of the longest root length of rooting for E. urophylla × E. grandis
试验号
ExperimentA 培养基类型
Medium typeB IBA浓度
IBA concentration/(mg·L−1)C NAA浓度
NAA concentration/(mg·L−1)D 无性系
clonal lineK1 12.75Bb 14.83 Bb 16.81Aa 18.21Aa K2 18.48Aa 13.69Bb 16.88Aa 15.43Aa K3 18.75Aa 16.68Aa 11.79Bb 10.95Bb K4 9.69Cc 14.46Bb 14.18Aa 15.08ABa 极差 R 9.06 3.17 5.09 7.26 表 7 尾巨桉生根性状评分率极差分析
Table 7. Range analysis of the root effective traits rate of rooting for E. urophylla × E. grandis
试验号
ExperimentA 培养基类型
Medium typeB IBA浓度
IBA concentration/(mg·L−1)C NAA浓度
NAA concentration/(mg·L−1)D 无性系
clonal lineK1 1.98Bb 2.35a 2.25a 2.38a K2 2.79Aa 2.30a 2.37a 2.34a K3 2.89Aa 2.13a 2.07a 1.95a K4 1.3Cc 2.19a 2.28a 2.30a 极差R 1.59 0.22 0.30 0.43 -
[1] 刘 菲. 森林资源配置对木材供给的影响研究[D]. 北京: 北京林业大学, 2020. [2] 苏晓华, 李金花, 卢宝明. 林木遗传改良与我国21世纪林业可持续发展[J]. 林业科学研究, 1999, 12(6):650-655. doi: 10.3321/j.issn:1001-1498.1999.06.015 [3] OUYANG L J, HUANG Z C, ZHAO L Y, et al. Efficient regeneration of Eucalyptus urophylla × Eucalyptus grandis from stem segment[J]. Brazilian Archives of Biology and Technology, 2012, 55(3): 329-334. doi: 10.1590/S1516-89132012000300001 [4] LU H F, XU J M, Li G Y, et al. Site classification of Eucalyptus urophylla × Eucalyptus grandis plantations in China[J]. Forests, 2020, 11(8): 871. doi: 10.3390/f11080871 [5] 李焕勇. 两种耐盐植物嫩枝扦插技术及生根生理研究[D]. 北京: 中国林业科学研究院, 2014. [6] 黄烈健, 王 鸿. 林木植物组织培养及存在问题的研究进展[J]. 林业科学研究, 2016, 29(3):464-471. doi: 10.3969/j.issn.1001-1498.2016.03.024 [7] 雷巾茗. 樱花组培快繁与扦插繁殖研究[D]. 北京: 北京林业大学, 2020. [8] 刘 娜, 代学焕, 向凤宁等. 植物体细胞脱分化分子调控机制研究进展[J]. 植物生理学报, 2020, 2(56):127-133. doi: 10.13592/j.cnki.ppj.2019.0179 [9] 卢开成. 尾巨桉DH_(32-26)组培快繁技术[J]. 安徽农业科学, 2016, 44(14):133-135. doi: 10.3969/j.issn.0517-6611.2016.14.047 [10] 杨卫星. 尾巨桉DH32-28组培快繁技术研究[J]. 现代农业科技, 2018(13):138-139. doi: 10.3969/j.issn.1007-5739.2018.13.088 [11] 梁秀莉. 尾巨桉三个无性系芽器官离体组培快繁技术研究[D]. 南宁: 广西大学, 2015. [12] 刘 果, 陈少雄, 高丽琼, 等. 两种优良巴西杂交桉树的组织培养和快速繁殖[J]. 桉树科技, 2017, 34(4):10-16. doi: 10.3969/j.issn.1674-3172.2017.04.002 [13] 王楚彪, 李华强, 樊林华, 等. 大量元素对桉树组培生根的影响[J]. 桉树科技, 2021, 38(1):45-50. [14] 付雪宁, 高洪治, 申耀荣, 等. 红桦组织培养体系的建立[J]. 林业科学研究, 2021, 34(3):194-200. doi: 10.13275/j.cnki.lykxyj.2021.03.023 [15] 张沛健, 高丽琼, 尚秀华. 不同激素种类、浓度及浸泡时间对金蒲桃扦插生根的影响[J]. 热带作物学报, 2020, 41(6):1084-1091. doi: 10.3969/j.issn.1000-2561.2020.06.003 [16] 王 艺, 贾忠奎, 马履一, 等. 4种植物生长调节剂对红花玉兰嫩枝扦插生根的影响[J]. 林业科学, 2019, 55(7):35-45. doi: 10.11707/j.1001-7488.20190704 [17] 邓 艺, 曾炳山, 刘 英, 等. 巨桉无性系EG5叶片高效再生体系的建立[J]. 林业科学研究, 2012, 25(3):394-399. doi: 10.3969/j.issn.1001-1498.2012.03.020 [18] ZLUHAN-MARTINEZ E, LOPEZ-RUIZ B A, GARCIA-GOMEZ M L, et al. Integrative roles of phytohormones on cell proliferation, elongation and differentiation in the Arabidopsis thaliana primary root[J]. Front Plant Sci, 2021, 12: 659155. doi: 10.3389/fpls.2021.659155 [19] LUO J, ZHOU J J, ZHANG J Z. Aux/IAA gene family in plants: molecular structure, regulation, and function[J]. International Journal of Molecular Sciences, 2018, 19(1): 259. doi: 10.3390/ijms19010259 [20] MOCKAITIS K, ESTELLE M. Auxin receptors and plant development: a new signaling paradigm[J]. Annu Rev Cell Dev Biol, 2008, 24: 55-80. doi: 10.1146/annurev.cellbio.23.090506.123214 [21] PARRY G, CALDERON-VILLALOBOS L I, PRIGGE M, et al. Complex regulation of the TIR1/AFB family of auxin receptors[J]. Proceedings of the National Academy of Sciences, 2009, 106(52): 22540-22545. doi: 10.1073/pnas.0911967106 [22] ULMASOV T, HAGEN G, GUILFOYLE T J. ARFI, a Transcription factor that binds to auxin response elements[J]. SCIENCE, 1997, 276(5320): 1865-1868. doi: 10.1126/science.276.5320.1865 [23] KROGAN N T, MARCOS D, WEINER A I, et al. The auxin response factor MONOPTEROS controls meristem function and organogenesis in both the shoot and root through the direct regulation of PIN genes[J]. The New Phytologist, 2016, 212(1): 42-50. doi: 10.1111/nph.14107 [24] VIETEN A, VANNESTE S, WISNIEWSKA J, et al. Functional redundancy of PIN proteins is accompanied by auxin-dependent cross-regulation of PIN expression[J]. Development, 2005, 132(20): 4521-4531. doi: 10.1242/dev.02027 [25] KRECEK P, SKUPA P, LIBUS J, et al. The PIN-FORMED (PIN) protein family of auxin transporters[J]. Genome Biology, 2009, 10(12): 249. doi: 10.1186/gb-2009-10-12-249 [26] SAUER M, KLEINE-VEHN J. PIN-FORMED and PIN-LIKES auxin transport facilitators[J]. Development, 2019, 146(15): dev168088. doi: 10.1242/dev.168088 [27] SCHALLER G E, BISHOPP A, KIEBER J J. The Yin-Yang of hormones: cytokinin and auxin interactions in plant development[J]. The Plant Cell, 2015, 27(1): 44-63. doi: 10.1105/tpc.114.133595 [28] RUZICKA K, SIMASKOVA M, DUCLERCQ J, et al. Cytokinin regulates root meristem activity via modulation of the polar auxin transport[J]. Proc Natl Acad Sci U S A, 2009, 106(11): 4284-4289. doi: 10.1073/pnas.0900060106 [29] EPSTEIN. Mineral nutrition of plants[M]. New England: Sinauer Associates Publishers, 2005. [30] JIANG C F, GAO X H, LIAO L L, et al. Phosphate starvation root architecture and anthocyanin accumulation responses are modulated by the gibberellin-della signaling pathway in Arabidopsis[J]. Plant Physiology, 2007, 145(4): 1460-1470. doi: 10.1104/pp.107.103788 [31] ZHANG Z L, OGAWA M, FLEET C M, et al. Scarecrow-like 3 promotes gibberellin signaling by antagonizing master growth repressor DELLA in Arabidopsis[J]. Proc Natl Acad Sci U S A, 2011, 108(5): 2160-2165. doi: 10.1073/pnas.1012232108 [32] LI K L, YU R B, FAN L M, et al. DELLA-mediated PIF degradation contributes to coordination of light and gibberellin signalling in Arabidopsis[J]. Nat Commun, 2016, 7: 11868. doi: 10.1038/ncomms11868 [33] SUN T. The molecular mechanism and evolution of the review GA-GID1-DELLA signaling module in plants[J]. Current Biology, 2011, 9(21): 338-345. [34] WARD J T, LAHNER B, YAKUBOVA E, et al. The effect of iron on the primary root elongation of arabidopsis during phosphate deficiency[J]. Plant Physiology, 2008, 147(3): 1181-1191. doi: 10.1104/pp.108.118562 [35] MORA-MACIAS J, OJEDA-RIVERA J O, GUTIERREZ-ALANIS D, et al. Malate-dependent Fe accumulation is a critical checkpoint in the root developmental response to low phosphate[J]. Proc Natl Acad Sci U S A, 2017, 114(17): E3563-E3572. [36] HETHERINGTON F M, KAKKAR M, TOPPING J F, et al. Gibberellin signaling mediates lateral root inhibition in response to K + -deprivation[J]. Plant Physiol, 2021, 185(3): 1198-1215. doi: 10.1093/plphys/kiaa093 [37] ZHANG Y Q, ZHOU Y W, CHEN S Y, et al. Gibberellins play dual roles in response to phosphate starvation of tomato seedlings, negatively in shoots but positively in roots[J]. Journal of Plant Physiology, 2019, 234-235: 145-153. doi: 10.1016/j.jplph.2019.02.007 [38] SHINDO M, NAGASAKA S, KASHIWADA S, et al. Shoot has important roles in strigolactone production of rice roots under sulfur deficiency[J]. Plant Signaling & Behavior, 2021, 16(4): 1880738. [39] ZHANG J, MAZUR E, BALLA J, et al. Strigolactones inhibit auxin feedback on PIN-dependent auxin transport canalization[J]. Nature Communications, 2020, 11(1): 3508. doi: 10.1038/s41467-020-17252-y [40] SUN H W, LI W Q, Burritt D J, et al. Strigolactone interact with other phytohormones to modulate plant root growth and development[J]. The Crop Journal, 2022, 10(6): 1517-1527. doi: 10.1016/j.cj.2022.07.014 [41] ALTAMURA M M, PIACENTINI D, DELLA R F, et al. New paradigms in brassinosteroids, strigolactones, sphingolipids, and nitric oxide interaction in the control of lateral and adventitious root formation[J]. Plants, 2023, 12(2): 413. doi: 10.3390/plants12020413 -




 下载:
下载: