-
土壤碳库作为陆地生态系统中最大的碳库,是陆地植物及土壤动物和微生物生存的养分库,而土壤对有机碳的矿物保护和团聚体保护,使得有机碳固存在土壤中,这对于减缓大气CO2浓度上升有重要意义[1]。而土壤有机碳的含量取决于其积累与分解的速率[2]。凋落物作为植物生长发育过程中的产物,其分解后残留在土壤中的有机碳是土壤碳库重要的来源之一[3]。研究者对凋落物分解做了很多研究,包括凋落物的分解及养分释放,主要有分解的过程、分解过程中状态的变化[4-8],还有不同类型、不同性状的凋落物或植物残体的分解[9-12],以及影响凋落物分解的因素研究[13-14]。影响凋落物分解的因素主要分为内在因素、气候因素、土壤因素等[15],而研究发现凋落物的分解还依赖于土壤动物[16]、土壤微生物多样性[17]等。蚯蚓作为典型的大型土壤动物,其生存所需来自土壤,但是又通过摄入土壤和凋落物或再分配等活动直接或间接影响土壤[18],对土壤的肥力和理化性质等的变化发挥不可小觑的作用。研究表明,蚯蚓对凋落物和有机质腐烂的影响强烈依赖于蚯蚓生态型和多样性,且蚯蚓生态型的高度多样性加速了凋落物的质量损失和有机质的腐烂[19]。
目前可以明确的信息是蚯蚓通过影响凋落物的分解为土壤碳库做出了巨大贡献,但是对于不同蚯蚓类群对土壤碳库的影响的研究过于单一,且研究大多集中于对土壤碳库总体的变化的阐明,缺少关于不同生态类型蚯蚓及其交互作用对凋落物源碳在土壤不同组分的分配规律的影响的研究。稳定碳同位素技术是研究土壤碳循环,探究土壤碳转化、分配的高效又科学的方法之一[20],用其标记植物后,可用来示踪植物残体有机碳在土壤中的转化与分配。因此,本研究采用稳定碳同位素技术,以不同生态类群蚯蚓和杨树叶凋落物为研究对象,结合室内培养实验,研究凋落物源碳在蚯蚓作用下在土壤中的转化与分配规律,揭示凋落物源碳在蚯蚓作用下在土壤中的去向,为深入研究不同生态型蚯蚓对杨树人工林土壤固碳增汇潜力的影响提供理论依据和数据支撑。
-
选择南京本地3种生态类型不同的蚯蚓种:表栖型赤子爱胜蚓(Eisenia foetida)、表-内栖型皮质远盲蚓(Amynthas corticis)、和深栖型威廉环毛蚓(Pheretima guillelmi),进行室内培养实验。另将一批同类型蚯蚓分类型养殖在高有机质湿润土壤中备用,以及时替换培养过程中活性较差或死亡的蚯蚓个体。
-
采集南京市八卦洲杨树人工林0~25 cm层土壤,拣出肉眼可见的植物残体、根系、石块等杂物,粉碎其中较大的土块并过5 mm筛,混合均匀后作为室内培养使用。
-
在杨树幼苗生长季,采用重复脉冲标记法[21],试验采用BaCO3与充足稀盐酸反应产生13CO2。每隔7 d标记1次,标记7次,时间为2021年3月20日至4月30日,之后在密封箱中继续培养30 d。标定完成后,采集植株上所有叶片供培养使用。
-
将混合后的供试土壤装入长度为30 cm的PVC管中(内径7.1 cm,外径7.5 cm),装入过程中不断上下震动促进轻微压实(PVC管底部用0.1 mm孔径尼龙网扎紧封口,防止土壤漏出),最终土壤装入量控制在25 cm高左右(预留5 cm空间用于接种蚯蚓和添加凋落物,不同PVC管中土壤装入质量保持一致),将PVC管中土壤含水量调节至田间持水量的60%并称量质量。装好后将土壤于培养室静置平衡一周接种蚯蚓。凋落物放入前需剪碎并高压灭菌30 min[22]。
实验设置9个不同处理,即土壤对照处理(CK);土壤 + 凋落物(T1);土壤 + 接种赤子爱胜蚓 + 凋落物(T2);土壤 + 接种皮质远盲蚓 + 凋落物(T3);土壤+接种威廉环毛蚓+凋落物(T4);土壤 + 接种赤子爱胜蚓 + 接种皮质远盲蚓 + 凋落物(T5);土壤 + 接种赤子爱胜蚓 + 接种威廉环毛蚓 + 凋落物(T6);土壤 + 接种皮质远盲蚓 + 接种威廉环毛蚓 + 凋落物(T7);土壤 + 接种赤子爱胜蚓 + 接种皮质远盲蚓 + 接种威廉环毛蚓 + 凋落物(T8)。接种蚯蚓时赤子爱胜蚓 10 条(约0.5 g·条−1),皮质远盲蚓 5 条(1~2 g·条−1),威廉环毛蚓 3 条(2~3 g·条−1),两种蚯蚓交互时接种赤子爱胜蚓 5 条,皮质远盲蚓 3条(1~2 g·条−1),威廉环毛蚓 2 条,3种蚯蚓交互时接种赤子爱胜蚓 4 条,皮质远盲蚓 2条,威廉环毛蚓 1 条。凋落物添加量为10 g。每个处理设置4个重复,实验周期持续120 d。完成所有实验处理后,将每个处理的PVC管束为一组,分别置于30 cm × 30 cm × 40 cm的定制钢化玻璃缸中,室内温度调节在25 ℃左右。玻璃缸底部平铺约10 cm厚的灭菌粗沙,用于调节透气透水和固定PVC管。接种初期注意观察蚯蚓的入土情况,将活性差和死亡的蚯蚓及时替换掉,并观察蚯蚓活动情况以及是否存在逃逸现象。培养过程的前一个月每隔3 d抽样检查一次土壤水分损失量,并根据PVC管的初始质量确定培养周期内的补水频率及每次补水数量。
培养结束后分离蚯蚓与土壤,土壤风干破碎,过5 mm筛备用。
-
在Six湿筛法[23]基础上稍加改动进行土壤团聚体分级实验,将湿筛后的土壤团聚体分成粗大团聚体(d>2 mm)、细大团聚体(2 mm≥d>0.25 mm)、微团聚体(0.25 mm≥d>0.053 mm)和粉-黏团聚体(d≤0.053 mm)4个粒径级别的水稳性团聚体。
-
土壤有机碳含量采用重铬酸钾外加热法测定;13C同位素丰度值采用气相色谱-燃烧-稳定同位素比值质谱仪(GC-C-MS)测定。
-
实验数据用Excel整理计算,使用SPSS 25.0软件进行单因素方差分析(One-way ANOVA)统计分析和独立样本T检验,采用Duncan法对不同处理进行事后多重检验,显著性水平为p<0.05。数据分析前,对所有的计算结果进行正态检验和方差齐性检验,保证数据统计分析的合理性。
-
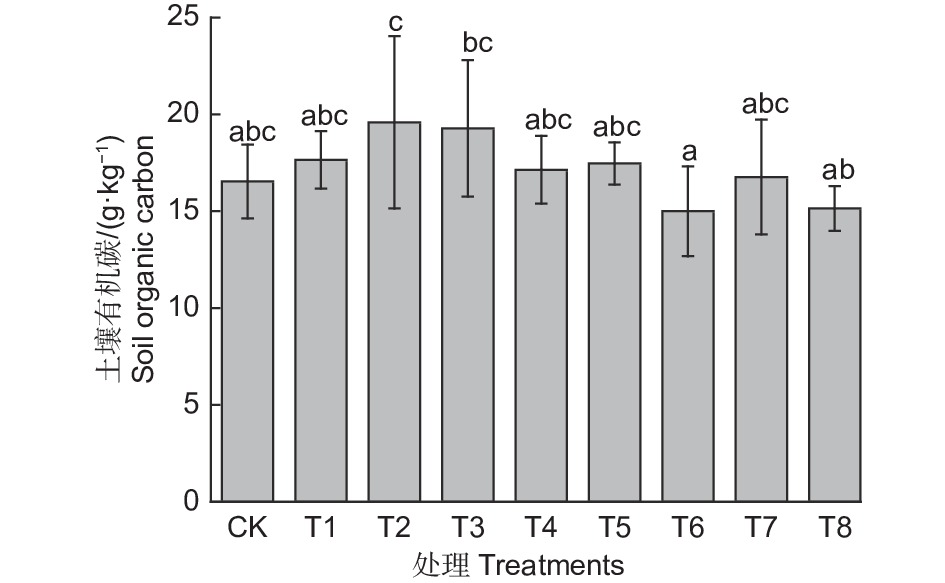
不同生态类群蚯蚓及其交互作用对土壤有机碳(SOC)含量的影响如图1所示,相对于T1只施加了凋落物,接种蚯蚓的处理中,除了T2和T3,其他接种蚯蚓的处理均使土壤有机碳含量降低,降低的效果从高到低依次为T6>T8>T7>T4>T5,T2、T3与T6差异显著,T2和T8差异显著。但是总体来说,不同生态类型蚯蚓及其交互作用对土壤总有机碳含量并无显著影响。
-
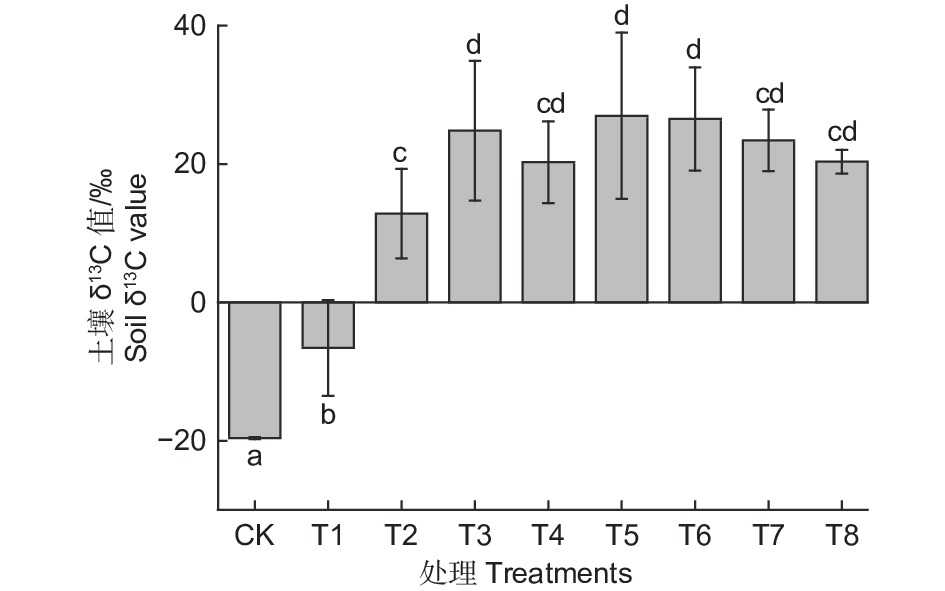
如图2所示,到培养结束,不同生态类群蚯蚓处理下土壤δ13C值均有显著提高(p<0.05)。其中T5处理下提高的幅度最大,相比T1提高了5倍,T2处理下提高的幅度最低,但也相比T1提高了3倍左右。各接种蚯蚓的处理之间,T2和T4、T7、T8差异不显著,T2和T3、T5、T6差异显著(p<0.05),不同生态型蚯蚓单独作用下,赤子爱胜蚓对凋落物源碳向土壤中并入的促进效果最低,皮质远盲蚓促进效果更大。蚯蚓交互作用下,赤子爱胜蚓和其他两种类型蚯蚓中任一种共同作用下会显著提高土壤δ13C值,但3种蚯蚓共同作用下效果并没有两种蚯蚓共同作用下显著。结果表明,蚯蚓在凋落物源碳向土壤中并入的过程中发挥的重大作用,在表栖型和内栖型蚯蚓或深栖型蚯蚓共同作用下,凋落物源碳向土壤中并入的效果更好。
-
不同生态类群蚯蚓对凋落物源碳在土壤团聚体中的分配的影响如图3所示。培养结束后,各粒级土壤团聚体中凋落物源碳含量均提高,接种蚯蚓促进了凋落物源碳向各粒级土壤团聚体中的转化。不同生态类群蚯蚓及其交互作用使凋落物源碳在团聚体中的分布集中在粗大团聚体和细大团聚体中,不同蚯蚓处理下的4种团聚体土壤的δ13C值,都是粉-黏团聚体土壤的δ13C值最低,而细大团聚体最高(T7为粗大团聚体δ13C值最高,细大团聚体次之)。
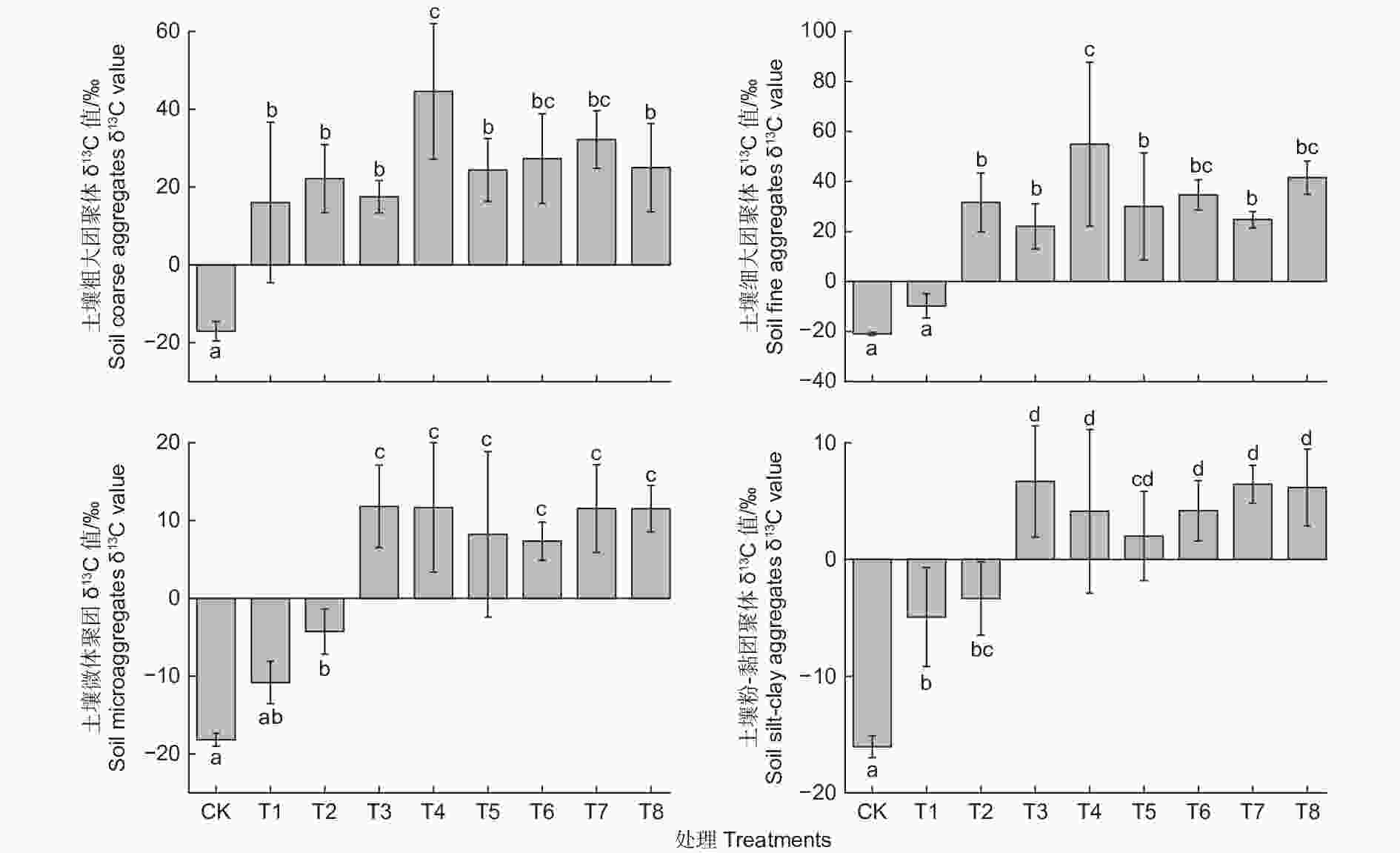
图 3 不同处理下土壤不同粒级团聚体δ13C值的变化
Figure 3. Changes of δ13C values of soil aggregates with different sizes under different treatments
针对不同粒径团聚体,不同的蚯蚓处理所产生的效果也各不相同。粗大团聚体中,与T1不接种蚯蚓相比,除了单独接种威廉环毛蚓对该粒级外源有机碳含量提高效果显著 (p<0.05),其他处理虽也提高了,但是影响不显著;接种蚯蚓的处理之间,T2、T3、T5、T6、T7、T8之间差异不显著,T4和T2、T3、T5、T8差异显著(p<0.05),T4和T6、T7差异不显著,各处理之间的促进效果从高到低依次为:T4>T7>T6>T8>T5>T2>T3。对于细大团聚体,与T1相比,接种了蚯蚓的处理均显著促进了凋落物源碳在其中的分布(p<0.05);而不同蚯蚓处理之间,接种威廉环毛蚓对凋落物源碳在细大团聚体中的分布促进作用更显著(p<0.05)。对凋落物源碳在微团聚体和粉-黏团聚体中的分布,单独接种赤子爱胜蚓对凋落物源碳分布的影响与T1相比差异不显著,其他6种接种蚯蚓处理与T1差异显著(p<0.05),但是6种处理之间差异不显著。蚯蚓交互作用下对凋落物源碳向较大团聚体(d>0.25 mm)中的分布和蚯蚓单独作用下无显著差异,对于凋落物源碳向微团聚体中的分布相较于赤子爱胜蚓单独作用显著提高了。结果表明,在本研究短期培养条件下,接种蚯蚓促进了凋落物源碳向团聚体中的分配,使较少的凋落物源碳进入更小粒级土壤组分中,而更多分布在较大粒级中。不同生态类型蚯蚓单独作用下,接种威廉环毛蚓对凋落物源碳向较大团聚体中分配的促进效果更显著,接种皮质远盲蚓对凋落物源碳向较小团聚体中的分配增加幅度更大;蚯蚓交互作用下,皮质远盲蚓和威廉环毛蚓对凋落物源碳向团聚体中的分配发挥主导作用。
-
蚯蚓通过自身活动及代谢等直接或间接对土壤的性质、土壤养分含量等产生影响[24]。通过添加杨树叶凋落物并培养120 d后,单独接种了赤子爱胜蚓和单独接种皮质远盲蚓的土壤有机碳含量增加,其他蚯蚓处理降低了土壤有机碳含量,但整体来说,接种蚯蚓对土壤总有机碳含量没有显著影响。研究表明,培养5个月后,接种了内生食土性蚯蚓的土壤 C 含量比未接种的更低,蚯蚓活动对碳矿化有净积极影响[25],还有研究表明,接种威廉环毛蚓后,土壤 SOC 含量显著降低[26],这与本实验得到的结果一致。但于建光等[27]的研究表明,接种蚯蚓并添加有机质后,土壤有机碳含量显著增加,这与本实验结果不相符。Zhu等[28]研究发现,接种表栖型蚯蚓对土壤中有机碳的积累有显著的促进作用,这与本实验研究结果相符。本研究还发现,蚯蚓的交互作用并没有提高土壤有机碳的固存,反而可能促进了土壤碳矿化,这可能是因为至少两个生态型蚯蚓的组合意味着蚯蚓的作用既促进了凋落物的破碎,又促进了土壤混合,导致表层植物材料进入矿物土层,这可能触发对 SOC 矿化的激发效应[29]。其次蚯蚓功能多样性的增加表明增加了土壤微生物生物量[30]和活动,而 SOC 的分解在很大程度上是由微生物推动的[31],因此低 SOC 浓度可能与高微生物生物量和高蚯蚓功能多样性下的活动有关。此外,由于本研究是室内培养试验,蚯蚓的食物资源有限,随着有机物料含量的降低,蚯蚓为了寻求食物,活动变得频繁,使得土壤通透性增加,间接影响土壤中微生物活性及有机碳分解等,可能也对实验结果造成一定的影响。
-
蚯蚓对凋落物的分解是土壤中有机质的重要来源之一,其可以通过摄食等直接影响凋落物分解,也可通过改变微生物活性、土壤物理化学性质等间接影响[24, 32]。通过影响凋落物分解,将凋落物有机质留存在土壤中,并基于凋落物碳矿化与稳定之间的平衡影响土壤碳固存。本研究表明,不同生态类群蚯蚓及其交互作用显著促进了凋落物源碳向土壤中的并入,土壤δ13C值显著提高;不同蚯蚓处理之间,单独接种赤子爱胜蚓的效果最小,可能是由于赤子爱胜蚓体型最小,又只在土壤表层活动,对凋落物向土壤中的转化作用有限,而在皮质远盲蚓和威廉环毛蚓参与下,由于这两种蚯蚓取食凋落物和土壤后在土壤较深层次活动,这使得凋落物源碳向土壤中的并入效果更显著。总之,蚯蚓对凋落物源碳向土壤中的并入发挥的重大作用,而且在表栖型和表-内栖型蚯蚓或深栖型蚯蚓的共同作用下,凋落物源碳向土壤中并入的效果更好。
3种生态类型蚯蚓对各粒径水稳团聚体的δ13C值也是提高的,但是提高的效果因处理不同而有差异。凋落物源碳并入到土壤中后的分配,主要集中在粗大团聚体和细大团聚体。有研究表明,蚯蚓促进大团聚体的形成,且土壤大团聚体比微团聚体含有更多新形成的有机物[33],这与本研究结果相符。一些研究外源有机碳在土壤团聚体内的分布的结果表明,培养结束后团聚体土壤的δ13C最小值在>250 µm的团聚体[34],也有研究表明外源有机碳培养后<53 µm团聚体土壤的δ13C值最小,但是δ13C值最大的为53~250 µm团聚体[35],这与本研究结果不同;但吕元春等[36]研究外源有机碳在土壤团聚体中的分配规律表明,外源新碳进入到土壤团聚体中的数量由大到小顺序依次为250~2 000 μm、50~250 μm和<50 μm,这与本实验研究结果相同。导致这种结果差异较大的原因众多,可能是由粒径较大的团聚体由于不够稳定,更容易受到外源凋落物以及土壤动物的影响。
本研究通过对不同生态类型蚯蚓单独作用下土壤团聚体δ13C值的对比发现,威廉环毛蚓对于凋落物源碳向较大团聚体(d>0.25 mm)中的分配促进效果更显著,这与Bossuyt等[37]研究结果相一致,这可能是由于蚯蚓单独作用下,深栖型蚯蚓的取食、钻洞行为更剧烈,会在觅食和排泄期间重新排列和重组土壤团聚结构,产生新的大团聚体,且深栖型蚯蚓倾向于取食高有机质颗粒,这使得凋落物有机碳更多的分配进入较大土壤团聚体。皮质远盲蚓单独作用下相比于另外两种蚯蚓对凋落物源碳向土壤较大团聚体中的分配促进效果最低,但却对凋落物源碳向较小团聚体中的分配促进效果高于另外两种蚯蚓,这可能是表-内栖型蚯蚓主要是通过将新鲜植物凋落物主要结合到大团聚体中,但由于时间较短,形成的团粒结构还不稳定。有研究表明,不同生态类型蚯蚓促进凋落物源碳进入土壤的机制不同,表-内栖型蚯蚓主要通过有机残留物消耗和微生物生物量刺激凋落物分解将凋落物碳结合到土壤中,而深栖型蚯蚓通过形成大的大团聚体和将SOM组分转化为更顽强的形式来稳定已经并入土壤中的有机碳[38]。不同生态型蚯蚓交互作用下,有皮质远盲蚓和威廉环毛蚓参与作用下,更大幅度提高了凋落物源碳在粗大团聚体、微团聚体和粉-黏团聚体中的分配。不同生态类型蚯蚓对于凋落物源碳在较大团聚体中的分配并没有显著差异,皮质远盲蚓和威廉环毛蚓对凋落物源碳在团聚体中的分配发挥主导作用,这可能是由于蚯蚓作用下土壤团聚体虽先形成大团聚体,但不同生态型蚯蚓共同作用下,对资源的竞争,使得内生物种可能会在觅食和排泄活动期间增加对土壤有机质的取食,重构土壤团聚体结构,且表生蚯蚓作为碳输入部分,将有机质转化进土壤中后,由内生型蚯蚓来实现有机碳在土壤中的进一步稳定[39-40],所以凋落物源碳向土壤团聚体中的分配受到内生型蚯蚓的主导。
-
短期培养内,不同生态类型蚯蚓及其交互作用对土壤总有机碳含量并无显著影响。然而,本研究发现接种蚯蚓促进了凋落物源碳向土壤中的并入与分配,提高了土壤中新碳的含量。相比于表栖型蚯蚓单独作用,由于表-内栖型蚯蚓和深栖型蚯蚓的活动土层更深,体型更大,使得凋落物源碳向土壤中的并入效果更好。
在蚯蚓的作用下,大部分的凋落物源碳固存在粗大团聚体和细大团聚体中,粗大团聚体和细大团聚体对于新碳的积累贡献更大。不同生态类型蚯蚓单独作用下,深栖型蚯蚓对于凋落物源碳向较大团聚体(d>0.25 mm)中的分配促进效果更显著,表-内栖型蚯蚓对凋落物源碳向较小团聚体(d≤0.25 mm)中的分配提升幅度更高;蚯蚓交互作用下,表-内栖型和深栖型蚯蚓对凋落物源碳在团聚体中的分配发挥主导作用。总之,表-内栖型蚯蚓和深栖型蚯蚓更明显的加速了外源有机质在土壤中的固持,且凋落物源碳被固定在粒径较大的团聚体中。
不同生态类群蚯蚓对凋落物源碳在土壤团聚体中的分配的影响
Effects of Different Ecological Groups of Earthworms on the Distribution of Litter into Aggregates
-
摘要:
目的 通过研究不同生态型蚯蚓作用下凋落物源碳在土壤中的转化与分配规律,揭示凋落物源碳在土壤中的去向,为深入探究蚯蚓对杨树人工林土壤固碳增汇潜力的影响提供理论依据和数据支撑。 方法 应用脉冲标记法标记富集13C的杨树幼苗叶片;接种3种不同生态型蚯蚓,通过室内短期培养试验(室温25℃,培养120 d),研究不同生态型蚯蚓作用下凋落物源碳在粗大团聚体(d>2 mm)、细大团聚体(2 mm≥d>0.25 mm)、微团聚体(0.25 mm≥d>0.053 mm)和粉-黏团聚体(d≤0.053 mm)4个粒径级别的水稳性团聚体中的分配。 结果 接种蚯蚓后,显著促进了凋落物源碳向土壤中的并入与分配,土壤δ13C值显著提高,单独接种表栖型蚯蚓提升的幅度最低,表栖型和表-内栖型共同作用提升的幅度最高;不同粒级土壤水稳性团聚体的δ13C值在蚯蚓的作用下均显著升高;4种土壤团聚体的δ13C值,都是粉-黏团聚体的最低,粗大团聚体和细大团聚体中最高,接种赤子爱胜蚓对凋落物向土壤团聚体中并入作用效果低于接种皮质远盲蚓和威廉环毛蚓。 结论 120 d的短期培养内,不同生态型蚯蚓作用显著促进凋落物源碳向土壤中的并入与分配,更是显著增加了凋落物源碳在粗大团聚体和细大团聚体中的积累,且在表-内栖型蚯蚓和深栖型参与作用下,更显著提高了凋落物源碳向团聚体中的分配。建议可以在林业生产经营过程中适当增加林木凋落物残体的施用,同时考虑不同生态型蚯蚓之间的协同和竞争作用,接种多种类型蚯蚓以改善或增强蚯蚓调节林业生态系统中土壤有机碳(SOC)动态的潜能,加速土壤中外源有机质向土壤中的并入与分配。 Abstract:Objective By studying the transformation and distribution patterns of litter-derived carbon in soil under the action of different ecotypes of earthworms, providing theoretical basis and data support for exploration of the impact of earthworms on the carbon sequestration and sink enhancement potential of soil in poplar plantations. Methods The leaves of poplar seedlings enriched with 13C were marked by pulse labeling method. Three different ecotypes of earthworms were inoculated to study the distribution of litter source carbon in water-stable aggregates of coarse aggregates (d>2 mm), fine aggregates (2≥d>0.25 mm), microaggregates (0.25≥d>0.053 mm) and silt-clay aggregates (d≤0.053 mm) under the action of different ecotypes of earthworms. Results After inoculation of earthworms, the incorporation and distribution of litter source carbon into the soil were significantly promoted, and the soil δ13C value was significantly increased. The enhancement range of epigeic earthworms was the lowest, in contrast, that of epi-endogeic and anecic types was the highest. The δ13C values of soil water stable aggregates of different particle sizes increased significantly under the action of earthworms. The δ13C values of four kinds of soil aggregates were the lowest in silt-clay aggregates, and the highest in coarse aggregates and fine aggregates. The effect of Eisenia foetida on the incorporation of litter into soil aggregates was lower than that of Amynthas corticis and Pheretima guillelmi. Conclusion After 120 days of short-term culture, different ecotypes of earthworms significantly promotes the incorporation and distribution of litter-derived carbon into the soil, and significantly increases the accumulation of litter source carbon in coarse aggregates and fine aggregates. With the participation of epi-endogeic and anecic types, the distribution of carbon to aggregates from litter is significantly increased. We suggest that the application of forest litter residues should be appropriately increased in the process of forestry production and management, and the cooperation and competition among different ecotypes of earthworms should be taken into account. Multiple types of earthworms should be inoculated to improve or enhance the potential of earthworms to regulate soil organic carbon (SOC) dynamics in the forestry ecosystem, accelerating the incorporation and distribution of exogenous organic matter into the soil. -
Key words:
- earthworms
- / ecological groups
- / soil aggregates
- / litter-derived carbon
- / δ13C
-
[1] 汪业勖, 赵士洞, 牛 栋. 陆地土壤碳循环的研究动态[J]. 生态学杂志, 1999, 18(5):29-35. [2] 金 峰, 杨 浩, 赵其国. 土壤有机碳储量及影响因素研究进展[J]. 土壤, 2000(1):12-18. [3] 李常准, 陈立新, 段文标, 等. 凋落物处理对不同林型土壤有机碳全氮全磷的影响[J]. 中国水土保持科学, 2020, 18(1):100-109. [4] 胡肄慧, 陈灵芝, 陈清朗, 等. 几种树木枯叶分解速率的试验研究[J]. 植物生态学与地植物学学报, 1987, 11(2):124-132. [5] WANG B, BLONDEEL H, BAETEN L, et al. Direct and understorey-mediated indirect effects of human-induced environmental changes on litter decomposition in temperate forest[J]. Soil Biology and Biochemistry, 2019, 138: 107579. doi: 10.1016/j.soilbio.2019.107579 [6] 代松家, 周晨霓, 段 斐, 等. 组分和生境差异对藏东南原始冷杉林凋落物分解和养分释放特征的影响[J]. 中国水土保持科学(中英文), 2020, 18(6):72-80. [7] HEIM A, FREY B. Early stage litter decomposition rates for Swiss forests[J]. Biogeochemistry, 2004, 70(3): 299-313. doi: 10.1007/s10533-003-0844-5 [8] DJUKIC I, KEPFER-ROJAS S, SCHMIDT I K, et al. Early stage litter decomposition across biomes[J]. Science of the Total Environment, 2018, 628-629: 1369-1394. doi: 10.1016/j.scitotenv.2018.01.012 [9] 鲁 昱, 崔莎莎, 李文洋, 等. 三种常见挺水植物凋落物的分解动态及养分释放规律[J]. 植物科学学报, 2023, 41(1):17-25. [10] 梁嘉玲, 莫维维, 陆湘云, 等. 海岸带3种林分类型凋落物-土壤-酶活性动态变化[J]. 森林与环境学报, 2022, 42(5):521-528. [11] 牛喜妹, 李佳南, 王 平, 等. 羊草地上不同性状凋落物分解对土壤碳组分的影响[J]. 环境生态学, 2022, 4(9):54-60. [12] BA Z D, GEER T, DU H S, et al. Effects of different litter treatments on soil microbial biomass carbon and nitrogen in temperate grassland[J]. Journal of Biotech Research, 2022, 13: 260-268. [13] LUAN J W, LI S Y, DONG W, et al. Litter decomposition affected by bamboo expansion is modulated by litter-mixing and microbial composition[J]. Functional Ecology, 2021, 35(11): 2562-2574. doi: 10.1111/1365-2435.13911 [14] ANGST G, POKORNY J, MUELLER C W, et al. Soil texture affects the coupling of litter decomposition and soil organic matter formation[J]. Soil Biology and Biochemistry, 2021, 159(1): 108302. [15] 周庭宇, 肖 洋, 黄庆阳, 等. 森林凋落物分解的研究进展与展望[J]. 中国农学通报, 2022, 38(33):44-51. [16] 邓承佳, 袁 访, 卜通达, 等. 土壤动物对黔中地区喀斯特森林凋落物分解的影响[J]. 林业科学研究, 2022, 35(3):72-81. [17] 董学德, 高 鹏, 李 腾, 等. 土壤微生物群落对麻栎-刺槐混交林凋落物分解的影响[J]. 生态学报, 2021, 41(6):2315-2325. [18] 单 军, 季 荣. 土食性大型土壤动物转化土壤有机碳的14C示踪法应用研究进展[J]. 土壤, 2008, 40(6):863-871. [19] HUANG W, GONZÁLEZ G, ZOU X. Earthworm abundance and functional group diversity regulate plant litter decay and soil organic carbon level: A global meta-analysis[J]. Applied Soil Ecology, 2020, 150: 103473. doi: 10.1016/j.apsoil.2019.103473 [20] 李发东, 栗照鑫, 乔云峰, 等. 土壤有机碳同位素组成在农田生态系统碳循环中的应用进展[J]. 中国生态农业学报(中英文), 2023, 31(2):194-205. [21] BAHN M, LATTANZI F A, HASIBEDER R, et al. Responses of belowground carbon allocation dynamics to extended shading in mountain grassland[J]. New Phytologist, 2013, 198(1): 116-126. doi: 10.1111/nph.12138 [22] ZHANG W X, HENDRIX P F, DAME L E, et al. Earthworms facilitate carbon sequestration through unequal amplification of carbon stabilization compared with mineralization[J]. Nature Communications, 2013, 4(10): 2576. [23] SIX J, CALLEWAERT P, LENDERS S, et al. Measuring and understanding carbon storage in afforested soils by physical fractionation[J]. Soil Science Society of America Journal, 2002, 66(6): 1981-1987. doi: 10.2136/sssaj2002.1981 [24] 康玉娟, 武海涛. 蚯蚓对土壤碳氮循环关键过程的影响及其机制研究进展[J]. 土壤与作物, 2021, 10(2):150-162. [25] COQ S, BARTHES B G, OLIVER R, et al. Earthworm activity affects soil aggregation and organic matter dynamics according to the quality and localization of crop residues - An experimental study (Madagascar)[J]. Soil Biology and Biochemistry, 2007, 39(8): 2119-2128. doi: 10.1016/j.soilbio.2007.03.019 [26] ZHENG Y, WANG S, BONKOWSKI M, et al. Litter chemistry influences earthworm effects on soil carbon loss and microbial carbon acquisition[J]. Soil Biology and Biochemistry, 2018, 123: 105-114. doi: 10.1016/j.soilbio.2018.05.012 [27] 于建光, 胡 锋, 李辉信, 等. 接种蚯蚓对土壤团聚体分布、稳定性及有机碳赋存的影响[J]. 水土保持学报, 2010, 24(3):175-179 + 184. [28] ZHU X Y, HU Y C, WANG W, et al. Earthworms promote the accumulation of maize root-derived carbon in a black soil of Northeast China, especially in soil from long-term no-till[J]. Geoderma, 2019, 340: 124-132. doi: 10.1016/j.geoderma.2019.01.003 [29] HOANG D T T, BAUKE S L, KUZYAKOV Y, et al. Rolling in the deep: Priming effects in earthworm biopores in topsoil and subsoil[J]. Soil Biology and Biochemistry, 2017, 114: 59-71. doi: 10.1016/j.soilbio.2017.06.021 [30] FERLIAN O, EISENHAUER N, AGUIRREBENGOA M, et al. Invasive earthworms erode soil biodiversity: A meta-analysis[J]. Journal of Animal Ecology, 2018, 87(1): 162-172. doi: 10.1111/1365-2656.12746 [31] LUBBERS I M, VAN GROENIGEN K J, FONTE S J, et al. Greenhouse-gas emissions from soils increased by earthworms[J]. Nature Climate Change, 2013, 3(3): 187-194. doi: 10.1038/nclimate1692 [32] 徐 璇, 王维枫, 阮宏华. 土壤动物对森林凋落物分解的影响: 机制和模拟[J]. 生态学杂志, 2019, 38(9):2858-2865. [33] SIX J, PAUSTAIN K, ELLIOT E T, et al. Soil structure and organic matter: I. Distribution of aggregate-size classes and aggregate-associated carbon[J]. Soil Science Society of America Journal, 2000, 64(2): 681-689. doi: 10.2136/sssaj2000.642681x [34] 慈 恩, 杨林章, 马 力, 等. 长期耕作水稻土的有机碳分布和稳定碳同位素特征[J]. 水土保持学报, 2007, 21(5):72-75 + 179. [35] 李涵诗, 毛艳玲, 邹双全. δ13C标记林木残体碳在土壤团聚体中的分布[J]. 土壤学报, 2017, 54(4):1038-1046. [36] 吕元春, 薛丽佳, 尹云锋, 等. 外源新碳在不同类型土壤团聚体中的分配规律[J]. 土壤学报, 2013, 50(3):534-539. [37] BOSSUYT H, SIX J, HENDRIX P F. Interactive effects of functionally different earthworm species on aggregation and incorporation and decomposition of newly added residue carbon[J]. Geoderma, 2006, 130(1-2): 14-25. doi: 10.1016/j.geoderma.2005.01.005 [38] WU J T, LI H Q, ZHANG W X, et al. Contrasting impacts of two subtropical earthworm species on leaf litter carbon sequestration into soil aggregates[J]. Journal of Soils and Sediments, 2017, 17(6): 1672-1681. doi: 10.1007/s11368-017-1657-9 [39] BOSSUYT H, SIX J, HENDRIX P F. Protection of soil carbon by microaggregates within earthworm casts[J]. Soil Biology and Biochemistry, 2005, 37(2): 251-258. doi: 10.1016/j.soilbio.2004.07.035 [40] YAVITT J B, FAHEY T J, SHERMAN R E, et al. Lumbricid earthworm effects on incorporation of root and leaf litter into aggregates in a forest soil, New York state[J]. Biogeochemistry, 2015, 125(2): 261-273. doi: 10.1007/s10533-015-0126-z -




 下载:
下载: