-
近三十年,植物多样性与生产力的关系受到非常大的重视,研究二者的关系,有助于更好地保护和恢复生态系统稳定性[1]。目前植物多样性-生产力关系的研究主要关注的是地上生产力的提高及其驱动机制[2],例如,混交林的地上生产力显著高于纯林,这符合生态位互补假说[3-4]。而植物多样性对根生物量的影响还没有统一定论[5],可能与植物根性状或菌根类型有关,但缺乏相关证据。
在植物根系中,细根(直径<2.0 mm)对植物的生长发育起着决定性的作用。根据细根结构与功能的关系,将其分为吸收根(即位于根系末端非木质化的具有较厚皮层细胞,执行土壤资源获取功能的根系)和运输根(即具有明显次生结构且木质化程度较高,执行土壤资源运输功能的根系)[6]。陆地上90%以上的植物会与土壤真菌形成共生关系,称之为菌根[7]。目前分布最广研究较多的两种菌根类型主要是丛枝菌根(arbuscular mycorrhiza, AM)和外生菌根(ectomycorrhiza, EM),但这两种类型菌根由于其进化历史和侵染根的方式不同,使其侵染植物的根性状有所不同[8]。其中,AM真菌早在4亿年前就已经出现[9],而且其主要侵染根的皮层,所以根直径粗、皮层厚,有利于AM真菌侵染;而EM真菌则是在AM真菌之后,主要是在白垩纪期间随着土壤矿质风化程度增加而出现的,其菌丝不进入根细胞内,主要在根表皮周围包裹菌丝形成菌丝鞘,所以其侵染的植物根直径通常较细[10]。此外,之前的研究发现根形态性状(如根直径、比根长)和构型性状(如根分支强度和分支比)对环境变化的响应程度不同[11]。然而,植物多样性是否以及如何影响不同菌根植物的根性状变化仍不清楚。
尽管有研究表明,植物多样性能够通过改变吸收根性状的变化来增加植物获取土壤资源的能力和效率,然而,实证研究报道了根性状对植物多样性有不同的响应趋势[12]。例如,植物多样性增大能增加比根长[13],因为单位生物量成本下,比根长的增加能提高植物对土壤资源获取的有效性[14]。但是也有研究表明,植物多样性增大对比根长没有显著影响[15]或者有负效应[16]。同样地,植物多样性增大对根直径、根长密度和根氮浓度的影响也有不同的趋势[11]。造成不同研究结果的可能原因,之前的研究只考虑了物种丰富度、立地环境或生态类型,并未考虑植物菌根类型的影响。
为深入理解菌根类型和植物多样性对吸收根功能性状的影响,本研究在江西省新岗山选择8种树种,包括枫香(Liquidambar formosana Hance.)、南酸枣(Choerospondias axillaris (Roxb.) B. L. Burtt & A. W. Hill)、无患子(Sapindus saponaria Linn.)、蓝果树(Nyssa sinensis Oliv.)、乌桕(Triadica sebifera (Linnaeus) Roxb.)、锥栗(Castanea henryi (Skan) Rehder & E. H. Wilson)、短柄枹栎(Quercus serrata var. brevipetiolata (A.DC.) Nakai.,Qs)和苦槠(Castanopsis sclerophylla (Lindl.) Schottky),对8种树种分别进行单独种植(单种)和所有树种混合种植(混种)处理,通过测定吸收根(前两级根)的7个功能性状,包括:(i)形态性状:根直径(RD)、单根长度(IRL)、比根长(SRL)和根组织密度(RTD);(ii)构型性状:根分支强度(BrI)和分支比(BrR);(iii)菌根真菌侵染率(MC),旨在解决以下科学问题:(1)菌根类型和种植方式对不同根性状有何影响?(2)不同菌根树种根性状对种植方式的响应趋势是否一致?(3)混种如何影响不同菌根树种吸收根功能性状的可塑性变化?
-
研究区位于江西省德兴市新岗山镇(27°48′~29°42′ N,116°13′~118°29′ E),该区域属典型亚热带季风性湿润气候,自然植被以亚热带常绿落叶阔叶混交林为主。年均温为16.7 ℃,最冷月1月的均温为0.4 ℃,最热月7月的均温为34.2 ℃,年均降水量为1 821 mm,海拔为105~275 m[17-18]。
-
本试验基于中国亚热带森林生物多样性与生态系统功能研究平台,实验地主要分两个样地(样地A和样地B)。样地A建于2009年,以667 m2(25.8 m × 25.8 m)为样方进行幼苗种植,每个样方的株行距均为1.29 m,相当于400株·(667 m2)-1(20行 × 20列)幼苗的密度[19]。本研究从样地A选择了8个树种的单独种植(简称“单种”)和8个树种全部随机混合种植(简称“混种”)的处理样方,共9个处理,每个处理设置3个重复;对混种的样方来说,每个树种种植50株幼苗,8种树种共400株幼苗。本研究选择的8个树种根据Soudzilovskaia等[20]判定所选的8种树种中5种为AM树种(枫香、南酸枣、无患子、蓝果树、乌桕),3种为EM树种(锥栗、短柄枹栎和苦槠)。
-
2018年8月,在9个样方根据Guo等[21]的方法采集根系样品。每个样地内的每个树种随机选择4棵树,主要在表层土(0~20 cm)沿着树木根基部仔细地挖掘细根,每棵树的根样品挑选5~8个完整根系,小心清理掉根表面土壤和杂质,装入自封袋贴上标签,24 h内运回实验室后放在冰柜−20 ℃保存,用于测定根性状。
在实验室内,将采集的根系样品用去离子水仔细清洗干净,按照Pregitzer等[22]根系分级方法进行根系分级。本研究主要关注的是1、2级根,将其统称为吸收根[6],因为以前的研究表明,树种的前两级根主要被菌根真菌侵染,主要执行资源获取的功能[21-22]。
根性状的测定:将1、2级根分别平铺在装有蒸馏水的透明塑料盘,用爱普生扫描仪(Epson Expression 10000 XL desktop scanner, Suwa, Japan)在400 dpi分辨率下扫描,扫描后的图片用根系分析软件WinRHIZO (Regent Instruments, 加拿大魁北克)分别获得1、2级根的平均直径/mm、根体积/cm3、根数量和总根长度/m,之后根样品在60 ºC下烘干至质量恒定,获取各级根的干质量/g。分别计算各级根的比根长(对应根级的总根长度除以其总干质量)/(m·g−1)、根组织密度(对应根级的总干质量除以其体积)/(g·m−3)和单根长度(对应根级的总根长度除以其根数量)/cm;所有1、2级根的这些根性状的平均值为吸收根对应的根性状值。根分支强度为1级根的数量除以2级根的单根长度;根分支比为2级根的数量除以1级根的数量。
丛枝菌根真菌侵染率的测定:吸收根样品浸泡于10%(质量/体积)的氢氧化钾溶液中在90 ℃下软化50 min后,在室温下用2%的盐酸酸化5 min,再用0.05%的酸性品红(1.2 g品红溶于体积比为1∶1∶1的甘油、10%的乳酸和去离子水混合溶液中)染色,染色完成的根段,随机选取100条1~2级根系在显微镜下用十字交叉法(line-intersect)来测定丛枝菌根真菌侵染率,观测到的丛枝、囊泡以及没有格的粉色菌丝,均被认为有丛枝菌根真菌侵染,其侵染率计算为侵染的吸收根数量除以观测的总根数量[23-24]。
外生菌根真菌侵染率的测定:每个处理随机选择100~150个吸收根样品,在显微镜下观察是否被外生菌根真菌侵染,被侵染的根样品呈现出黄褐色到金黄色的肿胀形态,其侵染率计算为被侵染的根数量除以观测的总根数量[25]。
-
用SPSS (版本23.0, SPSS, Chicago, USA)的双因素方差分析比较树种种植方式、菌根类型及其交互作用对根性状的影响。用独立样本T检验分别比较根性状在单种与混种间、AM和EM树种间的差异。采用单因素方差分析比较每个树种在单种和混种下的根性状差异。采用Pearson相关性分析检验不同根性状及侵染率之间的关系。计算每个树种在单种和混种下不同根性状的可塑性指数(plasticity index, PI)[26]。
$ \text{}\text{可塑性指数}{PI=}\frac{{Trait}_{\text{mix}}-{Trait}_{\text{mono}}}{\text{Trait}_{\text{mono}}}\text{ × 100\%} $
其中,Traitmono是单种下树种的根性状,Traitmix是混种下树种的根性状。
-
双因素方差分析结果表明,种植方式对根组织密度和根构型性状(根分支强度和根分支比)有显著影响(p< 0.05),对其他根性状和菌根侵染率无显著影响。而菌根类型对所有根性状均有显著影响,但是种植方式和菌根类型对所有根性状均没有交互影响(表1)。
表 1 种植方式和菌根类型对根性状影响的双因素方差分析
Table 1. Results of two-way ANOVA for the effects of planting method and mycorrhizal type on root traits
根性状Root traits 种植方式
Planting method (P)菌根类型
Mycorrhizal type (M)种植方式 × 菌根类型
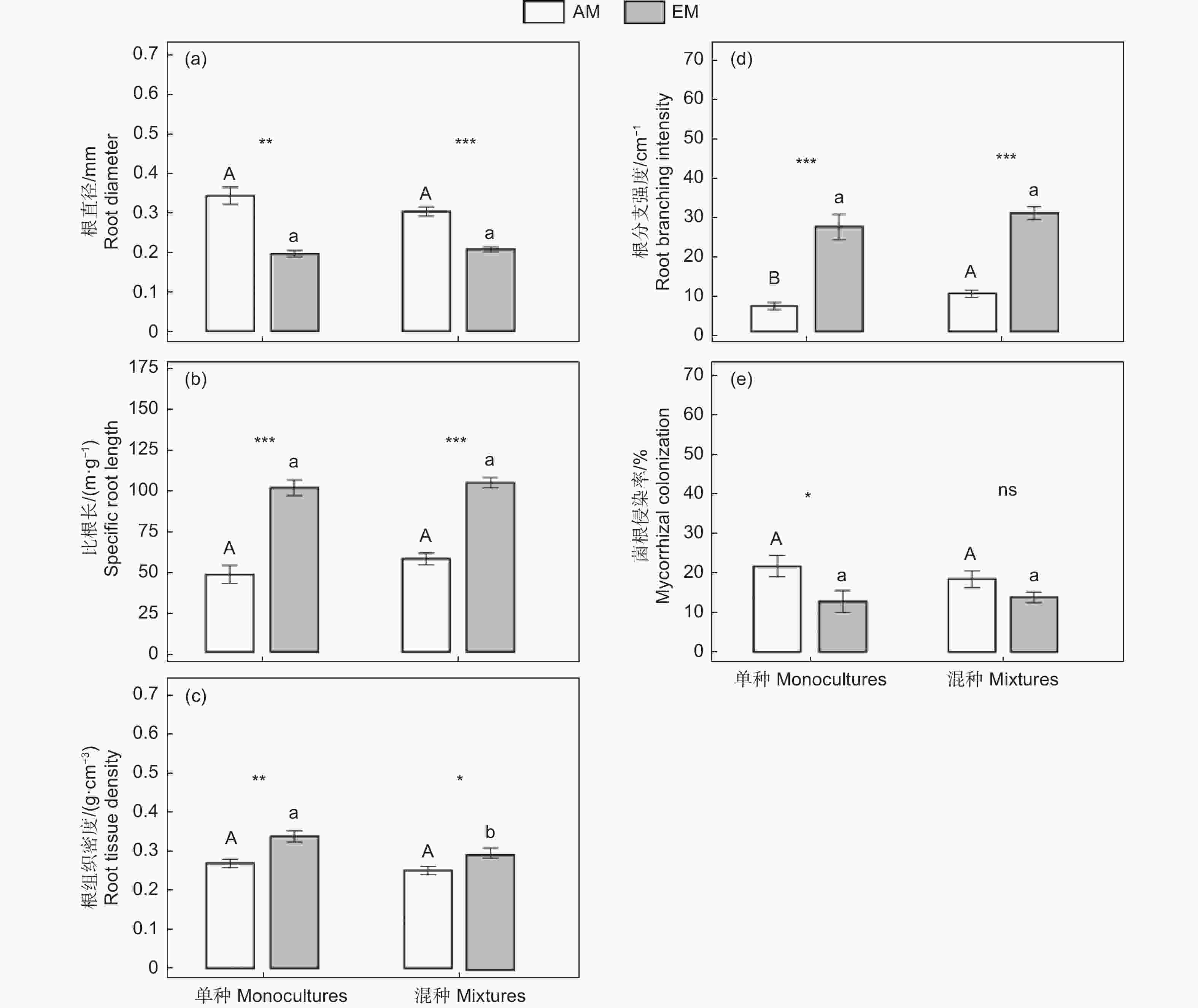
P × MF p F p F P 根形态性状 Root morphological traits 根直径 RD 0.79 0.379ns 56.0 <0.001*** 2.48 0.123ns 比根长 SRL 1.75 0.193ns 108 <0.001*** 0.47 0.498ns 根组织密度 RTD 5.59 0.023* 19.7 <0.001*** 0.91 0.347ns 单根长度 IRL 2.85 0.098ns 34.7 <0.001*** 3.12 0.084ns 根构型性状 Root architectural traits 根分支强度 BrI 4.42 0.041* 157 <0.001*** 0.01 0.946ns 根分支比 BrR 5.65 0.022* 49.0 <0.001*** 1.56 0.218ns 菌根侵染率 MC 0.19 0.668ns 7.09 0.011* 0.74 0.395ns 注/Notes:RD: root diameter; SRL: specific root length; RTD: root tissue density; IRL: individual root length; BrI: branching intensity; BrR: branching ratio; MC: mycorrhizal colonization; ***: p<0.001; **: p<0.01; *: p<0.05; ns: p>0.05.下同/The same below 具体而言,无论单种还是混种条件下,AM树种的根直径显著高于EM树种,而比根长、根组织密度、根分支强度均显著低于EM树种(图1)。菌根侵染率则是单种下AM树种显著高于EM树种,而混种下两类菌根树种间无显著差异(图1e)。此外,与单种相比,混种下AM树种根分支强度显著增加(图1d),其他根性状则无显著变化;混种下EM树种则只有根组织密度显著降低(图1c)。
相对于单种下,AM树种在混种的变化趋势不同,但EM树种在混种下的根性状都呈现上升趋势(根组织密度除外)。
-
与单种相比,混种下AM树种中乌桕和蓝果树的根直径分别降低21%和32%(图2a);比根长是蓝果树和EM树种中锥栗分别增加53%和17%(图2b);根组织密度是AM树种中枫香和EM树种中锥栗分别降低31%和33%(图2c)。根分支强度是AM树种中南酸枣、无患子,以及EM树种中锥栗分别增加40%、48%和47%(图2d)。不同树种的菌根侵染率在单种和混种下变异趋势有所不同,尽管相比较单种,大多数树种在混种下菌根侵染率有降低趋势,但是AM树种的南酸枣和EM树种的短柄枹栎却是混种下分别显著增加46%和73% (图2e)。
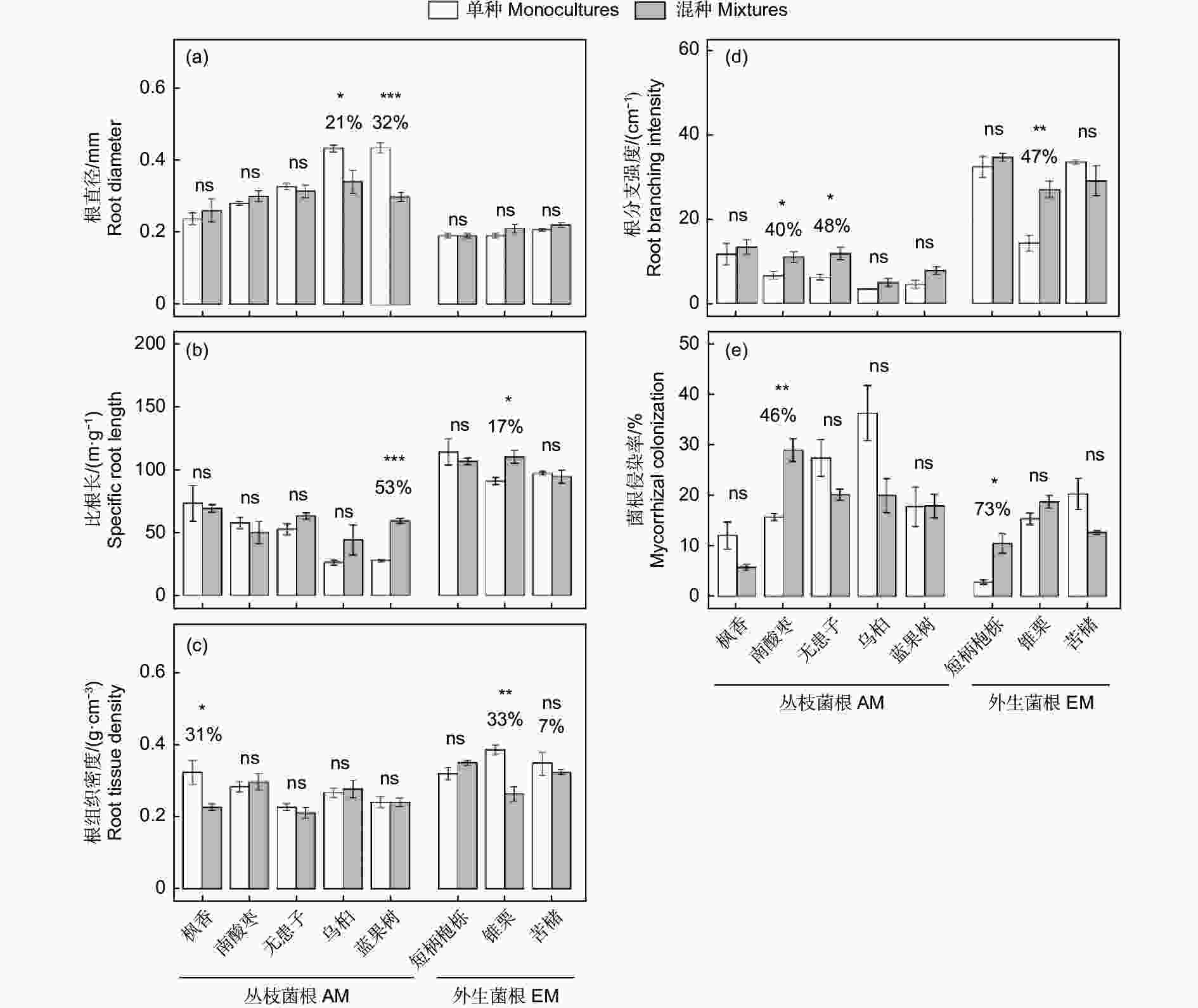
图 2 丛枝菌根和外生菌根树种在单种和混种下的根性状变化
Figure 2. The changes in root traits between monoculture and mixture for arbuscular mycorrhizal (AM) and ectomycorrhizal (EM) tree species
综上所述,AM树种主要通过增加根分支来适应共生环境,而EM通过增加根直径来适应共生环境。
-
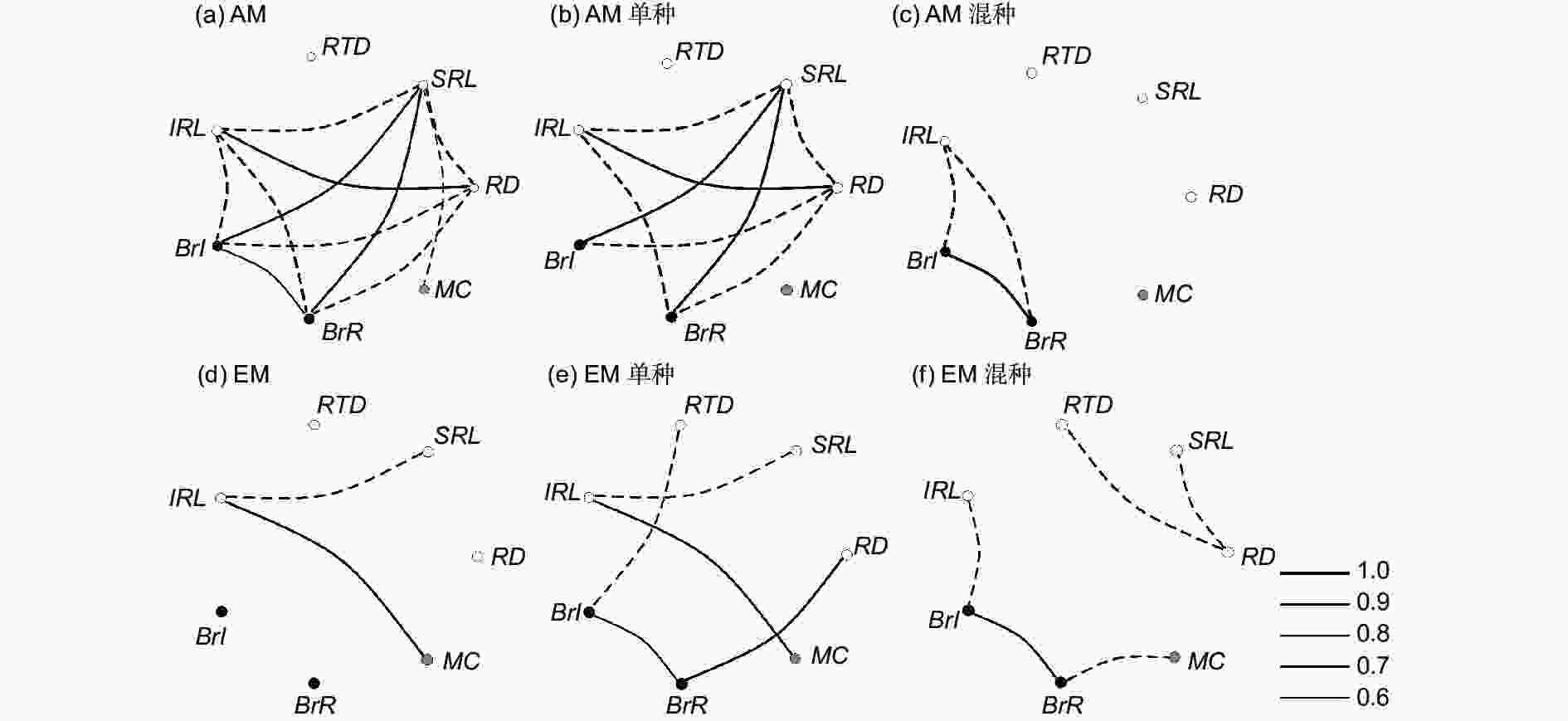
通过对树种的不同根性状及菌根侵染率进行相关性分析,结果表明:除混种外,其他条件下AM树种的根性状间相关性程度均比EM树种高(图3);且AM所有树种和EM所有树种的单根长度和比根长都成显著负相关(图3a、d),且在单种情况下呈现相同的趋势(图3b、e)。在混种情况下,根分支强度与单根长度均是显著负相关,但与根分支比是正相关(图3c、f)。AM树种不管在所有种、单种还是混种情况下,根组织密度与其他根性状都没有显著性关系;单根长度与根分支比呈显著负相关(图3a~c)。在EM单种和混种情况下,根分支强度与根分支比呈显著正相关,但在所有种下没有相关性;同时,比EM所有种下的相关性强度大(图3d~f)。菌根侵染率与不同根性状的相关性在不同条件下差异较大,在AM单种和混种情况下都没有相关性,但在所有种下只与比根长呈负相关(图3a);在EM所有种和单种下,菌根侵染率与单根长度呈正相关,但在混种下只与根分支比呈负相关(图3d~f)。
-
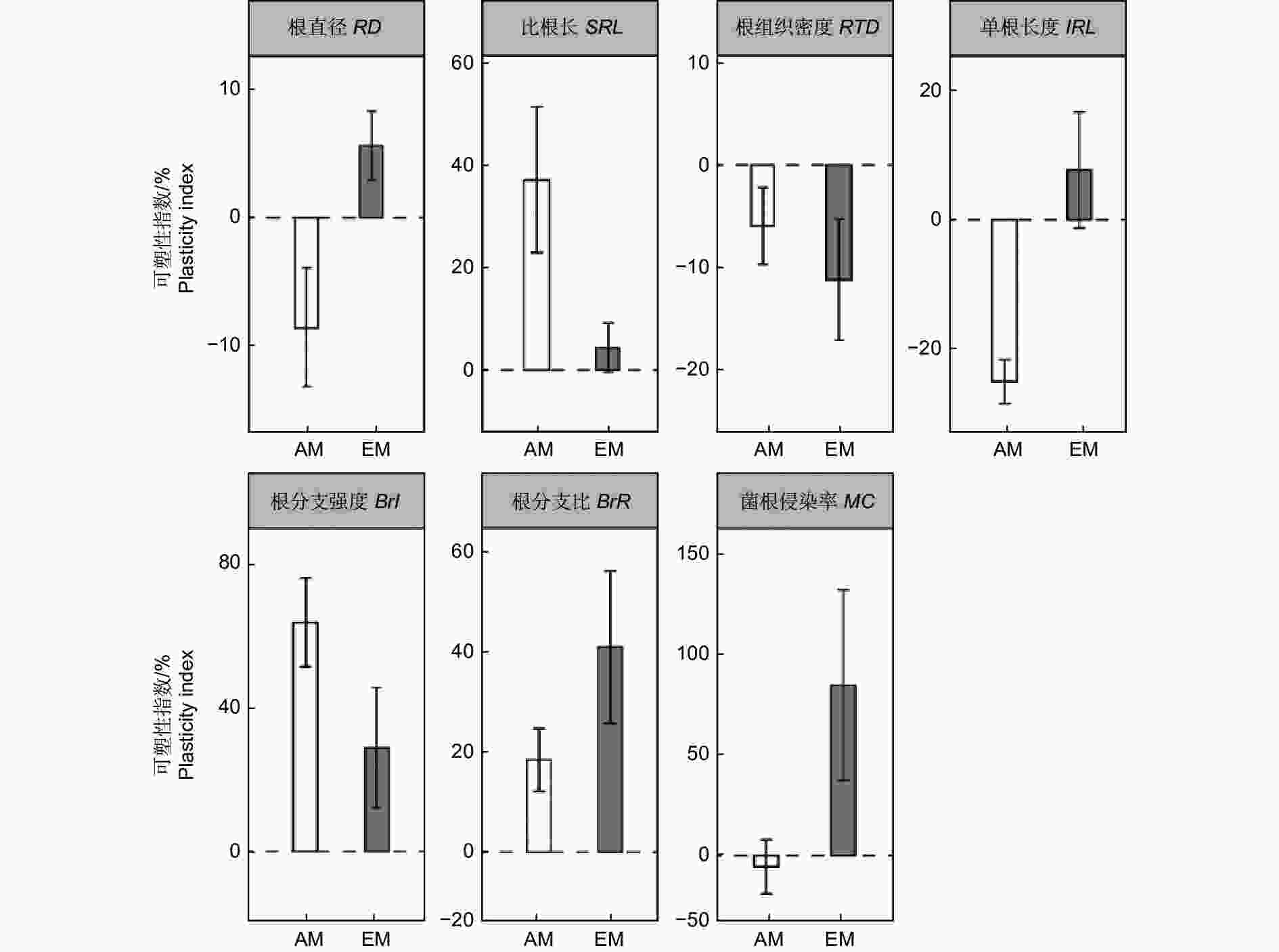
AM树种的根直径和单根长度的可塑性指数均是混种低于单种,而EM树种则是相反的趋势。相比较单种,混种下AM树种的比根长、根分支强度和根分支比的可塑性指数均增加,EM树种在混种下则是根分支比增加,根组织密度降低。对于菌根侵染率,AM树种在混种下降低,EM树种在混种下升高。(图4)。
-
本研究表明,树种的菌根类型对不同根性状均有显著影响(表1),其中,AM树种的根直径显著高于EM树种,比根长则相反(图1),这与之前的很多研究结果一致[10,27-28]。一方面是因为不同菌根真菌侵染根的方式不同,例如,AM真菌主要侵染根的皮层细胞,在细胞内形成丛枝或泡囊结构,因此根直径粗、皮层较厚,有助于AM真菌侵染;而EM真菌主要在根尖周围包裹菌丝,形成菌丝鞘或哈氏网,而且EM真菌外延菌丝能增加根系的吸收面积和范围,因此植物不需要花费高的成本来构造直径粗的根[29]。另一方面是因为不同菌根真菌进化时间不同,例如,AM真菌早在真正的根出现之前就已经存在,所以更倾向于侵染进化早期树种的根直径,而研究也表明进化早期树种的根直径更粗;EM真菌则是在AM真菌出现后,随着环境条件的改善而出现,所以更倾向于侵染进化晚期树种的根直径,而进化晚期树种的根直径则较细[9,30]。此外,与AM树种对比,EM树种的根组织密度较高,这可能是因为EM树种的根直径较细,皮层较薄,相应的维管束的比例较大,从而导致根组织密度较大[10]。
另外,本研究发现,EM树种的根分支强度和分支比均显著高于AM树种(图1),这可能是因为EM真菌主要侵染根尖,因此,根分支强度和分支比高,相对应的根尖数量多,有利于EM真菌侵染;而且之前的研究也表明EM树种的养分获取策略更多的是依赖菌根真菌,也就是“菌丝生长策略”[28]。相反,AM树种则主要依赖根生长来获取土壤资源,即“根生长策略”[28,31],正如本研究结果表明的AM树种的比根长与根分支强度和分支比均有显著的正相关关系(图3c),可见此类菌根树种增加根生长可能是通过增加根分支和根数量来实现;而且有研究也表明根分支强度和分支比对土壤养分环境变化的响应更为敏感[24]。另外,之前的研究发现不同AM树种在利用吸收根和菌根真菌获取土壤资源时,存在权衡策略,即吸收根直径更细的树种倾向于利用吸收根获取土壤资源,而吸收根直径更粗的树种则倾向于利用菌根真菌获取土壤资源[31,24]。同样地,我们的研究结果也表明AM树种的比根长与菌根真菌侵染率呈现显著负相关关系(图3)。此外,相比较AM树种,EM树种的根性状变异程度和性状间的相关性均较低(图3)。这也侧面反应了EM树种可能更多地依赖共生真菌获取土壤资源,从而减弱了自身根性状的变异及其联系。尽管本研究的3个EM树种均来自壳斗科,可能会影响EM树种根性状的变异度;但是Kong等[10]对96个亚热带森林树种进行研究,发现直径最细的鼎湖血桐(Macaranga sampsonii Hance)和直径最粗的黄桐(Endospermum chinense Benth.)均来自大戟科(Euphorbiaceae),但其直径相差约14倍,可见,同一个科的树种其根性状也可能存在巨大差异。
-
本研究结果表明尽管根性状变异度在单种和混种间的趋势基本一致,但种植方式对根组织密度和根构型性状有显著影响(表1),这可能是因为根组织密度表征植物根系的投资成本和生长策略[32],根构型性状则对环境变化的响应更为敏感[24],因此,混交林植物种间作用主要是调整根组织密度和构型性状来作出响应。另外,本研究也发现种植方式对AM和EM树种的根性状有不同的影响(图1、2)。例如,相比较单一栽培种植,混交林显著降低EM树种的根组织密度(图1c),同时显著增加AM树种的根分支强度(图1d)。这可能是因为不管是AM树种还是EM树种,相比较纯林,混交林选择将更多的碳分配到地上部分,提高地上部分生产力[33-34],而地下部分仍有较高的养分获取效率来维持地上部分对养分和水分的需求[35],但是不同菌根树种地下部分获取土壤资源的策略不同[28]。
本研究表明单种下AM树种的菌根侵染率显著高于EM树种,但是混种下两类菌根树种的菌根侵染率则无显著差异(图1e),可见,混种下EM树种可能更多地依赖菌根真菌获取土壤资源。正如本研究发现混种下EM树种的根组织密度显著低于单种(图1c),可能是因为混种下EM树种选择降低根构造的碳投入,而是将碳成本投资在菌根真菌上来获取土壤资源,之前的研究也表明植物在根和菌根真菌的碳投资上存在权衡策略[7]。AM树种由于种间根性状和菌根侵染率变化趋势不同,因此具有多样性的地下资源获取策略。例如本研究的蓝果树在混交林下根直径显著降低,比根长显著增加,菌根侵染率则无显著变化(图2),可能该树种主要是利用根生长策略来获取土壤资源;而南酸枣在混交林下根形态性状无显著变化,根分支强度和菌根侵染率则是显著增加(图2),可能该树种主要是利用菌根策略获取土壤资源。
对于AM树种来说,单种和混种均会降低树种根性状之间的相关性,尤其是混种降低幅度更大(图3a~c);与之相反的是,单种和混种均会增加EM树种根性状之间的相关性(图3d~e)。这可能是因为正如前面所讨论的,细根树种和粗根树种的土壤资源获取策略不同,所以AM树种混交林表现出根形态性状间无相关性(图3c)。而EM物种在根尖周围形成了菌丝膜,限制了皮质组织的发育,增加了根枝数量,使得根形态性状发生改变,因此EM树种单种和混种表现出更多的根形态性状间的相关性。本研究也发现,不管是AM树种还是EM树种,与单种相比,混种能降低且改变树种根性状间的相关性(图3c、f)。这可能是因为有菌丝覆盖物的EM根,根系分泌物的量较多,且EM树种的根系分泌物与直径、比根长之间存在显著相关性;但AM在树种中不显著。因此,AM树种和EM树种在混种情况下,可能会相互影响,导致在混种时根形态性状间的相关性降低,且在单种和混种时的相关性存在差异[36]。
本研究结果表明,AM树种的根直径和单根长度均是混种显著低于单种,而EM树种则是相反的趋势(图4)。这可能是混种时存在EM树种和AM树种相互影响的情况,在高度多样化的生态系统中,养分竞争加剧,AM树可能更多地依赖快速凋落物分解来获得无机养分[37],同时,EM树通常比AM树具有更高的木质素浓度,产生更多的顽固凋落物,导致凋落物分解和养分矿化较慢,但土壤有机质积累较高[38],因此在混种下AM树种的根长和单根长度都比单种下低;而EM真菌虽保留了了来自其腐生祖先的降解酶[36,39],但由于EM真菌的分解能力低于腐生真菌[40],EM植物可能不得不依赖其他养分保存策略,如养分再吸收,以确保其养分需求[41]。
-
本研究通过对5种AM树种(枫香、南酸枣、无患子、乌桕、蓝果树)和3种EM树种(短柄枹栎、锥栗、苦槠)为研究对象,结果发现AM树种和EM树种的菌根类型会极显著影响吸收根间的功能性状,但种植方式不会。AM和EM树种的根形态和构型性状均有显著差异,但同一菌根类型树种在不同种植方式下普遍没有显著差异。混种对AM和EM树种根性状的可塑性有不同程度的影响,主要增大AM树种的分支强度,降低EM树种的根组织密度。可见,不同菌根树种可以通过调节不同根性状变化来实现物种共存。
种植方式和菌根类型对吸收根性状的影响
The Influence of Planting Patterns and Mycorrhizal Types on Absorptive Root Traits
-
摘要:
目的 通过分析种植方式对两种菌根类型树种吸收根性状的影响,揭示物种共存的适应条件。 方法 本研究选择8个树种(5个AM树种和3个EM树种)的单种和所有树种混种的样地,分析不同种植方式(单种vs混种)下两类型菌根(AM vs EM)树种吸收根(1~2级根)的主要形态性状(根直径、比根长、根组织密度、单根长)和构型性状(根分支强度、根分支比)及菌根侵染率的差异。 结果 菌根类型极显著影响吸收根的形态和构型性状(p<0.001),显著影响菌根侵染率(p<0.05);种植方式仅显著影响吸收根的组织密度和根构型性状(p<0.05);菌根类型和种植方式对所有性状均无交互影响(p>0.05)。AM树种根性状间的相关程度高于EM树种,混种大幅度降低AM树种根性状间的相关性。混种降低AM树种根形态性状的可塑性(比根长除外),增大其构型性状的可塑性;混种降低EM树种根组织密度的可塑性,增大根直径、构型性状及侵染率的可塑性。 结论 AM和EM树种的根形态和构型性状均有显著差异。混种对AM和EM树种根性状的可塑性有不同程度的影响,主要增大AM树种的分支强度,降低EM树种的根组织密度。可见,不同菌根树种可以通过调节不同根性状变化来实现物种共存。 Abstract:Objective The effects of planting methods and the mycorrhizal types on absorptive root traits of tree species were analyzed to reveal the adaptive conditions for species coexistence. Methods In this study, monoculture and mixture of 8 species (5 AM and 3 EM) were selected. The main morphological traits (root diameter, specific root length, root tissue density, individual root length) and architectural traits (root branching intensity, root branching ratio strength) and mycorrhizal colonization of absorptive roots (first two order roots) of two types of mycorrhizal tree species (AM vs EM) under two planting patterns (monoculture vs mixture) were analyzed. Results Mycorrhiza significantly affected morphological and architectural traits of absorptive roots (p<0.001), and significantly affected mycorrhizal colonization(p<0.05); while planting patterns only significantly affected root tissue density and root architectural traits (p<0.05); mycorrhizal types and planting patterns had no interaction on all root traits (p>0.05). The correlation between root traits of AM species was higher than that of EM species, and the mixture greatly reduced correlations between root traits of AM tree species. For AM species, the mixture reduced the plasticity of root morphological traits (except for specific root length) and increased the plasticity of architectural traits. For EM species, the mixture reduced the plasticity of root tissue density, and increased the plasticity of root diameter, architectural traits and mycorrhizal colonization. Conclusion There are significant differences in root morphological and architectural traits between AM and EM species. Mixed forests mode has varying degrees of effects on the plasticity of root traits of AM and EM species, mainly increasing the branching intensity of AM species and decreasing the root tissue density of EM species. Therefore, different mycorrhizal species can achieve species coexistence by regulating different root trait changes. -
Key words:
- tree species
- / arbuscular mycorrhiza
- / ectomycorrhiza
- / root traits
- / mycorrhiza colonization
-
表 1 种植方式和菌根类型对根性状影响的双因素方差分析
Table 1. Results of two-way ANOVA for the effects of planting method and mycorrhizal type on root traits
根性状Root traits 种植方式
Planting method (P)菌根类型
Mycorrhizal type (M)种植方式 × 菌根类型
P × MF p F p F P 根形态性状 Root morphological traits 根直径 RD 0.79 0.379ns 56.0 <0.001*** 2.48 0.123ns 比根长 SRL 1.75 0.193ns 108 <0.001*** 0.47 0.498ns 根组织密度 RTD 5.59 0.023* 19.7 <0.001*** 0.91 0.347ns 单根长度 IRL 2.85 0.098ns 34.7 <0.001*** 3.12 0.084ns 根构型性状 Root architectural traits 根分支强度 BrI 4.42 0.041* 157 <0.001*** 0.01 0.946ns 根分支比 BrR 5.65 0.022* 49.0 <0.001*** 1.56 0.218ns 菌根侵染率 MC 0.19 0.668ns 7.09 0.011* 0.74 0.395ns 注/Notes:RD: root diameter; SRL: specific root length; RTD: root tissue density; IRL: individual root length; BrI: branching intensity; BrR: branching ratio; MC: mycorrhizal colonization; ***: p<0.001; **: p<0.01; *: p<0.05; ns: p>0.05.下同/The same below -
[1] JACTEL H, BAUHUS J, BOBERG J, et al. Tree diversity drives forest stand resistance to natural disturbances[J]. Current Forestry Reports, 2017, 3(3): 223-243. doi: 10.1007/s40725-017-0064-1 [2] ENGBERSEN N, STEFAN L, BROOKER R W, et al. Using plant traits to understand the contribution of biodiversity effects to annual crop community productivity[J]. Ecological Applications, 2022, 32(1): 1-11. [3] LOREAU M, HECTOR A. Partitioning selection and complementarity in biodiversity experiments[J]. Nature, 2001, 412(7): 72-76. [4] CARDINALE B J, WRIGHT J P, CADOTTE M W, et al. Impacts of plant diversity on biomass production increase through time because of species complementarity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(46): 18123-18128. [5] HRIVNÁK R, BOŠEĽA M, SLEZÁK M, et al. Competition for soil resources forces a trade-off between enhancing tree productivity and understory species richness in managed beech forests[J]. Science of the Total Environment, 2022, 849(8): 1-8. [6] MCCORMACK M L, DICKIE I A, EISSENSTAT D M, et al. Redefining fine roots improves understanding of below-ground contributions to terrestrial biosphere processes[J]. New Phytologist, 2015, 207(3): 505-518. doi: 10.1111/nph.13363 [7] ZHU X, ZHANG Z, WANG Q, et al. More soil organic carbon is sequestered through the mycelium pathway than through the root pathway under nitrogen enrichment in an alpine forest[J]. Global Change Biology, 2022, 28(16): 4947-4961. doi: 10.1111/gcb.16263 [8] SMITH S E, READ D J. Mycorrhizal symbiosis(3rd Edn)[M]. New York: Academic Press, 2008. [9] TAYLOR T N, REMY W, HASS H, et al. Fossil arbuscular mycorrhizae from the early devonian[J]. Mycologia, 1995, 87(4): 560-573. doi: 10.1080/00275514.1995.12026569 [10] COMAS L H, MUELLER K E, TAYLOR L L, et al. Evolutionary patterns and biogeochemical significance of angiosperm root traits[J]. International Journal of Plant Sciences, 2012, 173(6): 584-595. doi: 10.1086/665823 [11] KONG D, MA C, ZHANG Q, et al. Leading dimensions in absorptive root trait variation across 96 subtropical forest species[J]. The New Phytologist, 2014, 203(3): 863-872. doi: 10.1111/nph.12842 [12] PENG S, CHEN H Y H. Global responses of fine root biomass and traits to plant species mixtures in terrestrial ecosystems[J]. Global Ecology and Biogeography, 2021, 30(1): 289-304. doi: 10.1111/geb.13205 [13] DIETRICH P, CESARZ S, LIU T, et al. Effects of plant species diversity on nematode community composition and diversity in a long-term biodiversity experiment[J]. Oecologia, 2021, 197(2): 297-311. doi: 10.1007/s00442-021-04956-1 [14] OSTONEN I, LÕHMUS K, HELMISAARI H, et al. Fine root morphological adaptations in Scots pine, Norway spruce and silver birch along a latitudinal gradient in boreal forests[J]. Tree Physiol, 2007, 27(11): 1627-1634. doi: 10.1093/treephys/27.11.1627 [15] GOULD I J, QUINTON J N, WEIGELT A, et al. Plant diversity and root traits benefit physical properties key to soil function in grasslands[J]. Ecology Letters, 2016, 19(9): 1140-1149. doi: 10.1111/ele.12652 [16] SALAHUDDIN S, REWALD B, RAZAQ M, et al. Root order-based traits of Manchurian walnut & larch and their plasticity under interspecific competition[J]. Scientific Reports, 2018, 8(1): 1-14. [17] BRUELHEIDE H, BÖHNKE M, BOTH S, et al. Community assembly during secondary forest succession in a Chinese subtropical forest[J]. Ecological Monographs, 2011, 81(1): 25-41. doi: 10.1890/09-2172.1 [18] SUN Z, LIU X, SCHMID B, et al. Positive effects of tree species richness on fine-root production in a subtropical forest in SE-China[J]. Journal of Plant Ecology, 2017, 10(1): 146-157. doi: 10.1093/jpe/rtw094 [19] BONGERS F J, SCHMID B, BRUELHEIDE H, et al. Functional diversity effects on productivity increase with age in a forest biodiversity experiment[J]. Nature Ecology & Evolution, 2021, 5(12): 1594-1603. [20] SOUDZILOVSKAIA N A, VAESSEN S, BARCELO M, et al. Fungal root: global online database of plant mycorrhizal associations[J]. New Phytologist, 2020, 227(3): 955-966. doi: 10.1111/nph.16569 [21] GUO D L, XIA M X, WEI X, et al. Anatomical traits associated with absorption and mycorrhizal colonization are linked to root branch order in twenty-three Chinese temperate tree species[J]. New Phytologist, 2008, 180(3): 673-683. doi: 10.1111/j.1469-8137.2008.02573.x [22] PREGITZER K S, DEFOREST J L, BURTON A J, et al. Fine root architecture of nine North American trees[J]. Ecological Monographs, 2002, 72(2): 293-309. doi: 10.1890/0012-9615(2002)072[0293:FRAONN]2.0.CO;2 [23] MCGONIGLE T P, FITTER A H. Ecological specificity of vesicular-arbuscular mycorrhizal associations[J]. Mycological Research, 1990, 94(1): 120-122. doi: 10.1016/S0953-7562(09)81272-0 [24] LIU B. , LI H, ZHU B, et al. Complementarity in nutrient foraging strategies of absorptive fine roots and arbuscular mycorrhizal fungi across 14 coexisting subtropical tree species[J]. New Phytologist, 2015, 208(1): 125-136. doi: 10.1111/nph.13434 [25] KOU L, GUO D, YANG H, et al. Growth, morphological traits and mycorrhizal colonization of fine roots respond differently to nitrogen addition in a slash pine plantation in subtropical China[J]. Plant and Soil, 2015, 391(1-2): 207-218. doi: 10.1007/s11104-015-2420-x [26] WAMBSGANSS J, FRESCHET G T, BEYER F, et al. Tree species mixing causes a shift in fine-root soil exploitation strategies across European forests[J]. Functional Ecology, 2021, 35(9): 1886-1902. doi: 10.1111/1365-2435.13856 [27] COMAS L H, CALLAHAN H S, MIDFORD P E. Patterns in root traits of woody species hosting arbuscular and ectomycorrhizas: Implications for the evolution of belowground strategies[J]. Ecology and Evolution, 2014, 4(15): 2979-2990. doi: 10.1002/ece3.1147 [28] CHEN W, KOIDE R T, ADAMS T S, et al. Root morphology and mycorrhizal symbioses together shape nutrient foraging strategies of temperate trees[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(31): 8741-8746. [29] 欧阳园丽, 张参参, 林小凡, 等. 中国亚热带不同菌根树种的根叶形态学性状特征与生长差异: 以江西新岗山为例[J]. 生物多样性, 2021, 29(6):746-758. [30] CHEN N, ZHANG Y J, ZHU J T, et al. Nonlinear responses of productivity and diversity of alpine meadow communities to degradation[J]. Chinese Journal of Plant Ecology, 2018, 42(1): 50-65. doi: 10.17521/cjpe.2017.0252 [31] EISSENSTAT D M, KUCHARSKI J M, ZADWORNY M, et al. Linking root traits to nutrient foraging in arbuscular mycorrhizal trees in a temperate forest[J]. New Phytologist, 2015, 208(1): 114-124. doi: 10.1111/nph.13451 [32] BERGMANN J, WEIGELT A, PLAS F, et al. The fungal collaboration gradient dominates the root economics space in plants[J]. Science Advances., 2020, 6(27): 1-9. [33] POORTER H, NIKLAS K J, REICH P B, et al. Biomass allocation to leaves, stems and roots: meta-analyses of interspecific variation and environmental control[J]. New Phytologist, 2012, 193(1): 30-50. doi: 10.1111/j.1469-8137.2011.03952.x [34] ARCHAMBAULT L S, TRZILOVA D, GONIA S, et al. Intravital imaging reveals divergent cytokine and cellular immune responses to Candida albicans and Candida parapsilosis[J]. Microbiology, 2019, 10(3): 1-18. [35] WAMBSGANSS J, BEYER F, FRESCHET G T, et al. Tree species mixing reduces biomass but increases length of absorptive fine roots in European forests[J]. Journal of Ecology, 2021, 109(7): 2678-2691. doi: 10.1111/1365-2745.13675 [36] AKATSUKI M, MAKITA N. Influence of fine root traits on in situ exudation rates in four conifers from different mycorrhizal associations[J]. Tree Physiology, 2020, 40(8): 1071-1079. doi: 10.1093/treephys/tpaa051 [37] TEDERSOO L, BAHRAM M. Mycorrhizal types differ in ecophysiology and alter plant nutrition and soil processes[J]. Biological Reviews of the Cambridge Philosophical Society, 2019, 94(5): 1857-1880. doi: 10.1111/brv.12538 [38] MIDGLEY M G, BRZOSTEK E, PHILLIPS R P. Decay rates of leaf litters from arbuscular mycorrhizal trees are more sensitive to soil effects than litters from ectomycorrhizal trees[J]. The Journal of Ecology, 2015, 103(6): 1454-1463. doi: 10.1111/1365-2745.12467 [39] AYUSO-FERNÁNDEZ I, RUIZ-DUEÑAS F J, MARTÍNEZ A T. Evolutionary convergence in lignin-degrading enzymes[J]. Proceedings of the National Academy of Sciences, 2018, 115(25): 6428-6433. doi: 10.1073/pnas.1802555115 [40] SILVIA P, STEFANIA D, ELENA M. Ericoid mycorrhizal fungi and their genomes: another side to the mycorrhizal symbiosis?[J]. New Phytologist, 2018, 220(4): 1141-1147. doi: 10.1111/nph.15218 [41] CLEVELAND C C, HOULTON B Z, SMITH W K, et al. Patterns of new versus recycled primary production in the terrestrial biosphere[J]. Proceedings of the National Academy of Sciences, 2013, 110(31): 12733-12737. doi: 10.1073/pnas.1302768110 -




 下载:
下载: