-
土壤酶作为土壤生物产生的高效活性物质,催化大分子有机物分解为易被植物和微生物同化利用的碳源和养分,进而参与生态系统碳(C)、氮(N)、磷(P)循环过程[1]。常见的土壤酶通常被分为C循环酶:β-葡糖苷酶、多酚氧化酶和过氧化物酶,N循环酶:N-乙酰-葡糖苷酶和亮氨酸氨基肽酶,P循环酶:酸性磷酸酶。越来越多的研究表明:除了温度和湿度等环境因子外,土壤养分、底物供应(凋落物输入)和土壤微生物群落组成也是调控土壤酶活性的重要因子[2-4]。“资源配置理论”[5]和“最优分配原则”[6]认为在参与调控土壤C、N、P循环过程中,土壤生物优先分配给缺乏的资源以缓解土壤碳和养分的限制作用,说明C、N、P循环酶产量应对生物和非生物因子变异的协同和权衡响应。基于此形成的土壤酶生态化学计量特征可以定量的表述土壤微生物受到C、N、P的相对限制作用[7]。已有研究多关注于土壤酶活性对生物和非生物因子变化的响应,近年来,越来越多的研究利用土壤酶生态化学计量特征表征地下生态学过程中的元素限制作用。
毛竹(Phy llostachys edulis (Carr. ) Lehaie)作为我国面积最大,分布最广的竹种,广泛分布于我国亚热带地区[8]。芒萁(Dicranopteris dichotoma (Thunb. ) Berhn.)是毛竹林常见并广泛分布的林下植被,在粗放式经营毛竹林中呈强烈聚集分布[9-10]。芒萁可与毛竹竞争P元素,加剧竹林P元素限制作用[11]。此外,芒萁和毛竹凋落物的异速分解过程也势必会改变竹林土壤底物供应[12-13]。土壤养分和底物供应的变化如何影响土壤酶活性及其生态学计量特征尚不清楚。以往的研究多关注于毛竹林经营措施、林地转化和模拟气候变化背景下土壤酶活性的变化[14-16],对毛竹林下植被如何影响土壤酶活性的研究较少,这也限制了深入探索在毛竹林高效培育过程中林地生产力的长期维持能力。土壤团聚体是土壤结构的基本单元,不同粒径团聚体的可接触性、养分含量和微生物群落组成等性质的差异直接影响着土壤酶活性,进而影响土壤C固持和养分供给[17]。先前研究发现,不同芒萁盖度下的毛竹林土壤团聚体组成和养分具有明显差异[11]。区分土壤团聚体组成及与之相关的土壤酶活性可以比未进行团聚体分级的混合土壤更有效、快速的反映土壤养分循环的变化[3, 18]。因此,了解团聚体酶活性变化特征,对掌握竹林土壤养分变化具有重要的意义。本研究以四川省长宁县粗放经营的毛竹林为研究对象,探究不同盖度芒萁对毛竹林土壤团聚体酶活性及生态化学计量特征的影响,以期为深入认识林下植被不同盖度下毛竹林地力差异和制定高效经营措施提供科学依据和基础数据。
-
研究地点位于四川省宜宾市长宁县蜀南竹海自然保护区(28°15ʹ~28°47ʹ N,104°44ʹ~105°03ʹ E),研究区属中亚热带湿润性季风气候,年均气温18.3 ℃,年均降雨量1 114.2 mm,研究区主要有毛竹、硬头黄竹(Bambusa rigida Keng et Keng f.)、慈竹(Neosinocalamus affinis (Rendle) Keng)和苦竹(Pleioblastus amarus (Keng) keng)等竹种[19]。本研究试验地依托四川长宁竹林生态系统国家定位观测研究站毛竹林观测点,所选试验地林分近十年无施肥、劈山和勾梢等经营,毛竹林下常见大面积的芒萁种群集中连片分布,少量混杂狗脊(Woodwardia japonica (L.f.) Sm.)和里白(Hicriopteris glauca (Thunb.) Ching)等蕨类,土壤为山地黄壤[19-20]。
-
样地设置见王一等[11],具体为:2016年3月在四川长宁竹林生态系统定位观测研究站毛竹林观测点选择海拔、坡度和坡向一致,长势良好的毛竹林为研究对象,在林下芒萁稀疏分布(芒萁盖度7.75%)的毛竹林内设置4个面积为20 m × 20 m样方(PE);同时,在林下芒萁强烈聚集分布(芒萁盖度63.25%)的毛竹林内设置4个相同面积的样方(DD),保持样方之间相隔距离在150 m以上。同年6月对样地内全部毛竹进行统计,研究地信息见表1。
表 1 研究地基本情况
Table 1. Stand characteristics of Phyllostachys edulis
样方类型
Plot盖度
Canopy/
%立竹密度
Bamboo density/(株∙hm−2)新生竹株数
Current year bamboo/
株新生竹胸径
Mean DBH/
cm坡度
Slope/
(°)坡向
Aspect海拔
Altitude/
mPE 7.75 ± 0.63 B 4 993 ± 459 22.50 ± 4.66 10.64 ± 0.15 A <5 南 South 889 ± 3.35 DD 63.25 ± 3.84 A 4 550 ± 322 23.00 ± 2.48 9.71 ± 0.16 B <5 南 South 896 ± 2.21 注:PE:低芒萁盖度样方;DD:高芒萁盖度样方;下同。表中数值为均值 ± 标准误;不同大写字母表示在95%置信区间T检验结果显著(95%置信区间)
Notes: PE: Low coverage of Dicranopteris dichoyoma plots; DD: High coverage of D. dichoyoma plots; The same as bellows. Values in the table are mean values ± standard error; Different uppercase letters meant significant differences in T-test between PE and DD plots at P<0.05 -
2016年7月在PE和DD样方设置两条对角线,并在交点处及距交点东、南、西、北5 m处共设置5个采样点,去掉采样点地表植被和凋落物层,用直径10 cm的PVC管采集采样点0~10 cm土层原状土[11]。将原状土带回实验室并沿土壤自然纹理掰开,去掉可见根系和石砾后过8 mm筛并将同一样方样品混合均匀,采用四分法取样后对土壤团聚体进行分级。为保证筛分效果并减少对土壤微生物和酶活性的影响,土壤样品在4 ℃下风干至含水量15%左右进行再进行分级,具体为:称取100 g土壤样品置于震动筛分仪(Retsch AS200)2 mm和0.25 mm土壤筛,设置1.5 mm振幅震动2 min,将土壤团聚体分为大团聚体(>2 mm)、中团聚体(0.25~2 mm)和微团聚体(<0.25 mm)3个团聚体粒径[11]。
-
采用元素分析仪(ECS 4010 CHNSO, Costech Analytical Tecnologies Inc., Vlencia, CA, USA)测定分级后土壤团聚体的有机碳(SOC)和全氮(TN)含量,采用化学分析仪(Smartchem 300, AMS-AllianceWestco Scientific Instruments, Rome, Italy)结合H2SO4/HClO4消煮法测定全磷(TP)含量[21]。
-
分级后的土壤团聚体采用荧光微平板法测定土壤酶活性[2, 22]:将1.25 g鲜土加入125 mL 50 mmol·L−1的醋酸钠缓冲液(pH=4.2)中,在搅拌机中匀速搅拌1 min制成土壤悬液。加入酶底物进行25 ℃暗培养3 h后添加5 µL 0.5 mol L−1 NaOH溶液停止反应,采用酶标仪(Perkine-Elmer LAMBDA 35)进行读数。本研究共测定参与土壤碳、氮、磷循环的4种关键水解酶活性和2种氧化酶活性:β-葡糖苷酶(BG)、N-乙酰-葡糖苷酶(NAG)、亮氨酸氨基肽酶(LAP)和酸性磷酸酶(AP)、多酚氧化酶(PHE)和过氧化物酶(PER)(表2)。
表 2 土壤酶种类和功能
Table 2. Soil enzyme and function
土壤酶
Soil Enzyme功能
Function底物
Substrate浓度
Concentration/(µmmol·L−1)β-葡糖苷酶
β-Glucosidase参与土壤碳循环:
降解纤维素成葡萄糖4-甲基伞形酮-β-D-葡萄糖苷
4-MUB-β-D-glucoside200 N-乙酰-葡糖苷酶
N-acetyl-glucosaminidase参与土壤氮循环:
降解几丁质4-甲基伞形酮-N-乙酰-β-D-氨基葡萄糖苷
4-MUB-N-acetyl-β-D-glucosaminide200 亮氨酸氨基肽酶
Leucine-amino-peptidase参与土壤氮循环:
降解蛋白质成氨基酸L-亮氨基-7-氨基-4-甲基香豆素
L-Leucine-7-amido-4-methylcoumarin200 酸性磷酸酶
Acid phosphatase参与土壤磷循环:
水解有机磷为无机磷4-甲基伞形酮-磷酸
4-MUB-phosphate100 多酚氧化酶
Phenoloxidase参与土壤碳循环:
降解木质素和芳香类物质L-3,4-二羟基苯丙氨酸
L-3,4-dihydroxyphenylalanine(DOPA)25 000 过氧化物酶
Peroxidase参与土壤碳循环:
降解木质素和芳香类物质L-3,4-二羟基苯丙氨酸
L-3,4-dihydroxyphenylalanine(DOPA)25 000 土壤C、N、P循环相关的酶生态化学计量特征计算如下[7]:
$ \begin{array}{c} 土壤{\rm{C}}:{\rm{N}}{酶活性计量比}\left({\rm{E}}_{{\rm{C}}:{\rm{N}}}\right)=\\ {\rm{Ln}}({\rm{BG}}):{\rm{Ln}}({\rm{NAG}}+{\rm{LAP}}) \end{array} $
(1) $ \begin{array}{c} {土壤}{\rm{N}}:{\rm{P}}{酶活性计量比}\left({\rm{E}}_{{\rm{N}}:{\rm{P}}}\right)=\\{\rm{Ln}}({\rm{NAG}}+{\rm{LAP}}):{\rm{Ln}}({\rm{AP}})\end{array}$
(2) $\begin{array}{c} {土壤}{\rm{C}}:{\rm{P}}{醇活性计量比}\left({\rm{E}}_{{\rm{C}}:{\rm{P}}}\right)=\\{\rm{{Ln}}}({\rm{BG}}):{\rm{Ln}}({\rm{AP}})\end{array}$
(3) 土壤微生物群落结构测定采用磷脂脂肪酸法(PLFAs),依据Bossio和Scow[23]提取和分析土壤微生物磷脂脂肪酸方法改进而来,主要过程分为土壤浸提-分离-纯化-萃取,通过酯化形成脂肪酸甲酯,利用Aligent 6890气象色谱测定土壤微生物特征类群脂肪酸含量,以正十九烷脂肪酸(19:00)内标物进行定量计算。在土壤微生物特征类群脂肪酸中[24-27],革兰氏阳性菌(GP)由i14:0,i15:0,a15:0,i16:0,i17:0和a17:0组成,革兰氏阴性菌(GN)由16:1w7c,16:1w9c,17:1w8c,18:1w7c,cy17:0和cy19:0组成,丛枝菌根真菌(AMF)由16:1w5c组成,真菌(F)由18:1w9c,18:2w6c和18:3w6c组成,放线菌(ACT)用Me16:0,Me17:0和Me18:0组成,细菌群落(B)由14:0,15:0,16:0,17:0以及放线菌、革兰氏阳性菌和革兰氏阴性菌组成。
-
采用T检验比较PE和DD样方芒萁盖度、立竹株数、新生竹株数、新生竹胸径、土壤团聚体相同粒径的土壤化学性质、酶活性及生态化学计量比、土壤微生物量和群落结构之间的差异,采用单因素方差分析比较相同样方内不同团聚体粒径土壤化学性质、酶活性及生态化学计量比、土壤微生物量和群落结构之间的差异。采用Canoco 4.5进行冗余分析,采用SPSS 16.0统计分析软件对数据进行差异性检验,采用SigmaPlot 12.5软件制图。
-
PE样方SOC、TN和TP含量在3种团聚体间无差异,而DD样方SOC、TN和TP含量整体呈现随团聚体粒径减少而增加的趋势,其中微团聚体SOC和TP含量均显著高于大团聚体,中团聚体TN含量显著高于大团聚体(表3)。DD样方中3种团聚体粒径的TP含量均显著低于PE样方,但仅大团聚体和中团聚体TN含量以及大团聚体SOC含量显著低于PE样方(表3)。PE样方ACT、AMF、GN、GP、B和F含量均呈现随团聚体粒径减少而增加的趋势,其中微团聚体不同类群土壤微生物量显著高于大团聚体和中团聚体(除AMF和F外);而DD样方ACT、AMF、GN、GP、B和F含量在3种团聚体间均无差异(表3)。除DD样方大团聚体ACT含量显著低于PE样方外,其余类群土壤微生物量在相同团聚体粒径的不同样方之间无显著差异(表3)。
表 3 不同芒萁盖度毛竹林土壤团聚体化学性质和微生物特征
Table 3. Soil chemical properties and microbial properties of soil aggregate size classes in different plots
指标
Index团聚体粒径 Soil aggregate size/mm PE DD >2 0.25~2 <0.25 >2 0.25~2 <0.25 有机碳 SOC/(g·kg−1) 70.20 ± 2.54 Aa 78.90 ± 3.59 Aa 75.23 ± 2.93 Aa 61.85 ± 1.38 Bb 73.48 ± 2.49 Aa 69.98 ± 1.66 Aa 全氮 TN/(g·kg−1) 6.15 ± 0.25 Aa 6.65 ± 0.22 Aa 6.38 ± 0.37 Aa 5.13 ± 0.09 Bb 5.93 ± 0.15 Ba 5.55 ± 0.20 Aab 全磷 TP/(g·kg−1) 0.14 ± 0.01 Aa 0.16 ± 0.01 Aa 0.13 ± 0.00 Aa 0.07 ± 0.00 Bb 0.07 ± 0.00 Bb 0.10 ± 0.00 Ba 放线菌 ACT/(nmol·g−1) 2.90 ± 0.12 Bb 2.83 ± 0.05 Ab 3.54 ± 0.20 Aa 3.01 ± 0.33 Aa 2.99 ± 0.34 Aa 2.85 ± 0.15 Aa 丛枝菌根真菌 AMF/(nmol·g−1) 0.62 ± 0.02 Ab 0.80 ± 0.04 Aab 0.91 ± 0.09 Aa 0.63 ± 0.06 Aa 0.81 ± 0.11 Aa 0.79 ± 0.07 Aa 革兰氏阳性菌 GP/(nmol·g−1) 6.65 ± 0.30 Ab 7.06 ± 0.25 Ab 8.41 ± 0.60 Aa 7.42 ± 0.76 Aa 7.88 ± 0.84 Aa 6.79 ± 0.34 Aa 革兰氏阴性菌GN/(nmol·g−1) 2.68 ± 0.18 Ab 3.18 ± 0.23 Ab 4.21 ± 0.45 Aa 2.92 ± 0.31 Aa 3.60 ± 0.38 Aa 3.58 ± 0.24 Aa 细菌 B/(nmol·g−1) 16.14 ± 0.51 Ab 17.66 ± 0.54 Ab 21.61 ± 1.72 Aa 17.88 ± 1.86 Aa 19.93 ± 2.20 Aa 18.32 ± 1.03 Aa 真菌 F/(nmol·g−1) 2.47 ± 0.19 Ab 3.20 ± 0.29 Aa 3.76 ± 0.46 Aa 2.72 ± 0.26 Aa 3.53 ± 0.45 Aa 3.33 ± 0.26 Aa 注:表中数值为均值 ± 标准误;不同大写字母表示相同团聚体粒径不同样方T检验结果显著(95%置信区间),不同小写字母表示相同样方不同团聚体粒径单因素方差分析结果显著(95%置信区间)
Notes: Values in the table are mean values ± standard error; Different uppercase letters meant significant differences in T-test between PE and DD plots in the same aggregate size class at P<0.05, different lowercase letters meant significant differences in one-way ANOVA between different aggregate size classes in the same plots at P<0.05 -
PE样方BG和LAP活性均随团聚体粒径减少而增加,PER活性随团聚体粒径减少而减少,PHE活性在中团聚体最高,而AP和NAG活性在团聚体不同粒径间差异不显著(图1)。DD样方BG、NAG和PHE活性均在中团聚体最高,PER活性随团聚体粒径减少而增加,AP和LAP活性在不同团聚体粒径间差异不显著(图1)。DD样方大团聚体和中团聚体LAP和PHE活性显著高于PE样方,PER活性显著低于PE样方,BG和NAG活性在相同团聚体粒径不同样方间无差异,DD样方3种团聚体粒径AP活性均显著高于PE样方(图1)。PE样方EC:N和EN:P在不同团聚体粒径间差异不显著,EC:P随团聚体粒径减少而增加(图1g~i)。DD样方EC:N和EC:P随团聚体粒径减少而增加,微团聚体EC:N和EC:P均显著高于大团聚体;而微团聚体EN:P显著低于大团聚体。相同团聚体粒径不同样方间EC:N无显著差异,且大团聚体和中团聚体EN:P和EC:P在PE和DD样方间差异不显著,但PE样方微团聚体EN:P和EC:P均高于DD样方(图1g~i)。
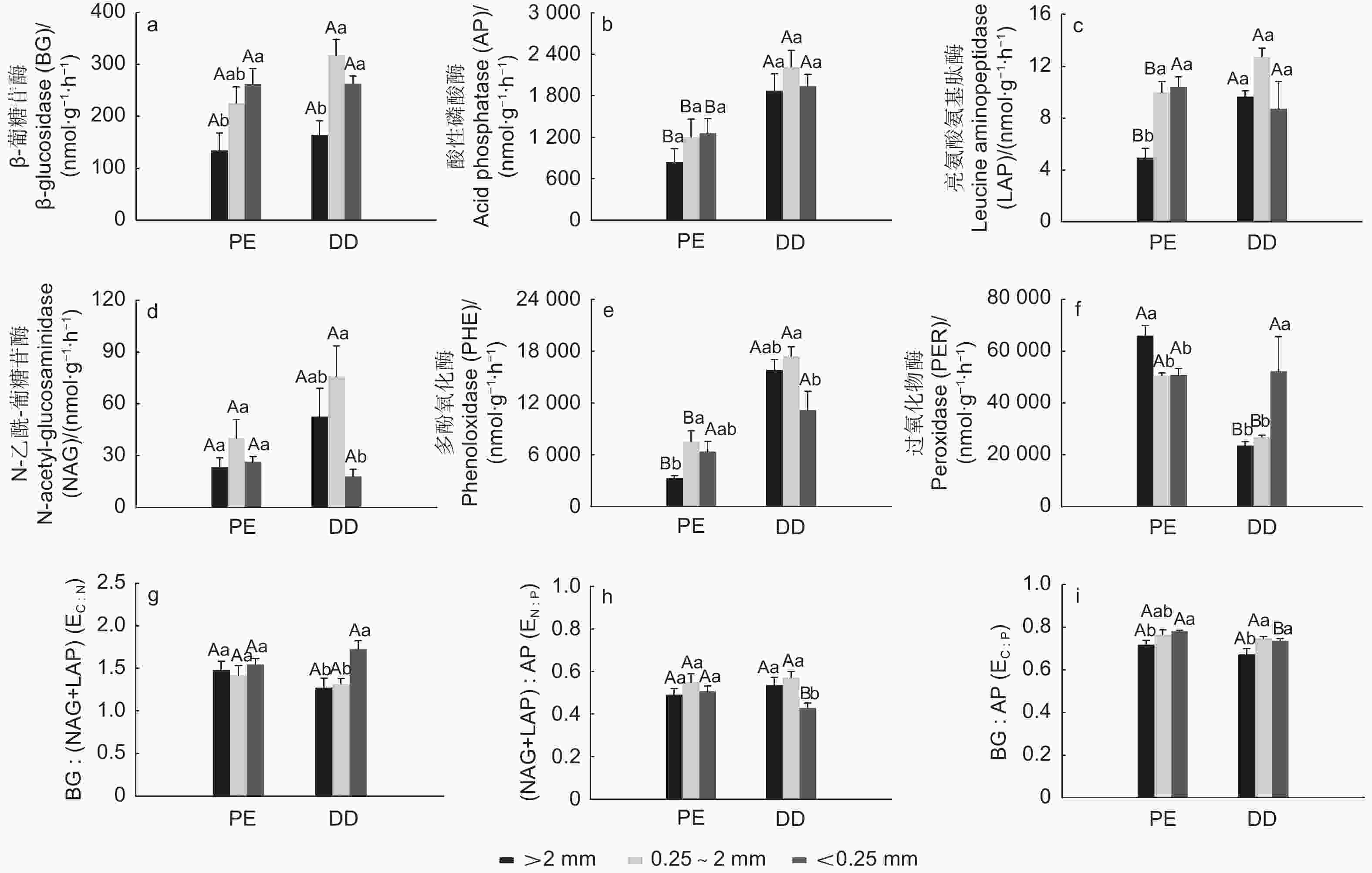
图 1 不同芒萁盖度毛竹林土壤团聚体酶活性和生态化学计量特征
Figure 1. Soil enzyme activities and stoichiometry of soil aggregate size classes in different plots
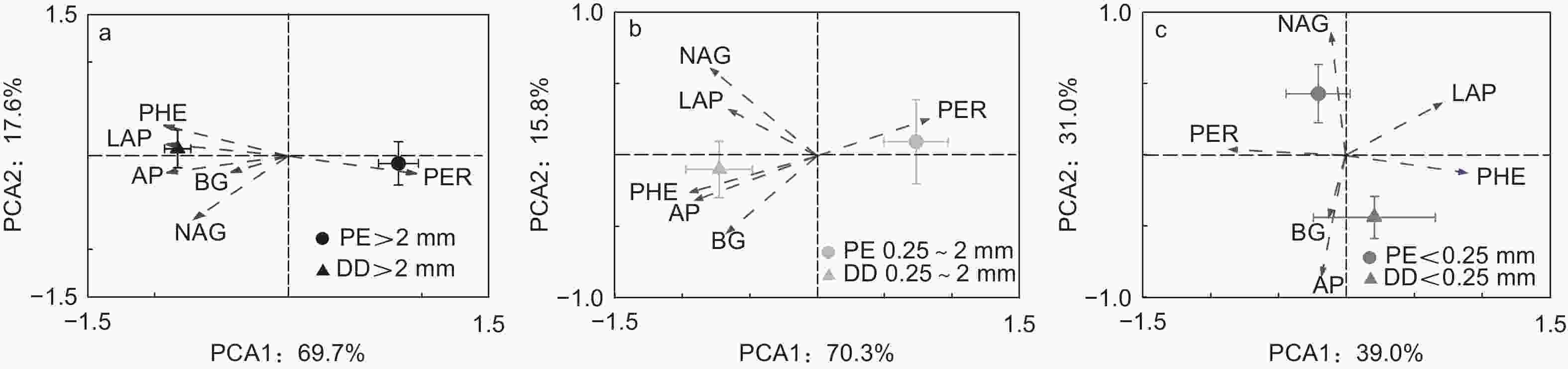
主成分分析发现PE和DD样方土壤酶活性呈现差异:PE和DD样方LAP和PHE均与第1主成分正相关,PER均与第1主成分负相关;PE样方NAG与第2主成分负相关,而DD样方AP与第2主成分正相关(图2和表4)。同一团聚体粒径土壤酶活性在PE和DD样方亦呈现差异;大团聚体和中团聚体AP和PHE中均与第1主成分正相关,PER均与第1主成分负相关,大团聚体BG与第2主成分正相关,微团聚体中LAP与第1主成分负相关,PER与第1主成分正相关(图3和表4)。
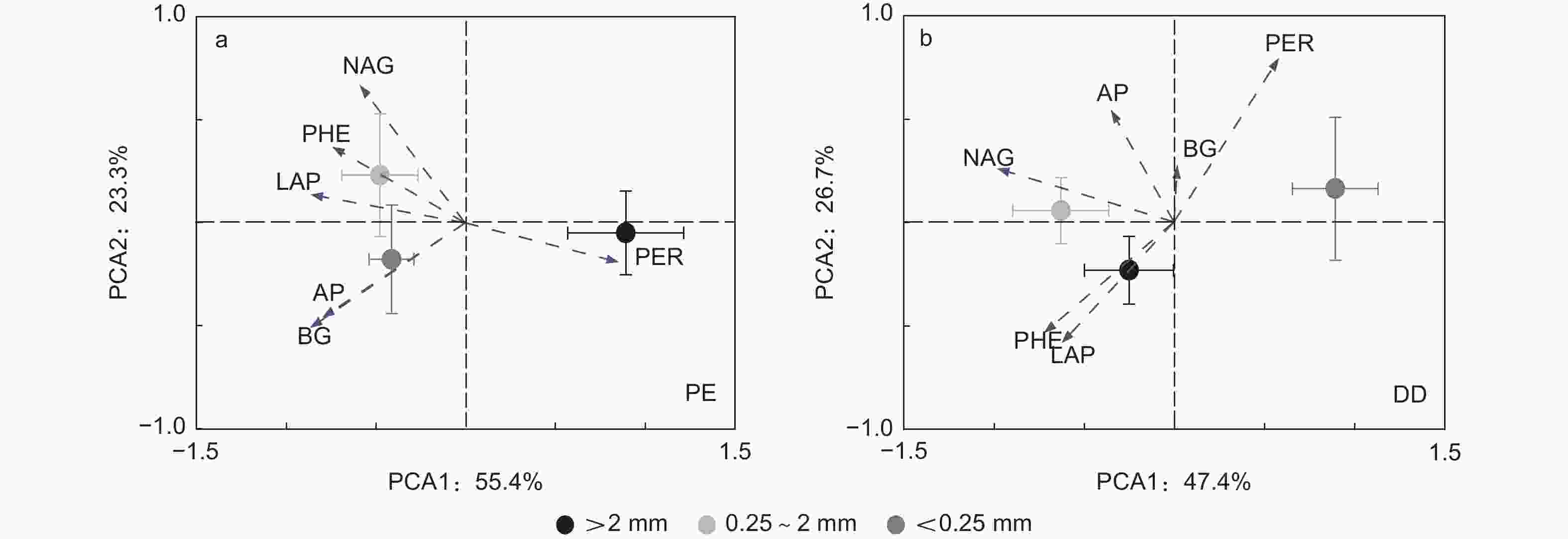
图 2 不同芒萁盖度毛竹林土壤酶活性主成分分析
Figure 2. Principal component analysis of soil enzyme activities in different plots
表 4 不同芒萁盖度和不同团聚体粒径毛竹林土壤酶活性主成分分析因子载荷矩阵
Table 4. Factor loading matrix for principal component analysis of soil enzyme activity in different plots and soil aggregate size classes
主成分 Principal component 指标
IndexPE DD >2 mm 0.25~2 mm <0.25 mm PCA1 PCA2 PCA1 PCA2 PCA1 PCA2 PCA1 PCA1 PCA2 PCA3 BG 0.767 0.613 0.373 0.682 0.439 0.853 0.792 0.059 0.737 −0.583 AP 0.653 0.595 0.332 0.838 0.937 0.185 0.890 0.556 0.752 0.228 NAG 0.456 −0.722 0.685 0.289 0.662 −0.522 0.746 −0.027 −0.773 −0.134 LAP 0.868 −0.242 0.882 −0.182 0.944 −0.136 0.719 −0.949 0.097 −0.204 PHE 0.770 −0.264 0.857 −0.176 0.930 −0.070 0.949 −0.526 0.275 0.741 PER −0.869 0.134 −0.785 0.534 −0.957 0.010 −0.909 0.922 −0.267 0.108 -
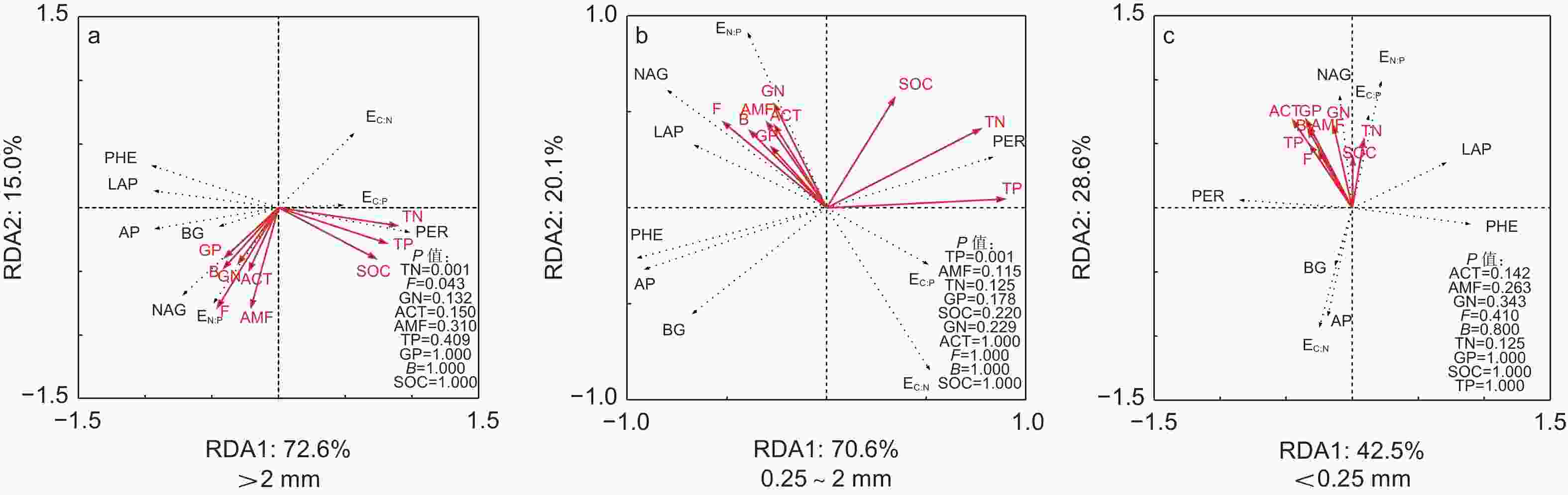
冗余分析结果表明:AMF极显著影响了PE样方不同团聚体粒径土壤酶活性的变异,而TP和ACT显著影响了DD样方不同团聚体粒径土壤酶活性的变异(图4)。TN和F显著影响了PE和DD样方大团聚体土壤酶活性变异,TP显著影响了PE和DD样方中团聚体土壤酶活性的变异,ACT是影响微团聚体土壤酶活性的变异的重要因子(图5)。
-
作为参与土壤C循环重要的酶,BG活性受到土壤有机碳含量和质量等因素影响[28]。本研究发现:DD样方不同团聚体粒径BG活性均与PE样方无显著差异(图1a),与BG活性相似,DD和PE样方中团聚体和微团聚体SOC无显著差异,且不同团聚体粒径SOC与BG均呈负相关关系(表3和图5a~c),本研究之前也发现DD和PE样方不同团聚体粒径土壤碳氮比无显著差异[11],故芒萁种群并未改变不同团聚体粒径SOC和土壤碳氮比可能是导致BG活性无差异的原因。与BG不同,研究发现参与土壤P循环的AP活性在不同团聚体粒径间DD样方均高于PE样方(图1b),而不同团聚体粒径TP含量DD样方均低于PE样方,且不同团聚体粒径TP与AP均呈负相关关系(表3和图5a~c),这可能是因为微生物-植物在低磷环境下需要分泌更多的磷酸酶将有机磷转化为无机磷供生物体利用[6]。这也进一步验证了之前的研究发现,即芒萁种群增加了其与毛竹对不同粒径团聚体P的竞争作用[11],故DD样方AP活性显著高于PE样方。与AP相似,参与土壤N循环的LAP活性仅在大团聚体和中团聚体具有差异(图1c),这是因为DD样方TN仅在大团聚体和中团聚体低于PE样方(表3),且LAP活性和TN在大团聚体和中团聚体均呈现负相关关系(图5a~b)。综上发现,在参与土壤C、N、P循环的水解酶活性中,芒萁种群显著增加了大、中、微团聚体AP活性,且显著增加了大和中团聚体LAP活性,但对BG活性无影响。与前期开展生态化学计量研究结果相同,芒萁种群对P的竞争利用强于对N的竞争利用[11],土壤生物体需要分泌更多的酶以开采土壤氮磷养分满足自身生长所需[6],故在DD样方全部团聚体粒径中AP活性均高于PE样方,而仅有大和中团聚体LAP活性高于PE样方(图1b~c)。
除水解酶外,氧化酶通过氧化还原作用参与土壤有机质的矿化作用。多酚氧化酶(PHE)氧化土壤中酚类和胺类物质,过氧化物酶(PER)氧化土壤中木质素等大分子,进而共同决定土壤有机质分解并反映土壤腐殖化和有机化程度[28-29]。由于芒萁具有较高的酚类物质[30],并将酚类物质分泌到土壤中通过化感作用抑制其他植物生长[31]。本研究发现DD样方大团聚体和中团聚体PHE活性显著高于PE样方(图1e),这可能是因为DD样方芒萁种群导致土壤中酚类物种含量增加,进而增加了PHE活性[32]。与PHE相反,DD样方大团聚体和中团聚体PER活性显著低于PE样方(图1f)。前人研究发现[33],与DD样方相比,PE样方烷基与氧烷基碳比例(Alkyl C/O-alkyl C)降低是导致SOC稳定性降低的主要原因。这可能是因为木质素的芳香环结构及其与烷基碳的结合形成了稳定的SOC[34],而PE样方内较高的PER活性可促进木质素氧化,打破了其与烷基碳的结合形式,导致Alkyl C/O-alkyl C降低,降低了SOC稳定性。此外,芒萁凋落物叶和细根中Alkyl C/O-alkyl C均显著高于毛竹,这也进一步增加了DD样方内SOC稳定性。氧化酶活性均在大团聚体和中团聚体表现出显著差异(图1e~f),这可能是因为氧化酶的合成和分泌主要受真菌调控,而真菌在大团聚体占优势地位[35],故大团聚体和中团聚体氧化酶活性差异显著。
-
本研究发现,PE样方不同团聚体粒径之间EC:N差异不显著(1.42~1.55),而DD样方微团聚体EC:N显著高于大和中团聚体(1.27~1.73),这是因为DD样方微团聚体NAG活性显著降低(图1d)。之前研究表明,芒萁种群显著降低土壤TN含量,且大团聚体和中团聚体TN含量降低是导致DD样方土壤TN含量下降的主要原因[11],故DD样方大团聚体和中团聚体的微生物需要分泌更多的NAG以保证氮素供给,冗余分析结果中EC:N与NAG负相关关系也进一步证明了本研究的结果(图4b)。本研究中亦发现DD样方微团聚体EN:P显著低于大和中团聚体(图1h),DD样方微团聚体EN:P=0.43,接近于全球平均水平0.44[36],而大和中团聚体EN:P位于0.54~0.57,说明DD样方大和中团聚体受到P限制作用更严重。这主要是因为DD样方大和中团聚体与微团聚体TN含量无差异,但大和中团聚体TP含量显著低于微团聚体(表3),冗余分析结果中EN:P与TP呈负相关关系也验证了微团聚体TP含量增加缓解了P限制作用(图4b)。由于土壤大团聚体对磷的解吸附能力强于微团聚体,大团聚体的磷元素更易被根系吸收利用[37],因此可能导致大团聚体TP含量降低。此外,DD样方微团聚体EN:P和EC:P均低于PE样方(图1h、i),这主要是因为DD样方AP活性显著高于PE样方且AP与EN:P和EC:P均呈负相关关系(图1b和图5c)。土壤酶生态化学计量特征作为反映微生物碳和养分限制重要的指示因子,全球尺度土壤酶化学计量比(EC:N:P)约为1:1:1[36]。本研究中,PE样方土壤大、中、微团聚体EC:N:P分别为1.46:1:2.03、1.40:1:1.83、1.52:1:1.97,DD样方土壤大、中、微团聚体EC: N:P分别为1.25:1:1.86、1.31:1:1.75、1.71:1:2.33,均偏离与全球尺度土壤酶化学计量比,说明研究地受到P限制作用,且芒萁种群加剧了P元素的限制作用。除了P限制作用外,EC:N:P亦可以表征研究地受到C限制作用,但P限制作用更强。根据“资源配置理论”[5]和“最优分配原则”[6],土壤微生物分泌酶优先分配给缺乏资源以缓解土壤碳和养分限制作用,所以本研究发现研究区参与土壤P循环酶活性(AP:842~2 221 nmol·g−1·h−1)和C循环酶活性(BG:134~318 nmol·g−1·h−1)高于N循环酶活性(NAG:18~76 nmol·g−1·h−1;LAP:5~13 nmol·g−1·h−1)。
-
受土壤化学性质和微生物特征影响,本研究发现PE样方AMF是影响土壤酶活性的主要原因(图4a),这可能是因为毛竹作为AMF树种,菌根真菌可通过运输能量和养分等物质与毛竹形成共生关系[38],故AMF是影响参与土壤C、N、P循环相关酶活性的重要因子。此外,菌根真菌作为调控土壤氧化酶合成和分泌的重要微生物类群[39],RDA分析中AMF与LAP和PHE显著正相关,而与PER显著负相关(图4a),因此土壤团聚体不同粒径之间AMF的差异是影响不同粒径之间LAP、PHE和PER活性差异的主要原因(表3)。PCA因子载荷矩阵亦发现PE样方LAP和PHE均与第1主成分正相关,而PER与第1主成分负相关,进一步说明了土壤团聚体不同粒径之间LAP、PHE和PER活性差异是土壤C、N、P循环相关酶活性在土壤团聚体不同粒径之间分异的主要原因(图2a和表4)。与PE样方不同,TP和ACT是影响土壤酶活性的主要原因(图4b)。这主要是因为芒萁种群加剧了P元素的限制作用,因此,根据“利比希最小因子定律”,TP显著影响了土壤酶活性的变异。在PCA因子载荷矩阵分析中发现DD样方AP与第2主成分正相关,且大团聚体和中团聚体AP均与第1主成分正相关也说明了磷元素在调控DD样方土壤酶活性的重要作用(图2b和表4)。ACT作为土壤微生物重要的类群,其携带的phoC和phoD基因与AP合成和分泌显著相关[40],故在磷限制更为明显的DD样方中,ACT与AP活性显著正相关(图4b),且是影响土壤酶活性变异的主要原因。
在不同团聚体粒径间,本研究发现大团聚体土壤酶活性变异主要受TN和F显著影响(图5a),而中团聚体土壤酶活性变异主要受TP影响(图5b)。芒萁种群引起土壤养分(TN和TP)的降低主要受大团聚体TN和TP含量降低调控,且对土壤养分贡献率的变化TN大于TP[11]。PCA因子载荷矩阵分析中大团聚体AP和PHE均与第1主成分正相关,PER与第1主成分负相关,BG与第2主成分正相关(图3a和表4)。RDA分析中TN亦与PER正相关,与AP、PHE和BG负相关。因此,TN是大团聚体中参与土壤C、N、P循环相关酶活性变化的主要原因。此外,菌丝作为真菌的重要组成部分,微团聚体可以在菌丝互相缠绕下形成大团聚体[17, 35],故F仅在大团聚体中显著影响土壤酶活性的变异(图5)。与大团聚体不同,TP是影响中团聚体土壤酶活性变异的主要原因。这是因为先前研究发现芒萁细根可以利用中团聚体的P,导致对土壤养分贡献率的变化TP大于TN[11]。因子载荷矩阵分析表明中团聚体AP和PHE中均与第1主成分正相关,PER与第1主成分负相关(图3b和表4)。RDA分析中TP亦与AP和PHE负相关,与PER正相关,故TP是中团聚体中参与土壤C、N、P循环相关酶活性变化的主要原因。
-
川南地区毛竹林下高盖度的芒萁种群未显著改变参与土壤C循环的水解酶活性(BG),但改变了参与土壤C循环的氧化酶活性(PHE和PER),与此同时,显著改变了参与土壤N和P循环的水解酶活性(LAP和AP)。土壤酶活性的改变主要发生在大团聚体和中团聚体内,说明不同团聚体粒径土壤酶活性对高盖度芒萁种群响应的敏感性具有差异。土壤酶生态化学计量特征分析表明了C和P在研究区生态系统中的限制作用,但P限制作用更强,且毛竹林下高盖度的芒萁种群加剧了该作用。
两种芒萁覆盖度下毛竹林土壤酶活性及生态化学计量特征比较研究
Soil Enzyme Activities and Ecological Stoichiometric Characteristics under Two Coverage of Dicranopteris dichoyoma in Phyllostachys edulis Forest
-
摘要:
目的 探究毛竹林下不同盖度芒萁对土壤酶活性及生态化学计量特征的影响。 方法 在亚热带选取低芒萁盖度(PE:7.75%)和高芒萁盖度(DD:63.25%)的毛竹林为研究对象,测定土壤团聚体不同粒径碳(C)、氮(N)、磷(P)含量、参与土壤C、N、P循环的酶活性及其生态化学计量特征(EC:N:P)和不同类群微生物量。 结果 (1)PE和DD样方土壤β-葡糖苷酶活性和N-乙酰-葡糖苷酶活性无显著差异,与PE样方相比,DD样方显著增加了亮氨酸氨基肽酶、酸性磷酸酶和多酚氧化酶活性,但显著降低了过氧化物酶活性,且这种差异主要在大团聚体和中团聚体。(2)与PE样方团聚体粒径间EC:N和EN:P无差异不同,DD样方微团聚体EC:N显著高于大和中团聚体,而EN:P显著低于大和中团聚体;大和中团聚体EC:N:P在PE和DD样方之间无显著变差异,但DD样方微团聚体的EN:P和EC:P显著低于PE样方。(3)除丛枝菌根真菌和放线菌分别调控PE和DD样方土壤酶活性变异外,土壤全磷含量(TP)也是影响DD样方酶活性变异的主要因子;此外,土壤全氮含量(TN)和TP分别是调控大团聚体和中团聚体土壤酶活性变异的重要因子,且大团聚体土壤酶活性变异亦受到真菌生物量影响。 结论 毛竹林下不同盖度芒萁群落显著改变了土壤团聚体不同粒径参与C、N、P循环的酶活性及其生态化学计量特征,研究区生态系统同时受到C和P的限制作用,但P限制作用更强,且高盖度的芒萁种群加剧了该作用。 Abstract:Objective To explore the effects of different coverage of Dicranopteris dichoyoma on soil enzyme activities and ecological stoichiometric characteristics in Phyllostachys edulis forest. Method The content of soil organic carbon (C), total nitrogen (N), total phosphorus (P), soil enzyme activities involved in soil C, N, and P cycling, soil enzyme ecological stoichiometric characteristics (EC:N:P) and microbial biomass of different groups in soil aggregates were measured in moso bamboo forests with low Dicranopteris dichoyoma coverage (PE: 7.75%) and high Dicranopteris dichoyoma coverage (DD: 63.25%), respectively. Results (1) There was no significant difference in β-glucosidase and N-acetyl-glucosaminidase activities between PE and DD sites. The activities of Leucine-amino-peptidase, acid phosphatase and phenoloxidase significantly increased, but the activity of peroxidase significantly decreased in DD site, compared to PE site, which mainly occurred in large and small marcroaggregates. (2) There was no significant difference in EC:N and EN:P between different soil aggregates in PE site, but EC:N in microaggregate was significantly higher than that in large and small marcroaggregates, while EN:P in microaggregate was significantly lower than that in large and small marcroaggregates in DD site. The EC:N:P in large and small marcroaggregates in DD site equaled to that in PE site, but compare to PE site, the EN:P and EC:P in microaggregate significantly decreased in DD site. (3) In addition to arbuscular mycorrhizal fungi and actinomycetes regulating the variation of soil enzyme activities in PE and DD sites, soil total phosphorus content (TP) is also a major factor affecting the variation of enzyme activities in DD site. Soil total nitrogen content (TN) and TP were important factors in regulating the variation of soil enzyme activities in large and small marcroaggregates, respectively, and the variation of soil enzyme activity in large marcroaggregate was also affected by fungal biomass. Conclusion The responses of soil enzyme activities in different soil aggregates and ecological stoichiometric characteristics vary with the coverage of Dicranopteris dichoyoma population in Phyllostachys edulis forest, and the moso bamboo ecosystem is co-limited by both C and P, but the P restriction is more stronger, and the limited effect is exacerbated under high coverage of Dicranopteris dichoyom population in the study area. -
表 1 研究地基本情况
Table 1. Stand characteristics of Phyllostachys edulis
样方类型
Plot盖度
Canopy/
%立竹密度
Bamboo density/(株∙hm−2)新生竹株数
Current year bamboo/
株新生竹胸径
Mean DBH/
cm坡度
Slope/
(°)坡向
Aspect海拔
Altitude/
mPE 7.75 ± 0.63 B 4 993 ± 459 22.50 ± 4.66 10.64 ± 0.15 A <5 南 South 889 ± 3.35 DD 63.25 ± 3.84 A 4 550 ± 322 23.00 ± 2.48 9.71 ± 0.16 B <5 南 South 896 ± 2.21 注:PE:低芒萁盖度样方;DD:高芒萁盖度样方;下同。表中数值为均值 ± 标准误;不同大写字母表示在95%置信区间T检验结果显著(95%置信区间)
Notes: PE: Low coverage of Dicranopteris dichoyoma plots; DD: High coverage of D. dichoyoma plots; The same as bellows. Values in the table are mean values ± standard error; Different uppercase letters meant significant differences in T-test between PE and DD plots at P<0.05表 2 土壤酶种类和功能
Table 2. Soil enzyme and function
土壤酶
Soil Enzyme功能
Function底物
Substrate浓度
Concentration/(µmmol·L−1)β-葡糖苷酶
β-Glucosidase参与土壤碳循环:
降解纤维素成葡萄糖4-甲基伞形酮-β-D-葡萄糖苷
4-MUB-β-D-glucoside200 N-乙酰-葡糖苷酶
N-acetyl-glucosaminidase参与土壤氮循环:
降解几丁质4-甲基伞形酮-N-乙酰-β-D-氨基葡萄糖苷
4-MUB-N-acetyl-β-D-glucosaminide200 亮氨酸氨基肽酶
Leucine-amino-peptidase参与土壤氮循环:
降解蛋白质成氨基酸L-亮氨基-7-氨基-4-甲基香豆素
L-Leucine-7-amido-4-methylcoumarin200 酸性磷酸酶
Acid phosphatase参与土壤磷循环:
水解有机磷为无机磷4-甲基伞形酮-磷酸
4-MUB-phosphate100 多酚氧化酶
Phenoloxidase参与土壤碳循环:
降解木质素和芳香类物质L-3,4-二羟基苯丙氨酸
L-3,4-dihydroxyphenylalanine(DOPA)25 000 过氧化物酶
Peroxidase参与土壤碳循环:
降解木质素和芳香类物质L-3,4-二羟基苯丙氨酸
L-3,4-dihydroxyphenylalanine(DOPA)25 000 表 3 不同芒萁盖度毛竹林土壤团聚体化学性质和微生物特征
Table 3. Soil chemical properties and microbial properties of soil aggregate size classes in different plots
指标
Index团聚体粒径 Soil aggregate size/mm PE DD >2 0.25~2 <0.25 >2 0.25~2 <0.25 有机碳 SOC/(g·kg−1) 70.20 ± 2.54 Aa 78.90 ± 3.59 Aa 75.23 ± 2.93 Aa 61.85 ± 1.38 Bb 73.48 ± 2.49 Aa 69.98 ± 1.66 Aa 全氮 TN/(g·kg−1) 6.15 ± 0.25 Aa 6.65 ± 0.22 Aa 6.38 ± 0.37 Aa 5.13 ± 0.09 Bb 5.93 ± 0.15 Ba 5.55 ± 0.20 Aab 全磷 TP/(g·kg−1) 0.14 ± 0.01 Aa 0.16 ± 0.01 Aa 0.13 ± 0.00 Aa 0.07 ± 0.00 Bb 0.07 ± 0.00 Bb 0.10 ± 0.00 Ba 放线菌 ACT/(nmol·g−1) 2.90 ± 0.12 Bb 2.83 ± 0.05 Ab 3.54 ± 0.20 Aa 3.01 ± 0.33 Aa 2.99 ± 0.34 Aa 2.85 ± 0.15 Aa 丛枝菌根真菌 AMF/(nmol·g−1) 0.62 ± 0.02 Ab 0.80 ± 0.04 Aab 0.91 ± 0.09 Aa 0.63 ± 0.06 Aa 0.81 ± 0.11 Aa 0.79 ± 0.07 Aa 革兰氏阳性菌 GP/(nmol·g−1) 6.65 ± 0.30 Ab 7.06 ± 0.25 Ab 8.41 ± 0.60 Aa 7.42 ± 0.76 Aa 7.88 ± 0.84 Aa 6.79 ± 0.34 Aa 革兰氏阴性菌GN/(nmol·g−1) 2.68 ± 0.18 Ab 3.18 ± 0.23 Ab 4.21 ± 0.45 Aa 2.92 ± 0.31 Aa 3.60 ± 0.38 Aa 3.58 ± 0.24 Aa 细菌 B/(nmol·g−1) 16.14 ± 0.51 Ab 17.66 ± 0.54 Ab 21.61 ± 1.72 Aa 17.88 ± 1.86 Aa 19.93 ± 2.20 Aa 18.32 ± 1.03 Aa 真菌 F/(nmol·g−1) 2.47 ± 0.19 Ab 3.20 ± 0.29 Aa 3.76 ± 0.46 Aa 2.72 ± 0.26 Aa 3.53 ± 0.45 Aa 3.33 ± 0.26 Aa 注:表中数值为均值 ± 标准误;不同大写字母表示相同团聚体粒径不同样方T检验结果显著(95%置信区间),不同小写字母表示相同样方不同团聚体粒径单因素方差分析结果显著(95%置信区间)
Notes: Values in the table are mean values ± standard error; Different uppercase letters meant significant differences in T-test between PE and DD plots in the same aggregate size class at P<0.05, different lowercase letters meant significant differences in one-way ANOVA between different aggregate size classes in the same plots at P<0.05表 4 不同芒萁盖度和不同团聚体粒径毛竹林土壤酶活性主成分分析因子载荷矩阵
Table 4. Factor loading matrix for principal component analysis of soil enzyme activity in different plots and soil aggregate size classes
主成分 Principal component 指标
IndexPE DD >2 mm 0.25~2 mm <0.25 mm PCA1 PCA2 PCA1 PCA2 PCA1 PCA2 PCA1 PCA1 PCA2 PCA3 BG 0.767 0.613 0.373 0.682 0.439 0.853 0.792 0.059 0.737 −0.583 AP 0.653 0.595 0.332 0.838 0.937 0.185 0.890 0.556 0.752 0.228 NAG 0.456 −0.722 0.685 0.289 0.662 −0.522 0.746 −0.027 −0.773 −0.134 LAP 0.868 −0.242 0.882 −0.182 0.944 −0.136 0.719 −0.949 0.097 −0.204 PHE 0.770 −0.264 0.857 −0.176 0.930 −0.070 0.949 −0.526 0.275 0.741 PER −0.869 0.134 −0.785 0.534 −0.957 0.010 −0.909 0.922 −0.267 0.108 -
[1] BURNS R G, DEFOREST J L, MARXSEN J, et al. Soil enzymes in a changing environment: Current knowledge and future directions[J]. Soil Biology and Biochemistry, 2013, 58: 216-234. doi: 10.1016/j.soilbio.2012.11.009 [2] 王 一, 刘彦春, 刘世荣. 暖温带森林土壤酶活性对增温的响应及其环境解析[J]. 林业科学研究, 2017, 30(1):117-124. [3] 雷 蕾, 肖文发, 曾立雄, 等. 三峡库区2种马尾松混交林土壤团聚体酶活性分布特征[J]. 生态学报, 2020, 40(17):6179-6188. [4] STEINWEG J M, DUKES J S, PAUL E A, et al. Microbial responses to multi-factor climate change: effects on soil enzymes[J]. Frontiers in Microbiology, 2013, 4(2): 146. [5] SINSABAUGH R L, MOORHEAD D L. Resource allocation to extracellular enzyme production: A model for nitrogen and phosphorus control of litter decomposition[J]. Soil Biology and Biochemistry, 1994, 26(10): 1305-1311. doi: 10.1016/0038-0717(94)90211-9 [6] MOORHEAD D L, SINSABAUGH R L, HILL B H, et al. Vector analysis of ecoenzyme activities reveal constraints on coupled C, N and P dynamics[J]. Soil Biology and Biochemistry, 2016, 93: 1-7. doi: 10.1016/j.soilbio.2015.10.019 [7] SINSABAUGH R L, LAUBER C L, WEINTRAUB M N, et al. Stoichiometry of soil enzyme activity at global scale[J]. Ecology Letters, 2008, 11(11): 1252-1264. doi: 10.1111/j.1461-0248.2008.01245.x [8] LI P H, ZHOU G M, DU H Q, et al. Current and potential carbon stocks in Moso bamboo forests in China[J]. Journal of Environmental Management, 2015, 156: 89-96. [9] 樊艳荣, 陈双林, 林 华, 等. 不同林下植被干扰措施对毛竹林下植物种群分布格局的影响[J]. 生物多样性, 2013, 21(6):709-714. [10] 潘标志. 竹林化学防除芒萁骨为主杂草试验[J]. 福建林业科技, 2000, 27(2):76-78. [11] 王 一, 任立宁. 两种芒箕覆盖度下毛竹林土壤团聚体的稳定性及生态化学计量特征比较研究[J]. 热带亚热带植物学报, 2023, 31(3):315-324. [12] 任立宁, 刘世荣, 王 一, 等. 毛竹和林下植被芒萁凋落物分解特征研究[J]. 林业科学研究, 2018, 31(5):91-97. [13] 任立宁, 刘世荣, 蔡春菊, 等. 川南地区毛竹和林下植被芒萁细根分解特征[J]. 生态学报, 2018, 38(21):7638-7646. [14] 王 一, 栾军伟, 刘世荣, 等. 根系去除改变了毛竹林土壤酶活性对氮磷添加的响应[J]. 生态学报, 2023, 43(16):6515-6527. [15] 彭春菊, 李 全, 顾鸿昊, 等. 模拟氮沉降及经营方式对毛竹林土壤酶活性的影响[J]. 应用生态学报, 2017, 28(2):423-429. [16] 赵睿宇, 李正才, 王 斌, 等. 毛竹林地覆盖和翻耕对土壤酶活性及土壤养分含量的影响[J]. 林业科学研究, 2019, 32(5):67-73. [17] 李 娜, 韩晓增, 尤孟阳, 等. 土壤团聚体与微生物相互作用研究[J]. 生态环境学报, 2013, 22(9):1625-1632. [18] WANG R Z, DORODNIKOV M, YANG S, et al. Responses of enzymatic activities within soil aggregates to 9-year nitrogen and water addition in a semi-arid grassland[J]. Soil Biology and Biochemistry, 2015, 81: 159-167. doi: 10.1016/j.soilbio.2014.11.015 [19] 李玉敏, 冯鹏飞. 基于第九次全国森林资源清查的中国竹资源分析[J]. 世界竹藤通讯, 2019, 17(6):45-48. [20] 漆良华, 蒋俊明, 唐森强, 等. 川南山丘区典型退耕竹林凋落物产量动态与养分归还[J]. 林业科学, 2013, 49(10):17-22. [21] 袁星明, 朱宁华, 郭 耆, 等. 南亚热带不同人工林对土壤理化性质的影响及土壤质量评价[J]. 林业科学研究, 2022, 35(3):112-122. [22] SAIYA-CORK K R, SINSABAUGHA R L, ZAK D R. The effects of long term nitrogen deposition on extracellular enzyme activity in an Acer saccharum forest soil[J]. Soil Biology and Biochemistry, 2002, 34(9): 1309-1315. doi: 10.1016/S0038-0717(02)00074-3 [23] BOSSIO D A, SCOW K M. Impacts of carbon and flooding on soil microbial communities: phospholipid fatty acid profiles and substrate utilization patterns[J]. Microbial Ecology, 1998, 35(3-4): 265-278. [24] RUESS L, CHAMBERLAIN P M. The fat that matters: Soil food web analysis using fatty acids and their carbon stable isotope signature[J]. Soil Biology and Biochemistry, 2010, 42(11): 1898-1910. doi: 10.1016/j.soilbio.2010.07.020 [25] OLSSON P A. Signature fatty acids provide tools for determination of the distribution and interactions of mycorrhizal fungi in soil[J]. FEMS Microbiology Ecology, 1999, 29(4): 303-310. doi: 10.1111/j.1574-6941.1999.tb00621.x [26] GUO L J, ZHANG Z S, WANG D D, et al. Effects of short-term conservation management practices on soil organic carbon fractions and microbial community composition under a rice-wheat rotation system[J]. Biology and Fertility of Soils, 2014, 51(1): 65-75. [27] HUANG X M, LIU S R, WANG H, et al. Changes of soil microbial biomass carbon and community composition through mixing nitrogen-fixing species with Eucalyptus urophylla in subtropical China[J]. Soil Biology and Biochemistry, 2014, 73: 42-48. doi: 10.1016/j.soilbio.2014.01.021 [28] YOU Y M, WANG J, HUANG X M, et al. Relating microbial community structure to functioning in forest soil organic carbon transformation and turnover[J]. Ecology and Evolution, 2014, 4(5): 633-647. doi: 10.1002/ece3.969 [29] 张 闯, 邹洪涛, 张心昱, 等. 氮添加对湿地松林土壤水解酶和氧化酶活性的影响[J]. 应用生态学报, 2016, 27(11):3427-3434. [30] 许 焱, 伊力塔. 对芒萁的化感活性及化学成分薄层的探讨[J]. 现代园艺, 2019(4):11-12. [31] 张 煜, 张 旭, 邱子豪, 等. 芒萁的生态学与资源利用研究进展[J]. 草业科学, 2021, 38(8):1525-1536. [32] 杨 梅, 谭 玲, 叶绍明, 等. 桉树连作对土壤多酚氧化酶活性及酚类物质含量的影响[J]. 水土保持学报, 2012, 26(2):165-169 + 174. [33] 任立宁. 川南毛竹林土壤有机碳和土壤微生物研究[D]. 北京: 中国林业科学研究院, 2018. [34] 刘 宁, 何红波, 解宏图, 等. 土壤中木质素的研究进展[J]. 土壤通报, 2011, 42(4):991-996. [35] GUGGENBERGER G, ELLIOTT E T, FREY S D, et al. Microbial contributions to the aggregation of a cultivated grassland soil amended with starch[J]. Soil Biology and Biochemistry, 1999, 31(3): 407-419. doi: 10.1016/S0038-0717(98)00143-6 [36] SINSABAUGH R L, HILL B H, FOLLSTAD SHAH J J. Ecoenzymatic stoichiometry of microbial organic nutrient acquisition in soil and sediment[J]. Nature, 2009, 462(7274): 795-798. doi: 10.1038/nature08632 [37] WANG X, YOST R S, LINQUIST B A. Soil aggregate size affects phosphorus desorption from highly weathered soil and plant growth[J]. Soil Science Society of America Journal, 2001, 65(1): 139-146. doi: 10.2136/sssaj2001.651139x [38] 牛利敏, 秦 华, 徐秋芳, 等. 长期种植毛竹林土壤丛枝菌根真菌群落演变趋势[J]. 土壤学报, 2017, 54(3):722-734. [39] COLPAERT J V, LAERE A V. A comparison of the extracellular enzyme activities of two ectomycorrhizal and a leaf-saprotrophic basidiomycete colonizing beech leaf litter[J]. New Phytologist, 1996, 134(1): 133-141. doi: 10.1111/j.1469-8137.1996.tb01153.x [40] LUO G W, SUN B, LI L, et al. Understanding how long-term organic amendments increase soil phosphatase activities: Insight into phoD- and phoC-harboring functional microbial populations[J]. Soil Biology and Biochemistry, 2019, 139: 107632. doi: 10.1016/j.soilbio.2019.107632 -




 下载:
下载: