-
马尾松(Pinus massoniana Lamb.)作为我国亚热带特有树种,具有分布广、速生、丰产、适生能力较强等优良特性,是我国南方最主要工业用材树种之一,种植面积约占2/3以上[1],同时也是典型的先锋树种和外生菌根树种[2]。由于酸沉降、马尾松自身凋落物和根系分泌物的作用使得马尾松林地土壤酸化严重,并随连栽代数的增加而酸化增强[3]。我国南方马尾松林土壤心土层pH值一般小于4.5,交换性铝含量很高[4],因而马尾松常表现出中等以上程度的受害,甚至枯死,进而导致林地生态功能失调,水土保持功能下降。20世纪80年代,由于铝毒作用导致我国南方酸雨地区发生了马尾松林衰亡现象[5]。已有大量研究表明,真菌和植物根系形成的共生体——菌根,不仅能促进植物的生长,还能通过外延菌丝扩大植物根系的吸收面积,增强植物对营养和水分的摄取能力,从而提升宿主对干旱胁迫、盐分胁迫、低磷胁迫、重金属毒害等的耐受性[6-10]。菌根化育苗造林必将成为林业生态工程综合治理的重要前沿技术途径。而且,在自然界也存在既耐铝又耐贫瘠的优良菌株,如彩色豆马勃(Pisolithus tinctorius)[11],筛选更多的优良本土菌株,研究其提高寄主植物耐铝机制对退化森林的恢复具有重要意义。
松属植物(包括马尾松)是各种外生菌根真菌的天然宿主[12-13]。马尾松可与约 36 种外生菌根真菌形成菌根,其中,以牛肝菌科(Boletaceace)和红菇科(Russulaceae)的真菌占优势[14]。接种外生菌根真菌,可以提高马尾松在酸性土壤中的生存能力和耐铝性,是因为外生菌根真菌可以将重金属元素吸附、固定并积聚在菌根菌丝等部位,限制其向植物体内运输,也可以通过菌套和哈蒂氏网等菌根结构吸收过滤有毒物质[15]。而且菌根分泌的有机酸降低了活性铝含量,菌根还可以促进土壤中难溶养分的溶解,促进植物对土壤养分的吸收[4, 9, 16]。陈展等[17]也发现,模拟酸雨处理下接种外生菌根真菌的马尾松幼苗根系中Al含量下降,抵消了酸雨胁迫对马尾松的影响。 接种褐环乳牛肝菌(Suillus luteus)的马尾松幼苗,还改变了马尾松幼苗根系结构从而提高了马尾松幼苗的耐铝能力[18]。
植物根系细胞壁是与铝接触的最初部位,铝在根尖细胞壁上的积累是铝对植物根尖产生毒害的先决条件[19]。铝与细胞结合后,会影响一系列的细胞过程,如影响细胞壁酶活性[20]、营养物质交换[21]、细胞器损伤[22]、降低细胞延展性[23]等。目前,关于铝的亚细胞定位仍然是以推测性的为主[21, 23],而铝在马尾松菌根细胞的亚细胞定位还未见报道。因此,本试验利用前期筛选出的优良外生菌根真菌褐环乳牛肝菌接种马尾松幼苗,采用砂培盆栽浇铝法,分别设置4个Al3+浓度梯度处理,通过比较研究马尾松菌根/非菌根幼苗的生理、根尖细胞超微结构的变化以及Al的亚细胞分布,分析菌根化苗木对铝的响应及其提高寄主植物耐铝性的可能机理,为外生菌根真菌在提高寄主植物抗逆性和育苗造林应用等方面提供理论依据。
-
试验选取的外生菌根真菌褐环乳牛肝菌Suillus luteus(SL)采自贵州省龙里林场马尾松人工纯林(107°00′37″ E,26°28′01″ N),菌株保存于贵州省森林资源与环境中心微生物实验室。马尾松种子采自贵州省都匀市马鞍山林场国家马尾松良种基地的优良半同胞家系黄12单株,千粒质量为11.1 g。
-
以接种褐环乳牛肝菌的马尾松半年生苗为试验组(SL),未接种褐环乳牛肝菌的马尾松半年生苗为对照组(NE)。采用砂培盆栽,石英砂经漂洗、在高压灭菌锅内(压力0.14 MPa,121 ℃ ) 连续灭菌2 h 后,装入营养钵(口底高:21 cm × 15 cm × 18.5 cm) 备用。选取生长基本一致的半年生马尾松幼苗移栽至盆内,每盆3株,先正常生长2周后,用1/2 Hoagland营养液预培养2周后,再开始进行不同外源铝浓度处理。试验采用双因素完全随机区组设计,因素1设接菌(SL)和未接菌(NE)2个处理,因素2为铝离子浓度,设 4个水平(pH 4.1 ± 0.1),分别为:0(无铝SL0、NE0)、0.2(低铝SL02、NE02)、0.4(中铝SL04、NE04)和0.8(高铝SL08、NE08)mmol·L−1 。铝以AlCl3 形式加入Hoagland完全营养液;用0.1 mol·L−1 的稀HCl和NaOH调节pH值,为了保持铝的活性,在营养液中同时加入0.5 mmol·L−1 CaCl2,以避免铝离子与溶液中其它离子的相互作用。每周浇处理液1次。实验设3次重复,每个重复15株。
处理60 d后,每处理随机取样 20 株,轻轻抖掉根系表面石英砂,流水冲掉根部附着石英砂,超纯水清洗,选取新鲜混合根样用于抗氧化酶活性和MDA含量测定。将马尾松根先端0~20 mm部分用刀片迅速切下,分别用于根先端亚细胞组分Al含量测定和组织染色,取根尖0~4 mm用于根尖细胞超微结构观测。
-
分别选取不同处理马尾松幼苗根系鲜样0.1 g,使用苏州科铭生物技术有限公司试剂盒测定超氧化物歧化酶(SOD) 、过氧化物酶(POD) 、过氧化氢酶(CAT) 活性和丙二醛(MDA)含量。
-
根尖Al含量的测定:分别称取不同处理的烘干植物根样0.3 g左右于消解管中,向管内加入10 mL优级纯浓硝酸,不时振摇,直至无气泡;盖上管盖,浸泡过夜12 h;打开管盖,置于全自动微波消解仪,按以下升温梯度消解:80 ℃加热40 min,130 ℃加热60 min,165 ℃赶酸至管内液体约1 mL。冷却至室温,用超纯水定容至50 mL,待测。用等离子发射光谱仪 Prodigy XP在波长308.21 nm垂直观测。
亚细胞组分Al含量的测定:参考于姣妲等[21]的方法,采用差速离心法分离不同的细胞组分,依次得到细胞壁组分(F1)、细胞核组分(F2)、线粒体组分(F3)和以液泡为主的含核糖体的可溶组分(F4),全部操作在4 ℃下进行。参照LY/T 1270-1999《森林植物与森林枯枝落叶层全硅、铁、铝、钙、镁、钾、钠、磷、硫、锰、铜、锌的测定》,采用分光光度法测定各组分Al含量。
-
参考余燕[24]的方法采用氯化硝基四氮唑蓝(NBT)染色、3,3′-二氨基联苯胺(3,3′-diaminobenzidian,DAB)、荧光探针2′,7′-二氯荧光黄双乙酸盐(DCFH-DA;Beyotime,Jiangsu,China)和Schiff’s reagent(Sigma-Aldrich)试剂分别对根尖染色,并在智能型体视荧光显微镜(M205FA,德国莱卡)下观察O2·−、H2O2、ROS和MDA的分布。
-
铝处理第60 d,分别采集不同处理的新鲜根尖材料,迅速投进 2.5%戊二醛(0.1 mol·L−1 PBS 配制,pH 值7.0)的固定液里,抽气使材料沉底,在4 ℃冰箱里固定24 h后取出。再经漂洗、再固定、梯度脱水后渗透包埋,样品固化后使用莱卡 EMUC7 超薄切片仪修块、切片(50~70 nm),3% 醋酸铀-枸橼酸铅双染色。使用透射电镜 JEOL JEM-1230(80KV)观察并拍片。
以上数据分析处理及图表在SPSS21.0和Excel表格中完成。
-
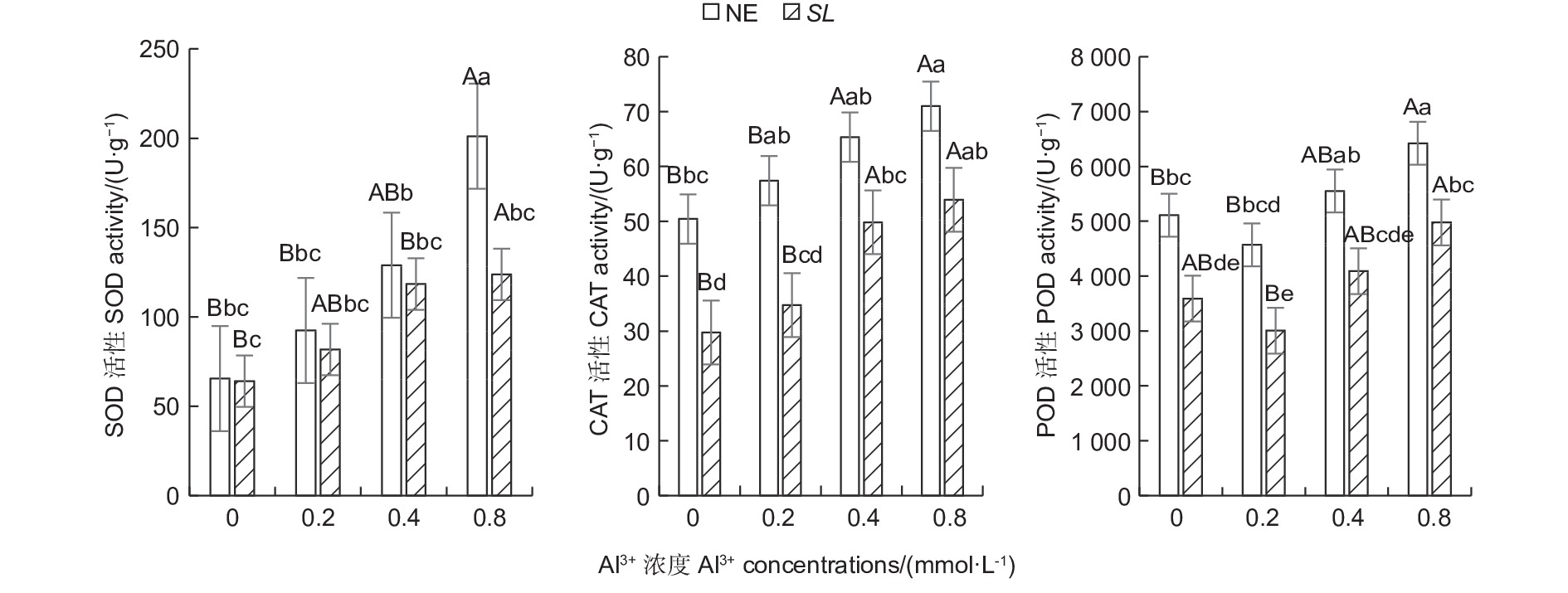
随铝浓度的升高,菌根和非菌根苗根系SOD、CAT活性均呈总体上升趋势,POD活性则呈先降低后升高趋势(图1),且未接菌NE组的抗氧化酶活性均高于接菌组,表明随着铝浓度的提升,根系抗氧化酶活性增强,并且,未接菌NE组受到铝的影响程度更大,接种SL在一定程度上缓解了铝毒害。其中,未接菌NE组在高铝(0.8 mmol·L−1)水平时SOD活性最高,达到201.14 U·g−1,且显著高于其他处理(P<0.05),其他各处理间差异不显著。CAT活性随铝浓度的提高呈上升趋势,在未接菌NE组中,高铝和中铝(0.4 mmol·L−1)水平下的CAT活性与无铝比差异显著,低铝(0.2 mmol·L−1)与无铝比差异不显著,接菌的SL组内,高铝和中铝水平下CAT活性与无铝比差异显著,低铝与无铝比差异不显著。接菌和未接菌组的POD活性均在低铝水平时最低,但与无铝比差异不显著,中铝与无铝比差异不显著,高铝水平下的POD活性显著高于无铝,且在同一铝浓度下,接菌组的POD均低于未接菌组。
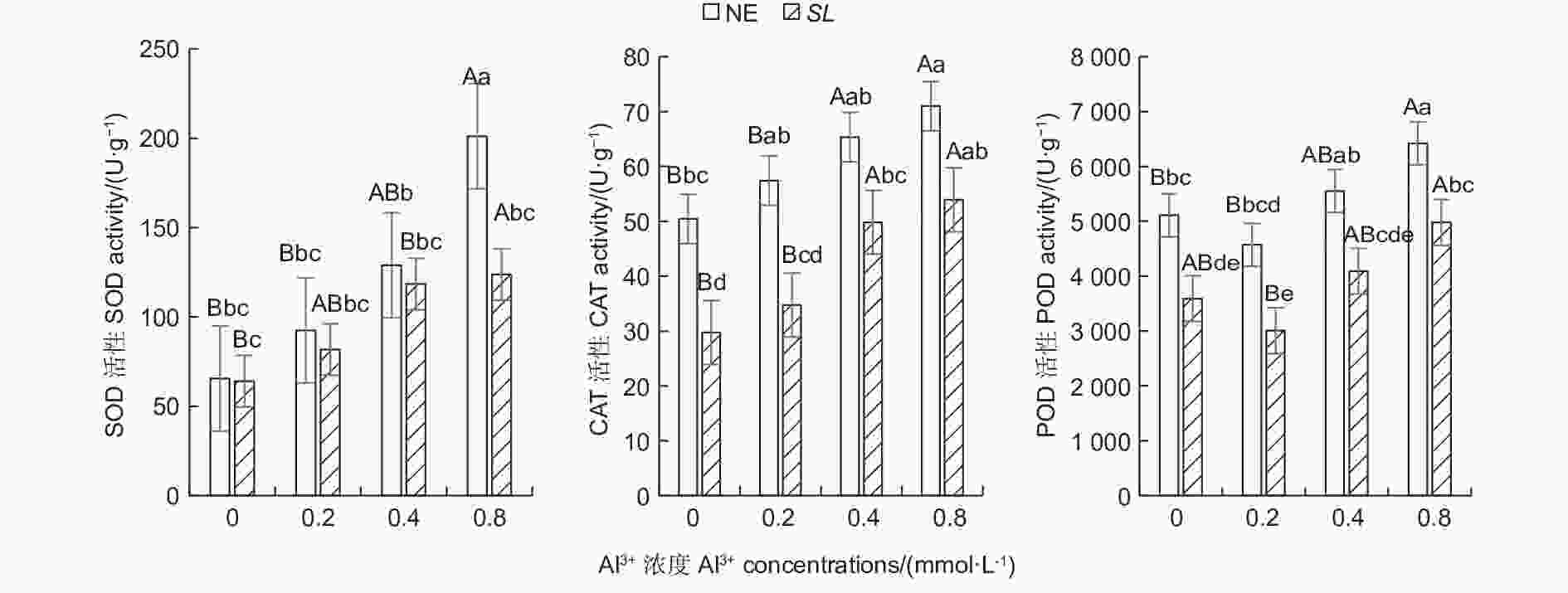
图 1 不同Al3+水平对马尾松根系抗氧化酶活性的影响
Figure 1. Effects on antioxidant enzyme activity in the root of Pinus massoniana seedlings at different aluminum levels
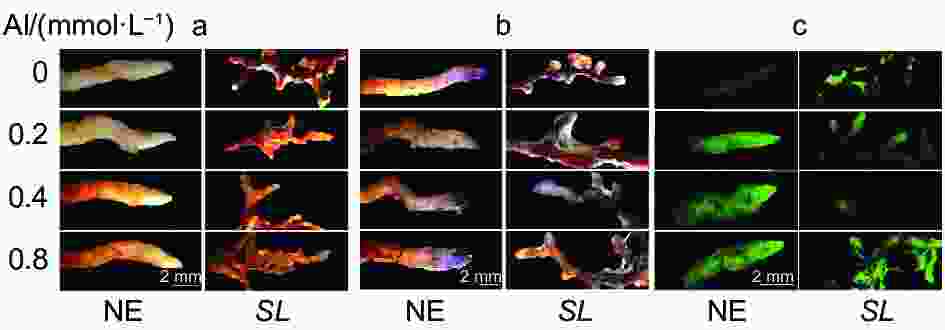
从组织染色(图2)也可以看出,马尾松未接菌NE组根尖DAB、NBT染色深度和DCHF-DA荧光强度均随着铝浓度的升高而逐渐加深,且各铝处理也使得根尖膨大、变粗、弯曲,表现出明显的铝毒害症状。而接菌SL组的各项染色均不明显,表明接菌后根尖的H2O2、O2·−及总活性氧ROS积累的含量不高,明显低于NE组,且各铝浓度间差异也不明显。
-
丙二醛(MDA)是表征植物细胞膜脂过氧化程度的重要指标。从图3a可以看出,随着外源铝浓度的升高,未接菌NE组的MDA含量呈逐渐上升趋势,在高铝(0.8 mmol·L−1)水平时含量最高,达5.10 nmol·g−1。接菌SL组的MDA含量呈现先降低后升高的趋势,在低铝(0.2 mmol·L−1)水平时MDA含量最低,为3.50 nmol·g−1。并且与无铝处理相比,从低铝到高铝,未接菌组MDA的增幅均大于接菌组,表明接菌苗缓解了根系细胞的膜脂过氧化程度,降低了铝对马尾松幼苗根尖的毒害作用。从Schiff’s reagent染色(图3b)的根尖也可以看出,随着铝浓度的升高,未接菌NE组的根尖染色均有不同程度的加深,表明铝处理加剧了马尾松幼苗根系膜脂过氧化程度。而接菌SL组的染色不明显,外源Al3+对菌根的膜脂过氧化程度影响较小。
-
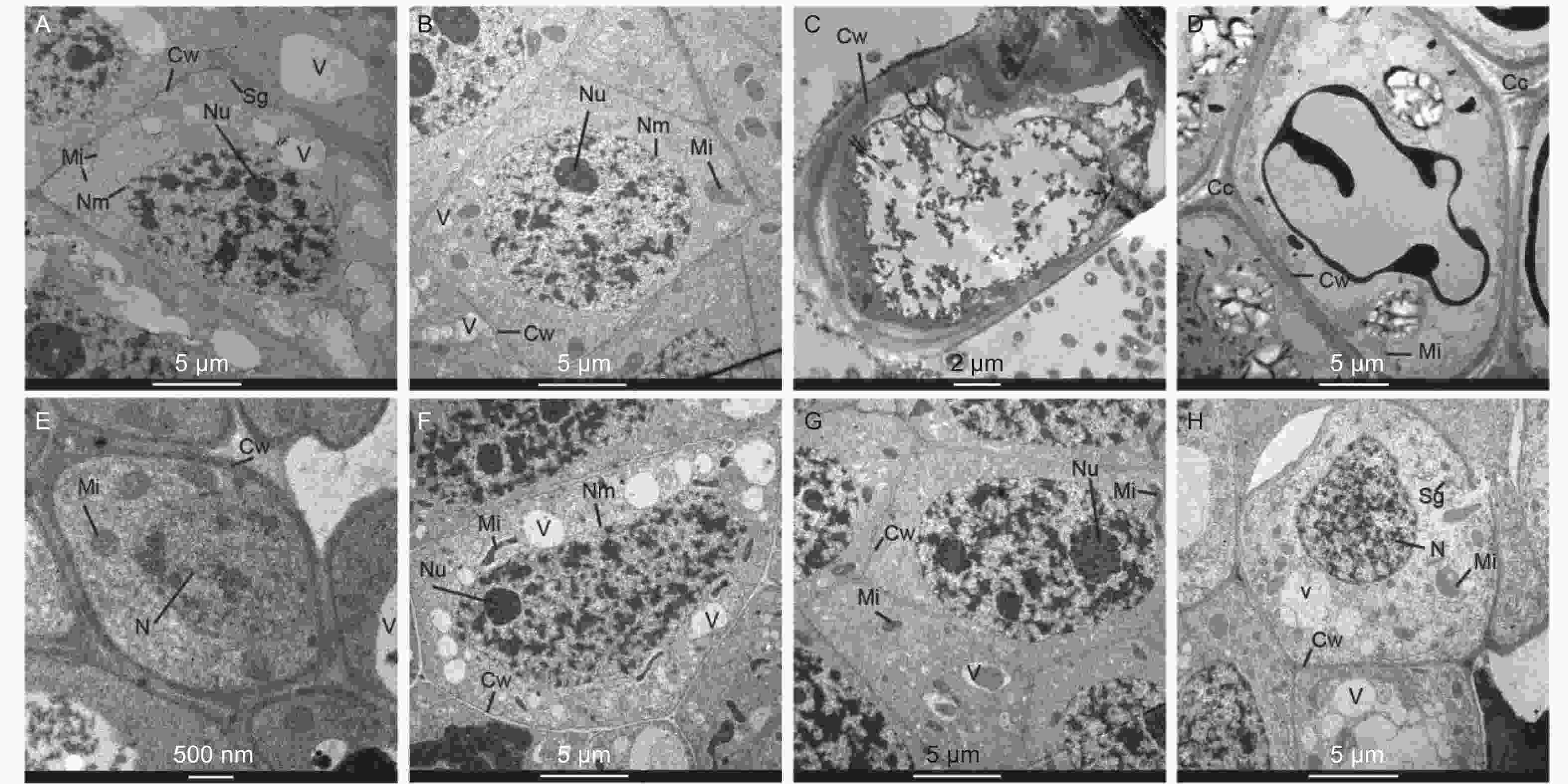
在马尾松未接菌NE组中(图4A~D),在无铝和低铝(0.2 mmol·L−1)水平下,根尖细胞排列紧密,细胞核、核仁、线粒体、液泡和都清晰可见,在无铝处理中还观察到淀粉粒,液泡较大且多;在低铝时,液泡则变得少且小,线粒体数量明显增加,且膨大变圆,核仁膨大。随着外源Al3+浓度的增加,在中铝(0.4 mmol·L−1)时,细胞壁明显增厚,细胞内液泡、细胞核等细胞器的膜结构遭到严重破坏,细胞空泡化现象十分严重,线粒体被挤压堆积在一侧,细胞核核质散入细胞质中。到高铝(0.8 mmol·L−1)时,细胞间隙增大,局部胞间层出现空隙,除细胞内各细胞器遭到严重破坏外,由于大量铝离子的进入而出现大面积黑色斑块。在接菌SL组(图4E~H),无铝处理的根尖边缘细胞较小,由于菌丝侵入皮层细胞间,形成哈蒂氏网,因此胞间层较厚且颜色较深。低铝时,根尖细胞内液泡增多且小,细胞核、核仁、线粒体等均清晰可见,线粒体结构完整。中铝时,细胞内线粒体膨大变圆,同时,由于铝不断向液泡转运,并在液泡中沉淀为黑色不溶颗粒,使液泡内颜色变深,直至结构遭到破坏,细胞质颜色变深。细胞核遭到破坏固缩,核物质凝聚,核膜不清晰,核仁膨大,有解体趋势。高铝时,液泡明显增大增多,细胞壁局部遭到破坏,发生了明显的质壁分离,线粒体数量进一步增加,细胞核膜被破坏,细胞核形状不规则化,核仁解散消失,核内染色质凝集。
-
如图5所示,在马尾松幼苗根尖中,随着外源Al3+浓度的提高,SL和NE组的根尖铝含量均呈上升趋势,同一铝浓度,SL组的根系铝含量都高于NE组。低铝下,菌根苗根尖吸收的铝含量显著高于非菌根苗,高出33.44%,中铝水平下,菌根苗根尖吸收的铝含量也高于非菌根苗,但差异不显著,到高铝时,菌根苗吸收的铝含量又显著高于非菌根苗,高出38.55%。表明接种褐环乳牛肝菌能够显著提高马尾松根系吸收铝的能力。
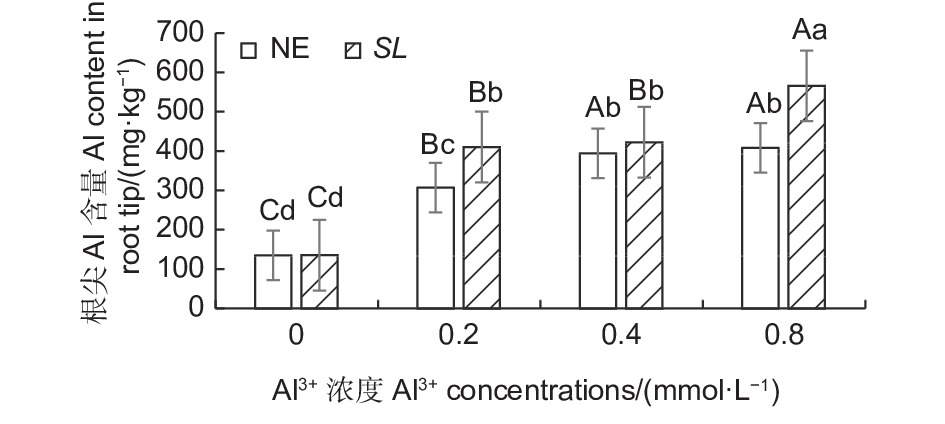
图 5 不同Al3+水平下未接菌/接菌幼苗根尖铝含量
Figure 5. Aluminium content in the root of inoculated and non-inoculated seedlings at different aluminum levels
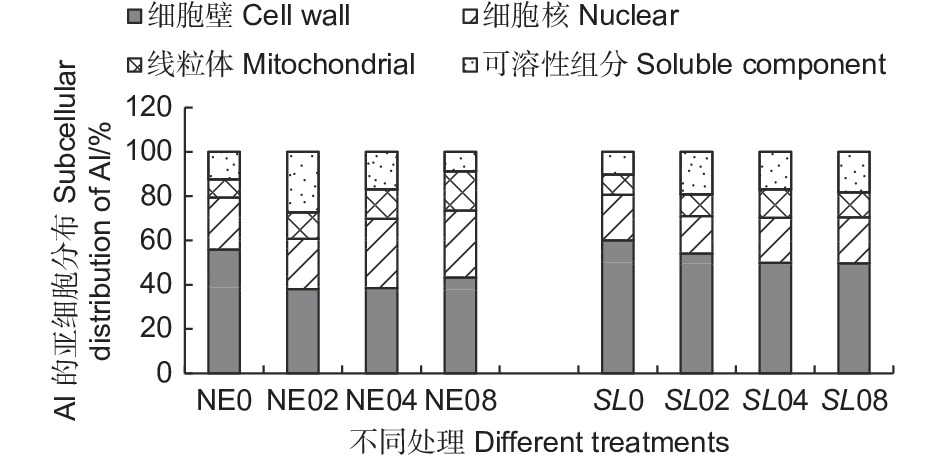
从根尖亚细胞组分的铝含量结果(表1) 可以看出,不同外源Al3+浓度处理下,铝在马尾松幼苗根尖的细胞壁组分(F1) 中含量最高,有铝处理时,平均铝含量在240.89~451.72 mg·kg−1 之间,在线粒体组分(F3) 中分布最少,表明铝在马尾松幼苗根系内主要分布在细胞壁,这可能是由于细胞壁对铝的滞留作用强,而使得其在线粒体内分布较少,而且由于菌根的吸附作用,使菌根苗的细胞壁吸收的铝更多。随Al3+浓度升高,铝在细胞壁组分(F1) 、细胞核组分(F2)和线粒体组分(F3)中富集均呈上升趋势,但在未接菌NE组中,铝在以液泡为主的可溶性组分(F4) 中的含量随铝浓度的升高反而减少,这可能是由于在高浓度的铝处理下,NE组的细胞核膜被破坏,核仁解体,染色质溶解在胞质中,在提取细胞核组分时,大部分的铝被提取至细胞核(F2)组分,而使可溶性组分中的铝含量下降。结果表明,铝胁迫使得马尾松幼苗根系将大部分铝吸附在细胞壁上,随着外源Al3+浓度的升高,马尾松幼苗根系亚细胞组分对铝的吸收总体呈增加趋势,随着铝胁迫的加强,由于细胞器受损,亚细胞组分中铝含量出现动态变化。
表 1 不同Al3+水平下马尾松幼苗根尖Al亚细胞组分分布
Table 1. The distribution of Al in subcellular components in the root tips of Pinus massoniana seedlings at different aluminum levels
不同处理
Different treatments细胞壁组分
Cell wall (F1) /(mg·kg−1)细胞核组分
Nuclear (F2)/(mg·kg−1)线粒体组分
Mitochondrial (F3) /(mg·kg−1)可溶组分
Soluble component (F4) /(mg·kg−1)NE0 76.52 ± 6.51 Ce 31.86 ± 4.41 Cd 11.36 ± 0.76 Ce 17.00 ± 0.76 Dd NE02 240.89 ± 1.64 Bd 143.84 ± 7.65 Bb 75.63 ± 6.13 Bc 173.47 ± 8.65 Aa NE04 287.67 ± 10.25 Ac 233.85 ± 11.28 Aa 98.98 ± 4.78 Bb 126.98 ± 16.68 Bb NE08 302.72 ± 6.10 Ac 212.51 ± 12.03 Aa 125.46 ± 13.81 Aa 61.49 ± 0.68 Cc SL0 81.72 ± 8.50 De 27.83 ± 3.37 Dd 12.32 ± 1.53 De 13.70 ± 1.78 Dd SL02 263.03 ± 7.07 Ccd 86.75 ± 34.65 Cc 47.88 ± 1.76 Cd 93.36 ± 1.10 Cbc SL04 369.68 ± 34.23 Bb 150.31 ± 10.48 Bb 94.52 ± 0.17 Bb 124.24 ± 1.91 Bb SL08 451.72 ± 14.78 Aa 189.66 ± 13.59 Aab 102.94 ± 1.69 Ab 169.28 ± 11.17 Aa 注:平均值 ± 标准误差(n=3),不同大写字母表示NE和SL组内不同铝浓度下差异显著,不同小写字母表示不同处理间差异显著(P<0.05)
Notes: mean ± SE(n=3). Different capital letters indicated that there were significant differences in NE or SL groups under different aluminum concentrations, different small letters indicated significant differences in the different treatments (P < 0.05)从铝在根尖亚细胞组分的分布(图6)可以看出,接菌和未接菌组在不同铝浓度处理下,铝的亚细胞分布的比例总体差异不大,其中,细胞壁(F1) 吸附的铝占据的比例最大,接菌SL组细胞壁(F1)所占比例在45.95%~59.98%之间,明显高于未接菌NE组。同时,SL组的细胞核组分(F2)和线粒体组分(F3)中所占比例则低于NE组。SL组的可溶性组分所占比在10.25%~20.80%之间,NE组所占比例8.77%~27.35%之间,差异较大,这可能与细胞器的结构破坏而导致的分布失调有很大关系。
-
本研究中,随着铝胁迫的增强,马尾松根系吸附的Al3+含量增加,根系的抗氧化酶活性增强,ROS增加,并进一步引起了MDA含量的增加,膜脂过氧化程度加重,表明铝对根细胞膜透性产生了不利影响,这是因为铝具有分别与细胞壁和膜的羧基和磷酸基结合的能力[25]。植物在铝胁迫下会引起线粒体和过氧化物酶体中活性氧(ROS)的产生[26],由于抗氧化机制失衡,又进一步引发细胞成分的氧化损伤[27-28]。铝引起的ROS系统失衡和细胞壁性质的改变是造成铝毒害的两个内在因素[23]。
Yamamoto等[29]揭示了大量的铝会导致细胞内过多的活性氧(ROS)积累,最终导致细胞死亡。而在本研究中,接菌SL后,丙二醛含量和抗氧化酶活性相对较低,表明SL缓解了马尾松中与ROS相关的损伤,降低了铝毒性,而接菌组SL和未接菌组NE之间的差异不明显,则是由于植物对逆境的生理响应往往发生在逆境初期,经过60 d的处理,植物体内的铝含量和根系介质中的铝含量达到了一个动态平衡状态,植物通过前期的各种生理调节而逐渐适应了现有的铝浓度,形成新的生理稳定状态,因而两组处理中的抗氧化酶活性和MDA含量往往差异不显著。褐环乳牛肝菌(SL)是一种广泛存在于松林中的外生菌根真菌。大量研究表明SL是一种耐铝真菌[30-31],有利于铝污染地区松苗的再生和种植。本项研究的结果完全证实了前人的发现,接种SL的马尾松能够更好地耐受铝胁迫。
-
细胞壁是有害金属进入植物根系的第一道屏障[32]。Kopittke 等[33]发现,植物暴露在铝环境下,铝立即与根表面的细胞外壁结合,因此认为铝的主要病变是质外体。本研究中,铝在马尾松幼苗根系细胞壁(F1) 中分布最多,这也证明铝与细胞壁的结合是马尾松耐铝毒的重要机制之一。铝离子主要与细胞壁的果胶基质、带负电荷的羧基及质膜的外表面结合[34-35],结合区主要位于根尖的铝敏感根区,从而损害质外体和共质体的细胞功能。此外,由于细胞壁含有蛋白质和多糖以及大量配位基团(羟基、羧基、醛基、氨基等) ,容易吸附Al3+[21]。马尾松根尖带负电的细胞壁能够大量吸附带正电的Al3+。本研究通过细胞超微结构观察也清晰证实了Al在细胞壁周围聚集。在铝胁迫下,铝离子在细胞壁上强烈而快速的结合破坏了细胞壁的结构和机械性能,降低了细胞壁的延展性,从而抑制了根系的伸长。
除细胞壁组分F1外,细胞核组分F2的铝含量最高,由根尖细胞超微结构可见,随着铝浓度升高,细胞核膜、核仁和染色质都受到了明显的破坏,细胞核内核酸等大分子物质外渗,细胞结构被严重破坏,细胞功能丧失。细胞核是细胞遗传代谢的调控中心,铝离子渗入细胞核内,易与核酸大分子物质结合,造成凝集,染色体断裂畸变,核酸代谢失常,细胞核损伤必然严重影响植物正常基因的调控及细胞分化[21]。铝对细胞核结构影响的同时,也会对DNA组成、模板活性和染色质结构产生不利影响[36]。铝还通过增加双螺旋上的刚性来限制DNA的复制[36-38]。
本研究中,未接菌NE组在高铝水平下,核膜、质膜、线粒体和液泡等的结构和形态都发生明显改变,植株表现出了明显的受害症状。细胞内的膜系统因铝离子的结合造成了破坏,其机制可能是由于铝离子与生物膜有着强烈的亲和力,可以导致膜的僵化变形,破坏细胞膜的结构和功能,改变膜的流动性,从而使膜功能散失。铝还通过与脂类、糖类和蛋白质作用而破坏膜的延展性,改变膜透性使细胞内物质向外渗漏作用加强,干扰细胞的各种调节过程,从而影响植株正常生长。由于生物膜受到破坏,大量线粒体肿胀,空泡增多,质膜破坏。凋亡前的核结构破坏被大多学者认为是铝胁迫的细胞特征,并认为铝信号遵循细胞死亡的线粒体途径[36, 39]。线粒体是细胞进行有氧呼吸制造能量的主要场所,线粒体等细胞器的消失或破坏会造成根的呼吸受阻,呼吸效率降低,不利于根的生长和对水分及营养的吸收[40],这也是本研究中马尾松幼苗根系抗氧化酶活性增强和MDA含量增加的原因。同时,其他生理代谢因受铝胁迫发生的变化也可能是细胞内部基因表达受到抑制或改变而产生的。在本研究中,NE组在高浓度铝水平下,由于细胞膜被破坏,无法阻隔Al3+侵入细胞核等细胞器,使植物明显受到铝毒害。而接种SL后,由于菌根对铝的吸附作用,侵入细胞内的铝离子含量相对较低,从而使得SL组细胞内细胞核组分(F2)和线粒体组分(F3)中的铝含量维持在较低水平,保护了亚细胞器结构,维持了细胞的基本功能,从而缓解了铝毒性。同时,植物可以通过液泡的区室化作用将重金属吸收在液泡中,降低重金属毒害,从图4G的细胞超微结构可以明显看出,接种SL在0.4 mmol·L−1铝水平下,液泡中吸收了大量的Al3+,因而根尖细胞受到的铝毒害作用明显较未接菌组小,受害症状也更小。
-
铝离子被马尾松幼苗根系吸收后,对根尖细胞的结构和功能产生了一系列的影响。Al3+与带负电的细胞壁结合,并被大量吸附而沉积,破坏细胞壁的结构和机械性能,降低了细胞壁的延展性,从而抑制了马尾松幼苗根系的伸长。进入细胞内的Al3+与生物膜有着强烈的亲和力,破坏了以蛋白质为主要成分的细胞膜的结构和功能,改变了膜的流动性和透性,使细胞器物质向外渗漏作用加强,干扰细胞的各种调节过程。核膜的破坏导致大量铝离子渗入细胞核内,Al3+与核酸大分子物质结合,造成凝集,染色体断裂畸变,核酸代谢失常。同时,Al3+使线粒体消失或破坏,造成根的呼吸受阻,在生理水平上造成根系抗氧化酶活性增强和MDA含量增加。而接种SL后,由于菌根对铝的吸附作用,侵入细胞内的铝离子含量相对较低,使细胞内细胞核和线粒体组中的铝含量维持在较低水平,并通过液泡的区室化作用将Al3+隔离在液泡中,保护了亚细胞器结构,维持了细胞的基本功能,从而缓解了铝毒性。进一步证明菌根可以通过吸附大量的铝而达到减少根尖铝毒害和提高植物耐铝能力的目的,这很可能是马尾松菌根苗的一个重要外部抗性机制。
铝对马尾松菌根化幼苗抗逆生理和根尖细胞超微结构的影响
Effects of Aluminum on Stress Resistance Physiology and Root Tip Cell Ultrastructure of Mycorrhizal Seedlings of Pinus massoniana
-
摘要:
目的 不同Al3+水平下,研究马尾松菌根/非菌根幼苗的生理、根尖细胞超微结构的变化以及Al的亚细胞分布,分析菌根化苗木对铝的响应及其耐铝性,为外生菌根真菌提高寄主植物耐铝性和育苗造林应用提供理论依据。 方法 以半年生菌根和非菌根马尾松苗为材料,采用砂培盆栽浇铝法,分别设置 0、0.2、0.4、0.8 mmol·L−1 Al3+ (AlCl3) 处理,分析其根系抗氧化酶活性和MDA含量等生理指标变化,Al的亚细胞分布,通过组织染色观察根尖ROS和MDA分布,并观察根尖超微结构变化。 结果 (1)随外源[Al3+]的升高,马尾松菌根/非菌根苗根系SOD、CAT、POD活性和MDA含量均呈总体上升趋势,在高铝(0.8 mmol·L−1)水平时,抗氧化酶活性和MDA含量最大,且非菌根苗受到铝的影响程度更大;(2)随外源[Al3+]的升高,马尾松根尖吸收的铝含量显著增加,且菌根苗吸收的铝含量显著高于非菌根苗;(3)从细胞超微结构和Al的亚细胞分布看,大量Al3+首先与细胞壁结合,细胞内的Al3+与生物膜强烈结合,使细胞器物质向外渗漏作用加强,干扰细胞核和线粒体等的各种调节过程。而由于菌根对铝的吸附作用,降低了侵入细胞内的铝离子含量,保护亚细胞器结构的同时也维持了细胞的基本功能,从而缓解铝毒性。 结论 铝处理使马尾松根系抗氧化酶活性和MDA含量增加,0.4 mmol·L−1以上的铝浓度产生明显铝毒害症状。而菌根可以通过吸收更多的铝降低铝毒害,并提高植物耐铝能力,这很可能是马尾松菌根苗的一个重要外部抗性机制。 Abstract:Objective To provide theoretical basis for the application of ectomycorrhizal fungi in improving the aluminum tolerance of host plants and afforestation, we studied the changes of physiology, root tip cell ultrastructure and subcellular distribution of Al in mycorrhizal / non mycorrhizal seedlings of Pinus massoniana under different Al3+ levels. Method Semi annual mycorrhizal and non mycorrhizal P. massoniana seedlings were treated with 0, 0.2, 0.4 and 0.8 mmol·L−1 Al3+ (AlCl3) respectively by sand culture and pot irrigation with aluminum. We analyzed the changes of antioxidant enzyme activity, MDA content and subcellular distribution of Al in roots, the distribution of ROS and MDA in roots, and the ultrastructure of root tips. Results (1) With the increase of exogenous aluminum concentration, the activities of SOD, CAT, POD and the content of MDA in the roots of mycorrhizal / non mycorrhizal seedlings of masson pine showed an overall upward trend. At high aluminum level (0.8 mmol·L−1), the activities of antioxidant enzymes and the content of MDA were the highest, and the non mycorrhizal seedlings were more affected by aluminum. (2) With the increase of exogenous aluminum concentration, the aluminum content absorbed by root tips of P. massoniana increased significantly, and the aluminum content absorbed by mycorrhizal seedlings was significantly higher than that of non mycorrhizal seedlings. (3) From the cell ultrastructure and subcellular distribution of Al, a large number of Al3+ first combined with the cell wall, and the intracellular Al3+ strongly combined with the biofilm, which strengthened the leakage of organelles and interfered with various regulatory processes of nucleus and mitochondria. Because of the adsorption of aluminum by mycorrhiza, the content of aluminum ions in cells reduced, the structure of subcellular organelles was protected, the basic function of cells was maintained, and the toxicity of aluminum was alleviated. Conclusion The antioxidant enzyme activity and MDA content of root of P. massoniana are increased by aluminum treatment, and aluminum with 0.4 mmol·L−1 produces obvious aluminum toxicity symptoms. Mycorrhizal fungi can reduce aluminum toxicity and improve plant aluminum tolerance by absorbing more aluminum, which is probably an important external resistance mechanism of root seedlings mycorrhiza of P. massoniana. -
表 1 不同Al3+水平下马尾松幼苗根尖Al亚细胞组分分布
Table 1. The distribution of Al in subcellular components in the root tips of Pinus massoniana seedlings at different aluminum levels
不同处理
Different treatments细胞壁组分
Cell wall (F1) /(mg·kg−1)细胞核组分
Nuclear (F2)/(mg·kg−1)线粒体组分
Mitochondrial (F3) /(mg·kg−1)可溶组分
Soluble component (F4) /(mg·kg−1)NE0 76.52 ± 6.51 Ce 31.86 ± 4.41 Cd 11.36 ± 0.76 Ce 17.00 ± 0.76 Dd NE02 240.89 ± 1.64 Bd 143.84 ± 7.65 Bb 75.63 ± 6.13 Bc 173.47 ± 8.65 Aa NE04 287.67 ± 10.25 Ac 233.85 ± 11.28 Aa 98.98 ± 4.78 Bb 126.98 ± 16.68 Bb NE08 302.72 ± 6.10 Ac 212.51 ± 12.03 Aa 125.46 ± 13.81 Aa 61.49 ± 0.68 Cc SL0 81.72 ± 8.50 De 27.83 ± 3.37 Dd 12.32 ± 1.53 De 13.70 ± 1.78 Dd SL02 263.03 ± 7.07 Ccd 86.75 ± 34.65 Cc 47.88 ± 1.76 Cd 93.36 ± 1.10 Cbc SL04 369.68 ± 34.23 Bb 150.31 ± 10.48 Bb 94.52 ± 0.17 Bb 124.24 ± 1.91 Bb SL08 451.72 ± 14.78 Aa 189.66 ± 13.59 Aab 102.94 ± 1.69 Ab 169.28 ± 11.17 Aa 注:平均值 ± 标准误差(n=3),不同大写字母表示NE和SL组内不同铝浓度下差异显著,不同小写字母表示不同处理间差异显著(P<0.05)
Notes: mean ± SE(n=3). Different capital letters indicated that there were significant differences in NE or SL groups under different aluminum concentrations, different small letters indicated significant differences in the different treatments (P < 0.05) -
[1] 周政贤. 中国马尾松[M]. 北京: 中国林业出版社, 2001: 3-10. [2] 马 琼, 黄建国, 蒋剑波. 接种外生菌根真菌对马尾松幼苗生长的影响[J]. 福建林业科技, 2005, 32(2):85-88. [3] 仝雅娜, 丁贵杰. 1, 2代马尾松林土壤不同形态铝含量[J]. 林业科学, 2012, 48(6):8-11. doi: 10.11707/j.1001-7488.20120602 [4] 周志峰, 王明霞, 袁 玲, 等. 不同生境外生菌根真菌对铝胁迫的响应[J]. 生态学报, 2016, 36(10):2842-2850. [5] 杜晓明, 田仁生. 重庆南山马尾松衰亡与铝中毒[J]. 环境科学学报, 1996, 16(6):21-25. [6] WANG J, HUANG Y, JIANG X Y. Influence of ectomycorrhizal fungi on absorption and balance of essential elements of Pinus tabulaeformis seedlings in saline soil[J]. Pedosphere, 2011, 21(3): 400-406. doi: 10.1016/S1002-0160(11)60141-0 [7] 王 艺, 张 弛, 丁贵杰, 等. 干旱胁迫对马尾松菌根化苗木水分生理和光合特性的影响[J]. 浙江林业科技, 2019, 39(4):1-8. [8] ZHANG T, WEN X P, DING G J. Ectomycorrhizal symbiosis enhances tolerance to low phosphorous through expression of phosphate transporter genes in masson pine (Pinus massoniana)[J]. Acta Physiol Plant, 2017, 39(7): 101. doi: 10.1007/s11738-017-2392-y [9] 辜夕容, 倪亚兰, 江亚男, 等. 接种双色蜡蘑对马尾松根际土壤无机磷和活性铝含量的影响[J]. 土壤学报, 2018, 55(5):1179-1189. doi: 10.11766/trxb201802120407 [10] YU P Y, SUN Y P, HUANG Z L, et al. The effects of ectomycorrhizal fungi on heavy metals’ transport in Pinus massoniana and bacteria community in rhizosphere soil in mine tailing area[J]. Journal of Hazardous Materials, 2020, 381: 121203. doi: 10.1016/j.jhazmat.2019.121203 [11] 张 薇, 黄建国, 袁 玲, 等. 外生菌根真菌对Al3+胁迫和低钾土壤的响应[J]. 环境科学, 2014, 35(10):3862-3868. [12] RINCÓN A, ALVAREZ I F, PERA J. Inoculation of containerized Pinus pinea L. seedlings with seven ectomycorrhizal fungi[J]. Mycorrhiza, 2001, 11(6): 265-271. doi: 10.1007/s005720100127 [13] LU N, YU M, CUI M, et al. Effects of different ectomycorrhizal fungal inoculates on the growth of Pinus tabulaeformis seedlings under greenhouse conditions[J]. Forests, 2016, 7(12): 316. doi: 10.3390/f7120316 [14] 安 丽. 我国森林生态系统的外生菌根研究进展[J]. 陕西林业科技, 2014, 42(2):14-21. doi: 10.3969/j.issn.1001-2117.2014.02.004 [15] 王明霞, 袁 玲, 周志峰, 等. 铝对外生菌根真菌草酸分泌及氮磷钾吸收的影响[J]. 林业科学, 2012, 48(2):82-88. [16] 高 悦, 吴小芹, 孙民琴. 马尾松不同菌根苗对氮磷钾的吸收利用[J]. 南京林业大学学报(自然科学版), 2009, 33(4):77-80. [17] 陈 展, 尚 鹤. 接种外生菌根菌对模拟酸雨胁迫下马尾松营养元素的影响[J]. 林业科学, 2014, 50(1):156-163. [18] 汪远秀, 李快芬, 丁贵杰, 等. 铝对马尾松菌根苗生长及营养元素吸收的影响[J]. 森林与环境学报, 2020, 40(2):119-125. [19] 周 圆. 一氧化氮和根系分泌物在植物铝毒害和耐铝机制中的作用[D]. 杭州: 浙江大学, 2012. [20] 姜 娜, 任 健, 罗富成, 等. 铝胁迫对不同耐铝基因型紫花苜蓿根尖及细胞壁氧化酶活性的影响[J]. 中国草地学报, 2020, 42(6):15-22. [21] 于姣妲, 夏丽丹, 殷丹阳, 等. 磷素对杉木幼苗耐铝性的影响机制[J]. 林业科学, 2018, 54(5):36-47. [22] 谈建康, 孔繁翔. 酸沉降对马尾松菌根内Al积累和细胞损伤的影响[J]. 中国环境科学, 2004, 24(4):424-428. [23] SINGH S, TRIPATHI D K, SINGH S, et al. Toxicity of aluminium on various levels of plant cells and organism: A review[J]. Environmental and Experimental Botany, 2017, 137: 177-193. doi: 10.1016/j.envexpbot.2017.01.005 [24] 余 燕. 多胺对小麦耐铝性的调控作用及其机理[D]. 杭州: 浙江大学, 2016. [25] GUNSÉ B, POSCHENRIEDER C, BARCELÓ J. Water transport properties of roots and root cortical cells in proton- and Al-stressed maize varieties[J]. Plant Physiol, 1997, 113(2): 595-602. doi: 10.1104/pp.113.2.595 [26] KOCHIAN L V, HOEKENGA O A, PIÑEROS M A. How do crop plants tolerate acid soils? Mecllanisms of aluminum tolerance and phosphorus efficiency[J]. Annual Review of Plant Biology, 2004, 55: 459-493. doi: 10.1146/annurev.arplant.55.031903.141655 [27] DARKO E, AMBRUS H, STEFANOVITS-BÁNYAI E, et al. Aluminium toxicity, Al tolerance and oxidative stress in an Al-sensitive wheat genotype and in Al-tolerant lines developed by in vitro microspore selection[J]. Plant Science, 2004, 166(3): 583-591. doi: 10.1016/j.plantsci.2003.10.023 [28] SHARMA P, DUBEY R S. Involvement of oxidative stress and role of antioxidative defense system in growing rice seedlings exposed to toxic concentrations of aluminum[J]. Plant Cell Reports, 2007, 26(11): 2027-2038. doi: 10.1007/s00299-007-0416-6 [29] YAMAMOTO Y, KOBAYASHI Y, MATSUMOTO H. Lipid peroxidation is an early symptom triggered by aluminum, but not the primary cause of elongation inhibition in pea roots[J]. Plant Physiology, 2001, 125(1): 199-208. doi: 10.1104/pp.125.1.199 [30] LIU H Y, CHEN H Y, DING G J, et al. Identification of candidate genes conferring tolerance to Aluminum stress in Pinus massoniana inoculated with ectomycorrhizal fungus[J]. BMC Plant Biology, 2020, 20: 521. doi: 10.1186/s12870-020-02719-3 [31] WANG M, YUAN L, HUANG J, et al. Al3+ absorption and assimilation by four ectomycorrhizal fungi[J]. Environment Science, 2015, 36(9): 3479-3485. [32] TAYLOR G J, STEPHENS J L, HUNTE D B, et al. Direct measurement of aluminium uptake and distribution in single cells of Chara coralline[J]. Plant Physiology, 2000, 123(3): 987-996. doi: 10.1104/pp.123.3.987 [33] KOPITTKE P M, MOORE K L, LOMBI E, et al. Identification of the primary lesion of toxic aluminum in plant roots[J]. Plant Physiology, 2015, 167(4): 1402-1411. doi: 10.1104/pp.114.253229 [34] BLAMEY F P C, ASHER C J, EDWARDS D G, et al. In vitro evidence of aluminium effects on solution movement through root cell walls[J]. Journal of Plant Nutrition, 1993, 16(4): 555-562. doi: 10.1080/01904169309364556 [35] CHANG Y C, YAMAMOTO Y, MATSUMOTO H. Accumulation of aluminium in the cell wall pectin in cultured tobacco (Nicotiana tabacum L. ) cells treated with a combination of aluminium and iron[J]. Plant Cell Environment, 1999, 22(8): 1009-1017. doi: 10.1046/j.1365-3040.1999.00467.x [36] GUPTA N, GAURAV S S, KUMAR A. Molecular basis of aluminium toxicity in plants: a Review[J]. American Journal of Plant Sciences, 2013, 4(12): 21-37. [37] VARDAR F, UNAL M. Aluminum toxicity and resistance in higher plants[J]. Advances in Molecular Biology, 2007, 1: 1-12. [38] ZHANG H H, JIANG Z, QIN R, et al. Accumulation and cellular toxicity of aluminum in seedling of Pinus massoniana[J]. BMC Plant Biology, 2014, 14(1): 264. doi: 10.1186/s12870-014-0264-9 [39] čIAMPOROVÁ M. Diverse responses of root cell structure to aluminum stress[J]. Plant Soil, 2000, 226(1): 113-116. doi: 10.1023/A:1026468403157 [40] 钱莲文, 吴文杰, 孙境蔚, 等. 铝胁迫对常绿杨生长及叶肉细胞超微结构的影响[J]. 林业科学, 2016, 52(11):39-46. doi: 10.11707/j.1001-7488.20161105 -




 下载:
下载: