-
山地生态系统常常被视为研究土壤微生物群落和气候变化的天然场所[1],山地海拔梯度变化会改变植被类型、影响土壤性质,从而对微生物多样性和群落组成产生重要影响[2]。土壤微生物驱动着土壤有机质周转和养分循环,在污染物转化与分解、温室气体产生和消减等过程中起着重要作用,直接影响着生物地球化学循环等生态过程[3]。在未来全球变暖的背景下,土壤微生物的作用至关重要[1],气候变暖导致温度、二氧化碳升高,很可能造成土壤微生物群落组成和功能发生变化[4]。因此,研究土壤微生物的海拔分布格局及其驱动机制将为未来气候变化的响应和预测提供重要依据[5]。
目前,对于土壤微生物在海拔梯度上的多样性模式及驱动因素研究仍无统一定论,前人研究表明微生物多样性呈单调型[6]、驼峰型或U型[7]、独立趋势[8]等,不同因素影响着土壤微生物的海拔梯度分布,如Kou等[9]发现土壤pH、植物丰富度是影响贡嘎山土壤微生物组成的重要因素。上述研究多集中在温带高山冻原区、青藏高原高山气候区及温带季风气候区等[10-11],具有大跨度海拔梯度不同生态系统的研究特点。已有研究表明微生物取样的尺度将强烈影响观察到的模式[12],然而目前罕见在同一生态系统的小跨度海拔梯度内的研究。常绿阔叶林是南方亚热带典型地带性森林类型,天然垂直分布于海拔1 000~2 000 m以下的中低山丘陵区域[13],具有海拔间隔和垂直距离相对较小的特点。已有亚热带森林土壤微生物研究多集中在针叶林中开展,如Huang等[14]发现SOC和全氮是影响针叶林土壤微生物群落变化的主要因素,对于小跨度海拔梯度的亚热带常绿阔叶林同一森林生态系统土壤微生物研究甚少,已有的大跨度海拔梯度的高山地区、不同气候带或植被类型等的土壤微生物研究结果是否同样适用于亚热带小跨度海拔梯度分布的常绿阔叶林林分尚不得而知。
郭岩山地处亚热带地区,其分布的丝栗栲(Castanopsis fargesii Franch.)天然林具有典型的亚热带植被带分布特征[15]。丝栗栲是亚热带常绿阔叶林中的常见优势树种,也是我国东南林区重要建群树种,该树种分布广泛,具有较高的经济、生态和科学价值[16]。已有丝栗栲的研究多集中在叶片酚类化合物[16]、种群分化的生态足迹[17],叶和根CNP的差异[18]、土壤有机碳[19]、外生菌根[20]等方面,仅有Qiao等[16]研究了丝栗栲土壤微生物群落不同生长季节的变化,对丝栗栲天然林分土壤微生物生态地理学的详细研究尚未见报道。因此本研究拟采用高通量测序技术对500~900 m海拔分布的丝栗栲天然林分土壤微生物群落进行研究,以期解决以下科学问题:(1)亚热带小跨度海拔梯度的天然林分土壤微生物多样性和群落组成变化是否与其他地区大跨度海拔梯度的变化相似?(2)影响亚热带小跨度海拔梯度的丝栗栲天然林分土壤微生物群落分布的主要因素是什么?
-
在南平市顺昌县郭岩山海拔500~900 m每间隔100 m设置3个20 m × 20 m的重复样地,样地间距大于15 m,以避免样地之间相互干扰,选取的样地地形、地貌、坡度和坡向基本一致,样地基本情况详见表1。在每个样地内选择5个采样位置,并使用土壤取样器采集0~10 cm的土壤样品,混匀后现场过筛,之后分成两份,用于土壤DNA提取和基本理化性质测定。
表 1 样地基本信息
Table 1. Basic information of the sample plots
海拔/m
Altitude地形地貌
Topography优势树种
Dominant species胸径/cm
DBH树高/cm
Tree height林分密度/(株·hm−2)
Stand density坡度/(°)
Slope坡向/(°)
Aspect500 低山丘陵 丝栗栲
Castanopsis fargesii14.5 ± 1.51 11.5 ± 1.02 360 ± 15 26.8 ± 3.84 西南238 600 低山 丝栗栲
Castanopsis fargesii13.3 ± 1.12 12.0 ± 1.98 450 ± 32 24.8 ± 4.18 西290 700 低山 丝栗栲
Castanopsis fargesii15.1 ± 0.98 13.5 ± 1.55 338 ± 16 26.1 ± 2.45 西南229 800 低山 丝栗栲
Castanopsis fargesii13.9 ± 2.28 11.0 ± 1.12 381 ± 21 24.4 ± 1.80 西南210 900 低山 丝栗栲
Castanopsis fargesii12.5 ± 0.91 10.5 ± 1.22 300 ± 15 24.5 ± 2.29 西251 -
参照《土壤农化分析》[22]进行基础土壤理化性质测定。土壤理化性质基本情况详见表2。
表 2 不同海拔土壤理化性质
Table 2. Soil physicochemical properties in different altitude
土壤性质
Soil properties海拔高度
Altitude/mF p 500 600 700 800 900 全氮 TN/(g·kg−1) 1.96 ± 0.44 a 2.40 ± 0.52 ab 2.50 ± 0.53 ab 3.69 ± 1.1 bc 4.35 ± 1.4 c 6.305 ** 全磷 TP/(g·kg−1) 0.69 ± 0.05 c 0.53 ± 0.12 bc 0.33 ± 0.04 a 0.50 ± 0.13 b 0.46 ± 0.21 ab 5.284 * 全钾 TK/(g·kg−1) 29.14 ± 3.0 ab 40.05 ± 4.16 c 24.28 ± 7.62 a 31.35 ± 3.00 b 25.18 ± 1.37 ab 11.004 ** 土壤 pH 5.07 ± 0.13 b 4.73 ± 0.17 ab 4.67 ± 0.19 a 4.42 ± 0.37 a 4.70 ± 0.24 a 4.815 ** 土壤含水率 SM/% 17.42 ± 5.07 ab 15.98 ± 1.99 ab 14.02 ± 2.57 ab 13.04 ± 2.35 a 18.82 ± 2.77 b 2.847 NS 土壤密度 BD/(g·cm−3) 1.07 ± 0.09 c 0.98 ± 0.02 bc 0.99 ± 0.07 bc 0.94 ± 0.05 ab 0.86 ± 0.13 a 4.625 ** 碱解氮 AN/(mg·kg−1) 122.50 ± 22.0 a 198.10 ± 29.35 b 214.20 ± 27.71 bc 277.90 ± 54.37 c 261.10 ± 64.85 bc 10.057 ** 有效磷 AP/(mg·kg−1) 12.09 ± 3.35 11.85 ± 2.71 8.01 ± 3.52 9.81 ± 4.07 7.28 ± 3.79 1.917 NS 速效钾 AK/(mg·kg−1) 89.51 ± 0.74 b 69.07 ± 6.42 a 64.51 ± 8.04 a 96.65 ± 4.83 b 106.85 ± 3.63 c 57.111 ** 碳氮比 C/N 22.15 ± 8.78 a 14.66 ± 4.94 ab 13.25 ± 2.45 b 12.21 ± 4.38 b 9.79 ± 1.92 b 4.197 * 总有机碳 TOC/(g·kg−1) 40.53 ± 4.93 bc 33.30 ± 4.60 ab 32.32 ± 3.47 a 41.83 ± 5.79 c 40.63 ± 6.92 bc 3.691 * 注:相同海拔间不同字母表示差异显著; **表示p≤0. 01,*表示0. 01<p≤0. 05,NS 表示p>0. 05
Notes: Different lowercase letters in the same column of data indicate significant differences; ** means p≤0.01, * means 0.01<p≤0.05, NS means p>0.05 -
根据美吉生物医药科技有限公司的方案,采用Omega DNA试剂盒从0.5 g土壤中提取土壤DNA。使用引物338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)进行靶向V3-V4区的细菌16S rRNA的PCR扩增[23];使用引物ITS1F(CTTGGTCATTTAGAGGAAGTAA)和ITS2R(GACGCTTCTCCAGACTACAAT)扩增真菌ITS1区域[24],然后基于Illumina Miseq平台进行15个土壤样本的测序。
-
用Mothur软件计算土壤微生物群落的α多样性,并用Origin软件绘图表示;用SPSS软件进行单因素方差分析和Spearman分析,探究土壤性质之间及其与土壤微生物多样性之间的相关性;基于Bray-Curtis算法开展NMDS分析和ANOSIM分析,探究土壤微生物群落的β多样性在不同海拔间的差异;分别使用R(3.3.2)生成微生物群落Bar图,来确定不同海拔梯度下微生物群落结构组成情况;进行冗余分析(RDA)及绘制微生物菌门与各土壤性质相关性热图来确定影响微生物群落沿海拔梯度分布的重要因素;生成VPA图,来定量研究相关因子对微生物群落的贡献度。
-
经过测序,从15个丝栗栲土壤样品中共获得3 887 404条优质细菌序列和4 760 165条优质真菌序列,每个样品的细菌序列范围为203 934~300 220条,真菌序列范围为272 355~387 205条。如图1所示,郭岩山细菌的α多样性沿海拔梯度呈现无趋势变化,而真菌的α多样性沿海拔梯度呈现先减后增。对郭岩山海拔500~900 m之间微生物群落的α多样性和丰富度指数进行单因素方差分析表明,细菌群落各指数差异均不显著(P>0.05),而不同海拔真菌群落的Sobs指数和Chao1指数存在极显著差异(P≤0.01)。海拔500 m的细菌和真菌群落多样性最高,海拔800 m时细菌群落多样性最低,海拔700 m时真菌群落多样性最低。
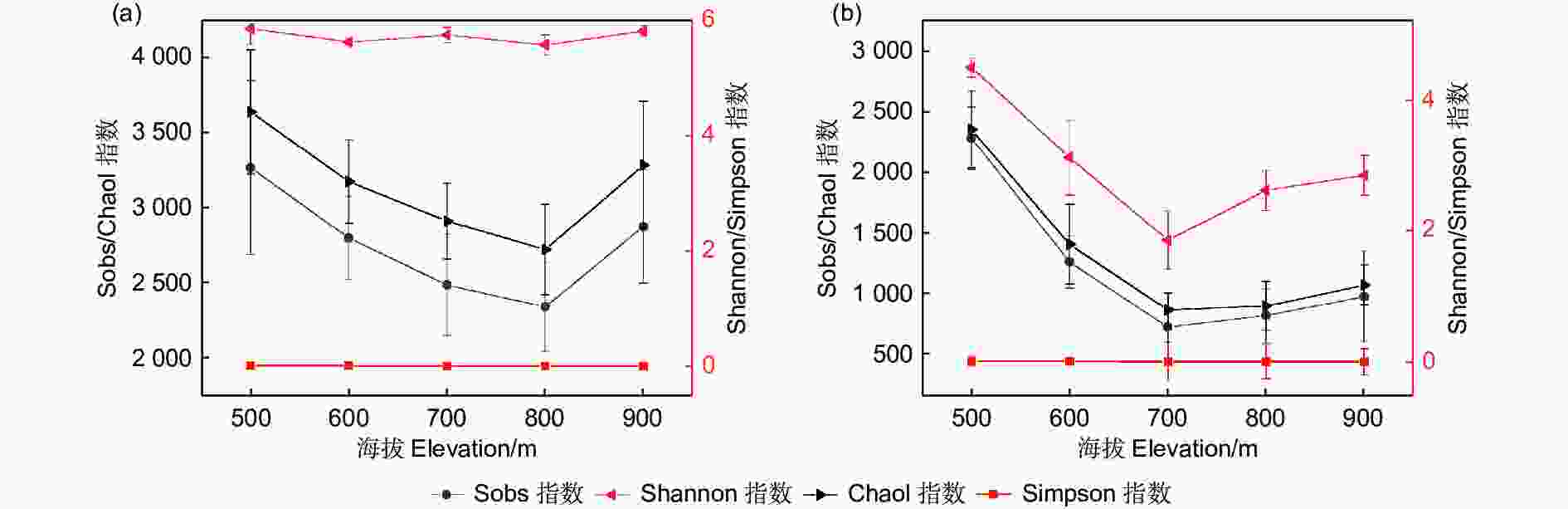
图 1 丝栗栲林土壤细菌(a)和真菌(b)α多样性随海拔的变化
Figure 1. Alpha diversity of bacterial (a) and fungal (b) diversity in Castanopsis fargesii forests soils with the elevations
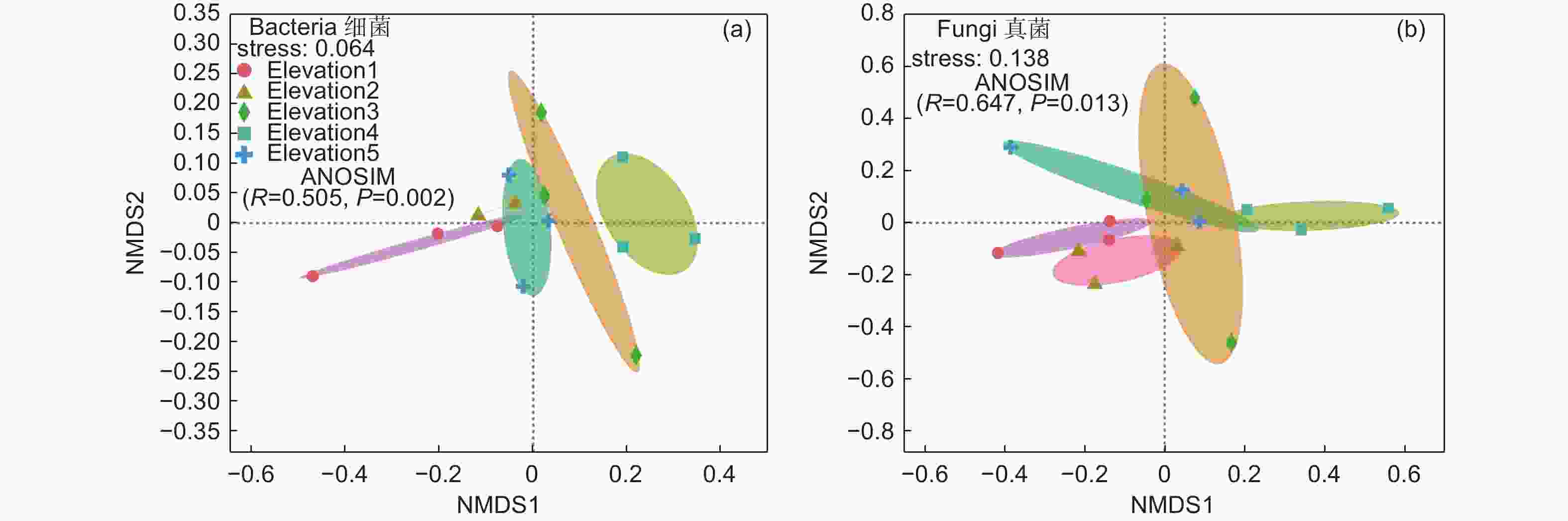
由图2 NMDS分析表明,细菌和真菌群落沿海拔梯度具有高度的变异性,不同的微生物群落在高度相近的海拔梯度上聚集为一类,ANOSIM分析的结果表明,不同海拔之间细菌和真菌β多样性均存在显著差异。随着海拔升高,细菌β多样性有明显的海拔分布格局,而真菌β多样性未呈现规律性变化。
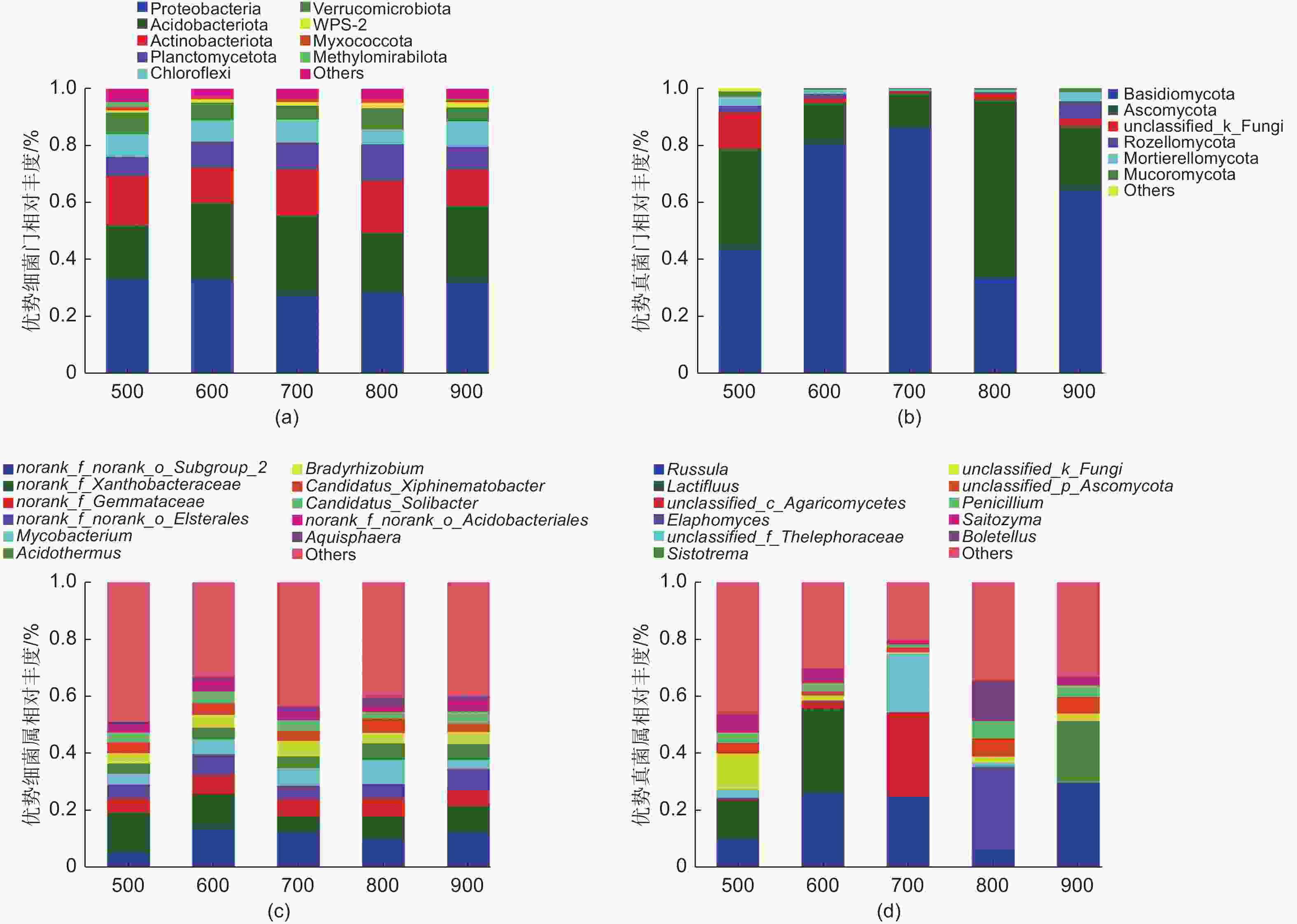
本研究中,细菌群落包括在38门,121纲,269目,437科,752属,真菌群落包括在16门,68纲,166目,381科,879属。在郭岩山5个海拔所有采样点中,变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria)是细菌群落的3个主要菌门,norank_f_norank_o_subgroup_2、norank_f_xanthobacteraceae是细菌群落的两个主要菌属(图3a、c);担子菌门(Basidiomycota)、子囊菌门(Ascomycota)是真菌群落的两个主要菌门,Russula、Lactifluus是真菌群落的两个主要菌属(图3b、d)。不同海拔微生物各菌门、属存在差异,但未呈现明显的海拔分布模式。
-
由Spearman相关分析可知(表3),郭岩山细菌α多样性与土壤理化性质无显著相关关系,而土壤全磷与真菌α多样性具有极显著相关关系;细菌和真菌β多样性与海拔梯度(Altitude)和碱解氮存在显著相关关系,此外全磷和土壤pH仅与细菌β多样性存在显著相关关系,而全钾和土壤密度仅与真菌β多样性具有显著相关关系。
表 3 土壤性质与微生物多样性指数相关分析
Table 3. Correlation analysis between soil physicochemical properties and microbial diversity
土壤性质
Soil properties细菌多样性
Bacterial diversity真菌多样性
Fungal diversityShannon 指数 NMDS1 NMDS2 Shannon 指数 NMDS1 NMDS2 全氮 TN 0.073 0.37 0.249 −0.331 0.397 0.394 全磷 TP −0.188 −0.574a −0.161 0.697b −0.343 −0.449 全钾 TK −0.461 −0.268 0.125 −0.018 −0.1 −0.661b 碱解氮 AN 0.05 0.561a 0.175 −0.321 0.432 0.611a 有效磷 AP −0.404 −0.421 0.089 0.311 −0.136 −0.329 速效钾 AK 0.189 0.118 −0.411 0.214 0.125 0.468 土壤 pH 0.243 −0.600a −0.168 0.221 −0.3 −0.289 碳氮比 C/N −0.289 0.304 −0.029 0.121 0.3 0.218 土壤含水率 SM 0.386 −0.091 −0.302 0.075 −0.202 −0.275 土壤密度 BD −0.211 −0.243 −0.018 0.295 −0.165 −0.612a 海拔 Altitude 0.132 0.618a 0.089 −0.407 0.489 0.536a 总有机碳 TOC −0.061 −0.171 0.043 0.261 −0.128 −0.025 注:a: 0.01<P≤0. 05;b: P≤0.01
Notes: a means the correlation is significant at the 0.05 level; b means the correlation is significant at the 0.01 level由图4冗余分析(RDA)可知,郭岩山的海拔(Altitude)梯度变化使其林分土壤所处的气候(如温度、降水)与土壤性质随之发生变化,进而影响了土壤微生物的群落组成,在所测定的土壤性质中,土壤pH、全磷和碱解氮是影响郭岩山不同海拔细菌群落组成的最重要因素;而土壤密度、全磷、速效钾和全氮是影响郭岩山不同海拔真菌群落组成的最重要因素。由图5a、c可知,髌骨菌门和WPS-2菌门分别与土壤pH显著负相关;变形菌门、疣微菌门和norank_f _xanthobacteraceae属分别与土壤全磷显著正相关,而酸杆菌门、髌骨菌门和norank_f _norank_o_subgroup_2属分别与土壤全磷显著负相关。对于真菌群落(图5b、d),土壤密度与真菌群落无显著相关关系;梳霉菌门、球囊菌门、罗兹菌门、Saitozyma菌属、unclassified_p_Ascomycota菌属、unclassified_k_Fungi菌门和属分别与土壤全磷显著正相关;而子囊菌门与土壤速效钾显著正相关。上述结果表明,土壤性质对各菌群的显著影响并不统一。

图 4 土壤理化性质与微生物群落结构的冗余分析
Figure 4. Redundancy analysis of soil physicochemical properties and microbial community structure

图 5 相对丰度排名前10位微生物菌门(a、b)和属(c、d)与土壤理化性质的spearman相关性分析
Figure 5. Spearman correlation analysis of the top 10 microbial phyla and genera in relative abundance and soil physicochemical properties
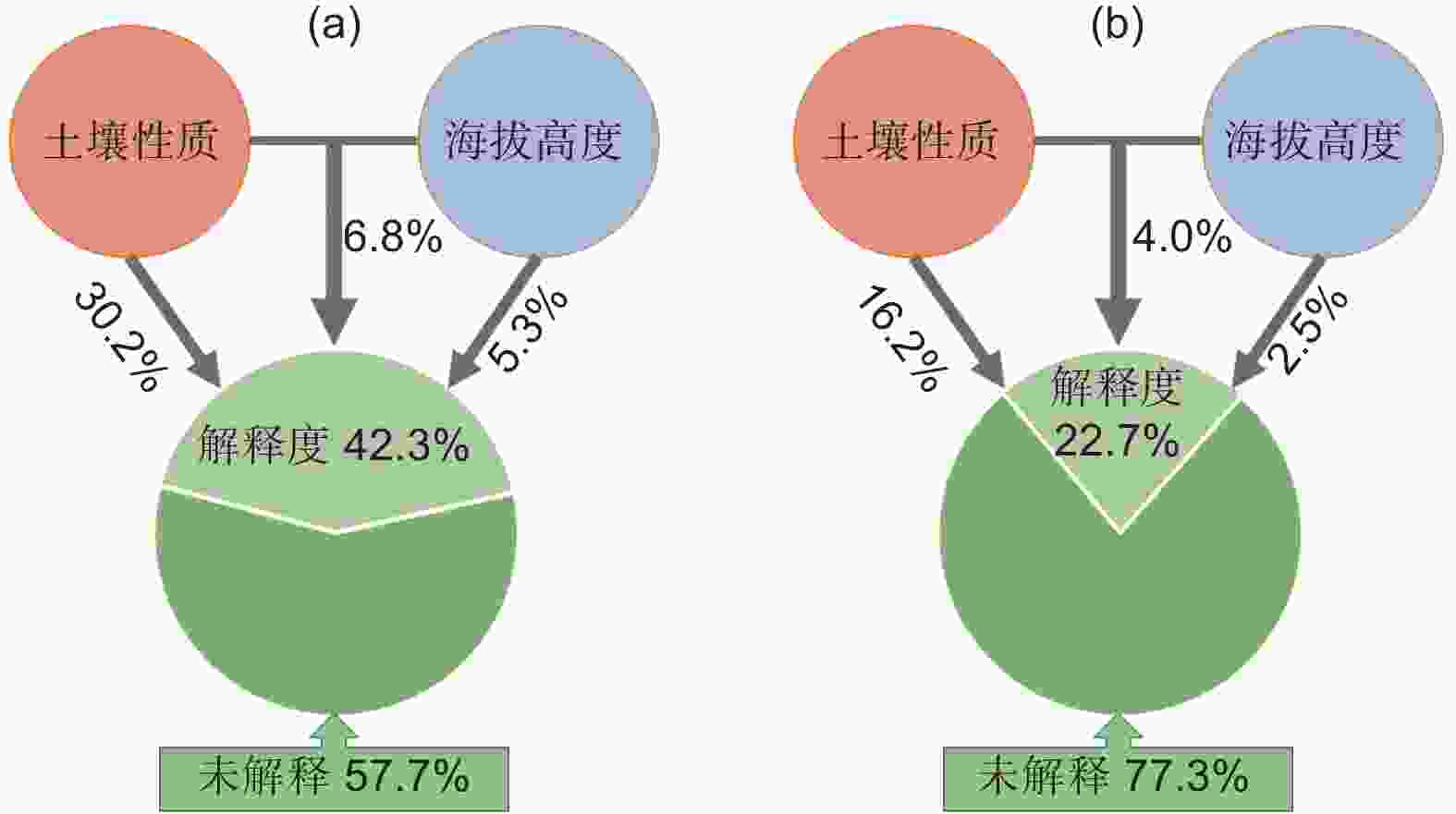
由图6方差分解分析(VPA)发现,土壤性质是造成土壤细菌、真菌群落差异的主要因素,分别解释了30.2%和16.2%的群落差异。海拔高度只能解释微生物群落差异的一小部分,如海拔高度仅仅解释了真菌群落2.5%的差异。
-
郭岩山自然保护区丝栗栲天然林分土壤细菌α多样性呈无规律变化的分布模式,土壤真菌α多样性和丰富度指数沿海拔先下降后上升,且不同海拔梯度之间真菌群落丰富度指数存在显著差异(图1),这一结果与姚兰等[25]和周煜杰等[26]在亚热带黄山地区和秦岭地区发现土壤微生物多样性海拔分布模式相似,不同的是本研究发现土壤全磷是真菌α多样性主要影响因素(表3),而上述研究结果表明影响微生物多样性海拔分布的因素是土壤pH,产生差异的原因可能是本研究是在较小跨度的海拔梯度上开展的,不同的海拔梯度导致了土壤具有不同的物理和化学性质,沿着海拔梯度土壤性质对微生物群落起着重要作用,影响着微生物多样性分布过程[27]。通过NMDS分析发现细菌和真菌群落在不同海拔梯度之间存在相异的聚类模式,随海拔升高,细菌β多样性海拔分布模式较明显,而真菌的β多样性海拔分布格局不明显(图2),这与Meng等[28]对土壤微生物多样性海拔分布格局在亚热带森林中的研究相似,相关分析表明海拔梯度和碱解氮显著影响了细菌和真菌β多样性,说明了土壤微生物β多样性海拔分布格局受海拔梯度和碱解氮的共同影响。此外,随着海拔梯度的变化,土壤pH值和全磷仅与细菌β多样性具有显著相关关系(表3),而全钾和土壤密度仅与真菌β多样性具有显著相关关系,这与丛静等[29]对湖北省神农架自然保护区的主要森林类型土壤微生物的研究结果有所不同,原因可能是本研究在同一优势树种森林类型且海拔跨度范围(500~900 m)较小,而神农架的研究涉及不同植被类型且海拔高、跨度大(1 000~2 800 m),其微生物群落组成直接被不同的凋落物和根系分泌物影响[30],并被变化较大的有机质、土壤pH、微气候等间接影响[2, 31],从而导致了土壤微生物多样性对土壤性质出现差异性响应。
本研究表明郭岩山自然保护区不同海拔间土壤微生物既有自身特异性,亦具有物种的相似性,在郭岩山五个海拔所有采样点中,变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria)是细菌群落的3个主要菌门,norank_f_norank_o_subgroup_2、norank_f_xanthobacteraceae是细菌群落的两个主要菌属(图3a、c);担子菌门(Basidiomycota)、子囊菌门(Ascomycota)是真菌群落的两个主要菌门,Russula、Lactifluus是真菌群落的两个主要菌属(图3b、d),这与Huang等[14]和Zhou等[32]分别在大跨度海拔梯度的中亚热带森林和秦岭亚热带锐齿栎林的研究结论相似,说明了海拔跨度不会显著影响优势微生物菌门和属的变化。变形菌门、酸杆菌门和放线菌门的主要功能为有机质分解作用[33],而担子菌门和子囊菌门也主要起代谢和分解有机质的作用[34]。郭岩山自然保护区地处具有丰富水热条件的亚热带季风气候区,雨热同期的先天条件促进了土壤有机质积累和凋落物分解,这为喜营养类的细菌和真菌类群提供了丰富的底物供给,促使土壤中与代谢和分解作用有关的微生物在各海拔梯度上的相对丰度均占据优势地位[35]。稀少群落的疣微菌门(Verrucomicrobia)、WPS-2菌门在土壤细菌群落中占比小,对大量养分的竞争能力非常有限且需求量少[36],而更倾向于对微量元素(磷)的获取以维持自身群落机制和养分平衡[35]。
本研究结果表明,不同海拔梯度使土壤理化性质发生转变,进而导致土壤微生物群落组成存在明显的差异,整个细菌群落的组成和优势门及属的相对丰度与土壤pH、全磷和碱解氮密切相关;而土壤全磷和速效钾是影响真菌群落组成和优势门及属相对丰度的最重要因素(图4,图5)。土壤性质解释了细菌和真菌30.2%和16.2%的群落差异,是森林土壤微生物群落聚集的主要驱动因素之一,在以往研究中已得到广泛验证,Yuan等[37]观察到降水和土壤 NH4 + 是影响土壤细菌群落的主要环境因素;Cui等[10]研究发现海拔、碳氮比、土壤温度是影响细菌和真菌群落的主要环境因素,其中全磷是影响细菌群落主要驱动因素,本研究结果与前人对于较大跨度海拔土壤微生物的研究结论相似,这说明土壤性质可以很好地预测土壤微生物群落组成的变化,即使在小跨度海拔梯度上亦是如此。前人研究表明土壤养分(如总碳、全氮、全磷、有效磷、碱解氮和有机碳)对微生物群落组成有很大影响,并且可以解释土壤微生物群落的大多数变化[11, 25]。本研究发现碱解氮与Patescibacteria细菌门的相对丰度呈显著正相关关系,碱解氮是森林生态系统中细菌的重要氮来源,参与了细菌的蛋白质合成,并促进微生物从富含木质素和纤维素的植物中获得C[38],因此微生物需从土壤中获取更多的碱解氮,以实现生物量元素的化学计量平衡[10]。本研究发现,随着海拔升高全磷含量逐渐减少(表2),这是因为高海拔处天然丝栗栲林趋于矮小和稀疏,凋落物归还较少,这增加了土壤养分淋失的风险[27],从而造成了全磷养分含量减少。此外,研究还发现Patescibacteria细菌门的相对丰度随土壤pH和全磷的升高而降低,但同时随碱解氮的升高而增加,Patescibacteria门的菌群具有固定CO2和水解碳水化合物的能力,且因为有简化的膜结构从而避免了被噬菌体入侵,以适应变化的土壤环境[39]。由此可见,土壤pH和氮磷养分是影响土壤Patescibacteria门发挥固碳作用和分解作用的重要驱动因素,并间接影响丝栗栲的生长和繁殖。土壤微生物群落的海拔分布规律体现了环境变量的重要性[11],海拔高度和土壤性质的空间变化对微生物群落组成有很大的影响[40]。本研究证实了海拔高度和土壤性质共同影响了郭岩山土壤微生物的生态地理学分布,但因为在高山生态系统中,海拔梯度主要通过影响森林土壤的性质,如pH、养分含量、植被类型和微气候等,间接对土壤微生物群落产生影响[2],导致海拔高度只能解释微生物群落差异的极少部分(图6)。而无法解释的微生物群落差异可能是由于本研究中未测量的其他因素,如土壤铵态氮、硝态氮、MBC、MBN等,未来将继续对此开展研究和验证。
-
(1)在小跨度海拔梯度的郭岩山自然保护区天然丝栗栲林分中,土壤细菌α多样性沿海拔梯度呈无规律的海拔分布格局,而真菌的α多样性沿海拔梯度先下降后上升,土壤全磷是真菌α多样性主要影响因子,这与大跨度海拔梯度的研究存在差异,原因是不同跨度的海拔梯度导致了土壤具有不同的理化性质,影响着微生物多样性分布过程;(2)变形菌门、酸杆菌门和放线菌门是土壤细菌群落的三个主要菌门,norank_f_norank_o_subgroup_2、norank_f_xanthobacteraceae是细菌群落的两个主要菌属;担子菌门、子囊菌门是真菌群落的两个主要菌门,Russula、Lactifluus是真菌群落的两个主要菌属,这与大跨度海拔梯度的研究相似,说明了小跨度的海拔梯度不会显著影响优势微生物菌门和属的变化;(3)土壤性质解释了细菌和真菌30.2%和16.2%的群落差异,是森林土壤微生物群落聚集的主要驱动因素之一,整个细菌群落的组成和优势门及属的相对丰度与土壤pH、全磷和碱解氮密切相关,而全磷和速效钾是影响真菌群落组成和优势门及属相对丰度的最重要因素,这与前人在较大跨度海拔梯度上的研究结果相似,说明了土壤性质可以很好地预测土壤微生物群落组成的变化,即使在小跨度海拔梯度上亦是如此。
郭岩山自然保护区丝栗栲天然林分土壤微生物群落沿海拔梯度变化
Changes of Soil Microbial Community along the Altitude Gradient in the Natural Stand of Castanopsis fargesii in the Guoyan Mountain
-
摘要:
目的 沿着海拔梯度探究郭岩山丝栗栲天然林分土壤微生物多样性和群落组成变化及其与土壤性质的相关关系,揭示气候变化对中国中亚热带中低海拔小跨度梯度下丝栗栲土壤微生物多样性和群落组成变化规律及其影响因素。 方法 选取郭岩山自然保护区海拔500~900 m梯度下丝栗栲天然林分的表层土壤,测定其理化性质,并进行Illumina高通量测序,采用相关性分析和冗余分析等方法研究土壤微生物多样性和群落组成特征及其影响因素。 结果 土壤细菌α多样性并没有呈现明显的海拔分布格局,而真菌的α多样性沿海拔梯度先下降后上升,这与大跨度海拔梯度的研究存在差异;酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)和变形菌门(Proteobacteria)是细菌群落的3个主要菌门,norank_f_norank_o_subgroup_2、norank_f_xanthobacteraceae是细菌群落的两个主要菌属;担子菌门(Basidiomycota)、子囊菌门(Ascomycota)是真菌群落的两个主要菌门,Russula、Lactifluus是真菌群落的两个主要菌属,说明了小跨度的海拔梯度不会显著影响优势微生物菌门和属的变化;优势细菌门及属相对丰度及群落组成与土壤pH值、全磷和碱解氮密切相关,而土壤全磷和速效钾是影响真菌群落组成和优势门及属相对丰度的最重要因素,土壤性质可以很好地预测土壤微生物群落的变化,即使在小跨度海拔梯度上亦是如此。 结论 土壤性质和海拔高度共同影响了郭岩山自然保护区土壤微生物的生态地理学分布。本研究将为南方亚热带常绿阔叶林小跨度海拔梯度土壤微生物多样性研究和群落组成保护提供科学依据。 Abstract:Objective To investigate the changes of soil microbial community along the altitude gradient in the natural stand of Castanopsis fargesii and their correlation with soil physicochemical properties in the Guoyan Mountain for revealing the impact of climate change on soil microbial diversity and community composition and the influencing factors of Castanopsis fargesii under the small-scale elevational gradients in the subtropical region of China. Methods The topsoils of the natural stand of Castanopsis fargesii along an elevation gradient in the Guoyan Mountain Nature Reserve were selected and their physicochemical properties were determined, and Illumina high-throughput sequencing was performed. The correlation analysis and redundancy analysis were used to study the characteristics of soil microbial diversity and community composition and their influencing factors. Results The alpha diversity of soil bacteria did not show a clear elevational pattern, while the alpha diversity of fungi first decreased and then increased along the elevation gradient, which was different from the studies across large-scale elevational gradients. The dominant bacterial phyla were Acidobacteria, Actinobacteria and Proteobacteria; the dominant bacterial genera were norank_f_norank_o_subgroup_2 and norank_f_xanthobacteraceae; the dominant fungal phyla were Basidiomycota and Ascomycota; the dominant fungal genera were Russula and Lactifluus. Our results showed that small-scale elevational gradients did not significantly affect the changes in the dominant microbial phyla and genera. The relative abundance and community composition of the dominant bacterial phyla and genera were closely related to soil pH, total phosphorous and available nitrogen, while soil total phosphorus and available potassium were the most important factors affecting the composition of fungal communities. Soil properties could well predict the changes in soil microbial communities, even on small scale elevational gradients. Conclusion Soil properties and altitude both influence the ecogeographic distribution of soil microorganisms in the Guoyan Mountain Nature Reserve. This study will provide a scientific basis for the study of soil microbial diversity and community composition conservation along small-scale elevation gradients in southern subtropical broad-leaved evergreen forests. -
Key words:
- nature reserve
- / Castanopsis fargesii
- / soil microorganisms
- / altitude
-
表 1 样地基本信息
Table 1. Basic information of the sample plots
海拔/m
Altitude地形地貌
Topography优势树种
Dominant species胸径/cm
DBH树高/cm
Tree height林分密度/(株·hm−2)
Stand density坡度/(°)
Slope坡向/(°)
Aspect500 低山丘陵 丝栗栲
Castanopsis fargesii14.5 ± 1.51 11.5 ± 1.02 360 ± 15 26.8 ± 3.84 西南238 600 低山 丝栗栲
Castanopsis fargesii13.3 ± 1.12 12.0 ± 1.98 450 ± 32 24.8 ± 4.18 西290 700 低山 丝栗栲
Castanopsis fargesii15.1 ± 0.98 13.5 ± 1.55 338 ± 16 26.1 ± 2.45 西南229 800 低山 丝栗栲
Castanopsis fargesii13.9 ± 2.28 11.0 ± 1.12 381 ± 21 24.4 ± 1.80 西南210 900 低山 丝栗栲
Castanopsis fargesii12.5 ± 0.91 10.5 ± 1.22 300 ± 15 24.5 ± 2.29 西251 表 2 不同海拔土壤理化性质
Table 2. Soil physicochemical properties in different altitude
土壤性质
Soil properties海拔高度
Altitude/mF p 500 600 700 800 900 全氮 TN/(g·kg−1) 1.96 ± 0.44 a 2.40 ± 0.52 ab 2.50 ± 0.53 ab 3.69 ± 1.1 bc 4.35 ± 1.4 c 6.305 ** 全磷 TP/(g·kg−1) 0.69 ± 0.05 c 0.53 ± 0.12 bc 0.33 ± 0.04 a 0.50 ± 0.13 b 0.46 ± 0.21 ab 5.284 * 全钾 TK/(g·kg−1) 29.14 ± 3.0 ab 40.05 ± 4.16 c 24.28 ± 7.62 a 31.35 ± 3.00 b 25.18 ± 1.37 ab 11.004 ** 土壤 pH 5.07 ± 0.13 b 4.73 ± 0.17 ab 4.67 ± 0.19 a 4.42 ± 0.37 a 4.70 ± 0.24 a 4.815 ** 土壤含水率 SM/% 17.42 ± 5.07 ab 15.98 ± 1.99 ab 14.02 ± 2.57 ab 13.04 ± 2.35 a 18.82 ± 2.77 b 2.847 NS 土壤密度 BD/(g·cm−3) 1.07 ± 0.09 c 0.98 ± 0.02 bc 0.99 ± 0.07 bc 0.94 ± 0.05 ab 0.86 ± 0.13 a 4.625 ** 碱解氮 AN/(mg·kg−1) 122.50 ± 22.0 a 198.10 ± 29.35 b 214.20 ± 27.71 bc 277.90 ± 54.37 c 261.10 ± 64.85 bc 10.057 ** 有效磷 AP/(mg·kg−1) 12.09 ± 3.35 11.85 ± 2.71 8.01 ± 3.52 9.81 ± 4.07 7.28 ± 3.79 1.917 NS 速效钾 AK/(mg·kg−1) 89.51 ± 0.74 b 69.07 ± 6.42 a 64.51 ± 8.04 a 96.65 ± 4.83 b 106.85 ± 3.63 c 57.111 ** 碳氮比 C/N 22.15 ± 8.78 a 14.66 ± 4.94 ab 13.25 ± 2.45 b 12.21 ± 4.38 b 9.79 ± 1.92 b 4.197 * 总有机碳 TOC/(g·kg−1) 40.53 ± 4.93 bc 33.30 ± 4.60 ab 32.32 ± 3.47 a 41.83 ± 5.79 c 40.63 ± 6.92 bc 3.691 * 注:相同海拔间不同字母表示差异显著; **表示p≤0. 01,*表示0. 01<p≤0. 05,NS 表示p>0. 05
Notes: Different lowercase letters in the same column of data indicate significant differences; ** means p≤0.01, * means 0.01<p≤0.05, NS means p>0.05表 3 土壤性质与微生物多样性指数相关分析
Table 3. Correlation analysis between soil physicochemical properties and microbial diversity
土壤性质
Soil properties细菌多样性
Bacterial diversity真菌多样性
Fungal diversityShannon 指数 NMDS1 NMDS2 Shannon 指数 NMDS1 NMDS2 全氮 TN 0.073 0.37 0.249 −0.331 0.397 0.394 全磷 TP −0.188 −0.574a −0.161 0.697b −0.343 −0.449 全钾 TK −0.461 −0.268 0.125 −0.018 −0.1 −0.661b 碱解氮 AN 0.05 0.561a 0.175 −0.321 0.432 0.611a 有效磷 AP −0.404 −0.421 0.089 0.311 −0.136 −0.329 速效钾 AK 0.189 0.118 −0.411 0.214 0.125 0.468 土壤 pH 0.243 −0.600a −0.168 0.221 −0.3 −0.289 碳氮比 C/N −0.289 0.304 −0.029 0.121 0.3 0.218 土壤含水率 SM 0.386 −0.091 −0.302 0.075 −0.202 −0.275 土壤密度 BD −0.211 −0.243 −0.018 0.295 −0.165 −0.612a 海拔 Altitude 0.132 0.618a 0.089 −0.407 0.489 0.536a 总有机碳 TOC −0.061 −0.171 0.043 0.261 −0.128 −0.025 注:a: 0.01<P≤0. 05;b: P≤0.01
Notes: a means the correlation is significant at the 0.05 level; b means the correlation is significant at the 0.01 level -
[1] SILES J A, MARGESIN R. Abundance and diversity of bacterial, archaeal, and fungal communities along an altitudinal gradient in alpine forest soils: what are the driving factors?[J]. Microbial Ecology, 2016, 72(1): 207-220. doi: 10.1007/s00248-016-0748-2 [2] 王 莹, 王彦梅, 陈龙池. 湖南会同地区森林植被转变对土壤微生物生物量碳和酶活性的影响[J]. 生态学杂志, 2010, 29(5):905-909. doi: 10.13292/j.1000-4890.2010.0156 [3] 丁 波, 丁贵杰, 赵熙州, 等. 间伐对杉木人工林土壤酶活性及微生物的影响[J]. 林业科学研究, 2017, 30(6):1059-1065. doi: 10.13275/j.cnki.lykxyj.2017.06.025 [4] SHEN R C, XU M, CHI Y G, et al. Soil microbial responses to experimental warming and nitrogen addition in a temperate steppe of northern China[J]. Pedosphere, 2014, 24(4): 427-436. doi: 10.1016/S1002-0160(14)60029-1 [5] SHEN C C, LIANG W J, SHI Y, et al. Contrasting elevational diversity patterns between eukaryotic soil microbes and plants[J]. Ecology, 2014, 95(11): 3190-3202. doi: 10.1890/14-0310.1 [6] SHEN C C, NI Y Y, LIANG W J, et al. Distinct soil bacterial communities along a small-scale elevational gradient in alpine tundra[J]. Frontiers in Microbiology, 2015, 6: 582. [7] SINGH D, TAKAHASHI K, KIM M, et al. A hump-backed trend in bacterial diversity with elevation on mount Fuji, Japan[J]. Microbial Ecology, 2012, 63(02): 429-437. doi: 10.1007/s00248-011-9900-1 [8] SINGH D, LEE-CRUZ L, KIM W, et al. Strong elevational trends in soil bacterial community composition on mt. Halla, South Korea[J]. Soil Biology and Biochemistry, 2014, 68: 140-149. doi: 10.1016/j.soilbio.2013.09.027 [9] KOU Y P, LI C N, TU B, et al. The responses of ammonia-oxidizing microorganisms to different environmental factors determine their elevational distribution and assembly patterns[J]. Microbial Ecology, 2023, 86(1): 485-496. doi: 10.1007/s00248-022-02076-8 [10] CUI Y X, BING H J, FANG L C, et al. Diversity patterns of the rhizosphere and bulk soil microbial communities along an altitudinal gradient in an alpine ecosystem of the eastern Tibetan Plateau[J]. Geoderma, 2019, 338: 118-127. doi: 10.1016/j.geoderma.2018.11.047 [11] 贺 婧, 闫 冰, 李俊生, 等. 秦岭中段北坡不同海拔土壤中细菌群落的分布特征及区域差异比较[J]. 环境科学研究, 2019, 32(8):1374-1383. doi: 10.13198/j.issn.1001-6929.2019.01.12 [12] GREEN J, J M BOHANNAN B. Spatial scaling of microbial biodiversity[J]. Trends in Ecology & Evolution, 2006, 21(9): 501-507. [13] 孙鸿烈. 中国资源科学百科全书[M]. 青岛: 中国石油大学出版社, 中国大百科全书出版社, 2000. [14] HUANG K X, XIANG J, MA Y Y, et al. Response of soil microbial communities to elevation gradient in central subtropical Pinus taiwanensis and Pinus massoniana forests[J]. Forests, 2023, 14(4): 772. doi: 10.3390/f14040772 [15] LIU D P, ZHENG D X, XU Y Y, et al. Changes in the stoichiometry of Castanopsis fargesii along an elevation gradient in a Chinese subtropical forest[J]. PeerJ, 2021, 9(1): 11553. [16] QIAO H Y, LUAN Y N, WANG B, et al. Analysis of spatiotemporal variations in the characteristics of soil microbial communities in Castanopsis fargesii forests[J]. Journal of Forestry Research, 2020, 31(5): 1975-1984. doi: 10.1007/s11676-019-00957-2 [17] SUN Y, HU H Q, HUANG H W, et al. Chloroplast diversity and population differentiation of Castanopsis fargesii (Fagaceae): a dominant tree species in evergreen broad-leaved forest of subtropical China[J]. Tree Genetics & Genomes, 2014, 10(6): 1531-1539. [18] 林君漪, 张 豪, 柏雨萱, 等. 郭岩山不同海拔土壤养分对丝栗栲细根碳、氮、磷及其化学计量特征影响[J]. 江西农业大学学报, 2021, 43(6):1348-1356. [19] 巩晟萱, 王 丹, 戴 伟, 等. 不同生长时期丝栗栲林下土壤有机碳含量及矿化特征[J]. 水土保持通报, 2015, 35(5):59-63. doi: 10.13961/j.cnki.stbctb.2015.05.077 [20] WANG Q, GAO C, GUO L D. Ectomycorrhizae associated with Castanopsis fargesii (Fagaceae) in a subtropical forest, China[J]. Mycological Progress, 2011, 10(3): 323-332. doi: 10.1007/s11557-010-0705-2 [21] 何冬梅, 陈逸飞, 苏 仪, 等. 郭岩山不同海拔天然栲树林土壤硅形态特征[J]. 林业科学研究, 2023, 36(2):153-160. doi: 10.12403/j.1001-1498.20220460 [22] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000: 14-111. [23] RUIZ-GONZÁLEZ C, SALAZAR G, LOGARES R, et al. Weak coherence in abundance patterns between bacterial classes and their constituent otus along a regulated river[J]. Frontiers in Microbiology, 2015, 6(1): 1293. [24] WALTERS W, HYDE E R, BERG-LYONS D, et al. Improved bacterial 16s rrna gene (v4 and v4-5) and fungal internal transcribed spacer marker gene primers for microbial community surveys[J]. Msystems, 2016, 1(1): e00009-15. [25] 姚 兰, 胡立煌, 张焕朝, 等. 黄山土壤细菌群落和酶活性海拔分布特征[J]. 环境科学, 2019, 40(2):859-868. doi: 10.13227/j.hjkx.201806056 [26] 周煜杰, 贾 夏, 赵永华, 等. 秦岭火地塘真菌群落海拔分布格局[J]. 应用生态学报, 2021, 32(7):2589-2596. doi: 10.13287/j.1001-9332.202107.033 [27] 赵盼盼, 周嘉聪, 林开淼, 等. 海拔梯度变化对中亚热带黄山松土壤微生物生物量和群落结构的影响[J]. 生态学报, 2019, 39(6):2215-2225. [28] MENG H, LI K, NIE M, et al. Responses of bacterial and fungal communities to an elevation gradient in a subtropical montane forest of China[J]. Applied Microbiology and Biotechnology, 2013, 97(5): 2219-2230. doi: 10.1007/s00253-012-4063-7 [29] 丛静. 神农架自然保护区土壤微生物多样性研究[D]. 长沙: 中南大学, 2013. [30] HOLM BACH L, GRYTNES J, HALVORSEN R, et al. Tree influence on soil microbial community structure[J]. Soil Biology and Biochemistry, 2010, 42(11): 1934-1943. doi: 10.1016/j.soilbio.2010.07.002 [31] 杜 倩, 梁素钰, 李 琳, 等. 阔叶红松林土壤酶活性及微生物群落功能多样性分析[J]. 森林工程, 2019, 35(1):1-7 + 15. doi: 10.16270/j.cnki.slgc.2019.01.001 [32] ZHOU Y J, JIA X, HAN L, et al. Fungal community diversity in soils along an elevation gradient in a quercus aliena var. Acuteserrata forest in qinling mountains, China[J]. Applied Soil Ecology, 2021, 167: 104104. doi: 10.1016/j.apsoil.2021.104104 [33] 乔沙沙, 周永娜, 刘晋仙, 等. 关帝山针叶林土壤细菌群落结构特征[J]. 林业科学, 2017, 53(2):89-99. [34] 林思诺, 苏延桂, 吕 坤, 等. 尖峰岭热带森林土壤真菌群落的海拔变化格局及驱动因素[J]. 应用生态学报, 2023, 34(2):349-358. doi: 10.13287/j.1001-9332.202302.033 [35] 李 聪, 吕晶花, 陆 梅, 等. 滇东南亚热带土壤细菌群落对植被垂直带变化的响应[J]. 生态环境学报, 2022, 31(10):1971-1983. doi: 10.16258/j.cnki.1674-5906.2022.10.005 [36] ZHAO Z Y, MA Y T, FENG T Y, et al. Assembly processes of abundant and rare microbial communities in orchard soil under a cover crop at different periods[J]. Geoderma, 2022, 406(15): 115543. [37] YUAN Y L, SI G C, WANG J, et al. Bacterial community in alpine grasslands along an altitudinal gradient on the Tibetan Plateau[J]. Fems Microbiology Ecology, 2014, 87(1): 121-132. doi: 10.1111/1574-6941.12197 [38] MEIER C L, RAPP J, BOWERS R M, et al. Fungal growth on a common wood substrate across a tropical elevation gradient: temperature sensitivity, community composition, and potential for above-ground decomposition[J]. Soil Biology and Biochemistry, 2010, 42(7): 1083-1090. doi: 10.1016/j.soilbio.2010.03.005 [39] NAUD S, IBRAHIM A, VALLES C, et al. Candidate phyla radiation, an underappreciated division of the human microbiome, and its impact on health and disease[J]. Clinical Microbiology Reviews, 2022, 35(3): e0014021. doi: 10.1128/cmr.00140-21 [40] GUO G X, KONG W D, LIU J B, et al. Diversity and distribution of autotrophic microbial community along environmental gradients in grassland soils on the Tibetan Plateau[J]. Applied Microbiology and Biotechnology, 2015, 99(20): 8765-8776. doi: 10.1007/s00253-015-6723-x -




 下载:
下载: