-
根瘤菌(Rhizobia)是革兰氏阴性无芽孢细菌,能在豆科植物根系分泌的黄酮类化合物激活下诱发根瘤共生体系的形成[1-3]。根瘤是生物固氮的主要场所,能促进植物和微生物间代谢物和固氮产物的交换,在全球氮循环、生态改良和农林生产等方面发挥着重要作用[4]。前人研究发现,根瘤内不仅有根瘤菌,其中还存在着大量非根瘤菌(Non-rhizobia endophytes)[5],它们与根瘤菌以及与植物体、土壤环境之间相互作用形成了特殊的微生态系统。多数根瘤菌能促进植物生长、增加土壤有机碳、速效氮和全氮含量,发挥典型的肥力岛效应 [6-7],而根瘤内其他内生菌虽不能诱导结瘤,但对宿主植物有促生、抗病、内生联合固氮等作用,因而也越来越受到关注[8-12]。Rajendran等[13]研究表明,单独接种木豆内生芽孢杆菌不能使木豆结瘤或促生而只能提高叶绿素含量;但与根瘤菌共接种时,对植株鲜质量、叶绿素含量等均有促进作用。Ibáez等[14]发现,阿根廷的花生(Arachis hypogaea L.)根瘤中的 Pseudomonas spp.、Enterobacter spp.等内生细菌,在与Bradyrhizobium 共生菌株混合接种花生时可以增加作物产量。李继红等[15]发现大豆根瘤中几乎所有菌株都产生IAA,部分可溶解磷矿物,少数具有固氮能力。
南洋楹(Falcataria falcata)是豆科Leguminosae南洋楹属 Falcataria常绿乔木,是国际林业研究协会(IUFRO)大力推广的速生固氮树种之一。我国自1940 年开始引种南洋楹,该树种在广东、广西等南方省(区)表现出较强的适应性和速生性,6 a生平均树高14.5 m、平均胸径17.5 cm[16],无愧于“植物赛跑家”的称号。南洋楹的速生特性决定了其生长发育需要充足养分[17-20],苗期常采用高剂量配方施肥配合精细管理等方式[18-20]。而采用接种结瘤促生的方式鲜有报道[21]。基于根瘤菌与其他内生菌群协同增效的“菌-菌互作”原理,本研究以不同来源南洋楹根瘤提取液为接种菌液,开展南洋楹苗木接种对比试验,探究微生物共生对其苗期生长结瘤、生物量积累、光合及固氮的影响,并运用高通量测序技术对回接根瘤16S rRNA基因全长测序,并以Silva.138为参考数据库进行物种注释,揭示相对丰度较高的根瘤内生菌与南洋楹苗木重要生长指标的关系,以期为南洋楹微生物菌肥研发奠定基础,同时也可为今后扩展根瘤菌研究视野以及科学利用根瘤中某些非根瘤菌提供依据[8]。
-
采样地包括位于广东省中部的广州市(113.373719° E,23.194212° N)、东部的惠州市(114.241918° E,23.201885° N)和西部的茂名市(111.248662°E ,21.628686° N)3个南洋楹苗木培育基地,选择上述3个基地中同一种子来源、同一育苗方式培育的0.5年生优质南洋楹苗木各5株,分别采集其根系上天然生长的饱满、肉色至粉色的球形根瘤10颗。用清水冲洗去根瘤表面杂质,在超净工作台中,依次用75%乙醇溶液30 s、0.1%升汞溶液8 min消毒、无菌水清洗5次后放入洁净离心管中,加入300 μL无菌水,用无菌研磨棒将根瘤压碎。静置5 min后,吸取上层液体至200 mL YMA液体培养基中,28 ºC恒温摇床120 rpm条件下振荡培养2~4 d,分光光度计检测菌液OD600值为1.2时[22],获得接种菌液,编号分别为YZ、YD、YX。
-
为了尽量控制其他内生细菌的干扰和排除不同基因型的生长差异,供接种试验的南洋楹苗木来源于广东省林业科学研究院自主选育的优良无性系178号组培苗,瓶苗规格为苗高5 cm左右的生根芽苗。育苗基质采用实验室用高纯石英砂和蛭石按体积比1∶1混合,经3次121 ºC灭菌25 min,分装于9.5 cm(内口径) × 8 cm(高)塑料育苗袋中。将移栽组培苗放入经紫外灯消毒的人工气候箱中培养,光照强度7 000 lux, 温度28 ºC 、湿度75%、光照时间12 h,每天以纯水喷施保持基质湿润。移栽组培苗14 d左右生长稳定。
-
选取移栽健康成活的苗木以浇灌方式接种,将菌液均匀浇灌于基质表面使其渗透,每株10 mL。采用完全随机区组试验设计,设4个处理,即分别接种YZ、YD、YX和对照(浇灌等量无菌YMA液体培养基),每个处理9株重复。试验期间所有苗木每天喷施纯水1次,每15 d施加Jensen无氮营养液1次,每盆每次施加10 mL,共计施加营养液4次。
-
苗木移栽培养3个月后,在不同处理中各选取3株生长正常的平均苗,即每个处理共计9株作为待测植株。将苗木从基质中小心挖出、洗净后用吸水纸控干、待测。用SPAD-502叶绿素仪测定每株中层的成熟叶片的相对叶绿素含量(SPAD, Specialty Products Agricultural Division),每株测定5片,取其平均值;以直尺测量每株苗高、根系自然舒展后密度达80%以上处的长度(精确到0.1 cm),电子数显游标卡尺测量地径(精确到0.01 mm),摘取每株根瘤并统计单株结瘤数,以1/1000电子天平称量每株的地上部分、地下部分及总根瘤鲜质量。再将苗木地上部分与地下部置于105 ºC烘箱中杀青30 min,在85 ºC下烘至质量恒定,并在干燥器中冷却后,用电子天平称取地上部、地下部干质量。
采用硫酸-双氧水消解-凯氏定氮法[23]测定植株的全氮含量;
$ \begin{array}{l} {{M}}={{a}} \times {{b}} ; \\ {{N}}={{M}}_{\rm{x}}-{{M}}_0 ; \\ {{E}}=({{N}} / {{M}}) \times 100 {\text{%}} \end{array}$
式中:M为总氮量,a为总干质量,b为含氮量,N为固氮量,Mx为接种根瘤菌的南洋楹的总氮量,M0为未接种根瘤菌的南洋楹的总氮量,E为固氮效益。
-
分别收集3个接种处理待测植株的全部回接根瘤,送北京百迈克生物科技有限公司提取根瘤内细菌DNA,进行16S rRNA基因全长测序,将测得的菌株序列使用NCBI(www.ncbi.nlm.nih.gov)中的BLAST程序在线比对,并从 GenBank数据库中下载与待分析序列相近的已知种模式菌株的16S rDNA序列,用DNAMAN进行多重比对,确定各菌株的种属分类地位。
-
采用Microsoft Excel整理数据。使用SPSS 25.0、SAS 8.0、TBtools等执行统计分析及图表绘制,均值显著性检验采用单因素方差分析和LSD多重比较(p<0.05),相关性分析采用Pearson法(p<0.05)。
-
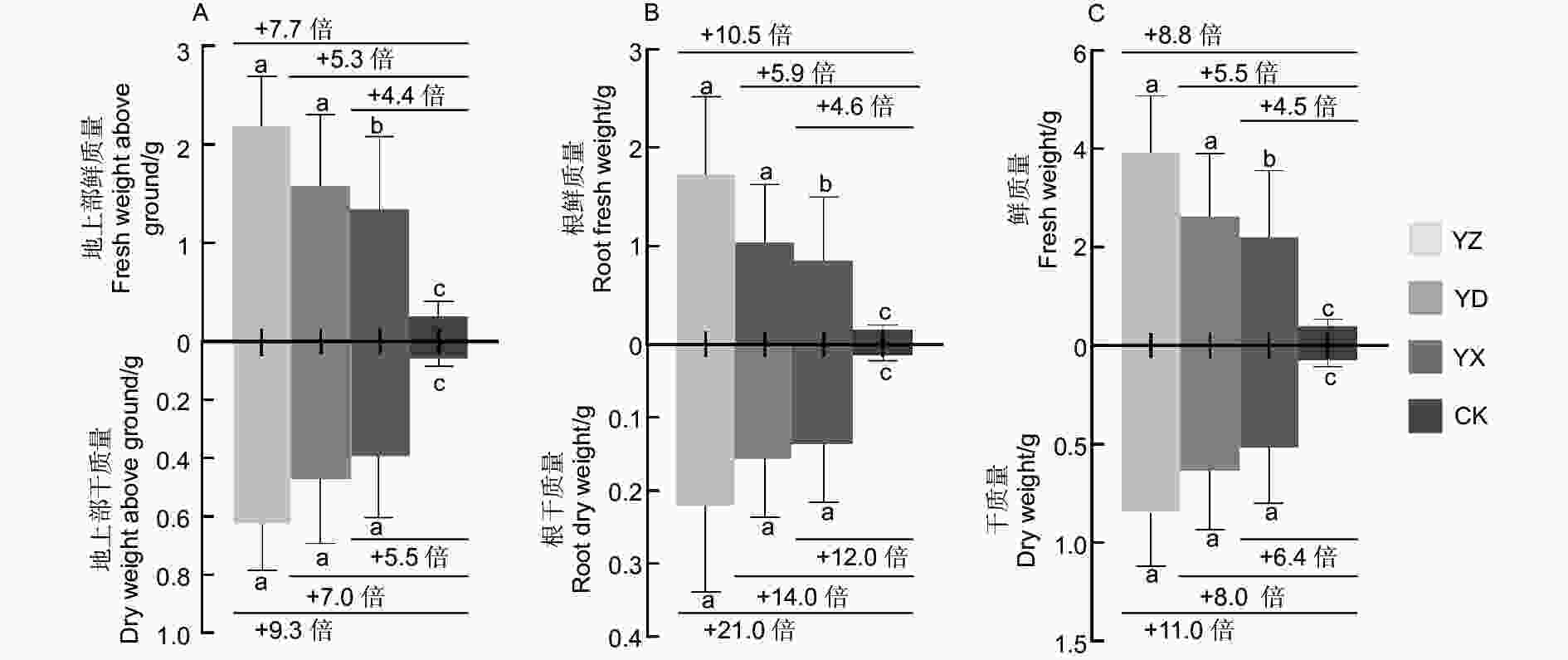
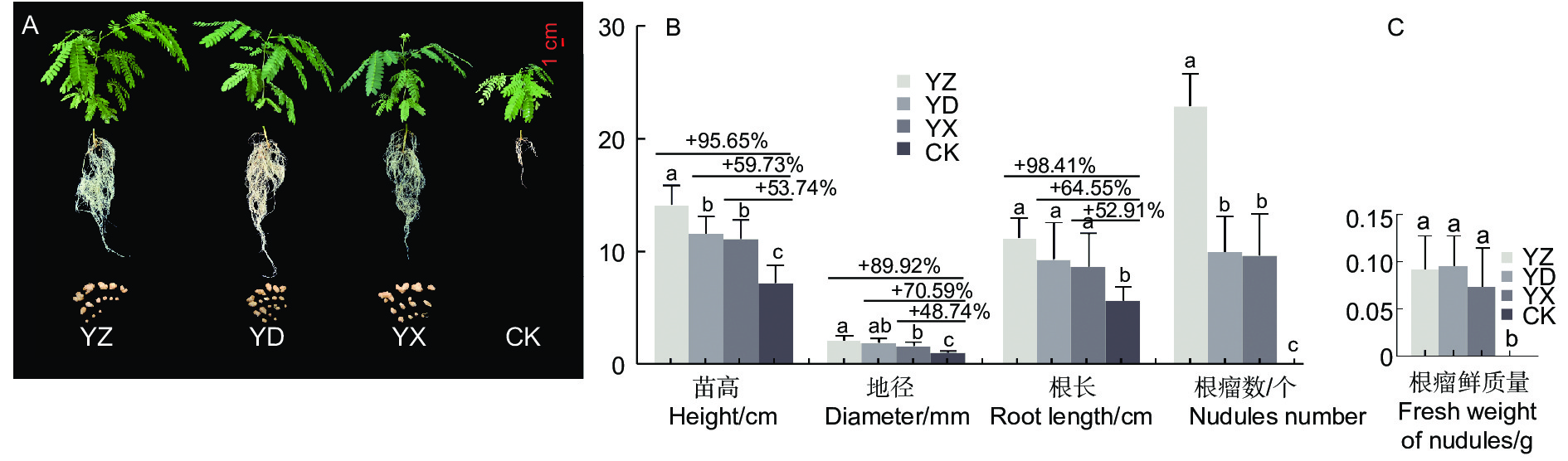
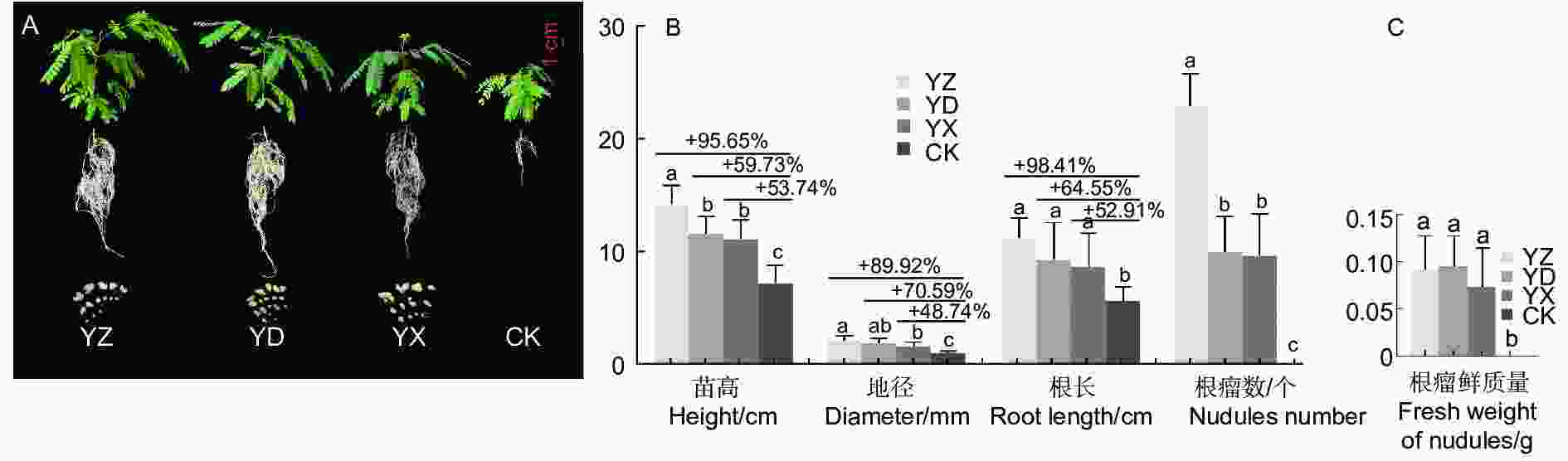
苗木移栽3个月后,3个接种处理及对照苗木均能正常生长(图1A),苗木生长与结瘤测定结果表明(图1B),接种处理的苗高、地径、根长、根瘤数、根瘤鲜质量等均比对照有极显著的增长(p <0.01)。其中YZ处理的苗木长势最优,苗高、地径和根长等3项生长指标值分别达到14.38 cm、2.26 mm、11.25 cm,与对照相比增幅超过或接近90%,YD处理与YX处理的3项指标高于对照48.87%~70.59%。进行接种处理的苗木均能成功接根瘤,而对照根系未见根瘤(图1A);不同接种处理的结瘤数差异较明显,数量以YZ最多,YD和YX的结瘤数量相当,3个处理的根瘤鲜质量相差并不大。
-
对不同试验处理苗木的地上部分生物量和地下部分生物量分析,结果(图2)表明,接种处理的地上部鲜质量、地上部干质量、根鲜质量、根干质量及总鲜质量、总干质量等均显著地高于对照(p <0.05)。其中,地上部分鲜质量和干质量分别比对照增加4.4~7.7倍和5.5~9.3倍,地下部分鲜质量和干质量分别比对照增加了4.6~10.5倍和12.0~21.0倍;3个接种处理间的根干质量差异不显著(p >0.05),YZ处理的生物量积累大于YD和YX处理。
-
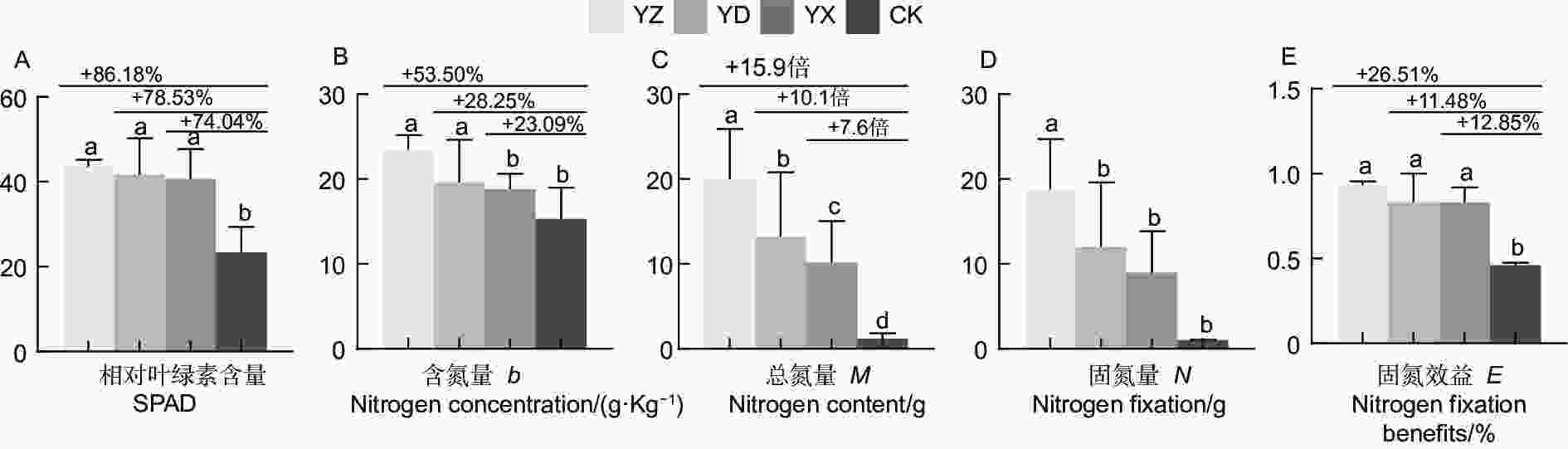
对不同试验处理南洋楹苗木的光合及固氮效应相关指标测定分析,结果(图3)表明,不同接种处理的南洋楹苗木的相对叶绿素含量(SPAD)、总氮量、固氮效益均显著地高于对照(p<0.05),含氮量和固氮量与对照差异显著(p<0.05)。YZ、YD、YX处理与CK相比,SPAD分别增长了86.18%、78.53%和74.04%,但3个接种处理间的SPAD值差异不显著;含氮量分别增长了53.50%、28.25%和23.09%;总氮量分别增加了15.9、10.1、7.6倍;固氮效益分别增长了26.51%、11.48%和12.85%,3个接种处理间无显著差异。
-
图4、表1中展示了接种YZ、YD、YX处理后分别从对应苗木根系上收获的根瘤内生菌种水平的相对丰度数据。结果表明,接种不同来源的根瘤提取液能够形成不同的根瘤内生菌群落。其中,YZ处理的根瘤内10种细菌的相对丰度最为均衡,细菌Cenchrus americanus相对丰度最高,为12.12%,其次为敏捷生丝微菌(Hyphomicrobium facile) 和埃氏慢生根瘤菌(Bradyrhizobium elkanii) ,相对丰度分别为9.94%和7.66%。YD处理的根瘤内,细菌Cenchrus americanus、埃氏慢生根瘤菌(Bradyrhizobium elkanii)、敏捷生丝微菌(Hyphomicrobium facile)处于主体地位,相对丰度分别为16.74%、8.28%和21.08%,仅这3种细菌的相对丰度几乎达到全部细菌的50%;YX处理的根瘤内丰度最大的3种内生菌与YD处理相同,其中埃氏慢生根瘤菌(Bradyrhizobium elkanii)相对丰度达22.41%;此外,YX中还含有3.5%的根瘤菌(Rhizobium azooxidifex),含根瘤菌最为丰富。YZ与YD处理的埃氏慢生根瘤菌(Bradyrhizobium elkanii)相对丰度比较接近,分别为7.66%和8.28%。YZ、YD、YX处理的根瘤的OTU数分别为234、206、191依次递减,YZ处理的根瘤内香农指数分别为5.54、4.83、4.61,也呈现依次递减的趋势。
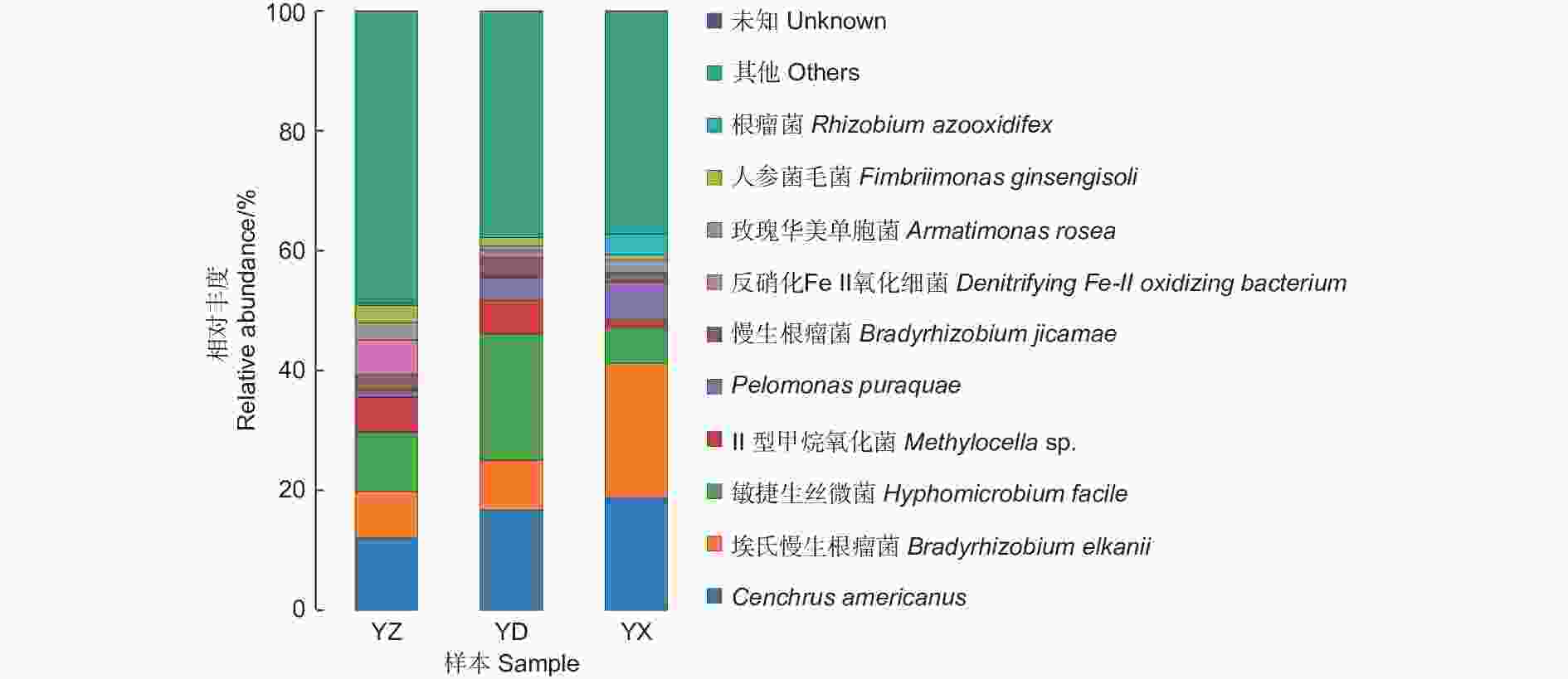
图 4 不同处理根瘤内种水平多样性柱状图
Figure 4. Histogram of species level diversity within the root nodules of different treatments
表 1 不同处理根瘤内种水平上相对丰度前十的细菌占比及多样性指数
Table 1. The proportion and diversity index of the top 10 bacteria in relative abundance at species level of nodules amomg different treatments
项目 Items YZ YD YX 细菌占比
Proportion of bacteria/%Cenchrus americanus 12.12 16.74 18.79 埃氏慢生根瘤菌 Bradyrhizobium elkanii 7.66 8.28 22.41 敏捷生丝微菌 Hyphomicrobium facile 9.94 21.08 5.87 Ⅱ型甲烷氧化菌 Methylocella sp. 5.73 5.58 1.35 Pelomonas puraquae 1.10 3.74 6.36 慢生根瘤菌 Bradyrhizobium jicamae 2.70 3.39 1.55 反硝化Fe-Ⅱ氧化细菌 denitrifying Fe-II oxidizing bacterium 5.80 1.19 0.04 玫瑰华美单胞菌 Armatimonas rosea 2.99 0.78 2.08 人参菌毛菌 Fimbriimonas ginsengisoli 2.82 1.35 0.77 根瘤菌 Rhizobium azooxidifex 0.35 0.53 3.50 相对丰度前三细菌之和 Sum of the top-three bacteria in relative abundance 29.73 46.12 47.57 OTU数 OTU number 234 206 191 香农指数 Shannon index 5.54 4.83 4.61 -
对南洋楹苗木生长与结瘤、生物量积累、光合及固氮等相关指标进行主成分分析,结果(表2)表明,两个主成分即PC1、PC2分别解释总变异的77.14%、15.29%,二者累积贡献率达92.43%。其中第一主成分(PC1)主要由苗高、根长、根瘤数、总氮量和固氮量决定,均为正相关;第2主成分(PC2)主要由SPAD决定,载荷量为0.728 0,且表现正相关。因此,以苗高、根长、根瘤数、SPAD、总氮量和固氮量等指标来表征南洋楹苗木的综合情况。
表 2 南洋楹生长指标主成分特征值、贡献率、累积贡献率及主成分分析因子载荷阵
Table 2. The eigenvalue,proportion,cumulative and eigenvectors of the principal component factors (growth index) of Falcataria falcata growth index
指标 Index 主成分1 PC1 主成分2 PC2 苗高 Height 0.117 4 −0.003 3 根长 Root length 0.127 6 0.187 1 相对叶绿素含量 SPAD 0.326 1 0.728 0 含氮量 b 0.222 8 0.162 0 根瘤数 Nodules number 0.502 6 −0.638 2 总氮量 M 0.523 2 0.020 9 固氮量 N 0.523 1 0.020 9 特征值 Eigenvalue 218.993 97 43.408 45 贡献率 Variance/% 77.14 15.29 累计贡献率 Cumulative rate/% 77.14 92.43 -
选取各样品中相对丰度前五的7种根瘤内生菌(表1),和提取到的7个主成分(表2)进行相关性分析,结果(图5)表明:内生菌Cenchrus americanus、Pelomonas puraquae都与南洋楹苗高和根瘤数呈极显著负相关关系(p<0.01);细菌denitrifying Fe-II oxidizing bacterium与苗高、根瘤数呈极显著正相关(p<0.01),与含氮量、总氮量和固氮量呈显著正相关关系(p<0.05);OTU数和香农指数均与苗高和根瘤数呈极显著正相关关系(p<0.01),且香农指数还与含氮量、总氮量和固氮量呈显著相关关系(p<0.05)。
-
豆科植物结瘤固氮及其生产实践应用研究在花生(Arachis hypogaea L.)、大豆(Glycine max (Linn.) Merr.)、苜蓿(Medicago sativa L. )等蝶形花亚科的农作物和牧草中最为成熟[24-26]。而木本豆科植物已有相关研究结果也表明,格木(Erythrophleum fordii Oliv.)、银合欢(Leucaena leucocephala (Lam.) de Wit)、海南红豆(Ormosia pinnata (Lour.) Merr.)等回接高效根瘤菌菌株后,植株的苗高、干质量及总氮量分别比对照植株提高0.7~3.2、1.3~15.8、1.3~14.8倍[27];回接黑木相思根瘤菌株 RITF522的黑木相思(Acacia melanoxylon R.Br.)和银合欢(Leucaena leucocephala (Lam.) de Wit),生物量比不接种处理分别增加了 110.1%和59.8%,促生效果显著[28];SARR等[29]在播种后立即接种含根瘤菌混合物的可溶藻酸盐微珠,观察到其对金合欢属阿拉伯胶树(Acacia senegal (Linn.) Willd)和阿拉伯金合欢(Acacia nilotica (L.) Delile)的生长有明显促进作用。Dhiman等[30]发现与对照植株相比,施加根瘤菌组合PGPR1 + PGPR2能显著提高印度黄檀(Dalbergia sissoo Roxb. ex DC.)的根系和地上部生物量、结瘤状况及固氮酶活性生长指标。而本研究以来源不同根瘤提取液为接种菌液,进行接种处理的南洋楹苗木均能成功结根瘤。不同接种处理的结瘤数差异较明显,数量以YZ最多,YD和YX的结瘤数量相当,而3个处理的根瘤鲜质量相差并不大,可见接种YD和YX的单个根瘤形态相对较大。与对照相比,苗高增长了53.74%~95.65%,地径增加了48.74%~89.92%,根长增长了52.91%~98.41%,干质量增加了6.4~11.0倍,SPAD增长了74.04%~86.18%,含氮量分别增长了23.09%~53.50%;总氮量上比CK增加了7.6~15.9倍,固氮效益增加了11.48%~26.51%。可见,不同试验处理对南洋楹苗木生物量积累效应的影响趋势与苗木生长结瘤效应基本一致,接种处理可显著促进苗木生物量的积累,特别是极大促进了根系的生长发育、改变根系的空间结构,使根系网络更加错综复杂、紧密交织。然而,不同来源的接种菌液对南洋楹苗木的促生效果存在一定差异,其中接种菌液YZ对生长结瘤和固氮效果最为显著,该研究结论可为南洋楹微生物菌肥的研发提供一定的参考依据。
豆科植物根瘤内存在除共生根瘤菌外的其它细菌的现象,是一个不争的事实。王浩等[31]对不同品种大豆根际细菌的种群结构进行了分析,发现细菌的种群极具多样性,以变形杆菌(Proteobacteria) 类群为主;中国东北地区栽培大豆根瘤中既有慢生根瘤菌,也有其他6个不同属的内生菌 (Pantoea、Acinetobacter、 Bacillus、Agrobacterium、Burkholderia、Serratia)存在;段如雁[32]探索了花榈木(Ormosia henryi Prain)根瘤细菌主要由Rhizobium、Bacillus、Bradyrhizobium、Devosia、Pseudomonas等61属细菌组成,且不同纬度采集的花榈木根瘤内细菌组成差异较大。本研究发现,来源不同的南洋楹根瘤提取液能够与南洋楹根系形成具有不同内生菌群组成的根瘤,并在种水平上都以埃氏慢生根瘤菌、慢生根瘤菌等不同根瘤菌占比最大,细菌Cenchrus americanus、敏捷生丝微菌、反硝化Fe-Ⅱ氧化细菌等也占有较大丰度;但OTU数和香农指数存在一定差异,以接种菌液YZ回接根瘤中的细菌物种数最多和α多样性最高。对根瘤内生细菌及其与植物生长关系的研究中,常体现为菌-菌互作、协同增效的互惠模式,也存在某些功能基因在根瘤内生细菌之间发生横向转移的现象[33-34],在根瘤微生态学研究上具有非常重要的意义。在本研究发现,与南洋楹生长结瘤及固氮效应密切正相关的是OTU数及香农指数,而并非某种特定细菌,由此可反映出根瘤内生菌种类越丰富、相对丰度越均衡,对南洋楹幼苗协调增效作用越显著。值得提出的是,南洋楹根瘤内丰度占比较大、与重要生长指标相关性显著的Cenchrus americanus、Pelomonas puraquae和反硝化Fe-II氧化细菌等3种细菌均属于变形菌门β变形菌纲伯克氏菌目的丛毛单胞菌科(Comamonadaceae),但细菌Cenchrus americanus与南洋楹苗高和根瘤数目呈现极显著负相关(p<0.01),而反硝化Fe-Ⅱ氧化细菌与生长结瘤、固氮和相对叶绿素含量均有不同程度的正相关关系,推测是前者能降解根瘤素从而阻碍根瘤的形成,进而对南洋楹幼苗生长起到负面作用。对于后者,有研究表明,与之同属细菌Aquabacterium pictum sp. nov.是第一个含有叶绿素a的好氧革兰氏阴性细菌[35],而SPAD又与净光合速率高度正相关[36],故推测南洋楹根瘤中的该细菌与叶片中SPAD具有关联性,可通过调控光合作用效率[37]、提高植物的光合作用,加强共生固氮作用的能源的供应从而促进苗木的生长,其具体作用机制和效果有待进一步纯化培养后观测研究。
-
南洋楹根瘤提取液能对南洋楹苗期的生长与结瘤、生物量积累、光合及固氮起到积极的促进作用,不同来源的接种菌液对苗木的促生效应及回接根瘤内生菌群组成存在一定差异,其中来源于广州市南洋楹苗木培育基地的接种菌液(YZ)对苗木促生、结瘤和固氮效应最为显著;3种接种菌液的回接根瘤中,种水平上都以埃氏慢生根瘤菌、慢生根瘤菌等不同根瘤菌占比最大,但接种菌液YZ回接根瘤中的细菌物种数最多和α多样性最高,该2项指标与南洋楹苗高、根瘤数、含氮量、总氮量和固氮量等呈极显著或显著正相关关系(p<0.01或p<0.05),反映出根瘤内生菌种类越丰富、相对丰度越均衡,对南洋楹幼苗促生和固氮作用越显著。
根瘤内生菌群对南洋楹苗木生长的影响
Effect of Endophytic Bacteria on Seedling Growth of Falcataria falcata
-
摘要:
目的 探究根瘤内生菌群对南洋楹苗木的促生效应,并揭示根瘤优势内生菌组成及其与苗木生长的关系,为南洋楹菌肥研发提供参考。 方法 以来源于广东广州、惠州和茂名等3个地区的南洋楹根瘤提取液为接种菌液(YZ、YD和YX),开展南洋楹组培苗接种对比试验,并对回接根瘤进行16S rRNA基因测序鉴定和数据分析。 结果 与对照相比,3种接种处理的南洋楹苗木均能成功接根瘤,其苗期生长与结瘤、生物量积累、光合及固氮等相关指标均显著优于对照,其中苗高、根长、相对叶绿素含量和总氮量等表征南洋楹苗木的综合情况的指标分别比对照增加了53.74%~95.65%、52.91%~98.41%、74.04%~86.18%和7.6~15.9倍。3种接种处理中,接种菌液YZ对苗木促生、结瘤和固氮效应最为显著。回接根瘤内生菌群组成存在一定差异,YZ处理的根瘤内生菌的比例最均衡、细菌物种数(OTU数)最多和α多样性(香农指数)最高。根瘤内生菌中一种反硝化Fe-Ⅱ氧化细菌与南洋楹苗高、回接根瘤数呈极显著正相关,与含氮量、总氮量和固氮量呈显著正相关;OTU数和香农指数与南洋楹苗高、根瘤数、总氮量和固氮量等呈极显著或显著正相关关系。 结论 南洋楹根瘤提取液能对南洋楹苗期的生长与结瘤、生物量积累、光合及固氮起到积极的促进作用,不同来源的接种菌液对苗木的促生效应及回接根瘤内生菌群组成存在一定差异,根瘤内生菌种类越丰富、相对丰度越均衡,对南洋楹幼苗促生和固氮作用越显著。 Abstract:Objective To reveal the composition of dominant nodule endophytes in Falcataria falcata and explore their effect on the growth of Falcataria falcata seedlings, thus providing information for the development of Falcataria falcata fertilizer. Methods Endophytic bacteria were screened from Falcataria falcata nodules collected from three locations (Guangzhou, Huizhou and Maoming of Guangdong province), and inoculation with the three different geographical nodule endophytes (YZ, YD and YX) were conducted. The growth traits of Falcataria falcata seedlings after inoculation with different geographical endophytic bacteria were measured. Furthermore, species identification of endophytic bacteria with different treatments was performed by using 16S rRNA gene sequencing technology. Results Compared with the CK (negative control), Falcataria falcata seedlings under the three treatments were able to develop nodules successfully, and the seedling growth and nodule number, biomass, photosynthesis and nitrogen fixation ability were significantly higher than those under the control treatment. Particularly, the seedling height, root length, SPAD in the three treatments increased by 53.74%~95.65%, 52.91%~98.41%, 74.04%~86.18%, and 7.6~15.9 times compared to the control, respectively. Among the three inoculation treatments, seedling after inoculation with YZ showed the highest values of seedling growth, nodulation number and nitrogen fixation. Significant differences in the composition of endophytic bacteria were found among the three treatments, and YZ treatment had the largest number of OTU number and the highest diversity of α (Shannon index). The denitrifying Fe-II oxidizing bacterium had significant effects on seedlings height, nodules number, nitrogen concentration, nitrogen content and nitrogen fixation in Falcataria falcata. Conclusion The endophytes isolated from Falcataria falcata nodule can promote seedling growth, biomass accumulation, photosynthesis ability and nitrogen fixation in Falcataria falcata seedlings. Different geographical nodule endophytes show different composition of endophytic bacteria and varying effects on seedling growth. Endophytes with high diversity have obvious growth-promoting effect on Falcataria falcata seedlings. -
Key words:
- Falcataria falcata
- / Nodules
- / Inoculation solution
- / Endophytes flora
- / Grow-promoting effect
- / Correlation
-
表 1 不同处理根瘤内种水平上相对丰度前十的细菌占比及多样性指数
Table 1. The proportion and diversity index of the top 10 bacteria in relative abundance at species level of nodules amomg different treatments
项目 Items YZ YD YX 细菌占比
Proportion of bacteria/%Cenchrus americanus 12.12 16.74 18.79 埃氏慢生根瘤菌 Bradyrhizobium elkanii 7.66 8.28 22.41 敏捷生丝微菌 Hyphomicrobium facile 9.94 21.08 5.87 Ⅱ型甲烷氧化菌 Methylocella sp. 5.73 5.58 1.35 Pelomonas puraquae 1.10 3.74 6.36 慢生根瘤菌 Bradyrhizobium jicamae 2.70 3.39 1.55 反硝化Fe-Ⅱ氧化细菌 denitrifying Fe-II oxidizing bacterium 5.80 1.19 0.04 玫瑰华美单胞菌 Armatimonas rosea 2.99 0.78 2.08 人参菌毛菌 Fimbriimonas ginsengisoli 2.82 1.35 0.77 根瘤菌 Rhizobium azooxidifex 0.35 0.53 3.50 相对丰度前三细菌之和 Sum of the top-three bacteria in relative abundance 29.73 46.12 47.57 OTU数 OTU number 234 206 191 香农指数 Shannon index 5.54 4.83 4.61 表 2 南洋楹生长指标主成分特征值、贡献率、累积贡献率及主成分分析因子载荷阵
Table 2. The eigenvalue,proportion,cumulative and eigenvectors of the principal component factors (growth index) of Falcataria falcata growth index
指标 Index 主成分1 PC1 主成分2 PC2 苗高 Height 0.117 4 −0.003 3 根长 Root length 0.127 6 0.187 1 相对叶绿素含量 SPAD 0.326 1 0.728 0 含氮量 b 0.222 8 0.162 0 根瘤数 Nodules number 0.502 6 −0.638 2 总氮量 M 0.523 2 0.020 9 固氮量 N 0.523 1 0.020 9 特征值 Eigenvalue 218.993 97 43.408 45 贡献率 Variance/% 77.14 15.29 累计贡献率 Cumulative rate/% 77.14 92.43 -
[1] HASSAN S, MATHESIUS U. The role of flavonoids in root–rhizosphere signalling: opportunities and challenges for improving plant–microbe interactions[J]. J Exp Bot, 2012, 63(9): 3429-3444. doi: 10.1093/jxb/err430 [2] JANCZAREK M, RACHWAL K, MARZEC A, et al. Signal molecules and cell-surface components involved in early stages of the legume–rhizobium interactions[J]. Applied Soil Ecology, 2015, 85: 94-113. doi: 10.1016/j.apsoil.2014.08.010 [3] LIU C W, MURRAY J D. The role of flavonoids in nodulation host-range specificity: an update[J]. Plants, 2016, 5(3): 33. doi: 10.3390/plants5030033 [4] 邓家珍, 叶绍明, 林铭业, 等. 降香黄檀根瘤以及根瘤菌形态和超微结构特征[J]. 南京林业大学学报(自然科学版), 2023, 47(5):259-267. [5] 刘 杰, 汪恩涛, 陈文新. 豆科植物根瘤内生细菌的发现及其研究进展[J]. 微生物学报, 2011, 51(8):1001-1006. [6] RHOADES C C, ECKERT G E, COLEMAN D C. Effect of pasture trees on soil nitrogen and organic matter: implications for tropical montane forest restoration[J]. Restoration Ecology, 1998, 6(3): 262-270. doi: 10.1046/j.1526-100X.1998.00639.x [7] MITCHELL J S, RUESS R W. N2 fixing alder (Alnus viridis spp. fruticosa) effects on soil properties across a secondary successional chronosequence in interior Alaska[J]. Biogeochemistry, 2009, 95(2-3): 215-229. doi: 10.1007/s10533-009-9332-x [8] 李 静. 陕北地区白刺花根瘤内生菌遗传多样性及其促生特性研究[D]. 延安: 延安大学, 2022. [9] 邱并生. 根瘤内生细菌[J]. 微生物学通报, 2013, 40(3):544. [10] 赵龙飞, 徐亚军, 曹冬建, 等. 溶磷性大豆根瘤内生菌的筛选、抗性及系统发育和促生[J]. 生态学报, 2015, 35(13):4425-4435. [11] 钟宇舟, 余秀梅, 陈 强, 等. 四川盆地大豆根瘤内生细菌的分离鉴定及促生效果[J]. 应用与环境生物学报, 2017, 23(1):46-53. [12] 张爱梅, 韩雪英, 孙 坤, 等. 高通量测序分析中国沙棘根瘤与根际土壤细菌多样性[J]. 草原与草坪, 2018, 38(2):49-55. [13] RAJENDRAN G, SING F, DESAI A J, et al. Enhanced growth and nodulation of pigeon pea by co-inoculation of Bacillus strains with Rhizobium spp.[J]. Bioresource Technology, 2008, 99(11): 4544-4550. doi: 10.1016/j.biortech.2007.06.057 [14] IBÁÑEZ F, ANGELINI J, TAURIAN T, et al. Endophytic occupation of peanut root nodules by opportunistic Gammaproteobacteria[J]. Systematic and Applied Microbiology, 2009, 32(1): 49-55. doi: 10.1016/j.syapm.2008.10.001 [15] LI J H, WANG E T, CHEN W F, et al. Genetic diversity and potential for promotion of plant growth detected in nodule endophytic bacteria of soybean grown in Heilongjiang province of China[J]. Soil Biology and Biochemistry, 2008, 40(1): 238-246. doi: 10.1016/j.soilbio.2007.08.014 [16] 国家林业局, LY/T 1864-2009, 南洋楹速生丰产用材林栽培技术规程[S]. [17] MELYA RINIARTI, WAHYU HIDAYAT, HENDRA PRASETIA, et al. Using two dosages of biochar from shorea to improve the growth of Paraserianthes falcataria seedlings. [C]IOP Conference Series: Earth and Environmental Science2021, 749: 012049 [18] 刘 英, 曾炳山, 裘珍飞, 等. 苗木规格对南洋楹组培苗移植成活与生长的影响[J]. 中南林业科技大学学报, 2013, 33(3):47-50 + 63. [19] 刘 英, 曾炳山, 裘珍飞, 等. 基质对南洋楹组培苗移植成活的影响[J]. 中南林业科技大学学报, 2013, 33(11):29-33. [20] 广东省质量技术监督局. DB44/T 1112-2013, 南洋楹育苗技术规程[S]. 2013-07-15. [21] 潘超美, 杨 风, 李幼菊. 南洋楹根瘤菌株分离和应用的研究初报[J]. 热带亚热带土壤科学, 1996, 5(4):232-234. [22] 文 黎, 杨振德, 席英卓, 等. 降香黄檀根瘤菌的分离、鉴定及生物学特性[J]. 北方园艺, 2022(11):95-103. [23] 中华人民共和国农业部, NY/T 2419-2013_2500, 中华人民共和国农业部[S]. [24] 吴 月, 隋新华, 戴良香, 等. 慢生根瘤菌及其与花生共生机制研究进展[J]. 中国农业科学, 2022, 55(8):1518-1528. [25] 薛晓昀, 冯瑞华, 关大伟, 等. 大豆根瘤菌与促生菌复合系筛选及机理研究[J]. 大豆科学, 2011, 30(4):613-620. [26] 李佳欢, 希 娜, 漫 静, 等. 苜蓿根瘤菌接种数量与方式对接种效果的影响[J]. 草地学报, 2022, 30(3):743-749. [27] 王作明, 蚁伟民, 余作岳, 等. 豆科树种回接根瘤菌的研究[J]. 植物生态学报, 1996, 20(4):363-370. [28] 朱亚杰, 陆俊锟, 康丽华, 等. 黑木相思根瘤菌的系统发育分析及其结瘤效果研究[J]. 微生物学通报, 2015, 42(11):2198-2206. [29] SARR A, DIOP B, PELTIER R, et al. Effect of rhizobial inoculation methods and host plant provenances on nodulation and growth of Acacia senegal and Acacia nilotica[J]. New Forest, 2005, 29(1): 75-87. doi: 10.1007/s11056-004-5232-z [30] VINAY K D, NEERJA R, VIVEK K D, et al. Effect of rhizobial isolates and nitrogen fertilizers on nursery performance, nodulation behavior and nitrogenase activity of Dalbergia sissoo Roxb. Seedlings[J]. Plant Stress, 2022, 4: 100080. [31] 王 浩, 赵双进, 王绍东, 等. 不同茬口土壤和大豆品种对根瘤菌遗传多样性的影响[J]. 中国生态农业学报, 2014, 22(6):648-654. [32] 段如雁. 花榈木根瘤菌多样性及优良菌株筛选[D]. 贵阳: 贵州大学, 2019. [33] WU L J, WANG H Q, WANG E T, et al. Genetic diversity of nodulating and non-nodulating rhizobia associated with wild soybean (Glycine soja Sieb. & Zucc. ) in different ecoregions of China[J]. FEMS Microbiology Ecology, 2011, 76(3): 439-450. doi: 10.1111/j.1574-6941.2011.01064.x [34] BARCELLOS F G, MENNA P, da SILVA BATISTA J S, et al. Evidence of horizontal transfer of symbiotic genes from a bradyrhizobium japonicum inoculant strain to indigenous diazotrophs Sinorhizobium (Ensifer) fredii and Bradyrhizobium elkanii in a Brazilian savannah soil[J]. Applied and Environmental Microbiology, 2007, 73(8): 2635-2643. doi: 10.1128/AEM.01823-06 [35] SETSUKO H, MARCUS T, ERI H, et al. Aquabacterium pictum sp. nov., the first aerobic bacteriochlorophyll a-containing fresh water bacterium in the genus Aquabacterium of the class Betaproteobacteria.[J]. International Journal of Systematic and Evolutionary Microbiology, 2020, 70(1): 596-603. doi: 10.1099/ijsem.0.003798 [36] 郭兆武. 高产杂交稻‘两优培九’的光合特性研究[D]. 长沙: 湖南农业大学, 2008. [37] 杨 波, 王邵军, 赵 爽, 等. 丛枝菌根真菌共生对石漠化生境白枪杆生长及光合特性的影响[J]. 浙江农林大学学报, 2022, 39(5):1028-1036. -




 下载:
下载: