-
竹子是世界上生长迅速、用途广泛的植物物种之一,主要集中在热带和亚热带地区[1]。竹类约占世界和中国森林总面积的 0.8%和 2.94%[1]。竹类因其生长速度快,具有从大气中吸收CO2固定在生物质和土壤中的巨大潜力。据估计,中国竹林生态系统碳储量为1.43 × 109 tC,约占中国整个森林碳储量的5.1%[2]。因此,竹林在森林碳汇功能中占有重要的地位。由于竹子的快速生长和大量克隆繁殖,加之人为或自然灾害对原生森林植被的干扰,竹子向森林群落扩张被广泛报道[3-5],造成生态系统结构和功能的实际和潜在变化[5-6]。在广东南岭地区,受2008年特大冰雪灾害干扰的常绿阔叶林也出现了苦竹(Pleioblastus amarus (Keng) keng)大量入侵的现象。因此,对竹子生态功能的研究需要进一步加强。
全球气候变暖会改变地球固有的大洋洋流和大气环流,从而形成更多的极端气候事件,如洪水、干旱、风暴潮、台风、冰雪灾害和极端高温等[7]。近年来,极端气候事件日益频发,强度也越来越大,其中强台风、冰雪灾害等类型的极端气候事件会给森林造成大面积机械损伤,从而产生大量新鲜植物残体[8]。我国学者把外力作用条件下产生的新鲜植物残体定义为“非正常凋落物(Abnormal litterfall)” [9],其数量往往可达到正常全年凋落物产生量的数倍乃至数十倍[10]。竹子由于中空的竹秆结构,在外力作用下更容易折断,如在2008年特大冰雪灾害中,江西省分宜毛竹中心的毛竹(Phyllostachys edulis (Carriere) J. Houzeau)有高达54.48%的竹秆受损,平均每公顷产生16.42 t干死生物量,占地上生物量总量的 37.73%[11]。如此大量的新鲜残体堆积地表将会对生态系统过程产生一系列影响,但目前对新鲜残体的生态影响研究还比较缺乏。
凋落物分解是陆地生态系统碳和养分循环的基本过程[12-13]。凋落物的分解过程主要受环境因素(温度、湿度、 pH值等)、凋落物质量和分解生物的影响,是生物、物理和化学过程的综合作用结果[14-16]。植物新鲜残体和正常凋落物比往往具有较高的养分和较低的木质素含量[10],一般认为其分解速率更快[17]。目前已有较多针对竹子凋落物分解的研究[18-19],但针对竹子新鲜残体分解的研究则鲜有报道。
苦竹是南方林区常见的竹类植物,在广东南岭地区广泛分布在林缘和次生林内, 具有适应性强、生长速度快等特点[20]。由于南岭地处南亚热带和中亚热带的气候交错带,更容易遭受极端气候事件的影响,而苦竹往往在极端气候事件中受到较大的机械损伤。因此,研究苦竹新鲜残体的分解对评估和预测极端气候事件对森林养分循环和碳汇功能的影响具有重要意义。本文以广东南岭地区皆伐后苦竹大量萌生的次生林为对象,通过人工清除林内竹子模拟极端气候事件影响下的林内环境,探讨不同群落环境下苦竹新鲜残体各器官的分解过程,研究结果可以揭示苦竹新鲜残体分解过程及影响因子,预测苦竹林受损后生态系统物质循环变化过程,评估灾害对森林碳汇功能的影响,为灾后森林科学管理提供依据。
-
研究区处于广东乳源瑶族自治县西部的天井山林场,位于地处南岭支脉五岭的南麓(112°53′~113°15′ E、24°39′~24°51′ N)。气候属中亚热带湿润气候大区南岭气候区,为中山山地气候,雨量充沛,干湿季分明。年均气温17~20℃,年均降水量为2 800 mm。成土母岩为花岗岩。区内分布有山地红壤、山地黄壤、黑色石灰土三个大类的土壤。地带性植被为中亚热带常绿阔叶林。
试验区域为1989年皆伐掉所有树木后自然恢复形成的次生林,林内萌生有大量的苦竹,主要优势树种为黧蒴锥(Castanopsis fissa (Champion ex Bentham) Rehder et E. H. Wilson)、木莲(Manglietia fordiana Oliver)和米锥(Castanopsis chinensis (Spreng.) Hance),由于苦竹郁闭度极高,林内极少有灌木和草本植物。林地土壤为山地黄壤,表层(0~10 cm)pH值为4.40 ± 0.08,有机质含量为41.29 ± 3.27 g·kg−1,全氮(TN)含量为1.67 ± 0.16 g·kg−1,全磷(TP)含量为0.14 ± 0.02 g·kg−1,全钾(TK)含量为32.90 ± 1.58 g·kg−1。
-
2021年4月中旬在试验区域选取有代表性的林地,建立6个30 m × 40 m的标准植物样方,设置对照(CK)和林内竹子清除(RB)两组林内环境,每组3个重复。样地建立后对乔木层每木检尺,分析群落结构。采用冠层分析仪分析林冠层郁闭度。CK样地不做处理,林冠层郁闭度平均为0.97,RB样地人工砍掉样地内部和样地外距样地边线5 m范围内所有的苦竹,并将砍除残体移出样地外,处理后冠层郁闭度平均为0.73。
在砍除的残体中,选取生长良好、竹秆无破损和病虫害的样竹,收集竹叶、竹枝、竹秆(直径4~5 cm)的新鲜残体,随机选择竹桩挖掘出竹根,采集细根(直径<2 mm)。竹枝和细根剪成长度为4~6 cm的小段,竹秆锯成长度15 cm的小段。竹叶、竹枝和竹根准确称取25.0 g,竹秆取3段称量质量后装入凋落物分解袋并标记编号,分解袋规格为20 cm × 25 cm,网孔大小为底部0.2 mm(防止分解残渣漏掉),表面层5 mm(方便土壤动物进出)。每器官装60袋,共计240袋。每个器官另外采集50 g(竹秆采集3段)样品各3份,带回实验室在65℃下烘干至质量恒定,测定含水量,用于推算放置在凋落物袋内残体的初始干质量。烘干的各器官样品粉碎后用于测定碳(C)、N、P、K和木质素的初始含量。其中,C含量采用重铬酸钾氧化-外加热法测定;N含量采用碱解扩散法测定,P含量采用钼锑抗比色法测定,K含量采用火焰光度计法测定,木质素含量采用苯醇抽提法测定。
2021年4月底将分解袋放入建立好的样地中,每个器官的分解袋在每样地内放置10个,放置时网孔密的一面贴近地表,网孔疏的一面朝上。放置后的第2、4、6、9、12、16、20、26个月取样,每次从每样地内收集4个器官分解袋各1袋,带回实验室,小心去除表面泥土和新长入的细根,于65℃烘干至质量恒定,计算干质量残留率和分解速率。
-
苦竹各器官残体的质量残留率(Hw,%)用公式Hw=Mt /M0 × 100%计算,式中:M0为初始凋落物干质量/g;Mt为t天分解后的残余干质量/g。质量损失率(Pw,%)用公式Pw=100%−Hw计算。凋落物的分解速率采用Olson负指数衰减模型[21] y=ae−kt进行回归,式中,y为质量残留率/%,a为拟合参数,t为分解时间/a, k为凋落物的分解系数/(g·g−1·a−1),根据回归方程估算分解半衰期(T0.5)和分解周期(T0.95)。采用单因素方差分析(One-Way ANOVA)和最小显著差异法(LSD)比较不同处理及不同器官初始化学元素含量和分解指标间的差异;采用Pearson相关分析方法,分析苦竹残体分解系数与初始基质质量之间的关系。采用Excel 2021对数据进行整理和作图,采用SPSS 21.0对数据进行统计和回归分析。
-
苦竹不同器官间的基质质量存在较大差异(表1),竹叶的C、木质素含量和C/N、C/P、木质素/N最低,但N、P、K含量和N/P最高,且大多和其他器官间存在显著差异(p<0.05);竹枝的C、N、K含量和C/N、C/P、N/P介于竹秆和竹根间,P含量显著高于竹秆但和竹根、竹叶间差异不显著,木质素和木质素/N高于竹叶但低于竹秆和竹根;竹秆的C含量和C/N、C/P、木质素/N显著高于其他3个器官,N、P、K含量和N/P在4个器官中最低;竹根的C含量和C/N、C/P高于竹叶但低于竹枝和竹秆,N、K含量和N/P低于竹叶但高于竹枝和竹秆,P含量显著低于竹叶但和竹枝、竹秆间差异不显著,木质素含量显著高于其他器官,木质素/N显著高于竹叶、竹枝但显著低于竹秆。
表 1 苦竹不同器官分解前基质质量
Table 1. Initial quality of different organs of Pleioblastus amarus before decomposition
器官
OrganC/(g·kg−1) N/(g·kg−1) P/(g·kg−1) K/(g·kg−1) 木质素
Lignin /(g·kg−1)C/N C/P N/P 木质素/N
Lignin /N竹叶 Leaves 376.6 ± 7.9 c 20.8 ± 1.13 a 0.90 ± 0.06 a 11.9 ± 1.6 a 191.9 ± 9.4 c 18.2 ± 0.8 c 421.2 ± 21.0 c 23.2 ± 0.9 a 9.3 ± 0.8 d 竹枝 Twigs 468.6 ± 7.5 b 6.79 ± 0.84 b 0.73 ± 0.10 ab 6.3 ± 0.5 bc 210.3 ± 11.8 bc 71.0 ± 8.5 b 666.4 ± 91.0 b 9.6 ± 1.7 bc 32.5 ± 6.4 c 竹杆 Culms 492.4 ± 6.2 a 3.06 ± 0.16 c 0.45 ± 0.02 c 5.2 ± 0.3 c 242.8 ± 9.5 b 161.6 ± 7.2 a 1094.4 ± 58.9 a 6.8 ± 0.7 c 79.6 ± 3.3 a 竹根 Roots 395.9 ± 5.4 c 7.19 ± 0.46 b 0.64 ± 0.09 bc 8.7 ± 0.9 b 454.9 ± 19.3 a 55.5 ± 3.3 b 640.1 ± 71.4 b 11.5 ± 0.8 b 64.0 ± 6.0 b 注:数值为平均值 ± 标准误, 同列相同字母表示在列上差异不显著(p>0.05)
Notes: The data is mean values ± standard error, and same letter in the same column indicates non-significant difference in columns (p>0.05) -
苦竹新鲜残体各器官的分解过程可以分为两个阶段,即前期阶段(前2个月)质量快速损失,损失了总质量的16.6%~51.2%,后期阶段(后24个月)缓慢分解,损失了总质量的19.6%~40.3% (图1)。前期阶段两种林内环境下各器官平均质量损失率依次为竹叶(51.2 ± 2.7%)>竹枝(31.7 ± 1.5%)>竹根(24.4 ± 1.8%)>竹秆(16.6 ± 1.9%),各器官间均存在显著差异,RB环境下竹叶的质量损失率显著低于CK,其他器官在不同环境下无显著差异(图2),表明清除林下竹子在前期阶段减缓了竹叶的分解。在后期分解阶段,各器官的分解速率均较缓慢,两种林内环境下各器官平均质量损失率依次为竹枝(40.3 ± 2.3%)>竹叶(29.1 ± 1.7%)>竹秆(28.1 ± 2.2%)>竹根(19.6 ± 2.2%),其中竹枝显著高于其他3个器官(CK处理下和竹叶差异不显著),竹根显著低于其他3个器官,竹叶和竹秆间无显著差异。RB环境下竹枝的质量损失率显著高于CK,竹根的质量损失率显著低于CK,竹叶和竹秆在不同环境下无显著差异(图2),表明清除林下竹子在后期阶段加快了竹枝的分解但减缓了竹根的分解。在为期26个月的分解过程中,两种林内环境下各器官平均质量损失率依次为竹叶(80.4 ± 2.7%)>竹枝(72.0 ± 2.5%)>竹秆(44.8 ± 3.2%)>竹根(44.0 ± 3.2%),各器官间差异除竹叶和竹枝在RB处理下不显著外均达到显著水平。RB环境下竹叶和竹根的质量损失率显著低于CK,竹枝和竹秆在不同环境下无显著差异,表明清除林下竹子减缓了竹叶和竹根的分解,但对竹枝和竹秆的分解影响不大。

图 1 苦竹新鲜残体不同器官质量损失率动态变化
Figure 1. Dynamics of fresh residue mass loss percentage in different organs of Pleioblastus amarus
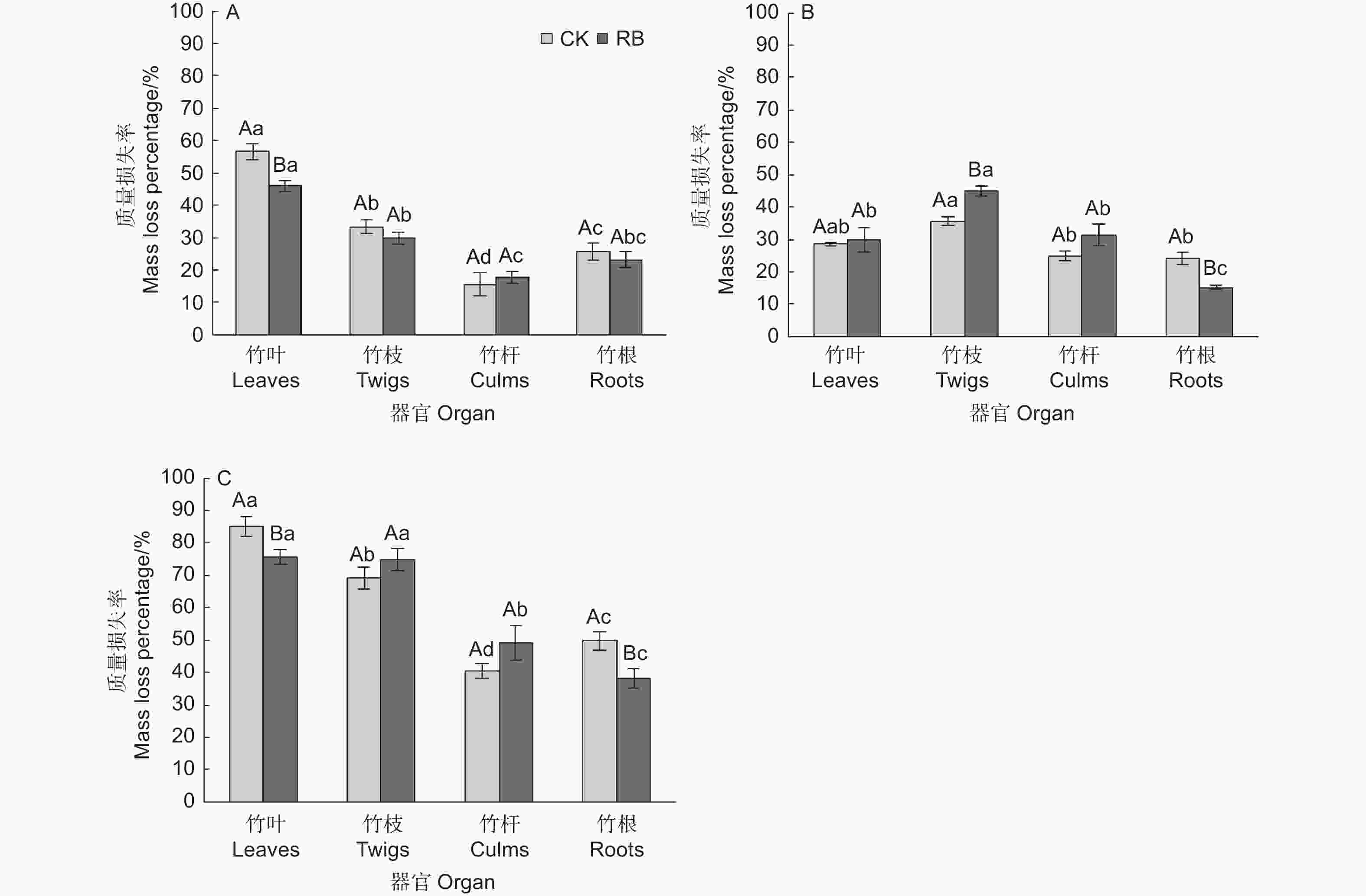
图 2 苦竹新鲜残体不同分解阶段质量损失率动态变化
Figure 2. Dynamics of fresh residue mass loss rates at different decomposition stags of Pleioblastus amarus
苦竹各器官残体在两种林内环境下的分解过程符合Olson的指数分解模型,各器官分解模型的相关系数均较高且达到显著水平(表2),表明Olson指数模型能够较好的模拟苦竹不同器官新鲜残体的分解过程。两种林内环境下各器官的平均分解系数(k)依次为竹叶(0.891 ± 0.090)>竹枝(0.554 ± 0.040)>竹秆(0.249 ± 0.026)>竹根(0.242 ± 0.032),其中竹叶显著高于其他3个器官,竹枝显著高于竹秆和竹根。RB环境下竹叶的k显著低于CK,其他3个器官在不同环境间无显著差异。两种林内环境下各器官分解50%的周期(T0.5)依次为竹秆(2.48 ± 0.22 a)>竹根(2.44 ± 0.34 a)>竹枝(0.97 ± 0.07 a)>竹叶(0.51 ± 0.04 a),其中竹根和竹秆显著高于竹枝和竹叶,RB环境下竹根的T0.5显著高于CK,其他3个器官在不同环境间无显著差异。两种林内环境下各器官平均分解周期(T0.95)依次为竹根(12.81 ± 1.64)>竹秆(12.12 ± 0.98)>竹枝(5.22 ± 0.34)>竹叶(3.22 ± 0.30),其中竹根和竹秆显著高于竹枝和竹叶。RB环境下竹秆的T0.95显著低于CK,竹根的T0.95显著高于CK,竹叶和竹枝在不同环境间无显著差异。
表 2 苦竹新鲜残体不同器官质量残留率与时间的指数回归方程
Table 2. Regression equations of residual rates versus time of different organ of fresh residues of Pleioblastus amarus
处理
Treatment器官
Organa k R2 T0.5/a T0.95/a CK 竹叶 Leaves 77.22 ± 0.59 Aa 1.051 ± 0.105 Ac 0.75 ± 0.01 Aa 0.42 ± 0.04 Aa 2.65 ± 0.25 Aa 竹枝 Twigs 83.11 ± 0.72 Ab 0.512 ± 0.042 Ab 0.83 ± 0.01 Abc 1.01 ± 0.09 Aa 5.57 ± 0.44 Ab 竹杆 Culms 90.19 ± 2.30 Ac 0.213 ± 0.008 Aa 0.85 ± 0.05 Ac 2.78 ± 0.22 Ac 13.61 ± 0.63 Ad 竹根 Roots 84.72 ± 0.84 Ab 0.302 ± 0.037 Aa 0.77 ± 0.02 Aab 1.80 ± 0.24 Ab 9.66 ± 1.17 Ac RB 竹叶 Leaves 77.16 ± 1.31 Aa 0.730 ± 0.060 Bb 0.73 ± 0.03 Aa 0.60 ± 0.03 Aa 3.79 ± 0.27 Aa 竹枝 Twigs 85.44 ± 0.94 Ab 0.596 ± 0.065 Ab 0.88 ± 0.01 Ab 0.92 ± 0.11 Aa 4.87 ± 0.50 Aa 竹杆 Culms 90.39 ± 1.07 Ac 0.285 ± 0.044 Aa 0.89 ± 0.01 Ab 2.18 ± 0.34 Ab 10.62 ± 1.49 Bb 竹根 Roots 86.45 ± 1.23 Ab 0.182 ± 0.017 Aa 0.71 ± 0.02 Aa 3.08 ± 0.35 Bc 15.96 ± 1.49 Bc 注:数值为平均值 ± 标准误, 同列相同大写字母表示在处理间差异不显著(p>0.05),相同小写字母表示在器官间差异不显著(p>0.05)
Notes: The data is mean values ± standard error, and the same uppercase letters in same columns indicate non-significant differences between treatments (p>0.05), and same lowercase letters indicate non-significant differences between organs (p>0.05) -
苦竹新鲜残体的初始基质质量与分解指标间的相关关系总体上表现为:C、木质素、C/N、C/P、木质素/N与前期质量损失率和k负相关,与分解周期指标(T0.5、T0.95)正相关,N、P、K、N/P与前期阶段质量损失率和k正相关,与分解周期指标负相关(表3)。初始基质质量与前期阶段质量损失率的相关性高于后期阶段,不同林内环境间并无明显差异,与后期阶段质量损失率间的相关性均未达到显著水平,表明初始基质质量主要影响苦竹残体分解的前期阶段。初始基质质量与k、T0.5、T0.95间的相关性在不同林内环境间存在较大差异,除木质素含量外,其他质量指标与CK环境下分解指标间的相关性均高于RB,表明初始基质质量在CK环境下对苦竹新鲜残体分解的影响高于RB。
表 3 苦竹新鲜残体基质质量与分解指标的相关分析
Table 3. Correlations between substrate quality and decomposition index of fresh residues of Pleioblastus amarus
项目
Item处理
TreatmentC N P K 木质素
LigninC/N C/P N/P 木质素/N
Lignin /N前期质量损失率
Mass loss rate in early stageCK −0.712 0.968* 0.971* 0.868 −0.429 −0.850 −0.884 0.949* −0.962* RB −0.668 0.962* 0.961* 0.840 −0.486 −0.817 −0.855 0.938* −0.967* 后期质量损失率
Mass loss rate in late stageCK 0.229 0.118 0.464 −0.108 −0.596 −0.264 −0.315 0.044 −0.598 RB 0.578 −0.064 0.145 −0.378 −0.822 0.164 0.097 −0.149 −0.358 k CK −0.642 0.969* 0.929* 0.833 −0.531 −0.764 −0.805 0.944* −0.946* RB −0.242 0.740 0.817 0.486 −0.804 −0.543 −0.607 0.680 −0.929* T0.5 CK 0.631 −0.829 −0.989** −0.739 0.362 0.900* 0.930* −0.801 0.979* RB 0.063 −0.621 −0.699 −0.327 0.893 0.384 0.455 −0.551 0.847 T0.95 CK 0.607 −0.840 −0.987** −0.732 0.412 0.879 0.913* −0.808 0.989** RB −0.016 −0.564 −0.639 −0.256 0.924* 0.309 0.382 −0.492 0.802 注:* 表示相关性显著( p<0.05),**表示相关性极显著( p<0.01)
Notes: * indicates significant correlation (p<0.05) and ** indicates extremely significant correlation (p<0.01)初始基质质量中,C和K含量与分解指标(前期质量损失率、后期质量损失率和k)间的相关性均未达到显著水平(p>0.05),表明这两个指标对苦竹新鲜残体分解的影响较小。N、P、N/P与前期阶段质量损失率间显著正相关,与CK环境下k、T0.5、T0.95间的相关性也较高,木质素/N与前期阶段质量损失率间显著负相关,与CK环境下k、T0.5、T0.95间的相关性也达到了显著水平,表明这4个指标对苦竹新鲜残体分解的影响较大。
-
本研究中,苦竹各器官新鲜残体的分解过程可分为两个阶段,即前期阶段(前2个月)质量快速损失,后期阶段(后24个月)缓慢分解,这一现象在凋落物分解研究中较为普遍[14, 22-25]。凋落物分解是一个包含了物理、化学和生物学等多种因素影响的过程,主要由物理淋溶、土壤动物取食和微生物代谢共同完成[26]。前期质量快速损失阶段的主导因子是凋落物中的可溶性成份的淋溶和凋落物中的非结构性碳被微生物快速利用[23]。本研究中,苦竹新鲜残体开始放置时间正值南方雨季,淋溶作用强烈。此外,新鲜残体往往含有较多的非结构性碳,加之分解材料未经烘干处理保留了细胞中的降解酶,在微生物和降解酶共同作用下造成了质量的快速损失。经过前期的快速分解,残留组织中主要成分为难降解的纤维素、木质素、酚类和单宁等[24, 27],这一阶段主要由真菌利用难分解物质完成[28]。本研究中,苦竹残体后期分解较为平稳缓慢,分解速度慢于同亚热带地区的乔木树种的凋落物[14],反映了苦竹残体中的成份更难被降解。
-
本研究中,苦竹新鲜残体各器官间分解速率存在显著差异,总体表现为竹叶>竹枝>竹秆>竹根,其中竹叶显著高于其他3个器官,竹枝显著高于竹秆和竹根,竹秆和竹根间差异不大,这和之前研究结果相符[19],这种差异的主要原因是各器官间初始基质质量差异。在凋落物分解的各种驱动因素中,凋落物的初始基质质量是分解速率的直接调节因素[14]。以往研究表明,凋落物中的N[29]、P[25]、C/N[30]、木质素/N[31]等对凋落物的分解速率有重要影响。本研究中,苦竹残体各器官基质质量中的N、P、N/P、木质素/N与分解速率显著相关,和其他竹类凋落叶分解的影响因素相似[14]。N、P、N/P与分解速率显著正相关,且主要影响分解前期阶段,和之前报道相符[25, 29],这主要是因为N和P是微生物生长和繁殖必需的营养元素,高的N和P含量在分解初期促进了微生物的活动,之后随着易分解物质的耗尽,分解过程主要由木质素等难分解成分主导。木质素/N与分解速率显著负相关,是各器官分解速率差异的主导因子,和之前报道相符[31]。木质素是苦竹残体的主要组分,由结构复杂、稳定、多样的无定型三维体形大分子构成,被认为是凋落物中最难降解的组分[32],且能与纤维素、蛋白质等大分子物质结合形成类似“屏障”的结构,阻碍分解者活动,从而控制凋落物的整个分解进程[33]。本研究中竹根的木质素含量高达454.9 g·kg−1,远高于其他器官,这可能是其分解周期(T0.95)最高的主要原因。
-
本研究中苦竹鲜叶在两种林内环境下的分解系数(k)分别为1.051和0.730,与苦竹凋落叶和鲜叶在竹林内的分解系数(分别为1.00和0.93)[23] 接近,高于华西箭竹(Fargesia nitida (Mitford) Keng f. ex Yi)凋落叶在常绿阔叶林下的分解系数(0.40)[14],低于苦竹凋落叶在杉木(Cunninghamia lanceolata (Lamb.) Hook.) + 苦竹林内的分解系数(1.322)[20],这种差异可能主要由分解物基质质量和分解环境差异造成的。苦竹鲜叶分解周期(T0.95)在两种林下环境中分别为2.65 和3.79 a,高于箭竹凋落叶在常绿阔叶林下(2.50 a)[14]和苦竹凋落叶在杉木 + 苦竹林下(2.27 a)[20] 的分解周期,和苦竹凋落叶和鲜叶在竹林下的分解周期(分别为3.00和3.22 a)[23]接近。本研究中苦竹新鲜小枝的分解速率低于苦竹凋落小枝在竹林下的分解速率[23]。一般情况下,新鲜植物残体含有比正常凋落物更多的营养物质和更低的C/N[10],更容易被微生物降解利用,因此其分解速度要高于正常凋落物[34]。但Tu等对比了苦竹鲜叶和凋落叶的养分含量,发现鲜叶木质素和C含量高于凋落叶,P、K、C/N、木质素/N均低于凋落叶[23],这可能是本研究中苦竹鲜叶分解速率低于之前报道的凋落叶的原因之一。此外,分解环境的不同可能是本研究中苦竹鲜叶分解速率较低的另一原因,这有待进一步实验证实。
-
本研究中,清除林下竹子减缓了竹叶和竹根的分解,增加了其分解周期,对竹秆和竹枝的分解有一定促进作用,降低了其分解周期。除基质质量外,分解环境是凋落物分解速率的另一关键影响因素[35-37],一般认为,高温高湿的环境有利于凋落物的分解[38]。清除林下竹子后,林下环境发生多种改变,更多的阳光到达地表使得土壤温度升高,蒸发加快,更多的雨水直接到达地表增强了淋溶和物理冲刷。竹叶和竹根含有更多的养分和非结构性碳,其早期分解主要由微生物和土壤动物主导,而在凋落物早期分解过程中,水分通过影响土壤动物活动对分解起着主导作用[39]。因此,清除林下竹子后地表湿度的降低不利于微生物和土壤动物活动,可能是竹叶和竹根分解减慢的原因之一。竹秆和竹枝木质素含量较高,清除林下竹子后强烈的淋溶和雨水冲刷可能是其分解加快的原因之一。紫外线B(UVB)已被证明能够促进凋落物中木质素和纤维素的降解[40],清除竹子后更多的UVB辐射可能是加快木质素含量较高的竹杆和竹枝分解的原因之一,这尚需进一步实验证实。
-
(1) 苦竹各器官新鲜残体的分解过程可分为两个阶段:前期阶段(前2个月)质量快速损失,后期阶段(后24个月)缓慢分解。
(2)竹叶具有最高的分解系数和最短的分解周期,其次为竹枝;竹秆和竹根的分解系数最低分解周期最长。
(3) 苦竹各器官新鲜残体基质质量中,C、K、木质素、C/N、C/P对分解速率影响较小,N、P、N/P与分解速率正相关,木质素/N与分解速率负相关,且主要影响分解前期阶段。
(4) 清除林下竹子能减缓竹叶和竹根的分解,加快竹秆和竹枝的分解,减弱基质质量对分解速率的影响。
不同林内环境下苦竹新鲜残体的分解特征
Decomposition Characteristics of Fresh Residues of Pleioblastus Amarus in Different in-forest Environments
-
摘要:
目的 研究苦竹新鲜残体的分解过程及影响因素可以预测苦竹林在受到极端气候事件导致的机械损伤后生态系统物质循环变化过程,评估灾害对森林碳汇功能的影响,为灾后森林科学管理提供依据。 方法 以广东南岭地区皆伐后苦竹大量扩张的次生林为对象,设置对照(CK)和移除林下竹子(RB)两种林内环境,采用分解袋法研究了苦竹各器官新鲜残体的分解特征。 结果 苦竹各器官新鲜残体的分解过程可以分为两个阶段,即前期阶段(前2个月)质量快速损失,后期阶段(后24个月)缓慢分解。前期阶段各器官平均质量损失率依次为竹叶(51.2%)>竹枝(31.7%)>竹根(24.4%)>竹秆(16.6%),各器官间均存在显著差异(P<0.05),RB环境下竹叶的质量损失率显著低于CK。后期阶段各器官平均质量损失率依次为竹枝(40.3%)>竹叶(29.1%)>竹秆(28.1%)>竹根(19.6%),各器官间除竹叶与竹秆外均存在显著差异,RB环境下竹枝的质量损失率显著高于CK,竹根的质量损失率显著低于CK。Olson分解模型能够较好地模拟各器官的分解过程,平均分解系数(k)依次为竹叶(0.891)>竹枝(0.554)>竹秆(0.249)>竹根(0.242),各器官间除竹秆和竹根外均存在显著差异,RB环境下竹叶的k显著低于CK。各器官分解50%的周期(T0.5)依次为竹秆(2.48 a)>竹根(2.44 a)>竹枝(0.97 a)>竹叶(0.51 a),其中竹根和竹秆显著高于竹枝和竹叶,RB环境下竹根的T0.5显著高于CK。各器官分解周期(T0.95)依次为竹根(12.81 a)>竹秆(12.12 a)>竹枝(5.22 a)>竹叶(3.22 a),其中竹根和竹秆显著高于竹枝和竹叶,RB环境下竹秆的T0.95显著低于CK,竹根的T0.95显著高于CK。各器官基质质量与分解指标间的相关系数总体上表现为前期阶段高于后期阶段,CK环境下高于RB环境下,其中碳(C)、钾(K)、C/氮(N)、C/磷(P)与分解指标间相关系数较小,N、P、N/P与分解速率呈正相关,木质素/N与分解速率呈负相关。 结论 苦竹新鲜残体的分解过程表现为前期快速失重后期缓慢分解;竹叶分解速率最快,其次为竹枝,竹秆和竹根最慢;各器官基质质量中,N、P、N/P、木质素/N对分解速率影响较大,且主要影响分解前期阶段;清除林下竹子能减缓竹叶和竹根的分解,加快竹秆和竹枝的分解,减弱基质质量对分解速率的影响。 Abstract:Objective To study the decomposition process of fresh residues of Pleioblastus amarus (Keng) keng and its influential factors, predict the changes in processes of ecosystem material cycling in bamboo forests after being mechanically damaged by extreme climatic events, and assess the impacts of the disaster on the function of forest carbon sinks for providing a basis for the scientific management of forests after the disaster. Methods Based on the secondary forests, where P. amarus expanded greatly after clearcutting, in the Nanling area of Guangdong Province, two treatments including removal of understory bamboos (RB) and control (CK) were set uo to generate distinct in-forest environments, and the decomposition characteristics of fresh residues from various organs of P. amarus were studied using the decomposition bag method. Results The decomposition process of fresh residues of each organ of P. amarus could be divided into two stages, rapid mass loss in the early stage (first 2 months) and slow decomposition in the later stage (last 24 months). The average mass loss rate of each organ in the early stage was in the order of leaves (51.2%) > twigs (31.7%) > roots (24.4%) > culms (16.6%), and there were significant differences (P<0.05) among all organs, with a significantly lower mass loss rate of leaves in RB environment than that of CK. The average mass loss rate of each organ at the later stage was in the order of twigs (40.3%) >leaves (29.1%) > culms (28.1%) > roots (19.6%), and there were significant differences among the organs except for leaf and culm. The mass loss rate of branches in RB environment was significantly higher than that of CK, while the mass loss rate of roots was significantly lower than that of CK. The Olson decomposition model could well fit the decomposition processes of various organs., The average decomposition coefficient (k) of leaves (0.891) was the largest, followed by the twigs (0.554), culms (0.249), and roots (0.242). There were significant differences of the k among all organs except for culms and roots, and the k of leaves in RB environment was significantly lower than that of CK. The period of 50% decomposition (T0.5) of each organ was in the order of culms (2.48 a) > root (2.44 a) > twigs (0.97 a) > leaves (0.51 a), with roots and culms significantly higher than twigs and leaves, and the T0.5 of root in RB environment was significantly higher than that of CK. The decomposition period (T0.95) of each organ was in the order of roots (12.81 a) > culms (12.12 a) > twigs (5.22 a) > leaves (3.22 a), with roots and culms significantly higher than twigs and bamboo leaves. Under RB environment, the T0.95 of culms and roots was significantly lower and higher than that of CK, respectively. The correlation coefficient between the substrate quality of various organ and decomposition indexes was generally higher in the early stage than in the later stage, and higher in the CK than in the RB environment. Among them, the correlation coefficients between carbon (C), potassium (K), C/nitrogen (N), C/phosphorus (P) and the decomposition indexes were relatively small; N, P, and N/P were positively correlated with decomposition rate, and lignin/N was negatively correlated with decomposition rate. Conclusion Decomposition of fresh residues of P. amarus is characterized by a rapid weight loss in the early stage and a slow decomposition in the later stage. Leaves have the fastest decomposition rate, followed by twigs and culms, and roots are the slowest. Among the substrate qualities of various organ, N, P, N/P, and lignin/N have significant impacts on the decomposition rate, in particular in the early stage of decomposition. Removal of understory bamboo can slow down the decomposition of leaves and roots, accelerate decomposition of culms and twigs, and attenuate the effects of substrate quality on decomposition rates. -
表 1 苦竹不同器官分解前基质质量
Table 1. Initial quality of different organs of Pleioblastus amarus before decomposition
器官
OrganC/(g·kg−1) N/(g·kg−1) P/(g·kg−1) K/(g·kg−1) 木质素
Lignin /(g·kg−1)C/N C/P N/P 木质素/N
Lignin /N竹叶 Leaves 376.6 ± 7.9 c 20.8 ± 1.13 a 0.90 ± 0.06 a 11.9 ± 1.6 a 191.9 ± 9.4 c 18.2 ± 0.8 c 421.2 ± 21.0 c 23.2 ± 0.9 a 9.3 ± 0.8 d 竹枝 Twigs 468.6 ± 7.5 b 6.79 ± 0.84 b 0.73 ± 0.10 ab 6.3 ± 0.5 bc 210.3 ± 11.8 bc 71.0 ± 8.5 b 666.4 ± 91.0 b 9.6 ± 1.7 bc 32.5 ± 6.4 c 竹杆 Culms 492.4 ± 6.2 a 3.06 ± 0.16 c 0.45 ± 0.02 c 5.2 ± 0.3 c 242.8 ± 9.5 b 161.6 ± 7.2 a 1094.4 ± 58.9 a 6.8 ± 0.7 c 79.6 ± 3.3 a 竹根 Roots 395.9 ± 5.4 c 7.19 ± 0.46 b 0.64 ± 0.09 bc 8.7 ± 0.9 b 454.9 ± 19.3 a 55.5 ± 3.3 b 640.1 ± 71.4 b 11.5 ± 0.8 b 64.0 ± 6.0 b 注:数值为平均值 ± 标准误, 同列相同字母表示在列上差异不显著(p>0.05)
Notes: The data is mean values ± standard error, and same letter in the same column indicates non-significant difference in columns (p>0.05)表 2 苦竹新鲜残体不同器官质量残留率与时间的指数回归方程
Table 2. Regression equations of residual rates versus time of different organ of fresh residues of Pleioblastus amarus
处理
Treatment器官
Organa k R2 T0.5/a T0.95/a CK 竹叶 Leaves 77.22 ± 0.59 Aa 1.051 ± 0.105 Ac 0.75 ± 0.01 Aa 0.42 ± 0.04 Aa 2.65 ± 0.25 Aa 竹枝 Twigs 83.11 ± 0.72 Ab 0.512 ± 0.042 Ab 0.83 ± 0.01 Abc 1.01 ± 0.09 Aa 5.57 ± 0.44 Ab 竹杆 Culms 90.19 ± 2.30 Ac 0.213 ± 0.008 Aa 0.85 ± 0.05 Ac 2.78 ± 0.22 Ac 13.61 ± 0.63 Ad 竹根 Roots 84.72 ± 0.84 Ab 0.302 ± 0.037 Aa 0.77 ± 0.02 Aab 1.80 ± 0.24 Ab 9.66 ± 1.17 Ac RB 竹叶 Leaves 77.16 ± 1.31 Aa 0.730 ± 0.060 Bb 0.73 ± 0.03 Aa 0.60 ± 0.03 Aa 3.79 ± 0.27 Aa 竹枝 Twigs 85.44 ± 0.94 Ab 0.596 ± 0.065 Ab 0.88 ± 0.01 Ab 0.92 ± 0.11 Aa 4.87 ± 0.50 Aa 竹杆 Culms 90.39 ± 1.07 Ac 0.285 ± 0.044 Aa 0.89 ± 0.01 Ab 2.18 ± 0.34 Ab 10.62 ± 1.49 Bb 竹根 Roots 86.45 ± 1.23 Ab 0.182 ± 0.017 Aa 0.71 ± 0.02 Aa 3.08 ± 0.35 Bc 15.96 ± 1.49 Bc 注:数值为平均值 ± 标准误, 同列相同大写字母表示在处理间差异不显著(p>0.05),相同小写字母表示在器官间差异不显著(p>0.05)
Notes: The data is mean values ± standard error, and the same uppercase letters in same columns indicate non-significant differences between treatments (p>0.05), and same lowercase letters indicate non-significant differences between organs (p>0.05)表 3 苦竹新鲜残体基质质量与分解指标的相关分析
Table 3. Correlations between substrate quality and decomposition index of fresh residues of Pleioblastus amarus
项目
Item处理
TreatmentC N P K 木质素
LigninC/N C/P N/P 木质素/N
Lignin /N前期质量损失率
Mass loss rate in early stageCK −0.712 0.968* 0.971* 0.868 −0.429 −0.850 −0.884 0.949* −0.962* RB −0.668 0.962* 0.961* 0.840 −0.486 −0.817 −0.855 0.938* −0.967* 后期质量损失率
Mass loss rate in late stageCK 0.229 0.118 0.464 −0.108 −0.596 −0.264 −0.315 0.044 −0.598 RB 0.578 −0.064 0.145 −0.378 −0.822 0.164 0.097 −0.149 −0.358 k CK −0.642 0.969* 0.929* 0.833 −0.531 −0.764 −0.805 0.944* −0.946* RB −0.242 0.740 0.817 0.486 −0.804 −0.543 −0.607 0.680 −0.929* T0.5 CK 0.631 −0.829 −0.989** −0.739 0.362 0.900* 0.930* −0.801 0.979* RB 0.063 −0.621 −0.699 −0.327 0.893 0.384 0.455 −0.551 0.847 T0.95 CK 0.607 −0.840 −0.987** −0.732 0.412 0.879 0.913* −0.808 0.989** RB −0.016 −0.564 −0.639 −0.256 0.924* 0.309 0.382 −0.492 0.802 注:* 表示相关性显著( p<0.05),**表示相关性极显著( p<0.01)
Notes: * indicates significant correlation (p<0.05) and ** indicates extremely significant correlation (p<0.01) -
[1] FOOD AND AGRICULTURE ORGANIZATION OF THE UNITED NATIONS (FAO). Global Forest Resources Assessment 2010: Main Report[R]. 2010. [2] 郭起荣, 杨光耀, 杜天真, 等. 中国竹林的碳素特征[J]. 世界竹藤通讯, 2005, 3(3):25-28. [3] LIMA R A F, ROTHER D C, MULER A E, et al. Bamboo overabundance alters forest structure and dynamics in the Atlantic Forest hotspot[J]. Biological Conservation, 2012, 147(1): 32-39. doi: 10.1016/j.biocon.2012.01.015 [4] XU Q F, JIANG P K, WU J S, et al. Bamboo invasion of native broadleaf forest modified soil microbial communities and diversity[J]. Biological Invasions, 2015, 17(1): 433-444. doi: 10.1007/s10530-014-0741-y [5] LUAN J W, LI S Y, DONG W, et al. Litter decomposition affected by bamboo expansion is modulated by litter-mixing and microbial composition[J]. Functional Ecology, 2021, 35(11): 2562-2574. doi: 10.1111/1365-2435.13911 [6] XU Q F, LIANG C F, CHEN J H, et al. Rapid bamboo invasion (expansion) and its effects on biodiversity and soil processes[J]. Global Ecology and Conservation, 2020, 21: e00787. doi: 10.1016/j.gecco.2019.e00787 [7] SCHIERMEIER Q. Climate change: A sea change[J]. Nature, 2006, 439(7074): 256-260. doi: 10.1038/439256a [8] FAHEY T J, YAVITT J B, SHERMAN R E, et al. Earthworm effects on the incorporation of litter C and N into soil organic matter in a sugar maple forest[J]. Ecological Applications, 2013, 23(5): 1185-1201. doi: 10.1890/12-1760.1 [9] 吴仲民, 李意德, 周光益, 等. “非正常凋落物”及其生态学意义[J]. 林业科学, 2008, 44(11):28-31. [10] XU X N, HIRATA E, ENOKI T, et al. Leaf litter decomposition and nutrient dynamics in a subtropical forest after typhoon disturbance[J]. Plant Ecology, 2004, 173(2): 161-170. doi: 10.1023/B:VEGE.0000029319.05980.70 [11] ZHOU B Z, LI Z C, WANG X M, et al. Impact of the 2008 ice storm on moso bamboo plantations in southeast China[J]. Journal of Geophysical Research-Biogeosciences, 2011, 116(G3): G6H. [12] WU J J, ZHANG H, CHENG X L, et al. Nitrogen addition stimulates litter decomposition rate: From the perspective of the combined effect of soil environment and litter quality[J]. Soil Biology and Biochemistry, 2023, 179: 108992. doi: 10.1016/j.soilbio.2023.108992 [13] GILL A L, SCHILLING J, HOBBIE S E. Experimental nitrogen fertilisation globally accelerates, then slows decomposition of leaf litter[J]. Ecology Letters, 2021, 24(4): 802-811. doi: 10.1111/ele.13700 [14] LIU W Y, FOX J, XU Z F. Leaf litter decomposition of canopy trees, bamboo and moss in a montane moist evergreen broad-leaved forest on Ailao Mountain, Yunnan, south-west China[J]. Ecological Research, 2000, 15(4): 435-447. doi: 10.1046/j.1440-1703.2000.00366.x [15] PEÑA-PEÑA K, IRMLER U. Modelling litter decomposition rates along a geographic, climatic, and land-use gradient in Southern Amazonia and Pará[J]. Pedobiologia, 2022, 95: 150839. doi: 10.1016/j.pedobi.2022.150839 [16] SERES A, KRÖEL-DULAY G, SZAKÁLAS J, et al. The response of litter decomposition to extreme drought modified by plant species, plant part, and soil depth in a temperate grassland[J]. Ecology and Evolution, 2022, 12(12): e9652. doi: 10.1002/ece3.9652 [17] FONTE S J, SCHOWALTER D T. Decomposition of greenfall vs. senescent foliage in a tropical forest ecosystem in Puerto Rico[J]. Biotropica., 2004, 36(4): 474-482. doi: 10.1111/j.1744-7429.2004.tb00343.x [18] 涂利华, 戴洪忠, 胡庭兴, 等. 模拟氮沉降对华西雨屏区撑绿杂交竹凋落物分解的影响[J]. 生态学报, 2011, 31(5):1277-1284. [19] 李仁洪, 胡庭兴, 涂利华, 等. 模拟氮沉降对华西雨屏区慈竹林凋落物分解的影响[J]. 应用生态学报, 2009, 20(11):2588-2593. [20] 连华萍. 杉木苦竹混交林生长效应与凋落物分解研究[J]. 福建林业科技, 2014, 41(3):6-11. [21] OLSON J S. Energy storage and the balance of producers and decomposers in ecological systems[J]. Ecology, 1963, 44(2): 322-331. doi: 10.2307/1932179 [22] 郭培培, 江 洪, 余树全, 等. 亚热带6种针叶和阔叶树种凋落叶分解比较[J]. 应用与环境生物学报:, 2009, 15(5):655-659. [23] TU L H, HU H L, HU T X, et al. Litterfall, litter decomposition, and nutrient dynamics in two subtropical bamboo plantations of China[J]. Pedosphere, 2014, 24(1): 84-97. doi: 10.1016/S1002-0160(13)60083-1 [24] MAO B, CUI T T, SU T Q, et al. Mixed-litter effects of fresh leaf semi-decomposed litter and fine root on soil enzyme activity and microbial community in an evergreen broadleaf karst forest in southwest China[J]. Frontiers in Plant Science, 2022, 13: 1065807. doi: 10.3389/fpls.2022.1065807 [25] 伍六斤, 张傲冬, 牟 凌, 等. 川西地区7种常见彩叶树种凋落物分解[J]. 应用与环境生物学报, 2021, 27(3):625-631. [26] SULKAVA P, HUHTA V. Effects of hard frost and freeze-thaw cycles on decomposer communities and N mineralisation in boreal forest soil[J]. Applied Soil Ecology, 2003, 22(3): 225-239. doi: 10.1016/S0929-1393(02)00155-5 [27] BERG B, MATZNER E. Effect of N deposition on decomposition of plant litter and soil organic matter in forest systems[J]. Environmental Reviews, 1997, 5(1): 1-25. doi: 10.1139/a96-017 [28] PRESCOTT C E. Litter decomposition: what controls it and how can we alter it to sequester more carbon in forest soils?[J]. Biogeochemistry, 2010, 101(1-3): 133-149. doi: 10.1007/s10533-010-9439-0 [29] COTRUFO M F, INESON P. Effects of enhanced atmospheric CO2 and nutrient supply on the quality and subsequent decomposition of fine roots of Betula pendula Roth. and Picea sitchensis (Bong. ) Carr.[J]. Plant and Soil, 1995, 170(2): 267-277. doi: 10.1007/BF00010479 [30] SHI L, FAN S H, JIANG Z H, et al. Mixed leaf litter decomposition and N, P release with a focus on Phyllostachys edulis (Carriere) J. Houz. forest in subtropical southeastern China[J]. Acta Societatis Botanicorum Poloniae, 2015, 84(2): 207-214. doi: 10.5586/asbp.2015.019 [31] PEÑA-PEÑA K, IRMLER U. Nitrogen and carbon losses from decomposing litter in natural and agroecosystems of two different climate regions of Brazil[J]. European Journal of Soil Biology, 2018, 86: 26-33. doi: 10.1016/j.ejsobi.2018.02.003 [32] BROWN M E, CHANG M C Y. Exploring bacterial lignin degradation[J]. Current Opinion in Chemical Biology, 2014, 19: 1-7. doi: 10.1016/j.cbpa.2013.11.015 [33] AUSTIN A T, BALLARE C L. Dual role of lignin in plant litter decomposition in terrestrial ecosystems[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(10): 4618-4622. [34] YU G C, ZHAO H B, CHEN J, et al. Soil microbial community dynamics mediate the priming effects caused by in situ decomposition of fresh plant residues[J]. Science of the Total Environment, 2020, 737: 139708. doi: 10.1016/j.scitotenv.2020.139708 [35] 张 悦, 张艺凡, 马怡波, 等. 森林生态系统凋落物分解影响因素研究进展[J]. 环境生态学, 2023, 5(4):45-56. [36] 段文标, 朱帅威, 陈 佳, 等. 椴树红松林掘根倒木及其微立地对凋落叶分解的影响[J]. 中南林业科技大学学报, 2022, 42(6):1-14. [37] 陈 佳, 段文标, 曲美学, 等. 云冷杉红松林掘根倒木及其微立地对凋落叶分解速率及养分释放的影响[J]. 生态学报, 2021, 41(24):9749-9759. [38] 彭少麟, 刘 强. 森林凋落物动态及其对全球变暖的响应[J]. 生态学报, 2002, 22(9):1534-1544. [39] LIAO S, NI X Y, YANG W Q, et al. Water, rather than temperature, dominantly impacts how soil fauna affect dissolved carbon and nitrogen release from fresh litter during early litter decomposition[J]. Forests, 2016, 7(10): 249. [40] SONG X Z, JIANG H, ZHANG Z T, et al. Interactive effects of elevated UV-B radiation and N deposition on decomposition of Moso bamboo litter[J]. Soil Biology & Biochemistry, 2014, 69: 11-16. -




 下载:
下载:

