-
植物在生长发育过程中会遭受多种生物与非生物胁迫,其中干旱胁迫是植物面临的主要非生物胁迫之一[1-2]。在干旱胁迫下,植物体内活性氧(ROS,reactive oxygen species)等次生代谢物积累,损伤植物细胞结构;影响植物体内叶绿素合成,植物光合能力减弱;影响植物生长发育,降低植物产量[3-4]。研究植物响应干旱胁迫的分子机制,提高植物抗旱性,对生态环境建设、国民经济发展具有重要意义。
植物响应干旱胁迫的生理和分子机制在模式植物拟南芥和作物中研究较多、较深入,研究表明,在22 ℃,12 h光照/12 h黑暗条件生长3周的拟南芥,停止浇水干旱处理约2周,观察表型发现野生型拟南芥生长未受到影响[5];同样的生长条件,生长10 d的单子叶植物玉米,停止浇水后约一周,可以观察到叶片萎蔫[6]。多年生木本植物由于个体大、世代周期长等原因,使得其生理和分子机制的研究相对困难;同时,由于多年生木本植物具有规律的生长周期、次生维管组织复杂等特性,其生物学特性与一年生草本植物的差异非常大[7]。因此,以多年生林木为研究对象,探究其对干旱胁迫的响应机制,不仅能够为林木响应干旱胁迫的研究提供理论基础,也有助于科学培育苗木,为培育耐旱林木新品种提供理论支撑。
中国是森林资源贫乏的国家,每年国家需要进口大量木材才能满足经济建设,通过使用丰产栽培方式种植速生树种,是在短期内解决国家木材短缺的重要途径。杨树用途广泛,不仅用于防护林、生态林建设,也用于工业用材[8]。在毛果杨中研究发现,PtrSWRA复合体所催化的H3K4me3修饰,对于维持杨树的耐旱性具有至关重要的作用[9];在欧美杂交杨中研究发现,在干旱胁迫下PdGNC的表达升高,PdGNC能够直接上调PdHXK1表达,激活的PdHXK1进而增加己糖激酶活性来促进保卫细胞中NO和H2O2的积累,触发气孔关闭,从而提高植株水分利用率和干旱耐受性[10]。作为白杨派的银白杨,广泛分布于我国西北、华北等地,其树干通直,成材快,但在其生长过程中会遭受干旱、盐碱、病虫害等生物与非生物胁迫。目前银白杨已经具有高质量基因组数据和转化体系[11-12]。深入研究银白杨响应干旱胁迫的分子机制,对了解干旱胁迫对多年生树木的影响具有重要意义。
本文以在土里生长5周的银白杨幼苗为研究对象。通过干旱胁迫处理银白杨幼苗,并对银白杨生长变化,生理、生化指标检测,基因表达变化进行分析。解析银白杨响应干旱胁迫的生理机制,为科学培育苗木提供理论指导。
-
取在温室中正常培养5周、高度约36 cm,长势一致且健壮的银白杨植株,将其完全浇透水后,放置在正常生长条件下培养,并停止浇水,开始干旱处理,从这一天(0 d)开始直至干旱处理至12 d,每隔1 d随机选4棵幼苗,取其第6片叶片,进行叶片相对含水量的测定。首先,测量取得的叶片的鲜质量,然后,将叶片置于无菌去离子水中浸泡12 h,取出并擦干水分,称取叶片的饱和鲜质量。最后,将叶片置于65 ℃烘箱中进行烘干,直至叶片质量恒定。叶片相对含水量的计算公式如下:
$ W C=\left(W_{\mathrm{F}}-W_{\mathrm{D}}\right) /\left(W_{\mathrm{T}}-W_{\mathrm{D}}\right) \times 100 {\text{%}} $
式中:WC为叶片相对含水量,WF为鲜质量,WD为干质量,WT为饱和鲜质量
-
在银白杨干旱处理的第0、4、8和12 d,分别随机取4株银白杨的第5片叶片进行气孔开度观察。在第5片叶片的中心位置避开叶脉随机取约4 mm
$ \times $ 4 mm大小叶片,立即放入2.5%戊二醛溶液进行固定,并对叶片进行抽真空处理,叶片固定24 h;将固定好的叶片使用0.1 mol·L−1 pH7.2的磷酸缓冲液清洗样品3次;接着依次使用30%、50%、70%、80%、90%、95%、100%的乙醇进行梯度处理,每个梯度处理15~20 min,全程在冰上进行。脱水处理后的样品使用全自动临界点干燥仪对样品进行干燥。干燥后的样品使用扫描电镜进行气孔开度观察。 -
在银白杨干旱处理的第0、2、4、6、8、10和12 d,分别随机取4株银白杨植株,取其第7片叶片进行叶绿素a,叶绿素b和总叶绿素含量的测定。利用植物叶绿素含量检测试剂盒(货号:BC0990,索莱宝,北京)提取银白杨叶片的叶绿素。利用酶标仪进行叶绿素含量的测定,分别测量叶绿素提取液在663 nm和645 nm波长下的吸光度值。叶绿素a,叶绿素b和总叶绿素含量的计算公式分别为:
$ \begin{aligned} C_{\text {Chla }}=\left(12.7 \times A_{663}-2.69 \times A_{645}\right) \times F \div W \text {; } \\ C_{\text {Chlb }}=\left(22.9 \times A_{645}-4.68 \times A_{663}\right) \times F \div W \text {; } \\ C_{\text {Chla + b }}=\left(20.21 \times A_{645} + 8.02 \times A_{663}\right) \times F \div W \\ \end{aligned} $
-
为了检测不同干旱处理时间下,银白杨叶片中ROS含量的差异,本研究以干旱处理0、4、8和12 d的银白杨植株的第5片叶为材料进行研究。将所取的不同干旱处理天数的银白杨叶片置于1 mg·mL−1的DAB染液(pH3.8)中暗处理24 h后,在室温下将叶片用100%乙醇脱色3 h,95%乙醇煮沸约10 min至叶片不再变色。拍照,比较不同干旱处理天数的叶片的颜色,ROS含量越高,颜色越深。
-
在银白杨干旱处理的0、2、4、6、8、10和12 d分别随机选取3棵植株的第4片叶放在液氮中保存。利用这些材料进行ABA和IAA含量的测定。测定时,将样品用冷冻干燥机进行冻干,每份样品精密称量20 mg干燥粉末后加入1 mL 80%甲醇水溶液,并加入两种植物激素稳定同位素内标[13C]6-IAA和[2H]6-ABA(OlChemIm Company, Czech Republic)。4 ℃提取3次,收集提取液。提取液经真空浓缩后加入1 mL去离子水,离心取上清,加入含5%乙酸的乙酸乙酯萃取,收集萃取液。萃取液经真空离心干燥机干燥,然后加入10 µL吡啶和40 µL BSTFA,80 ℃反应30 min,加入50 µL正己烷进行质谱分析。
-
为了研究银白杨受干旱胁迫后,干旱响应基因的表达变化,本研究以拟南芥响应干旱胁迫的标记基因AT3G56850(AREB3),AT2G36270(ABI5)和AT5G52300(RD29A/B)序列为模板,对银白杨的基因组(Vision1.0,NCBI数据库BioProject 序列号:PRJNA491245)进行了blastN搜索[12],共鉴定到了PaAREB3(scaffold1203: 615611-617752),PaABI5(scaffold264: 305707-307586),PaRD29(scaffold459: 248079-250269)三条基因。
将在温室中培养5周的银白杨植株进行干旱处理,分别在处理的0、2、4、6、8、10、12 d随机选4棵植株采集其第8片叶和根。使用RNAprep Pure Plant Kit(天根,北京)对采集样品进行总RNA的提取。使用PrimeScriptTM RT reagent Kit(Perfect Real Time)(TakaRa)将总RNA反转录为cDNA。以cDNA为模板,通过RT-qPCR检测PaAREB3、PaABI5、PaRD29的表达量,RT-qPCR引物见表1。相对定量实验分别进行至少三次生物学重复和三次技术重复。
表 1 RT-qPCR检测银白杨干旱响应基因表达量的引物
Table 1. Primers used for the detection of drought-response genes by RT-qPCR
目的基因
Target gene引物名称
Primer name引物序列5’-3’
Primer sequence 5’-3’PaAREB3 PaAREB3-F GCAAACATGATGGGGAGATG PaAREB3-R ACAACAGGACCGCCATC PaABI5 PaABI5-F CTCGTCTCTTGGCAGACAAT PaABI5-R CAGTCCAGATACTGGCAAG PaRD29 PaRD29-F GGATGAAGAAATGGTTGAGG PaRD29-R ATCAGTGCCTGTATGTTCC PaActin PaActin-F GACCTTCAATGTGCCTGCAA PaActin-R CGAAGGATGGCATGTGGAAG -
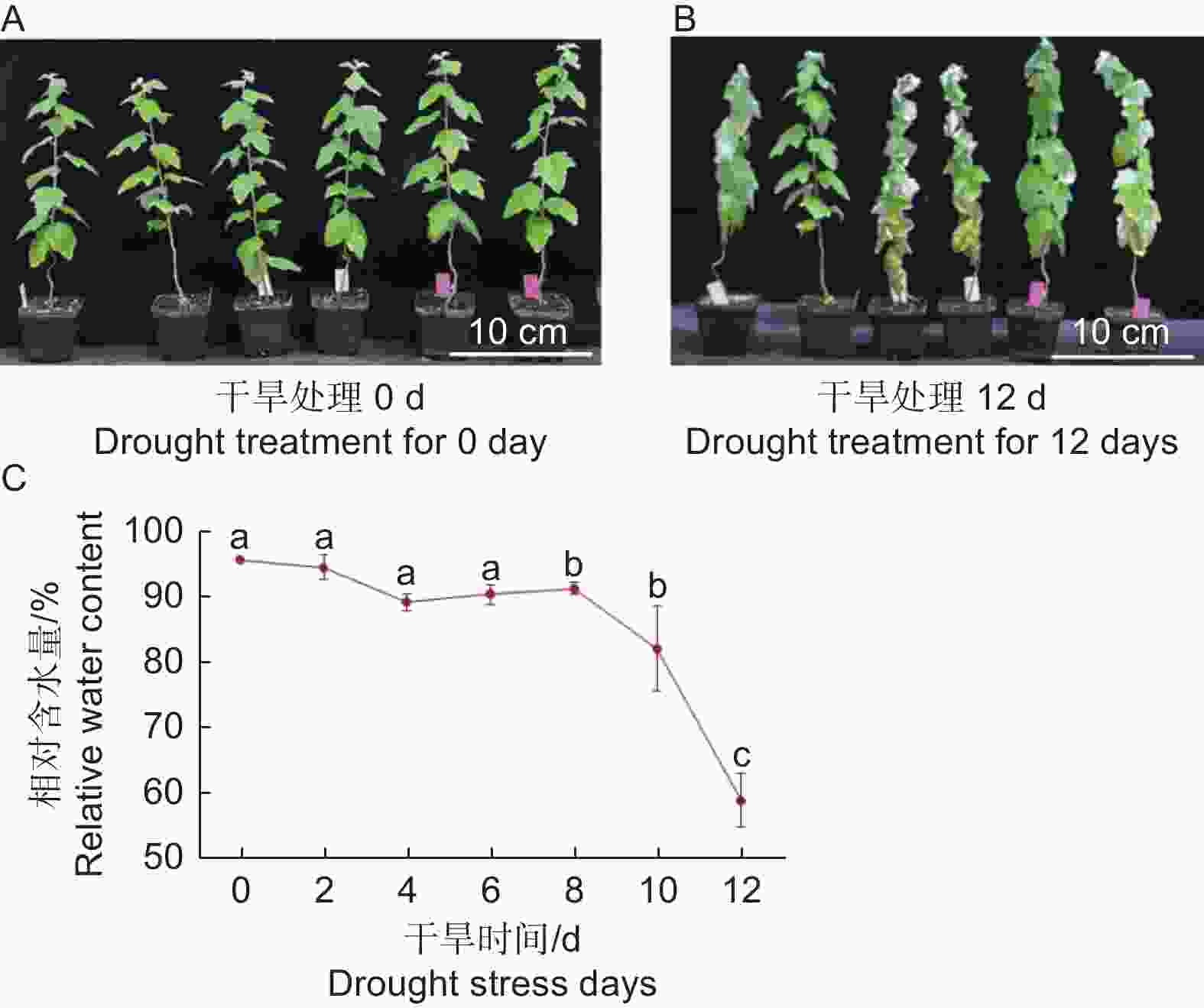
植物叶子是最易受环境影响的器官之一,其功能是进行光合作用合成有机物,通过蒸腾作用,提供根系从外界吸收水和矿物质的动力[13]。为了研究干旱胁迫对银白杨叶片的影响,本文以银白杨为实验材料,发现在土里生长5周左右的银白杨幼苗,干旱处理8 d后出现轻度萎蔫;干旱处理12 d后出现叶片皱缩,叶片发软下垂的现象(图1 A、B)。进一步分析银白杨叶片对干旱敏感表型,从植株顶端第一片叶子开始数,取第5片叶子,进行植物叶片含水量检测,分别在0、2、4、6、8、10、12 d取叶片,计算银白杨叶片相对含水量。实验结果表明,干旱处理后,0~6 d植物叶片含水量比较稳定,在90%以上;但干旱处理第8 d其含水量明显下降;干旱到第12 d,叶片含水量急剧下降至58.87%(图1 C)。说明干旱胁迫来临时,植物叶片失水,造成叶片萎蔫。
-
气孔由一对保卫细胞组成,分布在植物叶片背面[14]。植物感知外界干旱胁迫,通过调节气孔运动对干旱胁迫做出响应。为了了解银白杨在干旱胁迫下气孔开度变化,以生长5周左右的银白杨幼苗为材料,分别在干旱处理0、4、8、12 d取银白杨成熟叶片,并利用扫描电镜观察气孔开度变化,实验结果表明,干旱处理0、4 d气孔处于打开的状态,干旱处理8 d后气孔几乎处于关闭状态,干旱处理12 d后气孔完全关闭(图2)。
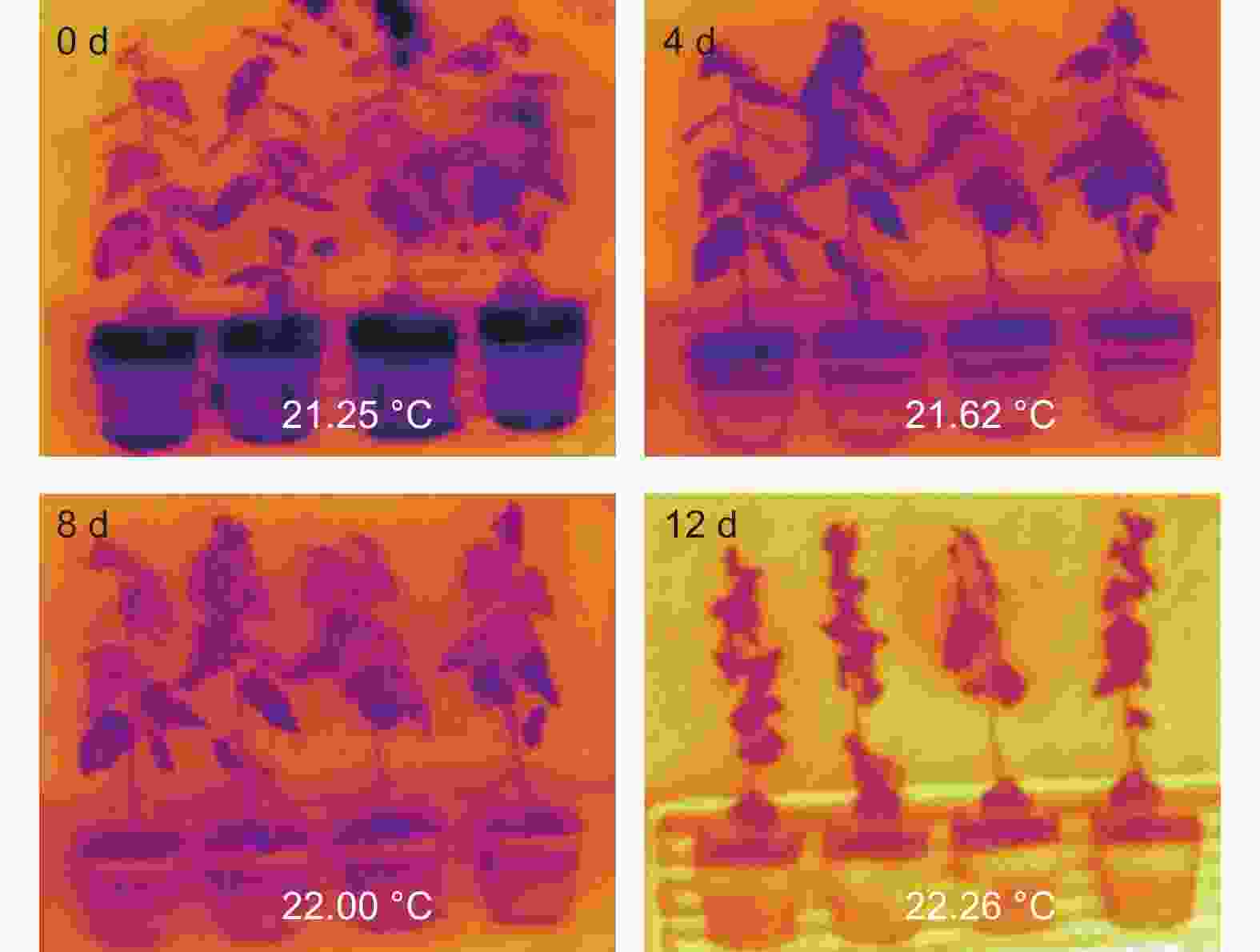
植物蒸腾作用主要通过叶片表面气孔将植物体内水分散失到环境中,水分蒸发会带走植物体内的热量,因此植物叶片表面温度的高低直接反应植物蒸腾作用的强弱,即植物失水速率的快慢。本文利用远红外线检测植物体表面温度的红外相机,拍照记录干旱胁迫下叶片表面温度变化,实验结果表明,随着干旱胁迫处理时间延长,植物叶片表面温度逐渐升高(图3)。说明干旱胁迫下植物通过关闭气孔,减弱蒸腾作用,以降低植物体内水分的过多损耗。
综合以上说明,随着干旱胁迫的加剧,银白杨通过抑制气孔开度抑制蒸腾作用,减少体内水分的流失。
-
活性氧ROS是植物有氧代谢的副产物,干旱胁迫会导致植物产生过量的ROS等次生代谢物。为了研究干旱胁迫对银白杨体内ROS含量的影响,本文检测了干旱处理后银白杨叶片中ROS含量的变化,实验结果显示,干旱处理4 d后,银白杨叶片有少量的ROS,随着处理时间的增长,ROS含量积累变多,干旱处理12 d时ROS有了非常明显的累积(图4 A)。
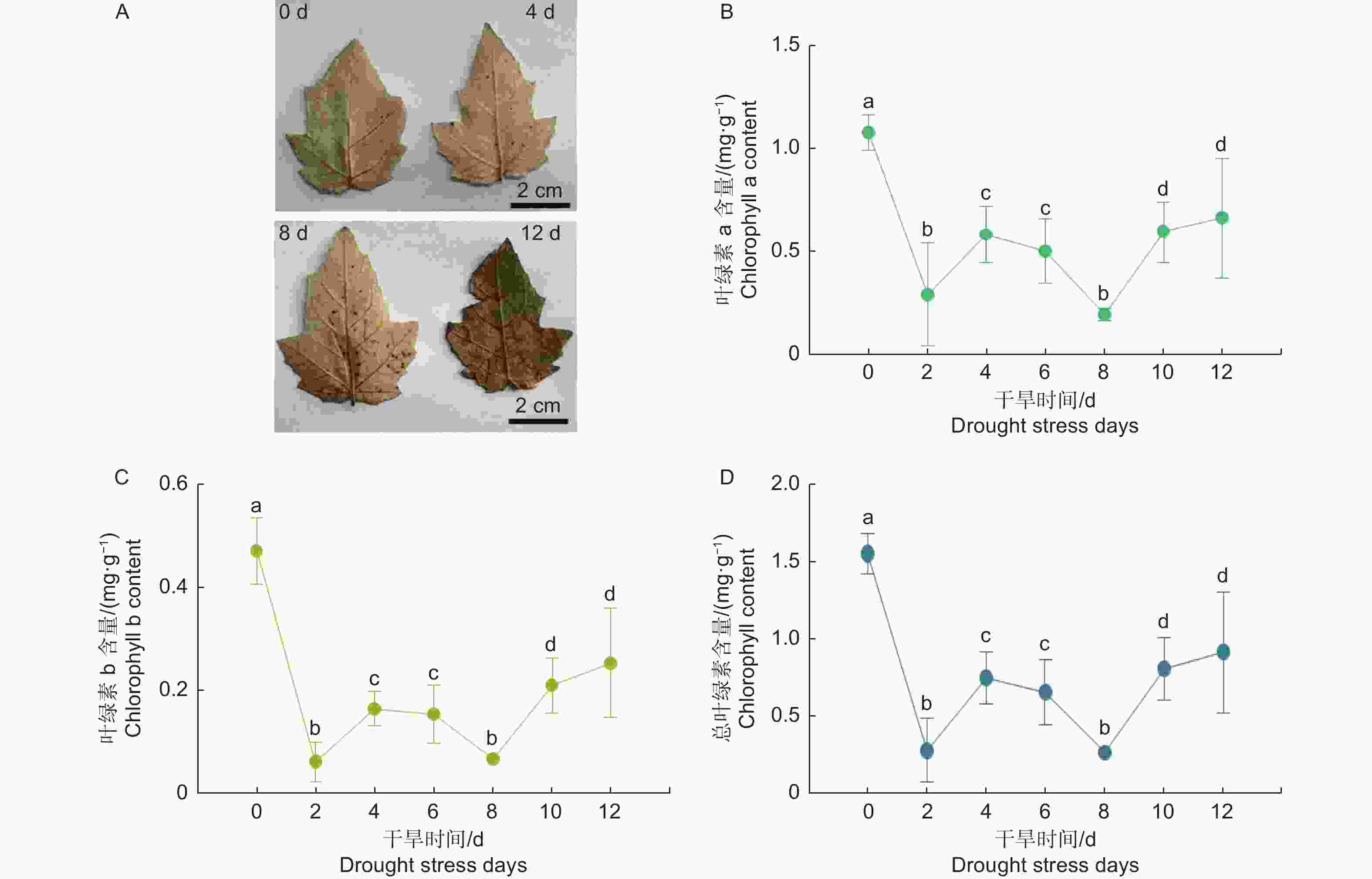
图 4 干旱胁迫对银白杨植株ROS、叶绿素含量的影响
Figure 4. The ROS and chlorophyll content under drought stress in Populus alba
在干旱胁迫下由于ROS的积累会导致膜结构发生变化,从而影响叶绿素含量的变化。叶绿素在光合作用中发挥着重要作用,因此叶绿素含量的测定可以反映植物对干旱胁迫的抵抗能力。为了研究干旱胁迫对银白杨叶绿素含量的影响,本文检测了干旱处理后银白杨叶片中叶绿素含量的变化,实验结果显示,叶绿素a、叶绿素b及总叶绿素含量在干旱处理后迅速下降,在干旱处理第二天下降显著,随后稍有回升,然后继续下降,并在干旱处理第8 d以后叶绿素含量慢慢上升(图4 B~D),这可能是由于干旱处理8 d后叶片含水量下降,导致叶绿素含量相对变高。
-
植物激素对植物生长发育及胁迫响应有重要的调控作用,ABA是干旱胁迫中最重要的激素。为了研究干旱胁迫下,银白杨体内ABA含量的变化。本文检测了不同干旱胁迫条件下银白杨体内的ABA含量。实验结果表明,对银白杨停止浇水后,银白杨体内的ABA含量有先下降后上升的趋势,干旱处理10 d以后ABA含量显著上升(图5 A)。植物通过单个或多种激素共同调控植物的生长、发育和逆境胁迫反应。生长素促进植物的生长,本文同时对干旱胁迫处理后银白杨体内的IAA含量进行检测,发现IAA的含量变化与ABA含量变化呈现相反趋势。对银白杨停止浇水后,前4 d IAA含量明显上升,第6 d以后IAA的含量出现明显下降现象(图5 B)。
-
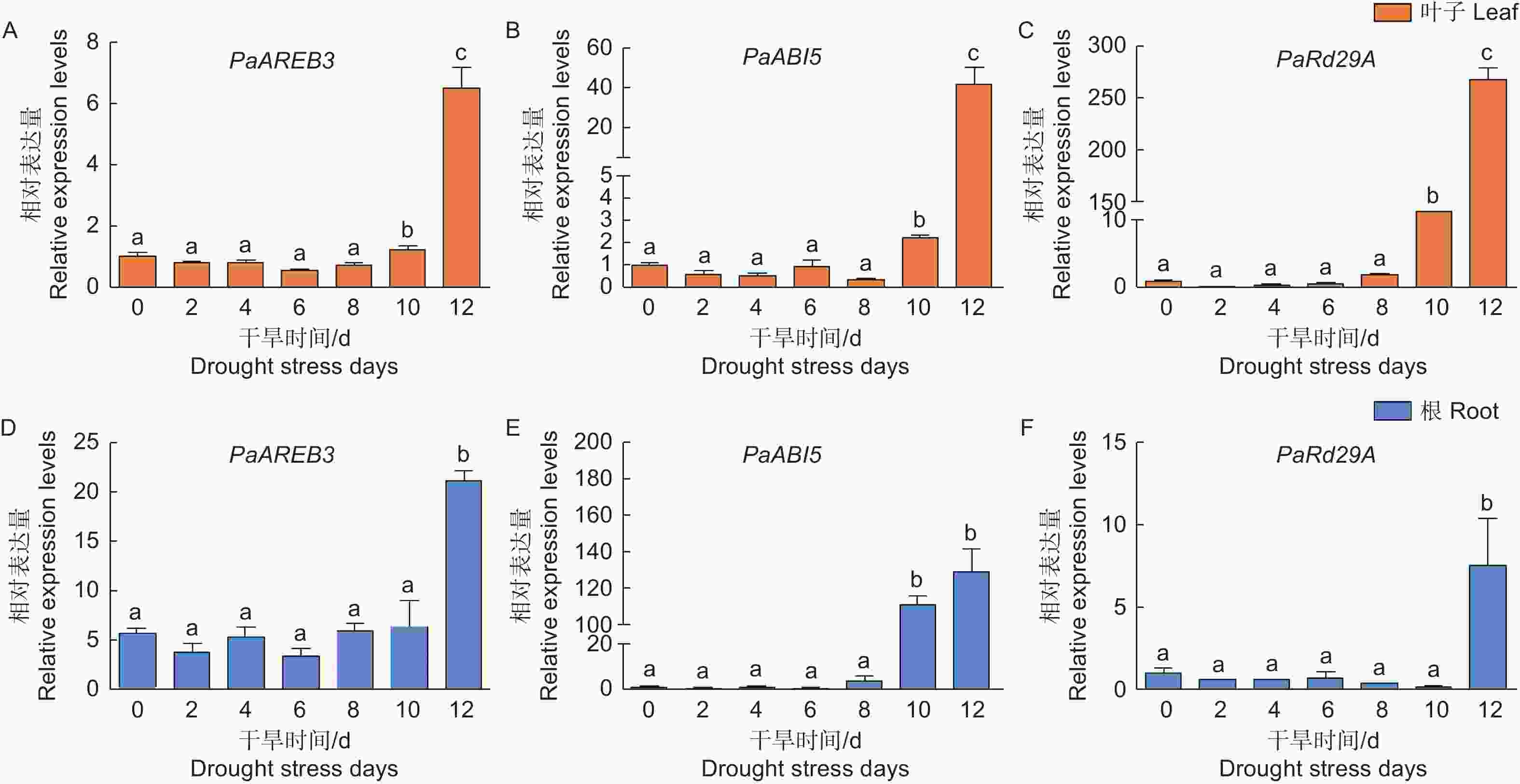
植物通过信号转导和转录调控响应干旱胁迫。为了检测干旱胁迫对银白杨基因表达的影响,本文检测了干旱胁迫响应基因ABI5 (Abscisic acid-insensitive 5)、AREB (ABA-Responsive element binding protein)、Rd29A (Responsive to desiccation 29A)的表达变化,实验结果表明,在银白杨叶片中PaAREB3、PaABI5、PaRd29A在干旱处理的第10 d表达量明显上升(图6 A);在根中除了PaRd29A在第12 d的时候表达量上升,PaAREB3、PaABI5同样在第10 d开始表达量上调(图6 B),综合以上说明植物通过逆境胁迫响应相关基因的表达提高其耐受性。
-
多年生林木生长周期长,因此面临的非生物胁迫更加复杂和频繁。干旱胁迫对植物的影响是多方面的,例如抑制植物生长、光合作用减弱、气孔关闭等。植物感知到胁迫后,通过信号转导途径向下进行干旱胁迫信号传递,位于下游与干旱相关的基因被激活应答干旱胁迫[15]。银白杨产于中国新疆,在西北、西南、东北等地区均有栽培,这些地区属于干旱与半干旱地区,水资源匮乏,因此研究银白杨的耐旱机制具有重要意义。本文发现,干旱胁迫导致银白杨叶片萎蔫、气孔关闭;ROS积累、叶绿素含量降低;ABA含量增加、干旱胁迫响应基因被激活。由于多年生木本植物与一年生植物在其生长周期和生理特性方面具有差异,因此对银白杨干旱胁迫的生理响应研究,可为深入解析林木响应干旱胁迫的分子机制奠定基础。
气孔的开关受到多种因素影响,通过调节细胞膜和液泡膜上的离子通道蛋白、水通道蛋白,改变保卫细胞膨压和体积,促使气孔的开关运动[16-17]。在正常条件下,光诱导植物气孔打开,水分通过气孔蒸发,CO2经过气孔进入植物体内进行光合作用,植物正常生长;气孔打开过程中,首先激活细胞膜上的质膜H + -ATPase蛋白,使细胞膜形成质子梯度,进而刺激细胞膜上的钾离子通道蛋白KAT1、KAT2打开K + 内流,气孔打开;当受到干旱胁迫时,通过激活钾离子和阴离子外排通道,抑制钾离子内排通道,促使植物降低气孔开度,减少蒸腾作用,抑制水分散失,以维持机体最基本的生长[18-19]。本文发现在干旱处理八天后,银白杨叶片含水量明显下降、气孔基本处于关闭状态,虽然此时叶片气孔几乎处于关闭状态,蒸腾作用被极大地抑制,但是银白杨叶片含水量仍然迅速下降,这可能由于根吸水及体内水份运输不足,以及大量水份被用于干旱胁迫响应途径的多种生理生化反应所致。
有研究报道,干旱处理后玉米中叶绿素含量,随着干旱胁迫处理时间的增加呈现先降低后增加的趋势[20];而在有些植物如藤本植物中,干旱胁迫下叶绿素含量会持续下降[21]。说明不同的植物种类其叶绿素对干旱胁迫的响应有所不同。本文干旱胁迫处理银白杨后,叶片中叶绿素含量下降,然后有小幅度的回升,说明体内可能存在某种保护机制在缺水的状态下保护叶绿素稳定性;同时由于气孔开度降低,叶片摄取到的二氧化碳减少,植物为了维持光合作用从而提高叶绿素合成;随着干旱胁迫加剧,叶绿素含量持续下降,8 d后,叶片中ROS的明显积累对叶绿素稳定性造成进一步破坏。之前文章报道也证明,干旱胁迫处理杨树幼苗并检测其光合特性和活性氧代谢,发现在轻度干旱胁迫下杨树幼苗具有较高的光合效率,而随着干旱胁迫的加重,其光合效率降低,抗氧化保护酶系统被破坏[22]。另外,干旱处理8 d后叶绿素含量仍有回升,这可能部分由于叶片鲜质量在8 d后显著降低,导致叶绿素含量相对的升高。
ABA是主要的逆境激素,干旱胁迫下,植物激素ABA被受体蛋白PYL/PYR/RCARs感知并结合,抑制蛋白磷酸酶PP2C的活性,进而PP2C释放对蛋白激酶SnRKs的抑制,被激活的SnRKs磷酸化下游并激活ABA信号,响应干旱胁迫。在干旱胁迫下ABA合成增多并积累,同时其它激素的含量也会发生变化[23]。本文检测干旱胁迫对银白杨叶片中ABA和IAA含量的影响,发现在干旱处理2 d后ABA含量出现持续增长的现象。同时,在干旱胁迫下IAA含量的减少导致银白杨生长被抑制,以减少生长发育的能量消耗,从而将更多的能量提供给干旱胁迫响应途径。ABA与IAA的拮抗作用说明植物生长过程中其发育与抗逆受到精细调控。
干旱胁迫下,植物感受干旱胁迫信号,引起植物渗透压失衡、ROS积累等生理变化,同时诱导ABA合成,ABA作为植物干旱胁迫响应的关键信号,将干旱胁迫信号通过ABA信号通路传递到下游,一方面通过激活质膜上的离子通道蛋白以响应干旱胁迫;另一方面主要通过下游转录调控,将干旱胁迫信号级联放大响应干旱胁迫。已有文章报道,在毛果杨中下调转录因子PtrAREB1会降低其耐旱性[24];在胡杨中PeABF3通过调控ADF5提高其抗旱性[25]。本文在银白杨的叶片和根组织中分别鉴定了下游转录因子AREB3、ABI5及Rd29A等干旱胁迫响应基因的表达,发现这些转录因子主要在干旱处理后8 d被激活;说明在银白杨中存在与其它草本和木本植物相似的干旱胁迫响应机制,但由于目前参与杨树旱胁迫响应的关键基因及分子机制还研究较少,因此未来需要通过分子生物学手段进一步挖掘银白杨旱胁迫响应中的关键组分,为抗旱杨树的基因工程育种提供理论基础和潜在的靶基因。
-
本文对生长约5周的银白杨幼苗进行干旱胁迫处理,通过12 d连续在形态特征、生理指标、激素合成以及基因表达等多个方面检测了干旱胁迫对银白杨生长发育的影响,发现停止浇水后的前6 d植物处于正常生长状态,但是8 d后银白杨幼苗受到显著胁迫,生长受到抑制。建议及时补充水源以保障植物正常生长,本研究为科学培育苗木提供理论指导。
银白杨对干旱胁迫的生理响应研究
The Physiological Response of Populus alba to Drought Stress
-
摘要:
目的 以银白杨为研究对象,探究干旱胁迫对其生长发育的影响,为解析多年生林木响应干旱胁迫的分子机制奠定基础。 方法 对生长在土里5周左右的银白杨幼苗进行干旱胁迫处理,通过观察其生长状态,测定与干旱胁迫相关生理指标以及检测相关基因表达情况,探究银白杨对干旱胁迫的耐受能力。 结果 对银白杨植株进行干旱处理8 d后,其叶片含水量明显下降、气孔开度变小;ROS含量明显上升,体内ABA积累、而与生长相关的IAA含量下降;与干旱胁迫相关的基因表达上调。 结论 通过多角度探究银白杨对干旱胁迫的耐受性,银白杨幼苗在干旱处理8 d后其生长受到显著抑制,建议及时浇水。 Abstract:Objective In this study, Populus alba was used to detect the effect of drought stress on growth and development, which provided reference for the molecular mechanism of the response to drought stress in woody. Method The seedlings of Populus alba about five weeks were treated with drought stress, the growth state and drought stress-related physiological indicators and genes were record and detected to reveal the resistance of Populus alba to drought stress. Result The results showed that the water content of leaves decreased significantly and stomatal aperture became smaller after 8 days of drought treatment; meanwhile ROS increased significantly, ABA accumulated in the body, and the growth-related hormone IAA content decreased, drought stress-related genes were upregulated. Conclusion By detecting the tolerance of Populus alba to drought stress from multiple perspective, the growth of their seedlings is significantly inhibited after drought treatment for 8 days, which indicates that watering timely is necessary. -
Key words:
- drought stress
- / Populus alba
- / physiological indicators
-
表 1 RT-qPCR检测银白杨干旱响应基因表达量的引物
Table 1. Primers used for the detection of drought-response genes by RT-qPCR
目的基因
Target gene引物名称
Primer name引物序列5’-3’
Primer sequence 5’-3’PaAREB3 PaAREB3-F GCAAACATGATGGGGAGATG PaAREB3-R ACAACAGGACCGCCATC PaABI5 PaABI5-F CTCGTCTCTTGGCAGACAAT PaABI5-R CAGTCCAGATACTGGCAAG PaRD29 PaRD29-F GGATGAAGAAATGGTTGAGG PaRD29-R ATCAGTGCCTGTATGTTCC PaActin PaActin-F GACCTTCAATGTGCCTGCAA PaActin-R CGAAGGATGGCATGTGGAAG -
[1] GONG Z Z, XIONG L M, SHI H Z, et al. Plant abiotic stress response and nutrient use efficiency[J]. Science China (Life Sciences), 2020, 63(5): 635-674. doi: 10.1007/s11427-020-1683-x [2] ZHU J K. Abiotic stress signaling and responses in plants[J]. Cell, 2016, 167(2): 313-324. doi: 10.1016/j.cell.2016.08.029 [3] XIONG L M, SCHUMAKER K S, ZHU J K. Cell signaling during cold, drought, and salt stress[J]. The Plant Cell, 2002, 14(Suppl): S165-S183. [4] LUSHCHAK V I. Adaptive response to oxidative stress: bacteria, fungi, plants and animals[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2011, 153(2): 175-190. [5] HUA D P, WANG C, HE J N, et al. A plasma membrane receptor kinase, GHR1, mediates Abscisic Acid- and hydrogen Peroxide-Regulated stomatal movement in Arabidopsis[J]. The Plant Cell, 2012, 24(6): 2546-2561. doi: 10.1105/tpc.112.100107 [6] LI X D, GAO Y Q, WU W H, et al. Two calcium-dependent protein kinases enhance maize drought tolerance by activating anion channel ZmSLAC1 in guard cells[J]. Plant Biotechnology Journal, 2022, 20(1): 143-157. doi: 10.1111/pbi.13701 [7] 尹佟明, 朱其慧, 黄敏仁, 等. 多年生植物模式物种基因组研究的历史及进展[J]. 植物分类学报, 2004, 42(5):464-479. [8] 冯 岩. 略论人工杨树林的栽培史及其资源现状[J]. 农业与技术, 2012, 32(4):44. [9] ZHANG B F, WANG Z W, DAI X F, et al. A COMPASS histone H3K4 trimethyltransferase pentamer transactivates drought tolerance and growth/biomass production in Populus trichocarpa[J]. New Phytologist, 2023 Dec 14. doi: 10.1111/nph.19481. [10] SHEN C, ZHANG Y, LI Q, et al. PdGNC confers drought tolerance by mediating stomatal closure resulting from NO and H2O2 production via the direct regulation of PdHXK1 expression in Populus[J]. New Phytologist, 2021, 230(5): 1868-1882. doi: 10.1111/nph.17301 [11] 曾庆银, 刘妍婧, 姜鹏飞, 等. 一种银白杨遗传转化方法[P]. 中国专利: CN201910967371. X, 2021-01-29. [12] LIU Y J, WANG X R, ZENG Q Y. De novo assembly of white poplar genome and genetic diversity of white poplar population in Irtysh River basin in China[J]. Science China Life Sciences, 2019, 62(5): 609-618. doi: 10.1007/s11427-018-9455-2 [13] 毛 伟, 李玉霖, 张铜会, 等. 不同尺度生态学中植物叶性状研究概述[J]. 中国沙漠, 2012, 32(1):33-41. [14] TORII K U, KANAOKA M M, PILLITTERI L J, et al. Stomatal development[J]. Plant Signaling & Behavior, 2007, 2(4): 311-313. [15] ZHU J K. Salt and drought stress signal transduction in plants[J]. Annual Review of Plant Biology, 2002, 53(1): 247-273. doi: 10.1146/annurev.arplant.53.091401.143329 [16] MEDEIROS D B, DALOSO D M, FERNIE A R, et al. Utilizing systems biology to unravel stomatal function and the hierarchies underpinning its control[J]. Plant, Cell & Environment, 2015, 38(8): 1457-1470. [17] NOVAK C A. Closing the gaps: rolling doors that meet mandatory ASHRAE 90.1 standards[J]. Architectural Record, 2016, 204(5): 248-249. [18] Kim TH, Bohmer M, Hu H, et al. Guard cells signal transduction network: advances in understanding abscisic acid CO2, and Ca2+ signaling[J]. Annual Review of Plant Biology, 2010, 61: 561-591. doi: 10.1146/annurev-arplant-042809-112226 [19] Qi J, Song CP, Wang B, et al. Reactive oxygen species signaling and stomatal movement in plant responses to drought stress and pathogen attack[J]. Journal of Integrative Plant Biology, 2018, 60(9): 805-826. doi: 10.1111/jipb.12654 [20] 刘乔斐, 周自云, 杜妮妮. 干旱胁迫与复水对苗期玉米光合特性的影响[J]. 农业工程, 2021, 11(11):112-120. doi: 10.3969/j.issn.2095-1795.2021.11.024 [21] 邓沛怡, 周杰良, 陶抵辉, 等. 干旱胁迫对6种藤本植物光合作用及叶绿素荧光参数的影响[J]. 湖南农业大学学报(自然科学版), 2015, 41(3):263-270. [22] 井大炜, 邢尚军, 杜振宇, 等. 干旱胁迫对杨树幼苗生长, 光合特性及活性氧代谢的影响[J]. 应用生态学报, 2013, 24(7):1809-1816. [23] KLINGLER J P, BATELLI G, ZHU J K. ABA receptors: The START of a new paradigm in phytohormone signalling[J]. Journal of Experimental Botany, 2010, 61(12): 3199-3210. doi: 10.1093/jxb/erq151 [24] YU D D, WILDHAGEN H, TYLEWICZ S, et al. Abscisic acid signaling mediates biomass trade-off and allocation in poplar[J]. New Phytologist, 2019, 223(3): 1192-1203. doi: 10.1111/nph.15878 [25] Yang Y L, Li H G, Wang J, et al. ABF3 enhances drought tolerance via promoting ABA-induced stomatal closure by directly regulating ADF5 in Populus euphratica[J]. Journal of Experimental Botany, 2020, 71(22): 7270-7285. doi: 10.1093/jxb/eraa383 -




 下载:
下载: