-
毛竹(Phyllostachys edulis (Carr.) H. de Lehaie)是我国分布最广、面积最大和经济价值最高的竹种。第八次全国森林资源清查(2009—2013年)数据表明,我国竹林面积达601万hm2,其中毛竹林面积为443万hm2,占竹林总面积的73%,并且毛竹林面积还将继续增加[1-2]。毛竹具有生长速度快、经济效益好等优点,是山区农民的重要收入来源。为了获得更大的经济效益,近年来大面积马尾松(Pinus massoniana Lamb.)林以及杉木(Cunninghamia lanceolata (Lamb.) Hook.)林等被毛竹林所替代。然而,已有研究表明,天然林受到毛竹入侵或人为改造成毛竹林后,毛竹易形成单优群落,导致生物多样性明显下降[3-4]。同时,毛竹叶能释放化感物质抑制林下植被的生长,引起植物群落结构及物种多样性的改变[5]。近年来,毛竹林生物多样性降低、生产力下降等现象开始引起人们的广泛关注。
土壤微生物是土壤养分循环的核心驱动力,在土壤形成和发育过程以及维护土壤生态系统稳定性方面发挥着至关重要的作用[6]。地上植被对土壤微生物群落结构形成起着至关重要的作用[7],植物种类改变会引起凋落物种类、根系分泌物以及养分吸收特性等方面的改变,从而导致土壤物理、化学和生物学性质发生改变[8-9]。Chang等[10]研究表明,毛竹入侵日本柳杉(Cryptomeria japonica (L. f.) D. Don)林后显著改变了土壤微生物活性及群落结构。徐秋芳等[11]对比了马尾松林和毛竹林土壤微生物特性,发现马尾松林土壤微生物量较高,多样性更为丰富;而孙棣棣等[12]发现天然马尾松林改种毛竹林后,土壤微生物量和多样性变化不大,但微生物群落结构发生了变化。目前,关于马尾松林改造成毛竹林以及长期粗放经营后毛竹林土壤微生物量及群落结构的演变趋势的研究结果尚不统一,而导致土壤微生物群落发生改变的关键控制因子也并不清楚,开展长期粗放经营毛竹林土壤微生物群落演变趋势及其控制因素的研究,有助于深入了解土壤微生物群落对环境因子的响应机理,对于保护森林生态系统稳定性具有重要意义。
本研究在浙江安吉选取4个不同粗放经营年限的毛竹林,同时选取附近的马尾松林作为对照,通过分析土壤微生物生物量及群落结构的演变趋势,筛选影响土壤微生物群落的关键环境因子,揭示土壤微生物群落对毛竹林长期粗放经营的响应机理,为评估毛竹林生态系统稳定性,促进毛竹林可持续发展提供理论依据。
-
试验样地位于浙江省湖州市安吉县(30°52′~30°23′ N,119°53′~119°14′ E),该地属于北亚热带季风气候,年平均气温15℃,年均降水量1 485 mm。当地主要林分为马尾松林和毛竹林,均生长于低山丘陵地貌,土壤母质为粉砂和细砂混合岩。于2013年10月对当地毛竹林开展调研,根据农户调查结果,选择的毛竹林均由马尾松林演变而来且均实施粗放经营,土壤类型和母质一致,坡度、坡向以及海拔等地形条件基本相同,但是竹林改造年限不同。马尾松林盖度为50%左右,下层木主要有木荷(Schima superba Gardn. et Champ.)、青冈(Cyclobalanopsis glauca (Thunb.) Oerst.)、檵木(Loropetallum chinense (R. Br.) Oliver)、山鸡椒(Litsea cubeba (Lour.) Pers.)、连蕊茶(Camellia cuspidate (Kochs) Bean)、映山红(Rhododendron simsii Planch.)等树种,草本层主要为蕨类植物。毛竹林盖度为90%左右,下层木主要有油茶(Camellia oleifera Abel.)、山鸡椒,草本层以蕨类植物为主。实施粗放经营的毛竹林在生长期中保留林下灌木和杂草,每2 a砍伐一次,没有受到钩梢、施肥、垦覆等人为培育措施干扰。
-
选取粗放经营时间为5 a、9 a、15 a和18 a(营造年份分别为2008、2004、1998、1995年)的毛竹林,同时选择毛竹林附近立地条件相似的马尾松(Masson pine, MP)林作为对照,共计5个林地。分别在每个林地选取10 m×10 m标准样地3个,共计15个标准样地。每个标准样地按一定距离设置5个采样点,去除表层落叶及大的石块等杂物后采集0~20 cm土壤样品,将5份土壤样品混合,四分法去除部分土壤,剩余土壤装入自封袋置于冰盒带回实验室。土壤样品混匀后过2 mm筛,一部分土样先测定含水量,剩余土样风干后用于土壤理化性质分析,一部分新鲜土样立即提取和测定土壤磷脂脂肪酸。
-
土壤含水量及理化性质等参照鲁如坤等[13]方法进行。其中,土壤含水量采用烘干法,新鲜土样装入铝盒后于105℃烘干至恒质量,称质量;土壤pH值测定采用1∶2.5土水比,用复合电极测定;有机质(Organic matter, OM)含量采用重铬酸钾-硫酸外加热法测定;碱解氮(Alkalytic nitrogen, AN)采用碱解扩散-硼酸吸收法测定;有效磷(Available phosphorus, AP)采用盐酸-氟化铵提取,钼锑抗比色法测定;速效钾(Available potassium, AK)采用醋酸铵提取,火焰光度计测定。
-
土壤磷脂脂肪酸(Phospholipid fatty acids, PLFA)分析参照Frostegard等[14]方法,并在此基础上进行改进[15]。主要步骤如下:(1)称取3.00 g冷冻干燥的土样,加入3.2 mL柠檬酸缓冲液、4 mL氯仿和8 mL甲醇,充分漩涡振荡。避光条件下摇床振荡2 h,3 000 rpm条件下离心10 min。转移上清液后重复提取一次。混合好的上清液振荡均匀,隔夜静置后小心转移下层氯仿相,用氮气吹干。(2)准备好SPE柱(Supelco Inc., Bellefonte, PA, USA),8 mL氯仿洗柱后用氯仿溶解样品,并全部转移到SPE柱中,使样品在柱中停留8 min。依次加入氯仿和丙酮洗中性脂和糖脂。然后用甲醇洗磷脂,小号试管收集。收集物用氮气吹干,加200 μL内标,涡旋后再氮气吹干。(3)加1 mL甲醇甲苯混合液(甲醇:甲苯=1:1),溶解磷脂,再加1 mL 0.2 mol·L-1的氢氧化钾甲醇溶液,37℃水浴15 min后,加入2 mL正己烷氯仿混合液(正己烷:氯仿=4:1)、0.3 mL 1 mol·L-1的醋酸、2 mL去离子水振荡分离10 min,在3 000 rpm条件下离心5 min,转移上层有机相到小号试管中。重复提取一次,合并有机相,氮气吹干。(4)-20℃冷冻保存,在上机测定前用150 μL正己烷溶解。采用安捷伦6890N气相色谱仪(Agilent Technologies Inc., USA)对提取的磷脂脂肪酸进行测定,MIDI Sherlocks微生物鉴定系统(MIDI, Inc., Newark, DE)进行磷脂脂肪酸鉴定。
脂肪酸命名采用Petersen等[16]方法。所有检测到的脂肪酸总量为土壤总磷脂脂肪酸含量。根据以往文献的分类方法,对磷脂脂肪酸进行分类[17-18]。其中,14:0、15:0、16:0、17:0、i15:0、a15:0、i16:0、i17:0、a17:0、cy17:0、cy19:0、16:1ω7c、17:1ω8c、18:1ω5c、18:1ω7c以及19:0ω8c代表细菌;i14:0、i15:0、a15:0、i16:0、i17:0以及a17:0代表革兰氏阳性细菌;cy17:0、16:1ω7c、18:1ω5c、18:1ω7c、17:1ω8c以及19:0ω8c代表革兰氏阴性细菌;10Me16:0、10Me17:0以及10Me18:0代表放线菌;16:1ω5c、18:1ω9c、18:2ω6, 9c代表真菌;20:0代表原生动物。
-
采用SPSS 18.0统计软件进行数据处理,Duncan单因素方差分析比较各处理之间的差异显著性(P<0.05);逐步回归分析找出对土壤PLFA含量影响最显著的土壤理化因子(解释变量集)。采用R语言Vegan包计算不同处理土壤微生物群落丰富度、Shannon多样性指数等;对不同处理土壤微生物群落进行非度量多维尺度转换排序(non-metric multidimensional scaling, NMDS)分析,并通过相似性检验(Analysis of similarities, ANOSIM)测试不同群落之间的差异显著性(P<0.05)。使用CANOCO 4.5软件(Microcomputer Power, Ithaca, USA)对PLFA揭示的土壤微生物群落结构与环境参数进行典范对应分析(Canonical correspondence analysis, CCA),手动前向选择环境因子,采用999次的蒙特卡罗排列检验(MonteCarlo permutation test 999 permutations, full model)进行显著性检验。
-
研究结果表明,毛竹林土壤含水量均显著低于马尾松林(P<0.05),其中18 a毛竹林土壤水分含量最低(表 1)。毛竹林在粗放经营初期,土壤pH值呈现出逐渐升高的趋势,9 a毛竹林土壤pH值显著高于天然马尾松林和其它年份毛竹林(P<0.05),但长期粗放经营后土壤pH值又逐渐下降,18 a毛竹林与马尾松林没有显著差异。在改种毛竹的初始几年,土壤有机质、有效磷、速效钾等含量迅速增长,5 a毛竹林土壤有机质、有效磷、速效钾含量均显著高于马尾松林(P<0.05),但随着粗放经营年限的延长土壤有机质及碱解氮及有效磷又呈现出下降趋势,其中18 a毛竹林土壤有机质含量显著低于马尾松林(P<0.05)。与其它养分不同的是,随着粗放经营年限的延长,土壤碱解氮含量呈现出下降趋势,18 a毛竹林土壤碱解氮含量显著低于马尾松林(P<0.05)。
表 1 不同粗放经营年限毛竹林土壤理化性质
Table 1. Soil physic-chemical properties under bamboo stands with different culture histories
处理
Treatment含水量
Soil Moisture/%pH
(H2O)有机质
Organic matter/(g·kg-1)碱解氮
Alkalytic N/(mg·kg-1)有效磷
Available P/(mg·kg-11)速效钾
Available K/(mg·kg-1)MP 23.71±0.60a 4.51±0.05c 43.28±2.18b 115.21±21.88a 0.64±0.15b 40.0±7.2b 5a 18.91±1.45b 4.61±0.08bc 57.84±1.60a 102.20±3.9ab 1.97±0.41a 67.0±8.2a 9a 20.42±1.00b 4.88±0.15a 35.75±1.25bc 93.12±3.7ab 1.95±0.43a 41.0±5.0b 15a 19.08±1.99b 4.71±0.12b 41.87±2.13bc 93.95±20.4ab 1.49±0.85ab 45.7±3.2b 18a 15.51±2.13c 4.63±0.06bc 35.01±4.22c 70.15±5.1b 1.23±0.25ab 44.7±5.9b 注: 数据为3个重复的平均值及标准差(mean±SD);同列中不同字母表示处理间差异达5%显著水平。MP表示马尾松林;5 a、9 a、15 a、18 a表示毛竹林粗放经营年限为5年、9年、15年、18年。下同。
Note: The data in the table are the means of 3 replicates and the standard error (mean±SD). Different letters in the same column indicate significant difference at 5% level. MP indicates masson pine. 5 a、9 a、15 a、18 a indicate moso bamboo stands with 5, 9, 15, 18 years of extensive management age, respectively. The same below. -
利用PLFA分析方法表征不同样地土壤微生物生物量及其群落,结果表明,马尾松林土壤微生物总PLFA含量以及细菌、真菌、放线菌等PLFA含量均显著高于毛竹林(P<0.05),而不同粗放经营年限毛竹林土壤总PLFA含量之间没有显著差异(表 2)。对于细菌,革兰氏阳性细菌PLFA含量变化趋势与总细菌相同,而15 a毛竹林土壤革兰氏阴性细菌PLFA含量与马尾松林没有显著差异。
表 2 不同粗放经营年限毛竹林土壤PLFA含量
Table 2. Soil PLFA contents under bamboo stands with different culture histories
nmol·g-1 处理
Treatment总PLFA
Total PLFA细菌
Bacteria革兰氏阳性细菌
G+ bacteria革兰氏阴性细菌
G- bacteria真菌
Fungi放线菌
Actinomycete原生动物
ProtozaMP 113.01±19.98a 63.97±13.92a 24.65±4.76a 22.55±5.84a 8.69±2.09a 11.28±4.74a 0.53±0.14a 5a 48.05±16.60b 28.74±10.20b 9.81±3.34b 11.30±4.49b 4.53±1.77b 5.75±1.96b 0.24±0.05b 9a 43.74±11.67b 26.86±7.48b 9.42±2.80b 10.53±2.91b 3.93±1.03b 4.30±2.21b 0.31±0.18b 15a 58.82±15.49b 34.87±9.72b 12.63±3.47b 16.10±5.01ab 5.36±1.29b 6.50±1.34b 0.25±0.04b 18a 46.61±4.28b 25.56±2.45b 9.53±0.60b 9.98±1.10b 5.14±0.55b 5.57±0.52b 0.26±0.04b 将土壤微生物总PLFA含量作为因变量,土壤理化性质作为自变量,进行逐步回归分析,以揭示对不同种类微生物PLFA含量影响最显著的一组变量(表 3)。结果表明,引入的变量中,碱解氮和有效磷对土壤总PLFA含量以及细菌(包括革兰氏阳性和阴性细菌)、真菌、原生动物PLFA含量等影响显著,均达到1%极显著水平(P<0.01)。对于真菌PLFA含量的影响,有效磷的贡献大于碱解氮。与土壤微生物总PLFA含量以及其它类群微生物相比,土壤放线菌PLFA含量主要受碱解氮、土壤pH以及有机质含量这组变量影响,同样达到极显著水平(P<0.01)。
表 3 逐步回归分析
Table 3. Stepwise regression analysis
因变量
Dependence自变量
IndependenceF值
F value显著性
Significance总Total AN, AP 26.703 0.000 细菌Bacteria AN, AP 26.348 0.000 真菌Fungi AP, AN 13.043 0.001 放线菌Actinomycete AN, pH, OM 44.152 0.000 原生动物Protoza AN, AP 8.672 0.005 G-细菌G- bacteria AN, AP 17.134 0.000 G+细菌G+ bacteria AN, AP 23.552 0.000 注:AN、AP、OM分别为碱解氮、有效磷和土壤有机质。
Note: AN, AP, and OM indicate alkalytic N, available P and soil organic matter, respectively. -
马尾松改种毛竹后,在短期内土壤微生物物种丰富度没有发生明显变化,但是在长期尺度上有下降的趋势,15 a和18 a毛竹林土壤微生物物种丰富度显著低于马尾松林以及5 a和9 a毛竹林(P<0.05),Shannon多样性指数也有相似的变化趋势(表 4)。所有毛竹林土壤微生物群落Simpson多样性指数均显著低于马尾松林(P<0.05)。与Shannon多样性指数及Simpson多样性指数相反,长期粗放经营毛竹林土壤微生物群落Shannon均匀度及Simpson均匀度呈现出先下降再逐渐升高的趋势,15 a和18 a毛竹林均显著高于5 a及9 a毛竹林(P<0.05),其中18 a毛竹林Shannon均匀度和Simpson均匀度显著高于对照马尾松林(P<0.05)。
表 4 土壤微生物多样性指数
Table 4. Soil microbial diversity indexes
处理
Treatment物种丰富度
RichnessShannon多样性
Shannon diversitySimpson多样性
Simpson diversityShannon均匀度
Shannon evenessSimpson均匀度
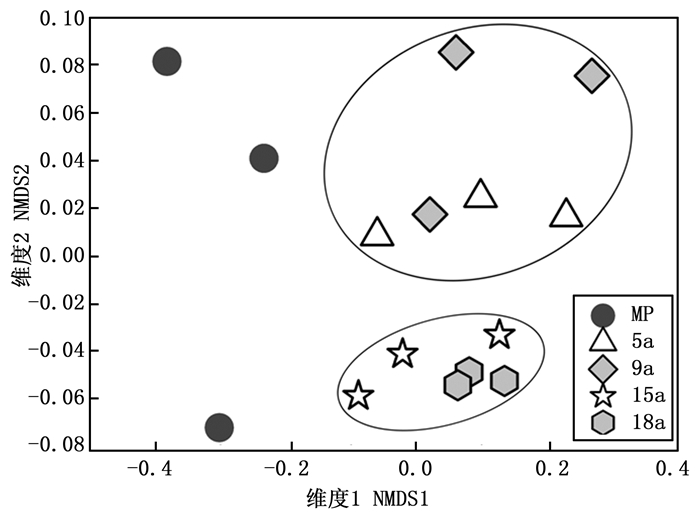
Simpson evenessMP 45±6.81a 23.55±2.16a 17.03±1.65a 0.53±0.05bc 0.38±0.05bc 5a 44±6.66a 21.39±0.90ab 15.09±0.59b 0.49±0.07c 0.35±0.06c 9a 47±1.00a 21.36±1.12ab 14.72±0.74b 0.45±0.03c 0.31±0.02c 15a 35±3.21b 20.60±0.71b 15.17±0.34b 0.60±0.04ab 0.44±0.04ab 18a 32±0.58b 20.00±0.25b 15.28±0.54b 0.63±0.02a 0.48±0.03a 对马尾松林以及不同粗放经营年限毛竹林土壤微生物群落进行NMDS分析(图 1),马尾松林与毛竹林土壤微生物群落在NMDS第1排序轴上有明显的区分,而不同粗放经营年限毛竹林土壤微生物群落之间也存在差异,5 a、9 a毛竹林与15 a和18 a毛竹林在第2排序轴上区分明显。相似性检验结果表明,各处理土壤微生物群落之间存在显著差异(R=0.388 1, P=0.009)。典范对应分析结果表明,土壤含水量(F=5.401, P=0.001)、有效磷(F=2.494, P=0.022)、碱解氮(F=3.150, P=0.036)以及pH值(F=2.046, P=0.062)对土壤微生物群落结构的变异具有重要影响,合计解释了90.28%的变异量(图 2),其中土壤含水量、有效磷及碱解氮含量对土壤微生物群落结构变异影响显著(P<0.05)。
-
土壤微生物生物量及群落结构是土壤质量的敏感指标,其易受土壤质地、pH值、温度、水分以及养分状况等的影响,而人为干扰如改变土地利用方式、施肥、翻耕等经营措施等对土壤微生物影响尤为剧烈,从而影响土壤生态系统功能稳定性[19]。本研究结果表明,毛竹林土壤无论是微生物总PLFA含量还是细菌、真菌、放线菌等PLFA含量,均显著低于天然马尾松林(P<0.05)。地上植被群落、林龄、林分中温度、湿度以及凋落物现存量等都可能会对土壤微生物量产生较大影响[20]。McDaniel等[21]发现作物多样性增加明显提高了土壤微生物量碳、氮。在调查中作者发现天然马尾松林植被多样性比较丰富,林下有1~2 cm的凋落物层,而毛竹林植被单一,林下下只有少量杂灌。同时,由于毛竹每年产生的竹叶凋落物较少,加之竹叶较易分解,因此马尾松林改造为毛竹林后,土壤有机质也有逐渐降低的趋势。已有研究表明,土壤微生物量与有机碳含量呈正相关关系[22],土壤有机碳含量的降低是导致毛竹林土壤微生物量降低的可能因素之一。
逐步回归分析结果表明,除放线菌外,土壤微生物总PLFA含量以及各微生物种群PLFA含量受土壤碱解氮和有效磷影响显著。王卫霞等[23]发现,在岷江干旱河谷造林过程中,随着土壤氮含量的增加,土壤总PLFA含量、细菌、真菌、放线菌等PLFA含量均随着增加,且与土壤全氮呈显著正相关,这与本试验结果一致。施瑶等[24]研究了氮磷添加对内蒙古典型温带草原土壤微生物群落的影响,发现随着氮添加量的增加,土壤总PLFA含量以及细菌、放线菌等PLFA含量均显著增加。尽管本研究中并没有任何施肥措施,但之前大量研究表明,在一些氮含量缺乏的森林土壤中,氮素有效性是控制土壤微生物量的重要因子[25]。在磷限制条件下,如果土壤有效磷含量增加,能显著提高土壤微生物生物量[26]。尽管马尾松林改造成毛竹林后土壤有效磷含量均显著增加,但总体处于较低水平,考虑到在毛竹生长过程中大量吸收氮素养分,土壤碱解氮含量下降幅度较磷素养分更为剧烈,因此作者推测在该土壤母质条件下,土壤有效氮素含量应该是控制微生物量的一个关键因子。与其它微生物种群不同,土壤放线菌PLFA含量不仅受土壤碱解氮影响,其还受到土壤pH值及有机碳含量影响,这可能是由于毛竹林下凋落物较马尾松林少,从而导致依赖于分解土壤中植物凋落物中某些难分解组分的放线菌数量降低[27]。
植被群落的改变会导致森林生态系统改变,从而直接影响土壤理化性质以及微生物群落[8-10]。与马尾松林相比,毛竹林土壤微生物群落Shannon多样性指数和Simpson多样性指数逐渐下降,而长期粗放经营毛竹后土壤微生物群落Shannon多样性指数和Simpson多样性指数均显著低于马尾松林,说明地上植被群落多样性减少影响了土壤微生物群落。植被群落改变后,由于不同的植物种类其凋落物性质、根系分泌物以及养分吸收特性不同[7-9],如本研究区域中马尾松林地上植被群落多样性较丰富,而演变成毛竹林后,凋落物及根系分泌物主要来自于单一的毛竹,加之毛竹的养分吸收特性与普通乔灌木品种迥异,从而造成在长期时间尺度上土壤微生物群落多样性指数显著下降。与短期粗放经营毛竹林(5 a、9 a)相比,长期粗放经营毛竹林(15 a、18 a)土壤微生物丰富度以及基于Shannon多样性指数和Simpson多样性指数计算的均匀度指数均显著降低(P<0.05)。有研究表明,当群落中物种发生变化时,Simpson多样性指数对于富集种更加敏感,而Shannon多样性指数对于稀疏种更加敏感[27]。作者推测在毛竹林经营过程中,由于地上植被逐渐发生改变,导致土壤有机质来源发生变化,一些稀疏种和富集种随之发生改变,最终演变形成了适应毛竹纯林有机质输入特点(丰富的毛竹根系分泌物以及竹叶凋落物)的稳定的土壤微生物群落。
土壤微生物群落结构的改变也部分验证了作者以上推测,马尾松林与短期粗放经营(5 a、9 a)和长期粗放经营(15 a、18 a)毛竹林土壤微生物群落结构差异显著。Chang等[10]利用PLFA方法研究了毛竹入侵日本柳杉林对土壤微生物群落结构的影响,发现毛竹入侵后土壤微生物群落结构发生了显著的改变;Lin等[28]发现毛竹纯林以及毛竹入侵杉木林后的混交林其土壤微生物群落比较类似,但显著区别于杉木纯林。研究表明毛竹具有强烈的化感作用,其本身也有抗菌活性[29],可以降低土壤微生物生物量并改变土壤微生物群落。这些已有的研究很好地解释了本研究结果,说明毛竹林替代马尾松林以及长期粗放经营对土壤微生物群落结构产生了重要影响。本研究发现,土壤含水量、碱解氮及有效磷含量对微生物群落结构改变具有显著的贡献。土壤水分含量是微生物群落活性的重要控制因素[30]。Brockett等[31]同样利用PLFA方法研究了加拿大西部七个不同生物地理气候区土壤微生物群落,发现土壤含水量是影响土壤微生物群落结构以及酶活性的主要驱动因子;Morris等[32]发现土壤细菌和真菌生物量随土壤含水量梯度变化显著。由此作者推测,马尾松林改造为毛竹林后,由于地表植被和凋落物层明显减少,导致土壤水分含量随之减少,从而对土壤微生物群落,特别是细菌和真菌群落产生重要影响。由于毛竹的生长特性,导致林下灌木杂草等难以生长,降低了地上植物群落多样性,从而影响土壤微生物群落和养分循环过程。基于本研究结果,作者建议适当加大粗放经营毛竹林砍伐强度,创造有利于下层灌木和杂草生长的环境,从而提高植物多样性和增加土壤有机质输入,提高土壤微生物多样性和养分有效性,保障竹林可持续发展。
-
(1) 长期粗放经营毛竹林土壤微生物总PLFA含量以及细菌、真菌、放线菌、原生动物等PLFA含量均显著低于马尾松林,土壤微生物量变化主要受碱解氮和有效磷含量变化影响。
(2) 与马尾松林相比,长期粗放经营毛竹林土壤微生物群落多样性指数均显著下降,群落结构变化显著。
(3) 毛竹林长期粗放经营后导致的土壤含水量、碱解氮、有效磷含量变化是土壤微生物群落结构变异的主要贡献因子。
长期粗放经营毛竹林土壤微生物群落演变特征
Variation Patterns of Soil Microbial Community of Phyllostachys edulis Stands under Long-term Extensive Management
-
摘要:
目的 通过分析土壤微生物生物量及群落结构的演变趋势,筛选影响土壤微生物群落的关键环境因子,揭示土壤微生物群落对毛竹林长期粗放经营的响应机理。 方法 选取不同粗放经营年限(5 a、9 a、15 a、18 a)毛竹林,以天然马尾松林(Masson pine,MP)作为对照,采用磷脂脂肪酸(Phospholipid fatty acids,PLFA)分析方法表征土壤微生物量及群落结构。 结果 结果表明,毛竹林土壤微生物总PLFA含量以及细菌、真菌、放线菌等PLFA含量均显著低于马尾松林(P<0.05),但不同经营年限毛竹林之间没有显著差异。土壤碱解氮及有效磷含量对土壤微生物总PLFA含量以及细菌、真菌、原生动物等PLFA含量影响显著(P<0.05),而土壤碱解氮、pH值以及有机质含量对放线菌PLFA含量影响显著(P<0.05)。长期粗放经营过程中毛竹林土壤微生物丰富度及多样性均呈逐渐下降趋势。非度量多维尺度转换排序(Non-metric multidimensional scaling,NMDS)分析结果表明,毛竹林土壤微生物群落结构与马尾松林有明显区分(R=0.388 1,P=0.009)。土壤含水量、碱解氮、有效磷以及pH值合计解释了90.28%的微生物群落结构变异量,其中土壤含水量、碱解氮、有效磷贡献显著(P<0.05)。 结论 长期粗放经营降低了毛竹林土壤微生物量,改变了群落结构,其生态风险还有待于进一步评估。 Abstract:Objective To investigate the effect of long-term extensive management on soil microbial communities and the related mechanisms. Method Moso bamboo (Phyllostachys edulis) stands with different extensive management time (5, 9, 15, and 18 years) were selected and compared with natural masson pine forest (Pinus massoniana Lamb.) as control. The phospholipid fatty acids (PLFA) were analyzed to indicate the soil microbial biomass and community composition. Result Results showed that the total soil microbial PLFA contents as well as bacterial, fungal, actinomycic and protozoal PLFA contents under moso bamboo stands were all significant lower than that of masson pine forest (P < 0.05), while no significant difference was found among bamboo stands. The total PLFA contents of soil microbial community as well as bacterial, fungal and protozoal PLFA contents were all significantly correlated with soil alkalytic nitrogen (AN) and available phosphorus (AP) contents (P < 0.05), while the actinomycic PLFA content correlated with AN, organic matter contents and pH significantly (P < 0.05). Soil microbial diversity, i.e. richness, Shannon diversity and Simpson diversity indexes, decreased progressively with the extensive management time of moso bamboo. According to the results of non-metric multidimensional scaling (NMDS), the soil microbial communities under moso bamboo and masson pine forest were significantly different (R=0.388 1, P=0.009). Furthermore, the soil microbial communities were different between the moso bamboo stands with short-term (5a, 9a) and long-term (15a, 18a) extensive management. The soil moisture, AN, AP and pH explained 90.28% of the total microbial community variation, among which the soil moisture, AN and AP contributed significantly to the microbial community variation (P < 0.05). Conclusion The results indicate that long-term extensive management has a negative effect on soil microbial biomass and result in shifting of microbial community structure. However, the ecological risks of the forest substitution and long-term extensive management still need to be further assessed. -
表 1 不同粗放经营年限毛竹林土壤理化性质
Table 1. Soil physic-chemical properties under bamboo stands with different culture histories
处理
Treatment含水量
Soil Moisture/%pH
(H2O)有机质
Organic matter/(g·kg-1)碱解氮
Alkalytic N/(mg·kg-1)有效磷
Available P/(mg·kg-11)速效钾
Available K/(mg·kg-1)MP 23.71±0.60a 4.51±0.05c 43.28±2.18b 115.21±21.88a 0.64±0.15b 40.0±7.2b 5a 18.91±1.45b 4.61±0.08bc 57.84±1.60a 102.20±3.9ab 1.97±0.41a 67.0±8.2a 9a 20.42±1.00b 4.88±0.15a 35.75±1.25bc 93.12±3.7ab 1.95±0.43a 41.0±5.0b 15a 19.08±1.99b 4.71±0.12b 41.87±2.13bc 93.95±20.4ab 1.49±0.85ab 45.7±3.2b 18a 15.51±2.13c 4.63±0.06bc 35.01±4.22c 70.15±5.1b 1.23±0.25ab 44.7±5.9b 注: 数据为3个重复的平均值及标准差(mean±SD);同列中不同字母表示处理间差异达5%显著水平。MP表示马尾松林;5 a、9 a、15 a、18 a表示毛竹林粗放经营年限为5年、9年、15年、18年。下同。
Note: The data in the table are the means of 3 replicates and the standard error (mean±SD). Different letters in the same column indicate significant difference at 5% level. MP indicates masson pine. 5 a、9 a、15 a、18 a indicate moso bamboo stands with 5, 9, 15, 18 years of extensive management age, respectively. The same below.表 2 不同粗放经营年限毛竹林土壤PLFA含量
Table 2. Soil PLFA contents under bamboo stands with different culture histories
nmol·g-1 处理
Treatment总PLFA
Total PLFA细菌
Bacteria革兰氏阳性细菌
G+ bacteria革兰氏阴性细菌
G- bacteria真菌
Fungi放线菌
Actinomycete原生动物
ProtozaMP 113.01±19.98a 63.97±13.92a 24.65±4.76a 22.55±5.84a 8.69±2.09a 11.28±4.74a 0.53±0.14a 5a 48.05±16.60b 28.74±10.20b 9.81±3.34b 11.30±4.49b 4.53±1.77b 5.75±1.96b 0.24±0.05b 9a 43.74±11.67b 26.86±7.48b 9.42±2.80b 10.53±2.91b 3.93±1.03b 4.30±2.21b 0.31±0.18b 15a 58.82±15.49b 34.87±9.72b 12.63±3.47b 16.10±5.01ab 5.36±1.29b 6.50±1.34b 0.25±0.04b 18a 46.61±4.28b 25.56±2.45b 9.53±0.60b 9.98±1.10b 5.14±0.55b 5.57±0.52b 0.26±0.04b 表 3 逐步回归分析
Table 3. Stepwise regression analysis
因变量
Dependence自变量
IndependenceF值
F value显著性
Significance总Total AN, AP 26.703 0.000 细菌Bacteria AN, AP 26.348 0.000 真菌Fungi AP, AN 13.043 0.001 放线菌Actinomycete AN, pH, OM 44.152 0.000 原生动物Protoza AN, AP 8.672 0.005 G-细菌G- bacteria AN, AP 17.134 0.000 G+细菌G+ bacteria AN, AP 23.552 0.000 注:AN、AP、OM分别为碱解氮、有效磷和土壤有机质。
Note: AN, AP, and OM indicate alkalytic N, available P and soil organic matter, respectively.表 4 土壤微生物多样性指数
Table 4. Soil microbial diversity indexes
处理
Treatment物种丰富度
RichnessShannon多样性
Shannon diversitySimpson多样性
Simpson diversityShannon均匀度
Shannon evenessSimpson均匀度
Simpson evenessMP 45±6.81a 23.55±2.16a 17.03±1.65a 0.53±0.05bc 0.38±0.05bc 5a 44±6.66a 21.39±0.90ab 15.09±0.59b 0.49±0.07c 0.35±0.06c 9a 47±1.00a 21.36±1.12ab 14.72±0.74b 0.45±0.03c 0.31±0.02c 15a 35±3.21b 20.60±0.71b 15.17±0.34b 0.60±0.04ab 0.44±0.04ab 18a 32±0.58b 20.00±0.25b 15.28±0.54b 0.63±0.02a 0.48±0.03a -
[1] 何冬华, 陈俊辉, 徐秋芳, 等. 集约经营对毛竹林土壤固氮细菌群落结构和丰度的影响[J]. 应用生态学报, 2015, 26(10): 2961-2968. [2] 季海宝, 庄舜尧, 张厚喜, 等. 我国毛竹林生态系统碳储量的地带性差异[J]. 生态环境学报, 2013, 22(1): 1-5. doi: 10.3969/j.issn.1674-5906.2013.01.003 [3] 白尚斌, 周国模, 王懿祥, 等. 天目山保护区森林群落植物多样性对毛竹入侵的响应及动态变化[J]. 生物多样性, 2013, 21(3): 288-295. [4] Okutomi K, Shinoda S, Fukuda H. Causal analysis of the invasion of broad-leaved forest by bamboo in Japan[J]. Journal of Vegetation Science, 1996, 7(5): 723-728. doi: 10.2307/3236383 [5] Larpkern P, Moe S R, Totland O. Bamboo dominance reduces tree regeneration in a disturbed tropical forest[J]. Oecologia, 2011, 165(1): 161-168. doi: 10.1007/s00442-010-1707-0 [6] 殷士学. 土壤微生物生物量及其与养分循环关系的研究进展[J]. 土壤学进展, 1993, 21(4): 1-8. [7] Grayston S, Campbell C, Bardgett R, et al. Assessing shifts in microbial community structure across a range of grasslands of differing management intensity using CLPP, PLFA and community DNA techniques[J]. Applied Soil Ecology, 2004, 25(1): 63-84. doi: 10.1016/S0929-1393(03)00098-2 [8] Chen G S, Yang Y S, Xie J S, et al. Soil biological changes for a natural forest and two plantations in subtropical China[J]. Pedosphere, 2004, 14(3): 297-304. [9] Lucas-Borja M E, Candel D, Jindo K, et al. Soil microbial community structure and activity in monospecific and mixed forest stands, under Mediterranean humid conditions[J]. Plant and Soil, 2012, 354(1-2): 359-370. doi: 10.1007/s11104-011-1072-8 [10] Chang E H, Chiu C Y. Changes in soil microbial community structure and activity in a cedar plantation invaded by moso bamboo[J]. Applied Soil Ecology, 2015, 91: 1-7. doi: 10.1016/j.apsoil.2015.02.001 [11] 徐秋芳, 张许昌, 王绪南, 等. 毛竹林与马尾松林土壤生物学性质及微生物功能多样性比较[J]. 浙江林业科技, 2008, 28(3): 8-12. doi: 10.3969/j.issn.1001-3776.2008.03.002 [12] 孙棣棣, 徐秋芳, 田甜, 等. 不同栽培历史毛竹林土壤微生物生物量及群落组成变化[J]. 林业科学, 2011, 47(7): 181-186. [13] 鲁如坤. 土壤农化分析[M]. 北京: 中国农业科技出版社, 2000. [14] Frostegård A, Bååth E. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil[J]. Biology and Fertility of Soils, 1996, 22(1-2): 59-65. doi: 10.1007/BF00384433 [15] Wu Y P, Ma B, Zhou L, et al. Changes in the soil microbial community structure with latitude in eastern China, based on phospholipid fatty acid analysis[J]. Applied Soil Ecology, 2009, 43(2-3): 234-240. doi: 10.1016/j.apsoil.2009.08.002 [16] Petersen S O, Klug M J. Effects of sieving, storage, and incubation temperature on the phospholipid fatty acid profile of a soil microbial community[J]. Applied and Environmental Microbiology, 1994, 60(7): 2421-2430. doi: 10.1128/aem.60.7.2421-2430.1994 [17] Frostegård Å, Bååth E, Tunlio A. Shifts in the structure of soil microbial communities in limed forests as revealed by phospholipid fatty acid analysis[J]. Soil Biology and Biochemistry, 1993, 25(6): 723-730. doi: 10.1016/0038-0717(93)90113-P [18] Moore-Kucera J, Dick R. PLFA profiling of microbial community structure and seasonal shifts in soils of a douglas-fir chronosequence[J]. Microbial Ecology, 2008, 55(3): 500-511. doi: 10.1007/s00248-007-9295-1 [19] 陈晓娟, 吴小红, 刘守龙, 等. 不同耕地利用方式下土壤微生物活性及群落结构特性分析: 基于PLFA和MicroRespTM方法[J]. 环境科学, 2013, 34(6): 2375-2382. [20] 李娇, 蒋先敏, 尹华军, 等. 不同林龄云杉人工林的根系分泌物与土壤微生物[J]. 应用生态学报, 2014, 25(2): 325-332. [21] McDaniel M, Tiemann L, Grandy A. Does agricultural crop diversity enhance soil microbial biomass and organic matter dynamics? A meta-analysis[J]. Ecological Applications, 2014, 24(3): 560-570. doi: 10.1890/13-0616.1 [22] Sul W J, Asuming-Brempong S, Wang Q, et al. Tropical agricultural land management influences on soil microbial communities through its effect on soil organic carbon[J]. Soil Biology and Biochemistry, 2013, 65: 33-38. doi: 10.1016/j.soilbio.2013.05.007 [23] 王卫霞, 罗达, 史作民, 等. 岷江干旱河谷造林对土壤微生物群落结构的影响[J]. 生态学报, 2014, 34(4): 890-898. [24] 施瑶, 王忠强, 张心昱, 等. 氮磷添加对内蒙古温带典型草原土壤微生物群落结构的影响[J]. 生态学报, 2014, 34(17): 4943-4949. [25] Turner B L, Wright S J. The response of microbial biomass and hydrolytic enzymes to a decade of nitrogen, phosphorus, and potassium addition in a lowland tropical rain forest[J]. Biogeochemistry, 2014, 117(1): 115-130. doi: 10.1007/s10533-013-9848-y [26] 马朋, 李昌晓, 雷明, 等. 三峡库区岸坡消落带草地, 弃耕地和耕地土壤微生物及酶活性特征[J]. 生态学报, 2014, 34(4): 1010-1020. [27] 许晴, 张放, 许中旗, 等. Simpson指数和Shannon-Wiener指数若干特征的分析及"稀释效应"[J]. 草业科学, 2011, 28(4): 527-531. doi: 10.3969/j.issn.1001-0629.2011.04.001 [28] Lin Y T, Tang S L, Pai C W, et al. Changes in the soil bacterial communities in a cedar plantation invaded by moso bamboo[J]. Microbial Ecology, 2013, 67(2): 421-429. [29] Tanaka A, Shimizu K, Kondo R. Antibacterial compounds from shoot skins of moso bamboo (Phyllostachys pubescens)[J]. Journal of Wood Science, 2013, 59(2): 155-159. doi: 10.1007/s10086-012-1310-6 [30] Hackl E, Pfeffer M, Donat C, et al. Composition of the microbial communities in the mineral soil under different types of natural forest[J]. Soil Biology and Biochemistry, 2005, 37(4): 661-671. doi: 10.1016/j.soilbio.2004.08.023 [31] Brockett B F T, Prescott C E, Grayston S J. Soil moisture is the major factor influencing microbial community structure and enzyme activities across seven biogeoclimatic zones in western Canada[J]. Soil Biology and Biochemistry, 2012, 44(1): 9-20. doi: 10.1016/j.soilbio.2011.09.003 [32] Morris S J, Boerner R E J. Spatial distribution of fungal and bacterial biomass in southern Ohio hardwood forest soils: scale dependency and landscape patterns[J]. Soil Biology and Biochemistry, 1999, 31(6): 887-902. doi: 10.1016/S0038-0717(99)00002-4 -





 下载:
下载: