-
DNA甲基化是指S-腺苷甲硫氨酸在DNA甲基化转移酶的作用下,将甲基基团共价结合到胞嘧啶5’碳位上的过程[1]。DNA甲基化是目前研究最为深入的表观遗传修饰。DNA甲基化既发生于对称的CG,CHG序列上,也发生于非对称的CHH(H=A,C或T)序列上[2]。DNA甲基化参与调控植物体多种生长发育过程及表型可塑性,如拟南芥(Arabidopsis thaliana)花发育过程[3]、水稻(Oryza sativa)种子发育过程[4]及红树植物拉关木(Laguncularia racemosa)对不同环境的适应性[5]等。
目前应用最为广泛的全基因组水平DNA甲基化检测方法主要分为两类,一类依托于高通量测序技术,包括全基因组亚硫酸盐测序法(Whole genome bisulfite sequencing,WGBs)、简化代表性亚硫酸盐测序法(Reduced reperesentation bisulfite sequencing,RRBS)和DNA甲基化免疫共沉淀测序法(Methylated DNA immunoprecipitation sequencing,MeDIP-seq)等[6],可在全基因组水平获得DNA甲基化信息,但价格昂贵且需要物种的全基因组序列;另一类是基于限制性内切酶的甲基化敏感扩增多样性(methylation-sensitive amplification polymorphism,MSAP)检测技术。MSAP技术是在AFLP技术基础上发展起来的,将AFLP中的内切酶Mse Ⅰ替换成同裂酶Hpa Ⅱ及Msp Ⅰ[7],通过比较两种同裂酶分别与EcoR Ⅰ组合获得电泳条带的差异确定CCGG位点甲基化情况。该技术的优点是操作简单、成本低,无需已知参考基因组序列,缺点是只能获得全基因组部分DNA甲基化信息。
日本落叶松(Larix kaempferi)是我国重要的经济和生态树种,具有生长速度快、抗病性强和适应性广的特点[8],开展日本落叶松DNA甲基化研究有助于在表观遗传水平解析其表型变异。由于参考基因组序列未知,李爱应用基于传统的聚丙烯酰胺凝胶电泳的MSAP技术在日本落叶松中检测了1447个5’-CCGG位点,并发现日本落叶松杂种优势可能与DNA甲基化模式的大量调整密切相关[9],但聚丙烯酰胺凝胶电泳耗时长,扩增条带难以确认,灵敏性差,不利于大样本的表观遗传变异研究。基于毛细管电泳(capillary electrophoresis,CE)的MSAP技术可以克服上述缺陷,但对反应体系要求比较高。本研究拟通过分析DNA模板用量及选择性扩增体系中主要成分浓度对毛细管电泳结果的影响,确立最佳反应体系,获得条带清晰、信号强度均一的DNA甲基化图谱,为今后开展日本落叶松表观遗传变异研究奠定基础。
-
试验材料为16年生日本落叶松1.3米胸径处未成熟木质部(图 1),采集于湖北省建始县长岭岗林场日本落叶松原生种源试验林,该试验林包括草津、浅间、富士、伊那、日光以及松本六个种源。随机选取草津种源中的一株作为本研究的试验材料。采用DNeasy Plant Mini试剂盒(Qiagen,德国) 提取总DNA,使用NanoDrop8000分光光度计及琼脂糖凝胶电泳检测DNA浓度与质量。DNA质量应满足:1)1.8<A260/A280<2.0;2)2.0<A260/A230<2.3;3)琼脂糖凝胶电泳条带完整、无明显降解现象。
用10 U同裂酶Msp Ⅰ和Hpa Ⅱ分别与10 U EcoR Ⅰ(NEB,美国)组合酶切基因组DNA,37℃酶切12 h。EcoR Ⅰ/Hpa Ⅱ组合的酶切产物80℃失活20 min,EcoR Ⅰ/ Msp Ⅰ酶切产物65℃失活20 min。通过T4 DNA连接酶连上接头,连接体系为:2 μL 10×T4 DNA连接酶Buffer, 10 μL酶切产物, 1μL T4 DNA酶(400U·μL-1), 1 μL EcoR Ⅰ接头(5 pmol·μL-1), 1 μL Hpa Ⅱ/Msp Ⅰ接头(50 pmol·μL-1),5 μL H2O。16℃连接16 h,65℃失活20 min(表 1)。
表 1 接头以及引物序列
Table 1. The DNA sequence of adaptors and primers
接头/引物
Adaptors/primers序列
Sequences荧光修饰
Fluorescent modification接头
AdaptorsEcoR Ⅰ-adapterF CTCGTAGACTGCGTACC 无 EcoR Ⅰ-adapterR AATTGGTACGCAGTCTAC 无 Hpa Ⅱ/Msp Ⅰ-adapterF GACGATGAGTCTCGAT 无 Hpa Ⅱ/Msp Ⅰ-adapterR CGATCGAGACTCAT 无 预扩
Pre-amplificationEcoR Ⅰ+0 GACTGCGTACCAATTC 无 Hpa Ⅱ/Msp Ⅰ+0 ATGAGTCTCGATCGG 无 选扩
Selective amplificationE3-AAC GACTGCGTACCAATTCAAC 5’-FAM E8-ACC GACTGCGTACCAATTCACC 5’-FAM H/M13-CAA ATGAGTCTCGATCGGCAA 无 H/M12-CAT ATGAGTCTCGATCGGCAT 无 H/M25-AGT ATGAGTCTCGATCGGAGT 无 H/M33-CTT ATGAGTCTCGATCGGCTT 无 预扩增的反应体系为:exTaq10×buffer 2 μL,exTaq DNA聚合酶(U·μL-1) 0.2 μL,dNTP(2.5 mmol·L-1) 1.6 μL,EcoR Ⅰ+0预扩增引物0.5 μL,Hpa Ⅱ/Msp Ⅰ+0预扩增引物0.5 μL(表 1),连接产物4 μL,灭菌水11.2 μL,总体积为20 μL。
-
稀释20倍的预扩增产物用于选择性扩增。选用E3-HM25为选择性扩增引物组合,优化DNA模板用量以及引物、Mg2+、dNTP和exTaq DNA聚合酶的浓度,设置梯度为:1)DNA模板100 ng,200 ng,300 ng以及400 ng;2)引物0.25 pmol·μL-1,0.5 pmol·μL-1,0.75 pmol·μL-1,1 pmol·μL-1;3)Mg2+ 1 mmol·L-1,1.5 mmol·L-1,2 mmol·L-1,2.5 mmol·L-1;4)dNTP 0.1 mmol·L-1,0.2 mmol·L-1,0.3 mmol·L-1,0.4 mmol·L-1;5)exTaq DNA聚合酶0.05 U·μL-1,0.125 U·μL-1,0.375 U·μL-1,0.5 U·μL-1。利用E3-HM13、E3-HM33以及E8-HM12三对引物来验证优化选择性扩增体系的稳定性。
预扩增及选择性扩增程序均采用吕金辉的方法[10]。选择性扩增产物使用仪器ABI3730进行检测(由北京睿博兴科生物技术有限公司完成),毛细管电泳图谱应用GenemarkerV2.2.0软件获得。
-
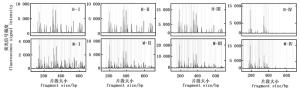
模板DNA用量对毛细管电泳结果影响不明显。由图 2可知,四种DNA模板用量(100 ng、200 ng、300 ng以及400 ng)得到毛细管电泳图谱在信号强度、信号均一性和杂峰干扰程度等方面没有显著差别。为了减少模板DNA的使用量,选择DNA模板用量为100 ng。
-
引物浓度是影响毛细管电泳结果的关键因素(图 3),浓度过高时,片段的数量明显减少。引物浓度0.25 pmol·μL-1、0.5 pmol·μL-1和0.75 pmol·μL-1的毛细管电泳结果相似,但以0.75 pmol·μL-1时毛细管电泳的信号强度最高;而当引物浓度为1 pmol·μL-1时EcoR Ⅰ/Hpa Ⅱ酶组合及EcoR Ⅰ/ Msp Ⅰ酶组合毛细管电泳结果虽然在200 bp和400 bp的主峰信号强度很强,但在400~600 bp片段的信号强度却非常弱。因此,最适引物浓度为0.75 pmol·μL-1。
-
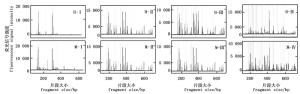
选择性扩增体系中Mg2+ 浓度是影响毛细管电泳结果的关键因素(图 4)。当Mg2+浓度为1 mmol·L-1时,EcoR Ⅰ/Hpa Ⅱ酶组合及EcoR Ⅰ/Msp Ⅰ酶组合的毛细管电泳结果主要集中在几个主带上;而当Mg2+浓度为2.5 mmol·L-1时,EcoR Ⅰ/Hpa Ⅱ酶组合在400 bp的一个主峰信号很强,其余信号相对较弱,EcoR Ⅰ/Msp Ⅰ酶组合杂峰相对较多;当Mg2+ 浓度为1.5 mmol·L-1或2 mmol·L-1时,均获得了非常理想的毛细管电泳结果,杂峰少,信号响度均一。可见,Mg2+ 浓度在1.5 mmol·L-1和2 mmol·L-1时毛细管电泳的效果最佳。
-
选择性扩增体系中dNTP 浓度是影响毛细管电泳结果的关键因素(图 5)。当dNTP浓度为0.1 mmol·L-1时,EcoR Ⅰ/Hpa Ⅱ酶组合及EcoR Ⅰ/Msp Ⅰ酶组合的毛细管电泳结果均在两个主峰处表现出很强的信号值,其它信号峰很弱;当dNTP浓度为0.2 mmol·L-1时,EcoR Ⅰ/Msp Ⅰ酶组合仍然表现在两个主峰处信号很强,其它信号峰很弱;当dNTP浓度为0.3 mmol·L-1及0.4 mmol·L-1时毛细管电泳的效果有了明显的提升,信号值均一,杂峰较少。可见,选择性扩增体系中的dNTP浓度在0.3 mmol·L-1和0.4 mmol·L-1时具有最佳的毛细管电泳效果。
-
与普通Taq DNA聚合酶相比,虽然exTaq DNA聚合酶稳定性及准确性更高,但其成本也相对高很多。四种exTaq DNA聚合酶浓度的毛细管电泳结果(图 6),在信号强度的均一性、杂峰程度上没有显著差异。四种exTaq酶浓度获得的EcoR Ⅰ/Hpa Ⅱ酶组合的毛细管电泳的信号强度是一致的,但EcoR Ⅰ/Msp Ⅰ酶组合的毛细管电泳的信号强度表现出随浓度的增加而降低的趋势。出于成本的考量,最终选定exTaq酶浓度为0.05 U·μL-1。
-
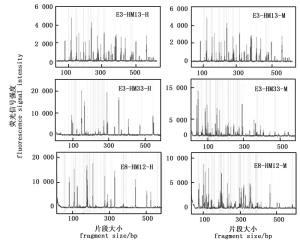
综上所述,本研究初步确立了基于毛细管电泳的MSAP反应体系:DNA模板用量100 ng,引物0.75 pmol·μL-1,Mg2+ 1.5~2.0 mmol·L-1,dNTP 0.3~0.4 mmol·L-1,exTaq DNA聚合酶0.05 U·μL-1。为了进一步优化体系,又在1.5~2 mmol·L-1和dNTP 0.3~0.4 mmol·L-1之间设置了五个梯度,两两组合,检测了相应组合获得的毛细管电泳结果的质量。结果表明,Mg2+ 2.0 mmol·L-1、dNTP 0.375 mmol·L-1的组合具有最佳的条带扩增效果(图 7)。选择三对选择性扩增引物(表 1),对优化后选择性扩增体系的稳定性进行了验证。由图 8可知,三对引物均获得了亮度清晰、信号较强且相对均一、杂峰较少的毛细管电泳图谱,表明所建的反应体系稳定性较高。
-
开展DNA甲基化研究对于解析表型变异的表观遗传机理具有重要意义[11-13]。MSAP检测技术是目前应用最为广泛的DNA甲基化检测技术[14]。相对于高通量的DNA甲基化检测方法,MSAP检测技术具有成本低,操作简单以及无需已经参考基因组的特点。基于毛细管电泳的MSAP检测技术较传统基于聚丙烯酰胺凝胶电泳的MSAP检测技术而言,省去了大量的制胶、跑板、染色、显影以及读带等繁琐的过程,极大地缩短了DNA甲基化检测的时间,显著地提高了效率,便于开展大样本的表观遗传变异研究,并且能够更加灵敏地识别浓度很低的扩增片段。本研究综合考虑了影响毛细管电泳扩增效果的多个因素,确立了基于毛细管电泳的日本落叶松MSAP技术最佳反应体系,为大批量分析日本落叶松DNA甲基化奠定了基础。
研究发现Mg2+及dNTP浓度是影响毛细管电泳结果最为关键的因素,浓度过低或过高均会导致毛细管电泳图谱条带明显减少,杂峰数量显著增多。该结果与宋春艳[15]、吕金辉[10]基于毛细管电泳的AFLP条件优化结果一致,同时也与李金龙[16]在北京油鸡中报道一致:Mg2+最佳浓度为1.25 mmol·L-1,浓度过低条带较少,过高时杂峰比较多;dNTP最佳浓度为0.15 mmol·L-1,浓度过高使得条带减少。本研究最佳反应体系中Mg2+浓度为2 mmol·L-1,dNTP浓度为0.375 mmol·L-1,这可能是由于物种不同,酶切获得的片段多少不同造成的。
引物浓度也是影响毛细管电泳结果的重要因素,当引物浓度为1 pmol·μL-1时,毛细管图谱的信号会集中在几个主峰上。吕金辉[10]和李金龙[16]研究发现引物浓度是影响毛细管电泳结果的关键因素,过高会造成非特异性扩增,过低会造成片段的缺失。
DNA模板用量和exTaq DNA聚合酶浓度对毛细管电泳结果影响较小。为了降低成本,选定DNA模板用量100 ng和exTaq DNA聚合酶浓度0.05 U·μL-1为最佳配置,可获得较好的条带扩增效果。吕金辉[10]认为DNA模板用量会影响基于毛细管电泳的AFLP结果。我们推测差异的原因可能在于物种的差异或者是DNA模板用量梯度差异设置造成的。同时,吕金辉[10]也发现exTaq DNA聚合酶的使用量不是影响毛细管电泳结果的关键因素,这与我们的结果是一致的。
-
本文以日本落叶松未成熟木质部为试材,探索不同DNA模板用量及选择扩增体系中引物浓度、Mg2+浓度、dNTP浓度和exTaq DNA聚合酶浓度等因素对毛细管电泳效果的影响,从而确立最适的MSAP反应体系。结果表明,DNA模板以及exTaq DNA聚合酶的用量对毛细管电泳结果的影响不明显,过高的引物浓度会减少扩增的条带数目,过低或过高的Mg2+ 和dNTP浓度会导致毛细管电泳图谱条带明显减少,杂峰显著增多。最终确立了最佳反应体系为:DNA模板100 ng,引物0.75 pmol·μL-1,Mg2+ 2 mmol·L-1,dNTP 0.375 mmol·L-1和exTaq DNA聚合酶0.05 U·μL-1。通过三对选择性扩增引物的验证性实验表明,该体系可获得亮度清晰、信号较强且强度相对均一以及杂峰较少的毛细管电泳图谱。本文首次建立了基于毛细管电泳的日本落叶松最佳MSAP反应体系,为今后开展日本落叶松表观遗传变异相关研究奠定基础。
基于毛细管电泳的日本落叶松MSAP反应体系的建立
Establishment of Larix kaempferi MSAP System Based on Capillary Electrophoresis
-
摘要:
目的 建立基于毛细管电泳的日本落叶松最佳MSAP反应体系,获得条带清晰信号强度均一的DNA甲基化图谱,为今后开展日本落叶松表观遗传变更研究奠定基础。 方法 以日本落叶松未成熟木质部为试材,设置不同梯度的DNA模板用量以及选择扩增体系中引物浓度、Mg2+浓度、dNTP浓度和exTaq DNA聚合酶浓度,确定各组分不同用量对毛细管电泳效果的影响,从而确立最适的MSAP反应体系。 结果 结果表明模板DNA以及exTaq DNA聚合酶浓度对毛细管电泳结果影响不明显,而高的引物浓度会引起条带的减少。Mg2+及dNTP浓度是影响毛细管电泳结果最为关键的因素,浓度过低或过高会导致毛细管电泳图谱条带明显减少,杂峰显著增多。 结论 最终确立的反应体系为:DNA模板100 ng,引物0.75 pmol·μL-1,Mg2+ 2 mmol·L-1,dNTP 0.375 mmol·L-1和exTaq DNA聚合酶0.05 U·μL-1。 -
关键词:
- DNA甲基化
- / 甲基化敏感扩增多态性(MSAP)
- / 毛细管电泳
- / 体系建立
- / 日本落叶松
Abstract:Objective This study aims at constructing the excellent reaction system of MSAP technology and obtaining DNA methylation maps with clear bands and uniform signal intensity, so as to provide references for the study on genetic variation of Larix kaempferi in the future. Method Taking immature xylem as experimental materials, the impact of five factors (dosage of DNA template, concentration of primers, Mg2+, dNTP and exTaq DNA polymerase) on the result of capillary electrophoresis was investigated. Result It was found that different concentrations of DNA template and the exTaq DNA polymerase did not affect the result of capillary electrophoresis. However, high concentration of primers would lead to sparse fragments in MSAP profile. Mg2+ concentration and dNTP concentration were the most important factors which determined the result of capillary electrophoresis. When the concentration of Mg2+/dNTP was unsuitable, the amount of band would significantly decrease, and the amount of impurity peak would significantly increase. Conclusion The MASP system determined for capillary electrophoresis in L. kaempferi is: DNA template dosage 100 ng, primers 0.75 pmol·μL-1, Mg2+ 2 mmol·L-1, dNTP 0.375 mmol·L-1 and exTaq DNA polymerase 0.05 U·μL-1. It can be widely used in detecting DNA methylation. -
表 1 接头以及引物序列
Table 1. The DNA sequence of adaptors and primers
接头/引物
Adaptors/primers序列
Sequences荧光修饰
Fluorescent modification接头
AdaptorsEcoR Ⅰ-adapterF CTCGTAGACTGCGTACC 无 EcoR Ⅰ-adapterR AATTGGTACGCAGTCTAC 无 Hpa Ⅱ/Msp Ⅰ-adapterF GACGATGAGTCTCGAT 无 Hpa Ⅱ/Msp Ⅰ-adapterR CGATCGAGACTCAT 无 预扩
Pre-amplificationEcoR Ⅰ+0 GACTGCGTACCAATTC 无 Hpa Ⅱ/Msp Ⅰ+0 ATGAGTCTCGATCGG 无 选扩
Selective amplificationE3-AAC GACTGCGTACCAATTCAAC 5’-FAM E8-ACC GACTGCGTACCAATTCACC 5’-FAM H/M13-CAA ATGAGTCTCGATCGGCAA 无 H/M12-CAT ATGAGTCTCGATCGGCAT 无 H/M25-AGT ATGAGTCTCGATCGGAGT 无 H/M33-CTT ATGAGTCTCGATCGGCTT 无 -
[1] 谭建新, 孙玉洁. 表观基因组学研究方法进展与评价[J]. 遗传, 2009, 31(1): 3-12. [2] Cokus SJ, Feng S, Zhang X, et al. Shotgun bisulphite sequencing of the Arabidopsis genome reveals DNA methylation patterning[J]. Nature, 2008, 452(7184): 215-219. doi: 10.1038/nature06745 [3] Yang H, Chang F, You C, et al. Whole-genome DNA methylation patterns and complex associations with gene structure and expression during flower development in Arabidopsis[J]. The Plant Journal: for Cell and Molecular Biology, 2015, 81(2): 268-281. doi: 10.1111/tpj.12726 [4] Xing MQ, Zhang YJ, Zhou SR, et al. Global Analysis Reveals the Crucial Roles of DNA Methylation during Rice Seed Development[J]. Plant Physiology, 2015, 168(4): 1417-1432. doi: 10.1104/pp.15.00414 [5] Lira-Medeiros CF, Parisod C, Fernandes RA, et al. Epigenetic variation in mangrove plants occurring in contrasting natural environment[J]. PloS One, 2010, 5(4): e10326. doi: 10.1371/journal.pone.0010326 [6] 沈圣, 屈彦纯, 张军. 下一代测序技术在表观遗传学研究中的重要应用及进展[J]. 遗传, 2014, 36(3): 256-275. [7] Schulz B, Eckstein RL, Durka W. Scoring and analysis of methylation-sensitive amplification polymorphisms for epigenetic population studies[J]. Molecular Ecology Resources, 2013, 13(4): 642-653. doi: 10.1111/1755-0998.12100 [8] Lai M, Sun X, Chen D, et al. Age-related trends in genetic parameters for Larix kaempferi and their implications for early selection[J]. BMC Genetics, 2014, 15 Suppl 1: S10. [9] Li A, Song W-Q, Chen C-B, et al. DNA methylation status is associated with the formation of heterosis in Larix kaempferi intraspecific hybrids[J]. Molecular Breeding, 2013, 31(2): 463-475. doi: 10.1007/s11032-012-9803-y [10] 吕金辉, 胡建军, 卢孟柱. 基于毛细管电泳的柳树AFLP分子标记研究[J]. 北京林业大学学报, 2012, 34(1): 51-57. [11] Ci D, Song Y, Du Q, et al. Variation in genomic methylation in natural populations of Populus simonii is associated with leaf shape and photosynthetic traits[J]. Journal of Experimental Botany, 2016, 67(3): 723-737. doi: 10.1093/jxb/erv485 [12] Latzel V, Allan E, Bortolini Silveira A, et al. Epigenetic diversity increases the productivity and stability of plant populations[J]. Nature Communications, 2013, 4: 2875. doi: 10.1038/ncomms3875 [13] Medrano M, Herrera CM, Bazaga P. Epigenetic variation predicts regional and local intraspecific functional diversity in a perennial herb[J]. Molecular Ecology, 2014, 23(20): 4926-4938. doi: 10.1111/mec.12911 [14] Alonso C, Pérez R, Bazaga P, et al. MSAP markers and global cytosine methylation in plants: a literature survey and comparative analysis for a wild growing species[J]. Molecular Ecology Resources, 2016, 16(1): 80-90. doi: 10.1111/1755-0998.12426 [15] 宋春艳, 楚鹰, 陈明杰, 等. 基于CEQ遗传分析仪的AFLP条件的优化试验[J]. 食用菌, 2006, 28(3): 14-15. doi: 10.3969/j.issn.1000-8357.2006.03.009 [16] 李金龙, 唐韶青, 邹智元, 等. 北京油鸡MSAP毛细管电泳荧光检测技术的建立[J]. 遗传, 2014, 36(5): 495-502. -





 下载:
下载: