-
植物激素中的细胞分裂素,影响着植物生长发育的不同过程,细胞分裂素信号转导系统是行使其功能的关键成分[1]。细胞分裂素信号系统,主要包括三个关键因子,跨膜的受体组氨酸激酶(HKs)、酸基团转移蛋白(HPs)和细胞核内的响应调节因子(RRs)[2]。根据氨基酸保守序列和能否被细胞分裂素诱导,拟南芥响应调节因子(ARR)基因家族被分为A类、B类和APRR,其中,A类在拟南芥中存在10个成员[3],为数众多的家族成员表明它们在细胞分裂素调节许多生物学过程中具有重要作用。拟南芥中A类ARR基因家族蛋白主要功能是作为负反馈调节细胞分裂素信号,抑制B类ARR家族活性。B类ARR是一类植物特异转录因子,在拟南芥中B类ARR家族成员功能冗余[4-7]。拟南芥APRRs蛋白氨基酸序列中的天冬氨酸位点缺失,APRR家族成员对昼夜节律具有重要调节作用,在对昼夜节律的调节方面不同成员显示不同的调控方式[8]。
A类ARR的表达影响根顶端分生组织的发生,在拟南芥根部发育过程中,细胞分裂素的缺失会影响分生组织的大小和活动[9]。A类ARR在生长素和细胞分裂素对根部发育共同调控中起到节点的作用,一方面,A类ARR7和ARR15的表达受生长素的调控,通过抑制细胞分裂素在未分化的干细胞中的积累,从而保持干细胞特征;另一方面,A类ARR成员中的ARR5、ARR6、ARR7和ARR15能被植物干细胞决定基因(WUS)直接抑制表达,降低对细胞分裂素信号的负反馈作用,从而上调细胞分裂素的作用,促进细胞分化[10]。
ARR家族作为细胞分裂素响应调节因子,对拟南芥的生长发育起到重要作用;然而,在杨树中,许多重要调控因子家族出现了扩张,杨树RRs家族功能的研究有待进一步深入。目前,杨树RRs家族已确定了33个RRs成员[11]。其中,B类PtRR13是抑制不定根形成的下游转录因子,在杨树根系发育过程中起着重要作用[12],但对杨树A类RRs基因家族研究还鲜见报道。本研究发现,A类ARR家族在根发育过程中有较高的表达。结合转录组数据,筛选出在根中表达丰度最高的PtRRI加以研究。通过定量表达分析和转基因技术、激素处理等对PtRRI基因的表达模式进行了初步探究,旨在为研究该基因在杨树生长发育过程中的功能机制提供基础,为进一步解析杨树A类RRs基因的功能奠定基础。
-
材料为银腺杨无性系84K(Populus alba × P. glandulosa)组培苗,培养温度为(25+1)℃,光照为16/8 h(白天/黑夜),光照强度为50 μmol·L-1·m-2·s-1,实验操作在林木遗传育种国家重点实验室中进行。
-
用拟南芥A类ARR的蛋白序列在毛果杨基因组数据库(http://www.phytozome.net/poplar.php)中进行Blastp比对分析,用Clustal X2.0对拟南芥A类ARR和杨树A类PtRR蛋白全长进行序列多重比对分析[13]。采用MEGA 4.0软件的邻结法(NJ)构建进化树[14]。利用在线软件MEME(http://meme-suite.org/)分析A类PtRR保守结构域。
-
半定量PCR及克隆PtRRI启动子的引物使用Primer3软件(http://primer3.ut.ee/)设计,引物见表 1。使用RNeasy Plant Mini试剂盒和RNase-free DNase I试剂盒分别提取毛果杨根、茎、叶、形成层、未成熟木质部总RNA。每个样品取大约1.5 μg RNA使用SuperscriptⅢ First-strand Kit试剂盒反转录合成cDNA的第一链。杨树PtActin作为内参基因(基因序列号:EF418792.1),每个cDNA为模板进行半定量PCR,扩增产物使用2%琼脂糖凝胶电泳进行检测。所有试验分别进行3次生物学重复与技术重复。
表 1 基因、启动子和实时定量PCR分析所用的引物
Table 1. Primer sequences for amplification of PtRR, promoters and qPCR
引物 序列(5′-3′) 用途 PtRRI-F 5′-CACTCATCTCCTCACCGTGTTTGTTAG-3′ 半定量RT-PCR引物 PtRRI-R 5′-CAACGCTATCAATCACACTACTACCACG-3′ PtActin-F 5′-GATGACCCAGATCATGTTTG-3′ 半定量RT-PCR内参基因引物 PtActin-R 5′-TCCTTGCTCATCCTGTCAG-3′ ProPtRRI-F 5′-AGGAATGGGTAGGAGAGAAAGATG-3′ PtRRI启动子引物 ProPtRRI-R 5′-TACAATTCCACTAACGATGTGTCA-3′ -
选取PtRRI基因上游2 200 bp的启动子区域,以毛果杨基因组DNA为模板,琼脂糖凝胶回收PCR扩增产物克隆至中间载体pDNOR222.1,测序正确后克隆至pMDC164,构建PPtRRI::GUS载体。载体构建采用gateway克隆系统(Life Technologies,Carlsbad,CA,USA),具体操作按产品说明书进行。
-
由于银腺杨无性系84K易于进行遗传操作,故选择其进行基因转化。在PPtRRI::GUS的农杆菌OD600=0.4~0.8时侵染银腺杨84K叶盘。感染后的叶盘在不定芽诱导培养基上,在温度为(25±1)℃的黑暗条件下共培养3天。共培养后的叶盘转移至SIM培养基上,诱导和筛选抗性不定芽。经过约25天的诱导培养,将抗性不定芽转移至生根培养基中,直至诱导出不定根[15]。promoter::GUS分析至少采用3个转基因株系。
-
GUS的组织化学染色按照如下步骤进行:2周的幼苗和4周的茎段在90%预冷丙酮中固定30 min,固定后的组织材料使用GUS染色缓冲液在冰上洗涤3次,再转移至GUS染色液中,真空抽气后在37℃,70 r·min-1温浴12 h密封存放后使用75%乙醇脱色[16]。每一个promoter::GUS转基因株系至少有5个克隆进行GUS染色,每个实验至少重复3次,通过实体显微镜观察根部染色和震荡切片观察茎部GUS表达情况。
-
选取20天生长状态一致的银腺杨84K组培苗15棵,在1/2MS溶液炼苗1周后,各取3棵分别用1 μmol·L-1 6-BA、1 μmol·L-1 IBA、1 μmol·L-1 GA3、100 μmol·L-1 ABA溶液和1/2M溶液处理2.5 h,分别混合研磨样品提取RNA,反转录后通过荧光定量PCR,检测PtRRI在4种激素处理下表达量的变化,上述实验重复3次。
-
在生根培养基内,对生长状态一致的PPtRRI::GUS组培苗茎段进行扦插,分别对扦插后第1、3、5、7、9天的茎段取样,进行GUS染色,观察拍照。
-
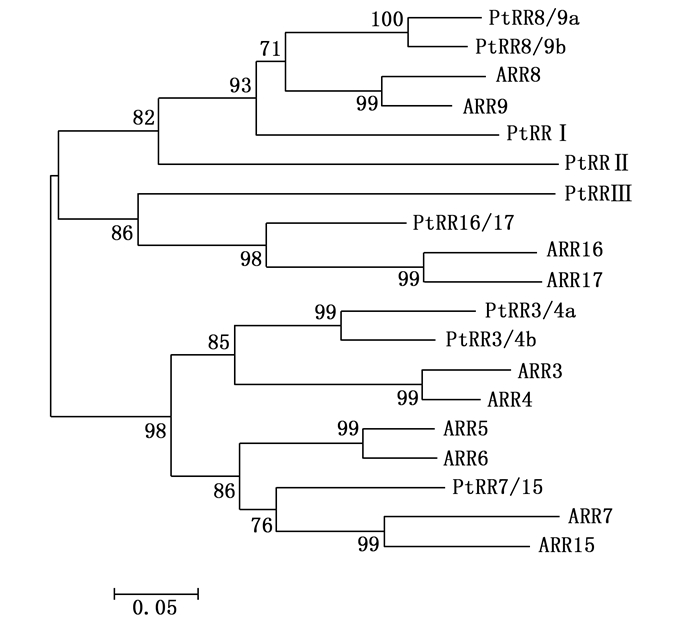
PtRRI在系统进化上属于A类PtRR家族成员,通过A类PtRR蛋白质序列与已报道的拟南芥A类ARR蛋白进行多重比对,采用MEGA 4.0中NJ法构建系统进化发生树,根据与拟南芥的对应关系命名,没有对应拟南芥的PtRR用罗马符号表示(图 1)。由图 1可以看出:拟南芥中ARR家族与杨树PtRR家族对应关系不强,ARR3和ARR4对应的杨树同源家族PtRR3/4a和PtRR3/4b,ARR5和ARR6没有对应的杨树同源家族,ARR8和ARR9对应的杨树同源家族PtRR8/9a和PtRR8/9b,ARR16和ARR17对应的杨树同源家族只有PtRR16/17,ARR7和ARR15对应的杨树同源家族也只有PtRR7/15,剩下的没有对应拟南芥ARR的杨树PtRR分别定名为PtRRI、PtRRⅡ、PtRRⅢ。对杨树A类RRs家族氨基酸序列分析,表明A类PtRR蛋白都具有RRs家族典型的D-D-K(由三部分组成,分别是天冬氨酸、天冬氨酸、赖氨酸的蛋白结构)结构域[3] (图 2)。
-
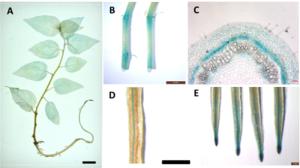
为了检测PtRRI基因在杨树发育上的作用,分析了A类PtRR基因在银腺杨无性系84K的两个时期(幼苗期和成熟植株)不同营养组织中的转录组数据,由图 3A可以看出:A类PtRR基因各成员之间在杨树2个生长发育时期的不同组织中表达量存在较大差异,同一个基因在不同发育时期和组织中的表达也存在较大差异。相对于杨树RRs家族其他成员,PtRRI在根部和木质部中表达量较高。用半定量PCR的方法验证毛白杨PtRRI基因的表达模式,结果与转录组数据一致(图 3B),从图中可以看出:PtRRI基因主要在根和木质部组织中表达,表明PtRRI可能参与了杨树木质部的发育过程。
-
为了深入研究PtRRI的表达模式,对其启动子驱动的GUS转基因植株进行了染色分析,图 4A显示:PtRRI主要在根里表达,并且集中在根尖分生区和维管束中(图 4D、E)。另外,在PPtRRI::GUS转基因杨树幼苗茎段也有GUS着色,主要集中在叶腋分生区(图 4B),对其进行解剖分析发现,GUS着色主要集中在形成层区域(图 4C),表明PtRRI可能与杨树维管系统发育密切相关。
-
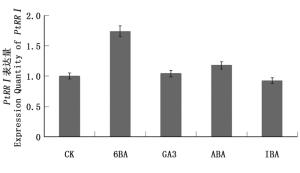
PtRRI作为细胞分裂素响应调节因子,可能参与了激素对植物生长发育的调控。用1 μmol·L-1 6-BA、100 μmol·L-1 ABA、1 μmol·L-1 GA3、1 μmol·L-1 IBA处理2.5 h后提取RNA,反转录后通过荧光定量PCR检测,结果(图 5)显示:6-BA处理下PtRRI表达量升高,GA3处理下PtRRI表达量略微升高,GA3处理下PtRRI表达量变化不显著,而IBA处理下PtRRI表达量略微下降,表明PtRRI基因受6-BA的调控,这与PtRRI作为细胞分裂素负反馈调节因子的理论一致。
-
不定根形成过程中需要生长素和细胞分裂素共同作用,PtRRI可能参与这个过程。因为promoter::GUS能很好地解析基因转录的动态变化,所以,对PPtRRI::GUS转基因植株进一步观察PtRRI在生根过程中的动态变化。在生根培养基内扦插后第1天的茎段切口处出现微弱的GUS信号(图 6A),第3天可以观察到GUS信号在切口处表达加强,集聚到根原基部位(图 6B),第5天GUS信号出现在愈伤基部(图 6c),第7天GUS信号在愈伤基部表达加强(图 6D),在扦插后第9天GUS信号在根基部较强,且集中在新生根根尖(图 6E)。实验过程表明:在不定根再生过程中,PtRRI主要在愈伤组织和根原基周边表达,生根后则在不定根的根尖,表明PtRRI可能参与了根部发育过程中的根源基的维持和愈伤组织的形成。
-
本研究在杨树最新基因组数据库中,利用拟南芥ARRs氨基酸序列Blastp进行搜索比对后,确定了9个杨树A类RRs基因家族成员。根据与拟南芥的对应关系命名,与以往的命名不同[11],分析蛋白保守结构域显示,PtRR家族氨基酸序列都具有典型的D-D-K结构域,它是证明蛋白属于RRs家族的主要依据[3],也表明了RRs家族成员虽然变异较大,但结构域非常保守,推测杨树的RRs家族与拟南芥相应家族有类似的功能。
通过不同组织中A类PtRR的转录组数据,分析了基因家族的表达模式。依据转录组数据筛选出在根部表达最强的PtRRI,PtRRI在系统进化上没有相对应的拟南芥ARR基因,其功能有待探究。通过构建PtRRI启动子GUS融合表达载体进一步研究PtRRI的组织表达模式,在转基因植株中GUS染色显示,PtRRI基因主要在杨树的根部和维管组织中表达,表明PtRRI可能参与了不定根和维管组织的发育。在拟南芥根部发育过程中,早已经明确了ARR基因家族的重要作用,与PtRRI在系统进化上最近的ARR8和ARR9的研究表明,其超表达植株对主根的生长作用很小,但是增加了侧根的数目;其它家族ARR成员超表达研究中,发现ARR3、ARR4、ARR5、ARR16和ARR17对主根生长起到重要促进作用,其中ARR3、ARR6、ARR15、ARR16和ARR17对侧根数目增加也起到重要作用[17]。在水稻中,也确定了细胞分裂素响应调节因子A类OsRR2基因和OsRR1基因对根系发育的重要作用[18-19],其中,OsRR2的表达受OsWOX11基因直接抑制,超表达OsWOX11基因的水稻表现为不定根生长的提前和数目的显著增多,OsWOX11基因突变后的水稻表现为不定根生长速度减缓和数目明显减少,OsRR2都直接参与OsWOX11基因调节不定根发育这些过程[18];OsRR1基因的表达直接受P2/ERF转录因子的CLR5蛋白调控,通过抑制细胞分裂素的信号转导,对不定根的发生起到促进作用[19]。这些结果也说明,不同物种的不同成员对根的发育具有不同的作用。
本研究根据对PtRRI启动子序列分析发现,启动子内含有为数众多的激素响应元件,推测PtRRI在根系发育过程中的作用可能与激素之间相互调节有关。不同激素处理对PtRRI转录的影响呈现差异进一步表明PtRRI基因功能可能参与了杨树根部发育过程中激素之间的相互作用,其中,细胞分裂素处理下的PtRRI转录水平提高,生长素处理下的PtRRI转录水平下降,正好符合A类RRs家族作为细胞分裂素负反馈调节因子这一特性。研究发现,在生长素和细胞分裂素相互作用来调控根部发育的过程,在根原基细胞中,受生长素调控的ARR5和ARR7对细胞分裂素具有负反馈调节作用,并且ARR7和ARR15只能表达在根源基的早期细胞中,依赖于A类ARR基因的这种时空表达模式,改变了不同阶段和部位细胞分裂素的浓度,从而对根部分生组织形态的维持起到重要作用[20-21]。进一步利用PtRRI启动子驱动的GUS基因的动态表达,发现PtRRI参与杨树不定根形成的具体过程,显示出在根源基形成时期表达升高,此时生长素作用减少,促进愈伤组织的形成;但分生组织分化时生长素上升[22],PtRRI表达减少,整个过程也与激素处理结果一致。
-
本研究鉴定确定了9个杨树A类RRs基因家族成员,根据与拟南芥的对应关系进行了新的命名,比以往的命名更加体现了与拟南芥ARR基因家族的系统进化关系,同时也为不同物种间相关成员功能研究提供了便利。组织表达分析发现,PtRRI在杨树根、叶和形成层呈现高表达,构建PtRRI启动子GUS融合表达进一步明确了PtRRI基因的表达模式,分析了PtRRI基因在生根过程中的表达水平,PtRRI转录受6-BA诱导,表明PtRRI可能参与了杨树根系发育过程。随着ARR基因家族在拟南芥中的功能深入研究,杨树作为世界上重要的林木和多年生模式植物,PtRR家族的功能有待进一步探究。研究杨树RRs家族功能以及PtRRI在杨树细胞分裂素信号转导途径中的作用和分子机制,对指导杨树分子育种,具有重要的科学理论和生产实践意义。
杨树PtRRI基因的组织特异性表达模式分析
Analysis of Tissue-specific Expression of Poplar PtRRI Gene
-
摘要:
目的 模式植物在木本植物中鉴定的许多重要调控因子家族在木本植物中出现了基因家族成员扩张, 但ARRs家族作为细胞分裂素响应调节因子在杨树基因组中成员数量反而减少, 其在木本植物中如何行使功能需要进一步研究。 方法 本研究通过生物信息学构建PtRRI启动子与GUS融合表达载体, 检测植物激素处理后PtRRI表达量和检测PPtRRI::GUS转基因植株在生根过程中GUS信号等方法, 对杨树PtRRI基因的组织特异性表达模式进行分析。 结果 表明:PtRRI在杨树根部、形成层、木质部表达量相对较高, PtRRI转录受6-BA激素诱导, 与其在不定根发育过程中激素调控下的表达相一致。 结论 PtRRI基因可能参与杨树的次级生长。 Abstract:Objective Many genes coding for important regulatory factors in model plant appears amplified numbers in woody plants. It is worth to be further investigated that the Class A ARR gene family, as a kind of cytokinin responsive factor, reduces its number in Populus. Method Based on the method of bioinformatics, the expression pattern of family members was analyzed by RNA-seq and semi-quantitative PCR, building PtRRI fused to GUS expression vector, Detecting the PtRRI expression in Populus alba×P. glandulosa clone after treated with 6-BA, GA3, ABA and IBA hormones and the GUS signals of PPtRRI::GUS transgenic plant in the process of rooting. Result The GUS signal in PPtRRI::GUS transgenic plants indicated that the PtRRI was mainly expressed in roots, cambium, xylem and this gene may involve in the secondary growth and the expression pattern during adventitious root formation. In addition, the PtRRI transcription expression was induced by 6-BA, which was consistent with its expression under hormone regulation during adventitious root development. Conclusion The results of this study suggest that PtRRs may involve in the process of secondary growth and development of Populus. -
Key words:
- Populus alba×P. glandulosa
- / PtRRI
- / promoter
- / expression analysis
-
表 1 基因、启动子和实时定量PCR分析所用的引物
Table 1. Primer sequences for amplification of PtRR, promoters and qPCR
引物 序列(5′-3′) 用途 PtRRI-F 5′-CACTCATCTCCTCACCGTGTTTGTTAG-3′ 半定量RT-PCR引物 PtRRI-R 5′-CAACGCTATCAATCACACTACTACCACG-3′ PtActin-F 5′-GATGACCCAGATCATGTTTG-3′ 半定量RT-PCR内参基因引物 PtActin-R 5′-TCCTTGCTCATCCTGTCAG-3′ ProPtRRI-F 5′-AGGAATGGGTAGGAGAGAAAGATG-3′ PtRRI启动子引物 ProPtRRI-R 5′-TACAATTCCACTAACGATGTGTCA-3′ -
[1] 罗超, 黄世文, 王菡, 等.细胞分裂素的生物合成、受体和信号转导的研究进展[J].特产研究, 2011, 33(2):71-75. doi: 10.3969/j.issn.1001-4721.2011.02.021 [2] Ferreira F J, Kieber J J. Cytokinin signaling[J]. Current Opinion in Plant Biology, 2005, 8(5):518-525. doi: 10.1016/j.pbi.2005.07.013 [3] Kakimoto T. Perception and signal transduction of cytokinins[J]. Annual Review of Plant Biology, 2003, 54(1):605-627. doi: 10.1146/annurev.arplant.54.031902.134802 [4] To J P, Haberer G, Ferreira F J, et al. Type-A Arabidopsis response regulators are partially redundant negative regulators of cytokinin signaling[J]. The Plant Cell, 2004, 16(3):658-671. doi: 10.1105/tpc.018978 [5] Ishida K, Yamashino T, Mizuno T. Expression of the cytokinin-induced type-A response regulator gene ARR9 is regulated by the circadian clock in Arabidopsis thaliana[J]. Bioscience, Biotechnology, and Biochemistry, 2008, 72(11):3025-3029. doi: 10.1271/bbb.80402 [6] Ishida K, Yamashino T, Yokoyama A, et al. Three Type-B Response Regulators, ARR1, ARR10 and ARR12, Play Essential but Redundant Roles in Cytokinin Signal Transduction Throughout the Life Cycle of Arabidopsis thaliana[J]. Plant Cell Physiology, 2008, (49):47-57. [7] Mason M G, Mathews D E, Argyros D A, et al. Multiple type-B response regulators mediate cytokinin signal transduction in Arabidopsis[J]. The Plant Cell, 2005, 17(11):3007-3018. doi: 10.1105/tpc.105.035451 [8] McClung C R. Plant circadian rhythms[J]. The Plant Cell, 2006, 18(4):792-803. doi: 10.1105/tpc.106.040980 [9] Werner T, Motyka V, Strnad M, et al. Regulation of plant growth by cytokinin[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(18):10487-10492. doi: 10.1073/pnas.171304098 [10] Leibfried A, To J P, Busch W, et al. WUSCHEL controls meristem function by direct regulation of cytokinin-inducible response regulators[J]. Nature, 2005, 438(7071):1172-1175. doi: 10.1038/nature04270 [11] Ramírez-Carvajal G A, Morse A M, Davis J M. Transcript profiles of the cytokinin response regulator gene family in Populus imply diverse roles in plant development[J]. New Phytologist, 2008, 177:77-89. [12] Ramírez-Carvajal G A, Morse A M, Dervinis C, et al. The Cytokinin Type-B Response Regulator PtRR13 Is a Negative Regulator of Adventitious Root Development in Populus[J]. Plant Physiology, 2009, 150(2):759-771. doi: 10.1104/pp.109.137505 [13] Thompson J D, Gibson T J, Plewniak F, et al. The CLUSTAL_X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Research, 1997, 25:4876-4882. doi: 10.1093/nar/25.24.4876 [14] Tamura K, Dudley J, Nei M, et al. MEGA4:molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Molecular Biology and Evolution, 2007, 24(24):1596-1599. [15] 舒文波, 赵树堂, 章晶晶, 等.超量表达FBL1对84K杨根系和生长量影响研究[J].林业科学研究, 2015, 28(6):871-876 doi: 10.3969/j.issn.1001-1498.2015.06.017 [16] Shu W, Liu Y, Guo Y, et al. A Populus TIR1 gene family survey reveals differential expression patterns and responses to1-naphthaleneacetic acid and stress treatments[J]. Frontiers in Plant Science, 2015, 6:719. doi: 10.3389/fpls.2015.00719 [17] Ren B, Liang Y, Deng Y, et al. Genome-wide comparative analysis of type-A Arabidopsis response regulator genes by overexpression studies reveals their diverse roles and regulatory mechanisms in cytokinin signaling[J]. Cell Research, 2009, 19(10):1178-1190. doi: 10.1038/cr.2009.88 [18] Zhao Y, Hu Y, Dai M, et al. The Wuschel-related homeobox gene WOX11 is required to activate shootborne crown root revelopment in rice[J]. The Plant Cell, 2009, 21(3):736-748. doi: 10.1105/tpc.108.061655 [19] Kitomi Y, Ito H, Hobo T, et al. The auxin responsive AP2/ERF transcription factor crown rootless5 is involved in crown root initiation in rice through the induction of OsRR1, a type-A response regulator of cytokinin signaling[J]. The Plant Journal, 2011, 67(3):472-484. doi: 10.1111/j.1365-313X.2011.04610.x [20] Beemster G T S, Baskin T I. STUNTED PLANT 1 Mediates Effects of Cytokinin, But Not of Auxin, on Cell Division and Expansion in the Root of Arabidopsis[J]. Plant Physiology, 2000, 124(4):1718-1727. doi: 10.1104/pp.124.4.1718 [21] Müller B1, Sheen J. Cytokinin and auxin interaction in root stem-cell specification during early embryogenesis[J]. Nature, 2008, 453(7198):1094-1097. doi: 10.1038/nature06943 [22] Wang Y, Wang J, Shi B, et al. The Stem Cell Niche in Leaf Axils Is Established by Auxin and Cytokinin in Arabidopsis[J]. The Plant Cell, 2014, 26(5):2055-2067. doi: 10.1105/tpc.114.123083 -





 下载:
下载: