-
植物在整个生长过程中经常会遭受洪涝、干旱、低温、高温和盐渍等非生物胁迫,严重影响植物生长发育,甚至导致植株死亡[1]。盐生植物能在盐碱地上正常生长发育,利用盐生植物改良盐碱土壤具有重要意义。柽柳是一种抗逆能力非常强的木本盐生植物,能在含盐量1%的盐碱地上形成自然林,是进行耐盐机制研究和耐盐基因克隆的理想材料[2]。
在植物生长发育的整个生命过程中,Ca2+作为植物细胞信号转导途径的第二信使,几乎调控了植物所有的生理生化反应过程[3-4]。钙离子信号感受器主要分为响应型感受器和依赖型感受器,其中,植物体内的响应型感受器主要为钙离子依靠蛋白激酶CDPK,它具有蛋白激酶活性,通过与钙离子结合改变自身分子构象,实现其功能和作;然而,依赖型感受器本身却不具有酶活性,与钙离子结合后只能依靠与其他的蛋白激酶发生相互作用而实现其功能作用。在植物中这样的依赖型感受器主要有二种:一种是钙调素(CaM);另一种是植物中特有的钙调磷酸酶B类似蛋白(CBL)[4]。
据报道,CBL家族在玉米的基因组中共有10个基因,其中,ZmCBL6、ZmCBL8、ZmCBL10分布于1号染色体上,ZmCBL3、ZmCBL4、ZmCBL7分布于3号染色体上,ZmCBL2、ZmCBL5、ZmCBL9分别分布在4、6、9、10号染色体上,在2、5、7、8号染色体上未发现CBL基因的分布[5]。在谷子SiCBL基因研究中发现,SiCBL4、SiCBL6、SiCBL7分布于5号染色体[6],该家族基因在染色体上的分布是不定向、不均匀的。然而,CBL蛋白作为植物所特有的钙离子信号感受器,它的结构中含有典型的与钙离子结合的结构域(即EF手型结构)和豆蔻酰化位点[7]。豆蔻酰化是一种翻译后的修饰作用,主要发生在CBL蛋白N端的第2个氨基酸(甘氨酸残基)位点处,促进了CBL蛋白与细胞膜上离子载体的相互作用[8-9]。
以往研究证明,CBL4基因具有抗旱耐盐能力[10]。如Kudla等[11]发现,在50 mmol·L-1 NaCl处理后,转AtCBL4基因拟南芥植株的表型和根长都明显优于野生型。Liu等[12]研究发现,AtCBL4基因在拟南芥耐盐胁迫应答中发挥重要作用。在拟南芥中,AtCBL4基因通过形成AtCBL4/SOS3-ATCIPK24/SOS2-SOS1调控通路从而参与根部耐盐调控[10]。Martínez-Atienza等[13]研究发现, 水稻(Oryza.sativa L.)OsCBL4与AtCBL4具有较高的同源性,存在与拟南芥SOS途径结构类似的信号系统,同样主要参与植物根部的耐盐调控[14]。这也是目前研究最明确的一条耐盐途径,其中,CBL4基因是该调控通路的起始信号基因,承载着整个信号途径转录翻译的信号传递。因此,在盐生植物刚毛柽柳中研究CBL4基因的耐盐功能以及其进一步的调控网络具有重要意义。
本研究从刚毛柽柳(Tamarix hispida)中克隆获得ThCBL4基因,利用实时荧光定量RT-PCR分析了ThCBL4基因响应不同非生物处理(高盐、干旱、ABA信号)后的表达模式,进一步构建了ThCBL4基因过表达载体(pROKII-ThCBL4)、抑制表达载体(pFGC5941-ThCBL4),将其在刚毛柽柳中瞬时表达,分析比较过表达、抑制表达ThCBL4基因刚毛柽柳和对照刚毛柽柳(转pROKII空载体)耐盐生理指标和生理染色情况,以初步鉴定ThCBL4基因功能。该研究为进一步分析刚毛柽柳耐盐机制和利用基因工程手段提高植物耐盐能力奠定理论基础。
-
植物材料的种植与胁迫处理参照Gao等方法[2],具体步骤为:将刚毛柽柳种子播种于塑料筐中,栽培基质为2:1(v/v)的泥炭土和砂子混合基质。温室中培养,温室平均温度控制在24℃,光暗周期14 h/10 h,相对湿度70%75%。2个月生刚毛柽柳幼苗分别用0.4 mol·L-1 NaCl、20%(w/v)PEG6000和100 μmol·L-1 ABA溶液进行浇灌处理,处理时间分别为6、12、24、48、72 h。同时以正常浇水刚毛柽柳材料为对照。胁迫处理后分别取刚毛柽柳根部和叶部组织。经液氮速冻后,保存于-80℃冰箱用于RNA的提取。
-
以“Calcineurin B-like protein”作为关键词,对实验室前期构建的刚毛柽柳7个转录组的Unigenes BLAST比对结果进行查找,获得ThCBL4基因cDNA序列,通过ORF founder(http://www.ncbi.nlm.nih.gov/gorf.htmL)程序,综合BLASTX比对结果确定其开放读码框,选择具有完整ORF的ThCBL4基因设计引物,引物序列为:ThCBL4-F:5’GCTCTAGAATGGGTTGTGGGCGGTCAAAG3’; ThCBL4-R:5’GGTACCCCGTCACTTCTGCTGTCGGACCGGACT3’。以刚毛柽柳cDNA为模板进行RT-PCR,进一步测序确定所获得的ThCBL4基因序列。对克隆获得的ThCBL4基因进行序列分析,用ProtParam(http://au.expasy.org/tools/protparam.html)软件计算推导ThCBL4基因编码蛋白质的分子量及理论等电点。在NCBI上对刚毛柽柳ThCBL4基因进行氨基酸序列同源比较,选取刚毛柽柳ThCBL4基因与拟南芥AtCBL全家族的10个CBL蛋白序列进行分析,利用Bioedit软件进行多序列比较,并利用MEGA软件邻接法Neighbor-Joining(NJ)预测系统发生树。这10个拟南芥CBL基因分别是AtCBL1(AT4G17615.1)、AtCBL2(AT5G55990)、AtCBL3(AT4G26570)、AtCBL4(AT5G24270.1)、AtCBL5(AT4G01420)、AtCBL6(AT4G16350)、AtCBL7(AT4G26560)、AtCBL8(AT1G64480)、AtCBL9(AT5G47100)和AtCBL10(AT4G33000)。
-
利用CTAB法提取刚毛柽柳不同组织总RNA,经DNase Ⅰ (Promega)消化处理,去除DNA污染。分别取1 μg总RNA进行反转录,反转录反应体系和操作参照Primer ScriptTM RT Reagent Kit(Perfect Real Time) (Takara)说明。实时定量RT-PCR体系及反应程序参照Gao等方法[2]。将反转录产物稀释10倍,用作Real time RT-PCR反应模板。选择刚毛柽柳β-tubulin、α-tubulin和β-Actin基因作为内参基因。内参和ThCBL4基因的定量PCR引物见表 1。Real time RT-PCR反应体系为20 μL,其中包括模板2 μL,基因特异性上下游引物各1 μL(10 μmol·L-1)和2×Power SYBR Green PCR master mix 10 μL。反应程序为95℃预变性30 s;95℃变性15 s,58℃退火15 s,72℃延伸30 s,80℃读板1 s,45个循环;72℃延伸7 min。3次重复。反应在MJ OpticonTM2仪器(BioRad Hercules.CA. USA.)上完成。实时定量RT-PCR数据利用2-△△Ct法进行分析[15]。
表 1 实时定量RT-PCR引物序列
Table 1. The primers sequences of Real time RT-PCR
基因
Gene正向引物(5’-3’)
Forward prime(5’-3’)反向引物(5’-3’)
reverse prime(5’-3’)ThCBL4 CAATTTGCCTTATTCAGGAAT CCACTATGCTCCCAACGATCT Actin AAACAATGGCTGATGCTG ACAATACCGTGCTCAATAGG α-tubulin CACCCACCGTTGTTCCAG ACCGTCGTCATCTTCACC β-tubulin GGAAGCCATAGAAAGACC CAACAAATGTGGGATGCT -
选择生长一致的1个月大刚毛柽柳组培苗,将构建好的ThCBL4基因过表达载体EHA105(pROKⅡ-ThCBL4)、抑制表达载体EHA105(pFGC5941-ThCBL4)和空载体EHA105(pROKⅡ)(对照)分别瞬时侵染刚毛柽柳,瞬时侵染方法参照Zang等描述[16]。利用实时定量RT-PCR技术分析3种瞬时转化刚毛柽柳中ThCBL4基因的表达。比较瞬时表达刚毛柽柳在逆境胁迫前后的生理染色(DAB、NBT、Evans blue染色)和胁迫相关生理指标(POD、SOD活性和MDA含量)[16]。
-
经转录组序列查找和进一步的RT-PCR克隆验证,证实克隆获得了刚毛柽柳ThCBL4基因,其cDNA长度为1 432 bp,其中,开放阅读框长675 bp,编码224个氨基酸,编码蛋白的分子量为25.57 kDa,理论等电点为5.0。Pfam分析结果表明:刚毛柽柳ThCBL4基因具有1个典型FRQ1 Multi-domain结构域,3个典型EF-Hand结构域,2个Ca2+结合位点结构域。
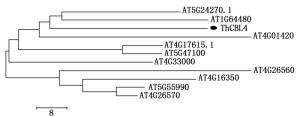
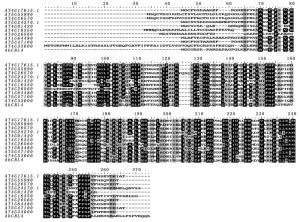
利用BioEdit软件和MEGA软件分别对刚毛柽柳ThCBL4蛋白序列与10条拟南芥CBL4蛋白序列进行多序列比对和系统进化分析,11条CBL蛋白序列除C端前70个氨基酸序列和N端后15个氨基酸序列不一致,其余序列都相对保守(图 1)。3个EF-Hand结构域也相对保守,氨基酸序列一致性在64% 76%,其中,刚毛柽柳ThCBL4基因与拟南芥AtCBL4基因蛋白同源性最高,氨基酸序列一致性为76%,因此,本研究克隆获得的刚毛柽柳ThCBL基因命名为ThCBL4。
根据进化树分析,拟南芥AtCBL家族组分为4组,Ⅰ组有AtCBL4(AT5G24270.1)、AtCBL8(AT1G64480)和AtCBL5(AT4G01420);Ⅱ组有AtCBL1(AT4G17615.1)和AtCBL9(AT5G47100);Ⅲ组有AtCBL10(AT4G33000);Ⅳ组由AtCBL7(AT4G26560)、AtCBL6(AT4G16350)、AtCBL2(AT5G55990)和AtCBL3(AT4G26570)组成。刚毛柽柳ThCBL4与拟南芥AtCBL4和AtCBL8亲缘关系较近,归为一组(图 2)。
-
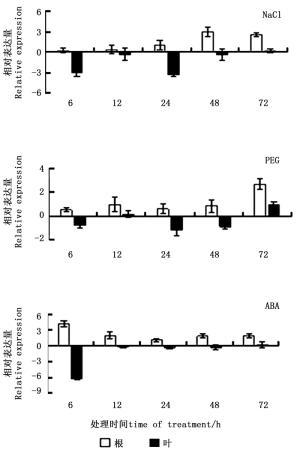
NaCl胁迫下,根中ThCBL4基因的表达主要为上调表达,但胁迫初期差异不明显,至胁迫48 h时,表达量最高(达对照的8.01倍);叶组织中ThCBL4基因表达主要表现为明显受抑制,胁迫24 h表达量最低,仅为对照的10.5%。与NaCl胁迫类似,PEG胁迫下,根中主要表现为上调表达,但胁迫初期表达量变化不明显,至胁迫72 h表达量最高(达对照的6.40倍);叶中则相反,ThCBL4基因表达主要表现为下调表达,但表达量变化不显著。ABA处理后,ThCBL4基因的表达能作出快速应答,根中ThCBL4基因表达主要为上调表达,处理6 h表达量即达最高,为对照的17.03倍;叶中ThCBL4基因表达主要为下调表达,处理6 h表达量即达最低,仅为对照的1.3%。以上结果表明,ThCBL4基因能对这3种处理作出应答,但表达模式不完全相同(图 3)。
-
为了进一步分析ThCBL4基因的抗逆功能,将ThCBL4基因的过表达载体pROKII-ThCBL4、抑制表达载体pFGC5941-ThCBL4进行刚毛柽柳瞬时转化,同时以pROKII瞬时侵染刚毛柽柳为对照,分析比较3种刚毛柽柳在逆境胁迫后ThCBL4基因表达、生理染色和生理指标情况。
-
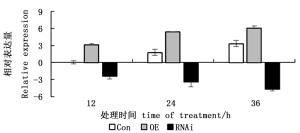
提取150 mmol·L-1 NaCl胁迫12、24、36 h后3种瞬时转化刚毛柽柳总RNA,反转录成cDNA后进行实时定量RT-PCR分析。图 4表明:所有的胁迫时间点,3种瞬时转化刚毛柽柳中,ThCBL4基因在瞬时过表达(OE)株系中的表达量都最高,在抑制表达(RNAi)株系中都最低。表明已成功获得了瞬时过表达和抑制表达ThCBL4基因刚毛柽柳植株。
-
NaCl胁迫后,NBT和DAB染色结果显示:瞬时过表达ThCBL4刚毛柽柳的O2·-和H2O2含量明显低于对照(图 5),RNAi植株的O2·-和H2O2含量明显高于对照植株。表明盐胁迫下过表达ThCBL4植株中ROS积累少于对照植株,ThCBL4基因RNAi植株中ROS积累则高于对照。Evans blue染色和MDA含量测定结果表明:NaCl胁迫后,与对照株系相比,过表达ThCBL4植株中细胞受损程度较轻,细胞死亡量较少;抑制表达ThCBL4植株中细胞受损程度较重,细胞死亡量较多。NaCl胁迫下,过表达ThCBL4刚毛柽柳可增强转基因刚毛柽柳细胞内清除活性氧能力,促使sO2-·和H2O2的积累减少,从而减少细胞受损或细胞死亡,增强植物的抗逆性,提示ThCBL4基因可能是一个耐盐能力优良的候选基因。
-
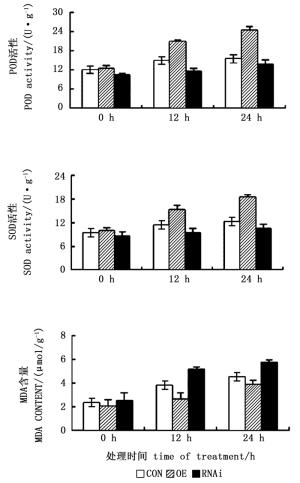
NaCl胁迫后,瞬时过表达ThCBL4基因株系中POD、SOD的活性强于对照,ThCBL4基因RNAi株系中POD、SOD活性弱于对照,且2种保护酶的活性在NaCl胁迫24 h均高于12 h(图 6),表明过表达ThCBL4基因植株中的POD、SOD活性较强,在盐害的环境下能够起到调节作用,具有很好的抗盐害作用。盐胁迫下,MDA含量变化趋势与SOD活性和POD活性变化趋势相反。在所研究的所有时间点均表现为过表达ThCBL4基因株系中MDA含量最低,抑制表达ThCBL4基因株系中MDA含量最高。与胁迫12 h的MDA含量相比,24 h时3个转基因刚毛柽柳株系的MDA含量均不同程度的增大,表明抑制表达ThCBL4基因株系中细胞受损程度高和死亡数量大,过表达ThCBL4基因株系中细胞受损程度低,死亡数量较少。
-
在逆境胁迫条件下,植物体内的钙离子浓度发生变化,钙离子结合蛋白感应到细胞内的Ca2+发生了浓度改变,把钙信号传递给其他信号途径的蛋白激酶,激活细胞内的一系列生理生化反应从而抵制各种逆境胁迫造成的伤害[17]。CBL是植物中最近发现的一类Ca2+结合蛋白,在植物抵制干旱、盐渍、低温等逆境胁迫中起重要调节作用[18]。本研究从刚毛柽柳中克隆获得ThCBL4基因,该基因与拟南芥AtCBL4基因亲缘关系较近。蛋白序列分析发现,CBL家族整体序列比较保守,与其他CBL蛋白一样,ThCBL蛋白也含有3个能和Ca2+结合的EF-hand结构和豆蔻酰化位点,而且ThCBL4还含有1个Ca2+结合蛋白结构域2个Ca2+结合位点,说明它们能够很好的与钙离子进行结合,而且可被豆蔻酰化,提高植物的盐敏感能力。
NaCl、PEG和ABA处理后,刚毛柽柳中ThCBL4基因的表达量发生了明显改变,在根中主要为上调表达,在叶中主要为下调表达,尤其在ABA激素处理后,根和叶中都能作出快速应答,表明ThCBL4基因能对盐、干旱和ABA处理做出响应。玉米(Zea mays)ZmCBL4基因在NaCl和PEG处理24 h后,ZmCBL4基因的表达量达到了最大值,并且该基因的过表达转基因拟南芥显著提高了植物的耐盐性[19]。对梨PbCBL家族进行研究发现,PbCBL4基因对NaCl、PEG、ABA这3种胁迫均产生响应[20]。其他植物的CBL家族的其它基因也能响应这3种信号途径,如拟南芥AtCBL1和AtCBL9在干旱和NaCl处理时其表达量均被强烈诱导[10],拟南芥AtCBL10主要受盐诱导[21];AtCBL9在ABA信号和ABA合成途径中起重要作用,并且主要在幼苗期参与拟南芥对逆境的胁迫应答[22]。因此,推测刚毛柽柳ThCBL4基因也可能参与了抗旱耐盐胁迫应答。
进一步的瞬时过表达、抑制表达ThCBL4基因刚毛柽柳和对照刚毛柽柳的盐和干旱胁迫耐受性比较发现,瞬时过表达ThCBL4基因刚毛柽柳在盐和干旱胁迫后,通过增加POD、SOD酶活性来增强转基因刚毛柽柳细胞内清除活性氧能力,促使O2·-和H2O2的积累减少,从而减少细胞受损或细胞死亡,表明ThCBL4基因的过表达提高了刚毛柽柳对盐胁迫的应答能力。
林木的遗传转化周期较长,通过转基因的方法过表达和RNAi抑制表达目的基因,用来研究基因的抗逆功能和抗逆机制较难、花费的时间较长。本研究采用的瞬时转化体系是一种快速有效的遗传转化方法,对林木基因功能研究具有重要意义,已经在柽柳、白桦和杨树等木本植物中使用。如Wang等[23]利用该技术证实了杨树(Populus trichocarpa)PtrGT10基因能提高转基因植物的抗渗透胁迫能力;Zhang等[24]证实,在白桦中成功获得了瞬时过表达和抑制表达CCR基因植株。在柽柳中,目前已通过该方法证实了多个基因具有抗逆能力,并利用稳定转化拟南芥等其他方法证实该方法的有效性,如bHLH[25]、ThVHAc1[26]、ThGSTZ1[27]、ThZFP1[16]等。此外,该方法在菜心(Brassica campestris L. ssp. chinensis var. utilis Tsen et Lee)等植物中也有应用[28]。
-
本研究从刚毛柽柳中克隆获得了一条ThCBL4基因,该基因cDNA长度为1 432 bp,编码区长度675 bp,编码224个氨基酸,编码蛋白分子量为25.57 kDa,理论等电点为5.0。该基因能对3种胁迫处理(NaCl、PEG、ABA)做出应答,可能参与了刚毛柽柳抗旱耐盐胁迫应答。进一步分析发现,150 mmol·L-1 NaCl胁迫后,瞬时过表达ThCBL4基因通过提高植株的保护酶活性,降低活性氧氧化程度和细胞损伤的程度,从而提高了转基因刚毛柽柳的耐盐能力,瞬时抑制表达ThCBL4基因得出了与之相反的结果。因此,初步表明ThCBL4基因的表达提高了刚毛柽柳对盐的耐受性。后续研究中,将进一步对该基因的耐盐机制进行分析。
瞬时过表达ThCBL4基因提高刚毛柽柳耐盐能力
A Novel Calcineurin B-like Proteins Gene (ThCBL4) Improving the Salt Tolerance in Transient Overexpression Tamarix hispida
-
摘要:
目的 本研究拟从刚毛柽柳(Tamarix hispida)中克隆获得1个ThCBL4基因,研究该基因的耐盐功能。 方法 以"Calcineurin B-like protein"作为关键词,对实验室前期构建的刚毛柽柳转录组序列进行比对查找获得ThCBL4基因cDNA序列,并通过RT-PCR和测序验证克隆获得的ThCBL4基因序列。利用生物信息学工具进行序列分析。利用Real time RT-PCR分析了0.4 mol·L-1 NaCl、20%(w/v)PEG6000和100 μmol·L-1 ABA胁迫处理后ThCBL4基因在刚毛柽柳根和叶中的表达情况。为了进一步分析ThCBL4基因的耐盐功能,构建了植物过表达载体pROKⅡ-ThCBL4,抑制表达载体pFGC5941-ThCBL4,并进行柽柳瞬时转化,同时以pROKⅡ瞬时侵染柽柳作为对照。分析比较NaCl胁迫后瞬时转化柽柳POD、SOD酶活性、MDA含量和DAB、NBT及Evans blue染色情况,以综合评定ThCBL4基因的耐盐功能。 结果 ThCBL4基因cDNA长度为1 432 bp,编码区长度675 bp,编码224个氨基酸,编码蛋白分子量为25.57 kDa,理论等电点为5.0。3种不同环境处理后,ThCBL4基因在刚毛柽柳根中均为上调表达,在刚毛柽柳叶中均为下调表达。对盐胁迫后瞬时表达柽柳ThCBL4基因的表达分析显示,成功获得瞬时过表达(标记为OE)、抑制表达(标记为RNAi)转基因株系。进一步的生理指标和生理染色结果显示,盐胁迫下过表达ThCBL4植株的保护酶类SOD与POD活性明显高于对照和抑制表达株系。NBT和DAB染色结果显示,过表达植株的O2·-和H2O2含量明显低于对照,抑制表达植株的O2·-和H2O2含量明显高于对照;而Evans blue染色和MDA含量测定结果显示,与对照相比,过表达ThCBL4植株着色更浅、MDA含量更低,而抑制表达ThCBL4植株着色更深、MDA含量更高。 结论 ThCBL4基因可能参与了刚毛柽柳的耐盐胁迫应答,瞬时过表达ThCBL4基因通过提高植株的保护酶活性,降低活性氧氧化程度和细胞损伤的程度,从而提高了转基因刚毛柽柳的耐盐能力。 Abstract:Objective It is reported that the Calcineurin B-like proteins (CBLs) play important roles in the regulating plant growth and stress tolerant. In this study, a CBL gene (ThCBL4) was cloned from Tamarix hispida. And the salt tolerance function of ThCBL4 was studied. Method The word "Calcineurin B-like protein" was used as a query to search against the functional annotation of non-redundant unigenes based on the previous constructed T. hispida transcriptomes for identification of the ThCBL4. The expression patters of ThCBL4 genes in the roots and leaves of T. hispida under 0.4 mol·L-1 NaCl, 20%(w/v)PEG6000 and 100 μmol·L-1 ABA treatment by using the real time RT-PCR. Furthermore, the plant overexpression vector and knockdown vector were constructed and transient transformed into T. hispida. At the same time, the vector pROKⅡ was also transient infected into T. hispida as a control. The MDA contents, POD, SOD activities and DAB, NBT and Evans blue staining under NaCl stress were measured and compared among the pROKⅡ-ThCBL4 transient transformed T. hispida, ThCBL4 knockdown transient transformed T. hispida and the control. Result The cDNA length of ThCBL4 was 1 432 bp, containing a length of 675 bp open reading frame encoding 224 amino acids. The relative molecular weight of ThCBL4 protein was 25.57 KDa, with isoelectric point 5.0. The expressions of ThCBL4 in T. hispida were upregulated in roots and downregualted in the leaves under NaCl, PEG or ABA stress conditions. Furthermore, the relative expression levels of ThCBL4 among three transient expression lines was the highest in the overexpression lines while the lowest in the knockdown transient expression lines. The results of physiological indicators and physiological staining showed that the protective enzymes SOD and POD activity in ThCBL4 overexpression plants were significantly higher than the control and suppression of expression lines under salt stress. NBT and DAB staining showed that the O2- and H2O2 contents in overexpression plants were significantly lower than the control. On the contrary, the O2- and H2O2 contents in the inhibited expression lines were significantly higher than the control. At the same times, Evans blue staining and MDA assay results showed that the ThCBL4 overexpressing plants colored more shallow compared with the control, MDA contents is lower than the control, and colored deeper and higher content of MDA in the inhibited expression of ThCBL4 plants. These results showed that the protective enzyme activities of ThCBL4 transient overexpression lines were higher than the control, the active oxygen contents were lower, and the degree of cell injury were lighter. Conclusion The transient overexpression of ThCBL4 lines increased the salt tolerance, and ThCBL4 gene may be involved in the response to salt stress in T. hispida. In the future, its function and the regulation mechanism need to be further studied. -
Key words:
- Tamarix hispida
- / ThCBL4 gene
- / gene expression
- / salt tolerance
-
表 1 实时定量RT-PCR引物序列
Table 1. The primers sequences of Real time RT-PCR
基因
Gene正向引物(5’-3’)
Forward prime(5’-3’)反向引物(5’-3’)
reverse prime(5’-3’)ThCBL4 CAATTTGCCTTATTCAGGAAT CCACTATGCTCCCAACGATCT Actin AAACAATGGCTGATGCTG ACAATACCGTGCTCAATAGG α-tubulin CACCCACCGTTGTTCCAG ACCGTCGTCATCTTCACC β-tubulin GGAAGCCATAGAAAGACC CAACAAATGTGGGATGCT -
[1] Wang W, Vinocur B, Altman A. Plant responses to drought, salinity and extreme temperatures:towards genetic engineering for stress tolerance[J]. Planta, 2003, 218(1):1-14. doi: 10.1007/s00425-003-1105-5 [2] Gao C, Wang Y, Liu G, et al. Cloning of ten peroxidase (POD) genes from Tamarix hispida and characterization of their responses to abiotic stress[J]. Plant Molecular Biology Reports, 2010, 28(1):77-89. doi: 10.1007/s11105-009-0129-9 [3] Luan S, Kudla J, Rodriguez-Concepcion M, et al. Calmodulins and calcineurin B-like proteins calcium sensors for specific signal response coupling in plants[J]. The Plant Cell, 2002, 14(suppl):S389-S400. [4] Ma B J, Gu Z M, Tang H J, et al. Preliminary study on the function of calcineurin B-like protein gene OsCBL8 in rice[J]. Rice Science, 2010, 17(1):10-18. doi: 10.1016/S1672-6308(08)60099-2 [5] 李利斌, 刘开昌, 王殿峰, 等.玉米CBL基因的生物信息学分析[J].玉米科学, 2010, 18(1):6-11. [6] 赵晋锋, 余爱丽, 田岗, 等.谷子CBL基因鉴定及其在干旱、高盐胁迫下的表达分析[J].作物学报, 2013, 39(2):360-367. [7] Lewit-Bentley A, Réty S. EF-hand calcium-binding proteins[J]. Current Opinion in Structural Biology, 2000, 10(6):637-643. doi: 10.1016/S0959-440X(00)00142-1 [8] Kolukisaoglu ü, Weinl S, Blazevic D, et al. Calcium sensors and their interacting protein kinases:genomics of the Arabidopsis and rice CBL-CIPK signaling networks[J]. Plant Physiology, 2004, 134(1):43-58. doi: 10.1104/pp.103.033068 [9] Ishitani M, Liu J, Halfter U, et al. SOS3 function in plant salt tolerance requires N-myristoylation and calcium binding[J]. Plant Cell, 2000, 12(9):1667-1678. doi: 10.1105/tpc.12.9.1667 [10] Cheong Y H, Kim K N, Pandey G K, et al. CBL1, a calcium sensor that differentially regulates salt, drought, and cold responses in Arabidopsis[J]. The Plant Cell, 2003, 15(8):1833-1845. doi: 10.1105/tpc.012393 [11] Kudla J, Xu Q, Harter K, et al. Genes for calcineurin B-like proteins in Arabidopsis are differentially regulated by stress signals[J]. Proceedings of the National Academy of Sciences, 1999, 96(8):4718-4723. doi: 10.1073/pnas.96.8.4718 [12] Liu J, Zhu J K. A calcium sensor homolog required for plant salt tolerance[J]. Science, 1998, 280(5371):1943-1945. doi: 10.1126/science.280.5371.1943 [13] Martínez-Atienza J, Jiang X, Garciadeblas B, et al. Conservation of the salt overly sensitive pathway in rice[J]. Plant Physiology, 2007, 143(2):1001-1012. [14] Hashimoto K, Eckert C, Anschutz U, et al. Phosphorylation of calcineurin B-like (CBL) calcium sensor proteins by their CBL-interacting protein kinases (CIPKs) is required for full activity of CBL-CIPK complexes toward their target proteins[J]. Journal of Biological Chemistry, 2012, 287(11):7956-68. doi: 10.1074/jbc.M111.279331 [15] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4):402-408. doi: 10.1006/meth.2001.1262 [16] Zang D, Wang C, Ji X, et al. Tamarix hispida zinc finger protein ThZFP1 participates in salt and osmotic stress tolerance by increasing proline content and SOD and POD activities[J]. Plant Science, 2015, 235:111-121. doi: 10.1016/j.plantsci.2015.02.016 [17] Batistic O, Kudla J. Plant calcineurin B-like proteins and their interacting protein kinases[J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2009, 1793(6):985-992. doi: 10.1016/j.bbamcr.2008.10.006 [18] Sanyal S K, Kanwar P, Yadav A K, et al. Arabidopsis CBL interacting protein kinase 3 interacts with ABR1, an APETALA2 domain transcription factor, to regulate ABA responses[J]. Plant Science, 2017, 254:48-59. doi: 10.1016/j.plantsci.2016.11.004 [19] Wang M, Gu D, Liu T, et al. Overexpression of a putative maize calcineurin B-like protein in Arabidopsis confers salt tolerance[J]. Plant Molecular Biology, 2007, 65(6):733-746. doi: 10.1007/s11103-007-9238-8 [20] 许园园, 蔺经, 李晓刚, 等.梨CBL基因家族全基因组序列的鉴定及非生物胁迫下的表达分析[J].中国农业科学, 2015, 48(4):735-747. [21] Quan R, Lin H, Mendoza I, et al. SCABP8/CBL10, a putative calcium sensor, interacts with the protein kinase SOS2 to protect Arabidopsis shoots from salt stress[J]. The Plant Cell, 2007, 19(4):1415-1431. doi: 10.1105/tpc.106.042291 [22] Pandey G K, Cheong Y H, Kim K N, et al. The calcium sensor calcineurin B-like 9 modulates abscisic acid sensitivity and biosynthesis in Arabidopsis[J]. The Plant Cell, 2004, 16(7):1912-1924. doi: 10.1105/tpc.021311 [23] Wang Z, Liu Q, Wang H, et al. Comprehensive analysis of trihelix genes and their expression under biotic and abiotic stresses in Populus trichocarpa[J]. Scientific Reports, 2016, 6:36274. doi: 10.1038/srep36274 [24] Zhang Y, Wang Y, Wang C. Gene overexpression and gene silencing in Birch using an Agrobacterium -mediated transient expression system[J]. Molecular Biology Reports, 2012, 39(5):5537-5541. doi: 10.1007/s11033-011-1357-2 [25] Ji X, Nie X, Liu Y, et al. A bHLH gene from Tamarix hispida improves abiotic stress tolerance by enhancing osmotic potential and decreasing reactive oxygen species accumulation[J]. Tree Physiology, 2016, 36(2):193-207. [26] Yang G, Wang C, Wang Y, et al. Overexpression of ThVHAc1 and its potential upstream regulator, ThWRKY7, improved plant tolerance of Cadmium stress[J]. Scientific Reports, 2016, 6:18752. doi: 10.1038/srep18752 [27] Yang G, Wang Y, Xia D, et al. Overexpression of a GST gene (ThGSTZ1) from Tamarix hispida, improves drought and salinity tolerance by enhancing the ability to scavenge reactive oxygen species[J]. Plant Cell, Tissue and Organ Culture (PCTOC), 2014, 117(1):99-112. doi: 10.1007/s11240-014-0424-5 [28] Zhong L, Zhang Y, Liu H, et al. Agrobacterium -mediated transient expression via root absorption in flowering Chinese cabbage[J]. Springerplus, 2016, 5(1):1825. doi: 10.1186/s40064-016-3518-1 -




 下载:
下载: