-
近几十年来,施肥、滥砍滥伐和化石燃料燃烧等人为因素导致陆地生态系统中活性氮大幅增加[1],氮沉降及其生态效应成为生态学领域研究热点之一。内蒙古自治区磴口县位于我国西部的乌兰布和沙漠东北缘,当地土壤类型主要为灰棕漠土,土壤中全氮和硝态氮含量极为缺乏[2],氮素是当地生态系统初级生产力的主要因子之一[3]。而随着氮沉降的持续增加[4],氮素对植被生长的影响日益明显[5]。大量研究表明外源氮素添加能够有效地影响植株的养分利用率,缓解植物的养分限制,促进植被的生长[6-7]。
芽库是指所有具有营养繁殖能力的芽的集合[8],其空间分布和季节动态是决定无性繁殖植物克隆结构和生长策略的重要机制[9]。植物可以通过延迟或提前形成无性系分株的时间[10],更好地利用资源。而芽库的垂直分布可以保证植物在受到强烈干扰后的更新能力[8]。大量研究表明,植物可以通过改变芽库物候、出芽率和分蘖能力来响应放牧、火烧和水分等环境因子的干扰[11-12],通常容量较大的芽库能更好的适应环境变化[13]。此外,不同地域和不同物种芽库的组成结构、季节动态具有一定的差异[9, 14]。因此,芽库在植物适应环境、繁殖更新和抵抗干扰等方面意义重大[15]。目前,国内外主要关注多年生草本植物的芽库研究[10, 16],而有关木本植物芽库的研究鲜有报道[17]。木本植物通常不具有地下芽库,干扰后由地上部分萌枝[18],其地上芽库动态与空间分布决定了植物的枝系构型[19]、无性繁殖更新和资源利用方式[8]。唐古特白刺(Nitraria tangutorum Bobr.),多年超旱生灌木,是干旱荒漠和半荒漠区植被重要建群种之一。其枝条呈开展或平卧,沙埋后可由节点处萌生形成新的分枝,在环境压力下,生殖方式倾向于压条型克隆繁殖[20],芽库可以视为白刺无性繁殖体的集合,承担植被更新的作用,并影响白刺地上枝系的生长及结构。目前对唐古特白刺的研究主要集中在耐盐性[21]、生物量分配[22]和生态化学计量[23]等方面,而关于其芽库对氮有效性的响应方面尚未涉及。
本文通过建立多个氮添加水平盆栽实验,研究不同氮添加梯度下白刺幼苗芽库组成及空间结构的差异,探讨了幼苗的养分限制、氮素利用以及根系和插穗的品质与芽库的关联,阐明了白刺芽库响应氮素有效性所采取的适应性策略。
-
本实验在中国林业科学研究院沙漠林业实验中心实验地进行,所使用唐古特白刺(Nitraria tangutorum Bobr.)幼苗为扦插苗。该地区属于温带大陆性季风气候,降雨主要集中在9月份[24]。年均降水量约144.5 mm,年均温约7.8℃,平均日照时长约3 300 h,无霜期约136 d。
2015年3月末,采集同一长势良好母株的枝条,并截成约10 cm的插穗。用浓度为250 mg·kg-1 ABT生根粉进行生根处理,然后扦插到基质为草炭:沙子=3:1(体积比)的营养杯中。5月初选取生长状况良好且长势一致的幼苗,移植于直径25 cm、高50 cm的花盆中,每盆1株。盆中基质为来自于当地沙丘的沙土。
-
本实验根据该地区不同生境的土壤氮含量,确定氮添加实验方案,共设置6个氮添加处理:0、12、24、36、48、60 mmol·L-1,每个处理18个重复。所用氮肥为含氮量46.7%的尿素,施肥时将称量好的肥料溶于等量蒸馏水中,均匀地喷洒到每株幼苗所在花盆中,实验过程中仅在5月初施肥1次。为避免土壤水分对肥效释放的影响及种间竞争,在实验过程中每隔一周浇1次水,并及时除草。
-
按照分生组织发育阶段将其分为4类:休眠芽(B1)、芽(B2)、营养枝(S1)和休眠枝(S2)(表 1)。进一步将枝条按照枝序(将主枝视为第一级枝,由第一级枝上的芽分化形成的枝条为第二级枝,以此类推)分类,由于观测到的休眠枝枝序皆属于二级,所以仅营养枝进一步分为二级枝(S1-2)和三级枝(S1-3)。在5月中旬、7月中旬和9月中旬分别对白刺幼苗地上芽库,即B1、B2、S1-2、S1-3、S2及各枝条上附着的芽进行计数,并按照由枝条基部至顶部的顺序,分别记录休眠芽、芽、营养枝和休眠枝所在节点的位置。
表 1 白刺幼苗芽和枝条的发育阶段
Table 1. Bud and shoot developmental stages of Nitraria tangutorum seedlings
发育阶段
Developmental stage标示符号
Symbol说明
Description休眠芽Dormant buds B1 未萌发但又未脱落的节点 芽Buds B2 萌发形成叶片的节点 营养枝Vegetative shoots S1 具有叶片的枝条 休眠枝Dormant shoots S2 不具有叶片的枝条 每次调查之后测定株高和芽间距,并在各处理中随机选取6株,于每株幼苗中部(约50%株高)选取生长状况良好且大致相同的叶片3枚,利用植物多酚-叶绿素测量计DUALEX SCIENTIFIC+(FORCE-A, Orsay, France)测量叶片中的叶绿素指数和类黄酮指数。然后将收获植株按叶片、枝条、根和插穗分离,将插穗和根清洗干净,测量长度和直径,再将各部分置于鼓风干燥机中于80℃条件烘干至恒质量后测定干质量。最后,将称质量后的植物样品研磨过筛,用于测定植物氮含量。于2015年5月4日,用直径7 cm的土钻在盆中基质来源地钻取3个土柱,取未扦插插穗3个,烘干至恒质量,过筛,分别用于土壤和插穗氮含量的测量。植物样品使用凯氏定氮法测量全氮含量,土壤样品使用紫外分光光度计法测量有效氮含量。
参考Dombroskie[25]的方法,稍作修改,进行如下指标的计算:
出芽强度(Buding intensity,BuI)是指单位质量枝条干质量的芽数量,即:
$ \mathit{B u I}{\rm{ = }}{\mathit{n}_{\rm{1}}}{\rm{ / }}\mathit{m} $
(1) 分枝强度(Branching intensity,BrI)是指单位质量枝条干质量的营养枝数量,即:
$ BrI = {n_2}/m $
(2) 式中, n1、n2分别是指每株幼苗的总芽数和总营养枝数,m是指枝条干质量(不含叶片)。
参考Ott[10]的方法,稍作修改,进行如下指标的计算:
二级枝出芽率(Bud production per secondary shoots,BP1)表示平均每个二级枝上产生的芽数量,三级枝出芽率(Bud production per tertiary shoots,BP2)表示平均每个三级枝上产生的芽数量。计算公式为:
$ B{P_1} = \left( {{n_3} + {n_6}} \right)/{n_4} $
(3) $ B{P_2} = {n_5}/{n_6} $
(4) 式中, n3、n4、n5、n6分别是指二级枝上的芽数量、二级枝数量、三级枝上的芽数量、三级枝数量。
氮平衡指数(Nitrogen balance index,NBI)表示植物叶片氮含量指数,可以作为植物氮胁迫的参考指标。计算公式为:
$ NBI = {C_{Chl}}/{C_{FLAV}} $
(5) 式中, CChl和CFLAV分别代表叶绿素指数和类黄酮指数。
根据霍中洋[6]的方法,进行如下指标的计算:
氮积累量(Nitrogen accumulation amount,NAA)计算公式为:
$ NAA = \sum {\left( {T{N_i} \times {M_i}} \right)} $
(6) 氮肥利用率(Nitrogen utilization rate,NUR)计算公式为:
$ NUR = \left[ {\left( {NA{A_j} - NA{A_{ck}}} \right)/N{A_j}} \right] \times 100 $
(7) 氮吸收率(Nitrogen absorption efficiency,NAE)计算公式为:
$ NAE = \left[ {NA{A_j}/\left( {N{A_j} + {N_{soil}}} \right)} \right] \times 100 $
(8) 土壤氮贡献率(Soil nitrogen contribution rate,SNCR)计算公式为:
$ SNCR = \left( {NA{A_j}/NA{A_{ck}}} \right) \times 100 $
(9) 式中, TNi和Mi分别代表相应器官的全氮含量和干质量,NAAj代表不同施肥处理下植株氮积累量,NAAck代表未施肥处理下植株氮积累量,NAj代表相应的氮添加量,Nsoil代表土壤氮供应量。
-
采用方差分析和多重比较(Duncan法检验),分析以上各指标对不同氮添加水平的响应差异;采用二项式回归拟合,分析幼苗芽库特征随氮平衡指数的变化趋势;采用Pearson相关性分析方法,计算芽库特征与氮素利用相关指标和地下部分形态指标间的相关性。所有数据用SPSS19.0进行统计分析,并用EXCEL2013进行制图。所有数据用平均值±标准差(M±S.D.)表示。
-
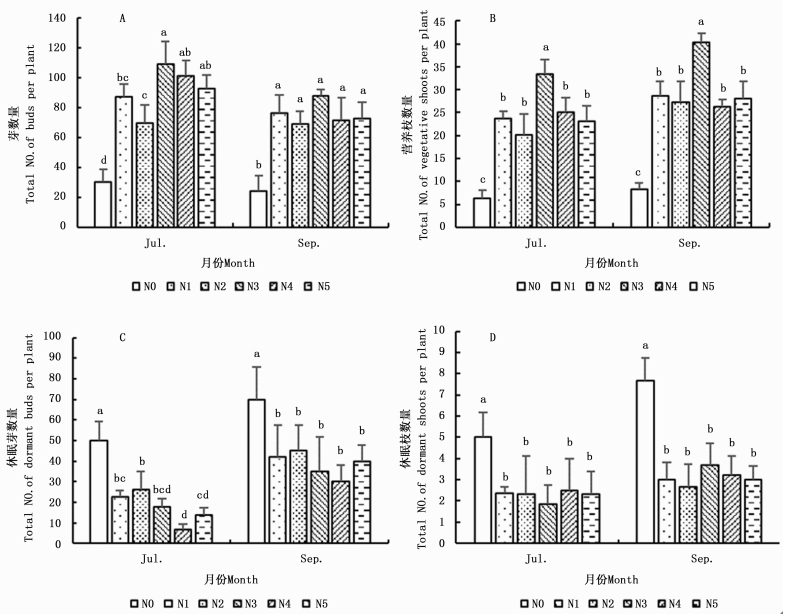
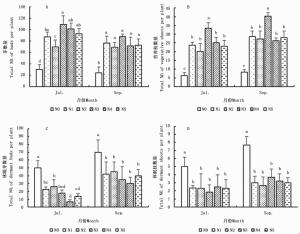
5月中旬,白刺幼苗仅观测到芽(B2),未观测到休眠芽(B1)、营养枝(S1)和休眠枝(S2),且不同处理间的芽数量无显著差异(P>0.05)。在另两个时期(7月和9月),白刺幼苗芽和营养枝数量随着氮添加水平的递增呈先增加后减少趋势(图 1-A,图 1-B),均在N3(36 mmol·L-1)时达到最大值,芽数量在7月和9月分别为108和88个·株-1,营养枝数量分别为33和40个·株-1;休眠芽和休眠枝数量随着氮添加水平的递增逐渐降低(图 1-C,图 1-D)。方差分析结果表明,氮添加处理条件下,幼苗芽和营养枝数量显著高于对照组(N0)(P < 0.05),休眠芽和休眠枝数量显著低于对照组(图 1)。说明氮添加对白刺幼苗芽库组成具有一定影响。
由图 2可知,氮添加处理条件下,幼苗二级枝和三级枝数量显著高于对照组,两个指标随着氮添加水平的递增呈先增加后减少趋势(图 2-A,图 2-B),均在N3(36 mmol·L-1)时达到峰值,二级枝数量在7月和9月分别为17和19个·株-1,三级枝数量分别为15和21个·株-1。随着氮添加水平的增加,7月二级枝出芽率(BP1)整体呈增加趋势,具体表现为N5>N4>N2>N1>N3>N0;9月BP1、7月和9月三级枝出芽率(BP2)整体均呈先增加后减小趋势,其中9月BP1表现为N4> N5> N2> N3> N1> N0,7月BP2表现为N4> N3> N5> N1> N2 >N0,9月BP2表现为N4> N5> N3> N1> N2> N0(表 2)。方差分析结果表明,不同氮添加处理间BP1和BP2均差异显著。说明在一定范围内,氮添加会提高植株的萌枝量和出芽率,增加其芽库容量。

图 2 不同氮添加对白刺幼苗营养枝影响
Figure 2. Effects of N addition on vegetative shoots of Nitraria tangutorum seedlings
表 2 不同氮添加对白刺幼苗出芽率的影响
Table 2. Effects of N addition on bud production of Nitraria tangutorum seedlings
处理
Treatment氮添加水平
N addition levels /(mmol·L-1)二级枝出芽率
Bud production per secondary shoot三级枝出芽率Bud production per tertiary shoot 7月July 9月September 7月July 9月September N0 0 3.35±0.28d 2.37±0.19e 1.62±0.11d 0.73±0.07c N1 12 4.90±0.26c 3.15±0.21d 2.09±0.32bc 1.17±0.21b N2 24 5.69±0.71bc 3.92±0.26bc 1.92±0.07cd 0.82±0.05c N3 36 4.67±0.32cd 3.68±0.11cd 2.34±0.19ab 1.43±0.18ab N4 48 6.77±0.87ab 4.58±0.46a 2.62±0.11a 1.67±0.10a N5 60 7.59±0.86a 4.42±0.26ab 2.14±0.15bc 1.65±0.20a 注:不同字母表示白刺幼苗在同一调查时间不同氮添加处理间差异显著性(P < 0.05)。下同。
Note: Different letters indicate significant difference among seven nitrogen addition levels. The same below. -
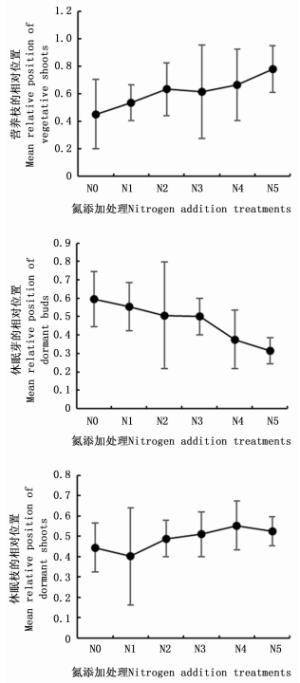
对不同氮添加处理白刺幼苗7月和9月芽库特征进行双因素方差分析(表 3),结果表明7月和9月幼苗芽库间差异极显著(P < 0.001),不同氮添加处理对幼苗芽库有极显著影响。随着氮添加水平的增加,白刺幼苗营养枝和休眠枝的相对位置逐渐上升,休眠芽相对位置逐渐降低(图 3),而芽的相对位置无显著变化,说明氮添加对白刺幼苗芽库的空间分布有一定影响。
表 3 白刺幼苗芽库特征双因素方差分析
Table 3. Two-way ANOVA analysis of bud bank of Nitraria tangutorum seedlings
指标
Treatment时间
Time氮添加水平
N addition levels时间×氮添加水平
Time×N addition levelsdf F P df F P df F P 芽数量Total number of buds 1 16.603 < 0.001 5 5.747 0.017 5 1.508 0.225 营养枝数量Total number of vegetative shoots 1 20.409 < 0.001 5 58.639 < 0.001 5 0.978 0.451 休眠芽数量Total number of dormant buds 1 36.751 < 0.001 5 11.711 < 0.001 5 0.135 0.983 休眠枝数量Total number of dormant shoots 1 10.221 0.004 5 11.450 < 0.001 5 1.040 0.417 -
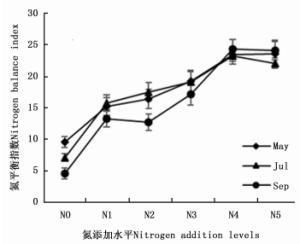
随着氮添加水平的增加,不同季节白刺幼苗的氮平衡指数和氮积累量均呈先增加后减小趋势,在N4(48 mmol·L-1)时达到最大值(图 4,表 4),说明在6个氮肥梯度中,该氮添加水平是缓解白刺幼苗氮胁迫的最佳氮添加水平。随着氮添加水平的增加,植株氮吸收效率逐渐减小;氮肥利用率呈先增加后减小趋势,在N3(36 mmol·L-1)时达到最大值;土壤氮贡献率呈先减小后增加的趋势,在N4(48 mmol·L-1)时达到最小值(表 4)。方差分析结果表明,N4处理和N3处理的土壤氮贡献率差异不显著,说明在本实验中氮添加水平为36 mmol·L-1时,白刺幼苗来对氮肥的吸收和利用效果最佳。
表 4 不同氮添加对白刺幼苗氮素吸收和利用的影响
Table 4. Effects of nitrogen addition on N absorption and utilization of Nitraria tangutorum seedlings
处理
Treatment氮添加水平
N addition levels /(mmol·L-1)氮积累量
N accumulation amount /mg氮吸收效率
N absorption efficiency/%氮肥利用率
N utilization rate/%土壤氮贡献率
Soil N contribution rate /%5月May 7月July 9月September N0 0 36.62±2.75c 64.04±4.28d 72.88±4.34e - - - N1 12 38.95±3.58bc 74.43±4.51c 85.53±3.21d 29.95±2.03a 6.27±0.71d 85.21±6.54a N2 24 45.88±4.68b 86.11±6.26b 102.84±7.54c 21.11±1.99b 7.43±0.22c 70.87±3.17b N3 36 61.90±2.11a 121.80±3.76a 141.90±5.39a 20.60±1.08b 11.41±0.53a 51.36±4.03c N4 48 64.13±7.76a 122.13±5.26a 146.11±8.67a 16.41±1.15c 9.08±0.47b 49.88±2.10c N5 60 62.35±5.87a 117.60±4.89a 127.72±4.83b 11.70±0.77d 5.44±0.55d 57.06±2.67c 进一步分析表明,随着氮平衡指数的增加,白刺幼苗出芽强度、分枝强度和二级枝出芽率显著增加,呈二次非线性相关关系(图 5)。三级枝出芽率也随氮平衡指数的增加而增加。出芽强度和分枝强度与氮平衡指数的关系呈抛物线形式,其拐点在15~20之间(图 5-A,图 5-B);而二级枝和三级枝出芽率随着氮平衡指数的增加呈持续上升趋势(图 5-C,图 5-D)。这说明,由氮添加引起的低氮胁迫有利于芽萌发、分枝形成和伸长生长。
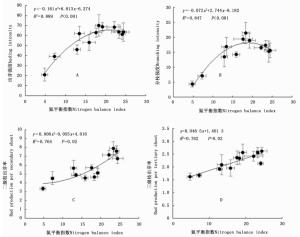
图 5 唐古特白刺幼苗芽库随氮平衡指数的变化趋势
Figure 5. Changing of bud bank of Nitraria tangutorum seedlings with nitrogen balance index
相关性分析结果表明(表 5),白刺幼苗芽(B2)和营养枝(S1)数量分别与植株氮含量、氮积累量、总根长和插穗直径呈极显著正相关,且营养枝数量与根干质量也呈显著正相关;而休眠芽和休眠枝数量分别与植株氮含量、氮积累量、总根长、根干质量和插穗直径呈显著负相关,说明较高的植株氮含量、氮积累量和品质较好的根系与插穗有利于芽萌发和营养枝形成,而且对于芽库内各组分的休眠具有抑制作用。
表 5 白刺幼苗芽库特征与氮素利用和地下部分形态指标的相关性分析
Table 5. The correlation coefficients between bud bank traits and N utilization, morphological indexes underground of Nitraria tangutorum seedlings
项目
Items氮含量
Nitrogen content氮积累量
Nitrogen accumulation氮吸收效率
Nitrogen absorption efficiency根直径
Root diameter总根长
Total root length根干质量
Root dry mass插穗直径
Cutting diameter芽数量Total number of buds 0.725** 0.683* -0.129 0.375 0.849** -0.471 0.896** 营养枝数量Total number of vegetative shoots 0.806** 0.689* -0.287 0.211 0.764** 0.690* 0.815** 休眠芽数量Total number of dormant buds -0.717** -0.844** 0.269 -0.316 -0.817** -0.726** -0.937** 休眠枝数量Total number of dormant shoots -0.571* -0.546* -0.295 -0.436 -0.763** -0.530* -0.905** 注:“*”、“**”和“***”分别表示相关系数达到0.05、0.01、0.001显著水平。
Note:“*”, “**”and “***”meant correlation coefficients are significant at 0.05, 0.01 and 0.001 levels, respectively. -
本研究结果发现,植物可以通过改变芽库容量和动态来适应氮添加引起的土壤有效氮含量的变化。这一结果在其他研究中也有报道[13]。这是由于氮添加可以诱导休眠芽萌发并进一步分化形成枝条[26],并抑制了其向休眠芽转化。同时,也可能是因为氮添加可以破坏顶端优势[27],促进了植物侧枝生长。郇慧慧等[28]对桑树(Morus alba L.)幼苗的研究发现,随着分枝数的增加,平均单枝叶片数显著减少。本研究中,当氮添加水平增加到一定程度(36 mmol·L-1)后,分枝数逐渐减少,而二级枝出芽率仍持续增加,这从一定程度上说明,当土壤氮含量较充足时,芽库萌枝量和出芽率之间存在权衡关系,Duffy等[29]对一年生十字花科植物的研究也有类似结果。
对草本植物而言,芽库时空分布是决定植物克隆结构的重要机制,植物可以通过延迟或提前形成无性系分株的时间[10],更好地利用资源,并保证植物在受到强烈干扰后的更新能力[8]。对木本植物而言,芽库时空格局与植株的枝系构型有关,本研究发现,生长季末期的营养枝数量略高于生长旺盛期(图 1-b),这可能是因为实验所在地的雨季出现在9月份,湿度较高,导致休眠芽再次萌发。且随着氮添加水平的增加,营养枝有从基部向顶端移动的趋势,这有助于对光资源的捕获,提高光合作用效率。这与柱花草(Stylosanthes guianensias (Aubl) Sw.)的研究类似[30]。
-
叶绿素是植物进行光合作用的必要组分,类黄酮是一种植物防御性物质,随着养分胁迫的降低,叶绿素含量逐渐增加,而类黄酮含量逐渐降低,二者的比值(NBI)可以作为评估植物养分状态的指标[31-32]。本研究发现,氮吸收效率随氮添加量的增加而减少,土壤氮贡献率随氮添加量的增加先减少后增加(表 4),因此,适量氮添加有利于缓解白刺幼苗的氮胁迫,减少对土壤养分的依赖性,而高氮添加已超过白刺幼苗生长所需,不能被充分利用,6个氮添加水平中36 mmol·L-1和48 mmol·L-1是白刺幼苗最适氮添加量,该结果显著高于闽楠(Phoebe bournei)幼苗最佳施肥量[5],这可能是由于土壤养分含量的差异和不同物种对氮素需求的差异引起的。土壤缺乏氮素时,随着氮添加水平的增加,白刺幼苗倾向于分枝数和平均单枝出芽率同时增加,从而获得更多的芽储备;当氮素浓度较高时,白刺幼苗倾向于产生相对较少的分枝数和更多的芽生产能力,减少了分枝间对光环境的竞争,同时更长的枝条可以接受充足的阳光[17],合成碳水化合物供植物生长需要。
植物地上部分和地下部分的关联性具有物种特异性。周永学等[33]对奥地利黑松(Pinus nigra J. F. Arnold)苗木的研究发现,其根系与地上部分的生长关系密切。但是詹书侠等[34]认为羊草(Leymus chinensis (Trin.) Tzvel.)地上地下功能性状的关联性较弱。本研究结果表明,白刺幼苗的总根长、根生物量、插穗直径对芽数量、营养枝数量有显著积极影响,对休眠芽数、休眠枝数有显著消极影响。这可能是由于根具有吸收水分和矿质营养的功能,并将运输到茎部,从而促进芽萌发和营养枝形成;另一方面,插穗中储存的营养物质也可以供应地上部分生长。
本研究仅围绕唐古特白刺的一年生幼苗为例的盆栽受控实验展开,将来的研究还可对多年生白刺植株进行长期野外施肥实验,除此之外,水分、磷、沙埋等因素及其交互作用对白刺芽库的影响也有待进一步探索。
-
氮添加显著提高了白刺幼苗芽库内部芽萌发、营养枝形成和氮素积累,抑制了芽休眠,从而影响幼苗芽库容量。随着氮添加水平的提高,各指标多数在N3和N4处理达到最大值后逐渐降低,因此6个氮添加水平中36 mmol·L-1和48 mmol·L-1是白刺幼苗最适氮添加量。氮添加对幼苗芽库内组分的相对位置产生了不同影响趋势,所以白刺幼苗可以通过改变芽库容量和空间分布来响应养分有效性变化。
白刺幼苗芽库及枝系构型对不同氮添加水平的响应
Effects of Different Nitrogen Addition on Bud Bank Traits and Branching Architecture of Nitraria tangutorum Seedlings
-
摘要:
目的 研究不同氮添加梯度下白刺幼苗芽库组成及空间结构的差异,探讨了幼苗的养分限制、氮素利用以及根系和插穗的品质与芽库的关联,阐明了白刺芽库响应氮素有效性所采取的适应性策略。 方法 本研究通过盆栽控制实验,对唐古特白刺幼苗的芽库特征进行了测量分析。 结果 氮添加显著增加了白刺幼苗芽和营养枝数量,显著降低了休眠芽和休眠枝数量,并对二级枝和三级枝出芽率具有明显促进作用;随着氮添加量的递增,营养枝有从基部向顶端移动趋势;氮平衡指数与白刺幼苗出芽强度、分枝强度、二级枝和三级枝出芽率均呈二次非线性正相关关系;植株氮含量、氮积累量和地下部分形态特征分别与芽和营养枝数量呈正相关关系,与休眠芽和休眠枝数量呈负相关关系。 结论 氮添加影响幼苗芽库容量。随着氮添加水平的提高,各指标多数在N3和N4处理达到最大值后逐渐降低,因此6个氮添加水平中36 mmol·L-1和48 mmol·L-1是白刺幼苗最适氮添加量。氮添加对幼苗芽库内组分的相对位置产生了不同影响趋势,所以白刺幼苗可以通过改变芽库容量和空间分布来响应养分有效性变化。 Abstract:Objective To investigate the differences in the composition and spatial structure of bud bank of Nitraria tangutorum seedling under the different nitrogen addition gradients, and nutrient limitation and nitrogen utilization, and to reveal the linkage between the quality of roots and cuttings and the bud bank, and finally elucidate the adaptation strategies of bud bank for the nitrogen availability. Method The bud bank traits of N. tangutorum seedlings under different nitrogen addition were studied using pot experiments. The N addition levels consist of 0, 12, 24, 36, 48 and 60 mmol·L-1. Result The nitrogen addition significantly increased the number of buds and vegetative shoots in bud bank, and significantly reduced the number of dormant buds and dormant shoots; meanwhile, the nitrogen addition promoted the bud production of secondary shoots and tertiary shoots. With the increasing of nitrogen addition, the relative position of vegetative shoots in bud bank had a tendency to move from base to tip. There was a quadratic nonlinear positive correlation between nitrogen balance index (NBI) and budding intensity, branching intensity, bud production of secondary and tertiary shoots of N. tangutorum seedling; The N content, accumulation amount (NAA) and the morphological traits underground were positively related to the number of buds and vegetative shoots, and negatively related to the number of dormant buds and dormant shoots. Conclusion Among the six nitrogen addition gradients, most of the indicators reached their maximum values in either 36 mmol·L-1 or 48 mmol·L-1 N addition levels, which were the optimum N additions for N. tangutorum seedlings. Nitrogen addition has a significantly influence on the bud bank size and spatial distribution of N. tangutorum seedlings, which also reflects a response to the changing nutrient availability. -
Key words:
- Nitraria tangutorum
- / nitrogen addition
- / bud bank
- / NBI
- / NAA
-
表 1 白刺幼苗芽和枝条的发育阶段
Table 1. Bud and shoot developmental stages of Nitraria tangutorum seedlings
发育阶段
Developmental stage标示符号
Symbol说明
Description休眠芽Dormant buds B1 未萌发但又未脱落的节点 芽Buds B2 萌发形成叶片的节点 营养枝Vegetative shoots S1 具有叶片的枝条 休眠枝Dormant shoots S2 不具有叶片的枝条 表 2 不同氮添加对白刺幼苗出芽率的影响
Table 2. Effects of N addition on bud production of Nitraria tangutorum seedlings
处理
Treatment氮添加水平
N addition levels /(mmol·L-1)二级枝出芽率
Bud production per secondary shoot三级枝出芽率Bud production per tertiary shoot 7月July 9月September 7月July 9月September N0 0 3.35±0.28d 2.37±0.19e 1.62±0.11d 0.73±0.07c N1 12 4.90±0.26c 3.15±0.21d 2.09±0.32bc 1.17±0.21b N2 24 5.69±0.71bc 3.92±0.26bc 1.92±0.07cd 0.82±0.05c N3 36 4.67±0.32cd 3.68±0.11cd 2.34±0.19ab 1.43±0.18ab N4 48 6.77±0.87ab 4.58±0.46a 2.62±0.11a 1.67±0.10a N5 60 7.59±0.86a 4.42±0.26ab 2.14±0.15bc 1.65±0.20a 注:不同字母表示白刺幼苗在同一调查时间不同氮添加处理间差异显著性(P < 0.05)。下同。
Note: Different letters indicate significant difference among seven nitrogen addition levels. The same below.表 3 白刺幼苗芽库特征双因素方差分析
Table 3. Two-way ANOVA analysis of bud bank of Nitraria tangutorum seedlings
指标
Treatment时间
Time氮添加水平
N addition levels时间×氮添加水平
Time×N addition levelsdf F P df F P df F P 芽数量Total number of buds 1 16.603 < 0.001 5 5.747 0.017 5 1.508 0.225 营养枝数量Total number of vegetative shoots 1 20.409 < 0.001 5 58.639 < 0.001 5 0.978 0.451 休眠芽数量Total number of dormant buds 1 36.751 < 0.001 5 11.711 < 0.001 5 0.135 0.983 休眠枝数量Total number of dormant shoots 1 10.221 0.004 5 11.450 < 0.001 5 1.040 0.417 表 4 不同氮添加对白刺幼苗氮素吸收和利用的影响
Table 4. Effects of nitrogen addition on N absorption and utilization of Nitraria tangutorum seedlings
处理
Treatment氮添加水平
N addition levels /(mmol·L-1)氮积累量
N accumulation amount /mg氮吸收效率
N absorption efficiency/%氮肥利用率
N utilization rate/%土壤氮贡献率
Soil N contribution rate /%5月May 7月July 9月September N0 0 36.62±2.75c 64.04±4.28d 72.88±4.34e - - - N1 12 38.95±3.58bc 74.43±4.51c 85.53±3.21d 29.95±2.03a 6.27±0.71d 85.21±6.54a N2 24 45.88±4.68b 86.11±6.26b 102.84±7.54c 21.11±1.99b 7.43±0.22c 70.87±3.17b N3 36 61.90±2.11a 121.80±3.76a 141.90±5.39a 20.60±1.08b 11.41±0.53a 51.36±4.03c N4 48 64.13±7.76a 122.13±5.26a 146.11±8.67a 16.41±1.15c 9.08±0.47b 49.88±2.10c N5 60 62.35±5.87a 117.60±4.89a 127.72±4.83b 11.70±0.77d 5.44±0.55d 57.06±2.67c 表 5 白刺幼苗芽库特征与氮素利用和地下部分形态指标的相关性分析
Table 5. The correlation coefficients between bud bank traits and N utilization, morphological indexes underground of Nitraria tangutorum seedlings
项目
Items氮含量
Nitrogen content氮积累量
Nitrogen accumulation氮吸收效率
Nitrogen absorption efficiency根直径
Root diameter总根长
Total root length根干质量
Root dry mass插穗直径
Cutting diameter芽数量Total number of buds 0.725** 0.683* -0.129 0.375 0.849** -0.471 0.896** 营养枝数量Total number of vegetative shoots 0.806** 0.689* -0.287 0.211 0.764** 0.690* 0.815** 休眠芽数量Total number of dormant buds -0.717** -0.844** 0.269 -0.316 -0.817** -0.726** -0.937** 休眠枝数量Total number of dormant shoots -0.571* -0.546* -0.295 -0.436 -0.763** -0.530* -0.905** 注:“*”、“**”和“***”分别表示相关系数达到0.05、0.01、0.001显著水平。
Note:“*”, “**”and “***”meant correlation coefficients are significant at 0.05, 0.01 and 0.001 levels, respectively. -
[1] Peñuelas J, Poulter B, Sardans J, et al. Human-induced nitrogen-phosphorus imbalances alter natural and managed ecosystems across the globe[J]. Nature Communications, 2013, 4(1):94-105. [2] 刘晓星, 吕光辉, 杨晓东, 等.艾比湖流域5种土壤类型的酶活性和理化性质[J].干旱区研究, 2012, 29(4):579-585. [3] 杨晓晖, 王葆芳, 江泽平.乌兰布和沙漠东北缘三种豆科绿肥植物生物量和养分含量及其对土壤肥力的影响[J].生态学杂志, 2005, 24(10):1134-1138. doi: 10.3321/j.issn:1000-4890.2005.10.004 [4] Arens S J T, Sullivan P F, Welker J M. Nonlinear responses to nitrogen and strong interactions with nitrogen and phosphorus additions drastically alter the structure and function of a high arctic ecosystem[J]. Journal of Geophysical Research Atmospheres, 2008, 113(G3):335-342. [5] Elser J J, Bracken M E S, Cleland E E, et al. Global analysis of nitrogen and phosphorus limitation of primary producers in freshwater, marine and terrestrial ecosystems[J]. Ecology Letters, 2007, 10(12):1135-1142. doi: 10.1111/ele.2007.10.issue-12 [6] 霍中洋, 葛鑫, 张洪程, 等.施氮方式对不同专用小麦氮素吸收及氮肥利用率的影响[J].作物学报, 2004, 30(5):449-454. doi: 10.3321/j.issn:0496-3490.2004.05.008 [7] 王东光, 尹光天, 邹文涛, 等.氮素营养对闽楠幼苗生长及光合特性的影响[J].林业科学研究, 2013, 26(1):70-75. doi: 10.3969/j.issn.1001-1498.2013.01.012 [8] Klimesova J, Klimes L. Bud banks and their role in vegetative regeneration-a literature review and proposal for simple classification and assessment[J]. Perspectives in Plant Ecology, Evolution and Systematics, 2007, 8:115-129. doi: 10.1016/j.ppees.2006.10.002 [9] Ott J P, Hartnett D C. Vegetative reproduction and bud bank dynamics of the perennial grass andropogon gerardii in mixedgrass and tallgrass prairie[J]. The American Midland Naturalist, 2015, 174:14-32. doi: 10.1674/0003-0031-174.1.14 [10] Ott J P, Hartnett D C. Bud bank dynamics and clonal growth strategy in the rhizomatous grass, Pascopyrum smithii[J]. Plant Ecology, 2015, 216:395-405. doi: 10.1007/s11258-014-0444-6 [11] Dalgleish H J, Hartnett D C. Below-ground bud banks increase along a precipitation gradient of the North American Great plains:A test of the meristem limitation hypothesis[J]. New Phytologist, 2006, 171:81-89. doi: 10.1111/nph.2006.171.issue-1 [12] Dalgleish H J, Hartnett D C. The effects of fire frequency and grazing on tallgrass prairie productivity and plant composition are mediated through bud bank demography[J]. Plant Ecology, 2009, 201:411-420. doi: 10.1007/s11258-008-9562-3 [13] Dalgleish H J, Kula A R, Hartnett D C, et al. Responses of two bunchgrasses to nitrogen addition in tallgrass prairie:the role of bud bank demography[J]. American Journal of Botany, 2008, 95(6):672-680. doi: 10.3732/ajb.2007277 [14] Ott J P, Hartnett D C. Contrasting bud bank dynamics of two co-occurring grasses in tallgrass prairie:Implications for grassland dynamics[J]. Plant Ecology, 2012, 213:1437-1448. doi: 10.1007/s11258-012-0102-9 [15] Bond W J, Midgley J J. Ecology of sprouting in woody plants:The persistence niche[J]. Trends in Ecology & Evolution, 2001, 16:45-51. [16] Qian J, Wang Z, Liu Z, et al. Belowground bud bank responses to grazing intensity in the inner-Mongolia steppe, china[J]. Land Degradation & Development, 2014, 109:332-356. [17] 孙书存, 陈灵芝.辽东栎芽库统计:芽的命运[J].生态学报, 2001, 21(3):385-390. doi: 10.3321/j.issn:1000-0933.2001.03.006 [18] Gill, A M. Stem and fires[M]//Gartner, B.L. ed, Plant stems: physiology and functional morphology. San Diego: Academic Press, 1995: 323-342. [19] Harper J L. Population biology of plants[M]. London:Academic Press, 1977:892. [20] 张运春, 苏智先, 高贤明.克隆植物的特性及研究进展[J].四川师范学院学报:自然科学版, 2001, 22(4):338-342. [21] 闫永庆, 刘兴亮, 王崑, 等.白刺对不同浓度混合盐碱胁迫的生理响应[J].植物生态学报, 2010, 34(10):1213-1219. doi: 10.3773/j.issn.1005-264x.2010.10.010 [22] Li Q, Xu J, Li H, et al. Effects of Aspect on Clonal Reproduction and Biomass Allocation of Layering Modules of Nitraria tangutorum in Nebkha Dunes[J]. Plos One, 2013, 8(10):e79927-e79927. doi: 10.1371/journal.pone.0079927 [23] Wang N, Gao J, Zhang SQ, et al. Variations in leaf and root stoichiometry of Nitraria tangutorum, along aridity gradients in the Hexi Corridor, northwest China[J]. Contemporary Problems of Ecology, 2014, 7(3):308-314. doi: 10.1134/S1995425514030123 [24] 李蕴.基于稳定同位素技术的泡泡刺水分来源研究[D].北京: 中国林业科学研究院, 2014. [25] Dombroskie S L, Tracey A J, Aarssen L W. Leafing intensity and the fruit size/number trade-off in woody angiosperms[J]. Journal of Ecology, 2016, 104(6):1759-1767. doi: 10.1111/1365-2745.12622 [26] Tolvanen A, Henry G H. Responses of carbon and nitrogen concentrations in high arctic plants to experimental warming[J]. Canadian Journal of Botany, 2001, 79:711-718. [27] Bonser S P, Aarssen L W. Allometry and development in herbaceous plants:functional responses of meristem allocation to light and nutrient availability[J]. American Journal of Botany, 2003, 90(3):404-412. doi: 10.3732/ajb.90.3.404 [28] 郇慧慧, 胥晓, 刘刚, 等.不同分枝数对桑树幼苗生长发育的影响[J].生态学报, 2014, 34(4):823-831. [29] Duffy N M, Bonser S P, Aarssen L W. Patterns of Variation in Meristem Allocation across Genotypes and Species in Monocarpic Brassicaceae[J]. Oikos, 1999, 84(2):284. doi: 10.2307/3546723 [30] 赵钢, 苏幸枝, 石秀兰, 等.施肥条件下柱花草生长早期构件生长规律的研究[J].中国草地学报, 2012, 34(6):32-35. doi: 10.3969/j.issn.1673-5021.2012.06.006 [31] 祖艳群, 李元, 高召华, 等. UV-B辐射对仙客来的生理效应[J].植物科学学报, 2007, 25(2):209-212. doi: 10.3969/j.issn.2095-0837.2007.02.019 [32] Cartelat A, Cerovic Z G, Goulas Y, et al. Optically assessed contents of leaf polyphenolics and chlorophyll as indicators of nitrogen deficiency in wheat (Triticum aestivum L.)[J]. Field Crop Res, 2005, 91(1):35-49. doi: 10.1016/j.fcr.2004.05.002 [33] 周永学, 樊军锋, 杨培华, 等.奥地利黑松苗木根系与地上部分生长关系研究[J].陕西林业科技, 2004, (1):6-9. doi: 10.3969/j.issn.1001-2117.2004.01.003 [34] 詹书侠, 郑淑霞, 王扬, 等.羊草的地上-地下功能性状对氮磷施肥梯度的响应及关联[J].植物生态学报, 2016, 40(1):36-47. -




 下载:
下载: