-
植物生长抑制剂能通过调控植物内源激素的含量来影响植物器官分生组织细胞的分裂与伸长,从而达到控制植物生长,矮化植株的目的。同时还具有影响光合作用、气孔导度、蒸腾速率、呼吸速率等作用[1-2]。现代园林树木的整形修剪中使用其辅助人工修剪,从而减少人工修剪次数已成为一种新型的技术手段。使用调节剂辅助人工修剪,不仅能够节约资金、节省劳力、更好的保持树木造型,也可以降低由频繁人工修剪而导致的生物量损失[3-4]。在现代造景的园林树木中,作为最具代表性的绿篱大叶黄杨,因其萌芽率高,枝条生长周期短,为保证其造型而被频繁修剪,耗费大量资金劳力。因此应用生长抑制剂对其进行化学修剪十分必要。那么对其化学修剪时抑制剂种类的选取,浓度的确定都是需要考量的,抑制剂除矮化外对植物产生哪些作用也是研究的重点。对此,国内学者做了一定的研究,从外观形态、微观解剖以及生化特征等方面探究PP333对大叶黄杨的矮化效果及其矮化机制以及从PP333、CCC、B9等几种调节剂中筛选使大叶黄杨矮化效果最佳的调节剂和喷施浓度[5-9]。这些研究都取得了一定的成果,但无论单独使用还是两种抑制剂混合使用,研究者都选择了相同作用机理(抑制GA的合成)的抑制剂进行研究,鲜有对不同抑制机理的抑制剂对大叶黄杨的抑制作用进行比较研究的。那么不同作用机理的抑制剂对大叶黄杨的作用效果如何?作用机理有何不同?都待解释。本研究采用3种不同作用机理(抑制GA合成、抑制生长素极性运输以及与生长素有拮抗作用)的抑制剂对大叶黄杨进行叶面喷施,并测定相应生长、叶形态以及光合作用等指标,以期探究不同作用机理抑制剂对大叶黄杨枝梢生长的抑制效果以及对叶片形态和光合作用的影响,为灌木绿篱的化学修剪提供技术指导。
-
试验地在位于北京市海淀区北安河乡境内的北京林业大学妙峰山林场苗圃(39°54′N,116°28′E)。试验材料采用1年生大叶黄杨扦插苗(苗高:47.28 cm,地径:6.85 mm)。2015年3月末,将大叶黄杨苗木以绿篱的方式分块密植于林场苗圃内,栽植密度为10 cm×15 cm,每块绿篱栽植面积约为2 m2,栽植株数为90株,绿篱块之间留有1 m宽的过道,试验区总面积为120 m2。栽植后,对苗木进行常规水肥管理。
-
2015年6月末,对大叶黄杨进行人工修剪,修剪后平均高度约为40 cm。选取3种植物生长抑制剂(多效唑(南京都莱生物技术有限公司,纯度≥98.0%),三碘苯甲酸(山东西亚化学工业有限公司,2, 3, 5-三碘苯甲酸,纯度98%),脱落酸(美国Acros试剂公司,纯度>98%))对大叶黄杨进行叶面喷施(喷施装置为手持压力式喷雾器),具体处理方式见表 1。每处理30株苗木,共3次重复。施药量以大叶黄杨叶片刚滴水为宜(约为500 mL·m-2)。喷药选在晴朗无风天的傍晚,在处理间设置隔离屏障,避免造成交叉影响。
表 1 各生长抑制剂种类及浓度
Table 1. Types and concentrations of growth inhibitors
处理
Treatment种类
Type浓度
Concentration/(mg·L-1)CK 清水 0 P1 多效唑(P) 200 P2 多效唑(P) 400 P3 多效唑(P) 600 P4 多效唑(P) 800 T1 三碘苯甲酸(T) 50 T2 三碘苯甲酸(T) 100 T3 三碘苯甲酸(T) 200 T4 三碘苯甲酸(T) 400 T5 三碘苯甲酸(T) 600 A1 脱落酸(A) 10 A2 脱落酸(A) 25 A3 脱落酸(A) 50 A4 脱落酸(A) 75 A5 脱落酸(A) 100 (1) 苗木生长指标:分别在处理后的第15、30和60 d在每块样地中选取6株长势基本一致且健康的苗木,利用钢卷尺测量其苗高。在处理后的第30~40 d(处理后的第一个生长高峰期刚过)分根、新梢、老茎、叶对苗木进行取样,在70℃下烘至恒质量,测定各部分生物量,计算根冠比(根冠比=根干质量/茎叶总干质量)及新梢生物量占比(新梢生物量占比=新梢干质量/茎干质量)。选取每处理选定的6株苗木上的第5~8片(从顶端向下数)完整功能叶片进行叶面积、叶长、叶宽、叶色、叶片厚度的测定。其中叶面积利用Epson数字化扫描仪以及Win RHIZO图像分析软件进行定量分析。叶长、叶宽采用直尺直接测量。叶长为叶尖端至叶柄起点处距离,叶宽为叶片最宽处距离。叶色采用CR-10手持式色差仪(日本柯尼卡美能达)进行测定。叶片厚度(单叶厚=待测叶总厚度/叶片数)采用游标卡尺进行测量。
(2) 光合速率测定:在处理后的第30~40 d,选择两个连续晴天上午的8:30至11:30,利用Li-6400(红外气体分析仪,Li-Cor生物科学公司)在每块样地中随机选取5株苗木上的第5~6片(从顶部向下数)向阳完整功能叶片进行测量。测量时选择内置LED光源,光照强度设为1 200 mol·(m2·s)-1(饱和光强),CO2浓度为室外自然环境浓度约为400μmol·mol-1,测量时每个叶片设置5个重复,最后结果取5次测量的平均值。通过光合速率与蒸腾速率的比值得到叶片瞬时水分利用效率。通过胞间CO2浓度与净光合速率比值得叶肉导度[10]。
-
采用SPSS(18.0)对各生长、形态以及光合作用指标进行描述统计和正态检验,并进行单因素方差分析,用LSD法及Duncan进行多重比较及显著性分析。用Sigmaplot(SYSTAT公司,13.0)及Excel 2013作图。
-
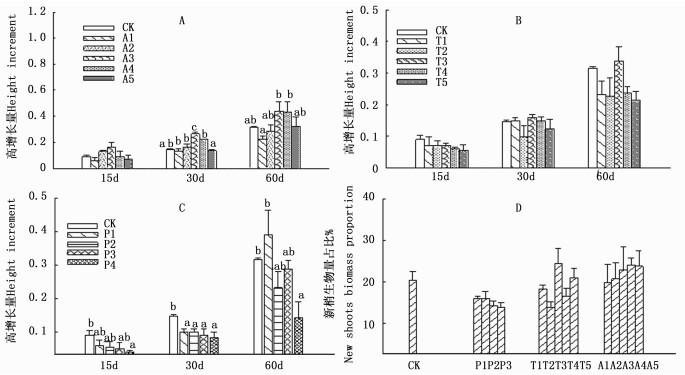
随A浓度的增加,3个时期的苗高增长量均呈先增加后降低的趋势。A对大叶黄杨高生长的抑制作用随天数的增加而呈现减弱的趋势(图 1-A)。新梢生物量占比随A浓度的增加呈逐渐增加的趋势,从A4处理开始变化趋于平稳,除A1外,新梢生物量占比均高于对照(图 1-D)。新梢生物量占比与苗高增长量在A1~A3处理下变化趋势一致,在A3~A5处理下变化趋势相反(图 1)。

图 1 各浓度生长抑制剂对大叶黄杨苗木高增长量及新梢生物量占比的影响
Figure 1. Effect of different growth inhibitors on height increment and new shoots biomass proportion of Euonymus japonicus
抑制剂T处理下,苗高增长量及新梢生物量占比随浓度的增加变化并不明显,普遍低于对照,但各浓度间及各浓度与对照间差异不显著(P>0.05)。新梢生物量占比与苗高增长量在T1T4处理下变化趋势基本一致。除T3外其他处理的矮化作用随天数的增加而呈现增强的趋势(图 1-B、图 1-D)。
苗高增长量及新梢生物量占比随抑制剂P浓度的增加大体呈逐渐降低的趋势,且普遍低于对照,3个时期的苗高增长量均以P4最低,分别比对照显著降低了4.9%,6.4%,17.4%(P<0.05)。高浓度P对苗高的抑制作用随天数的增加而呈现增强的趋势(图 1-C)。苗木新梢生物量占比随抑制剂P浓度的增加而呈现降低的趋势,且均低于对照,与苗高增长量的变化趋势基本一致(图 1-D)。
-
3种药剂处理的根冠比除T1、A1外均大于对照。苗木根冠比随抑制剂P浓度的增加而呈现增加的趋势,以P4最高,且各P处理均高于对照,随抑制剂T浓度的增加,呈现“M”型变化规律,随抑制剂A浓度的增加而呈现先增加后降低的趋势,且各A处理的根冠比均高于对照(图 2)。
-
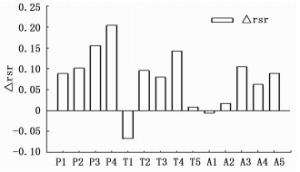
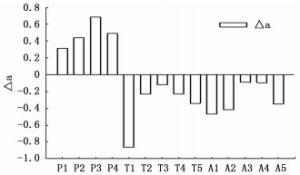
大叶黄杨叶色参数a值均为负值,△a在P处理下为正值,在T、A处理下均为负值,△a在P、T、A处理下随浓度的增加均呈先增加后降低的趋势,表明叶色参数a随P、T、A浓度的增加均呈先降低后增加的趋势,且除T1外,各抑制剂处理与对照差异均不显著(图 3)。
-
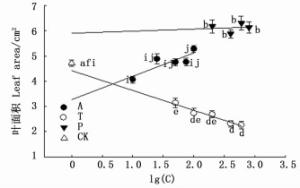
大叶黄杨叶面积在抑制剂P各浓度处理间变化并不明显(P>0.05),但均显著大于对照(P<0.05),且各P浓度叶面积均大于其他两组药剂处理。叶面积在抑制剂T处理下随浓度的增加呈减小的趋势,以T1最高,比T5高出38.6%(P<0.05),但各T浓度处理均小于对照(P<0.05)和其他两组药剂处理。叶面积在A处理下随浓度的增加整体呈增加的趋势,以A5最高,显著高于对照和其他浓度A处理(P<0.05)。3种抑制剂处理下叶面积的大小顺序大体为P>A>T,T和A处理对叶面积的影响程度大于P(图 4)。
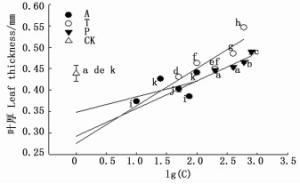
叶厚在3种抑制剂处理下随浓度的增加均呈现增加的趋势。在P处理下以P4最高,显著高于其他浓度P处理(P<0.05),且各P处理叶片厚度均高于对照。T处理对叶片厚度的影响较显著(P<0.05),且除T1外叶片厚度均高于对照。A处理下叶片厚度以A5最高,且均低于对照。3种抑制剂处理下叶厚的大小顺序大体为T>P>A。T和A处理对叶片厚度的影响程度大于P(图 5)。
-
大叶黄杨叶形线性回归系数为直线斜率及常数。该线性回归以浓度为自变量,对照与各浓度药品处理间叶宽、叶长的差值为因变量。斜率为负表示差值随浓度的增加而呈减小的趋势,反之则呈增加的趋势,若斜率为负,差值为负,则表明叶宽、叶长随浓度的增加而呈增加的趋势且均大于对照。若差值为正,则小于对照。若斜率为正,差值为正,则表明叶宽、叶长随浓度的增加而呈减小的趋势且均小于对照。斜率的大小反映了抑制剂对叶长叶宽的影响程度。由表 2得,叶宽在P处理下随浓度的增加呈增加趋势,因斜率太小,可认为几乎无变化(P>0.05)。在T处理下随浓度的增加而呈减小趋势且均小于对照,不同浓度T对叶宽、叶长的影响较明显。在A处理下随浓度的增加而呈增加的趋势,且叶宽均小于对照,叶长均大于对照,各浓度叶长叶宽变化较明显(表 2)。
表 2 不同抑制剂大叶黄杨叶形线性回归系数
Table 2. Linear regression coefficient of leaf shape in different treatment
处理
Treatment叶形回归系数
Linear regression coefficient of leaf shape斜率kw △lw 斜率kl △ll P -0.000 6 -0.497 -0.000 03 0.230 T 0.000 4 0.708 0.000 9 0.388 A -0.002 1 0.263 -0.004 8 -0.047 注:△lw、△ll分别表示对照与各抑制剂处理间叶宽、叶长的差值。
Note:△lw expresses the difference in leaf width between control and treatments, △ll expresses the difference in leaf length between control and treatments. -
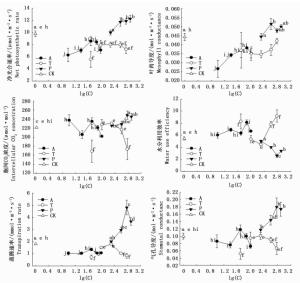
抑制剂P对净光合速率、气孔导度、叶肉导度、胞间CO2浓度、蒸腾速率以及水分利用效率影响显著(P<0.05)。P处理下,净光合速率、气孔导度、叶肉导度、胞间CO2浓度及蒸腾速率随浓度的增加大体呈增加的趋势,水分利用效率随P浓度的增加呈现与其他指标相反的趋势。抑制剂T对除叶肉导度以外的其它指标均有显著影响(P<0.05)。
抑制剂T处理下,净光合速率、气孔导度、胞间CO2浓度及蒸腾速率均以T1最低,除T1外,此三指标随浓度的增加大体呈降低的趋势。叶肉导度随T浓度的增加大体呈增加的趋势,但各浓度T处理间差异均不显著(P>0.05)。水分利用效率随T浓度的增加大体呈增加的趋势(T1除外)。
抑制剂A对光合作用各指标均有显著影响(P<0.05)。随A浓度的增加,净光合速率、蒸腾速率、气孔导度(除A1外)均呈先增加后降低的趋势,且均以A3最高,其他浓度处理间差异不显著(P>0.05),叶肉导度大体呈增加的趋势,A5虽有少量降低但与前两组浓度处理差异不显著(P>0.05),胞间CO2浓度呈“降低-增加-降低”的趋势,以A1最高,A5最低。水分利用效率随A浓度的增加呈现“M型”变化,以A4最高,显著高于其他浓度处理,且其他处理间差异不显著(P>0.05)(图 6)。在3种抑制剂处理中,净光合速率、气孔导度、叶肉导度、胞间CO2浓度、蒸腾速率普遍以P处理最高,A、T处理下净光合速率、蒸腾速率、气孔导度、叶肉导度及胞间CO2浓度普遍低于对照(T3、T2和A1、A3处理下的胞间CO2浓度除外),水分利用效率为T处理(T2、T3除外)和A处理普遍高于对照及P处理(图 6)。
-
P处理净光合速率与叶厚、叶肉导度、气孔导度、胞间CO2浓度及蒸腾速率有较高正相关关系,与叶色参数a值及水分利用效率有较高负相关关系。T处理净光合速率与叶面积、气孔导度、胞间CO2浓度及蒸腾速率有较高正相关关系,与叶色参数a值呈极显著负相关。A处理净光合速率与气孔导度、叶肉导度及蒸腾速率有较高的正相关关系,与叶色参数a值呈极显著负相关(表 3)。
表 3 各处理净光合速率与光合相关指标的相关性分析
Table 3. Correlation analysis between net photosynthetic rate and photosynthetic related indexes in different treatments
处理
Treatment叶厚
Leaf thickness叶面积
Leaf area色相a值
Hue a-value气孔导度
Stomatalconductance叶肉导度
Mesophyll conductance胞间
CO2浓度Intercellular CO2 concentration蒸腾速率
Transpiration rate水分利用效率
Water use efficiency净光合速率
Net photosyntheticP 0.615 0.018 -0.814 0.912 0.805 0.785 0.885 -0.922 T 0.289 0.667 -0.987** 0.928* 0.354 0.841 0.714 -0.557 A -0.059 0.341 -0.981** 0.778 0.889* 0.443 0.631 0.531 -
植物生长抑制剂主要通过调节植物体内源激素的变化而达到控制植株生长的效果。PP333主要通过阻碍GA合成,提高IAA氧化酶及过氧化物酶活性,降低IAA含量,缩小细胞长度等抑制植株地上部的纵向生长,使株型矮小紧凑,茎、根粗度增加[11-14]。TIBA通过阻碍植物体内IAA自上而下的极性运输,抑制顶端分生组织细胞伸长和分化,破坏顶端优势,使植株矮化[15]。ABA与IAA有拮抗作用,外施ABA可通过调节体内激素平衡控制植株生长。本研究中,3种抑制剂均有抑制植株生长的作用。抑制剂P处理下高增长量及新梢生物量占比随浓度的增加均呈降低的趋势,且低于对照(图 1-C)。表明抑制剂P具有矮化植株抑制植物新梢生长的作用,且P浓度越高,矮化效果越强。这与在紫穗槐[16]、金钱树[17]等木本植物研究中的结论基本一致。抑制剂T处理下苗高增长量、新梢生物量占比随浓度的增加变化不明显(P>0.05),但基本小于对照(图 1-B)。表明T对于黄杨的矮化及新梢生长同样具有抑制作用。但抑制效果不明显有可能与浓度的选取有关,可通过加大浓度梯度实验做进一步观察。A处理下苗高增长量随浓度的增加呈先增加后降低的趋势,低浓度A处理与对照差异不显著(图 1-A),新梢生物量随A浓度的增加大体呈增加趋势,在A4处理后变化趋于平稳(图 1-D)。表明在某一低浓度范围内A处理对于植物高生长有促进作用,而当A继续增加达到一定浓度后A处理对植物高生长转为抑制作用。可能因为低浓度脱落酸本身具有促进生长的作用而高浓度可抑制生长。且适当高浓度A具有矮化植株以及增加侧枝数量的作用。
植物在其生物和非生物环境发生变化时,会采取不同的生态策略以适应这种变化,例如改变生物量分配模式[18-19],这种策略下植株会分配更多的生物量到竞争器官,使其保持对资源的合理利用[20]。植株高生长受到抑制后,生物量向地下部转移,使根系粗度增加,根冠比增加[12]。本研究中,对高生长具有抑制作用的P处理、除T1外的T处理以及高浓度A处理的根冠比均大于对照(图 2)。表明P处理、以及T处理在高生长受到抑制后促使生物量向地下分配,这与林多等[21]的研究结论一致。T1处理根冠比较低可能由于低浓度T处理本身对根系生长具有抑制作用。而在低浓度范围内的A处理随浓度的增高根系生物量增加可能因为较低浓度A对根系生物量有一定的促进作用。
-
植物叶片形态(如大小、形状等)是植物在进化过程中适应环境的结果[22]。外界环境的改变使得植物自身内源激素含量发生变化从而影响叶片形态性状。有研究发现叶片发育及其形态建成与生长素的稳态调控、极性运输和信号转导密切相关[23]。叶原基的位点,叶片内细胞的分裂、伸长,叶片的极性建立以及维管模式的形成均与生长素有一定的联系[24-27]。本研究中,T处理的叶面积、叶长、叶宽均小于对照,叶厚大于对照(图 4、图 5、表 2),表明抑制剂T使叶片变狭窄短小且厚。有研究表明,生长素与叶片的极性生长密切关系,而T能通过阻断生长素的极性运输来影响叶片的极性生长[28]。本研究中T可能在叶原基形成初期,通过阻断生长素的运输而使叶片在基-顶轴和中-边轴两个轴向上极性发育受到抑制。A处理叶面积、叶长普遍大于对照,叶片厚度、叶宽小于对照(图 4、图 5、表 2)表明A能使叶片变大变薄,A对于叶面积的增加主要通过增加叶长来实现。可能是A抑制了叶片在中-边轴向上的生长而促进了基-顶轴上的生长所致。具体的作用机理还需根据后续实验进行探讨。P处理下叶长、叶宽、叶厚均大于对照(图 4、图 5、表 2),说明抑制剂P在短期内能使叶片厚度增加长宽变大从而增加叶片面积。这与杨忠义等[29]针对多效唑对冬小麦叶片影响的研究结果一致。认为P通过抑制GA的合成减小了植物细胞的伸长,增加了叶片厚度与宽度。但因修剪后生长素向侧芽运输积累,而P并不对生长素的运输起到限制作用,且取样时取得的叶片为喷药后第一批生长成熟的叶片,因此P对叶片基-顶轴方向的生长并无明显作用。
-
叶片是光合作用的载体,而叶片结构变化导致功能变化进而会对光合作用产生影响。有研究表明,叶片栅栏组织的厚度与光能获取能力及叶绿素含量呈正相关[30],气孔限制及叶肉限制也是光合作用的主要影响因素。叶绿素是植物进行光合作用的必需物质,而叶片色素含量与叶片色彩度有关,且有研究表明叶绿素与叶色参数a呈显著负相关[31]。因此,本研究采用叶色参数a值代替叶片叶绿素含量来反映叶片色彩的变化以及间接衡量植物光合作用强弱。本研究中,P处理净光合速率、叶肉导度、气孔导度、胞间CO2浓度、蒸腾速率均大于对照(图 6),叶色参数a(图 3)、水分利用效率小于对照,且净光合速率与叶厚、叶肉导度、气孔导度、胞间CO2浓度呈正相关,与叶色参数a呈负相关(表 3)。表明抑制剂P主要通过增加叶片厚度、叶绿素含量以及增加气孔、叶肉导度及胞间CO2浓度来增加光合作用。有研究发现,P能增加叶片栅栏组织厚度,增加栅栏组织与海绵组织比,使叶片获取和利用光的能力增强[32]。此外,由上述结果可知P未对气孔和叶肉传导CO2的能力产生抑制效应,且由于较大的蒸腾作用使叶片水分利用效率降低。
T处理净光合速率、叶肉导度、气孔导度、胞间CO2浓度、蒸腾速率大体低于对照(图 6),叶色参数a(图 3)、水分利用效率大体高于对照,且净光合速率与叶面积、气孔导度、蒸腾速率,胞间CO2浓度呈相对较高的正相关关系,与叶色参数a及水分利用效率呈相对较高的负相关关系(表 3)。表明T处理对叶面积及叶绿素的抑制以及对气孔导度的限制降低了光合作用,由于蒸腾速率较低使叶片水分利用效率提高。
存在于叶片保卫细胞中A能够促使叶表皮气孔关闭,降低光合速率及蒸腾消耗,增加水分利用效率,同时也能通过诱导叶片中叶绿体丧失的方式降低光合速率。本研究中,A处理净光合速率、叶肉导度、气孔导度、蒸腾速率均小于对照(图 6),叶色参数a(图 3)、水分利用效率大体高于对照,且净光合速率与气孔导度、叶肉导度、蒸腾速率及水分利用效率的正相关关系相对较高,与叶色参数a的负相关较显著(表 3)。表明A对于气孔、叶肉、叶绿体及蒸腾的限制,降低了光合速率,增加了水分利用效率。A处理净光合速率随A浓度的增加呈先增加后降低的趋势(图 6)。这与肖丹曦[33]对紫球藻研究的结果相似,可能与ABA处理对叶绿素含量的影响有关,叶片叶绿素含量可随ABA浓度的增加呈现出先增加后降低的趋势,在某一最适浓度下达到最高。另外,A1光合速率较低也可能与其叶面积较小有关。
-
本研究结果表明:3种抑制剂均有矮化植株、抑制新梢生长的作用,矮化效果最佳、抑制作用最强的为PP333,且高浓度PP333对于高生长的抑制作用持效性较长。叶宽、叶厚以及叶面积在短期PP333处理下高于对照。PP333能提高大叶黄杨净光合速率,主要通过增加叶厚、气孔导度、叶肉导度及叶绿素含量来实现,并且使蒸腾速率提高的同时降低了水分利用效率。TIBA有显著减小叶长、叶宽的作用,但能使叶厚增加,且随浓度的增加作用效果增强,主要通过减小叶面积,降低叶肉导度、气孔导度、胞间CO2浓度及叶绿素含量来降低净光合速率。ABA能增加叶面积(10 mg·L-1处理除外)、叶长以及减小叶片厚度,通过抑制气孔导度、叶肉导度、叶绿素含量降低净光合速率。TIBA及ABA均通过降低蒸腾速率而使水分利用效率提高, 800 mg·L-1 PP333对大叶黄杨具有较好的正向作用。
生长抑制剂对大叶黄杨形态及光合作用的影响
Effects of Plant Growth Inhibitors on the Morphology and Photosynthesis of Euonymus japonicus
-
摘要:
目的 探究抑制剂对大叶黄杨生长的抑制作用以及对其叶片形态和光合作用的影响,为灌木绿篱的化学修剪提供技术指导。 方法 在北京林业大学林场苗圃采用3种生长抑制剂(多效唑(PP333)、三碘苯甲酸(TIBA)以及脱落酸(ABA))对密植成绿篱状的1年生大叶黄杨扦插苗进行叶面喷施,对其生长、叶片形态及光合作用等指标进行测定。 结果 3种抑制剂均有矮化植株、抑制新梢生长的作用,矮化效果最佳、抑制作用最强的为PP333,且高浓度PP333对于高生长的抑制作用持效性较长。叶宽、叶厚以及叶面积在短期PP333处理下高于对照。PP333能提高大叶黄杨净光合速率,主要通过增加叶厚、气孔导度、叶肉导度及叶绿素含量来实现,并且PP333使蒸腾速率提高的同时降低了水分利用效率。TIBA有显著减小叶长、叶宽的作用,但能使叶厚增加,且随浓度的增加作用效果增强,主要通过减小叶面积,降低叶肉导度、气孔导度、胞间CO2浓度及叶绿素含量来降低净光合速率。ABA能增加叶面积(10 mg·L-1处理除外)、叶长以及减小叶片厚度,通过抑制气孔导度、叶肉导度、叶绿素含量降低净光合速率。TIBA及ABA均通过降低蒸腾速率,使水分利用效率提高。 结论 3种抑制剂均有矮化植株、抑制新梢生长的作用,并且影响叶片发育,进而影响叶片光合作用,且800 mg·L-1的多效唑对大叶黄杨具有较好的正向作用。 Abstract:Objective To study the effect of plant growth inhibitors on growth, leaf morphology and photosynthesis of Euonymus japonicus, and provide technical guidance for the chemical pruning shrubs. Method One-year-old E. japonicus cutting stocks planted into hedge were treated with 3 kinds of growth inhibitors, Paclobutrazol (PP333), triiodobenzoic acid (TIBA) and abscisic acid (ABA) by foliar spraying in the nursery of Beijing Forestry University. Then the growth, leaf morphology and photosynthesis were measured. Result These 3 kinds of chemicals can inhibit both plant height growth and shoot growth, and PP333 performed the best. The time of inhibitory effect of high concentration PP333 lasted longer. The leaf area, leaf width and leaf thickness were higher than the control with PP333 in the short term. PP333 increased photosynthetic rate by increasing leaf thickness, stomatal conductance, mesophyll conductance and chlorophyll content and it reduced water use efficiency by increasing the transpiration rate. The leaf length and leaf thickness significantly reduced, but the leaf thickness increased with TIBA concentration increasing. Photosynthetic rate reduced in TIBA mainly due to reduced leaf area, mesophyll conductance, stomatal conductance, intercellular CO2 concentration and chlorophyll content. The Leaf area (except 10 mg·L-1 ABA) and leaf length increased, but the leaf thickness reduced with ABA. ABA can reduce photosynthetic rate mainly by reducing the mesophyll conductance, stomatal conductance and chlorophyll content. TIBA and ABA increased water use efficiency by reducing the transpiration rate. Conclusion All the 3 kinds of chemicals can inhibit both plant height growth and shoot growth, and affect leaf development, and then affect leaf photosynthesis. PP333 with a concentration of 800 mg·L-1 performs the best. -
Key words:
- plant growth inhibitor
- / Euonymus japonicus
- / PP333
- / ABA
- / TIBA
- / photosynthesis
- / chemical pruning
-
表 1 各生长抑制剂种类及浓度
Table 1. Types and concentrations of growth inhibitors
处理
Treatment种类
Type浓度
Concentration/(mg·L-1)CK 清水 0 P1 多效唑(P) 200 P2 多效唑(P) 400 P3 多效唑(P) 600 P4 多效唑(P) 800 T1 三碘苯甲酸(T) 50 T2 三碘苯甲酸(T) 100 T3 三碘苯甲酸(T) 200 T4 三碘苯甲酸(T) 400 T5 三碘苯甲酸(T) 600 A1 脱落酸(A) 10 A2 脱落酸(A) 25 A3 脱落酸(A) 50 A4 脱落酸(A) 75 A5 脱落酸(A) 100 表 2 不同抑制剂大叶黄杨叶形线性回归系数
Table 2. Linear regression coefficient of leaf shape in different treatment
处理
Treatment叶形回归系数
Linear regression coefficient of leaf shape斜率kw △lw 斜率kl △ll P -0.000 6 -0.497 -0.000 03 0.230 T 0.000 4 0.708 0.000 9 0.388 A -0.002 1 0.263 -0.004 8 -0.047 注:△lw、△ll分别表示对照与各抑制剂处理间叶宽、叶长的差值。
Note:△lw expresses the difference in leaf width between control and treatments, △ll expresses the difference in leaf length between control and treatments.表 3 各处理净光合速率与光合相关指标的相关性分析
Table 3. Correlation analysis between net photosynthetic rate and photosynthetic related indexes in different treatments
处理
Treatment叶厚
Leaf thickness叶面积
Leaf area色相a值
Hue a-value气孔导度
Stomatalconductance叶肉导度
Mesophyll conductance胞间
CO2浓度Intercellular CO2 concentration蒸腾速率
Transpiration rate水分利用效率
Water use efficiency净光合速率
Net photosyntheticP 0.615 0.018 -0.814 0.912 0.805 0.785 0.885 -0.922 T 0.289 0.667 -0.987** 0.928* 0.354 0.841 0.714 -0.557 A -0.059 0.341 -0.981** 0.778 0.889* 0.443 0.631 0.531 -
[1] Sharma D K, Dubey A K, Srivastav M, et al. Effect of Putrescine and Paclobutrazol on Growth, Physiochemical Parameters, and Nutrient Acquisition of Salt-sensitive Citrus Rootstock Karna khatta (Citrus karna Raf.) under NaCl Stress[J]. Journal of Plant Growth Regulation, 2011, 30(3):301-311. doi: 10.1007/s00344-011-9192-1 [2] Steinberg S L, Zajicek J M, Mcfarland M J. Water relations of hibiscus following pruning or chemical growth regulation[J]. Journal of the American Society for Horticultural Science, 1991, 116(3):465-470. doi: 10.21273/JASHS.116.3.465 [3] Burch, P L, Wells R H, Kline W N I. Red maple and silver maple growth evaluated 10 years after application of paclobutrazol tree growth regulator[J]. Arboriculture, 1996, 22(2):61-66. [4] Redding K D, Burch P L, Miller K C. Growth, biomass, and trim/chip time reduction following application of flurprimidol tree growth regulator[J]. Arboriculture, 1994, 20:38-45. [5] 刘春燕, 胡国强, 宋红梅, 等.多效唑、矮壮素对绿篱植物大叶黄杨的矮化效果研究[J].林业实用技术, 2009(7):47-48. [6] 张福海, 夏繁茂.几种生长延缓剂在绿篱化学修剪中的应用研究[J].林业实用技术, 2007(10):8-9. [7] 杨艳丽.多效唑在绿篱化学修剪中的应用研究[J].现代农业科技, 2010(5):124-126. doi: 10.3969/j.issn.1007-5739.2010.05.090 [8] 刘克斌, 李曙轩, 裘文达.多效唑对大叶黄杨株型的控制效应[J].上海农业学报, 1989(1):47-54. [9] 姚连芳, 杨立峰, 张元文, 等. PP333抑制大叶黄杨枝梢生长的效果[J].河北农业技术师范学院学报, 1991(3):78-80. [10] 徐程扬.紫椴幼苗、幼树对光的响应与适应研究[D].北京, 北京林业大学, 1999. [11] Davis D B, Dernoeden P H. Summer patch and Kentucky bluegrass quality as influenced by cultural practices[J]. Agriculture, 1991, 83(4):670-677. [12] Burrows G E, Boag T S, Stewart W P. Changes in leaf, stem, and root anatomy of chrysanthemum cv. Lillian Hoek following paclobutrazol application[J]. Plant Growth Regulation, 1992, 11(4):189-194. doi: 10.1007/BF02115476 [13] Haque S, Farooqi A H A, Gupta M M, et al. Effect of ethrel, chlormequat chloride and paclobutrazol on growth and pyrethrins accumulation in Chrysanthemum cinerariaefolium Vis[J]. Plant Growth Regulation, 2007, 51(3):263-269. doi: 10.1007/s10725-007-9170-6 [14] Asin L, Alegre S, Montserrat R. Effect of paclobutrazol, prohexadione-Ca, deficit irrigation, summer pruning and root pruning on shoot growth, yield, and return bloom, in a 'Blanquilla' pear orchard[J]. Scientia Horticulturae, 2007, 113(2):142-148. doi: 10.1016/j.scienta.2007.02.008 [15] 何生根, 李红梅, 刘伟.植物生长调节剂在观赏植物上的应用[M].北京:化学工业出版社, 2010. [16] 刘静雅, 李绍才, 孙海龙, 等.多效唑对紫穗槐生长及生理特性的影响[J].植物科学学报, 2016, 34(2):271-279. [17] 姜英, 彭彦, 申文辉, 等.植物生长延缓剂对盆栽金钱树生长及观赏品质的影响[J].西南林业大学学报, 2011, 31(6):10-12. doi: 10.3969/j.issn.2095-1914.2011.06.003 [18] Westoby M, Falster D S, Moles A T, et al. Plant ecological strategies:some leading dimensions of variation between species[J]. Annual Review of Ecology and Systematics, 2002, 33(1):125-159. doi: 10.1146/annurev.ecolsys.33.010802.150452 [19] Niinemets U. Global-scale climatic controls of leaf dry mass Per area, density, and thickness in trees and shrubs[J]. Ecology, 2001, 82(2):453-469. doi: 10.1890/0012-9658(2001)082[0453:GSCCOL]2.0.CO;2 [20] Bloom A J, Chapin F S, Mooney H A. Resource limitation in Plants-An economic analogy[J]. Annual Review of Ecology and Systematics, 1985, 16(1):363-392. doi: 10.1146/annurev.es.16.110185.002051 [21] 林多, 赵康, 陈宁, 等.植物生长延缓剂对夏季番茄穴盘苗生长及根系形态的影响[J].西北农业学报, 2013, 22(10):140-145. doi: 10.7606/j.issn.1004-1389.2013.10.025 [22] 韩威, 刘超, 樊艳文, 等.长白山阔叶木本植物叶片形态性状沿海拔梯度的响应特征[J].北京林业大学学报, 2014, 36(4):47-53. [23] Woodward A W, Bartel B. A receptor for auxin[J]. Plant Cell, (2005a), 17(9):2425-2429. doi: 10.1105/tpc.105.036236 [24] Reinhardt D, Pesce E R, Stieger P, et al. Regulation of phyllotaxis by polar auxin transport[J]. Nature, 2003, 426(6964):255-260. doi: 10.1038/nature02081 [25] Zgurski J M, Sharma R, Bolokoski D A, et al. Asymmetric auxin response precedes asymmetric growth and differentiation of asymmetric leaf1 and asymmetric leaf 2 Arabidopsis leaves[J]. Plant Cell, 2005, 17(1):77-91. doi: 10.1105/tpc.104.026898 [26] Pekker I, Alvarez J P, Eshed Y. Auxin response factors mediate Arabidopsis organ asymmetry via modulation of KANADI activity[J]. Plant Cell, 2005, 17(11):2899-2910. doi: 10.1105/tpc.105.034876 [27] Mattsson J, Ckurshumova W, Berleth T. Auxin signaling in Arabidopsis leaf vascular development[J]. Plant Physiology, 2003, 131(3):1327-1339. doi: 10.1104/pp.013623 [28] Livanos P, Giannoutsou E, Apostolakos P, et al. Auxin as an inducer of asymmetrical division generating the subsidiary cells in stomatal complexes of Zea mays[J]. Plant Signaling & Behavior, 2015, 10(3):1-15. [29] 杨忠义, 范春晖, 郭平毅.氮肥和多效唑对冬小麦叶片生理功能的调控[J].植物营养与肥料学报, 2008, 14(5):947-950. doi: 10.3321/j.issn:1008-505X.2008.05.020 [30] 董倩, 王洁, 庞曼, 等.生长调节剂对黄连木光合生理指标和荧光参数的影响[J].西北植物学报, 2012, 32(3):484-490. doi: 10.3969/j.issn.1000-4025.2012.03.008 [31] 葛雨萱, 王亮生, 周肖红, 等.香山黄栌叶色和色素组成的相互关系及时空变化[J].林业科学, 2011, 47(4):38-42. [32] 游鸯.多效唑对藤本月季光合特性及叶片显微结构的影响[D].合肥, 安徽农业大学, 2014. [33] 肖丹曦.植物激素ABA和GA对紫球藻生长的影响[D].广州, 暨南大学, 2009. -




 下载:
下载: