-
白榆(Ulmus pumila L.)是我国北方重要的造林树种之一,具有木质好、长速快、适应能力强等特性,同时在耐盐碱、抗旱等方面也具有一定优势[1-2]。对于白榆的研究由最早的优种选育[3]到后来的白榆的耐盐性、耐盐品系的筛选[4-7]以及盐胁迫对白榆基因表达的影响[8]等方面,前人都做了大量的研究,关于如何提高白榆耐盐性的研究却少有报道。研究表明,外源施加水杨酸(salicylic acid,SA)有助于加强植物对逆境的抵抗能力[9]。基于此,本试验以1年生白榆品种‘白洼一号’幼苗为材料,研究不同浓度水杨酸的喷施对盐胁迫下白榆生理代谢的影响,为盐渍化立地白榆高效栽培管理技术体系的建立提供理论依据和技术支撑。
-
选择白榆‘白洼一号’1年生无性系组培苗,于2017年4月份移栽至中国林业科学研究院科研温室。选取植株健壮且长势一致的白榆苗进行盆栽培养,每盆种植1株白榆苗,定期浇水,保持基质湿润;花盆规格为22 cm × 20 cm,育苗基质为V(蛭石):V(珍珠岩)=3:1。缓苗2个月,待苗高达到40 cm时开始试验处理,期间浇1/2 Hoagland营养液,每周1次,每次每盆400 mL。
-
首先用少量无水酒精溶解SA,再用蒸馏水配制0、0.5、1.0、2.0 mmol·L-1 4个浓度梯度的SA溶液(内含0.02% Tween-20),记为SA0、SA0.5、SA1.0、SA2.0。每次均匀喷施叶片正反面,每株50 mL,对照采用等量的蒸馏水处理,3 d为1周期。待水杨酸喷施2 d后进行盐胁迫处理。
-
NaCl处理浓度分别为0、50、100和150 mmol·L-1,记为S0、S50、S100、S150,每盆浇500 mL NaCl溶液,对照浇等量蒸馏水,3 d为1周期。为防止盐浓度过高带来的冲击,100 mmol·L-1和150 mmol·L-1两个处理每天递增预定浓度的1/2,各处理同时达到预定盐浓度,此时定为盐胁迫的第一天。为防止水分蒸发导致盐累积现象,定期用同等浓度的盐溶液淋洗花盆基质。每种盐处理都对应喷施4种浓度的SA,共4×4个处理,每个处理10盆,3个重复。
处理30 d后对白榆水分生理、光合色素含量和光合气体交换参数进行测定。
-
叶片相对含水量的测定:采用烘干称量法[10]。
叶片电解质渗透率的测定:参照高俊凤[11]方法测定电解质渗透率。
叶片可溶性糖含量的测定:采用蒽酮比色法[10]。
叶片丙二醛含量的测定:采用硫代巴比妥酸法[10]。
叶片光合色素含量的测定:参照邹琦[23]的方法测定光合色素的含量。
光合气体参数的测定:选取白榆中上部健康无损伤的叶片,在天气晴朗的上午9:00—11:00用LI 6400便携式光合仪(LI-COR,Lincoln,Nebraska,USA)测定各处理叶片的光合气体交换参数:净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和胞间CO2浓度(Ci)。每个处理测定5株,每株测定2个叶片,每叶片以5次读数的平均值作为测定值。测定时设定光照强度在1 000 μmol·m-2·s-1,参比室CO2浓度为400 μmol·mol-1,相对湿度(RH)为35%~45%。
-
使用Origin 8.6软件对数据进行处理和图表绘制,SPSS 21.0软件进行统计分析,采用Duncan法进行多重比较。
各指标利用隶属函数法进行综合评价分析,计算公式[12]为:
对与耐盐性呈正相关关系的指标求出隶属函数值:
隶属函数值=(Xi-Xmin)/(Xmax-Xmin)
电解质渗透率和丙二醛含量与耐盐性呈负相关,需采用反隶属函数值:
反隶属函数值=1-(Xi-Xmin)/(Xmax-Xmin)
式中:Xi为某一指标测定值,Xmax、Xmin分别为某一指标的最大值和最小值。
-
在未喷施外源SA时,白榆叶片电解质渗透率、可溶性糖含量和丙二醛含量随着盐浓度的增加表现出逐渐升高的趋势,相对含水量则逐渐降低(表 1)。方差分析表明,SA处理以及二者交互作用(NaCl×SA)对白榆电解质渗透率影响均不显著。外源SA对S150处理下的白榆相对含水量改善作用更明显,其中S150SA2.0处理比S150SA0处理提高了11.22%(P < 0.05)。SA2.0处理对于可溶性糖含量增加作用最显著,在不同盐浓度下均与对照形成显著差异(P < 0.05)。外源喷施SA可以有效降低S100和S150处理下的白榆叶片丙二醛含量,其中S100SA0.5处理比S100SA0处理降低了28.98%,S150SA2.0处理比S150SA0处理降低了41.74%(P < 0.05)。
表 1 外源SA对NaCl胁迫下白榆叶片水分生理和膜脂过氧化的影响
Table 1. Effect of exogenous SA on water physiology and membrane lipid peroxidation of Ulmus pumila under NaCl stress
盐处理
NaCl/(mmol·L-1)水杨酸处理
SA/(mmol·L-1)相对含水量
RWC/%电解质渗透率
EL/%可溶性糖
SS content/(mg·g-1)丙二醛
MDA/(mmol·g-1)0 0 90.04±2.08bc 24.41±0.96abc 22.51±0.95a 8.14±0.31ab 0.5 91.89±0.51c 20.91±0.95a 28.20±1.99bcd 8.65±0.72ab 1.0 93.23±0.53c 21.40±1.07ab 24.69±1.71ab 7.82±1.23a 2.0 93.16±0.55c 23.75±0.95abc 22.10±0.77a 7.16±1.00a 50 0 87.99±4.04bc 25.21±1.33abcd 25.39±0.74abc 10.14±1.41abc 0.5 89.18±2.31bc 23.13±1.72abc 22.66±1.20a 13.35±1.08cd 1.0 90.10±0.98bc 24.91±2.43abc 31.28±0.71de 8.25±0.12ab 2.0 88.78±0.95bc 24.53±2.31abc 48.67±1.21h 8.23±0.38ab 100 0 85.87±3.35ab 30.35±1.91def 28.87±1.36cde 12.25±2.61cd 0.5 88.76±1.69bc 27.42±2.66bcde 31.35±0.04de 8.70±1.07ab 1.0 92.14±0.87c 28.77±1.73cde 33.01±1.35e 9.13±1.88ab 2.0 89.66±0.58bc 25.11±2.25abcd 44.12±1.80g 9.47±1.44abc 150 0 80.93±3.41a 34.66±2.89f 45.77±1.07gh 17.73±1.91e 0.5 87.32±0.32b 27.81±2.42cde 38.94±0.20f 13.91±1.17d 1.0 87.81±1.23bc 31.81±1.84ef 52.79±1.85i 10.64±0.16abcd 2.0 90.01±0.76bc 34.41±0.58f 65.28±2.16i 10.33±0.16abcd F值 NaCl 5.744** 20.056** 274.810** 11.858** SA 4.825** 2.796 105.886** 6.702** NaCl×SA 0.700 0.847 23.708** 2.170 注:同列数据后标不同字母表示差异显著(P < 0.05);*表示在0.05水平上显著,**表示在0.01水平上显著
Note:Different letters in each column mean significant different in P < 0.05 level;*Difference is significant at 0.05 level,** Difference is significant at 0.01 level. -
在未喷施外源SA时,随着NaCl浓度的升高,白榆叶片的光合色素含量均呈现先降低后升高的趋势(表 2)。在S0和S150处理下,外源喷施SA均未对光合色素含量造成显著影响(P>0.05)。在S50处理下,SA0.5处理效果最佳,能显著提高白榆光合色素含量(P < 0.05);在S100处理下,SA0.5和SA2.0处理均可以显著提高白榆叶片光合色素的含量(P < 0.05)。方差分析表明,SA处理对光合色素含量影响显著,NaCl处理以及二者交互作用(NaCl×SA)对叶绿素b和叶绿素(a+b)含量影响不显著。
表 2 外源SA对NaCl胁迫下白榆叶片光合色素含量的影响
Table 2. Effect of exogenous SA on photosynthetic pigment content of Ulmus pumila under NaCl stress
盐处理
NaCl/(mmol·L-1)水杨酸处理
SA/(mmol·L-1)叶绿素
aChla/(mg·g-1)/%叶绿素
bChlb/(mg·g-1)类胡萝卜素
Car/(mg·g-1)叶绿素(a+b)
Chla+b/(mg·g-1)0 0 1.90±0.11bcdef 0.70±0.05abc 0.33±0.02cdefg 2.59±0.17bcd 0.5 2.00±0.11f 0.68±0.08abc 0.35±0.02g 2.68±0.19d 1.0 1.77±0.01abc 0.63±0.02a 0.31±0.01abcde 2.40±0.01abc 2.0 1.95±0.03def 0.71±0.02abc 0.35±0.02g 2.66±0.03cd 50 0 1.75±0.12ab 0.64±0.04ab 0.30±0.01ab 2.40±0.16ab 0.5 1.92±0.05cdef 0.75±0.02c 0.33±0.01cdefg 2.67±0.07d 1.0 1.65±0.02a 0.63±0.02a 0.30±0.01abcde 2.28±0.03a 2.0 1.75±0.04ab 0.69±0.01abc 0.29±0.01a 2.44±0.04abcd 100 0 1.65±0.01a 0.64±0.02a 0.30±0.01abc 2.28±0.01a 0.5 1.98±0.03ef 0.74±0.02bc 0.35±0.01fg 2.73±0.05d 1.0 1.70±0.05a 0.64±0.02ab 0.31±0.01abcde 2.35±0.07ab 2.0 1.96±0.01def 0.76±0.02c 0.34±0.01efg 2.72±0.01d 150 0 1.82±0.02bcdef 0.71±0.01abc 0.32±0.01abcdef 2.53±0.02bcd 0.5 1.76±0.01abc 0.70±0.01abc 0.29±0.01ab 2.46±0.01abcd 1.0 1.79±0.06abcde 0.69±0.01abc 0.34±0.01defg 2.48±0.05abcd 2.0 1.94±0.06def 0.72±0.03abc 0.33±0.02defg 2.67±0.07cd F值 NaCl 3.742* 0.704 5.746** 1.836 SA 9.987** 5.710** 3.470* 9.451** NaCl×SA 2.426* 1.141 3.610** 2.076 注:同列数据后标不同字母表示差异显著(P < 0.05);*表示在0.05水平上显著,**表示在0.01水平上显著Note:Different letters in each column mean significant different in P < 0.05 level;*Difference is significant at 0.05 level,** Difference is significant at 0.01 level. -
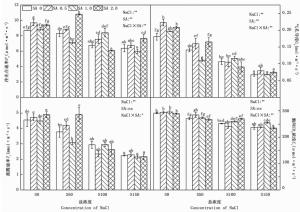
随着盐浓度的增加,白榆Pn、Gs、Tr、Ci均逐渐降低(图 1)。外源喷施SA对白榆Pn和Gs影响较显著(P < 0.05)。2.0 mmol·L-1SA效果最佳,能显著增加S50和S150盐处理下白榆Pn,最大增加了30.43%;此外,2.0 mmol·L-1SA还显著增加了S50处理下白榆Gs。方差分析结果表明外源喷施SA对白榆Tr和Ci影响不显著,其中SA2.0处理效果最佳,分别显著增加了S50处理下白榆Tr和S100处理下白榆Ci。此外,SA1.0处理显著降低了S50处理下白榆的Pn和Gs(P < 0.05),表现出了抑制作用。
-
由于不同生理指标在各处理组合中的表现各异,部分指标的变化难以综合的反映外源SA在各盐浓度下的作用效果,所以需采用隶属函数法对各处理组合的作用效果进行综合性评价。16个处理的隶属函数值及排序见表 3。由表 3可知,由于未进行NaCl胁迫,所以0 mmol·L-1NaCl浓度下喷施外源SA的处理组合排名靠前;50 mmol·L-1NaCl处理下,改善效果最佳的是0.5 mmol·L-1SA, 排名第4;100 mmol·L-1NaCl处理下,改善效果最佳的是2.0 mmol·L-1SA,排名第5;150 mmol·L-1NaCl处理下,改善效果最佳的是2.0 mmol·L-1SA,排名第9。综合分析,外源SA对50和100 mmol·L-1NaCl胁迫下白榆的生理指标改善效果更明显。
表 3 各处理下白榆隶属函数值
Table 3. Subordinate function values of Ulmus pumila under treatment
处理 平均隶属函数值 排序 S0SA0 0.681 3 S0SA0.5 0.825 1 S0SA1.0 0.604 6 S0SA2.0 0.808 2 S50SA0 0.425 10 S50SA0.5 0.667 4 S50SA1.0 0.353 13 S50SA2.0 0.602 7 S100SA0 0.212 16 S100SA0.5 0.572 8 S100SA1.0 0.389 11 S100SA2.0 0.618 5 S150SA0 0.244 15 S150SA0.5 0.299 14 S150SA1.0 0.382 12 S150SA2.0 0.498 9 -
盐胁迫抑制植物的生长可能与水分的吸收与利用效率降低有关[13]。本研究中,外源SA处理提高了盐胁迫下白榆叶片的相对含水量,提高了白榆的耐盐性,这与周旋[14]等对茶树的研究结果相似。盐胁迫会损害细胞膜,导致膜脂过氧化,进而使电解质渗透率升高。本研究中,盐胁迫下SA处理虽然能不同程度降低白榆叶片电解质渗透率,但除S150SA0.5处理外均未达到显著性差异,说明SA对盐胁迫下白榆叶片的电解质渗透率缓解作用不明显,这可能与植物种、试验设置浓度以及取样时间有关系。外源SA对白榆叶片相对含水量和电解质渗透率的改善作用均表现为50 mmol·L-1盐胁迫时作用不明显,100和150 mmol·L-1盐浓度下改善作用才明显,可能是由于白榆受到低盐(50 mmol·L-1NaCl)的胁迫作用影响较小,所以外源SA的效果不明显。本研究中,白榆叶片内的可溶性糖含量随着盐浓度的增加而上升,这与成铁龙等[15]对4种耐盐植物的研究结果一致,外源SA会增加盐胁迫下白榆叶片内的可溶性糖含量,进而降低渗透势,稳定细胞膜结构,提高白榆的吸水能力去适应盐胁迫,这表明外源SA改善了白榆的耐盐性,尤其以2.0 mmol·L-1 SA效果最佳。丙二醛含量是反映植物遭受胁迫程度的重要指标之一,盐胁迫导致的膜脂过氧化会导致植物体内的丙二醛含量升高[16],损坏细胞及细胞膜结构的完整。本研究中外源喷施SA会显著降低100和150 mmol·L-1盐胁迫下白榆体内丙二醛含量,降低了膜脂过氧化对白榆自身的伤害,这与前人的研究结果一致[17],而在50 mmol·L-1盐胁迫下改善作用不明显,这可能与50 mmol·L-1 NaCl并未显著增加白榆叶片丙二醛含量有关,导致改善作用不明显。
叶绿素含量可以反映盐胁迫下植物光合作用的强弱[18]。在土壤盐渍化条件下,植物叶片内的叶绿体结构会遭到破坏,导致叶绿素的合成受到抑制或者加速叶绿素的分解[19]。本研究中,未喷施外源SA的白榆叶片光合色素含量随着NaCl浓度的增加先降低后升高。低盐时破坏了白榆叶绿体结构,加之没能将白榆在盐胁迫下的抵抗机制激活,导致了光合色素含量的降低;随着盐浓度的升高,白榆通过提高体内光合色素的合成,进而降低盐胁迫带来的伤害。这与朱金方等[20]对盐胁迫下柽柳叶绿素的研究结果相似。SA能够通过促进叶绿素合成,使光合效率得到提高,以此来改善植物的耐盐性[21]。本研究中,添加不同浓度外源SA更倾向于提高50 mmol·L-1和100 mmol·L-1盐浓度下白榆叶片的叶绿素含量,而对150 mmol·L-1NaCl浓度下白榆光合色素含量改善作用不显著,这可能与SA0处理下150 mmol·L-1盐浓度较其它两个盐浓度白榆叶绿素含量有所升高有关,所以外源SA的改善作用不明显。此外,1.0 mmol·L-1SA对各盐浓度下白榆光合色素含量改善作用均不显著。其机制需要进一步补充分子证据来揭示。
目前,关于盐胁迫下植物光合速率下降的原因,广泛认为有两种,分别是气孔限制和非气孔限制。根据Farquhar等[22]的观点,气孔因素引起的Pn降低表现为Gs和Ci降低,而非气孔因素引起的Pn降低则伴随着Ci的提高。本研究中,白榆叶片Pn、Gs、Tr、Ci均随盐浓度的增加而明显降低,表明白榆光合作用的抑制主要是由气孔限制引起的,对柳树的研究有同样的结果[23]。喷施适量SA能有效改善盐胁迫对白榆光合气体交换能力的抑制,改善了白榆光合气体交换参数。一方面,SA能调节气孔导度,促进盐胁迫下叶片中碳的羧化作用,提高水分利用效率,从而提高光合作用[24];另一方面,SA能提高盐胁迫下Rubisco酶等光合作用相关酶的活性,从而提高光合作用[25]。盐胁迫下白榆对每一浓度的外源SA的生理响应不同,2.0 mmol·L-1 SA处理能明显提高50 mmol·L-1 NaCl胁迫下白榆的Pn、Gs和Tr,1.0 mmol·L-1 SA反而会加重胁迫伤害,显著降低Pn和Gs,抑制光合作用。这与董慧[26]对黑麦草的研究结果相符。因此,浓度应作为今后讨论SA对植物抗逆影响所考虑的一个方面。
-
隶属函数法综合评价可以看出,50 mmol·L-1NaCl浓度下,作用最佳的SA浓度是0.5 mmol·L-1,而100和150 mmol·L-1NaCl浓度下,作用最佳的SA浓度是2.0 mmol·L-1。外源SA还表现出一定的浓度效应,0.5 mmol·L-1和2.0 mmol·L-1 SA可以有效缓解盐胁迫对白榆幼苗的胁迫效应,改善其生理特性,而1.0 mmol·L-1 SA明显降低了50 mmol·L-1盐浓度下白榆幼苗的净光合速率和气孔导度。由于树种、试验处理方法以及设置浓度的不同,最适宜的外源SA浓度在不同的研究中存在差异。
外源水杨酸对盐胁迫下白榆生理特性的影响
The Effect of Exogenous Salicylic Acid on the Physiological Characteristics of Ulmus pumila Plantlet under NaCl Stress
-
摘要:
目的 以白榆幼苗为材料,研究不同浓度水杨酸(SA)的喷施对盐胁迫下白榆生理代谢的影响。 方法 以1年生白榆品种‘白洼一号’幼苗为材料,在0、50、100和150 mmol·L-1 NaCl浓度下,喷施不同浓度SA(0、0.5、1.0、2.0 mmol·L-1),处理30 d后对白榆水分生理、膜脂过氧化、光合色素含量和光合气体交换参数进行测定。 结果 表明:(1)盐胁迫下,外源SA可以显著提高白榆叶片相对含水量、可溶性糖含量,并降低丙二醛含量,但对电解质渗透率影响不显著。(2)0.5和2.0 mmol·L-1 SA会显著提高50和100 mmol·L-1NaCl胁迫下白榆叶片的光合色素含量,1.0 mmol·L-1 SA对各盐浓度下光合色素含量改善作用均不明显。(3)2.0 mmol·L-1 SA的添加提高了盐胁迫下白榆光合气体交换参数,1.0 mmol·L-1 SA明显降低了50 mmol·L-1盐浓度下白榆叶片的净光合速率和气孔导度。 结论 适宜浓度的SA能改善白榆的生理参数,隶属函数法综合评价表明:0.5和2.0 mmol·L-1 SA对盐胁迫下白榆生理参数的改善作用较明显。 Abstract:Objective To study the effect of spraying Salicylic acid (SA) with different concentration on the physiological metabolism of Ulmus pumila tissue-cultured plantlets under salt stress. Method One-year-old U. pumila "Baiwa NO.1" plantlets were selected as materials and the effect of spraying different concentrations of SA (0, 0.5, 1.0, 2.0 mmol·L-1) on the water physiology, membrane lipid peroxidation, photosynthetic pigment content and photosynthetic gas exchange parameters were studied under 0, 50, 100 and 150 mmol·L-1 NaCl treatments. Result (1) Exogenous SA improved the relative water content and soluble sugar content in leaves significantly, and decreased the MDA content, but it had no significant effects on the electrolyte leakage. (2) 0.5 and 2.0 mmol·L-1 SA improved the chlorophyll a, chlorophyll b, carotenoid and chlorophyll a+b contents in the leaves of U. pumila under 50 and 100 mmol·L-1 NaCl stress. And the effect of 1.0 mmol·L-1 SA on the chlorophyll content under each NaCl concentration was not significant. (3) The net photosynthetic rate (Pn), stomatal conductance (Gs), intercellular CO2 concentration (Ci) and transpiration rate (Tr) increased significantly with the addition of 2.0 mmol·L-1 SA under NaCl stress. The addition of 1.0 mmol·L-1 SA decreased Pn and Gs significantly under each NaCl concentration. Conclusion Appropriate SA concentration can alleviate the physiological parameters of U. pumila under salt stress. The results of comprehensive evaluation using the subordinate function method show that 0.5 and 2.0 mmol·L-1 are the optimal concentration of SA. -
Key words:
- Ulmus pumila
- / salt stress
- / salicylic acid
- / physiological characteristics
-
表 1 外源SA对NaCl胁迫下白榆叶片水分生理和膜脂过氧化的影响
Table 1. Effect of exogenous SA on water physiology and membrane lipid peroxidation of Ulmus pumila under NaCl stress
盐处理
NaCl/(mmol·L-1)水杨酸处理
SA/(mmol·L-1)相对含水量
RWC/%电解质渗透率
EL/%可溶性糖
SS content/(mg·g-1)丙二醛
MDA/(mmol·g-1)0 0 90.04±2.08bc 24.41±0.96abc 22.51±0.95a 8.14±0.31ab 0.5 91.89±0.51c 20.91±0.95a 28.20±1.99bcd 8.65±0.72ab 1.0 93.23±0.53c 21.40±1.07ab 24.69±1.71ab 7.82±1.23a 2.0 93.16±0.55c 23.75±0.95abc 22.10±0.77a 7.16±1.00a 50 0 87.99±4.04bc 25.21±1.33abcd 25.39±0.74abc 10.14±1.41abc 0.5 89.18±2.31bc 23.13±1.72abc 22.66±1.20a 13.35±1.08cd 1.0 90.10±0.98bc 24.91±2.43abc 31.28±0.71de 8.25±0.12ab 2.0 88.78±0.95bc 24.53±2.31abc 48.67±1.21h 8.23±0.38ab 100 0 85.87±3.35ab 30.35±1.91def 28.87±1.36cde 12.25±2.61cd 0.5 88.76±1.69bc 27.42±2.66bcde 31.35±0.04de 8.70±1.07ab 1.0 92.14±0.87c 28.77±1.73cde 33.01±1.35e 9.13±1.88ab 2.0 89.66±0.58bc 25.11±2.25abcd 44.12±1.80g 9.47±1.44abc 150 0 80.93±3.41a 34.66±2.89f 45.77±1.07gh 17.73±1.91e 0.5 87.32±0.32b 27.81±2.42cde 38.94±0.20f 13.91±1.17d 1.0 87.81±1.23bc 31.81±1.84ef 52.79±1.85i 10.64±0.16abcd 2.0 90.01±0.76bc 34.41±0.58f 65.28±2.16i 10.33±0.16abcd F值 NaCl 5.744** 20.056** 274.810** 11.858** SA 4.825** 2.796 105.886** 6.702** NaCl×SA 0.700 0.847 23.708** 2.170 注:同列数据后标不同字母表示差异显著(P < 0.05);*表示在0.05水平上显著,**表示在0.01水平上显著
Note:Different letters in each column mean significant different in P < 0.05 level;*Difference is significant at 0.05 level,** Difference is significant at 0.01 level.表 2 外源SA对NaCl胁迫下白榆叶片光合色素含量的影响
Table 2. Effect of exogenous SA on photosynthetic pigment content of Ulmus pumila under NaCl stress
盐处理
NaCl/(mmol·L-1)水杨酸处理
SA/(mmol·L-1)叶绿素
aChla/(mg·g-1)/%叶绿素
bChlb/(mg·g-1)类胡萝卜素
Car/(mg·g-1)叶绿素(a+b)
Chla+b/(mg·g-1)0 0 1.90±0.11bcdef 0.70±0.05abc 0.33±0.02cdefg 2.59±0.17bcd 0.5 2.00±0.11f 0.68±0.08abc 0.35±0.02g 2.68±0.19d 1.0 1.77±0.01abc 0.63±0.02a 0.31±0.01abcde 2.40±0.01abc 2.0 1.95±0.03def 0.71±0.02abc 0.35±0.02g 2.66±0.03cd 50 0 1.75±0.12ab 0.64±0.04ab 0.30±0.01ab 2.40±0.16ab 0.5 1.92±0.05cdef 0.75±0.02c 0.33±0.01cdefg 2.67±0.07d 1.0 1.65±0.02a 0.63±0.02a 0.30±0.01abcde 2.28±0.03a 2.0 1.75±0.04ab 0.69±0.01abc 0.29±0.01a 2.44±0.04abcd 100 0 1.65±0.01a 0.64±0.02a 0.30±0.01abc 2.28±0.01a 0.5 1.98±0.03ef 0.74±0.02bc 0.35±0.01fg 2.73±0.05d 1.0 1.70±0.05a 0.64±0.02ab 0.31±0.01abcde 2.35±0.07ab 2.0 1.96±0.01def 0.76±0.02c 0.34±0.01efg 2.72±0.01d 150 0 1.82±0.02bcdef 0.71±0.01abc 0.32±0.01abcdef 2.53±0.02bcd 0.5 1.76±0.01abc 0.70±0.01abc 0.29±0.01ab 2.46±0.01abcd 1.0 1.79±0.06abcde 0.69±0.01abc 0.34±0.01defg 2.48±0.05abcd 2.0 1.94±0.06def 0.72±0.03abc 0.33±0.02defg 2.67±0.07cd F值 NaCl 3.742* 0.704 5.746** 1.836 SA 9.987** 5.710** 3.470* 9.451** NaCl×SA 2.426* 1.141 3.610** 2.076 注:同列数据后标不同字母表示差异显著(P < 0.05);*表示在0.05水平上显著,**表示在0.01水平上显著Note:Different letters in each column mean significant different in P < 0.05 level;*Difference is significant at 0.05 level,** Difference is significant at 0.01 level. 表 3 各处理下白榆隶属函数值
Table 3. Subordinate function values of Ulmus pumila under treatment
处理 平均隶属函数值 排序 S0SA0 0.681 3 S0SA0.5 0.825 1 S0SA1.0 0.604 6 S0SA2.0 0.808 2 S50SA0 0.425 10 S50SA0.5 0.667 4 S50SA1.0 0.353 13 S50SA2.0 0.602 7 S100SA0 0.212 16 S100SA0.5 0.572 8 S100SA1.0 0.389 11 S100SA2.0 0.618 5 S150SA0 0.244 15 S150SA0.5 0.299 14 S150SA1.0 0.382 12 S150SA2.0 0.498 9 -
[1] 董健, 田志和.白榆种源和种源内家系综合选择及早期选择的研究[J].辽宁林业科技, 1990(2):3-5. [2] 刘炳响.白榆耐盐生理生态机制研究[D].保定: 河北农业大学, 2012. [3] 马常耕, 李培菊.白榆子代测验的十年结果[J].林业科学, 1990, 26(6):500-505. [4] 李庆贱, 陈志强, 时瑞亭, 等.白榆家系苗期耐盐碱研究[J].北京林业大学学报, 2010, 32(5):74-81. [5] 张晓晓, 慕德宇, 李红丽, 等. NaCl胁迫对不同无性系白榆生理生化特性的影响[J].干旱区资源与环境, 2016, 30(8):188-192. [6] 刘炳响, 王志刚, 梁海永, 等.盐胁迫对不同生境白榆生理特性与耐盐性的影响[J].应用生态学报, 2012, 23(6):1481-1489. [7] 朱建峰, 杨秀艳, 张庆国, 等. NaCl胁迫对白榆不同家系种子萌发及幼苗生长的影响[J].种子, 2016, 35(2):29-32. [8] Zhu J, Yang X, Liu Z, et al. Identification and Target Prediction of MicroRNAs in Ulmus pumila L. Seedling Roots under Salt Stress by High-Throughput Sequencing[J]. Forests, 2016, 7(12):318. doi: 10.3390/f7120318 [9] Senaratna T, Touchell D, Bunn E, et al. Acetyl salicylic acid (Aspirin) and salicylic acid induce multiple stress tolerance in bean and tomato plants[J].Plant Growth Regulation, 2000, 30(2):157-161. doi: 10.1023/A:1006386800974 [10] 邹琦.植物生理学实验指导[M].北京:中国农业出版社, 2000. [11] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社, 2006. [12] 韩瑞宏, 卢欣石, 高桂娟, 等.紫花苜蓿抗旱性主成分及隶属函数分析[J].草地学报, 2006, 14(2):142-146. [13] Rodríguez A A, Córdoba A R, Ortega L, et al. Decreased reactive oxygen species concentration in the elongation zone contributes to the reduction in maize leaf growth under salinity[J]. Journal of Experimental Botany, 2004, 55(401):1383-1390. doi: 10.1093/jxb/erh148 [14] 周旋, 申璐, 金媛, 等.外源水杨酸对盐胁迫下茶树生长及主要生理特性的影响[J].西北农林科技大学学报:自然科学版, 2015, 43(7):161-167. [15] 成铁龙, 李焕勇, 武海雯, 等.盐胁迫下4种耐盐植物渗透调节物质积累的比较[J].林业科学研究, 2015, 28(6):826-832. doi: 10.3969/j.issn.1001-1498.2015.06.010 [16] Allen D J, Mckee I F, Farage P K, et al. Analysis of limitations to CO2, assimilation on exposure of leaves of two Brassica napus cultivars to UV-B[J]. Plant Cell & Environment, 1997, 20(5):633-640. [17] Mimouni H, Wasti S, Manaa A, et al. Does Salicylic Acid (SA) Improve Tolerance to Salt Stress in Plants? A Study of SA Effects On Tomato Plant Growth, Water Dynamics, Photosynthesis and Biochemical Parameters[J]. Omics A Journal of Integrative Biology, 2016, 20(3):180-190. doi: 10.1089/omi.2015.0161 [18] 倪建伟, 武香, 张华新, 等. 3种白刺耐盐性的对比分析[J].林业科学研究, 2012, 25(1):48-53. doi: 10.3969/j.issn.1001-1498.2012.01.009 [19] 王伟华, 张希明, 闫海龙, 等.盐处理对多枝柽柳光合作用和渗调物质的影响[J].干旱区研究, 2009, 26(4):561-568. [20] 朱金方, 刘京涛, 陆兆华, 等.盐胁迫对中国柽柳幼苗生理特性的影响[J].生态学报, 2015, 35(15): 5140-5146. [21] Aftab T, Khan M M A, Silva J A T D, et al. Role of Salicylic Acid in Promoting Salt Stress Tolerance and Enhanced Artemisinin Production in Artemisia annua L [J]. Journal of Plant Growth Regulation, 2011, 30(4):425-435. doi: 10.1007/s00344-011-9205-0 [22] Farquhar G D, Sharkey T D. Stomatal Conductance and Photosynthesis[J]. Annual Reviews of Plant Physiology, 1982, 33(33):317-345. [23] 王宁, 周晓星, 刘俊祥, 等.盐胁迫对柳树无性系SH31离子含量及光合作用的影响[J].林业科学研究, 2015, 28(4):565-569. doi: 10.3969/j.issn.1001-1498.2015.04.017 [24] Nazar R, Iqbal N, Syeed S, et al. Salicylic acid alleviates decreases in photosynthesis under salt stress by enhancing nitrogen and sulfur assimilation and antioxidant metabolism differentially in two mungbean cultivars[J].Journal of Plant Physiology, 2011, 168(8):807-815. doi: 10.1016/j.jplph.2010.11.001 [25] Liu S, Dong Y, Xu L, et al. Effects of foliar applications of nitric oxide and salicylic acid on salt-induced changes in photosynthesis and antioxidative metabolism of cotton seedlings[J].Plant Growth Regulation, 2014, 73(1):67-78. doi: 10.1007/s10725-013-9868-6 [26] 董慧, 段小春, 常智慧.外源水杨酸对多年生黑麦草耐盐性的影响[J].北京林业大学学报, 2015, 37(2):128-135. -




 下载:
下载:


