-
印度黄檀(Dalbergia sissoo(Roxb))是蝶形花科黄檀属的多用途树种,分布于印度、巴基斯坦、尼泊尔等国家[1],其心材是优良的红木,是家具、雕刻及手饰等用材。叶是一种优良的饲用原料[1],花中的挥发油中含酯类、脂肪酸、醛酮类等46种化合物[2],其中的邻苯二甲酸二(2-乙基-己基)酯。具有抗肿瘤等多种活性。它适于年平均气温20℃以上,极端低温在0℃以下的时间不超过5 d,年降水量600~2 000 mm的地区推广种植[3-6]。1999年引入种植在元江干热河谷,它具有耐旱、耐瘠薄,生长快等优良特性,并在广东、广西、海南、四川、云南等省区已大面积推广,种植面积上千公顷。可它的应用目前仅做红木用材。
据报道,我国对石榴[7]、蓝梅[8]、拐枣[9]、葡萄[10]、辣木[11]、印楝[12-14]、苹果[15-16]、菊花[17]、柴胡[18]等中草药植物等的多酚物质提取[19-20]、工艺及抗氧化活性[21]方面都有较深入研究,而对印度黄檀仅李然等[22]利用HPLC法测定印度黄檀中黄檀素、黄檀素甲醚和4-甲氧基黄檀醌等3种物质进行分析测定。笔者也对印度黄檀的构造和变异化学性质[23]和物理力学[24]进行过研究,对其叶多酚的研究尚未见报道。印度学者Roy等[25]对印度黄檀树皮的水提取物和甲醇提取物进行了抗氧化活性测定,结果显示其提取物具有高抗氧化活性,它可能在治疗由ROS引起的疾病具有潜在的应用价值。本研究将通过对印度黄檀叶的进一步研究,为拓展印度黄檀叶等产物的用途和在疾病治疗等应用中提供理论依据。
-
材料选云南元江干热河谷试验区种植的印度黄檀,采集当年生的半木质化枝条及叶片,风干后粉碎过40目筛备用。
-
没食子酸;无水碳酸钠;福林酚;乙醇;FeSO4·7H2O;FeCl3·6H2O;HCl;CH3COONa·3H2O;冰醋酸,以上试剂均为分析纯。2,2-联苯基-1-苦基肼基(DPPH,alfa,95%);2, 4, 6-三(2-吡啶基)-1, 3, 5-三嗪(TPTZ,TCI);去离子水。
-
分析天平AB204-S (Mettler Toledo);微波合成/萃取反应仪(MAS-I上海新仪微波化学科技有限公司);分光光度仪(BECKMAN COULTER DU 800,1cm比色皿);纯水系统(CENTRA R 200,ELGA)。
-
称取2.0 g印度黄檀叶粉末于250 mL圆底烧瓶中,加入49%的乙醇,设定温度50℃、提取时间33 min。提取完成后常压过滤,滤液收集于100 mL容量瓶中定容,即为印度黄檀叶总酚提取液。把该提取液稀释10倍,检测多酚含量及对DPPH-自由基清除能力的测定。
-
在单因素试验的基础上,选择提取温度、提取时间、乙醇体积分数3个因素作为响应变量,利用Design-Expert V8.0.6软件按照Box—Behnken试验设计原理,以印度黄檀叶中总多酚含量为响应值,通过响应曲面分析进行印度黄檀叶总多酚微波辅助提取条件的优化,从而得到最优提取条件。实验因素水平编码设计见表 1。
表 1 响应面分析因素与水平取值
Table 1. Factors and their coded levels used in response surface analysis
因素Factor 编码水平Coded level -1 0 1 A提取温度Extraction temperature/℃ 50 60 70 B提取时间Extraction time/min 20 40 60 C乙醇体积分数volume fraction/% 40 50 60 注:-1、0和1分别表示三个不同编码水平。
Note:-1、0 and 1 represent three different coded level. -
取稀释后的样品溶液1.0 mL于10 mL容量瓶中,加入5.0 mL体积分数10%的福林酚,摇匀反应3~8 min,加入4.0 mL质量分数7.5%的Na2CO3溶液,摇匀静置60 min,于750 nm波长下检测吸光度值,同时以1.0 mL提取溶剂代替样品溶液经过相同步骤处理后作为空白对照。
-
准确称取0.100 0 g没食子酸,用水溶解,定容于100 mL容量瓶。分别移取1.0、2.0、3.0、4.0、5.0 mL没食子酸标准贮备液于100 mL容量瓶中,用水定容至刻度,质量浓度分别为10、20、30、40、50 mg·L-1,备用。分别移取上述工作液1.0 mL于10 mL容量瓶中,各加入5.0 mL体积分数10%的福林酚试剂,摇匀后约3~8 min内,加入4.0 mL质量分数7.5%的Na2CO3溶液,摇匀静置60 min,于750 nm波长下检测吸光度值,同时以1.0 mL水代替没食子酸标准溶液做空白对照。根据测得的吸光度值按标准溶液回归方程计算样品溶液中总多酚的质量浓度,并根据下式计算印度黄檀叶样品中总多酚提取率(%)[8-9]:
$ \mathit{W} = c/m \times 100\% $
式中:W为印度黄檀叶样品中总多酚所占干样品的质量分数(%);c为样品溶液中总多酚质量浓度,由标准曲线线性方程计算得到;m为印度黄檀叶样品质量(g)。
-
取已知浓度印度黄檀叶多酚提取液10、20、30、60、80、100、120、150、200、300 μL于10 mL具塞试管中,加水补至2 mL,各加入2.0 mL 0.1 mmol·L-1 DPPH乙醇溶液混合,室温避光静置30 min后,在517 nm处测定其吸光值As,同时取相应体积提取液,加去离子水补至2 mL,加入无水乙醇2.0 mL,室温避光静置30 min后测定517 nm处的吸光度值Ab,在2.0 mL去离子水中加入2.0 mL DPPH乙醇溶液,相同方法处理后测定吸光度值A0,用50%乙醇调仪器零点,按下面公式计算DPPH自由基清除率(R),并以相同浓度维生素C作为对照。
$ R = \frac{{{A_0} - ({\mathit{A}_\mathit{s}} - {\mathit{A}_\mathit{b}})}}{{{A_0}}} \times 100\% $
-
采用FRAP法测定样品的还原能力,参考Benzie等[26]配制的TPTZ工作液。
-
称取0.278 1 g FeSO4·7H2O,用水溶解后定容于100 mL容量瓶,作为标准贮备液,分别取标准贮备液0.2、0.4、0.6、0.8、1.0、1.5、2.0 mL稀释至100 mL,浓度分别为0.02、0.04、0.06、0.08、0.10、0.15、0.20 mmoL·L-1,分别取不同浓度FeSO4溶液2 mL,加入3 mLTPTZ工作液,混匀后于37℃水浴反应30 min,之后于593 nm处测定吸光度,以2 mL去离子水代替FeSO4溶液作为空白。
-
取不同体积印度黄檀叶多酚提取液,用去离子水补至2 mL,配制成系列不同浓度的检测液,各加入3 mL TPTZ工作液,混匀后于37℃水浴反应30 min,之后于593 nm处测定吸光度,根据吸光度值和标准曲线方程计算FeSO4的当量浓度,并和相同浓度维生素C的还原力作对比。
-
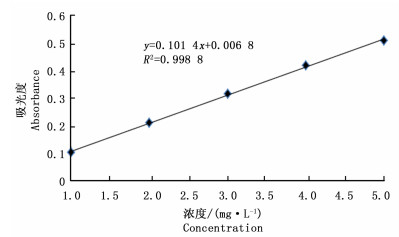
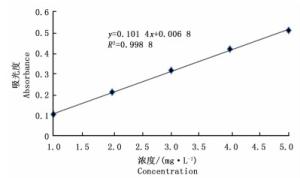
按照1.3.3节的方法测定没食子酸标准溶液的吸光度值,以所得吸光度值为纵坐标,样品质量浓度为横坐标绘制标准曲线,得到没食子酸质量浓度(C)(mg·L-1)与吸光度(A)的线性关系为:
A=0.101 4C+0.006 8 相关系数R2=0.998 8
在1~50 mg·L-1内,吸光度与质量浓度线性关系良好。没食子酸标准曲线见图 1。
-
固定提取时间20 min,乙醇体积分数70%,在提取温度分别为30、40、50、60、70℃下提取。结果(图 2A)显示:当温度从40℃增加至50℃时,样品溶液多酚含量随温度的升高而增大;但当温度继续升高时,溶液多酚含量逐渐下降,当温度上升至60℃时,多酚含量不再下降,温度继续升高到70℃时,样品溶液多酚含量达到最高值,因此,选取50、60、70℃作为响应面实验设计的提取温度条件。
-
固定提取温度50℃,乙醇体积分数70%,分别提取20、40、60、90、120 min。实验结果(图 2B)显示:提取时间在20~60 min时,样品的多酚含量呈逐渐增加趋势;当提取时间超过60 min,提取液多酚含量开始下降。表明提取时间较短时,溶液多酚含量较高,提取时间达到60 min时,印度黄檀叶多酚的提取物接近完成,再延长提取时间,溶液中可能会溶出更多杂质,且随着提取时间的延长,可能引起多酚的氧化,导致其含量降低。选取20、40、60 min作为响应面实验设计的提取时间。
-
固定提取温度50℃,提取时间20 min,在乙醇体积分数分别为10%、30%、50%、70%、90%条件下提取。结果(图 2C)显示:多酚含量随乙醇体积分数的增加呈先上升后下降趋势,当乙醇体积分数为50%时多酚含量最高;乙醇体积分数逐渐升高时,溶剂与多酚极性差异会增大,醇溶性杂质等成分溶出量也增加,与多酚类物质溶剂结合,样品溶液的多酚浓度随乙醇体积分数的增加会先上升后下降。选取乙醇体积分数40%、50%、60%作为响应面实验条件。
-
在单因素试验的基础上,运用Design-Expert V8.0.6数据统计分析软件设计三因素三水平试验,试验方案与结果见表 2。
表 2 Box-Behnken试验设计及结果
Table 2. Experimental design and corresponding results of Box-Behnken for response surface analysis
试验号
No.提取温度(A)
Extraction temperature (A)/℃提取时间(B)
Extraction time(B)/min乙醇体积分数(C)
Ethanol volume Fraction(C)/%多酚含量
Polyphenols content/%1 70 40 40 2.480 2 60 40 50 2.930 3 60 20 60 2.660 4 60 40 50 2.910 5 60 20 40 1.980 6 50 40 40 2.845 7 70 20 50 2.765 8 60 40 50 3.070 9 60 60 40 2.680 10 50 60 50 2.975 11 50 40 60 3.000 12 70 40 60 2.885 13 60 60 60 2.780 14 70 60 50 2.850 15 50 20 50 2.765 -
应用Design—Expert软件对表 2中的数据进行多元回归拟合,得到微波辅助提取印度黄檀叶多酚含量对提取温度(A)、提取时间(B)、乙醇体积分数(C)的二次多项回归方程:
$ \begin{array}{l} 印度黄檀叶多酚= 0.97 - 0.076A + 0.139B + \\ 0.168C - 0.031AB + 0.063AC - 0.145BC + 0.037{A^2}\\ - 0.204{B^2} - 0.241{C^2} \end{array} $
从表 3可知:回归模型显著,表明所得二次多项回归方程显著;失拟项不显著,表明方程失拟不显著,模型能够较好地描述各响应变量与响应值之间的关系,能够用该模型预测实验结果。B、C、B2、C2对印度黄檀叶多酚的提取率影响显著,其它项影响不显著。3个考察因素对印度黄檀叶多酚提取率的影响大小为乙醇体积分数>提取时间>提取温度。
表 3 回归模型方差分析
Table 3. Estimated values of the partial regression coefficients of the regression model
方差来源
Variance source平方和
Sum of squares自由度
Df均方
Mean squareF值
F valueP值
P value显著性
Significance模型Model 0.912 4 9 0.101 4 7.093 9 0.022 * A 0.045 7 1 0.045 8 3.201 5 0.134 B 0.155 4 1 0.155 4 10.874 0 0.022 * C 0.224 4 1 0.224 5 15.705 4 0.011 * AB 0.003 9 1 0.003 9 0.273 3 0.623 AC 0.015 6 1 0.015 6 1.093 3 0.344 BC 0.084 1 1 0.084 1 5.884 7 0.059 A2 0.019 7 1 0.019 7 1.381 5 0.293 B2 0.154 2 1 0.154 2 10.791 5 0.022 * C2 0.213 7 1 0.213 8 14.959 2 0.012 * 残差Residual 0.071 4 5 0.014 3 失拟项Lack of fit 0.056 2 3 0.018 8 2.467 4 0.302 不显著 纯误差Pure error 0.015 2 2 0.007 6 总和Cor total 0.983 9 14 注:*表示影响显著(P < 0.05)。
Notes: * represent correlation is significant at 5% level. -
根据回归模型绘出了印度黄檀叶总多酚提取3个因素交互作用的响应曲面图和等值线图(图 3~5)。
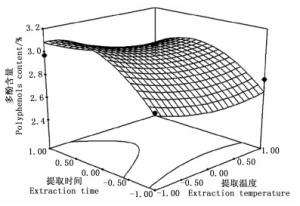
图 3 提取温度和提取时间对多酚含量的响应面和等值线图
Figure 3. The response surface and contour of extraction temperature and time
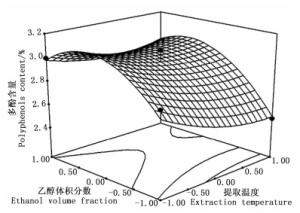
图 4 提取温度和乙醇体积分数对多酚含量的响应面和等值线图
Figure 4. The response surface and contour of extraction temperature and ethanol concentration
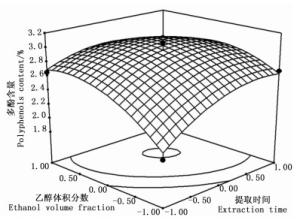
图 5 提取时间和乙醇体积分数对多酚含量的响应面和等值线图
Figure 5. The response surface and contour of extraction time and ethanol concentration
由图 3~5可知:乙醇体积分数曲线较陡,提取时间次之,提取温度曲线较平滑,表明乙醇体积分数对多酚含量的影响最明显[27-28],提取时间次之,提取温度的影响较弱,这与表 3的结果一致。等值线的形状反映了因素之间交互效应的强弱,图 5中等值线的形状呈明显的椭圆形,表明提取时间和乙醇体积分数之间的交互效应对提取率的影响较明显;图 3、4中等值线的形状不规则,表明提取温度和提取时间、提取温度和乙醇体积分数之间的交互效应对印度黄檀叶多酚的提取影响不明显,与表 3中AB、AC、BC之间拟合系数的绝对值大于顺序的方差分析结果一致。
-
为进一步对最佳组合条件进行验证,按回归模型预测确定最佳工艺条件,对印度黄檀叶多酚提取进行3次平行试验,计算叶多酚提取物的提取率及含量。印度黄檀叶多酚提取的最佳提取工艺条件为温度50℃、提取时间33 min、乙醇体积分数49%,印度黄檀叶中多酚含量的最高理论值为3.16%。经3次平行试验验证,得到的印度黄檀叶多酚含量平均值为3.08%,实验值与理论预测值相对误差为2.53%,利用响应面法分析优化得到的印度黄檀叶多酚提取工艺条件稳定,工艺准确可靠,具有实际指导意义。
-
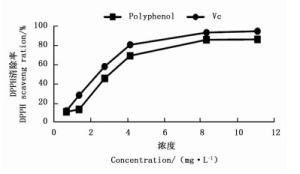
微波辅助提取印度黄檀叶多酚清除DPPH-自由基的测定结果见图 6。由图 6可知:印度黄檀叶乙醇-水提取液对DPPH-自由基具有较强的清除能力[13-14],并随多酚浓度的增加而增强,半数抑制质量浓度(IC50)约为3.2 mg·L-1,略大于维生素C的半数抑制质量浓度(IC50)2.5 mg·L-1。因时间和精力的原因,对印度黄檀叶多酚对·OH、DPPH·和ABTS·的清除作用和清除率有待进一步研究。
-
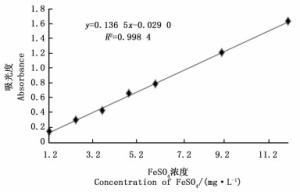
从图 7可知:当FeSO4质量浓度在1.216~12.16 mg·L-1时,浓度与吸光度值呈良好的线性关系。标准曲线方程为:y=0.136 5x-0.029 0
式中:x—FeSO4质量浓度(mg·L-1),y—593 nm处的吸光度值
相关系数R2=0.998 4。
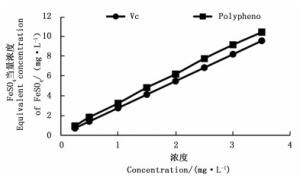
随着印度黄檀叶多酚浓度的增加,还原能力也不断增强,且印度黄檀叶多酚的还原力和天然Vc抗氧化力相当(图 8)。
-
多酚类物质广泛存在于植物的枝皮、根、叶、壳和果肉内,是植物体内的次生代谢产物,具有多元酚羟基结构[27]。提取多酚的方法有溶剂法、微波辅助提取、超声波辅助提取、生物酶解提取、超临界流体萃取、膜技术提取等多种。笔者采用微波辅助提取印度黄檀叶多酚,能强化浸取过程,体系受热均匀,提取物中多酚含量高,提取时间较短。采用这种方法提取印度黄檀叶多酚,其平均含量为3.08%,相对误差2.53%,试验值与理论值相符,是提取印度黄檀叶多酚的适宜方法。
对印度黄檀的应用研究中,印度学者Roy等[25]对印度黄檀树皮的水溶液和乙酸溶液抗氧化活性进行对比研究,发现其对1, 1-二苯基-2-苦基肼基(DPPH)自由基具有很强的清除活性,且对铁离子具有很强的还原能力,也具有很强的亚铁离子螯合作用,同时对Au纳米颗粒具有很好的形成潜力。说明,印度黄檀树皮的水溶液和乙酸溶液的抗氧化活性很强,国内姬国玺等[2]在对印度黄檀花的挥发油中发现其含有酯类、脂肪酸、醛酮类等46种化合物,其中,邻苯二甲酸二(2-乙基-己基)酯具有抗肿瘤等多种活性。黄伞[28]和何首乌[29]的叶片多酚提取液,也表现出了非常强的抗氧化活性。本研究也得出印度黄檀叶内含较高的多酚类物质,具有较强的体外抗氧化活性,可作为天然抗氧化植物资源开发利用。
-
应用响应面法优化印度黄檀叶多酚提取工艺试验结果表明,提取时间和乙醇体积分数对印度黄檀叶多酚的提取影响显著,提取温度的影响较弱,三个响应变量对提取率的影响大小为乙醇体积分数>提取时间>提取温度。二次项的B2、C2对多酚提取影响程度显著。交互作用项,二次项的A2对提取影响不显著。综合分析回归模型确定最佳工艺条件为提取温度50℃、提取时间33 min、乙醇体积分数49%,验证实验得到印度黄檀叶多酚含量平均为3.08%,与理论值相对误差2.53%,试验值与理论值相符。经体外抗氧化实验评价,印度黄檀叶多酚能够在较低浓度发挥抗氧化能力,其提取液对清除DPPH-自由基的半数抑制质量浓度(IC50)约为3.2 mg·L-1略大于Vc的质量浓度(IC50)2.5 mg·L-1,但印度黄檀叶多酚的还原能力略低于Vc的还原能力。
印度黄檀叶多酚提取工艺优化及抗氧化活性研究
Optimization of Extraction Process and Antioxidant Activity of Polyphenols from Leaves of Dalbergia sissoo Roxb.)
-
摘要:
目的 印度黄檀叶含有多酚及类黄酮物质,研究印度黄檀叶多酚及其抗氧化活性,可为其利用提供依据。 方法 以印度黄檀叶为原料,乙醇为提取液,经单因素实验与正交试验设计,检测在不同乙醇浓度、提取时间、提取温度及超声功率120 w时3个因素进行响应面优化试验,确定印度黄檀多酚的提取工艺;同时,鉴定印度黄檀叶乙醇-水提取液对DPPH-自由基的清除能力。 结果 低浓度印度黄檀叶多酚能发挥更强的抗氧化能力,其提取液对清除DPPH自由基的半数抑制质量浓度(IC50)约为3.2 mg·L-1,略大于Vc的2.5 mg·L-1;不过,其还原能力略低于Vc。 结论 印度黄檀叶内富含多酚类物质,具有很强的体外抗氧化活性,可作为天然抗氧化植物资源开发利用。 Abstract:Objective The leaves of Dalbergia sissoo (Roxb.) contain polyphenols and flavonoids. Polyphenols and flavonoids are scavengers of free radicals in organisms, preventing the toxic effects of free radicals on the body and inhibiting lipid peroxidation, i.e. antioxidant activity. Therefore, understanding of polyphenols extraction form leaves and its antioxidant activity in vitro could provide theoretical basis of utilization of leaves of D. sissoo. Method Ethanol was used as the extract of polyphenols in leaves of D. sissoo, and then single factor experiment and orthogonal experiment were used to determine the extraction process of polyphenols. At the same time, the removal capacity of DPPH-free radical of ethanol-water extract of leaves of D. sissoo was identified. Result Low-concentration of polyphenol solution of leaves of D. sissoo had strong antioxidant activity. The concentration of polyphenol solution for inhibitory half number of DPPH free radical (IC50) was about 3.2 mg·L-1, much higher than concentration 2.5 mg·L-1 of Vc, but its reducing ability was slightly lower than the Vc. Conclusion Leaves of D. sissoo are rich in polyphenols and have strong antioxidant activity, which can be used as natural antioxidant plant resources for development and utilization. -
Key words:
- Dalbergia sissoo
- / polyphenols
- / microwave extraction
- / antioxidant activity
-
表 1 响应面分析因素与水平取值
Table 1. Factors and their coded levels used in response surface analysis
因素Factor 编码水平Coded level -1 0 1 A提取温度Extraction temperature/℃ 50 60 70 B提取时间Extraction time/min 20 40 60 C乙醇体积分数volume fraction/% 40 50 60 注:-1、0和1分别表示三个不同编码水平。
Note:-1、0 and 1 represent three different coded level.表 2 Box-Behnken试验设计及结果
Table 2. Experimental design and corresponding results of Box-Behnken for response surface analysis
试验号
No.提取温度(A)
Extraction temperature (A)/℃提取时间(B)
Extraction time(B)/min乙醇体积分数(C)
Ethanol volume Fraction(C)/%多酚含量
Polyphenols content/%1 70 40 40 2.480 2 60 40 50 2.930 3 60 20 60 2.660 4 60 40 50 2.910 5 60 20 40 1.980 6 50 40 40 2.845 7 70 20 50 2.765 8 60 40 50 3.070 9 60 60 40 2.680 10 50 60 50 2.975 11 50 40 60 3.000 12 70 40 60 2.885 13 60 60 60 2.780 14 70 60 50 2.850 15 50 20 50 2.765 表 3 回归模型方差分析
Table 3. Estimated values of the partial regression coefficients of the regression model
方差来源
Variance source平方和
Sum of squares自由度
Df均方
Mean squareF值
F valueP值
P value显著性
Significance模型Model 0.912 4 9 0.101 4 7.093 9 0.022 * A 0.045 7 1 0.045 8 3.201 5 0.134 B 0.155 4 1 0.155 4 10.874 0 0.022 * C 0.224 4 1 0.224 5 15.705 4 0.011 * AB 0.003 9 1 0.003 9 0.273 3 0.623 AC 0.015 6 1 0.015 6 1.093 3 0.344 BC 0.084 1 1 0.084 1 5.884 7 0.059 A2 0.019 7 1 0.019 7 1.381 5 0.293 B2 0.154 2 1 0.154 2 10.791 5 0.022 * C2 0.213 7 1 0.213 8 14.959 2 0.012 * 残差Residual 0.071 4 5 0.014 3 失拟项Lack of fit 0.056 2 3 0.018 8 2.467 4 0.302 不显著 纯误差Pure error 0.015 2 2 0.007 6 总和Cor total 0.983 9 14 注:*表示影响显著(P < 0.05)。
Notes: * represent correlation is significant at 5% level. -
[1] Singh A K, Chand S. Plant regeneration from alginate-encapsulated somatic embryos of Dalbergia sissoo Roxb[J]. Indian Journal of Biotechnology, 2010, 9(6):319-324. [2] 姬国玺, 林励, 帅欧等, 印度黄檀花挥发油气相色谱-质谱分析[J].广州中医药大学学报, 2013, 30(3):409-412. [3] 石雷, 梁英扬, 邓疆.印度黄檀适生性的气候因子研究[J].林业科学研究, 2010, 23(2):191-194. [4] 梁英扬, 石雷, 邓疆.印度黄檀适生性区划方法研究综述[J].云南地理环境研究, 2009, 21(6):14-17. doi: 10.3969/j.issn.1001-7852.2009.06.003 [5] 石雷, 梁英扬, 邓疆.印度黄檀引种试验研究[J].西南农业学报, 2010, 23(2):556-560. doi: 10.3969/j.issn.1001-4829.2010.02.057 [6] 刘絮子, 石雷, 周汝良, 等.基于GIS的云南省印度黄檀造林区划研究[J].林业科学研究, 2012, 25(2):169-173. doi: 10.3969/j.issn.1001-1498.2012.02.010 [7] 赵艳红, 李建科, 李国荣.石榴皮多酚纯化及其抗氧化活性表征[J].食品科学, 2010, 31(11):31-37. [8] 李春阳, 冯进, 蓝莓叶多酚与蓝莓果渣多酚提取物抗氧化活性研究[J].食品工业科技, 2013, 34(7):56-60. [9] 郑朋朋, 李珊, 杨正涛, 等:拐枣不同提取物的体外抗氧化作用[J].中国酿造, 2015, 34(9):121-124. [10] 熊何健, 吴国宏.大孔吸附树脂分离纯化葡萄多酚的研究[J].食品研究与开发, 2007, 28(11):74-77. doi: 10.3969/j.issn.1005-6521.2007.11.023 [11] 林诗洋, 罗晓莲, 赵存朝.辣木叶中多酚提取及抗氧化活性研究[J].食品与发酵科技, 2018(2):62-68. [12] 王有琼, 马李一, 张重权, 等.印楝叶多酚提取及体外抗氧化活性[J].精细化工, 2015, 32(1):64-68. [13] 王有琼, 马李一, 张重权, 等.印楝树皮多酚的提取工艺研究[J].西南农业学报, 2016, 29(3):552-557. [14] 范刚, 杜娟, 尹鸿翔, 等.印楝叶总黄酮的提取工艺研究及含量测定[J].成都中医药大学学报, 2009, 32(3):74-76. [15] 牛鹏飞, 仇农学, 杜寅.苹果渣中不同极性多酚的分离及体外抗氧化活性研究[J].农业工程学报, 2008, 24(3):238-242. doi: 10.3321/j.issn:1002-6819.2008.03.048 [16] 艾志录, 王育红, 潘治利, 等.苹果渣中多酚物质的抗氧化活性研究[J].食品科学, 2006, 27(12):160-163. doi: 10.3321/j.issn:1002-6630.2006.12.031 [17] 皇甫阳鑫, 高子怡, 展俊岭, 等.响应面法优化菊花黄酮超声-微波辅助提取工艺及其抗氧化活性[J].分子科学学报:中英文版, 2018, 34(3):251-257. [18] 邓寒霜, 杨丽娜.响应面法优化柴胡多糖提取工艺[J].中国现代中药, 2018, 20(6):742-747. [19] 吴青, 黄娟, 罗兰欣, 等. 15种中草药提取物抗氧化活性的研究[J].中国食品学报, 2006, 6(1):284-289. doi: 10.3969/j.issn.1009-7848.2006.01.060 [20] 赵扬帆, 郑宝东.植物多酚类物质及其功能学研究进展[J].福建轻纺, 2006(11):107-110. doi: 10.3969/j.issn.1007-550X.2006.11.028 [21] 唐传核.植物生物活性物质[M].北京:化学工业出版社, 2004. [22] 李然, 林励, 祁龙凯等., HPLC法测定印度黄檀中黄檀素等3种成分含量[J].广东药学院学报, 2016, 32(1):51-54. [23] 石雷, 孙庆丰, 邓疆.引进树种印度黄檀解剖构造变异性质及其化学性质的研究[J].林业科学研究, 2008, 21(2):212-216. doi: 10.3321/j.issn:1001-1498.2008.02.014 [24] 石雷, 孙庆丰, 邓疆.引进树种印度黄檀木材解剖构造及其物理力学性质的初步研究[J].林业科学研究, 2008, 21(3):335-339. doi: 10.3321/j.issn:1001-1498.2008.03.010 [25] Roy N, Rajibul R A, Ismail S K, et al. A detailed study on the antioxidant activity of the stem bark of Dalbergia sissoo Roxb., an Indian medicinal plant[J]. Food Chemistry, 2011, 126(3):1115-1121. doi: 10.1016/j.foodchem.2010.11.143 [26] Benzie I F F, Strain J J. The Ferric Reducing Ability of Plasma (FRAP) as a Measure of "Antioxidant Power":The FRAP Assay[J]. Analytical Biochemistry, 1996, 239(1):70-76. [27] 彭茹洁, 汪佳丹, 韩伟.植物多酚提取、分离纯化及其分析方法的研究进展[J].机电信息, 2016(14):21-29. doi: 10.3969/j.issn.1671-0797.2016.14.006 [28] Riethmüller E, Tóth G, Alberti A, et al. Antioxidant activity and phenolic composition of Corylus colurna[J]. Nat Prod Commun, 2014, 9(5):679-682. [29] Pacifico S, Gallicchio M, Lorenz P, et al. Neuroprotective potential of Laurus nobilis antioxidantpolyphenol-enriched leaf extracts[J]. Chem Res Toxicol, 2014, 27(4):611-626. doi: 10.1021/tx5000415 -




 下载:
下载: