-
被子植物的柱头承受花粉并为花粉萌发提供必须基质和识别,柱头下为花柱结构,是花粉管生长的通道。柱头与花柱形成一个整体,使花粉管到达胚珠。花柱是花粉-雌蕊相互作用的部位,也是自交不亲和性反应的场所,因此,花柱的结构必然对花粉管的生长产生影响,并在雌蕊对花粉管的识别过程中发挥主导作用[1-2]。同时,柱头与花柱也分别是孢子体与配子体自交不亲和性反应发生的场所,花粉管生长分别在柱头和花柱中受到抑制[3]。我国学者过去曾在少数植物中开展过关于花柱结构的专门研究:胡适宜等[4]对王百合(Lilium regale Wilson)花柱通道细胞的超微结构研究发现,其通道细胞分泌面的细胞壁的内侧具有许多伸向细胞质的内突,证实通道细胞是一种典型的分泌型传递细胞。狭叶锦鸡儿(Caragana stenophylla Pojark.)花柱道中含有丰富的营养物质,有的是通道细胞分泌,有的是分泌面的壁破裂后原生质流入花柱道中[5]。荞麦(Fagopyrum esculentum Moench)成熟的柱头表面无乳突细胞,柱头细胞的细胞壁存在发达的壁内突,花柱为实心型无引导组织[6]。而在大多数植物中,对发生在柱头和花柱中的自交不亲和性研究多是观察花粉管发生的抑制反应,对花柱本身的结构特征或变化则很少提及[3, 7-10]。
油茶(Camellia oleifera Abel.)为山茶科(Theaceae)山茶属(Camellia)常绿灌木或小乔木,是我国南方重要且特有的木本食用油料树种[11]。油茶在我国种植历史悠久,但生产中产量一直很低,存在花多果少、坐果率低的症结。本研究组历时8年,通过大量研究已探明油茶为自交不亲和性植物,自交不亲和反应发生在花柱基部[7, 12-14]。这一发现主要基于对自交花粉管生长情况的观察而得出,并未涉及花柱的结构特征和变化趋势。但随着研究的深入,在进一步解析自交花粉管在花柱中的抑制机制和花粉管在花柱中的定向生长等一系列问题时受到阻碍,在之前的研究中尚未开展花柱结构的研究,因而不能将自交不亲和反应发生前、后花柱结构变化进行关联分析以阐明自交不亲和性发生的细胞学机制。为解决上述问题,应首先探明油茶未授粉前成熟花柱的结构特征,因此,本研究基于前期研究的基础,利用切片技术观测柱头和花柱的显微和超微结构特征。同时在山茶属植物中,也还未见关于花柱结构的详细、系统的报道,特别是未见油茶花柱超微结构方面的报道。本研究可为进一步解析油茶自交不亲和反应的花粉管-花柱互作机制提供理论依据,同时也为油茶远缘杂交育种工作奠定理论基础,丰富油茶生殖生物学资料。
-
选择生长健壮、能正常开花结果的油茶为试验材料采集对象,材料种植于中南林业科技大学校园,常规水肥管理。本研究中以开花当天未授粉雌蕊的成熟花柱为试验材料,进行显微和超微结构研究。
-
显微结构观测参照高超[12]的方法进行样品制备。将油茶未授粉的成熟花柱取下后放置在卡诺(Carnoy’ s)固定液[95%乙醇:冰醋酸(V/V)=3:1]中固定12 h,同时抽尽材料中的空气,后转入到70%的酒精溶液中并置于4℃冰箱保存备用。将固定好的材料进行适当修整后经各浓度酒精逐级脱水、二甲苯透明、石蜡渗透后包埋,石蜡切片机(Leica RM2235,Germany)切片,厚度为8 μm。后经粘片、脱蜡、复水、4%硫酸铁铵媒染3 h、0.8%爱氏(Ehrlich’ s)苏木精染色25 min、2.0%硫酸铁铵分色20 min、再经脱水、0.2%曙红染色,最后用加拿大树胶制作永久封片。最后于光学显微镜(Olympus BX-51,Japan)下拍照。
-
扫描电镜观测的制样是用镊子和解剖刀小心取下并切割花柱,用2.5%戊二醛固定液(0.1 mol·L-1磷酸缓冲液配制)前固定2 h,磷酸缓冲液(0.1 mol·L-1)洗涤后用1%锇酸固定液(0.1 mol·L-1磷酸缓冲液配制)后固定2 h,磷酸缓冲液(0.1 mol·L-1)洗涤后乙醇梯度脱水,过渡到叔丁醇中后,冷冻干燥。将样品摆放在样品台上放入离子溅射仪中镀金20 min。用扫描电子显微镜(JSM-6390,Japan)进行观察、拍照。
-
超微结构制样是用解剖工具小心切下花柱,迅速投入到由2.5%戊二醛、0.1 mol·L-1磷酸缓冲液(pH 7.2)配制的前固定液中,在4℃冰箱中固定4 h。用0.1 mol·L-1磷酸缓冲液洗涤3次,每次30 min;再加入由1%锇酸、0.1 mol·L-1磷酸缓冲液配制的后固定液在4℃冰箱中固定12 h。用上述缓冲液洗涤3次,每次30 min。后用丙酮梯度系列脱水,EMbed 812树脂包埋。包埋块在超薄切片机(Leica UC7,Germany)上用玻璃刀切取厚度为1 μm的半薄切片,用1%甲苯胺蓝染液染色20 s,光学显微镜拍照(Olympus BX-51,Japan)并观察、拍照。根据选取的典型切片,对树脂块再次修整后用钻石刀切为60 nm厚度的超薄切片,镀膜铜网捞片,醋酸双氧铀和柠檬酸铅双重染色(分别染色20 min)并晾干后,用透射电子显微镜(Hitachi TEM system 7700,Japan)观察、拍照。
-
油茶为完全花,开花当天雌蕊已成熟,具有完整的柱头、花柱和子房结构,雌蕊着生于花托之上(图 1A)。油茶为典型的湿性柱头,柱头表面密布乳突细胞,与柱头以下的花柱基本组织差异显著。乳突细胞呈狭长条状,排列紧密,细胞质浓厚,而基本组织的细胞呈椭圆状,排列较为疏松,仅能观察到细胞核,细胞质不明显(图 1B、C)。柱头上大量的乳突细胞展开最大面积可更多的接收花粉粒。乳突细胞间或表面具有丰富的分泌物(图 1D、E),这为花粉萌发和识别提供基本的物质基础。油茶花柱通常由35根独立花柱共同组成,整个花柱长约1113 mm左右,上端约2/3的部分相互分离形成离生区,从2/3处开始(图 1A中a处)到花柱基部(图 1A中b处)每根之间相互连接形成合生区。离生区的每根独立花柱卷合形成中空的贝壳状(图 1F),横切面观察每根花柱由外表皮、基本组织和花柱道内表皮构成(图 1G)。将花柱平展开后在荧光显微镜下观察外表皮和内表皮有明显差异,花柱道内表皮是花粉管生长的通道,内表皮由一层排列紧实近圆形细胞构成,这层细胞比基本组织细胞大而规则,在光镜下可观察到细胞核明显,细胞质浓厚,具有腺质细胞的特点(图 1H、I),外表皮细胞为长型细胞,排列疏松,细胞核小(图 1J、K),这些特征都反应了通道内表皮细胞在花柱成熟时活跃的状态。在花柱的合生区,外表皮、基本组织和花柱道内表皮各部位均逐渐合生(图 1L),整个花柱从上到下呈现出花柱道逐渐贴合的趋势,越往下花柱道贴合越紧密,间隙也越来越小,特别是到花柱基部后,在离生区相互独立的每根花柱的花柱道在花柱基部(b处)聚合到一起,并且各自成为一道狭小的缝隙,同时各道之间相互连通(图 1M),与花柱开始合生处(a处)的花柱道内表皮细胞相比,花柱基部的花柱道内表皮细胞排列更加紧密、规整,而且细胞更大,细胞中大液泡明显,细胞外有明显的分泌物(图 1N)。
-
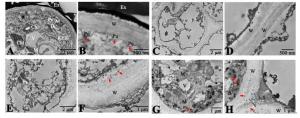
花柱是花粉管生长的通道,而柱头是花粉粒的接受体,是花粉最早接触雌蕊的部位,在花粉-柱头相互作用中起到重要作用。在对柱头的显微结构观察中,已观察到油茶柱头乳突细胞呈长条形,相互之间排列规整,通过超微结构观察到乳突细胞中细胞质浓厚,细胞器丰富,分布有大量内质网、高尔基体、多聚核糖体、线粒体、叶绿体和液泡等(图 2A)。在细胞壁外观察到有大量分泌物,为花粉萌发提供条件,这也是湿型柱头的特征,同时还观察到细胞壁存在内突的现象,这也是典型的腺质细胞的特征(图 2B)。在花柱基本组织细胞中,细胞内含物较少,细胞器也较少,细胞壁薄且壁外无分泌物(图 2C、D),这些特征表明基本组织在花柱中主要行使从柱头到子房的结构支撑功能,并且从花柱上部到花柱基部的整个花柱中,花柱基本组织细胞的结构特征均无太大变化,比较一致;但在花柱通道细胞中情况则不同。观察花柱离生区的通道内表皮细胞发现,这一段花柱的内表皮细胞较大,细胞质比基本组织细胞稍多,可观察到的细胞器数量和种类均相对较多,主要以内质网、高尔基体和线粒体为主(图 2E),另外一个明显的特征是该段花柱内表皮细胞的细胞壁非常厚,在壁外可以观察到有一些分泌物存在,这些分泌物与柱头的分泌物相比,所呈现的状态有一定差别(图 2F);在花柱合生区部分的通道细胞中,细胞质较花柱离生区的通道细胞更浓厚,细胞器数量和种类也更丰富,主要以线粒体、内质网为主,在该细胞中同样观察到内突的现象(图 2G)。在此段花柱的细胞间隙和壁外可以观察到同样存在分泌物。这些细胞分泌物首先以团状形式(红色箭头)出现在细胞壁与质膜之间的区域,然后通过外排作用分泌至通道细胞间隙内(图 2H)。通道细胞内细胞质浓度、细胞器数量与种类在整个花柱中呈现逐渐增加的趋势。
-
油茶开花当天雌蕊已完全成熟,此时柱头表面充满明显的液体分泌物,为典型的湿型柱头。在烟草[15]、百合[4]和大豆[16]等植物中,也观察到成熟雌蕊柱头活跃的分泌细胞外产生并释放渗透物。根据对大量植物柱头类型的研究报道,湿型柱头分为有乳突和无乳突两种类型[17]。在本研究中,从柱头纵切面结构看,可观察到油茶柱头表面密布大量的乳突细胞,为湿柱头中的有乳突类型。油茶开花当天的柱头有大量的分泌物覆盖在柱头表面,为花粉的附着、水合萌发提供了必要的基质,也在花粉与柱头的相互识别过程中起重要作用,特别是对远缘杂交和一些孢子体自交不亲和性植物研究尤为重要[18-19]。油茶柱头观察到的分泌物是否为脂类物质以及分泌物中含有的具体成分还有待进一步研究。在油茶柱头细胞质中观察到含有液泡、叶绿体、线粒体、内质网等,发达的扩张内质网显示了与分泌作用相关。同时在柱头分泌面的壁观察到壁内突,这些都是典型的分泌细胞的特征。
花柱是支撑花粉管从柱头生长至子房的结构,也是配子体自交不亲和反应的发生部位。油茶花柱为开放型,具有中空的花柱道。与柱头相同,在本研究中也观察到油茶的开放型花柱中充满分泌物,即花柱道细胞也属于分泌细胞,这层特化的内表皮细胞也可称为通道细胞[20]。在空心花柱植物中,花粉管沿着花柱通道生长,通道内表皮外聚集了大量分泌物,花粉管在分泌物中向下生长,花柱中的这些分泌物为花粉管生长提供了营养物质和引导花粉管定向生长[21]。作者曾对油茶花粉管生长途径及双受精进程进行过详细报道[13],观察到油茶花粉管在花柱中沿着中空的花柱通道细胞表面生长并进入子房,在对山茶属植物茶树(Camellia sinensis)的研究中[22-23],也观察到花粉管在花柱中同样的生长情况。与花柱基本组织细胞相比,油茶的通道细胞在超微结构上表现为代谢活跃的细胞特征。细胞质中充满各种丰富的细胞器,包括线粒体、高尔基体、内质网等。在研究中,可以观察到细胞分泌物首先出现在细胞壁与质膜之间的区域,然后通过外排作用分泌至通道细胞间隙内。有学者研究报道[24],植物的自交不亲和性遗传学特征和抑制部位之间有密切的关系,植物的花粉管抑制作用发生在子房中的一个共同特征是花柱为开放型,花粉管与花柱组织必须密切接触才能发生抑制作用。本研究组在油茶自交不亲和性研究中也发现[12],油茶的自交不亲和反应发生在花柱基部接近子房处,具有后期自交不亲和性的特征。本研究中也发现花柱基部接近子房处的花柱通道是花柱中最窄的部位,此处的分泌物也是通道中最多的,整个花柱从柱头到子房表现为花柱道逐渐变窄、通道中的分泌物逐渐增多的特点。在配子体自交不亲和系统中,大多数不亲和的花粉在柱头萌发时不受影响,能够萌发产生花粉管并穿过柱头生长进入花柱,但在花柱中的不同部位停止生长。花粉从柱头上吸水,在渗出液中开始萌发。如果亲和,则花粉粒萌发后花粉管进入柱头并伸长穿过花柱组织;如果不亲和,则雌蕊产生拮抗反应,花粉管生长受到抑制,在不同部位停止生长。外壁蛋白和内壁蛋白是花粉壁上存在着的两类蛋白类物质,花粉与雌蕊之间的识别反应,正是基于花粉壁的蛋白质和柱头乳突细胞表面的蛋白质表膜之间的相互作用。花粉管的生长表现为胞质环流模式,当花粉管接触到液体物质时,外壁蛋白迅速释放,说明花粉壁蛋白作为识别因子,对花粉的接受或拒绝起到决定作用[25]。有研究发现,花粉管在穿过柱头和花柱时,会诱导产生出一种花粉管转录体,说明雌蕊组织直接影响花粉管的基因表达水平[26]。综合之前对油茶自交不亲和反应的研究结果,推测其花柱通道细胞分泌物成分能识别自身花粉管,进而抑制花粉管生长。这些分泌物的成分还有待进一步研究,如利用细胞化学的方法观察花粉和柱头的相互作用,利用高分辨透射电镜分析花粉壁蛋白在花柱何处结合及结合发生的时间。通过本研究对油茶花柱结构有了进一步的认识,而油茶自交花粉管在花柱中的的不亲和性反应机制、花粉管死亡特征和花粉管-雌蕊的互作机理等研究将成为今后的重要研究方向。
-
本研究表明:油茶为湿型柱头,柱头乳突和花柱通道细胞为分泌型细胞,花柱分为离生区(占2/3)和合生区(占1/3)两部分,花柱中基本组织细胞结构单一,壁外无分泌物。整个花柱从柱头到子房花柱道逐渐变窄,各花柱道在基部相互连通形成狭小的缝隙,具有花柱通道细胞壁外分泌物和细胞内细胞质浓度、细胞器数量与种类逐渐增加的趋势和特点。
油茶柱头和花柱的显微与超微结构特征
Microstructure and Ultrastructure Characteristics of Stigma and Style of Camellia oleifera
-
摘要:
目的 从显微和超微层面探究油茶柱头和花柱的结构特征,可为探讨油茶自交不亲和性的细胞学机制提供理论依据,同时也为油茶杂交育种工作奠定基础。 方法 以开花当天的雌蕊为试验材料,利用细胞学方法研究油茶柱头和花柱的显微及超微结构特征。 结果 油茶雌蕊具完整的柱头、花柱和子房结构,湿性柱头其表面密布乳突细胞,排列紧密,细胞质浓厚,细胞器丰富,细胞间具有丰富的分泌物。基本组织细胞内含物和细胞器较少,细胞壁薄且壁外无分泌物。整个花柱由35根独立花柱组成,上端约2/3部分相互分离形成离生区,从2/3处开始到花柱基部相互连接形成合生区。每根花柱中空,由外表皮、基本组织和花柱道内表皮构成。花柱通道细胞外充满大量分泌物,该细胞比基本组织细胞大而规则、细胞质浓厚,具有腺质细胞的特点。花柱道从上到下贴合逐渐紧密,花柱基部的各花柱道之间相互连通,形成狭小的缝隙。 结论 本研究分析了油茶柱头和花柱的显微及超微结构特征,探明柱头乳突和花柱通道细胞为分泌型细胞,基本组织细胞结构单一,从柱头到子房花柱道逐渐变窄,在基部相互连通形成狭小的缝隙,花柱通道细胞从上至下壁外分泌物和细胞内细胞质浓度、细胞器数量与种类具有逐渐增加的趋势和特点。 Abstract:Objective To investigate the structural characteristics of the stigma and style of Camellia oleifera at the microscopic and ultramicroscopic levels and provide a theoretical basis for elucidating the cytological mechanism of breeding self-incompatibility reactions in C. oleifera style, while at the same time to establish a theoretical foundation for hybrid breeding of C. oleifera. Method Using the pistil of C. oleifera on the day of blooming as the experimental material, the microscopic and ultramicroscopic structural characteristics of C. oleifera stigma and styles were observed to study them from a cytological perspective using cytological method. Result The pistil of C. oleifera is composed of an intact stigma, style, and ovary. C. oleifera has a wet stigma. The papillary cells are densely distributed on the receptive surface. They are densely arranged with concentrated cytoplasm and abundant organelles. Abundant secretions are presented among papillary cells. Generally, there is less content and fewer organelles in tissue cells, the cell wall is thinner, and there are no secretions outside the cell wall. The style of C. oleifera is composed of 3-5 independent styles. The upper 2/3 of the style are separated from each other, whereas between the lower 2/3 and the base of style they begin to fuse. Each style of C. oleifera is hollow and composed of an epidermis, parenchymal tissue, and the inner surface of the style duct. The area outside the style duct cells is filled with large amounts of secreted mucous substances. The cells are more organized and larger than those in the parenchymal tissue, have dense cytoplasm, and have characteristics of glandular cells. The style duct becomes gradually denser from top to bottom with continuously decreasing gap size. At the base of the style, the style ducts fuse with each other, forming a small cavity. Conclusion The microscopic and ultramicroscopic structural characteristics of the stigma and style of C. oleifera is analyzed. The cells of the stigma papilla and style duct are secretory cells. The parenchymal tissue cells in the style have a uniform structure. The style duct gradually narrows from the stigma to the ovary. In the base of the style, each style duct fuses with each other to form a small cavity. It is characterized by the substances secreted by the style duct cell wall, cytoplasmic density, and a gradually increasing tendency in the number of types of organelles. -
Key words:
- Camellia oleifera
- / stigma
- / style
- / microstructure
- / ultrastructure
-
[1] Bedinger P A, Broz A K, Tovar-Mendez A,et al. Pollen-pistil interactions and their role in mate selection[J]. Plant Physiology,2017, 173(1): 79-90. doi: 10.1104/pp.16.01286 [2] Gotelli M M, Galati B G, Medan D. Structure of the stigma and style in sunflower (Helianthus annuus L.)[J]. Biocell, 2010, 34(3): 133-138. [3] Takayama S, Isogai A. Self-incompatibility in plants[J]. Annual Review of Plant Biology, 2005, 56(56): 467-489. [4] 胡适宜,朱澂,徐丽云. 王百合花柱通道细胞的细微结构的研究[J]. 植物学报,1982,24(5):395-402. [5] 王迎春,屠骊珠. 狭叶锦鸡儿花柱的超微结构观察[J]. 植物学通报,1994(S1): 36. [6] 王秀玲,高新起. 荞麦柱头、花柱的结构及ATP酶的超微细胞化学定位[J]. 西北植物学报,2002, 22(5): 1221-1224. doi: 10.3321/j.issn:1000-4025.2002.05.027 [7] Liao T, Yuan D Y, Zou F, et al. Self-sterility in Camellia oleifera may be due to the prezygotic late-acting self-incompatibility[J]. PLoS ONE, 2014, 9(6): e99639. doi: 10.1371/journal.pone.0099639 [8] Nasrallah J B, Nasrallah M E. Pollen-stigma signaling in the sporophytic self-Incompatibility response[J]. The Plant Cell, 1993, 5(10): 1325. [9] Thomas S G, Franklin-Tong V E. Self-incompatibility triggers programmed cell death in Papaver pollen[J]. Nature, 2004, 429(6989): 305. doi: 10.1038/nature02540 [10] Haring V, Gray J E, McClure B A, et al. Self-incompatibility: a self-recognition system in plants[J]. Science, 1990,250(4983): 937-941. doi: 10.1126/science.2237440 [11] 庄瑞林. 中国油茶(第二版)[M]. 北京:中国林业出版社, 2008. [12] 高超,袁德义,杨亚,等. 油茶自交不亲和性的解剖特征[J]. 林业科学, 2015,51(2): 60-68. [13] Gao C, Yuan D Y, Yang Y, et al. Pollen tube growth and double fertilization in Camellia oleifera[J]. Journal of the American Society for Horticultural Science, 2015, 140(1): 12-18. doi: 10.21273/JASHS.140.1.12 [14] 廖婷,袁德义,高超,等. 油茶授粉受精及早期胚胎发育[J]. 林业科学,2014,50(2): 50-55. [15] 胡适宜,朱澂. 被子植物有性生殖图谱[M]. 北京:科学出版社,2000. [16] 王学东,于洋,刘岩,等. 大豆花柱和柱头的显微结构观察[J]. 东北农业大学学报,2013,44 (1): 7-11. doi: 10.3969/j.issn.1005-9369.2013.01.004 [17] Heslop-Harrison Y, Shivanna K R. The receptive surface of the angiosperm stigma[J]. Annals of Botany, 1997, 41(6): 1233-1258. [18] Hiscock S J, McInnis S M. Pollen recognition and rejection during the sporophytic self-incompatibility response: Brassica and beyond[J]. Trends in Plant Science, 2003, 8(12): 606-613. doi: 10.1016/j.tplants.2003.10.007 [19] 律春燕,王雁,朱向涛,等. 黄牡丹与芍药组间杂交花粉与柱头识别的解剖学研究[J]. 西北植物学报,2009,29(10): 1988-1994. [20] 王艳杰,刘林德,孔冬瑞,等. 刺五加雌、雄花的花柱引导组织结构观察[J]. 电子显微学报,2011, 30(4-5): 460-465. [21] 陈妍,王玲丽,刘文哲. 授粉对烟草花柱引导组织结构的影响[J]. 西北植物学报,2016,36(3): 486-492. [22] Chen X, Hao S, Wang L, et al. Late-acting self-incompatibility in tea plant (Camellia sinensis)[J]. Biologia, 2012, 67(2): 347-351. [23] Wachira F N, Kamunya S K. Pseudo-self-incompatibility in some tea clones (Camellia sinensis (L.) O. Kuntze)[J]. Journal of Horticultural Science and Biotechnology, 2005, 80(6): 716-720. doi: 10.1080/14620316.2005.11512004 [24] Brewbaker J L. Pollen cytology and self-incompatibility systems in plants[J]. Journal of Heredity, 1957, 48(6): 271-277. doi: 10.1093/oxfordjournals.jhered.a106742 [25] Cheung A Y, Wu H M. Structural and signaling networks for the polar cell growth machinery in pollen tubes[J]. Annual Review of Plant Biology, 2008(59): 547-572. [26] Qin Y, Leydon A R, Manziello A, et al. Penetration of the stigma and style elicits a novel transcriptome in pollen tubes, pointing to genes critical for growth in a pistil[J]. PLoS Genetics, 2009(5), e1000621. -





 下载:
下载: