-
枣缩果病也称为枣黑斑病[1]、枣铁皮病、枣干腰缩果病[2]和枣褐腐病[3]等,发病的枣果瘦小,在成熟前极易脱落[4],没有商品价值。该病在全国各大枣区都有发生,是目前枣树生产中最严重的果实病害之一。枣缩果病菌可在花期侵入[5-6],也可以在幼果期从果洼处侵入,侵入后的病菌呈潜伏状态,直至8月中下旬才开始发病[7],但是,至发病前,枣果在林间没有任何病症。至今对该病害的初侵染来源尚不清楚。
研究发现,互隔链格孢菌(Alternaria alternata)是枣缩果病的初侵染病原菌[8-9]。该菌是一种常见的真菌,对基质和生态环境有着极强的适应性[10]。目前,在全世界的链格孢种级分类单位中,95%以上的链格孢种类兼性寄生于植物上。据报道,互隔链格孢菌危害番茄的果实,引起番茄黑斑病[11-12];危害烟草,引起烟草赤星病[13-14];苹果链格孢菌(A. mali)是苹果褐纹病的病原菌,主要危害嫩叶,也危害果实和枝条[15-16];互隔链格孢菌还可以引起梨黑斑病[17-18]和杨树叶枯病[19]。在我国北方,枣园附近一般有农户居住,周围常种植果树和蔬菜等植物,且道路旁边大多以杨树作为行道树。枣缩果病初侵染互隔链格孢菌除侵染枣属植物外,是否能侵染危害非枣属植物尚未见报道。
本研究将供试材料以刺伤和无伤接种的方式,接种经绿色荧光蛋白基因(gfp)标记的枣缩果病菌CN193::gfp菌株,采用组织分离法[20]对供试材料病原菌进行分离,并以荧光显微镜观察,以探究枣缩果病菌侵染非枣属植物的情况,了解其寄主范围及初侵染来源,防止多种植物间相同病菌交互侵染而加重病害的发生,为生产上正确指导枣树周围植物合理布局提供参考。
-
供试菌株:经gfp标记的互隔链格孢菌(A. alternata)CN193::gfp菌株,由河北农业大学林木病理实验室提供,其原始菌株CN193于2011年分离自河北省唐县杨高和村的枣缩果病病枣[8]。
供试材料:番茄(Lycopersivon esculentum Mill.)果实、烟草(Nicotiana tabacum L.)叶片、红富士苹果(Malus domestica cv. Red Fuji)果实和叶片、雪花梨(Pyrus bretschneideri)果实、新梨七号(P. bretschneideri)叶片、毛白杨(Populus tomentosa Carr.)和加杨(P. canadensis Moench)的叶片。
-
采用常规法[5]配制孢子悬浮液浓度为5×103个·mL-1,备用。
刺伤接种:将番茄果实、烟草叶片、苹果果实和叶片、梨果实和叶片、毛白杨和加杨离体叶片清洗干净,用灭菌的接种针轻度刺伤表面;用100 μL的移液枪取配制好的孢子悬浮液接种于刺伤材料,每个伤口3~4 μL;覆盖灭菌的滤纸片保湿24 h;以接种无菌水作为对照。每个处理接种8个果实或叶片,每个果实或叶片接种6个点,试验重复2次。
无伤接种:用100 μL的移液枪取配制好的孢子悬浮液接种于供试材料的表面,每滴3~4 μL,接种位置与刺伤接种伤口的位置相对应;覆盖灭菌的滤纸片保湿;以接种无菌水作为对照。每个处理的数量、接种点数和试验重复次数同上。
将上述处理后的离体果实和叶片放在底部垫有湿纱布的培养盒中,离体枝条插入盛有清水的300 mL三角瓶中,置于25℃保湿培养。分别于接种后3 d、5 d和7 d观察,记录各供试材料的发病情况。
发病率=(各供试材料每组发病的点数/各供试材料每组接种总点数)× 100%
-
直接挑取发病部位的组织和对照组的相应组织做成切片,在荧光显微镜下观察组织中是否有荧光。将供试材料病健交界处的组织置于加有浓度为10 μg·mL-1潮霉素B的PDA培养基上,然后放入25℃恒温箱中黑暗培养,待含有潮霉素B的PDA培养基上长出菌后,挑取不同寄主植物中分离得到的病原菌菌丝用荧光显微镜观察是否有荧光。
-
采用SPSS 17.0软件进行统计分析,并用最小显著差异(LSD)法进行差异显著性检验。
-
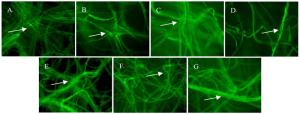
番茄刺伤接种的果实(图 1A)与无伤接种的果实(图 1B)表面均出现褐色或黑色的病斑,形状为圆形至不规则,中间略微凹陷;病斑表面出现绒毛状的菌丝和分生孢子,在果实发病的后期,有时多个小病斑结合成大病斑,感病果实逐渐软腐。刺伤接种对照(图 1a)和无伤接种对照(图 1b)均没有异常变化。

图 1 各潜在寄主接种后的发病症状
Figure 1. The symptoms of potential hosts inoculated with Alternaria alternata CN193::gfp
烟草刺伤叶片并未出现烟草赤星病所具有的典型症状,只是在刺伤处出现了结痂状结构,表面变硬,逐渐失水干枯变黄,由伤口中部向四周逐渐剥落。
苹果果实感病后,表面出现褐色斑点(图 1C),且斑点周围带有红色晕圈;对照(图 1c)的伤口处只有轻度褐变。苹果叶片受害后,初期表面出现褐色圆形的小斑点,且周围带有紫褐色的晕圈,在适宜的条件下,多个小病斑结合在一起形成不规则的大病斑,叶片到最后开始枯焦脱落(图 1D)。果实和叶片(图 1d)的对照均没有异常变化。
梨果实接种后,表面出现黑色、略凹陷的圆形病斑,稍有同心的轮纹,且病斑表面有菌丝和黑色的霉层(图 1E),后期果实逐渐软腐;对照(图 1e)的果实伤口只有轻微褐化,没有发病症状。梨叶片接种后,表面略微显现出带有轮纹的淡黑褐色病斑(图 1F),后期病斑直径可达20 mm;对照(图 1f)的叶片只有刺伤口有轻微褐变。
毛白杨叶片(图 1G)与加杨叶片(图 1H)感病初期,因失绿形成圆形、多角形至不规则形状的褐色病斑,且病斑逐渐扩大;感病后期,病斑出现黑褐色霉状物,若干小病斑相互连接形成大病斑,导致叶片枯死脱落;对照(图 1g和图 1h)没有异常变化。
-
由图 2可知,接种孢子悬浮液的离体果实和叶片培养3 d后,除烟草外,刺伤的材料均发病,经方差分析,各材料的发病率差异不显著(P>0.05);培养5 d后,苹果果实的发病率增幅最大,番茄发病率增幅最小,经方差分析,番茄和苹果果实之间发病率差异显著(P<0.05),其他各材料在第5 d的发病率差异不显著(P>0.05);培养7 d后,各材料的发病率都较高,且差异不显著(P>0.05)。无伤接种的各材料中,只有番茄发病,5 d后发病率为8.3%,7 d后发病率为12.5%,其他各材料和对照组的材料均未发病。
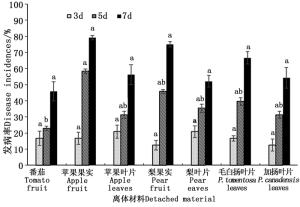
图 2 各潜在寄主接种孢子悬浮液后不同时期发病情况
Figure 2. The incidences of fruits and detached leaves from different potential host plants inoculated with spore suspension of Alternaria alternata CN193::gfp at different dates
离体枝条上的叶片刺伤接种孢子悬浮液后均发病,比较培养3 d后的发病率,苹果的相对较低,梨的相对较高,二者的发病率有显著性差异(P < 0.05),其他材料之间发病率差异性不显著(P>0.05);比较培养5 d后的发病率,苹果的相对较低,毛白杨的相对较高,苹果的发病率与其他材料之间有显著性差异(P < 0.05)。各材料的发病率见表 1。
表 1 接种孢子悬浮液的离体枝条叶片不同时期发病率
Table 1. The incidences of leaves from detached branches of different host plants at different dates after inoculation with spore suspension of Alternaria alternata CN193::gfp
% 培养时间
Incubation time离体枝条叶片(刺伤)
Leaves on a detached branch (stab wound)苹果
M.domestica梨
P.bretschneideri毛白杨
P.tomentosa加杨
P.canadensis3 d 10.4±3.9 b 31.3±4.3 a 20.8±5.4 ab 25.0±4.8 ab 5 d 41.7±5.6 b 58.3±6.2 a 66.7±5.6 a 62.5±3.7 a 注:表中数据为平均数±标准误。同行不同小写字母表示LSD法检验在P<0.05水平差异显著。
Note: Data are mean±SE. Different letters in the same row indicate significant difference at P<0.05 level by LSD test. -
番茄果实(图 3A)感病部位组织用荧光显微镜可看见含有荧光的菌丝,而对照(图 3B)除果肉中自带的微弱荧光外,则观察不到菌丝的荧光;而在苹果果实和叶片、梨果实和叶片、毛白杨和加杨叶片感病部位组织中,由于受组织内叶绿体的影响,在荧光显微镜下无法观察到含有荧光的菌丝。
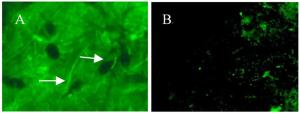
图 3 荧光显微镜下观察番茄感病组织及对照
Figure 3. Observation of the tomato fruit tissues with and without infection under fluorescence microscope
如图 4,对番茄、苹果果实和叶片、梨果实和叶片、毛白杨和加杨叶片发病部位的组织进行分离,所有发病材料在加有10 μg·mL-1潮霉素B的培养基上均长出菌丝;分别挑取菌丝用荧光显微镜观察,菌丝中都有荧光,且荧光强烈,在40×10显微镜下可清晰地看到菌丝中带有荧光的质粒,表明互隔链格孢菌CN193::gfp菌株是导致发病的病原菌。
-
互隔链格孢菌(A. alternata)是常见腐生或寄生真菌,本研究以CN193::gfp菌株进行接种,可排除自然界中所存在的互隔链格孢菌(A. alternata)的干扰。接种后番茄果实、苹果果实和叶片、梨果实和叶片、毛白杨和加杨的叶片均发病,且症状与乔镜澄[12]、张彩霞[26]、王宏[18]、黄毅[27]等人的研究结果一致。引致番茄、苹果、梨和杨树等发病的链格孢菌与枣缩果病互隔链格孢菌是否为同一种病原菌尚不能确定,但枣缩果病互隔链格孢菌可以侵染上述几种植物,因此,这些植物可能成为枣缩果病菌的潜在寄主。同时,引致番茄、苹果、梨和杨树等发病的链格孢菌接种枣果是否会引起缩果病也值得探索。烟草接种CN193::gfp后未出现发病症状,处理的组织在加有潮霉素B的PDA培养基上也未见接种的菌生长,但烟草的刺伤接种处出现结痂、表面变硬、干枯变黄并逐渐剥落的现象,其原因可能是烟草叶片受到CN193::gfp侵染后产生的一种过敏性坏死反应。
枣园周围的植物种类较多,枣缩果病菌的寄主范围有可能包括更多的植物,我们的研究不可能也没有必要去穷尽所有寄主,所以,仅选取枣园周围常见的栽培植物作为研究对象,至于这些潜在寄主上的病菌是如何传播和侵入枣树的有待今后再行研究。同时,枣一年结一次果,适宜病害研究的时间较短,为此,开展枣缩果病菌潜在寄主的研究,也是为了找到该菌的合适寄主在室内进行相关的研究,突破季节限制,延长研究时间,为枣缩果病菌的常年研究提供支持。
采用刺伤接种互隔链格孢菌的方法[28-29],枣缩果病菌更容易侵染寄主,致其发病。为此,在枣树管理过程中要尽可能地提高操作技术水平,采取适当的经营措施,尽量避免造成伤口。无伤接种的苹果、梨和杨树均未发病;番茄果实无伤接种虽然发病,但其发病率显著低于刺伤接种,这可能与接种材料的成熟度和病原菌初侵染时机的选择有关。也可能自然界中的气流、风雨飞溅等才是病原菌适宜的传播途径,病原菌究竟是通过何种方式侵染其他潜在寄主还有待进一步研究。
本研究中,各供试材料刺伤接种CN193::gfp发病后,荧光显微镜观察各病部组织,发现番茄果实组织中有明显的荧光现象,病原菌侵入过程非常清晰,可以实时观测病原菌在植物体内的扩展进程,比用CuSO4标记[30]更便捷直观,这或将成为打开枣缩果病菌侵入途径的突破口,以及研究病原菌在寄主体内动态变化过程的关键。
-
本研究选用枣园周围经常种植的番茄、苹果、梨、毛白杨和加杨为研究对象,并用gfp标记过的枣缩果病初侵染互隔链格孢菌CN193::gfp菌株开展对这些植物的侵染研究,结果枣缩果病菌均可引致上述植物产生与番茄黑斑病、苹果褐纹病、梨黑斑病和杨树叶枯病相同的症状,说明这些植物可以成为枣缩果病菌的潜在寄主,扩大了枣缩果病菌侵染来源的范围。枣缩果病菌或许借助这些寄主越冬,待翌年再通过一定的方式传播侵入枣树致枣感病。因此,在枣园规划布局时应避免种植一些容易被互隔链格孢菌侵染的植物。
枣缩果病互隔链格孢菌的潜在寄主研究
Potential Hosts of Alternaria alternata, the Pathogen of Jujube Shrunken-fruit Disease
-
摘要:
目的 发掘枣缩果病菌可能存在的潜在寄主,为探究枣缩果病的初侵染来源寻找突破口。 方法 用gfp标记的枣缩果病初侵染互隔链格孢菌CN193菌株(CN193::gfp)的孢子悬浮液,以刺伤和无伤两种方式,接种选自枣园周围栽植的番茄、烟草、苹果、梨、毛白杨和加杨,然后,将发病部位病健交界处的组织置于加有10 μg·mL-1潮霉素B的PDA培养基上培养,荧光显微镜观察发病组织和从各寄主上分离获得的病菌菌丝。 结果 刺伤接种7 d后,除烟草外,其他刺伤的材料均发病,发病率依次为番茄果实45.8%、苹果果实79.2%、苹果叶片75.0%、梨果实56.3%、梨叶片52.1%、毛白杨叶片66.7%和加杨叶片54.2%;无伤处理的仅番茄发病,其他材料和对照组均未发病。番茄病部组织的荧光清晰可辨;在发病的番茄果实、苹果果实和叶片、梨果实和叶片、毛白杨和加杨离体叶片病部组织分离后长出的菌丝中,均可以观察到明显的荧光。 结论 枣缩果病菌能成功侵染番茄、苹果、梨、毛白杨和加杨,并可使各寄主植物产生与番茄黑斑病、苹果褐纹病、梨黑斑病和杨树叶枯病相同的症状,推断番茄、苹果、梨、毛白杨和加杨为枣缩果病菌的潜在寄主,扩大了枣缩果病菌初侵染来源的范围,为进一步开展枣缩果病的防治拓宽了渠道。 Abstract:Objective To explore the potential hosts of Alternaria alternata, the pathogen of jujube shrunken-fruit disease (JSFD) and the sources of primary infection for JSFD. Method The spore suspension of a gfp-tagged strain of A. alternata CN193, designated as CN193::gfp, were inoculated with and without stab wound to the fruits and/or leaves of Lycopersivon esculentum, Nicotiana tabacum, Malus domestica cv. Red Fuji, Pyrus bretschneideri, Populus tomentosa and Populus canadensis from the surrounding area of jujube plantation. The marginal tissues with healthy and diseased parts were transferred onto potato dextrose agar media with supplement of 10 μg·mL-1 hygromycin B, and the infected tissues and the hyphae isolated from each of the inoculated material were observed under fluorescence microscope. Result All the inoculated materials with stabbing wound, except for N. tabacum plant, developed diseased symptoms after 7 days of inoculation. The disease rates of all the above materials inoculated with spore suspension were 45.8% of L. esculentum fruits, 79.2% of apple fruits, 75.0% of M. domestica cv. Red Fuji leaves, 56.3% of Pyrus bretschneideri fruits, 52.1% of Pyrus bretschneideri leaves, 66.7% of Populus tomentosa leaves and 54.2% of Populus canadensis leaves. Through non-wounded inoculation only L. esculentum fruits showed the symptoms, and all the other treated materials and the controls did not present any visible disease development. Strong fluorescence could be observed in the infected tissues of L. esculentum fruits, and in the hyphae of isolates from all infected materials, including the fruits of L. esculentum, the fruits and leaves of M. domestica cv. Red Fuji, the fruits and leaves of Pyrus bretschneideri, and the leaves of Populus tomentosa and Populus canadensis. Conclusion The pathogen of JSFD is able to successfully infect the L. esculentum, M. domestica cv. Red Fuji, Pyrus bretschneideri, Populus tomentosa and Populus canadensis, and it could cause the same symptoms as tomato melasma, apple brown spot, pear black spot, and poplar leaf blight, inferring that L. esculentum, M. domestica cv. Red Fuji, Pyrus bretschneideri, Populus tomentosa and Populus canadensis are the potential hosts of JSFD. -
Key words:
- Alternaria alternata
- / green fluorescent protein
- / host range
- / shrunken-fruit disease
- / Ziziphus jujuba
-
表 1 接种孢子悬浮液的离体枝条叶片不同时期发病率
Table 1. The incidences of leaves from detached branches of different host plants at different dates after inoculation with spore suspension of Alternaria alternata CN193::gfp
% 培养时间
Incubation time离体枝条叶片(刺伤)
Leaves on a detached branch (stab wound)苹果
M.domestica梨
P.bretschneideri毛白杨
P.tomentosa加杨
P.canadensis3 d 10.4±3.9 b 31.3±4.3 a 20.8±5.4 ab 25.0±4.8 ab 5 d 41.7±5.6 b 58.3±6.2 a 66.7±5.6 a 62.5±3.7 a 注:表中数据为平均数±标准误。同行不同小写字母表示LSD法检验在P<0.05水平差异显著。
Note: Data are mean±SE. Different letters in the same row indicate significant difference at P<0.05 level by LSD test. -
[1] 何丽, 郭开发, 艾尼古丽·依明, 等.新疆红枣缩果病和枣果黑斑病病原鉴定[J].石河子大学学报:自然科学版, 2017, 35(3):312-318. [2] 郑晓莲, 赵光耀, 齐秋锁, 等.枣干腰缩果病症状类型及侵染规律研究[J].植物保护, 1998, 24(4):17-19. doi: 10.3969/j.issn.0529-1542.1998.04.005 [3] 杨自民, 姚忍让, 王月丽, 等.枣缩果病的发生原因及防治方法探讨[J].北方果树, 2002, (4):33-34. doi: 10.3969/j.issn.1001-5698.2002.04.021 [4] 徐祥彬, 赖童飞, 景云飞, 等.山西壶瓶枣缩果病病原菌分离和鉴定[J].植物病理学报, 2009, 39(3):225-230. doi: 10.3321/j.issn:0412-0914.2009.03.001 [5] 赵乐.枣缩果病菌的初侵染时期及防治研究[D].保定: 河北农业大学, 2015. [6] 许瑛, 姚兆群, 王兰, 等.阿拉尔地区枣园不同时期枣花枣果黑斑病菌带菌量检测[J].新疆农业科学, 2017, 54(10):1-8. [7] 侯晓杰.枣缩果病病原和防治研究[D].保定: 河北农业大学, 2010. [8] 韩党悦.枣缩果病初侵染病原及防治研究[D].保定: 河北农业大学, 2012. [9] 许阳.枣缩果病初侵染病原的分子检测及防治研究[D].保定: 河北农业大学, 2014. [10] 翟凤艳, 张柯, 李娟, 等.新乡地区链格孢菌病害病原鉴定[J].河南科技学院学报, 2015, 43(5):30-35. doi: 10.3969/j.issn.1008-7516.2015.05.007 [11] Yang J, Sun C, Zhang Y, et al. Induced resistance in tomato fruit by γ-aminobutyric acid for the control of alternaria rot caused by Alternaria alternata[J]. Food Chemistry, 2017, 221:1014-1020. doi: 10.1016/j.foodchem.2016.11.061 [12] 乔镜澄, 刘宇, 马敬昊, 等.番茄黑斑病病原菌的鉴定及生物学特性研究[J].江苏农业科学, 2017, 45(10):94-97. [13] 祖艳青, 蒋士君, 王海涛, 等.河南省烟草赤星病病原鉴定[J].中国烟草学报, 2013, 19(4):73-77. doi: 10.3969/j.issn.1004-5708.2013.04.012 [14] 杨涛, 黎妍妍, 郑露, 等.湖北烟区烤烟赤星病病原鉴定[J].中国烟草科学, 2017, (5):32-38. [15] Zhu L, Ni W, Liu S, et al. Transcriptomics analysis of apple leaves in response to Alternaria alternata apple pathotype infection[J]. Frontiers in Plant Science, 2017, 8:22. [16] 任璐, 史晓晶, 姚众, 等.苹果斑点落叶病菌对戊唑醇敏感基线建立及抗性突变体适合度[J].植物病理学报, 2017, 47(3):380-388. [17] Kan J, Liu T, Ma N, et al. Transcriptome analysis of Callery pear (Pyrus calleryana) reveals a comprehensive signalling network in response to Alternaria alternata.[J]. Plos One, 2017, 12(9):e0184988. doi: 10.1371/journal.pone.0184988 [18] 王宏.梨黑斑病菌(Alternaria alternata Japanese pear pathotype)生物学特性及其生物-化学协同控制技术的研究[D].南京: 南京农业大学, 2006. [19] 苏晓华, 张绮纹, 沈瑞祥, 等.美洲黑杨×青杨F_2代抗杨叶枯病遗传变异研究[J].林业科学研究, 1998, 11(6):4-7. [20] 潘凤英, 蓝霞, 黄羽, 等.广西地区葡萄黑痘病病原菌的分离与鉴定[J].植物病理学报, 2017, 47(1):9-14. [21] Mukesh M, Andleeb Z, Prashant S, et al. Effect on lycopene, β-carotene, ascorbic acid and phenolic content in tomato fruits infected by Alternaria alternata and its toxins[J].Archives of Phytopathology and Plant Protection, 2017, 50(7-8):317-329. doi: 10.1080/03235408.2017.1312769 [22] Hou Y J, Ma X, Wan W T, et al. Comparative genomics of pathogens causing brown spot disease of tobacco:Alternaria longipes and Alternaria alternata[J]. Plos One, 2016, 11(5):1-21. [23] Jung K H. Growth inhibition effect of pyroligneous acid on pathogenic fungus, Alternaria mali, the agent of Alternaria blotch of apple[J]. Biotechnology and Bioprocess Engineering, 2007, 12(3):318-322. doi: 10.1007/BF02931111 [24] Ting T P, Da W S, Hong B P, et al. Detection of A. alternata from pear juice using surface-enhanced Raman spectroscopy based silver nanodots array[J]. Journal of Food Engineering, 2017:147-155. [25] Zhi C J, Ji Q G, Yi M S, et al. Enhanced resistance to fungal pathogens in transgenic Populus tomentosa Carr. by overexpression of an nsLTP-like antimicrobial protein gene from motherwort (Leonurus japonicus)[J]. Tree Physiology, 2010, 30(12):1599-1605. doi: 10.1093/treephys/tpq093 [26] 张彩霞, 陈莹, 李壮, 等.苹果斑点落叶病致病菌的鉴定及生物学特性研究[J].生物技术, 2011, (4):58-61. doi: 10.3969/j.issn.1004-311X.2011.04.102 [27] 黄毅.杨树叶枯病生物防治初步研究[D].哈尔滨: 东北林业大学, 2010. [28] 卢东升, 杨霁虹.冷藏苹果褐斑病病原菌鉴定及致病性研究[J].河南农业科学, 2006, (12):76-78. doi: 10.3969/j.issn.1004-3268.2006.12.025 [29] 王宏, 常有宏, 陈志谊.梨黑斑病病原菌生物学特性研究[J].果树学报, 2006, (2):247-251. [30] 赵乐, 邢艺林, 李正楠, 等.枣缩果病初侵染链格孢菌的抗硫酸铜标记及稳定性[J].林业科学, 2016, 52(7):53-58. -




 下载:
下载: