-
新疆是杏树的起源地之一,已有1 600多年的栽培历史,品种繁多,主要包括3个类型:Armeniaca vulgaris Lam.,A. sibirica (L.) Lam.和A. dasgcarpa (Ebrh) Pers,其下约有100余种[1-6]。他们是我国重要的果树资源之一。然而,从2016年以来,巩留县超过50%杏树遭受病害,部分枝干产生坏死斑,叶片形成圆形穿孔,而果实受害情况尤为严重,其表面出现褐色、圆形、凹陷、分散或连续的病斑,树木落果,造成果实品质和产量下降。为确定造成巩留县杏树果实病害的原因,本研究对受害杏树果实病斑进行分离、培养,得到病原菌,利用传统形态学观察和分子系统学分析相结合的方式对所分离出菌株进行分类鉴定及其致病性检测。旨在研究造成新疆巩留县杏树果实病害的原因,为当地杏树防治工作提供依据。
-
2017年5月在新疆伊犁州巩留县(82°49′20.05″ E,43°15′16.97″ N)杏树上采集罹病杏10枚。
-
采用常规组织分离法分离病原菌[7]:取杏果实病健交界处,经75%酒精消毒处理2 min,使用无菌水冲洗2次,无菌滤纸吸附水分后置于PDA培养基(马铃薯200 g、琼脂18 g、葡萄糖18 g、蒸馏水1 L)平板上,每个平板接6个组织块,3个重复,25℃培养3~4 d。分别挑取少量菌丝进行纯化培养产物进行后续试验操作。
-
选取病斑明显的新鲜病果,利用徒手切片法,制成临时水载玻片,置于显微镜(Zeiss Primo Star, Carl Zeiss)下观察,并用CCD相机(TCC-5.0,图森图像技术有限公司)拍照。
-
将分离获得的纯菌株置于PDA培养基平皿上,于25℃下培养15 d后,观察其菌落颜色和形态,在显微镜下观察其菌丝、孢子等显微结构特征并拍照。
-
所获得的真菌菌株于PDA培养基上培养10 d后,刮取少量菌丝,采用改良CTAB法进行总DNA的提取[8]。随后,利用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)其rDNA-ITS序列进行扩增[9]。PCR反应体系为25 μL,其中包括12.5 μL 2×Taq PCR MasterMix(天根生化科技有限公司), 9.5 μL ddH20, 1 μL ITS1, 1 μL ITS4和1 μL DNA模板。PCR反应程序为:94℃预变性5 min,94℃变性30 s,54℃退火30 s,72℃延伸30 s,35个循环,最后72℃延伸10 s,4℃保存。扩增产物经琼脂糖凝胶电泳检测后,送北京美吉桑格生物医药科技有限公司进行双向测序。
-
测序结果利用Staden Package 1.6.0 (MRC, Cambridge, England)进行序列拼接。将来自NCBI网站[10]的参考序列与已测菌株序列用在线网站Mafft进行序列比对[11],MEGA6进行序列删减输出fas格式,Mesquite转换成Phy格式,置于在线网站ATGC[12],基于最大似然法构建系统发育树(ML树)。并用Bayesian方法建立Bayesian系统发育学树(Bayesian树)。外群选为Fusarium solani。
-
将所分离的纯菌株于25℃条件下在PDA培养基上培养10 d,然后用打孔器打出5 mm直径菌饼,正面朝下放置在已用无菌水和酒精消毒过的、健康完好的杏树青果和叶片上,滴上1%水琼脂密封保湿,放入无菌的且铺有湿润吸水纸的培养皿和塑料盒中,杏果实6个重复,杏叶片3个重复,25℃培养3~10 d,以接种无菌琼脂块作为对照[13]。待产生病斑后,测量病斑大小并拍照。随后用PDA培养基分离病健交界处,鉴定是否为所接种病原菌[14]。
-
于杏果实病斑处分离纯化获得15个菌落形态一致菌株,随机挑选3株(CYT1701、CYT1702、CYT1703)进行后续显微形态观察和系统发育学分析。
-
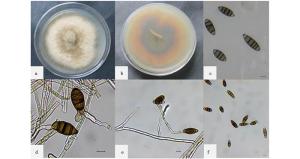
杏果实表面形成褐色、凹陷、圆形聚集或分散的病斑,其薄片制成的临时玻片在显微镜下观察时,可看到病原菌的分生孢子形态(如图 1)。分生孢子为褐色至黑色,分散或聚集存在,梭形或蠕虫形,顶细胞钝圆或锥形,多具有3~5个分隔,在分隔的地方出现缢缩。分生孢子大小为(24.24~49.90) μm×(9.58~18.74) μm,平均为(37.62±7.55) μm×(13.81±2.27) μm。结果与Thyrostroma carpophilum (Lév.) B. Sutton[15]所产生分生孢子基本一致。
-
将PDA培养基分离到菌株于25℃培养15 d后,观察到结果如图 2。菌株菌落呈薄毡状,气生菌丝为白至灰褐色,菌落边缘分生孢子散生或聚集。背面菌落中央呈深褐色,边缘为土黄色。分生孢子梗单生或合轴分枝。分生孢子为梭形或蠕虫形,顶细胞钝圆或锥形,多具有3~5个分隔,在分隔的地方出现缢缩,与自然寄主上形态相似。分生孢子大小为(33.85~56.31) μm×(10.46~22.58) μm,平均为(41.77±5.88) μm×(15.77±3.08)μm。产孢结构为菌落和分生孢子的形态特征与T. carpophilum[15]基本一致。
-
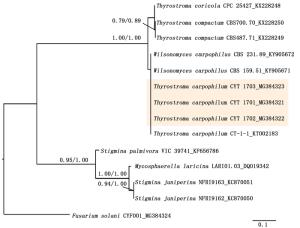
菌株CYT1701、CYT1702、CYT1703(对应GenBank登录号:MG384321、MG384322、MG384323)序列与菌株T. carpophilum (CBS231.89)进行多重序列比对,序列一致性为100%。
将分离到的3株菌的ITS序列和NCBI下载的相关参考序列一起构建ML和Bayesian系统发育学树,结果显示,ML树和Bayesians树拓扑结构与分支情况基本一致,3株菌均聚在T. carpophilum这一支(ML树支持率≥75%,Bayesian树支持率≥85%分别依次标注在分支上)(Fig. 3)。
-
在25℃保湿培养条件下,杏叶片在接种24 h后出现病症,72 h后病斑最大直径达18 mm,呈褐色,凹陷状(图 4);杏果实于接种后48 h出现病症,5 d后病斑直径达17 mm,呈近圆形,深褐色,凹陷状(图 5)。杏果实和叶片的发病率均为100%,然后从其病健交界处进行再分离,所得菌株形态结构和DNA提取、PCR扩增获得ITS片段比对与系统发育学树构建后结果一致,原病原菌T. carpophilum被重新分离获取,满足柯赫氏法则。
-
Thyrostroma carpophilum [异名:Stigmina carpophila (Lév.) M.B. Ellis,Helminthosporium carpophilum Lév.,Clasterosporium carpophilum (Lév.) Aderh.,Coryneum carpophilum (Lév.) Jauch,Sciniatosporium carpophilum (Lév.) Morgan-Jones, Sporocadus carpophilus (Lév.) Arx,Wilsonomyces carpophilus (Lév.) Adask.,Macrosporium rhabdiferum Berk.,Passalora brunaudii Sacc.,Coryneum beyerinckii Oudem.],该菌于1846年在法国首次被观察到,后来陆续在非洲、亚洲、欧洲、北美、中南美洲、澳大利亚和大洋洲也有发现[14]。随着研究的深入,T. carpophilum不断被重新分类。当前该菌最新学名,维基百科显示为W. carpophilus;真菌索引显示为S. carpophila;Mycobank显示为T. carpophilum。
T. carpophilum常侵染核果类果树,可引起植物发生病变[16-18]。侵染叶片,可产生圆形病斑,随时间逐渐扩大,坏死后脱落;侵染树枝,坏死斑形成并逐渐变大,凹陷;侵染果实,形成圆形凹陷坏死组织,具有褐色色圈,树木受到严重危害时落叶、落果[18-21]。墨西哥杏树的叶片,枝条和果实受到病害,经鉴定为该菌侵染造成[18];印度杏树和桃树果实、叶片和枝条也遭遇该菌危害,损失惨重[19];伊朗的核果类树木中分离出大量T. carpophilum[22-23];在国内,甘肃省兰州、临洮等地区的桃树受到T. carpophilum危害后,引起桃果实褐斑病[20]。本研究中杏果实出现的病症被命名为杏果实斑点病[24]。朱建兰等人在对杏果实斑点病菌进行生物学性状研究时提到此病害在中国和印度等国家多有发生[24-25]。由于T. carpophilum危害后核果类树木叶片发生穿孔现象,因此以T. carpophilum作为病原菌引起的植物病害也有记录为穿孔病而被深入研究[17, 19, 21, 26-27]。
目前与杏树相关的病害有30多种,其中侵染循环和适宜发病条件的被明确的病害主要有褐斑穿孔病、霉斑穿孔病、褐腐病、杏疔病、腐烂病、白纹羽病等[25, 27-29]。新疆杏树病害主要为穿孔病(病原为Xanthomonas pruni (Smith) Dowson.)、流胶病(生理原因或病菌感染)和果实软腐病(生理性病害)[1, 30-31],其中穿孔病以细菌性穿孔病研究为主,危害果实,初期表面形成水渍状褐色圆形小斑点,后期扩大为褐色病斑,病斑边缘翘起;危害叶片,病斑初期呈水渍状小点,后期变为褐色斑点,脱落穿孔;危害枝条,常发生水渍状暗紫色斑点,后变为褐色,枝条呈水渍状干枯[28]。虽然此病菌最后使果实出现斑点病,叶片出现穿孔病,但是其病原病斑形成方式与T. carpophilum不同。
-
通过对新疆巩留县杏果实病斑处分离,获得3株病原菌,再经形态观察、系统发育学分析以及致病性检测,鉴定出引起杏果实斑点病害病原菌为Thyrostroma carpophilum。这是第一次在新疆巩留县发现该菌并且报道。
新疆巩留县杏果实斑点病病原菌鉴定
The Pathogen Identification of Apricot Fruit Spots Disease in Gongliu County, Xinjiang
-
摘要:
目的 鉴定引起新疆巩留县杏树果实斑点病病原菌,研究造成杏树果实病害的原因,为当地杏树防治工作提供依据。 方法 采用常规组织分离法分离得到罹病杏真菌菌株,利用传统形态学观察和分子系统学分析相结合的方式对所分离出菌株进行分类鉴定及其致病性检测。 结果 杏果病斑处的病原菌在显微镜下观察到分生孢子形态与经PDA培养基培养后观察到分生孢子形态均与Thyrostroma carpophilum(Lév.)B.Sutton所产生分生孢子一致;将分离获得的3株真菌的rDNA-ITS片段测序后与NCBI参考序列进行多重序列比对的结果显示,其序列与T.carpophilum一致性为100%;在基于ITS基因序列构建的系统发育树中,3株菌与T.carpophilum聚在同一分支。在接种了T.carpophilum后,杏果实和叶片均产生明显病斑并且从其所产生的病斑上再次分离到所接菌,满足柯赫氏法则。 结论 从新疆巩留县杏果实病斑处分离获得的3株真菌,经鉴定为引起杏穿孔病的病原菌T.carpophilum。这是该菌首次在该地区发现并报道。 -
关键词:
- 杏果实斑点病
- / rDNA-ITS
- / 系统发育学分析
- / Thyrostroma carpophilum
Abstract:Objective This study aims to identify the pathogen of apricot fruit spots disease in Gongliu County, Xinjiang, and to find the causes of apricot fruit diseases, so as to provide a reference for the disease prevention and control of local apricot trees. Method The fungal strains on the infected apricot were isolated by using conventional tissue separation method, and the isolates were identified by morphological observation, phylogenetic analysis and pathogenicity. Result The morphological feature of conidia developed on apricot fruit lesions and PDA medium were consistent with the conidia produced by Thyrostroma carpophilum (Lév.) B. Sutton. Furthermore, sequence identity comparison showed that all the three strains obtained were 100% identical in rDNA-ITS sequences with the NCBI reference sequence of T. carpophilum, and the three strains grouped into one consensual cluster with the reference isolates of T. carpophilum in the phylogenic tree based on rDNA ITS sequence. After inoculation of the obtained isolate, both apricot fruits and leaves produced obvious lesions, and the pathogen were again isolated from the lesions, thereby satisfying Koch's postulate. Conclusion The three strains isolated from the apricot fruit spots in Gongliu County were identified as T. carpophilum. This is the first report of this disease presence in Xinjiang Uygur Autonomous Region. -
Key words:
- apricot fruit spots
- / rDNA-ITS
- / phylogenetic analysis
- / Thyrostroma carpophilum
-
-
[1] 林培钧, 崔乃然.天山野果林资源——伊犁野果林综合研究[M].北京:中国林业出版社, 2000. [2] 张钊, 刘明彰, 陈文椒, 等.新疆杏的种质资源[J].果树学报, 1985(3):18. [3] 蒋萍, 赵莉, 李文慧, 等.新疆南疆杏树病害调查[J].新疆农业大学学报, 2012, 35(2):132-136. doi: 10.3969/j.issn.1007-8614.2012.02.010 [4] 刘娟.新疆杏种质资源遗传多样性及核心种质构建[D].乌鲁木齐: 新疆农业大学, 2015. [5] 刘娟, 廖康, 刘欢, 等.新疆野杏种质资源表型性状多样性研究[J].西北植物学报, 2015, 35(5):1021-1030. [6] 兰彦平, 吐拉克孜, 郭文英, 等.巴旦杏的研究现状及开发利用前景[J].林业科学研究, 2004, 17(5):674-679. doi: 10.3321/j.issn:1001-1498.2004.05.020 [7] 方中达.植病研究方法[M].北京:中国农业出版社, 2007. [8] Huai W X, Guo L D, He W. Genetic diversity of an ectomycorrhizal fungus, Tricholoma terreum, in a Larix principis-rupprechtii, stand assessed using random amplified polymorphic DNA[J]. Mycorrhiza, 2003, 13(5):265-270. doi: 10.1007/s00572-003-0227-8 [9] White T J, Bruns T D, Lee S B, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: PCR Protocols[M] Academic Press, 1990: 315-322. [10] W W M, Myers E W, Lipman D J. Blast (basic local alignment search tool)[J]. Encyclopedia of Genetics Genomics Proteomics & Informatics, 2008, 215(3):221-221. [11] Nakamura T, Yamada K D, Tomii K, et al. Parallelization of MAFFT for large-scale multiple sequence alignments.[J]. Bioinformatics, 2018, 34(14):2490-2492. doi: 10.1093/bioinformatics/bty121 [12] Guindon S, Dufayard J F, Lefort V, et al. New algorithms and methods to estimate maximum-likelihood phylogenies:assessing the performance of PhyML 3.0.[J]. Systematic Biology, 2010, 59(3):307-321. doi: 10.1093/sysbio/syq010 [13] 刘开启, 杨炜华, 郭泺.杏果实黑斑病病原鉴定及病原菌生物学特性[J].仲恺农业工程学院学报, 2003, 16(4):1-6. doi: 10.3969/j.issn.1674-5663.2003.04.001 [14] Koch R. Studies on bacteria V. The etiology of anthrax disease, based on the developmental history of Bacillus anthracis[J]. Bio D Plants, 1876, 2:277-310. [15] Sutton B C, On Stigmina, Wilsonomyces and Thyrostroma (Hyphomycetes)[J]. Arnoldia, 1997, 14:33-35. [16] Ivanová, Kaločaiová, Bolvansky. Shot-hole disease on Prunus persica-the morphology and biology of Stigmina carpophila[J]. Folia Oecologica, 2012, 39(1):21-27. [17] 翟洪民.杏树穿孔病的发生与综合防治[J].农家科技, 2013(7):16-17. [18] Tovar-Pedraza J M, Ayala-Escobar V, Segura-León O L. Thyrostroma carpophilum, causing apricot shot-hole in Mexico[J]. Australasian Plant Disease Notes, 2013, 8(1):31-33. doi: 10.1007/s13314-013-0089-7 [19] Dar R A, Rai A N, Shiekh I A. Stigmina carpophila, detected on Prunus armeniaca, and Prunus persica, in India[J]. Australasian Plant Disease Notes, 2017, 12(1):19-22. doi: 10.1007/s13314-017-0245-6 [20] 何苏琴, 白滨, 文朝慧, 等.甘肃省桃果实褐斑病病原鉴定[J].植物保护, 2016, 42(5):53-57. doi: 10.3969/j.issn.0529-1542.2016.05.008 [21] Teviotdale B L, Goodell N, Harper D. Abscission and kernel quality of almond fruit inoculated with the shot hole pathogen Wilsonomyces carpophilus.[J]. Plant Disease, 1998, 81(12):1454-1458. [22] Yousefi A, Panjehkeh N H S M. Evaluation of shot hole disease incidence and severity on stone fruit trees in Razavi Korasan province[C]//The National Iranian Conference of Plant Protection, Volume Ii, Plant Disease, Tehran-Iran, 31 July-3 August. 2010. [23] Ahmadpour A, Ghosta Y, Javan-Nikkhah M, et al. Isolation and pathogenicity tests of Iranian cultures of the shot hole pathogen of Prunus, species, Wilsonomyces carpophilus[J]. Australasian Plant Disease Notes, 2009, 4(1):133-134. [24] 朱建兰, 常永义, 陈德荣, 等.杏果实斑点病菌生物学性状的研究[J].甘肃农业大学学报, 1990, 25(2):165-169. [25] 赵军营, 程弘.杏树病害研究进展[J].中国果树, 2001(1):45-48. [26] Teviotdale B L, Goodell N, Harper D. Effect of infection by the shot-hole fungus, Wilsonomyces carpophilus, on drop and quality of almond fruit 1[J]. Eppo Bulletin, 2010, 27(4):493-500. [27] 曹若彬, 浙江农业大学.果树病理学[M].北京:农业出版社, 1992. [28] 赵丽瑞.杏树常见病虫害及其防治[J].湖南农机:学术版, 2008, 35(6):32-33. [29] Thakur V S, Gupta V K, Garg R C. Management of fungal diseases of stone fruits with fungicides in Himachal Pradesh.[J]. Indian Journal of Agricultural Sciences, 1991, 61(9):677-681. [30] 蒋萍, 赵莉, 李文慧, 等.新疆南疆杏树病害调查[J].新疆农业大学学报, 2012, 35(2):132-136. doi: 10.3969/j.issn.1007-8614.2012.02.010 [31] 阿里木·买买提, 张静文, 阿依夏木·亚库甫.新疆轮台县杏树侵染性流胶病病原菌的鉴定[J].北方园艺, 2018(1):40-45. -





 下载:
下载: