-
无距虾脊兰(Calanthe tsoongiana T. Tang et F. T. Wang)为兰科(Orchidaceae)虾脊兰属(Calanthe R. Br.)多年生草本植物,喜阴湿、排水良好的林下土壤,可以耐0℃以下低温,在我国浙江、江西、福建、贵州、安徽等地均有分布[1],其总状花序疏生数朵淡紫色下垂小花,花姿秀丽,具有较高的观赏价值。近年来,由于“兰花热”的兴起,野生环境的破坏,无距虾脊兰野生种群遭受严重毁坏。2004年《中国物种红色名录》将无距虾脊兰列为近危物种[2],2015年黄卫昌等基于标本和分布信息对中国虾脊兰属的濒危状况重新进行了评估,确定了无距虾脊兰的濒危等级为极度濒危[3]。为促进兰科植物种质资源保存、扩繁及观赏应用,急需开展对无距虾脊兰繁殖过程的研究。
兰科植物兼具营养繁殖和种子繁殖2种繁殖方式,自然界中的营养繁殖主要以分株繁殖为主,但繁殖效率低下,幼苗生长缓慢。优质兰花野生原种种性的保存和延续依赖于种内自交后的播种,而兰科植物种胚发育不完整,没有胚乳,自然栖息地中的种子繁殖需与真菌共生才能萌发,萌发率较低,且从类原球茎形成到幼苗分化完成所需时间较长[4],难以维持种群的稳定以及满足实际生产的需要。1922年,Kundson等首次将兰花种子播种在无菌培养基上且成功萌发,利用体外无菌播种技术为快速、大量繁殖濒危、罕见及具有园艺价值的兰花提供了可操作性系统[5]。研究无距虾脊兰从种子萌发到幼苗形成进程中的关键特征是进一步探索其种子萌发分子机制的基础。尽管从种子萌发到幼苗的形态建成是一个连续的发育过程,为了描述和研究的方便,通过形态学和解剖学研究对整个进程进行科学划分仍是十分必要的。本文首次确定和筛选了无距虾脊兰种子无菌播种的最佳授粉后胚龄和最适萌发培养基,详细观察研究不同萌发状态下的种子结构特征、原球茎形态建成和发育细胞组织学特征、萌发过程中的一些特殊情况等,旨在揭示无距虾脊兰种子萌发过程的形态特征和组织结构特点,为无距虾脊兰的保育和离体快速繁殖提供参考依据。
-
本研究所采用的无距虾脊兰果实采自模式标本来源地浙江临安境内的天目山国家级自然保护区,于当年3月份对其野生居群进行人工授粉,后采摘不同胚龄的蒴果。
-
采摘开花授粉后胚龄为90、120、150、180、210 d的蒴果带回实验室,将蒴果先置于流水下冲洗干净,75%酒精表面擦拭后置于0.1%升汞灭菌约10 min,无菌水冲洗5~6次。在无菌条件下剖开蒴果,用镊子夹住果壳,轻轻将种子均匀抖落在提前配置好的培养基表面。每个处理播种10瓶,3个重复,以VW作为基本培养基。
最适萌发培养基筛选实验选用MS、1/2MS、1/4MS、KC、VW、HyponexⅠ 6种培养基作为基本培养基,分别添加香蕉泥和椰子汁作为有机添加物,每个处理播种5瓶,3个重复。
-
培养温度为(26±2)℃,培养室光照强度1 500~2 000 lx,光照时间12 h·d-1。
将萌发过程中不同阶段的组织材料置于Olympus SZ61变焦体式显微镜下观察并拍照。
-
常规石蜡切片法制片,以不同发育阶段的原球茎为材料,置于FAA固定液中固定过夜,切片厚度为8 μm,改良海氏苏木精-伊红染色,中性树胶封片,切片置于Olympus CX41光学显微镜和Olympus SZ61变焦体式显微镜下观察并拍照。
-
播种120 d后统计瓶萌发率,每种培养基的萌发瓶率的统计参照徐晓薇等[6]的方法。实验数据采用Excel 2016、SPSS 22.0软件进行统计分析和作图。
-
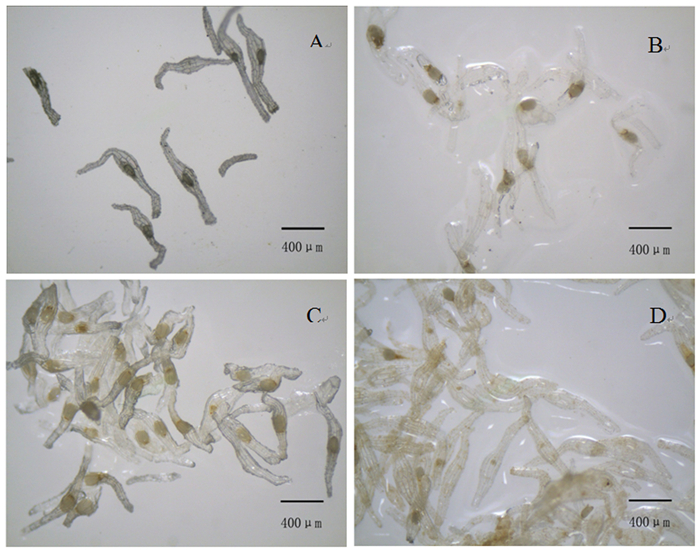
无距虾脊兰种子从播种到种胚突破种皮最快需要70 d。种子由种皮和种胚组成,种胚较小(图 1A),种子质地脆弱,容易折断,将其播种于培养基后,种胚吸水膨胀变大(图 1B、C),此时细胞排列紧密,细胞体积和细胞核较大,球形胚体时期未见表皮组织的分化。种胚在突破种皮前就已显示出结构上的极性,种胚中的细胞具有不同的分化命运。种胚尚未发育完全时采摘蒴果,种胚在培养基中停止发育,同时也无法吸水膨胀进而启动萌发过程(图 1D)。此外,胚龄相对较小时,蒴果内含水量较高,种子较为幼嫩,不仅难以分散开充分吸收养分,而且易粘连胎座组织,播种后迅速褐化,影响萌发率。种胚发育正常,但正常播种后仍然无法萌发的种子停留在种胚吸水膨胀未突破种皮阶段(图 1B)。
-
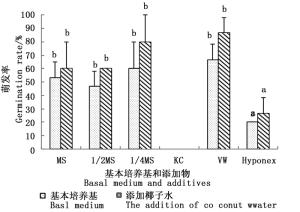
实验结果(图 2)表明:种子萌发率与胚龄具有密切的联系,胚龄为90 d的种子萌发率为0,胚龄为120 d时萌发率最高,随后逐渐降低,到210 d时,萌发率降为0,无距虾脊兰种子在授粉后120 d左右采收播种最佳,此时胚已饱满趋于成熟,萌发潜力最大。

图 2 不同授粉后胚龄对无距虾脊兰种子萌发的影响
Figure 2. The effect of different embryo-age on seed germination of C.tsoongiana
无距虾脊兰种子在VW培养基上萌发效果最好,其次为1/4MS和1/2MS,在KC培养基上无法萌发。以MS、1/2MS、1/4MS和VW为基本培养基对萌发率的影响差异不显著。添加椰子水能够促进种子萌发,但除萌发率较低的HyponexⅠ和KC培养基,其余培养基中添加椰子水后,种子萌发表现无显著差异。添加香蕉泥后所有培养基中的种子都不能萌发,因此,香蕉泥对无距虾脊兰的种子萌发具有抑制作用(图 3)。
-
种胚突破种皮到幼苗形成耗时约1~2个月。自播种到观察停止的255 d内,培养瓶中不断有原球茎出现并发育成幼苗。无距虾脊兰原球茎为顶端具有指状凸起,基部具有束状假根的球形或扁球型结构(图 4E、F)。顶端凸起为封闭构造,不断伸长后分化出幼叶(图 4F、G、H)。幼根在原球茎基部出现,长有大量根毛(图 4H)。原球茎发育后期,其侧面将会出现多条根的生长,根的生长呈现明显的向地性(图 4I)。
原球茎的发育过程中还存在一些特殊情况。原球茎初期,观察到培养瓶中有较多的原球茎死亡,表现为原球茎无绿色,最后变黑(图 5D)。此外,还观察到原球茎发育畸形以及具有多个生长点等现象(图 5C、F),这种异常发育的原球茎最终都无法形成幼苗。另外,有些原球茎发生分裂,分裂成的各部分在基部相连(图 5A、B),也存在1个原球茎上分化出2个茎尖,最后发育成2株幼苗的情况(图 5E)。
-
原球茎表皮为种胚中原表皮发育而来,由一层体积较小的细胞组成,排列整齐紧密。种子萌发后,球形胚体逐渐显示出极性,形态学上端细胞有丝分裂旺盛,细胞体积较小,具有相似的细胞学特征,下部薄壁细胞含有大量的淀粉粒。能够发育成茎顶端分生组织的细胞具有较大的核质比,细胞核位于细胞中央,基部的薄壁细胞体积扩大(图 6Ⅱ、Ⅲ)。顶端分生组织的发育模式遵循原套-原体学说,初始呈圆顶状结构,细胞不断分裂后呈圆锥形(图 6Ⅲ、Ⅳ、Ⅵ)。顶端分生组织区的两侧细胞增大形成叶原基并突出表面,随后形成幼叶(图 6Ⅳ、Ⅵ),同时,顶端分生组织向内分化出的原形成层发育出维管束(图 6Ⅶ),幼叶中的细胞分裂、增大后脱离茎端转变成肉眼可见的片状幼叶,芽体内部叶原基分化出4~5片幼叶后,原球茎基部出现新的原形成层,维管束由一束变为多束,此时,幼根在原球茎基部侧面形成,维管束起到连接幼叶和幼根的作用(图 6Ⅴ、Ⅻ),此时开始进行幼苗阶段的生长。无距虾脊兰幼根具有单子叶植物根的典型特征,由表皮、皮层、中柱组成,中柱未充分发育,幼根具有根毛(图 6Ⅷ)。

图 6 无距虾脊兰种子萌发及原球茎形成和发育的解剖学特征
Figure 6. Anatomic features of seed germination as well as the formation and development of C. tsoongiana
淀粉粒在原球茎形成和发育的整个进程中大量存在,原球茎发育后期,淀粉粒集中于底部,原球茎基部起到类似储藏器官的功能(图 6Ⅺ)。晶体散布于绿色的原球茎中,在茎顶端分布相对较多(图 6Ⅺ)。原球茎初期就开始形成的透明束状假根伸入培养基中,它具有两种起源方式,一是直接起源于表皮细胞的增厚,二是表皮细胞首先分裂突出表面,假根起源于增厚或者未增厚的表皮细胞(图 6Ⅸ、Ⅹ)。
-
根据对培养过程中种子萌发特征的观察,将无距虾脊兰种子离体萌发过程分为以下4个阶段:(1)种子吸水膨胀阶段:种胚中含有数量较少、尚未分化的细胞,种胚首先吸水膨胀,体积变大,直到从合点端突破种皮(图 4B,图 6Ⅰ);(2)茎顶端分生组织阶段:种胚突破种皮后形成的小球体表皮组织已经分化完成,其顶端细胞具备分生能力并形成茎顶端分生组织,浅绿色小球体颜色逐渐加深(图 4C、D,图 6Ⅱ、Ⅲ),形态学上端开始出现凸起;(3)幼叶形成阶段:原球茎顶端出现的凸起不断伸长,顶端分生组织不断分化出叶原基,叶原基形成幼叶,原球茎基部尚未出现幼根(图 4F,图 6Ⅳ);(4)根叶分化阶段:原球茎上端首先分化出第1片幼叶,该幼叶较小且位于幼苗基部,第2片幼叶顶端卷曲,呈现出叶片的雏形。根端分生组织在原球茎基部出现,随后生长发育成幼根突出表面(图 4G、H,图 6Ⅴ、Ⅶ)。
-
试验过程中发现无距虾脊兰种子生活力较低,多数种子萌发所需时间较长,萌发率较低并存在严重的不同步性。从播种到种子突破种皮速度最快需要70 d,从成功萌发到幼苗分化完成需3个月左右。无距虾脊兰种子构造简单,不含胚乳,种胚也未见胚根、胚轴、胚芽和子叶的分化,种子结构的差异导致其种胚发育方式与其它开花植物存在显著不同。不同的兰科植物种胚具有不同的细胞数目和大小,多数兰科植物成熟种子胚表现出表皮组织、分生组织和薄壁组织这3种组织学之间的差异,薄壁组织细胞较大,分生组织细胞小型,无维管组织的分化。有研究称种胚中细胞大小呈梯度变化的较之于无显著大小差异的兰科植物更容易萌发[7],光镜下的无距虾脊兰膨大种胚仅由核大、含有内含物、数量较少的薄壁细胞组成,细胞大小不存在梯度变化,这可能是导致其种子萌发速度缓慢和萌发率低的潜在原因之一。
-
无距虾脊兰种胚突破种皮后形成的浅绿色球形结构即被称为原球茎[8],其种胚在撑破种皮但还尚未脱离种皮时已经显示出结构上的极性,种胚内部已进行了对应的组织分化,此时的结构与膨大种胚的结构存在明显的差异,因而,种胚撑破种皮时即为原球茎的起始。原球茎形态学上端出现的指状突起为一封闭结构,内部结构具有类似于芽的特征,茎顶端分生组织在进行了一定的生长和分化之后,根端分生组织才开始在基部出现,因此,幼根在基部出现时为原球茎阶段的结束和幼苗阶段的开始。
国内外学者对兰花原球茎的性质持有较大的争议,Batygina等[9]认为,原球茎是一种双极性结构,具有发育出茎尖和根端分生组织的能力,因此,把原球茎视为正在发育中的幼苗;Nishimura等[10]表示,一些蝴蝶兰属(Phalaenopsis Blume)植物的原球茎即为幼苗,因为它的顶部是一种类似于特化叶、能够进行光合作用的结构;而Edward等[7]则把原球茎视为胚发育阶段的延伸。无距虾脊兰原球茎为具有多种组织分化,但根、叶尚未分化完全的特殊结构,在促使种子成功萌发并形成幼苗的过程中起到关键的联结作用,无论是从组织结构,还是形态特征的角度来说,都不应简单地把无距虾脊兰原球茎的性质与种胚和幼苗等同。
-
原球茎转绿表明细胞内叶绿体的产生,无距虾脊兰同化产物方式由异养型转变为光合自养型。一些萌发速度较快的兰花,如鹤顶兰(Phaius tankervilleae (Banks ex L'Herit.) Bl.)[11]、白芨(Bletilla striata (Thunb.) Rchb. f.)[12]、Vanda dearei Rchb. f.[13]等,存在种胚突破种皮前就已转绿的发育方式。吴明开等[14]认为,兰花种胚占比较小的需要借助于光合作用突破种皮,在种皮破裂前就已转绿。本研究中的无距虾脊兰种胚在突破种皮后才开始转绿,这表明种胚中叶绿体的产生时期与种胚的相对大小同样无绝对的联系。无距虾脊兰种子在播种后70~255 d开始萌发形成原球茎,萌发需要时间较短的兰花常发生种胚在突破种皮前就已转绿的现象[11-13],需时较长的兰花种子萌发后,叶绿体多出现在原球茎时期[15-18]。因此,作者推测种皮破裂或原球茎形成所需时间的长短与叶绿体的产生时期有一定的关系。叶绿体的产生对种子成功萌发具有一定的促进作用。
-
原球茎基部长有较长的假根[19-21],也有学者称之为“纤毛”[22],它与幼根的根毛具有相似的形态特征,原球茎顶端分生组织出现后便开始显现,在根端分生组织出现后逐渐退化消失。在墨兰(Cymbidium sinense(Andr.)Willd.)[23]、三棱虾脊兰(C. tricarinata Lindl.)[24]、雪茄萼足兰(Cyrtopodium punctatum (L.) Lindl.)[18]和白芨[12]原球茎基部都观察到存在相同的纤毛状突起。无距虾脊兰假根起源于原球茎表皮细胞的分裂或增厚,幼根根毛是由表皮细胞发生凸起形成,二者虽然具有相异的形成方式,但具有相同的起源,因此,作者推断假根在原球茎生长发育中起到吸收水分和养分的作用,与根毛的功能是相同的。
-
原球茎褐化死亡可能存在2种原因,一是叶绿体的缺失导致死亡,二是发育出叶绿体后培养环境的影响(如光照)致使其无法正常生长而死亡。至于无距虾脊兰种子离体培养过程中出现的原球茎发育畸形、呈现多个生长点,最后死亡的现象,已有研究证明在原球茎发育期间,生长素极性运输抑制剂能够影响叶片形成和原球茎形态发生[7],这种畸形发育和生长可能与原球茎内激素含量有关,此种情况易发生于后熟期长的种子中,即从播种到原球茎形成的发育阶段[25],这与无距虾脊兰种子具有较长的后熟期相符合。
-
无距虾脊兰种子无菌萌发速度缓慢,萌发率较低,原球茎为从种子转变为幼苗过程中的重要中间结构,形态学顶端具有与芽类似的内部结构,顶端分生组织、叶绿体和维管束为原球茎生长和发育过程中的重要结构。本文为无距虾脊兰种子无菌萌发并成功形成幼苗的首次报道,但仅初步探索了其无菌萌发的基本条件,为更好地完善无距虾脊兰无菌萌发和离体繁殖体系,还需对离体条件进行更深入的研究。
濒危植物无距虾脊兰种子无菌萌发与幼苗形成
Seed Germination and Seedling Morphogenesis of an Endangered Species Calanthe tsoongiana
-
摘要:
目的 揭示无距虾脊兰种子无菌萌发过程的形态特征和组织结构特点,为无距虾脊兰保育和离体快速繁殖提供参考依据。 方法 以浙江天目山无距虾脊兰野生居群为材料,采收其果实进行无菌萌发实验。通过形态观察和石蜡切片法,对种子萌发到幼苗初步形成过程进行细胞组织学研究,并对发育阶段进行划分。 结果 无距虾脊兰种子萌发的适宜基本培养基为VW培养基,椰子水对萌发具有促进作用,而香蕉泥对萌发具有抑制作用,在授粉后胚龄为4个月左右采收进行播种,萌发率最高。依据对其萌发过程中种胚膨胀、顶端分生组织的出现和发育、叶和根的分化等突出性状的观察,将无距虾脊兰种子萌发过程分为4个阶段。 结论 无距虾脊兰的种子无菌萌发过程主要由种胚吸水膨胀,原球茎的形成和分化2个生物学过程组成,其中,顶端分生组织、叶绿体和维管束为原球茎生长和发育过程中的重要结构。 Abstract:Objective The study aims at revealing the morphological characteristics and histological structure during aseptic seed germination of Calanthe tsoongiana, so as to provide some references for its conservation and in vitro rapid propagation. Method This study was conducted by using wild population of C. tsoongiana distributed in Tianmushan, Zhejiang Province, aseptic germination was taken after harvesting the fruits. The process from seed germination to initial seedling formation was studied and divided into several developmental stages by morphological observation and paraffin section method. Result It proved that the Vacin & Went (VW) medium was the suitable basal medium for seed germination which was facilitated by coconut water. Nevertheless, the banana slurry had an inhibitory effect. The germination rate reached the highest when harvesting the fruit at the time of four months or so after pollination. The process of seed germination was divided into four stages according to the observation on swelled embryo, the presence and development of shoot apical meristem, the differentiation of young leaf and root, etc. Conclusion The process of aseptic seed germination is mainly composed of two biological processes, seed imbibition and the form and differentiation of protocorm. Apical meristem, chloroplast and vascular bundle are the major structures during the growth and development of protocorm. -
Key words:
- Calanthe tsoongiana
- / seed
- / aseptic germination
- / protocorm
- / histology of cell
-
-
[1] 中国科学院中国植物志编辑委员会.中国植物志:第18卷[M].北京:科学出版社, 1997:279. [2] 汪松, 解焱.中国物种红色名录[M].北京:高等教育出版社, 2004. [3] 黄卫昌, 周翔宇, 倪子轶, 等.基于标本和分布信息评估中国虾脊兰属植物的濒危状况[J].生物多样性, 2015, 23(4):493-498. [4] 李海峰, 赵志莲, 张海珠, 等.濒危莲瓣兰杂交育种及原生地种子萌发的研究[J].西北植物学报, 2010, 30(3):541-545. [5] Kaur S, Bhutani K K. In vitro conservation and asymbiotic propagation of Coelogyne flaccida (Lindl.):a threatened orchid[J]. Plant Biosyst, 2014, 148(5):935-944. doi: 10.1080/11263504.2013.801368 [6] 徐晓薇, 柴明良, 杨燕萍, 等.寒兰杂交及种子离体萌发研究[J].园艺学报, 2011, 38(10):2010-2016. [7] Edward Y. A perspective on orchid seed and protocorm development[J], Bot Stud, 2017, 58(1):33 doi: 10.1186/s40529-017-0188-4 [8] 连静静, 钱鑫, 王彩霞, 等.无距虾脊兰胚珠发育及种子形成研究[J].西北植物学报, 2013, 32(3):494-500. doi: 10.3969/j.issn.1000-4025.2013.03.010 [9] Batygina T, Andronova E. The orchid protocorm: an opinion[M]//Mukerji K. Glimpses in botany. New Delhi: APH Publishing, 2000: 60-77. [10] Nishimura G. Comparative morphology of Cattleya and Phalaenopsis (Orchidaceae) seedlings[J]. Botanical Gazette, 1981, 142(3):360-365. doi: 10.1086/337235 [11] 姚绍嫦, 凌征柱, 蓝祖栽, 等.鹤顶兰种子萌发及原球茎增殖培养研究[J].西北植物学报, 2012, 32(7):1474-1479. doi: 10.3969/j.issn.1000-4025.2012.07.029 [12] 张燕, 黎斌, 李思锋.不同培养基上白芨的种子萌发与幼苗形态发生[J].西北植物学报, 2009, 29(8):1584-1589. doi: 10.3321/j.issn:1000-4025.2009.08.013 [13] Jualang A G, Devina D, Hartinie M, et al, Asymbiotic seed germination and seedling development of Vanda dearei[J]. Malays Appl Biol, 2014, 43(2):25-33. [14] 吴明开, 李晶, 沈志君, 等.3种兰科植物种胚的形态发育特征观察[J].贵州农业科学, 2011, 39(6):19-23. doi: 10.3969/j.issn.1001-3601.2011.06.006 [15] 唐凤鸾, 江海涛, 赵志国, 等, 多花兰种子无菌萌发及离体快繁研究[J].广西植物, 2012, 32(6):793-799. doi: 10.3969/j.issn.1000-3142.2012.06.015 [16] 胡琦敏, 李勇毅, 黄云峰, 等.海伦兜兰的无菌播种与快速繁殖[J].植物生理学报, 2016, 52(9):1443-1448. [17] 周伟香, 龚宁, 李光, 等.花叶开唇兰种子非共生萌发的研究[J].中草药, 2007, 38(4):610-613. doi: 10.3321/j.issn:0253-2670.2007.04.045 [18] Dutra D, Kane M E, Richardson L. Asymbiotic seed germination and in vitro seedling development of Cyrtopodium punctatum:a propagation protocol for an endangered Florida native orchid[J]. Plant Cell, Tissue and Organ Culture, 2009, 96(3):235-243. doi: 10.1007/s11240-008-9480-z [19] Vudala S M, Ribas L L F. Seed storage and asymbiotic germination of Hadrolaelia grandis (Orchidaceae)[J].South African Journal of Botany, 2017(1), 108:1-7. [20] Hoang N H, Kane M E, Radcliffe E N, et al. Comparative seed germination and seedling development of the ghost orchid, Dendrophylax linden (Orchidaceae), and molecular identification of its mycorrhizal fungus from South Florida[J]. Annals of Botany, 2017, 119(3):379-393. doi: 10.1093/aob/mcw220 [21] 聂宁, 朱艳, 田梅, 等.白及种子萌发及原球茎发育过程的细胞组织学观察[J].中国中药杂志, 2016, 41(8):1446-1449. [22] 张燕, 李思锋, 黎斌.独蒜兰种子无菌萌发过程观察和萌发培养基筛选[J].西北农业学报, 2010, 19(1):136-139. doi: 10.3969/j.issn.1004-1389.2010.01.030 [23] 陈进勇, 程金水.几种中国兰种子试管培养根状茎发生的研究[J].北京林业大学学报, 1998, 20(1):35-38. [24] Godo T, Komorli M, Nakaoki E, et al. Germination of mature seeds of Calanthe tricarinata Lindl., an endangered terrestrial orchid, by asymbiotic culture in vitro[J]. In Vitro Cellular & Developmental Biology-Plant, 2010, 46(3):323-328 [25] 陈汝民, 叶庆生, 王小菁, 等.墨兰种子胚的发育和培养初步研究[J].热带亚热带植物学报, 1995, 3(4):72-75. -





 下载:
下载: