-
植物可通过感知光周期的昼夜变化和季节日照时间的长短,来调节启动开花的时间[1-2],这是内部节律基因与外部环境信号参与时间调控机制相互作用的结果[3]。FKF1是在研究晚花突变体时发现的蓝光特异性光受体基因[4-5],它受昼夜节律钟和光信号调控,位于开花促进基因CO、FT的上游 [3]。在蓝光介导下,FKF1能与GI蛋白发生互作形成FKF1-GI复合体,该复合体能通过泛素化途径的26S蛋白酶复合体降解CO的抑制因子CDF1,进而正向调节CO的转录水平[4, 6-7];另外,FKF1还能与开花促进基因CO直接互作并稳定CO的表达[8-9]。因此,在光周期途径中,FKF1在应答光信号、节律信号以及调控下游开花促进基因CO上起着重要的作用。目前,有关FKF1基因的研究主要集中在1年生草本植物中,而在多年生木本植物中的研究相对较少。在拟南芥(Arabidopsis thaliana (Linn.) Heynh.)[5, 7]、大豆(Glycine max (Linn.) Merr.)[10]中,fkf1突变体会延迟开花,而过量表达则引起提前开花。在水稻(Oryza sativa Linn.)中,FKF1的调控功能仍不清楚,它不受光周期影响就能促进开花,可能是一种自主的成花启动因子,也可能是通过其特异的功能来调控水稻特异基因Ehd2、Ghd7、Ehd1的表达[11]。因此,FKF1基因在不同光周期类型的植物中存在功能差异。
馥郁滇丁香(Luculia gratissima (Wall.) Sweet)属于典型的短日照多年生木本植物[12],是一种具有较高观赏价值的木本花卉,既可盆栽又可园林配置[13]。本课题组在前期的转录组测序中鉴定出馥郁滇丁香FKF1的同源基因,并发现其相对于非诱导光周期,在诱导光周期下呈显著下调表达,这与报道的草本植物的光周期成花表达模式相反。本研究根据转录组的信息,利用RACE技术克隆获得LgFKF1基因的cDNA全长序列,并对其进行生物信息学分析;同时,利用qRT-PCR对LgFKF1在特异组织中的节律表达进行分析,旨在为进一步研究FKF1的生物学功能提供参考依据。
-
以馥郁滇丁香品种‘香妃’扦插苗为试材。于2016年12月15日扦插,当生根的幼苗新长出2~3个茎节时,去除所有植株的顶端分生组织,并移入非诱导光周期(22:00~2:00暗中断补光,光照强度为1.8~2.3 μmol·m−2·s−1)的温室中培养;同时,在自然环境中放置部分植株设为对照。当对照植株出现花芽分化后,开始进行诱导光周期(光照/黑暗为10 h/14 h)处理。
-
根据前期的转录组测序结果为依据,选取诱导光周期处理7、10、13、19 d 4个时间点取样。每个时间点随机选10株单株,每个单株取主枝上的1个芽,共10个芽,采集的样品液氮速冻后-80℃保存。等量混合4个时间点的样品进行cDNA全长序列克隆。
-
参照万友名等[12]的方法,将非诱导光周期中培养的植株移入诱导光周期中进行诱导处理。自处理开始,每隔3~5 d随机选取10株植株,每株采集健壮主枝上的顶芽1个,共10个芽混合为1个样,重复3次。与此同时,每次都采用相同的方法在非诱导光周期中采集样品设为对照。每次在上午9:00—11:30采样。采样自诱导光周期处理开始至花蕾现蕾。所有样品采集后液氮速冻并保存在−80℃冰箱中用于qRT-PCR分析。然后,根据万友名等[12]的形态学观察结果,选取诱导光周期处理7 d(未分化期)、10 d(总苞原基分化期)、13 d(花序原基分化期)、19 d(小花原基分化期)4个时间点的样品及其对照样品进行qRT-PCR分析,共24个样。
-
于‘香妃’的盛花期,选取一天24 h,从早8:00开始,每隔3 h从种植条件一致的同一批试验材料中分别采集根(T1)、茎(T2)、叶(T3)、营养芽(T4)、着色期花蕾(T5)、露白期花蕾(T6)及开放的花朵(T7)1次,每次每个组织取300~500 mg,重复3次。所有样品采集后立即液氮速冻并保存于-80℃冰箱中用于qRT-PCR分析。
-
样品经液氮研磨后,按照生工生物工程(上海)公司提供的柱式植物总RNA抽提纯化试剂盒(SKB8661)说明书操作提取总RNA。利用第一链cDNA合成试剂盒(RevertAid Premium Reverse Transcriptase)(Thermo ScientificTM EP0733)按说明书操作将提取的RNA反转录成cDNA。
-
以转录组测序结果为基础,经信息分析获得与FKF1功能相似的Unigene片段,并命名为LgFKF1。采用Primer premier 5.0软件设计引物(表1)。然后,以合成的cDNA为模板,利用LA Taq(TaKaRa DRR02AG)进行PCR扩增,具体方法按照说明书操作。PCR反应条件为:95℃预变性3 min,94℃变性30 s,58℃退火30 s,72℃延伸60 s,33个循环,72℃ 修复延伸7 min。1%琼脂糖凝胶电泳检测PCR产物。采用柱式DNA胶回收试剂盒(生工B518131)回收目的条带。回收的目的片段连接pGM-T载体后转化大肠杆菌DH5α感受态细胞,37℃过夜培养,筛选阳性克隆送至生工生物工程(上海)公司测序。
表 1 LgFKF1克隆及qRT-PCR的引物
Table 1. Primers for LgFKF1 cloning and qRT-PCR
引 物primer 序 列
sequence5’adaptor GCTGTCAACGATACGCTACGTAACGGCATGACAGTGCCCCCCCCCCCCCCC 3’adaptor GCTGTCAACGATACGCTACGTAACGGCATGACAGTGTTTTTTTTTTTTTTTTTT 5-3’outer GCTGTCAACGATACGCTACGTAAC 5-3’inner GCTACGTAACGGCATGACAGTG FKF1-F1 TACATGAGCTATGCTTAGCCAGCAGACAG FKF1-F2 ACAGCTTAAAGCCACGCTACGTCTTCAA FKF1-R1 GCTCCAAAGCATCCGATACCACGA FKF1-R2 GCGTCGTAATGGGATACAAGAATTTCTCA FKF1-RT1 GTAAACTGGATATGACGCAC FKF1-RT2 TGTATCCCAATTATGTGTGTA Actin F CATAGTTGAACCACCACTGAGC Actin R TGCCCGATGGACAAGTTATT FKF1 F CGTGGTATCGGATGCTTTG FKF1 R CTGAGCACGAGGGTCTCTAAAT -
克隆拼接获得的序列经NCBI的ORF Finder (https://www.ncbi.nlm.nih.gov/gorf/gorf.html)分析翻译成氨基酸序列,然后,通过BLAST(http://b-last.ncbi.nlm.nih.gov/Blast.cgi)进行蛋白序列的同源性比对,同时,选取部分相似度高的同源蛋白序列利用DNAMAN5.1软件进行同源性比对;利用ProtParam(http://www.expasy.org/tools/protp-aram.html)在线工具软件预测分析蛋白的理化性;利用ProtScale(https://web.expas-y.org/cgi-bin/pro-tscale/protscale.pl)进行亲/疏水性预测分析;利用SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)预测蛋白的信号肽;利用PROTTER(http://wlab.e-thz.ch/protter/start/)建立蛋白跨膜结构模型;利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)在线软件分析蛋白的二级结构组成;利用SWISS-MODEL(https://swissmodel.expasy.org/interactive)同源建模方法得到蛋白的三维预测模型;利用ProtComp9.0(http://www.softberry.com/berry.phtml?topic=protcompan&grou-p=programs&subgroup=proloc)进行亚细胞定位预测;利用MEGA5.0软件构建蛋白系统进化树。
-
总RNA的提取及cDNA反转录同上,引物详见表1。以cDNA为模板,LgACT为内参基因,在LightCycler480 II上按照罗氏公司的SG Fast qPCR Master Mix(2×)(B639271)说明书进行qRT-PCR反应。反应体系为:SybrGreen qPCR Master Mix(2×)10 μL,上、下游引物(10 μmol·L−1)各0.4 μL,ddH20 7.2 μL,cDNA模板2 μL,总体系共20.0 μL。反应条件为:95℃预变性90 s,95℃变性5 s,60℃退火15 s,72℃延伸20 s,40个循环。所有样品反应设3次技术重复。
利用2−ΔΔCT法计算基因的表达量。采用Excel2010和SPSS16.0进行数据整理及绘图。
-
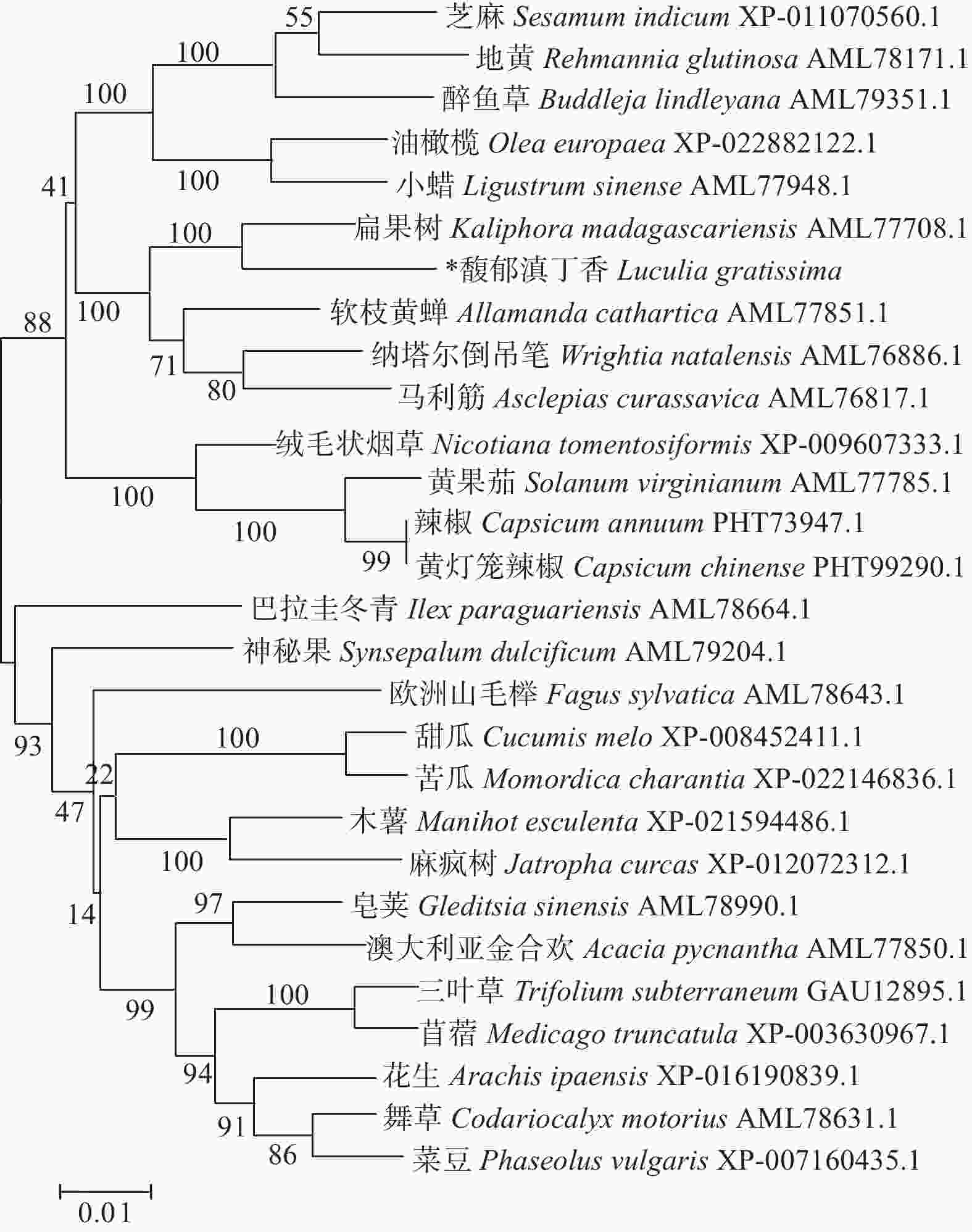
将转录组获得的LgFKF1核心序列与克隆的5xRACE序列、3xRACE序列(图1)比对拼接后,获得LgFKF1的cDNA全长序列。利用DNAMAN5.1软件对序列分析表明:该序列片段大小为2 271 bp,A、C、G、T碱基含量分别为26.9%、18.5%、26.1%、28.5%。经NCBI的ORF Finder软件分析,LgFKF1基因开放阅读框为1 917 bp,编码一个638个氨基酸的蛋白质(图2A)。将翻译成氨基酸的序列用BLASTp比对表明:该序列与扁果树(Kaliphora madagascariensis AML77708.1)、软枝黄蝉(Allamanda cathartica AML77851.1)、纳塔尔倒吊笔(Wrightia natalensis AML76886.1)、马利筋(Asclepias curassavica AML76817.1)的FKF1一致性较高,达92.59%(图2B)。
-
在线工具ProtParam蛋白理化性分析表明:蛋白质分子式为C3101H4889N881O942S28,相对分子量为70.483 kD,等电点(pI)5.63,不稳定指数为49.94,推测属于不稳定蛋白,酸性氨基酸残基总数(Asp+Glu)为84,碱性氨基酸残基总数(Arg+Lys)为69,平均亲水系数(GRAVY)为−0.294,脂肪系数为83.97。
LgFKF1蛋白通过软件SOPMA分析二级结构组成表明:二级结构由45.92%的无规则卷曲结构、24.29%的α螺旋结构、23.04%的扩展长链和6.74%的β-转角构成(图3A);软件SWISS-MODEL蛋白的三维预测建模发现:三级结构由α螺旋、扩展长链和无规则卷曲构成(图3B),与二级结构预测的结果基本一致。SignalP4.1 Server预测表明:不存在信号肽。PROTTER预测表明:无跨膜结构区(图3C),说明该蛋白属于非分泌蛋白,在细胞质中合成后不被转运;软件ProtScale预测蛋白亲/疏水性结果表明:蛋白亲水性氨基酸均占65%,疏水性氨基酸均占35%(图4),由此说明,亲水区域分布面积较广,所占比例较高;疏水区域分布面积较少,所占的比例较低,因此,推测LgFKF1蛋白为亲水性蛋白。在线软件ProtComp9.0预测亚细胞定位在细胞核中的可能性最大,为9.92。蛋白系统进化分析(图5)表明:LgFKF1蛋白与扁果树(Kaliphora madagascariensis AML77708.1)亲缘关系最近,软枝黄蝉(Allamanda cathartica AML77851.1)、纳塔尔倒吊笔(Wrightia natalensis AML76886.1)、马利筋(Asclepias curassavica AML76817.1)次之,与舞草(Codariocalyx motorius AML78631.1)、菜豆(Phaseolus vulgaris XP-007160435.1)最远。
-
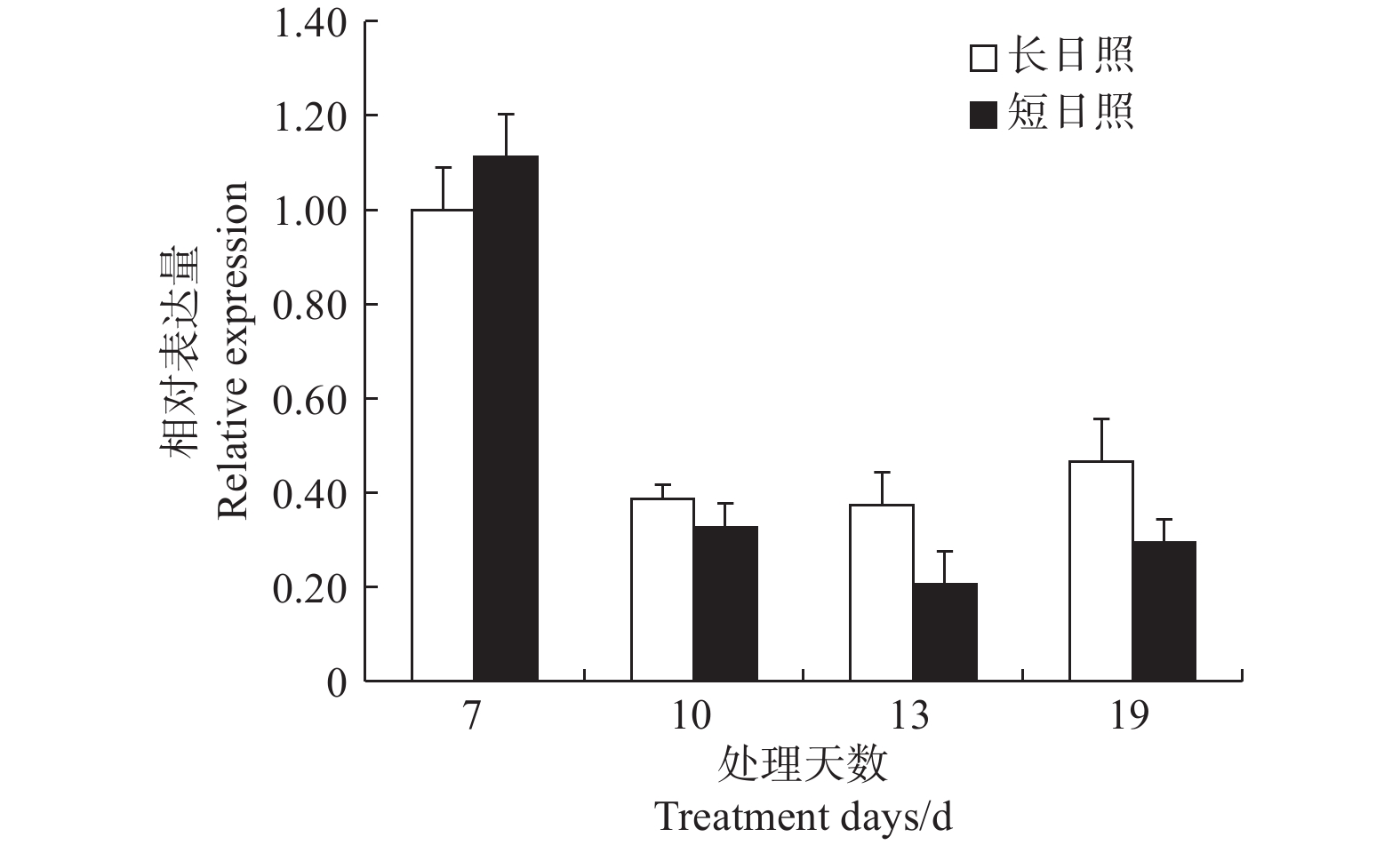
在短日照诱导光周期处理7 d时,LgFKF1较长日照非诱导光周期的表达量高,之后,在处理10、13、19 d的表达量均低于长日照的表达量,并且在成花形态发生明显转变时(即花序原基分化期,短日照处理13 d)表达量达最低(图6)。由此说明,LgFKF1在成花转变状态下呈下调表达,这与转录组测序的结果一致。
-
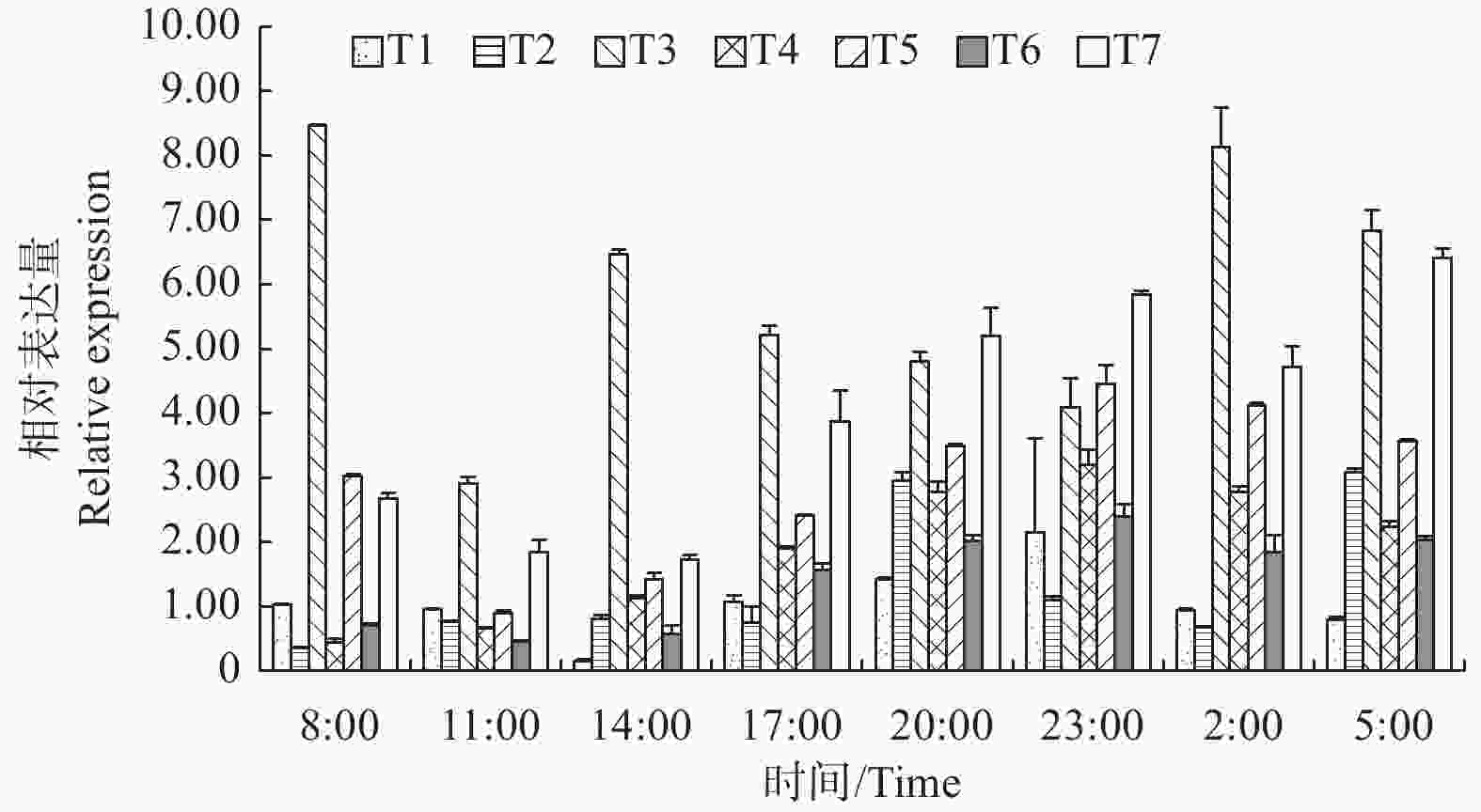
一天24 h中,LgFKF1基因在各组织中的表达分析(图7)表明:在根中,14:00为一天中表达量最低点,之后逐渐升高,并于23:00达到最高峰,随后又波动降低;在茎中,8:00为一天中表达量最低点,随后逐渐升高,并于20:00达到第1个高峰后又逐渐降低直至2:00,之后又开始升高,并于5:00达到与第一个峰值相当的第2个高峰,随后又降低进入下一轮循环;在叶中,8:00 为一天中表达最高峰,11:00为一天中表达的最低峰,之后在14:00回升后又逐渐降低直至23:00,随后又在2:00升高达到第二个高峰后再次降低进入下一轮循环;在顶芽中,8:00为一天中表达最低点,之后逐渐升高,直至23:00达到最高峰,随后逐渐降低进入下轮循环;在着色期和露白期花蕾中,表达规律基本一致,即11:00为一天中表达最低点,之后逐渐升高,直至23:00达到一天中最高峰后又逐渐降低进入下轮循环;在开放花朵中,14:00为表达最低点,之后逐渐升高,直至23:00后小幅度降低后又在5:00升高到一天中的最高峰,随后降低进入下轮循环。总体看,LgFKF1一天24 h内在各组织中在20:00—5:00期间的表达量较高,而在11:00—14:00期间的表达量较低。从各组织的平均表达情况看,平均表达量由高到低的顺序依次为:叶>开放花朵>着色期花蕾>顶芽>露白期花蕾>茎>根。
-
本研究中,同源性比对结果显示,LgFKF1与扁果树、软枝黄蝉、纳塔尔倒吊笔、马利筋的FKF1具有较高的同源性,而与研究成熟的拟南芥、水稻等草本模式植物的FKF1比对则没有达到较高的同源性。然而,与LgFKF1同源性较高的这些物种的FKF1生物学功能研究目前未见报道。因此,推测LgFKF1由于序列结构有别于草本模式植物,其功能也可能与草本模式植物存在差异。另外,生物信息学分析表明,LgFKF1蛋白具有不含信号肽,无跨膜结构,属于非分泌型亲水蛋白,亚细胞预测定位在细胞核,符合拟南芥[14]、大豆[10]FKF1蛋白的特征,满足FKF1基因发挥转录调控作用的要求。
在拟南芥中,AtFKF1在长日照下促进开花,短日照下开花表型不明显[4-5];而大豆GmFKF1转基因植株在长日照下大部分稍微晚花,而过表达植株在短日照下有50%以上表现为极早花[10]。在本研究中,相对于非诱导光周期,LgFKF1在诱导光周期下除了在较短时间处理上上调表达外,随处理时间延长均下调表达。由此暗示,馥郁滇丁香LgFKF1在成花状态下处于下调表达,其功能可能与拟南芥、大豆的FKF1有所不同,值得进一步进行功能验证。
不同植物的FKF1同源基因节律表达规律不尽相同。在拟南芥中,AtFKF1在长日照下表达峰值出现在早上10:00,在短日照下表达峰值出现在早上7:00[15];大豆GmFKF1的表达在短日照下仅在早上10:00达到峰值,在长日照下仅在早上12:00达到峰值[10];短日照洋葱(Allium cepa)品种中,AcFKF1在长日照和短日照下的表达都出现在早上7:00—8:00[16]。研究表明,FKF1在许多组织中均有表达,而以叶片中的表达量最高[17]。本研究中,LgFKF1除叶片中在早上8:00的表达峰值出现在白昼中,其余各组织中的表达峰值均出现在夜间,并且一些组织中还出现表达双峰值,这与报道的草本植物存在差异。由此推测,馥郁滇丁香LgFKF1基因在成花调控中可能具有特异的生物学功能。
-
从馥郁滇丁香中克隆获得了FKF1同源基因LgFKF1,该基因编码长度为638 aa的蛋白质,具有不含信号肽、无跨膜结构、属于非分泌型亲水蛋白以及亚细胞预测定位在细胞核等特征。随诱导光周期处理时间延长,LgFKF1相对于非诱导光周期呈下调表达;在诱导光周期下,根、芽及花蕾中出现单峰表达,而茎、叶及开放的花朵中出现双峰表达;除早上8:00叶片中的表达峰值出现在白昼,其余各组织中的表达峰值均出现夜间;一天中,叶片中的表达量最高。本研究为LgFKF1基因生物功能的进一步研究提供参考依据。
馥郁滇丁香LgFKF1基因的克隆及节律表达分析
Cloning and Rhythmic Expression Analysis of LgFKF1 Gene in Luculia gratissima
-
摘要:
目的 研究馥郁滇丁香LgFKF1基因的结构特点及其在特异组织中的节律表达特征,探索其在成花调控过程中的作用。 方法 采用RACE技术克隆获得馥郁滇丁香LgFKF1基因的cDNA全长序列,利用生物信息学方法对获得的基因核苷酸序列及编码蛋白质序列进行分析,利用qRT-PCR技术对特异组织的节律表达模式进行分析。 结果 序列分析表明:LgFKF1基因cDNA全长为2 271 bp,开放阅读框为1 917 bp,编码一个638个氨基酸的蛋白质;推导的氨基酸序列与扁果树、软枝黄蝉、纳塔尔倒吊笔、马利筋的FKF1蛋白具有较高同源性,达92.59%;预测LgFKF1蛋白属于不稳定的亲水性蛋白,定位在细胞核,无信号肽和跨膜区;结构主要由无规则卷曲结构、α螺旋结构、扩展长链和β-转角构成;遗传进化关系与扁果树最亲近。qRT-PCR分析表明:LgFKF1在诱导光周期下处理7 d时较非诱导光周期下的表达量高,而诱导光周期下处理10 d后其表达量则低于非诱导光周期的表达。一天中,LgFKF1在各组织中均有表达,且以叶片中的相对表达量较高。LgFKF1因组织不同在不同的时间呈现出单峰和双峰表达,其中,根、芽及花蕾中均在夜间23:00出现单峰表达;茎、叶及开放的花朵中在不同时间出现双峰表达,茎在晚上20:00和凌晨5:00,叶在凌晨2:00和早上8:00,开放花朵在夜间23:00和凌晨5:00。 结论 从馥郁滇丁香中克隆获得了LgFKF1基因,其编码的蛋白序列与其它植物的FKF1具有较高的同源性。LgFKF1基因的表达受光周期影响,在诱导光周期下,不同的组织呈现出不同的表达模式,其中,仅叶片中的1个表达峰值出现在白昼,其余组织中的表达峰值均出现在夜间。在各组织中,叶片中的表达量较高。LgFKF1基因的特异组织节律表达有助于为其生物学功能的进一步研究提供参考依据。 Abstract:Objective To study the regulatory role of LgFKF1 gene during flowering process of L.gratissima, based on the analysis of its gene structural characteristics and rhythmic expression in specific tissues. Method The RACE technology was used to clone the full length cDNA of LgFKF1 gene. Sequence of nucleotides and code of protein were analyzed by using the software of bioinformatics. qRT-PCR was applied in the rhythmic expression analysis of the gene in specific tissues. Result The result of sequence analysis showed that the LgFKF1 cDNA, 2 271 bp in length, has a 1 917 bp open reading frame encoding a putative protein with 638 amino acids. The results of sequence alignment showed that the amino acids sequence was highly homologous with the FKF1 of Kaliphora madagascariensis, Allamanda cathartica, Wrightia natalensis and Asclepias curassavica, with the homology of 92.59%. LgFKF1 protein that had the closest genetic relationship with K. madagascariensis was unstable hydrophilic proteins without signal peptide and transmembrane regions, and located in the nucleus, mainly consisted of alpha helix, irregular curling structure and extended long chain. The result of qRT-PCR showed that the expression of LgFKF1 under inductive photoperiod for 7 days was higher than that under non-inductive photoperiod treatment,but the expression was lower than that under non-inductive photoperiod treatment if inductive photoperiod was more than 10 days. In a day, LgFKF1 expressed in various tissues,and showed a high transcription level in leaf. For the rhythmic expression of LgFKF1 in different tissues, one peak value was appeared at 23: 00 in root, leaf bud and flower bud, and two peak values were appeared at 20: 00 and 5: 00 in stem, 2: 00 and 8: 00 in leaf, 23: 00 and 5: 00 in mature flower. Conclusion LgFKF1 was cloned from L.gratissima, and its putative protein sequence was highly homologous with the FKF1 of other plants. The expression of LgFKF1 gene was affected by photoperiod.Under the inductive photoperiod, various tissues showed itself expression pattern. A peak value of LgFKF1 expression in leaf was only appeared at 8: 00 during the daytime,and the peak values in other tissues were occurred during the night. In these tissues, LgFKF1 showed higher transcription level in leaf. The rhythmic expression of LgFKF1 in specific tissues might be helpful to provides some references for further study on its biological function. -
Key words:
- Luculia gratissima
- / LgFKF1 gene
- / cloning
- / rhythmic expression
-
表 1 LgFKF1克隆及qRT-PCR的引物
Table 1. Primers for LgFKF1 cloning and qRT-PCR
引 物primer 序 列
sequence5’adaptor GCTGTCAACGATACGCTACGTAACGGCATGACAGTGCCCCCCCCCCCCCCC 3’adaptor GCTGTCAACGATACGCTACGTAACGGCATGACAGTGTTTTTTTTTTTTTTTTTT 5-3’outer GCTGTCAACGATACGCTACGTAAC 5-3’inner GCTACGTAACGGCATGACAGTG FKF1-F1 TACATGAGCTATGCTTAGCCAGCAGACAG FKF1-F2 ACAGCTTAAAGCCACGCTACGTCTTCAA FKF1-R1 GCTCCAAAGCATCCGATACCACGA FKF1-R2 GCGTCGTAATGGGATACAAGAATTTCTCA FKF1-RT1 GTAAACTGGATATGACGCAC FKF1-RT2 TGTATCCCAATTATGTGTGTA Actin F CATAGTTGAACCACCACTGAGC Actin R TGCCCGATGGACAAGTTATT FKF1 F CGTGGTATCGGATGCTTTG FKF1 R CTGAGCACGAGGGTCTCTAAAT -
[1] Lu S X, Webb C J, Knowles S M, et al. CCA1 and ELF3 interact in the control of hypocotyl length and flowering time in Arabidopsis[J]. Plant Physiology, 2012, 158(2): 1079-1088. doi: 10.1104/pp.111.189670 [2] 刘锴栋, 袁长春, 黎海利, 等. 番荔枝节律钟输出基因 AsGI 的克隆、亚细胞定位与表达分析[J]. 园艺学报, 2015, 42(12):2395-2404. [3] Hayama R, Coupland G. The Molecular basis of diversity in the photoperiodic flowering responses of Arabidopsis and rice[J]. Plant Physiology, 2004, 135(2): 677-684. doi: 10.1104/pp.104.042614 [4] Imaizumi T, Schultz T F, Harmon F G, et al. FKF1 F-box protein mediates cyclic degradation of a repressor of CONSTANS in Arabidopsis[J]. Science, 2005, 309(5732): 293-297. doi: 10.1126/science.1110586 [5] Nelson D C, Lasswell J, Rogg L E, et al. FKF1, a clock-controlled gene that regulates the transition to flowering in Arabidopsis[J]. Cell, 2000, 101(3): 331-340. doi: 10.1016/S0092-8674(00)80842-9 [6] Lee C M, Feke A, Li M W, et al. Decoys untangle complicated redundancy and reveal targets of circadian clock F-Box proteins[J]. Plant Physiology, 2018, 177(3): 1170-1186. doi: 10.1104/pp.18.00331 [7] Sawa M, Nusinow D A, Kay S A, et al. FKF1 and GIGANTEA complex formation is required for day-length measurement in Arabidopsis[J]. Science, 2007, 318(5848): 261-265. doi: 10.1126/science.1146994 [8] Song Y H, Smith R W, To B J, et al. FKF1 conveys timing information for CONSTANS stabilization in photoperiodic flowering[J]. Science, 2012, 336(6084): 1045-1049. doi: 10.1126/science.1219644 [9] Song Y H, Estrada D A, Johnson R S, et al. Distinct roles of FKF1, GIGANTEA, and ZEITLUPE proteins in the regulation of CONSTANS stability in Arabidopsis photoperiodic flowering[J]. Proceedings of the National Academy of Sciences, 2014, 111(49): 17672-17677. doi: 10.1073/pnas.1415375111 [10] Li F, Zhang X, Hu R, et al. Identification and molecular characterization of FKF1 and GI homologous genes in soybean[J]. PLoS One, 2013, 8(11): e79036. doi: 10.1371/journal.pone.0079036 [11] Han S H, Yoo S C, Lee B D, et al. Rice FLAVIN-BINDING, KELCH REPEAT, F-BOX 1(OsFKF1) promotes flowering independent of photoperiod[J]. Plant, Cell & Environment, 2015, 38(12): 2527-2540. [12] 万友名, 马 宏, 赵振刚, 等. 不同光周期下馥郁滇丁香‘香妃’的成花反应以及花芽分化进程的解剖学研究[J]. 西北植物学报, 2018, 38(9):1659-1666. [13] 万友名, 马 宏, 刘秀贤, 等. 馥郁滇丁香新品种‘香妃’[J]. 园艺学报, 2018, 45(11):2271-2272. [14] Takase T, Nishiyama Y, Tanihigashi H, et al. LOV KELCH PROTEIN2 and ZEITLUPE repress Arabidopsis photoperiodic flowering under non-inductive conditions, dependent on FLAVIN-BINDING KELCH REPEAT F-BOX1[J]. The Plant Journal, 2011, 67(4): 14. [15] Imaizumi T, Tran H G, Swartz T E, et al. FKF1 is essential for photoperiodic-specific light signalling in Arabidopsis[J]. Nature, 2003, 426(6964): 302-306. doi: 10.1038/nature02090 [16] Taylor A, Massiah A J, Thomas B. Conservation of Arabidopsis thaliana photoperiodic flowering time genes in onion (Allium cepa L.)[J]. Plant and Cell Physiology, 2010, 51(10): 1638-1647. doi: 10.1093/pcp/pcq120 [17] 李芳. 大豆FKF1和GI基因克隆、表达模式及功能分析[D]. 北京: 中国农业科学研究院, 2012: 11, 61. -




 下载:
下载: