-
干旱是一种复杂的水文和气候灾害,具有持续时间长和破坏力强等特点,全球性干旱问题日趋严重,这致使森林的分布、结构、群落组成及生态多样性不断改变,也对各国林业发展造成严重影响[1-3]。我国干旱、半干旱地区面积不断增加,人工造林成活率仅为4%~30%[4-5]。杨树(Populus L.)作为我国北方地区传统的防风造林速生树种,又是可再生生物能源植物[6],在防风固沙、涵养水源、木材供应等方面起着重要作用。因此,探究杨树响应干旱胁迫的生理和分子机制,对林木的抗逆遗传改良具有重要的意义。
胁迫条件下,植物能够做出形态调节以及生理生化等方面相应的防御机制[7]。有研究表明,逆境胁迫下,谷氨酸(Glutamate)可通过参与改变植物体内某些生理代谢(如:碳、氮代谢),或调节相关基因表达和关键酶活性等方式来增强植物对各种逆境的适应性,从而有利于植物在逆境中的生长[8-10]。谷氨酸(也称α-氨基戊二酸)是一种普遍存在的氨基酸,在氨基酸代谢过程中发挥着重要的作用,尤其是参与合成多种前体物质和植物抗逆相关的蛋白或非蛋白氨基酸,如鸟氨酸(Ornithine)、脯氨酸(Proline)、精氨酸(Arginine)、谷胱甘肽(Glutathione,GSH)、γ-氨基丁酸(γ-aminobutyric acid,GABA)等[11]。谷氨酸还可以作为代谢产物、产生能量的底物、营养物质以及蛋白质结构的决定因素,甚至作为信号分子参与各种生物学反应[12]。Chang等对黄瓜(Cucumis sativus L.)研究发现,外源L-谷氨酸可能通过调节乙烯合成机制来缓解盐胁迫对黄瓜种子发芽率的抑制作用[13]。研究表明,紫花苜蓿短时间低浓度盐胁迫下谷氨酸含量会增加,长时间高浓度盐胁迫下含量则会降低;而铝胁迫下的植物可以分泌谷氨酸到根际,并与游离状态的铝形成稳定的化合物从而缓解铝毒害[14-15]。施燕华等发现,外源谷氨酸对铝胁迫下多花黑麦草(Lolium multiforum Lam.)幼苗叶片叶绿素含量、株高和根系的伸长均有一定的缓解作用[16]。Toyota等人发现,谷氨酸可作为一种信号分子诱导植物产生防御反应。对受伤的拟南芥外源施用谷氨酸,在伤口处发现了谷氨酸的显著积累,并伴随着钙离子信号的显著增加,这表明谷氨酸可以通过影响细胞质游离钙离子浓度([Ca2 + ]cyt)在细胞、组织、器官甚至整个植物之间进行信号传递[17-18]。也有研究表明,谷氨酸处理增加玉米种子发芽率,介导Ca2 + 信号的增加提高耐热性[19]。这为研究外源施加谷氨酸增强植物抗逆性提供了基础。
杨树作为我国速生人工树种,其生长发育长期受到各种胁迫的制约,因此,了解谷氨酸在杨树干旱胁迫下的作用以及对如何提高杨树抗逆性具有重要意义。本研究以银腺杨84K(Populus alba × P. glandulosa ‘84K’)为研究材料,研究添加外源谷氨酸对干旱胁迫下杨树的生长性能和生理指标的变化,测量脯氨酸含量、活性氧积累、抗氧化酶活性等,为揭示谷氨酸在干旱胁迫中对木本植物的缓解作用提供理论依据。
-
银腺杨84K(以下简称“84K杨”)为本研究团队保存,选用380 mL组培瓶培养。组培苗茎尖(3 cm)转入生根培养基,在光照培养室中生长1个月,株高约10 cm。培养条件为:光照16 h/黑暗8 h,温度25 ℃,光照强度12 000 Lux。选择长势良好,生长1个月的组培苗转移至装有营养土的育苗盆(10 cm × 10 cm × 8 cm)中土培1个月,株高约35 cm。培养条件为:光照16 h/黑暗8 h,温度23~25 ℃,光照强度 50 μmol·m−2·s−1。
-
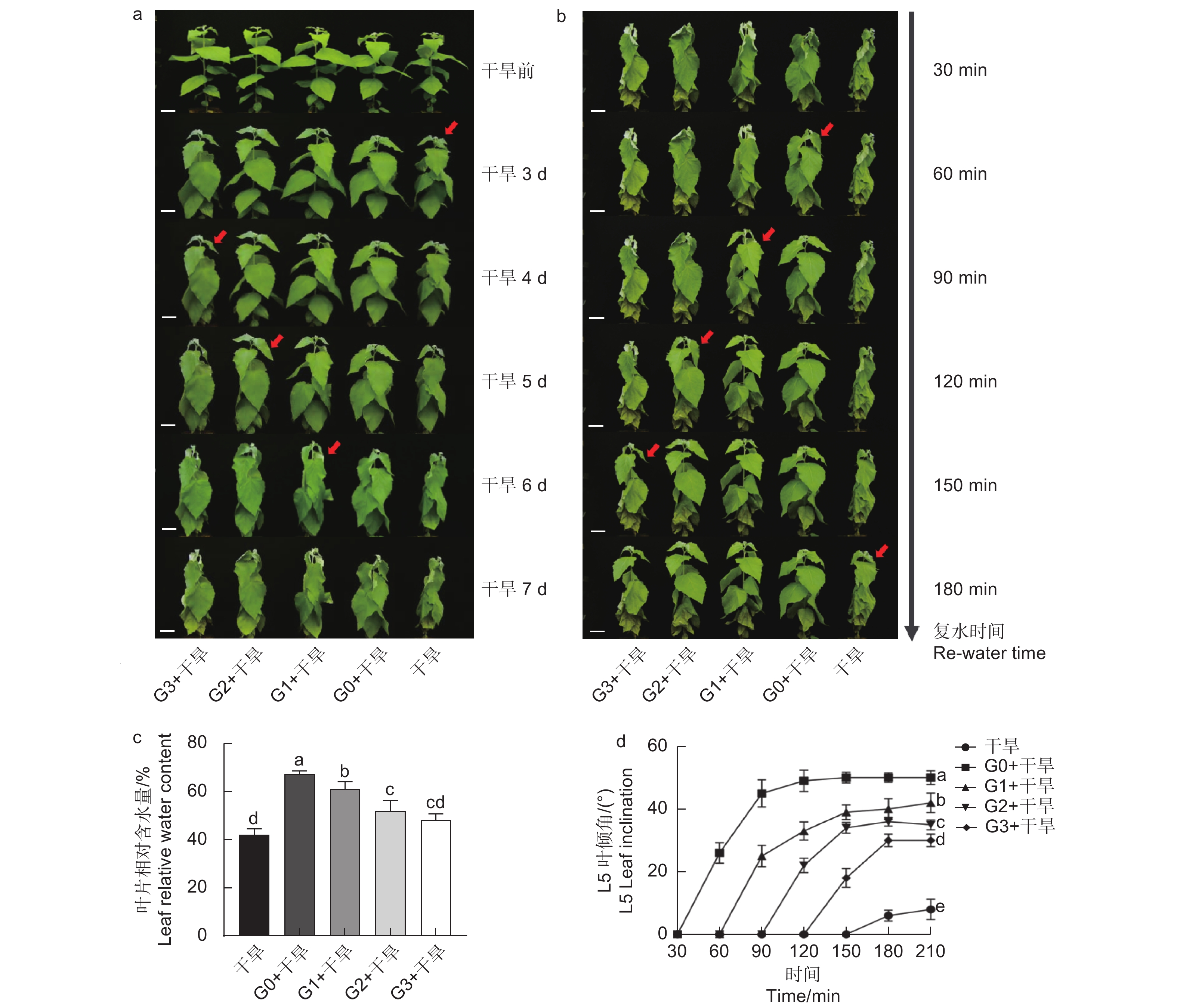
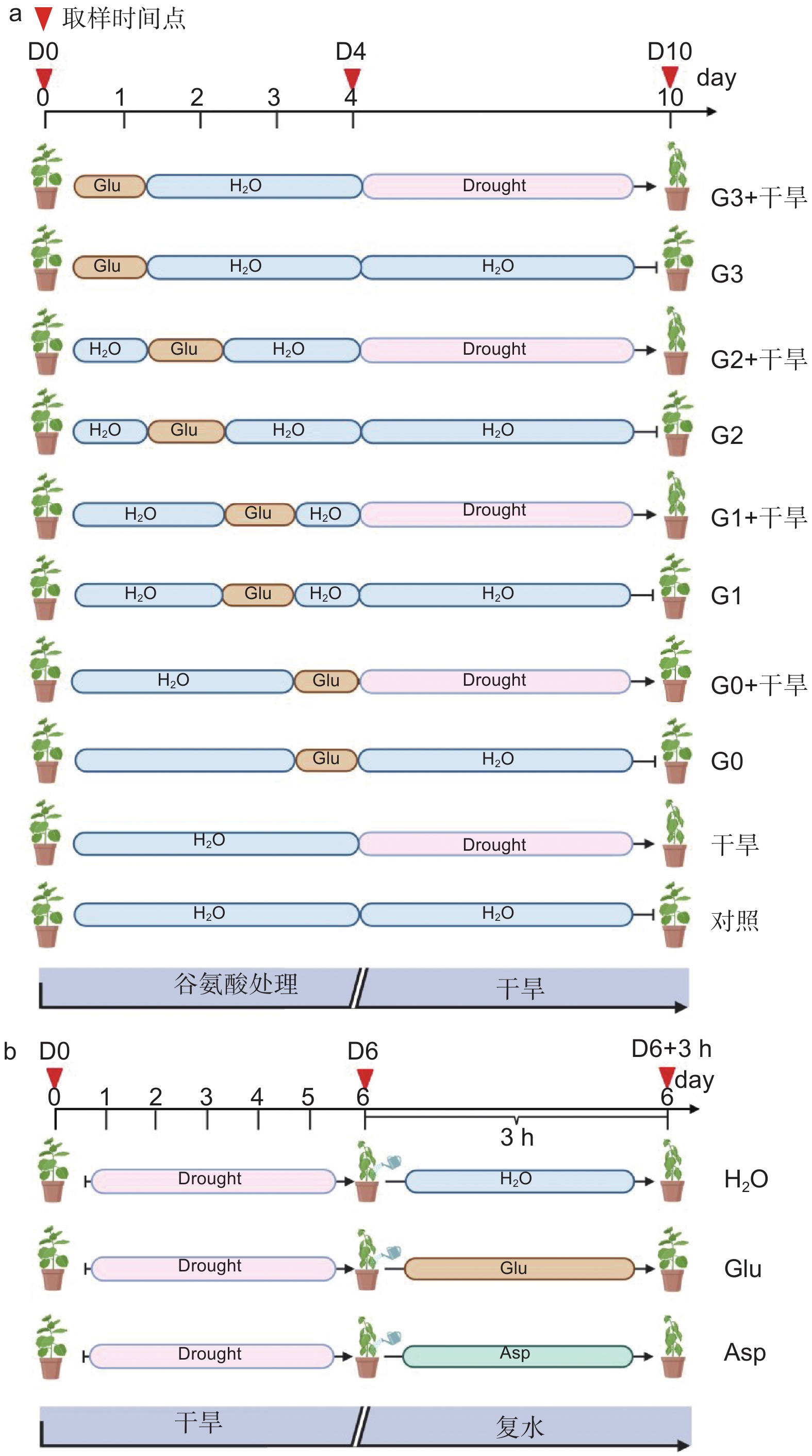
确定外源谷氨酸最优施加时间。以生长2个月的84K杨为材料,在84K杨干旱胁迫前0、1、2和3 d 进行外源L-谷氨酸根系浇灌50 mL(10 mmol·L−1)[20-21],并设置不加谷氨酸对照组。处理分别记为:G0、G1、G2、G3和对照。在此基础上将其分为两组:一组正常浇水,维持土壤含水量为75%;另一组施加谷氨酸后干旱,分别为施加谷氨酸后进行干旱(G0 + 干旱)、施加谷氨酸1 d后进行干旱(G1 + 干旱)、施加谷氨酸2 d后进行干旱(G2 + 干旱)、施加谷氨酸3 d后进行干旱(G3 + 干旱)和正常浇水后进行干旱(干旱)。自然干旱6 d(土壤含水量降至约25%),每个处理设6个生物学重复、3次试验重复,处理期间观察叶片表型,确定谷氨酸最优施加时间(图1a)。
经上述试验分析确定谷氨酸最优施加时间为0 d,随后对84K杨干旱胁迫前0 d浇灌谷氨酸并进行生理指标的测定。试验包括4个处理:正常浇水(对照)、正常浇水后进行干旱(干旱)、施加谷氨酸后正常浇水(谷氨酸)和施加谷氨酸后进行干旱(谷氨酸 + 干旱),每个处理设8个生物学重复,试验重复3次,分别在未处理(试验开始:D0)、谷氨酸处理后开始干旱(试验第4天:D4)和谷氨酸处理后干旱胁迫6 d(试验第10天:D10)3个时间点取样,具体试验处理详见图1a。
-
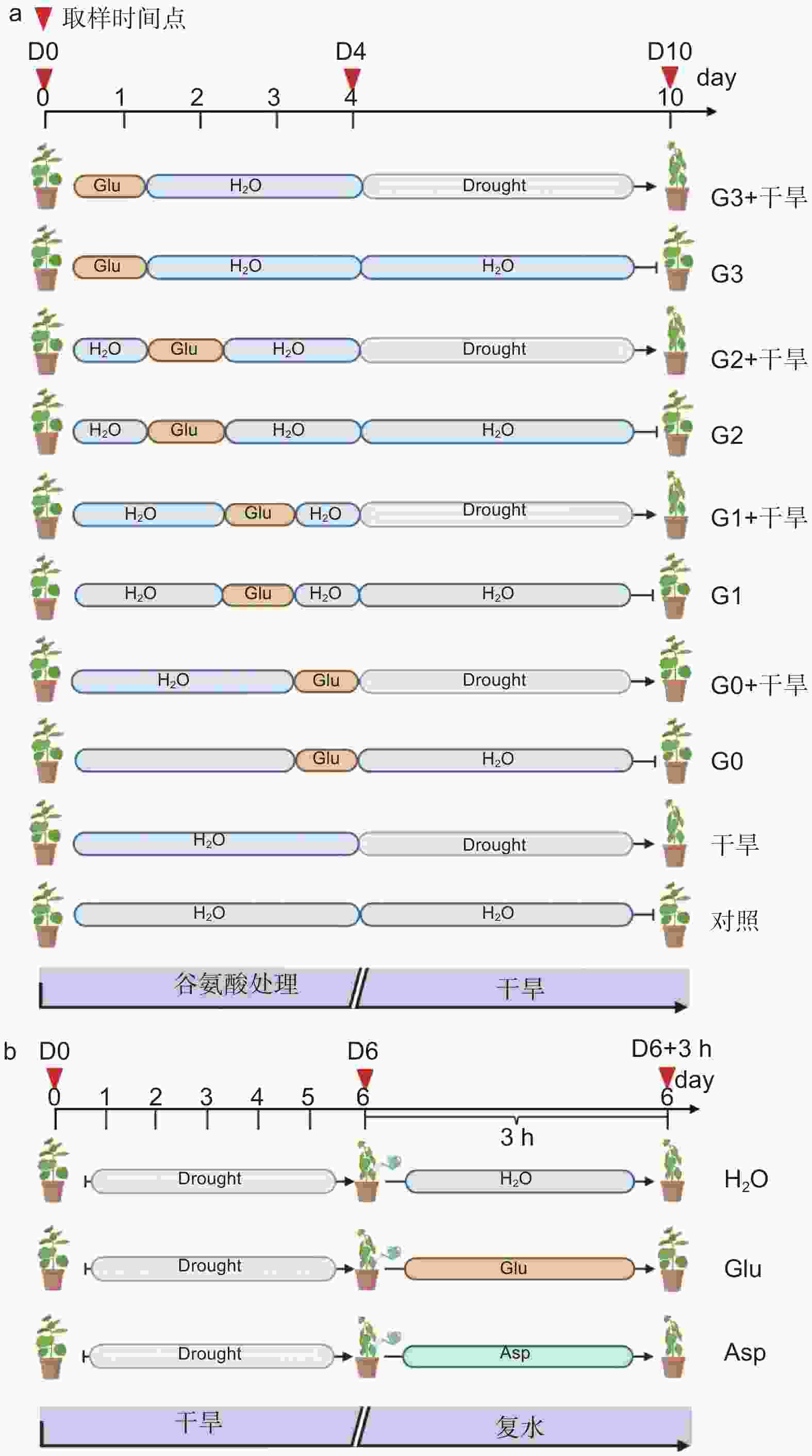
以生长2个月的84K杨为材料,自然干旱6 d(土壤含水量降至25%)后分别浇灌50 mL水(H2O)、10 mmol·L−1 L-谷氨酸溶液(Glu)以及10 mmol·L−1 L-天冬氨酸溶液(Asp),观察复水情况。分别在未处理(试验开始:D0)、干旱胁迫6 d(试验第6天:D6)及复水恢复培养3 h(D6 + 3 h)3个时间点取样,测定相应的生理指标,具体试验处理详见图1b。
-
对84K杨脯氨酸合成和降解相关基因在谷氨酸处理的不同时间进行实时荧光定量PCR分析。取正常生长以及不同处理后84K杨的第5和第6片叶片,提取RNA进行反转录,使用Vazyme ChamQ SYBR qPCR Master Mix(货号:Q311-02)按照说明书试验,使用2−△△CT计算表达量,内参基因为Actin,每个处理设4个生物学重复、3次试验重复。
-
取正常生长以及不同处理后84K杨的第8片叶片(L8)测定相对含水量(RWC)。取下叶片后立即称取鲜质量(记为FW),室温把叶片完全浸没于水中放置24 h,用滤纸擦干表面水分称量叶片饱和鲜质量(记为TW)。再将叶片装至信封放至75 ℃烘箱干燥至恒质量并称量(记为DW)。 RWC=(FW−DW)/(TW−DW) × 100%。
-
对正常生长以及不同处理后84K杨的第5片功能叶(L5)进行叶倾角的测量。植株保持垂直地面状态,选取L5叶面积最小的角度,在植株前60 cm处固定位置,用延时摄像机(ATLI,T100 TS)每隔30 min进行拍照。使用Image J软件,连接叶片基部与叶尖,利用量角器测量与主茎干之间的夹角[20]。每个处理设3个生物学重复、3次试验重复。
-
取正常生长以及不同处理后84K杨的第7片叶片测定电解质渗透率(ε)。用去离子水清洗叶片,滤纸吸干表面水分,主叶脉两端用6 mm打孔器各打5个小圆片,镊子夹取放入装有2 mL去离子水的10 mL离心管中,完全浸泡抽真空20 min后,向离心管中加入6 mL去离子水,25 ℃ 200 rpm摇床中振荡1 h,电导率仪测电导率(记为S1),将离心管封口放入沸水浴中水浴15 min,待溶液冷却至室温后,测不同处理电导率(记为S2)。电解质渗率计算公式: ε =(S1 / S2) × 100%。
-
取正常生长以及不同处理后84K杨的第4片叶片测定叶片失水率(γ)。取不同处理叶片立即称取鲜质量(FW),室温放置,每隔0.5 h称量1次,记为Wd,总时间为4 h。最后将叶片放置75 ℃烘箱里烘干至恒质量,称其干质量(DW)。叶片失水率测定公式: γ =(FW − Wd)/(FW − DW) × 100%。
-
取正常生长以及不同处理后84K杨的第5和第6片叶片测定谷氨酸的含量。选用谷氨酸含量检测试剂盒(北京索莱宝,BC1580),谷氨酸脱氢酶(GDH)催化谷氨酸和烟酰胺腺嘌呤二核苷酸(NAD)生成α-酮戊二酸、NADH和NH4+会引起340 nm处吸光度的上升,通过测定5 min内340 nm吸光度的变化,计算谷氨酸含量(CG)。以CG /(μmol·mL−1)为x轴,5 min内样品增加的吸光值ΔA为y轴,绘制y = kx + b标准曲线。样品充分研磨取0.1 g(W),按照样本质量计算:CG /(µmol·g−1)= x × V样总 / W,式中x表示以每mL为单位的谷氨酸含量,V样总表示加入提取液体积1 mL。
-
取正常生长以及不同处理后84K杨的第5和第6片叶片测定脯氨酸的含量。选用脯氨酸含量检测试剂盒(北京索莱宝,BC0290),依据加热处理后脯氨酸与酸性茚三酮溶液反应生成红色,在520 nm处有吸收峰测定脯氨酸含量(CP)。称取约0.1 g叶片组织(W),加入1 mL(V提)提取液沸水震荡提取10 min,常温离心10 min,取上清,冷却后加入酸性茚三酮溶液沸水浴保温30 min。以脯氨酸标准溶液浓度为横坐标x,∆A标准=A标准管−A空白管为纵坐标绘制标准曲线,在波长520 nm下将不同样品吸光值变化(ΔA)代入标准曲线得到x/(μg·mL−1)。按照样本质量计算:CP /(μg·g−1)= x × V提 / W。
-
取正常生长以及不同处理后84K杨的第5和第6片叶片测定过氧化氢(H2O2)和超氧阴离子(O2·−)含量,选用过氧化氢含量检测试剂盒和超氧阴离子含量检测试剂盒(北京索莱宝,BC3595,BC1295),样品液氮充分研磨后取0.1 g(W),加入1 mL(V提)提取液涡旋混匀,4 ℃离心取上清作为待测液。在离心管中按步骤加入试剂混匀,分别在波长415 nm和530 nm下测定吸光值,计算∆A标准=A标准管−A空白管,∆A样本=A测定管−A空白管。按样本质量计算H2O2含量(CH),CH/(μmol·g−1)= C标 × V提 ×(∆A样本/∆A标准) / W,式中C标为H2O2标准溶液(2 μmol·mL−1)。O2·−含量(CO)测定需以∆A标准为y轴,不同标准液浓度为x轴,绘制标准曲线y=kx + b,将∆A样本带入标准曲线得到x值,CO/(μmol·mg−1)= 2x × V提/ W。
-
取正常生长以及不同处理后84K杨的第5和第6片叶片测定过氧化氢酶CAT(BC0200)、过氧化物酶POD(BC0090)和超氧化物歧化酶SOD(BC0170)的活性,试剂均为北京索莱宝科技有限公司。样品液氮充分研磨后取0.1 g(W),加入1 mL提取液涡旋混匀,离心取上清作为待测液,按步骤加入检测工作液后立刻混匀5 s测定不同波长下吸光值。CAT活性以240 nm下每克组织在反应体系中催化1 μmol H2O2降解定义为1个酶活力单位;POD以470 nm下每克组织在每毫升反应体系中每分钟吸光值变化0.01为1个酶活力单位;SOD以560 nm下黄嘌呤氧化酶偶联反应体系中抑制百分率( Ri )为50%时,反应体系中的SOD酶活力定义为1个酶活力单位,按样本质量计算不同抗氧化酶活性:CAT/(U·g−1)=764.5 × ΔA / W,POD/(U·g−1)=7133 × ΔA / W,SOD/(U·g−1)=11.11 × [Ri /(1−Ri )]/W,ΔA=A测定−A对照,Ri =(A空白−A对照)/ A测定 × 100%。
-
采用Excel和SPSS统计软件进行数据处理和分析;样本数据采用SPSS 17.0数据处理软件进行独立样本t检验,在0.05水平上检验差异显著性,并用Excel进行数据分析、图表绘制。
-
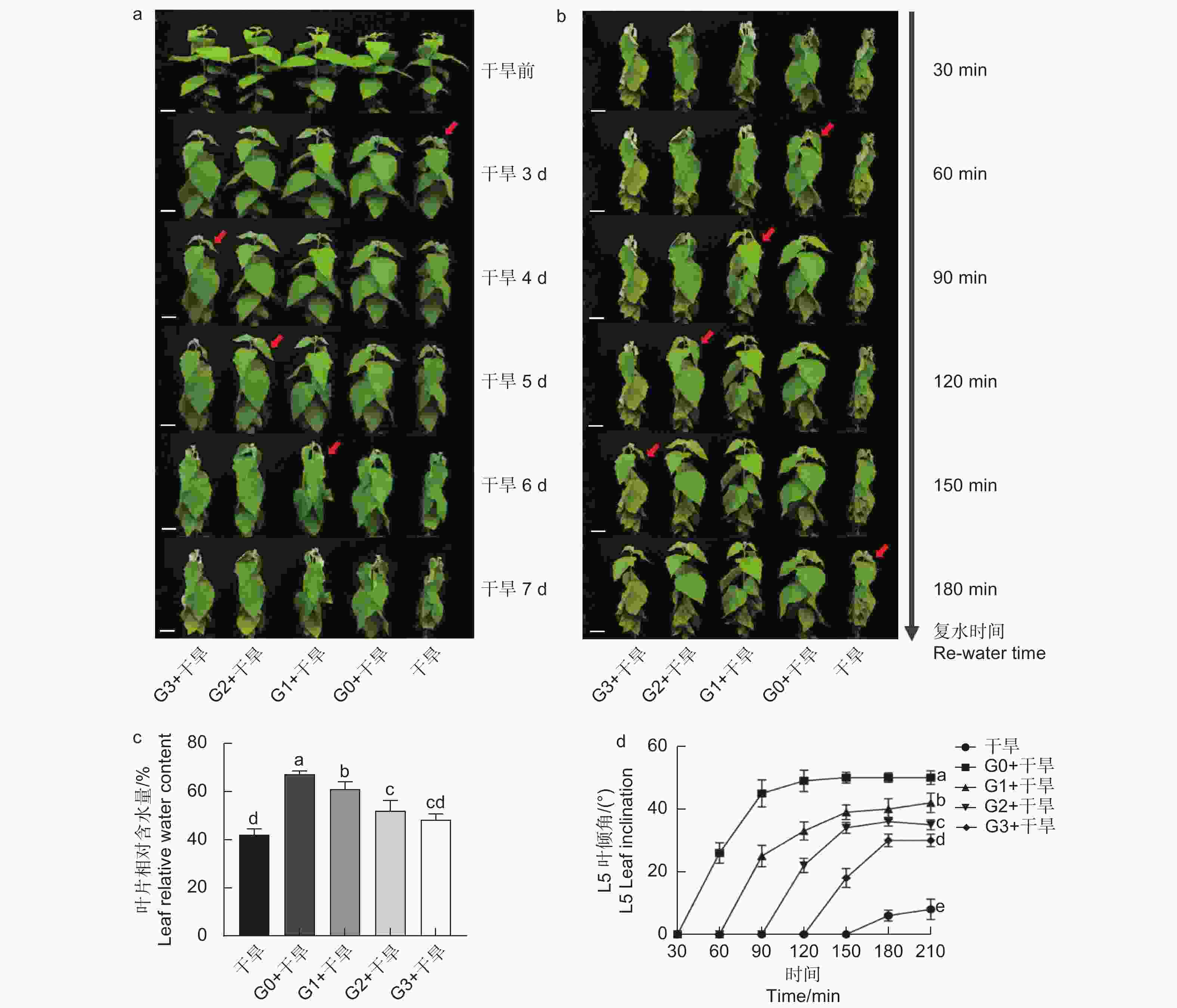
分别在干旱胁迫前0、1、2、3 d浇灌谷氨酸,观察表型及干旱6 d后的叶片相对含水量发现,干旱胁迫前0 d浇灌谷氨酸的植株干旱症状出现得更缓慢,其干旱胁迫程度由强到弱依次为干旱 < G3 + 干旱 < G2 + 干旱 < G1 + 干旱 < G0 + 干旱(图2a、c)。在干旱过程中,84K杨叶片萎蔫下垂,表现出对干旱胁迫的敏感性,但经过谷氨酸处理的植株对干旱的敏感性降低,G0 + 干旱处理植株叶片含水量比干旱植株高1.60倍,表现出较强的耐旱性(图2c)。
当所有处理出现茎尖萎蔫下垂表型时进行复水(50 mL),每30 min拍照记录。测定功能叶叶倾角发现,外施谷氨酸的植株叶片优先恢复,且恢复速度由快到慢依次为G0 + 干旱 > G1 + 干旱 > G2 + 干旱 > G3 + 干旱 > 干旱(图2b、d),表明干旱胁迫前0 d浇灌谷氨酸的84K植株复水响应能力更强。综上所述,谷氨酸处理降低了植株对干旱的敏感性,选择0 d为最优施加时间,进行后续生理指标的测定。
-
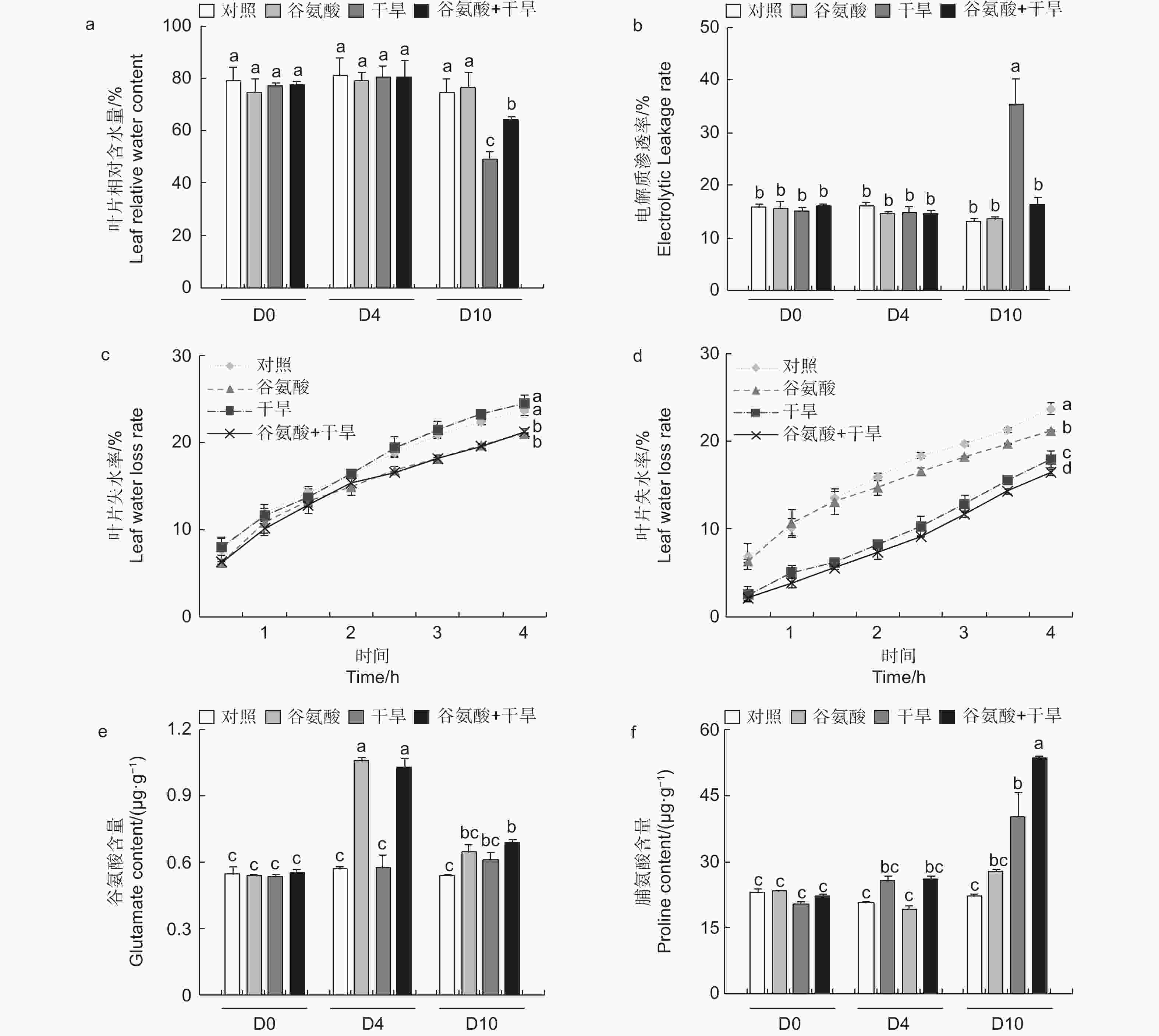
进一步检测了谷氨酸处理和对照的84K杨在干旱胁迫下4 d及10 d的生理变化。与对照相比,施加谷氨酸后(D4),植株叶片相对含水量和电解质渗透率没有明显的变化。相较于对照,干旱胁迫6 d后(D10),干旱处理84K杨叶片相对含水量降低34.2%,而谷氨酸 + 干旱处理后的植株相对含水量仅降低14.2%(图3a)。干旱胁迫6 d后,谷氨酸 + 干旱处理植株电解质渗透率显著升高,是对照84K杨的2.73倍;而谷氨酸 + 干旱处理植株电解质渗透率变化幅度较小,与对照84K杨无显著差异(图3b)。未干旱前(D4),相较于对照植株,谷氨酸处理植株叶片失水率显著降低(图3c)。植株干旱6 d后,由于干旱植株叶片已失水,干旱植株离体叶片失水率低于未干旱植株;相较于干旱植株,谷氨酸 + 干旱植株叶片失水率显著降低(图3d)。以上结果表明外施谷氨酸可以降低叶片失水率,增强保水能力,减轻干旱胁迫对细胞质膜透性的损伤,增强84K杨的耐旱性。
-
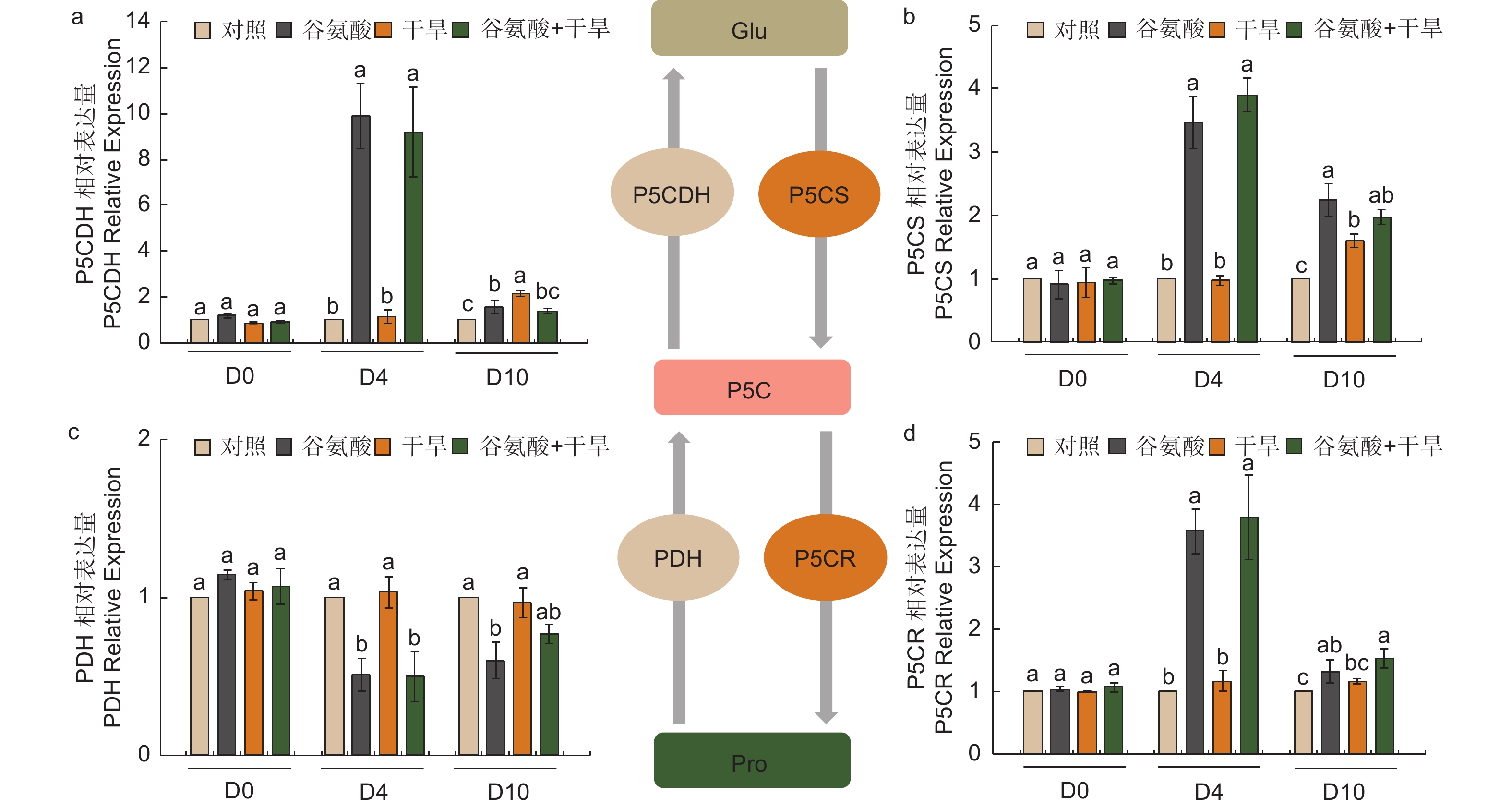
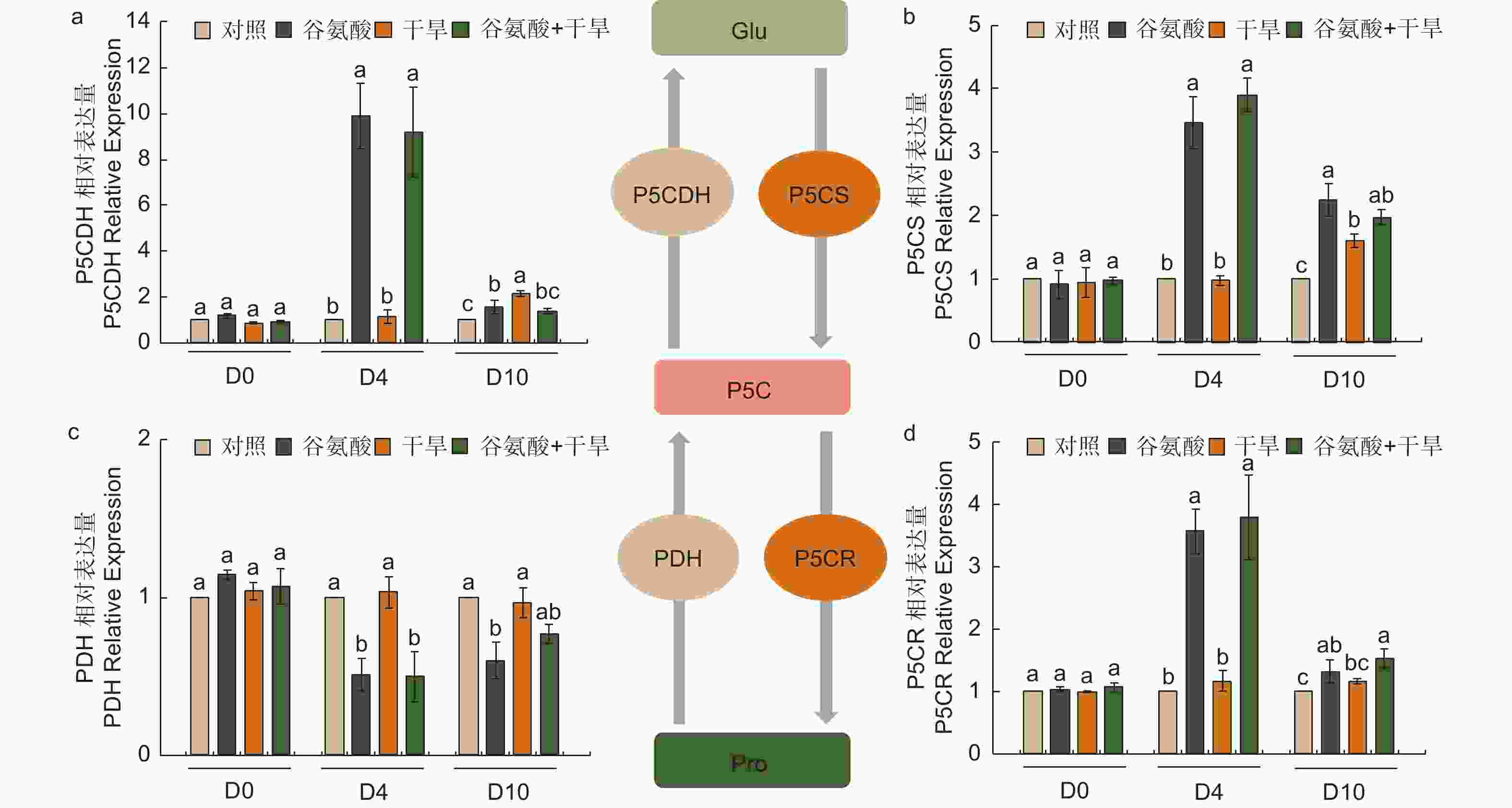
植物缺水时,植物细胞自身会合成一些渗透调节物质降低渗透势,维持细胞渗透平衡,防止细胞失水。外源施加谷氨酸后,植株叶片谷氨酸含量是对照处理的1.85倍(图3e)。施加谷氨酸后,4个处理脯氨酸含量无明显变化(图3f)。相较于谷氨酸处理后(D4),干旱胁迫6 d后(D10),谷氨酸含量增加幅度较低,但谷氨酸 + 干旱处理谷氨酸含量具有显著的增加,是对照的1.28倍。D10脯氨酸含量除对照外均有所增加,其中,谷氨酸 + 干旱处理植株脯氨酸含量最高,是对照的2.41倍,干旱处理植株的1.21倍(图3f)。施加谷氨酸后,与对照相比,脯氨酸合成相关吡咯啉-5-羧酸合酶基因(P5CS)、吡咯啉-5-羧酸还原酶基因(P5CR)和吡咯啉-5-羧酸脱氢酶基因(P5CDH)的表达显著升高,分别是对照的2.47倍、2.57倍和8.89倍,脯氨酸还原酶基因(PDH)表达量减少48.8%(图4)。干旱胁迫6 d后,与干旱处理相比,脯氨酸合成基因P5CS和P5CR在谷氨酸 + 干旱处理中表达量分别增加了23.0%和32.5%(图4b、d),脯氨酸降解基因PDH表达量降低20.4%(图4c)。上述结果表明,谷氨酸处理后增加了植株叶片谷氨酸含量,但随着植株的生长被分解代谢;在植株受到干旱胁迫时,谷氨酸作为脯氨酸合成的前体,诱导脯氨酸的合成和积累,提高渗透调节能力,降低植株对干旱的敏感性。
-
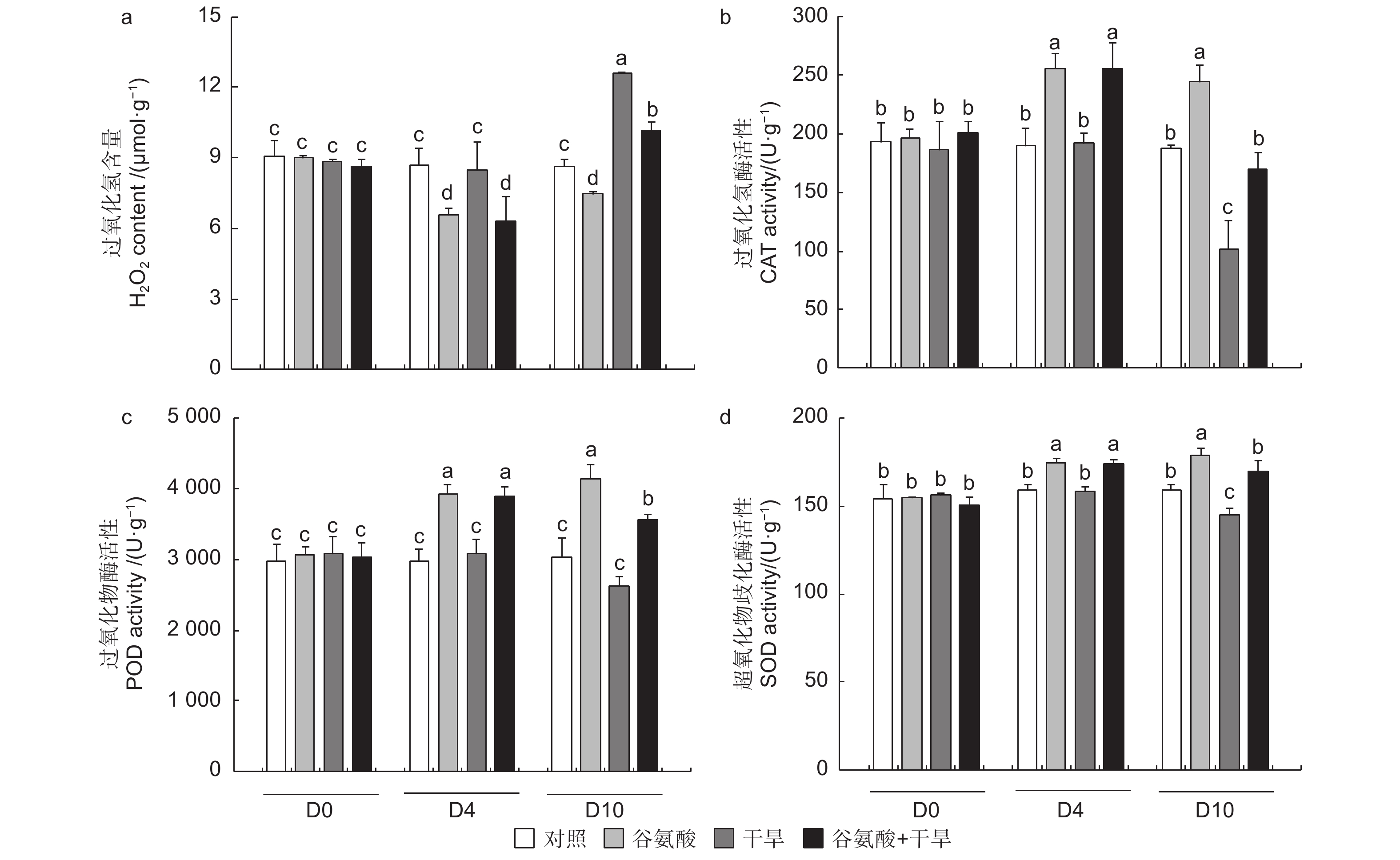
活性氧作为植物细胞代谢的副产物,在植物受到胁迫后大量增加,可对细胞产生氧化伤害。为探究谷氨酸处理干旱胁迫后的植株氧化损伤情况,本试验测定了谷氨酸处理和干旱过程中84K杨叶片的H2O2含量。相较于对照,施加谷氨酸后谷氨酸处理植株的H2O2积累显著降低(D4);干旱胁迫6 d后(D10),干旱84K杨H2O2含量增加了46.1%,而谷氨酸 + 干旱植株仅增加17.9%,增幅显著低于干旱处理植株(图5a)。
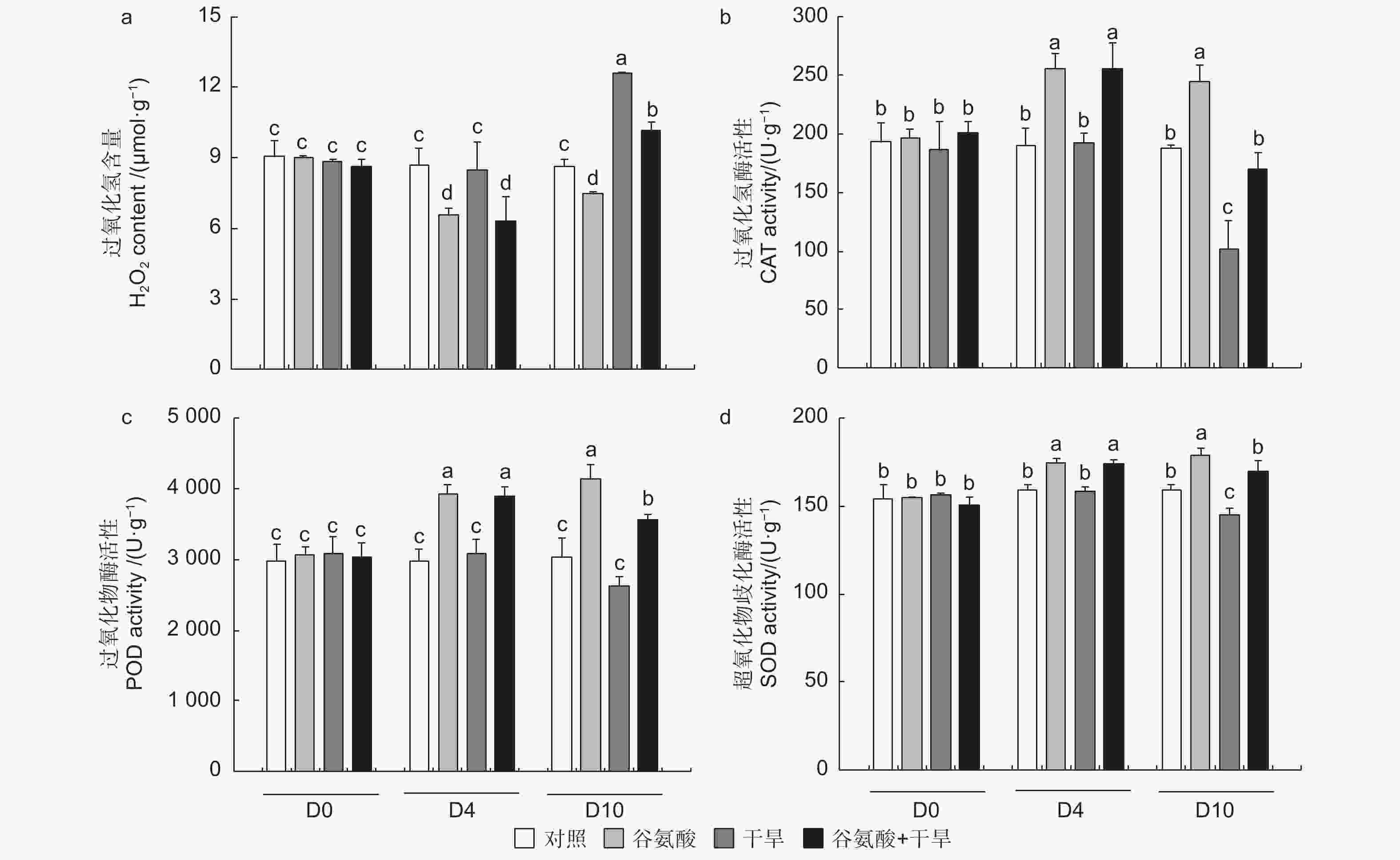
Figure 5. Determination of hydrogen peroxide content and analysis of antioxidant enzyme activity after glutamate treatment
过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性在干旱试验过程中呈现相同的趋势,谷氨酸处理后(D4),与对照相比,谷氨酸处理可以显著提高叶片的CAT、POD和SOD活性,分别提高了34.5%、32.5%和9.7%。干旱胁迫6 d后(D10),谷氨酸处理植株会维持较高的抗氧化酶活水平,CAT、POD和SOD活性分别是干旱处理植株的1.67、1.35、1.17倍(图5b、c、d)。较高的CAT和POD活性加速了过氧化氢的分解,干旱胁迫6 d后,谷氨酸处理后进行干旱的植株与干旱植株相比过氧化氢含量降低了19.3%(图5a)。故谷氨酸处理可缓解干旱胁迫产生的大量活性氧引起的氧化损伤,从而增强84K杨的耐旱性。
-
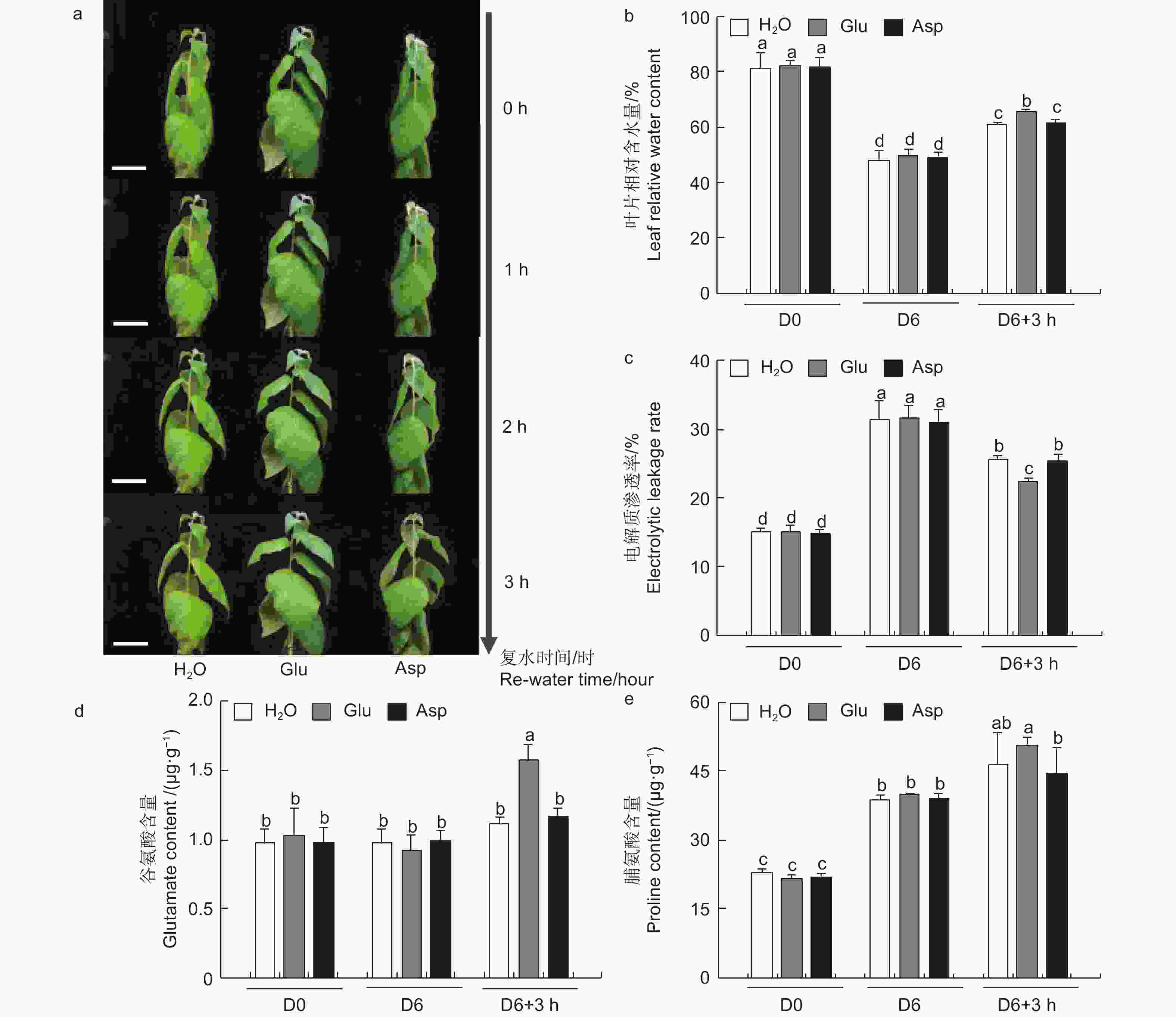
为探究干旱胁迫后外施谷氨酸(Glu)对84K杨恢复能力的影响,对干旱胁迫后的植株进行复水试验,并增加与谷氨酸相近的酸性氨基酸天冬氨酸(Asp)作为对照,验证谷氨酸在复水过程中特异性发挥作用。表型观察可知:萎焉植株复水后,第5、6片叶片最先发生响应,与复水处理相比,经谷氨酸处理的植株优先恢复(图6a)。
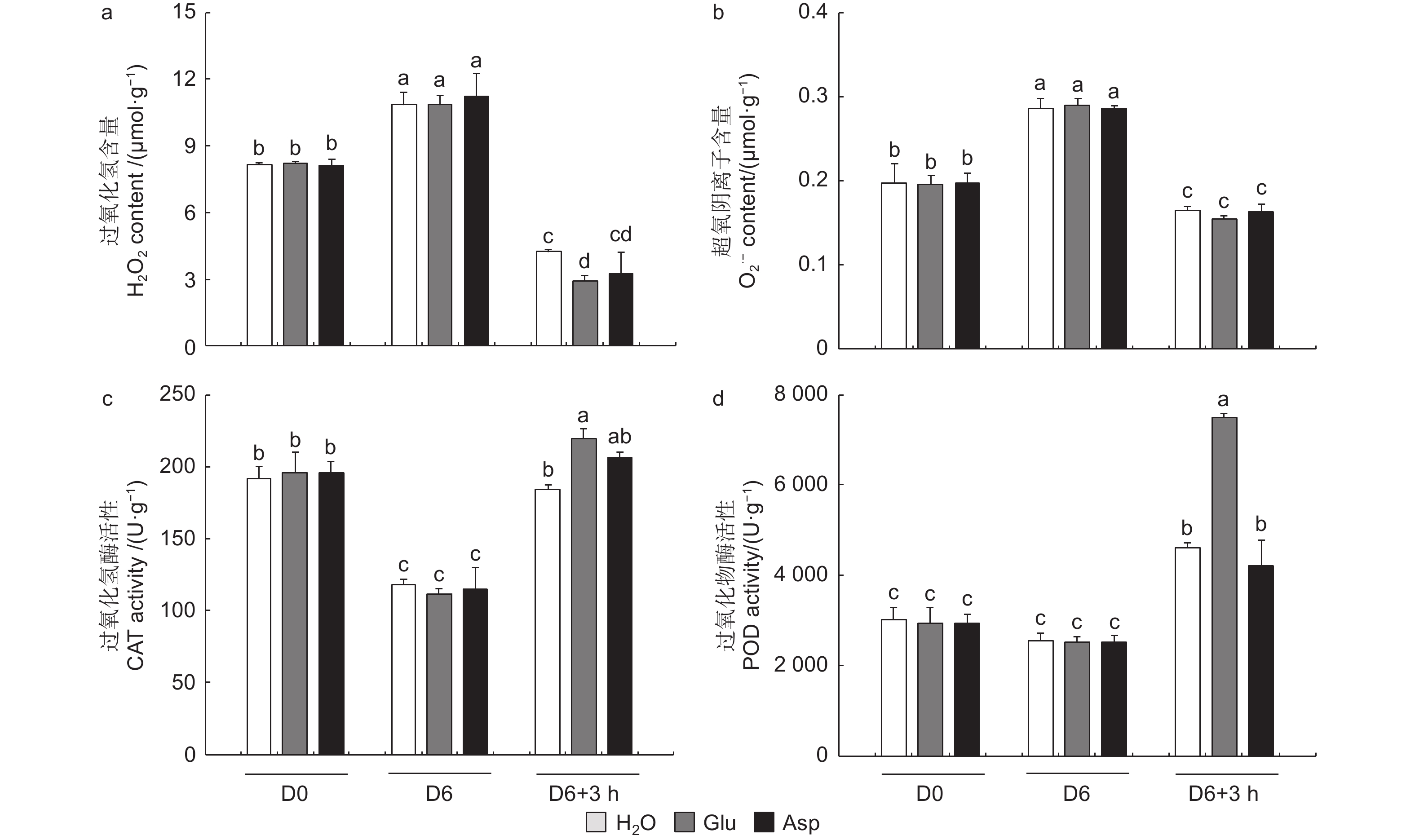
相较于干旱胁迫6 d后(D6)的84K杨,复水3 h后(D6 + 3 h),复水处理、复谷氨酸处理和复天冬氨酸处理叶片含水量分别增加了22.4%、36.9%和24.6%;电解质渗透率分别下降了18.6%、28.8%和18.0%(图6)。这些生理指标表明,复谷氨酸处理减轻了干旱胁迫带来的细胞膜损伤,叶片相对含水量更高,植株恢复能力更强。
-
3个处理在未处理(D0)和干旱胁迫6 d后谷氨酸含量无显著变化,但在复水3 h后复谷氨酸处理与复水相比,谷氨酸含量增加了41.8%(图6d)。复水3 h后复水处理和复谷氨酸处理脯氨酸含量均有所增加,但复谷氨酸处理增加更显著,是复水处理的1.48倍,复天冬氨酸处理无显著变化(图6e)。这表明谷氨酸处理后通过增加植物体内谷氨酸含量,诱导脯氨酸合成积累,维持细胞渗透平衡,阻碍水分亏缺。
-
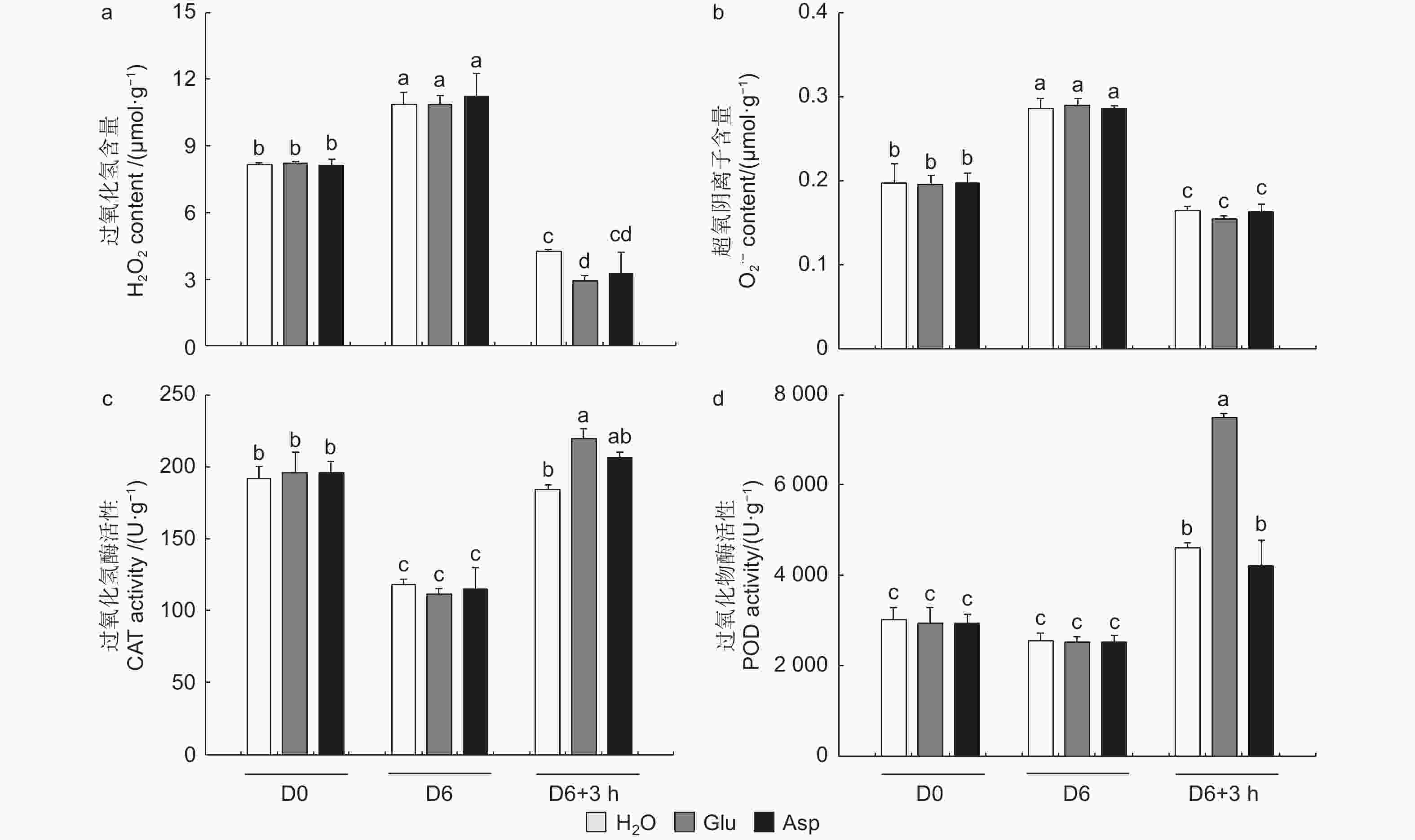
植物受到干旱胁迫后,会打破植物体内的活性氧动态平衡,活性氧含量增加,过氧化氢和超氧阴离子积累增加。复水3 h后,复水植株过氧化氢和超氧阴离子含量显著降低,而复谷氨酸处理植株过氧化氢降低幅度显著高于复水84K杨,且过氧化氢含量由高到低为H2O > Asp > Glu(图7a、b)。复水后,与复水处理相比,复谷氨酸处理CAT和POD酶活性分别提高了19.0%和62.7%(图7c、d)。结果表明:谷氨酸处理后,增强抗氧化酶活性,减轻了活性氧增加带来的氧化损伤,加快了84K杨的恢复能力。
-
谷氨酸作为初级代谢产物,参与合成多种与植物抗逆相关的有机化合物,同时作为一种信号分子可以通过Ca2 + 在整个植物之间进行信号传递,提高植物对非生物胁迫的适应[22-24]。本研究以L-谷氨酸作为外源诱导因子为切入点,探究在84K杨树干旱前后外源施加谷氨酸对植株耐旱性及干旱后恢复能力的影响。
有研究表明,谷氨酸是一种非常活跃的氨基酸,被植物根系直接吸收,通过木质部和韧皮部在植物组织和器官间运输并参与到代谢过程,以维持植物体内稳态[25-26]。通过植株干旱前不同时间施加谷氨酸试验发现,随着谷氨酸施加与干旱处理之间的间隔时间越短,植株表现出的耐旱性越强;谷氨酸施加与干旱处理之间的间隔时间越长,植株表现出的耐旱性越弱(图2)。有研究表明,植物正常生长情况下,谷氨酸在种子萌发、根结构建成和花粉管生长等过程中发挥作用;然而,在植物受到胁迫后,谷氨酸首先会参与植物伤口反应、增强病原体抗性以及对非生物胁迫(如盐、冷、热和干旱)的反应和适应[12]。因此,本研究推测,在干旱胁迫前随着谷氨酸处理时间间隔的增长,谷氨酸被植物吸收后主要在促进生长发育过程中发挥作用。谷氨酸在植物氨基酸代谢中起着核心作用,通过氨的同化、异化和转氨作用,为氨基酸的生物合成提供碳骨架和α-氨基,因此,植株吸收的谷氨酸可导致内部氨基酸代谢的变化[27-29]。在干旱胁迫下,脯氨酸合成酶(P5CS)和吡咯啉-5-羧酸还原酶(P5CR)催化谷氨酸合成脯氨酸[30]。脯氨酸作为一种具有较强水合力的水溶性氨基酸,在植物受到非生物胁迫后会显著积累,这被认为是植物适应胁迫的自我保护手段[31]。干旱胁迫6 d后,谷氨酸 + 干旱处理植株脯氨酸含量最高,是干旱处理植株的1.21倍(图3f),且谷氨酸施加后脯氨酸合成酶(P5CS)和吡咯啉-5-羧酸还原酶(P5CR)表达量升高(图4b、d),说明外源施加谷氨酸在干旱胁迫下,通过积累脯氨酸增强84K杨渗透调节能力,从而在一定程度上缓解干旱对84K杨的胁迫。本研究中,谷氨酸处理使84K杨体内脯氨酸合成基因(P5CS、P5CR)表达量增加,降解基因(PDH)表达量降低,谷氨酸和脯氨酸含量上升,叶片细胞质中渗透物质浓度提高,渗透势下降而减轻水分胁迫的伤害,所以在干旱胁迫下,谷氨酸处理植株叶片失水率显著低于对照植株(图3d)。与之相反,谷氨酸 + 干旱处理植株叶片相对含水量显著高于干旱植株,这表明谷氨酸和脯氨酸含量的增加,可以维持细胞渗透平衡,阻碍水分亏缺进一步的发生和发展,增强植株耐旱性,也有利于复水后植株的快速恢复[10,32]。除谷氨酸作为氨基酸前体合成脯氨酸外,谷氨酸本身也作为一种渗透调节物质,以游离的形式在植物细胞中积累,通过降低细胞渗透势来减少水分流失[33-34]。谷氨酸处理后植株活性氧的积累量较对照明显减少(图5a),抗氧化酶活性显著提高,也证明了谷氨酸在一定程度上缓解了干旱对植株的氧化胁迫伤害。这些变化趋势与Hayat等对逆境下渗透调节物质积累和活性氧代谢的研究相符[35]。相较于干旱处理,施加谷氨酸的84K杨干旱后脯氨酸含量增加33.1%(图3f),谷氨酸可作为脯氨酸合成前体,由此认为,谷氨酸诱导了脯氨酸的合成,调节了干旱胁迫下植株的渗透能力,增强抗氧化酶活性,清除了过量的活性氧,从而增强了植株对干旱胁迫的耐受力。
植物受到胁迫后,活性氧自由基与抗氧化酶之间的平衡被破坏,活性氧的大量积累损伤细胞膜系统,使细胞内电解质外渗导致电导率增大[36]。在复水试验中,谷氨酸处理后减轻84K杨细胞膜损伤,电解质渗透率显著降低,有助于植株复水后的快速恢复(图6a、c)。为避免受到活性氧的伤害,植物体内会形成一套有效的防御机制,其中,起主要作用的是活性氧清除酶系统,如POD、SOD、CAT等可有效清除植物体内的H2O2和O2·−,抑制高浓度活性氧的积累,防止膜脂的过氧化和细胞的死亡[37-38]。本研究中,无论植株干旱前施加谷氨酸或干旱后复水试验,添加谷氨酸后都可迅速提高植株体内POD、CAT的酶活性(图5b、c;图7c、d),减少活性氧积累。这与Teixeira等结果类似,在大豆作物中,叶面或种子中施用谷氨酸可以通过激活抗氧化酶过氧化氢酶、过氧化物酶、超氧化物歧化酶、多酚氧化酶和苯丙氨酸解氨酶来增强抗氧化能力应对胁迫[39]。本研究表明,外施谷氨酸可提高木本植物84K杨树的耐旱性,增强对环境胁迫的抗逆性。
-
干旱处理前外施谷氨酸可增加植株叶片谷氨酸含量、诱导脯氨酸合成基因的表达、增加脯氨酸积累、降低渗透势以减少叶片失水、增强叶片持水能力;同时还提高了植株体内抗氧化酶(CAT、POD和SOD)活性,减少了H2O2积累,从而缓解了干旱胁迫对植株的负面症状,增强了植株耐旱性。干旱胁迫后施加谷氨酸,增强了抗氧化酶CAT和POD活性清除,减轻膜脂过氧化造成细胞膜损伤,从而加速植株在干旱胁迫后的快速恢复。综上所述,谷氨酸既可作为木本植物干旱胁迫的缓解剂又可作为恢复剂,在干旱胁迫下能够调节植物生理代谢来减轻胁迫带来的伤害,为揭示谷氨酸在林木耐旱性方面的作用提供了重要依据。
Effect of Exogenous Application Glutamate on Drought Tolerance of Populus alba × P. glandulosa ‘84K’
- Received Date: 2022-11-26
- Accepted Date: 2023-03-27
- Available Online: 2023-08-20
Abstract:





 DownLoad:
DownLoad: