-
黄脊竹蝗(Ceracris kiangsu Tsai)隶属于直翅目(Orthoptera)蝗总科(Acridoidea)网翅蝗科(Arcypteridae)竹蝗属(Ceracris)[1],主要分布于云南、四川、重庆、福建等地。近年来,云南黄脊竹蝗灾害发生地主要集中在中老边境的州(市)县[2]。黄脊竹蝗为不完全变态昆虫,其发育时期分为卵、若虫和成虫。若虫喜食禾本科牧草,成虫喜食芭蕉(Musa basjoo Siebold & Zucc. ex Iinuma )和竹类植物,最为喜食芭蕉和毛竹(Phyllostachys pubescens Mazel)。因具有食性广、迁飞能力强、产卵量大的特点,黄脊竹蝗成为了危害性极大的林业害虫之一[3-4]。
关于蝗虫系统的研究主要集中在东亚飞蝗(Locusta migratoria manilensis)、沙漠蝗(Schistocerca gregaria)和中华稻蝗(Oxya chinensis)上。目前,学者已经对它们的生物学特性、胚胎发育特性、卵滞育特性、神经分化、基因与蛋白质表达等都展开了相关的研究。而对黄脊竹蝗的研究则主要集中于生物学特性及防治技术[5-7],关于其蝗卵和胚胎发育方面的研究比较少,仅对其胚胎发育阶段进行了划分[8],但对于各个胚胎发育阶段的历期和特征以及其胚胎卵滞育发生的阶段尚未明确。因此,本研究对黄脊竹蝗胚胎发育特征及卵滞育特性进行了研究,研究结果可为黄脊竹蝗卵滞育分子机制研究奠定基础,同时有助于从其卵期发育寻找突破口,探索有效防控新途径。
-
黄脊竹蝗1龄若虫于2022年4月采自西双版纳自治州勐腊县。采回的1龄若虫放入室内饲养以供后续实验观察。蝗卵为黄脊竹蝗室内饲养1代后所产的卵。饲养黄脊竹蝗所用的寄主植物分别为扁穗雀麦(Bromus cartharticus Vahl.)、毛竹和芭蕉。扁穗雀麦种子购买于北京正大种业有限公司,种植于云南省林业和草原科学院后山大棚内,毛竹和芭蕉均为云南省林业和草原科学院森林保护研究所培育。
-
黄脊竹蝗饲养:将采回的1龄若虫放入50 cm × 50 cm × 50 cm 的养虫笼内,每笼饲养20只,保持雌雄比例一致。将养虫笼放入温度为25 ℃,湿度为60%~75%,LD 12:12(在前期预实验中,温度25 ℃,湿度60%~75%为黄脊竹蝗适宜的生活条件)的恒温养虫室内饲养。饲养期间,选用拔节期的扁穗雀麦、出笋后20 d的毛竹和长至5片真叶的芭蕉。3种寄主植物均选取幼嫩叶片各20 g插入装满水的锥形瓶内,等距离放入养虫笼内,每日更换新鲜叶片,供黄脊竹蝗取食。待黄脊竹蝗出现交尾时,在笼子底部放入土层厚度为8 cm,粒度为40目的砂土,以供黄脊竹蝗产卵。
卵块培养:将当日产下的蝗卵放入装有无菌沙土的一次性餐盒内,并用无菌沙土将卵块完全覆盖,然后放入温度为25 ℃,湿度为60%~75%,LD 12∶12(在前期预实验中发现,温度25 ℃湿度60%~75%为黄脊竹蝗适宜的产卵土壤温度)的人工气候箱内培养。
-
按照1.2的方法饲养黄脊竹蝗和培养卵块,每隔2 d从不同卵块中取出5粒卵,用Bouin ′s固定液(苦味酸饱和液(1.22%)75 mL、福尔马林25 mL和冰醋酸5 mL)固定24 h,再用70%酒精溶液清洗蝗卵3次后,取出蝗卵置于10%的次氯酸钠溶液中处理4 min,待卵外壳变薄且透明后,用0.75%盐水清洗3次。观察时,首先在体式显微镜下对黄脊竹蝗卵粒形态进行拍照,观察记录胚胎在卵中的位置、方向和发育特征。然后,用解剖针解剖出胚胎,并用0.75%盐水清洗残存的卵黄,并对胚胎正面、侧面和背面进行拍照。参照赵琴[8]对于胚胎发育阶段及特征为参考,观察记录黄脊竹蝗各个发育阶段的形态特征,并记录各个发育阶段所需要的时间,以统计出黄脊竹蝗胚胎发育历期。
-
按1.2的方法饲养黄脊竹蝗和培养卵块,每隔5日从不同卵块取出5粒卵,按照1.4中观察胚胎形态的方法,在体式显微镜下测量I-X各个胚胎发育阶段中的胚胎长度(头顶至腹部末端的直线距离)、头幅大小(两复眼间的直线距离)及触角长(触角芽基至触角末端的距离)。每个阶段3次重复,每个重复取10粒蝗卵进行测量。
-
取出不同发育阶段的卵粒,将表面的杂质处理干净并用无菌水润洗3次,用吸水纸吸干水分后用电子天平称量其鲜质量,以10粒卵为1组,每组6个重复。然后放入1.5 mL离心管中,根据赵琴[8]等对蝗卵的处理方法,在95 ℃的数显鼓风干燥箱中烘烤12 h,待干燥箱内温度降到室温后,取出卵粒并称其干质量,并计算相对含水量。
含水量 =[(鲜质量−干质量)/鲜质量] × 100%。
-
按1.2的方法饲养黄脊竹蝗和培养卵块,产卵后将卵块置于25 ℃的温度条件下,5 d后将卵粒自卵块中剥离并混合,于产卵后第30、40、50、60 d分别随机选取健康的卵粒20 粒,按1. 4 描述的方法对卵粒进行固定并解剖。观察其胚胎发育时间,并统计各个时间内V-VII阶段胚胎所占比例。
-
利用SPSS 统计软件One-Way ANVOA 中S-N-K 和 LSD 方法对数据进行方差和显著性分析,制图利用prism 9和Excel软件。
-
将刚产出的蝗卵放入25 ℃的恒温条件下培养,从第2天开始可观察到胚胎。根据胚胎的形态特征,参照崔双双等对中华稻蝗(Oxya chinensis)、陈伟等对越北腹露蝗(Fruhstorferiola tonkinensis)、赵琴等对黄脊雷蓖蝗(Rammeacris kiangsu)的胚胎发育阶段的划分方法[9-11],将黄脊竹蝗胚胎发育划分为 10个阶段 (图1)。在体式显微镜下观察发现,10个阶段胚胎形态变化明显。
第I阶段:发育第2—5 d(取当日产下的卵放入25 ℃恒温条件起开始计时,下同),此阶段是胚胎发育的起始阶段,胚盘、胚带、胚层和胚膜正在形成,胚胎紧贴在卵孔端,靠近腹面的卵黄表面,解剖后取出多余的卵黄,可以看见不规则的胚盘,但分不清原头和原颚胸(图1A)。
第Ⅱ阶段:发育第6—9 d,胚盘开始分化,较第一阶段相比,胚胎依旧靠近卵孔端,但位置稍有下移,未解剖时隐约可见胚胎轮廓(图1B-1)。解剖后可见原头复眼叶及原颚胸出现,开始出现复眼轮廓,此时,胚胎的腹部刚形成,只有模糊的细长躯干,还未见其分节(图1B-2)。
第Ⅲ阶段:发育第10—16 d,此时是胚胎生长发育最快的时期,和前两个阶段相比,胚胎变化明显,未解剖时可见胚胎在卵粒中靠近卵孔处,胚胎性状细长(如图1C-1);解剖后可见原头、原胸及分化出的腹部,原头上可见分化出的上唇及触角芽基,复眼叶近圆形,躯干部分进一步分化为原颚、胸和腹部。颚、胸部又各分为3节,可见分化出的附肢,腹部细长已分节,但未出现腹部附肢(如图1C-2、C-3)。该阶段为胚胎发育的原足期。
第IV阶段:发育第17—24 d,未解剖时可见胚胎向卵孔相反方移动,较上一阶段相比已移动至卵黄中上部,胚胎变长(如图1D-1);解剖后可见上唇和触角继续生长增大,触角开始分节,胸部附肢继续生长,后肢较前肢和中肢略长、略大,腹部开始分节,隐约可见腹部分为10节(如图1D-2、D-3)。该阶段为胚胎发育的多足期。
第V阶段:发育第25—32 d,如图1E-1未解剖时清晰可见触角、附肢等胚胎形态,胚胎长度为卵长的1/3左右;解剖后可见触角延长,几乎延伸到胸部,复眼位于头部两侧,复眼背面出现色素,原颚部的第1对附肢分化为上颚、下颚,芽基分为3部分,最外侧为下颚须,中间为盔节,最内侧为叶节,下唇的左右芽基仍各分为2部分,胸部的附肢指向后端,较前一阶段相比,腹部分节明显,腹部末端第10腹节的末端中央部分出现原肛(如图1E-2、E-3)。
第VI阶段:发育第33—75 d,如图1F-1未解剖时可见胚胎长度约为整个卵长的1/2,胚胎形态更清晰;解剖后可见原头和原颚基本合在一起形成头部,触角继续延长,分节明显,上唇介于两触角之间,可分为唇基和上唇部分,胸部附肢继续生长,并且分节清晰,除与身体相连的基节外,可分为腿节、胫节和跗节。较前一阶段相比,头部色素加深,胚胎变宽(如图1F-2、F-3)。
第VII阶段:发育第76—85 d,该阶段发生胚动,未解剖时可见胚胎在卵粒中反向移动,胚胎下移至卵中部,长度约占卵长的2/3(如图1G-1);与第VI阶段相比,复眼、触角、上唇和附肢等变化明显,复眼红色色素更加清晰,触角伸长,胸部附肢继续生长,后足跗节隐约分为3节,胚胎背面弯曲,原头弯向卵中央,胚胎完成旋转后,原头由原来的卵孔方向转为卵孔的相反方向(如图1G-2、G-3)。
第Ⅷ阶段:发育第86—92 d,胚转完成,未解剖时可见胚胎继续向前端生长,占全卵长度4/5以上,卵黄大部分已被包入体内(如图1H-1);解剖后可见复眼面积增大,单眼已形成,上颚内侧较厚,下唇两芽基渐渐合并,下唇须延长,中唇舌已形成;触角继续延长,近末端数节较粗,胸部附肢继续伸长,腹部各节腹板和侧板已可分开,背面逐渐向前端愈合(如图1H-2)。
第Ⅸ阶段:发育第93—100 d,如图I-1,未解剖时可见胚胎几乎占据整个卵粒,胚胎体形完整;解剖后可见复眼颜色更深,触角分节明显,上颚内侧的齿清晰可见,下颚须和下唇须伸长并目分节,胸部附肢的跗节各有1对跗垫,前跗节已形成为一爪状,后肢的腿节顶端已到达第6腹节,腿节上的花纹隐约可见,胫节边缘的刺已形成,腹部各节腹板和侧片划分明显,腹末的外生殖器及尾须清晰可见,背面愈合完全(如图1I-2、I-3)。
第X阶段:如图1J-1~J-5,发育第101—109 d,未解剖时可见胚胎完全占据整个卵粒,卵黄全部包入体内(如图1J-1);解剖后可见胚胎发育成熟,身体表面色素出现,复眼变为黑色,触角基节之间3个单眼明显,上颚齿颜色变深,孵化时变成黑色,胸部附肢胫节边缘的刺颜色变深,可见后足腿节上羽状纹,后足的腿节顶端已到达第8腹节,外生殖器明显可见,近似于1龄蝗蝻(如图1J2~J-5)。
-
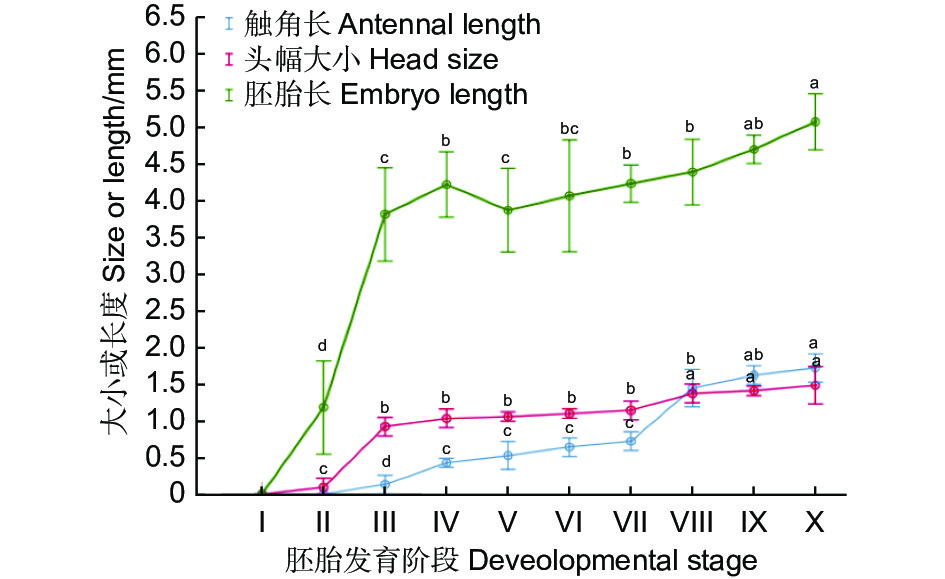
如图2可知,黄脊竹蝗不同阶段的胚胎长度不同,第Ⅰ阶段为胚胎发育的起始阶段,胚胎还未发育,长度为0 mm,从第Ⅱ阶段开始,胚胎开始发育,长度为1.18 ± 0.07 mm;随后胚胎有一较为快速增长期,第Ⅲ阶段时,胚胎长度显著增加(p<0.05),在体视显微镜下能清晰观察到胚胎,此时胚胎长度为 3.86 ± 0.14 mm;第Ⅳ阶段胚胎长度是所有时期中最长,显著长于此前的胚胎长度(p<0.05),长度达4.21 ± 0.50 mm;第Ⅴ阶段时,胚胎发育较为成熟,胚胎形态由刚开始的细长变粗变宽,胚胎长度缩短为3.98 ± 0.50 mm;随后,从第Ⅵ—Ⅷ阶段,胚胎长度介于 3.75 ± 0.42 mm~3.95 ± 0.37 mm,处于增长缓慢阶段,各观察点的胚胎长度间无显著差异(p>0.05);第Ⅸ—Ⅹ阶段,胚胎发育速度加快,其中,第X阶段时,胚胎长度达到最大值,为6.94 ± 0.91 mm,显著高于VI—VIII阶段。
Figure 2. Antennae, head size and embryo length at various embryonic stages of Ceracris kiangsu Tsai
与胚胎长度相似,第Ⅰ阶头幅长度为0 mm,且在第Ⅰ—Ⅱ阶段时发育慢,头幅变化不明显(p>0.05),其后快速增长;到第Ⅲ阶段时,头幅长度显著增加(p<0.05),达0.92 ± 0.05 mm;随后头幅增长缓慢,第Ⅲ—Ⅶ阶段胚胎头幅介于 0.92 ± 0.05 mm~1.08 ± 0.22 mm,各观察点的胚胎长度间无显著差异(p>0.05);至第Ⅷ阶段时,头幅显著增长(p<0.05),达到 1.47 ± 0.14 mm;从Ⅷ—Ⅹ阶段,胚胎头幅缓慢增长(p>0.05),到第Ⅹ阶段时头幅长度为1.48 ± 0.25 mm。
触角发育比体长和头幅慢,在胚胎的第Ⅲ阶段才观察到触角,第Ⅲ阶段的触角芽基长度只有0.13 ± 0.04 mm;第Ⅳ阶段时,增长迅速且与前几个阶段差异显著(p<0.05),长度达到0.43 ± 0.04 mm;和头幅发育相似,触角在第Ⅳ—Ⅶ阶段时发育缓慢,各发育阶段间差异不显著(p>0.05),触角长度介于0.51 ± 0.06 mm~0.65 ± 0.12 mm;第Ⅷ阶段时,触角长度为1.20 ± 0.35 mm,显著长于Ⅶ阶段(p<0.05);随后触角缓慢增长,各观察点的胚胎长度间无显著差异(p>0.05)。第Ⅷ阶段时—Ⅹ阶段,触角缓慢无明显变化(p>0.05),到第Ⅹ阶段时触角长度为1.55 ± 0.31 mm。与胚胎长度和头幅发育一致,从Ⅷ—Ⅹ阶段,胚胎头幅缓慢增长(p>0.05)。
-
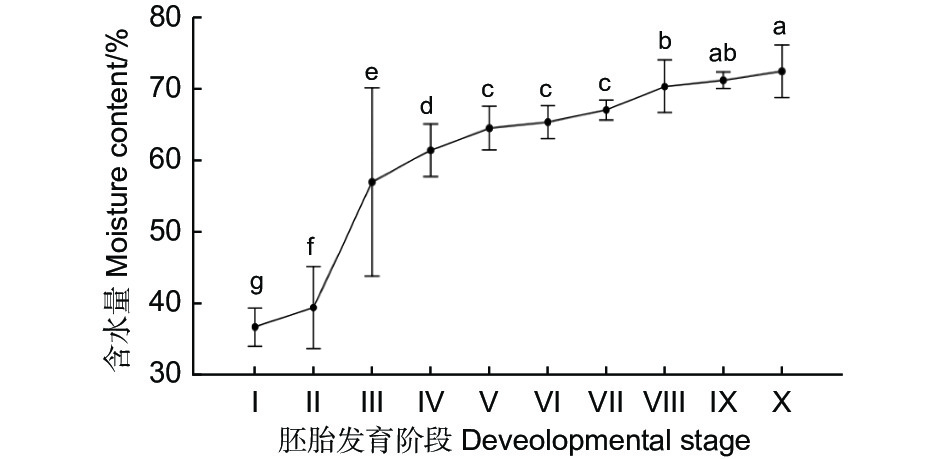
陈伟等对越北腹露蝗的胚胎研究发现,卵的含水量与胚胎生长发育有关[12]。本研究对黄脊竹蝗不同发育阶段卵粒含水量进行了测定,如图3,在25 ℃的恒温条件下,各发育阶段之间卵的含水量差异显著。第Ⅰ阶段是卵粒的发育起始阶段,此时卵含水量为整个时期中最低,仅为35%;第Ⅱ阶段较第Ⅰ阶段相比其含水量缓慢增加(p<0.05);到第Ⅲ阶含水量段迅速增加(p<0.05),平均为57.23%;第Ⅴ—Ⅶ阶段各阶段较前一阶段相比均无显著差异(p>0.05),各发育阶段之间含水量缓慢增加,维持在65%左右;但到Ⅷ阶段时,含水量又会迅速上升,达到70.35%;随着胚胎的稳定发育,含水量缓慢上升(p>0.05),在接近孵化时(Ⅹ阶段),卵的平均含水量为72.52%。结合卵粒含水量结果可知,蝗卵在第Ⅲ阶段含水量急速增加,第Ⅴ—Ⅶ阶段含水量无明显的增加,从第Ⅷ阶段开始含水量又会开始有所增加,因此可以认为黄脊竹蝗卵在25 ℃的恒温条件下,第Ⅴ—Ⅶ阶段是其胚胎发育的停滞期。
-
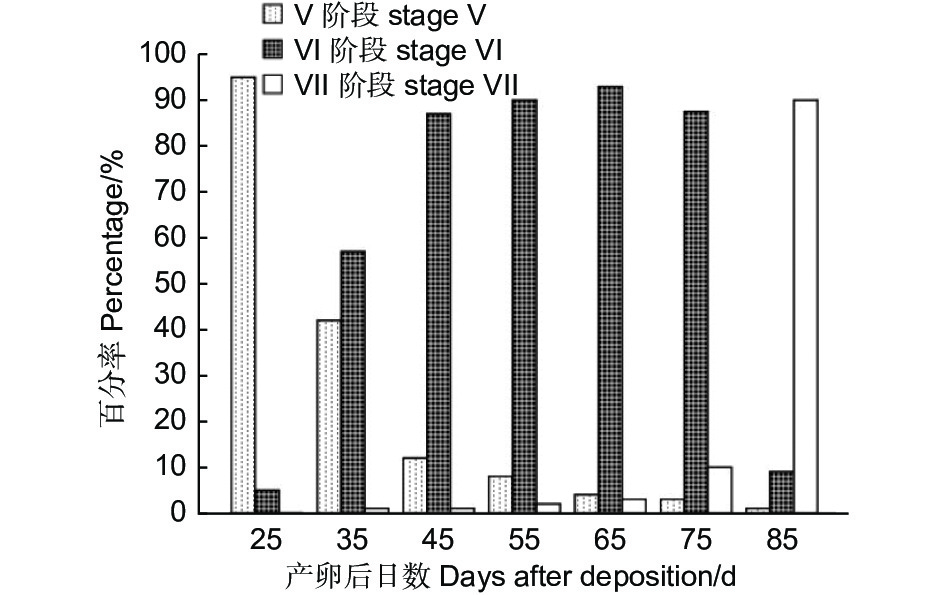
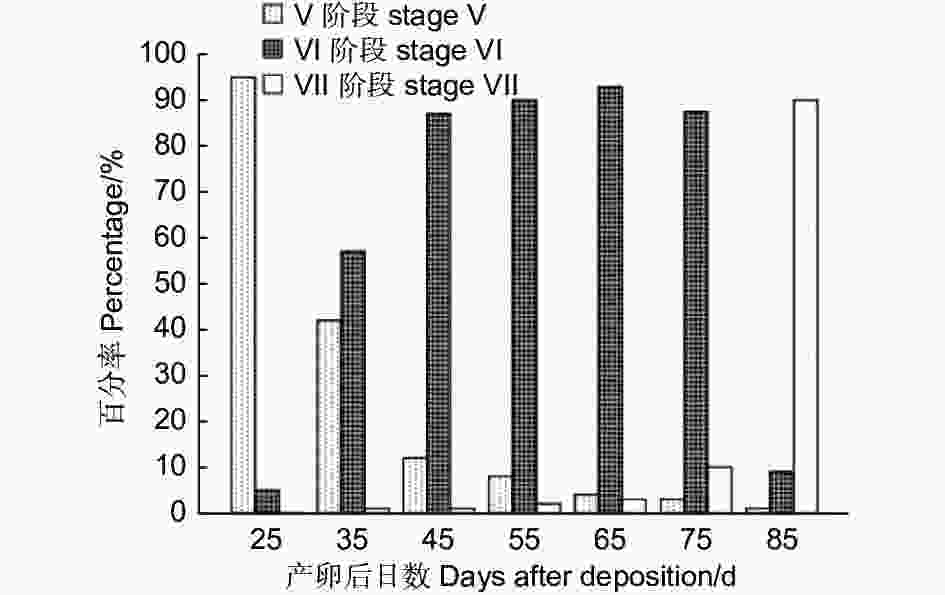
黄脊竹蝗蝗卵为100%滞育。根据以上胚胎、触角、头幅及卵粒含水量的研究结果可知滞育发生在Ⅴ—Ⅶ阶段。为明确滞育发生的具体阶段,对Ⅴ—Ⅶ阶段胚胎发育及发育时间进行了详细观察(图4)。根据各观测时间内Ⅴ—Ⅶ阶段胚胎的比例可知:产卵后第25 d第Ⅴ阶段的胚胎所占比例明显大于第Ⅵ阶段;第35 d 时,第Ⅵ阶段的胚胎占比已超第Ⅴ阶段;第45—75 d第Ⅵ阶段胚胎比例最大,但各个观测时间点之间胚胎比例无明显变化;第85 d时,第Ⅶ阶段的胚胎所占比例最大。黄脊竹蝗胚胎在产卵后第25 d,95%( N = 20,下同)都处于胚胎发育的第Ⅴ阶段,只有5%的胚胎进入了第Ⅵ阶段;产卵后第35 d时第Ⅴ阶段的胚胎下降至42%,大部分胚胎开始进入第Ⅵ阶段;产卵后第45 d,第Ⅴ阶段的胚胎明显下降,只有12%,87%的胚胎进入了第Ⅵ阶段;从第45—75 d,第Ⅴ阶段和第Ⅶ阶段的卵粒数量极少,87%以上的卵粒均停留在第Ⅵ阶段,且该段时间内第Ⅵ阶段的胚胎无明显变化;至第85 d时90%的胚胎进入了第Ⅶ阶段。
根据以上结果可知,50%以上的卵粒第Ⅴ阶段仅出现在第25 d和第35 d,80%以上的卵粒第Ⅵ阶段仅出现在第85 d,而85%以上的卵粒第Ⅵ阶段在第35—75 d里均大量出现,表明在胚胎发育过程中,第Ⅵ阶段停留的时间最长,可以认为,在25 ℃恒温条件下黄脊竹蝗在产卵后的第35 d之后卵粒进入滞育发育,卵滞育发生在第Ⅵ阶段。
-
昆虫的胚胎发育自卵裂、胚盘的形成,至胚胎的分节、附肢的形成,是一复杂的过程[13-14],可划分为若干阶段。蝗虫的种类不同,其胚胎发育阶段也存在差异。根据不同蝗虫胚胎形态特征,Salzen将东亚飞蝗的胚胎发育划分为 13 个阶段[15],Tvren将沙漠蝗的胚胎发育划分为 16 个阶段[16],闫梦云等将西伯利亚蝗胚胎发育划分为 12个阶段[17],钦俊德等[18]将亚洲飞蝗(Locusta migratoria)的胚胎发育划分为10个阶段,陈伟等[12]将越北腹露蝗(Fruhstorferiola tonkinensis)的胚胎发育分为10个阶段。对于黄脊竹蝗的胚胎发育阶段也已经有了明确的划分,赵琴和贺一原将黄脊竹蝗的胚胎发育划分为10个阶段[8]。本研究中,观察到黄脊竹蝗的胚胎分为10个阶段,结果与赵琴等研究结果一致,可以认为黄脊竹蝗的胚胎发育阶段不受地理分布的影响。
蝗虫胚胎发育历期也因种类和生活环境不同而有所差异,亚洲飞蝗胚胎发育无滞育现象,30 ℃条件下,经13 d就能孵化[18]。越北腹露蝗卵由于受到生理滞育的影响,孵化约需206 d,越冬期间的滞育期长达180 d[19]。西伯利亚蝗胚胎发育历期较长,卵孵化需220 d,滞育期长达193 d[17]。本研究中,黄脊竹蝗的发育历期与越北腹露蝗、西伯利亚蝗等的发育历期不一样,在25 ℃条件下,黄脊竹蝗胚胎发育历期为109 d,其中,滞育期为42 d,卵滞育解除后,出现胚转现象,胚胎开始恢复发育,这与大部分昆虫的胚胎发育一致。学者对昆虫胚转的相关研究表明,胚胎胚转主要与胚胎卵内营养物质的充分利用有关,同时可使胚胎在有限的卵内空间得以充分地发育[19]。胚动包括从卵的腹面向背面进行的反向移动和从卵的背面向腹面进行的顺向移动2种,一般来说,蜚蠊目、鞘翅目和等翅目等长胚带昆虫的胚动幅度小,而蜻蜒目、直翅目和半翅目等短胚带昆虫的胚动幅度较大[20]。从黄脊竹蝗的胚胎发育过程来看其胚动属于反向移动,本研究中也观察到黄脊竹蝗的胚转完成后,卵黄大部分被包裹进胚胎内,这表明胚动有助于胚胎吸收卵内营养物质,确保胚胎正常发育。
-
陈伟等对越北腹露蝗的胚胎研究发现,胚胎体长、头幅、触角的变化与胚胎生长发育有关,可将其作为观测胚胎发育快慢的指标[12]。本研究根据胚胎体长、头幅、触角的变化规律,将黄脊竹蝗的发育分为4个阶段,分别为胚胎发育起始期、快速发育期、缓慢发育期和恢复发育期。第Ⅰ阶段和第Ⅱ阶段胚胎刚开始发育,体长、头幅和触角均无显著变化,故为胚胎发育起始期;第Ⅲ阶段和第Ⅳ阶段,体长和头幅迅速增长,触角也有了变化,此时为胚胎的快速发育期;第Ⅴ—Ⅶ阶段,各阶段之间体长、头幅、触角均发育缓慢,此时其卵粒应处于滞育状态,为缓慢发育期;从第Ⅷ阶段开始至Ⅹ阶段结束,胚胎体长开始迅速变化,头幅和触角虽变化没有体长明显,但也在增加,且各发育阶段之间变化明显,为恢复发育期。对胚胎发育时期的划分,可为进一步研究黄脊竹蝗胚胎发育特征及卵滞育发生阶段提供参考。崔双双等对中华稻蝗卵滞育发生阶段的研究表明,卵粒的含水量是衡量胚胎发育速度的重要指标[21]。参照崔双双等的方法,本研究对黄脊竹蝗卵粒含水量进行了测定,结果表明,蝗卵在第Ⅲ阶段有一快速吸水过程,而第Ⅴ—Ⅶ阶段含水量无明显的增加,从第Ⅷ阶段开始又会出现快速吸水过程,因此可以认为黄脊竹蝗卵在25 ℃的恒温条件下,第Ⅴ-Ⅶ阶段是其胚胎发育的停滞期。
滞育是昆虫为了躲避不良环境的生存策略,一般分为卵滞育、幼虫滞育、若虫滞育、成虫滞育[22-23]。蛾类昆虫多为幼虫滞育[9-10],七星瓢虫、象甲的滞育类型为成虫滞育[11],蝗虫的滞育类型为卵滞育[24-25]。以滞育卵越冬的昆虫,种类不同卵滞育发生的胚胎发育阶段亦存在差异,家蚕(Bombyx mori)卵的滞育发生在胚胎初期[26]。对于蝗虫而言,卵滞育通常发生在胚胎发育的中后期,如飞蝗(Locusta migratoria)卵滞育发生在胚胎发育的中期[18, 27],中华稻蝗的卵滞育发生胚胎发育的后期[23]。本研究中,结合卵的含水量变化、胚胎发育速度及各个胚胎阶段的发育历期,可以认为在25 ℃的恒温条件下,黄脊竹蝗的卵滞育并非完全停滞发育,而是发育相对缓慢的时期,在产卵后第45 d进入卵滞育发育,卵滞育发生在第VI阶段,在胚胎发育的后期,这与中华稻蝗一致。本研究仅阐明了黄脊竹蝗卵滞育的发生阶段,对于卵滞育的控制机理仍需要进一步的深入研究。
-
研究表明,室内饲养黄脊竹蝗所产的卵块,在25 ℃恒温条件下,胚胎发育共划分为10个阶段,各个发育阶段胚胎形态特征差异明显,胚胎发育历期为109 d,其中滞育期42 d,产卵后第35—75 d为卵滞育期,滞育发生在第VI阶段。本研究结果为黄脊竹蝗卵滞育发生机制研究提供了数据支撑,也可为从卵期寻找突破口,探索有效防控黄脊竹蝗的新途径提供依据。
Embryonic Development and Egg Diapause Stage of Bamboo Locust Ceracris kiangsu Tsai
- Received Date: 2023-01-28
- Accepted Date: 2023-04-27
- Available Online: 2024-02-20
Abstract:








 DownLoad:
DownLoad: