-
早竹(Phyllostachys praecox C. D. Chu et C. S. Chao)笋期早、产量高、笋味美、营养价值高,是我国南方的重要笋用竹种[1-2]。据统计,我国南方早竹的种植面积在6.7万hm2以上,年产值达10亿多元[3];浙江省是早竹的主要种植区,仅德清县种植的早竹就有0.7万hm2,年产值近亿元。早竹在浙江省林业经济发展中发挥着重要作用,种植早竹已经成为林农增收致富的重要手段。然而,早竹却是丛枝病的易感竹种,绝大多数早竹林地都有丛枝病发生,发病严重林地的发病率高达52.2% [4-5]。
竹子丛枝病是竹类植物上的重要病害,发生普遍,危害严重,造成竹子长势衰弱、出笋减少、严重者整株枯死[6-7],影响竹子生长和竹林的可持续经营。引起竹子丛枝的原因众多,有病原菌侵染造成的,有昆虫取食引起的,也有自然发生的[8-9]。在我国,已报道的病原菌有竹针孢座囊菌(Aciculosporium take Miyake)、植原体(Candidatus Phytoplasma)、竹异香柱菌属(Heteroepichloё Tanaka)和竹暗球腔菌(Phaeosphaeria bambusae Miyake et Hara)4类,并且在不同竹种上引起丛枝病的病原菌不同,同一竹种上也可能存在多种病原菌混合侵染[9-11]。这些因素增加了竹子丛枝病病原研究的难度和复杂性,导致当前早竹丛枝病的研究止步不前。本研究采用单株水平和单枝盘水平的病害分级标准对浙江省德清县的早竹丛枝病进行了调查;利用丛枝病病原细菌和真菌的特异性PCR引物,采用分子生物学的方法对该地区的早竹丛枝病病原菌的保守序列进行扩增、克隆和序列分析,明确了引起早竹丛枝病的病原菌。本文研究结果可为早竹丛枝病的病害诊断和防治提供科学依据。
HTML
-
早竹丛枝病的样品采集于浙江省德清县的万亩早竹林。使用高枝剪剪取具有丛枝症状的小枝,每株早竹上只取1份样品,每两份样品之间间隔50 m以上。剪取的样品装于自封袋中,每个自封袋装1份,样品采集完后立即带回实验室,保存于-80℃超低温冰箱待用。同时在没有丛枝病发生的地块采集早竹小枝作为阴性对照材料。在中国林业科学研究院亚热带林业研究所试验林场,使用高枝剪剪取具有丛枝症状的泡桐(Paulownia spp.)枝条作为阳性对照材料。
-
植物基因组DNA提取试剂盒、普通DNA产物纯化试剂盒、DNA克隆试剂盒、TOP10感受态细胞和2×PCR MasterMix购于天根生化科技(北京)有限公司;DNA分子量标准DL2000购于宝生物工程(大连)有限公司。试验用到的引物由生工生物工程(上海)股份有限公司合成,DNA测序由铂尚生物技术(上海)有限公司完成。
-
早竹丛枝病发生严重期,在浙江省德清县选取6块样地进行病害调查。参照陈建寅等[5]的方法在每块样地中设置3个小样方,采用人眼观察法对每个样方的每株竹子进行调查,记录样方中竹子总株数、发病株数、发病株总枝盘数、感病枝盘数和感病枝盘的病情等级。
参照陈建寅[5]的方法将竹子单株水平的病情分为5级,依据观察和文献描述的竹子丛枝病病害症状的发展规律[12-13],将单枝盘水平上的病情分为5级,具体分级标准见表 1。早竹发病率和病情指数的计算公式如下:
病级
Infection
category单株水平的发病程度
Grading of witches’ broom disease at individual level单枝盘水平的发病程度
Grading of witches’ broom
disease at branch level代表数值
ValueⅠ级
Level 1无明显症状
No observable infection无明显症状
No observable infection0 Ⅱ级
Level 2发病枝盘数不超过总枝盘数的25%
The percent of infected branches to the total was less than 25%.小枝延长,叶片变小,但只有单根小枝,无丛生现象
The twig grow in an acropetal sequence with very thin stems and little leaves, but only for single twig without cluster phenomenon1 Ⅲ级
Level 3发病枝盘数占总枝盘数的26%~50%
The percent of infected branches to the total was 26% to 50%.侧芽长出,数个枝条丛生,小叶片无枯萎
The lateral buds grew out, several lateral branches clustered together, the little leaves was no withering.2 Ⅳ级
Level 4发病枝盘数占总枝盘数的51% ~ 75%
The percent of infected branches to the total was 51% to 75%.小枝复丛枝,呈小的团状分布,小叶片有的枯萎或脱落
The lateral buds repeatedly grew out with small clumps distribution, and the little leaves withered or fell off.3 Ⅴ级
Level 5发病枝盘数占总枝盘数的75%以上
The percent of infected branches to the total was more than 75%.小枝复丛枝,呈大的团状分布于竹秆上
The lateral buds repeatedly grew out with comprehensive clumps distribution of the bamboo culm.4 Table 1. Calculation of the disease index for bamboo withes' broom caused by A. take
-
将保存于超低温冰箱的样品取出,使用干净的剪刀剪碎,置于研钵中,添加液氮研磨成粉末。称取0.1 g左右的粉末,依据天根生化科技(北京)有限公司的植物材料DNA提取试剂盒的操作步骤进行DNA提取。以具有丛枝症状的泡桐枝条作为阳性对照样品,无丛枝症状的早竹小枝作为阴性对照样品。提取的总DNA采用凝胶电泳法检测其质量。
-
以提取的总DNA为模板,采用Duduk等[14]报道的引物对R16mF2/R16mR1(5’-CATGCAAGTC-GAACGGA-3’/5’-TTAACCCCAATCATCGAC-3’)和R16F2n/R16R2(5’-GAAACGACTGCTAAGACTGG-3’/5’-TGACGGGCGGTGTGTACAAACCCCG-3’)进行巢式PCR扩增,扩增的植原体16S rRNA基因片段大小约为1 200 bp。扩增使用的反应体系为:2 × PCR Mix 10 μL,10 mmol·L-1的正、反向引物各0.6 μL,模板1 μL,加ddH2O补足20 μL。巢式PCR第1轮的反应条件:94℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸90 s;72℃下延伸10 min,循环数为30。第1轮PCR的产物稀释20倍后取1 μL作为第2轮PCR的模板,PCR扩增的体系同上。第2轮PCR反应条件为:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸70 s;72℃延伸10 min,循环数为38。取5 μL第2轮PCR产物,使用0.9%的琼脂糖凝胶进行电泳分析。电泳结束后在凝胶成像仪上照相记录结果。
-
以提取的总DNA为模板,采用报道的引物对ITS1-F/ITS4(5’- CTTGGTCATTTAGAGGAAGTAA -3’/5’-TCCTCCGCTTATTGATATGC-3’)进行PCR扩增[15-16],扩增的真菌rDNA-ITS序列片段大小约为600 bp。扩增时使用的反应体系为:2 × PCR Mix 10 μL,10 mmol·L-1的正、反向引物各0.4 μL,模板1 μL,加ddH2O补足20 μL。PCR的反应条件为:94℃预变性5 min;95℃变性35 s,55℃退火55 s,72℃延伸60 s;72℃下延伸10 min,循环数为35。取5 μL的PCR产物,使用1.5%的琼脂糖凝胶进行电泳分析。电泳结束后在凝胶成像仪上照相记录结果。
-
PCR产物经凝胶电泳检测,阳性扩增子使用普通DNA产物纯化试剂盒纯化。纯化的PCR产物连接到pLB载体,连接的反应体系为:pLB载体0.5 μL、Insert DNA 0.6 μL、2 × Reaction Solution 0.5 μL、Blunting Enzyme 0.25 μL、T4 DNA Ligase 0.5 μL,最后加ddH2O补足至5 μL。全部连接产物转移到50 μL的感受态细胞中进行转化,转化的试验程序参照感受态细胞使用说明书进行。
挑取转化平板上长出的菌落,接种到4 mL的LB液体培养基中培养,培养条件为37℃下150 r·min-1培养12~16 h。培养好的菌液取0.5 μL作模板进行菌液PCR鉴定,菌液PCR的反应条件同1.4.2节。PCR鉴定为阳性的菌液,取1 mL送铂尚生物技术(上海)有限公司测序。
-
病害调查的原始试验数据使用Excel 2010和SPSS 13.0软件进行计算和处理。测定的序列采用NCBI上的BlastN软件进行在线比对,利用DNAMAN 6.0软件进行多重序列比对和同源性分析。多重比对时使用的其它序列来源于GenBank,其登陆号如下:AB066292、AB066293、AB086846、AB065423、EF363682、EF363683。
1.1. 试验材料
1.1.1. 供试植物材料
1.1.2. 试剂和引物
1.2. 早竹丛枝病的调查方法
1.3. 早竹丛枝病材料的总DNA提取
1.4. 早竹丛枝病病原菌的分子鉴定
1.4.1. 早竹丛枝病植原体病原的16S rDNA序列扩增
1.4.2. 早竹丛枝病真菌病原的rDNA-ITS序列扩增
1.4.3. PCR产物的纯化、克隆和序列分析
1.5. 数据处理
-
本试验在浙江省德清县的万亩早竹林共调查了6块样地的18个样方,病害调查结果见表 2。6块样地丛枝病发病率变化较大,最高发病率为43.23%,最低为6.08%,平均发病率为18.59%。样地病情指数最高为14.99,最低为1.52,平均病情指数为6.67。各样方感病株平均病情指数最高为31.15,最低为0,平均病情指数为11.86。
样地
Plot样方
Quadrat样方发病率
Incidence of quadrat/%样方病情指数
Disease index of quadrat感病株平均病情指数
Mean disease index of infected bamboo样地发病率
Incidence of plot/%样地病情指数
Incidence of plot1 11.11 2.78 17.50 1 2 7.14 1.79 6.25 6.08±5.63 1.52±1.41 3 0.00 0.00 0.00 1 8.33 1.67 10.00 2 2 27.27 11.36 14.34 21.87±11.80 8.51±5.95 3 30.00 12.50 11.67 1 18.18 4.55 9.38 3 2 0.00 0.00 0.00 9.76±9.16 2.44±2.29 3 11.11 2.78 15.38 1 60.00 22.50 13.31 4 2 36.36 11.36 11.16 43.23±14.60 14.99±6.50 3 33.33 11.11 8.91 1 20.00 5.00 12.92 5 2 9.09 4.55 23.08 9.70±10.01 3.18±2.76 3 0.00 0.00 0.00 1 22.22 11.11 19.03 6 2 18.18 11.36 31.15 20.87±2.33 9.34±3.28 3 22.22 5.56 9.38 Table 2. Survey results of witches' broom disease of Ph. praecox
从表 2中也可看出,在相同样方中其样方病情指数与感病株平均病情指数存在差异,绝大多数样方病情指数小于感病株平均病情指数。而不同样方间进行比较时,即使样方病情指数相同,其感病株平均病情指数也不同。如6号样地的样方2、4号样地的样方2和2号样地的样方2的样方病情指数都为11.36,但其感病株的平均病情指数分别为31.15、11.16和14.34,表明6号样地的样方2与4号样地的样方2和2号样地的样方2相比,其感病株上的小枝发病更为严重。故将单株水平和单枝盘水平的病情分级同时用于丛枝病的调查,能更好的反映丛枝病在样地中发生情况。
-
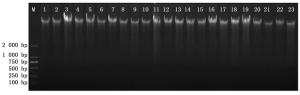
本研究提取了表现丛枝症状的早竹材料、健康的早竹材料和表现丛枝症状的泡桐材料的总DNA。提取的总DNA样品进行凝胶电泳检测,发现样品的总DNA带大小一致、清晰明亮,无明显拖尾现象,亦无蛋白质和RNA污染(图 1)。因此,本研究提取的总DNA浓度高、纯度好、降解少,可以用于后续的分子生物学试验。
-
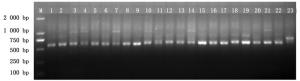
采用引物对R16mF2/ R16mR1和R16F2n/ R16R2对提取的DNA样品进行巢式PCR扩增,PCR扩增的产物进行琼脂糖凝胶电泳分析。结果表明,泡桐丛枝病材料的DNA样品能够扩增出约1 200 bp的条带,而所有早竹的DNA样品均不能够扩增出清晰的1 200 bp的条带(图 2)。表明样品中没有植原体DNA存在,即收集的早竹丛枝病材料的病原菌非植原体。
-
采用引物对ITS1-F/ ITS4对提取的DNA样品进行PCR扩增,扩增产物进行琼脂糖凝胶电泳分析。从结果可以看出,所有表现丛枝症状的早竹样品都能够扩增出约600 bp的DNA条带,而表现健康的早竹样品不能够扩增出相同大小的条带(图 3),表明在感病的早竹样品中存在真菌病原物。
-
PCR扩增出的真菌rDNA-ITS序列,采用凝胶回收试剂盒回收纯化,纯化产物连接到pLB载体并转化大肠杆菌感受态细胞。挑取转化平板上的菌落,接种于LB液体培养基,每个平板接种3个菌落。接种并培养后的菌液采用PCR法筛选重组子,重组子送铂尚生物技术(上海)有限公司测序。分析测序的结果,发现早竹丛枝病病原菌的rDNA-ITS序列扩增片段的长为585~586个核苷酸,包括ITS1、5.8S rRNA和ITS2的全长序列。将测定的序列在NCBI中进行BLAST分析,得到与早竹丛枝病病原物亲缘关系最近的真菌序列及同源性数据。在线比对发现,本研究测定的序列与竹针孢座囊菌的序列(EF363682、EF363683)的同源性高达99.00%;与其它的非竹针孢座囊菌的序列同源性最高的为Claviceps phalaridis(AJ133399),并且两者间的同源性仅为94.00%,故本研究中的早竹丛枝病的病原菌为竹针孢座囊菌。将测定的序列和GenBank下载的竹针孢座囊菌序列截取相同的长度(482 bp),使用DNAMAN 6.0进行序列的多重比对,结果表明测序序列间的同源性为99.65%,测序序列与已报道的竹子丛枝病病原物竹针孢座囊菌的序列同源性为99.63%。
2.1. 早竹丛枝病的调查结果
2.2. 早竹丛枝病材料的总DNA提取结果
2.3. 早竹丛枝病植原体病原的分子鉴定
2.4. 早竹丛枝病真菌病原的rDNA-ITS序列扩增
2.5. PCR产物的纯化、克隆和序列分析
-
竹子丛枝病是广泛发生于亚洲东部竹产区的重要病害,早在20世纪初,日本学者就对其病原物进行研究,到目前已经鉴定的竹子病原菌有植原体、竹针孢座囊菌、竹暗球腔菌、竹异香柱菌等[9-10],并且这些病原菌还会以混合侵染的形式存在于某一竹种上。这不仅造成竹林经营中的产量损失,也会给竹子丛枝病病原物的鉴定、致病性研究、抗病育种、病害防治等科学研究带来困难。而本研究使用植原体16S rDNA和真菌rDNA-ITS序列特异性的引物对竹子丛枝病材料的病原菌进行分子鉴定,能够全面、准确地鉴定发病材料的病原菌。
植原体是一类能够引起1 000多种植物发病的病原细菌,而丛枝症状是植原体侵染时产生的典型症状之一,故植物出现丛枝症状,常被怀疑为植原体侵染。事实上,在中国、韩国、印度、日本等国均有植原体引起的竹子丛枝病的报道[17-20]。本研究在浙江省德清县万亩早竹林采集到28份表现丛枝症状的早竹材料,使用试剂盒提取总DNA。利用植原体检测时使用的引物进行植原体保守序列16S rDNA的扩增,检测样品中的植原体病原物。然而,作者只在感病的泡桐DNA样品(阳性对照)中扩增出了目的片段,在所有感染丛枝病的早竹样品中均没有扩增出目的片段,表明早竹丛枝病材料中不存在植原体,即本研究的早竹丛枝病不是由植原体引起。
细胞核DNA中的转录间隔区(Internal Transcribed Spacer,ITS)既具有保守性,又在科、属、种水平上具有特异性的自身优点;并且在基因库中存放有超过172 000条全长的真菌ITS序列,可以通过在线比对快速确定要鉴定物种的分类信息,故ITS广泛地用于单个真菌和环境中的真菌混合物的物种鉴定[21-22]。在本研究中,使用rDNA-ITS序列特异引物对ITS1-F/ ITS4进行扩增时,所有感病的早竹DNA样品均能够扩增出约600 bp的目的条带,而健康的早竹样品在该位置没有扩增出条带,只在约700 bp处出现一条较弱的杂带,该杂带可能由竹子内生菌污染造成。扩增出的目的条带克隆到载体pLB并进行测序、序列分析和在线比对,发现其与报道的竹针孢座囊菌的序列同源性为99.00%,确证早竹丛枝病的病原物为麦角菌科(Clavicipitaceae)的竹针孢座囊菌。竹针孢座囊菌的主要传播方式是分生孢子通过春雨传播[23-24],因此,可在其分生孢子散发之前铲除发病的竹株,防止病原菌的扩散和蔓延。
通过样方法对浙江省德清县的早竹进行丛枝病病害调查,6块样地18个样方的平均发病率为18.59%,平均病情指数6.67,表明调查的早竹林轻度发生丛枝病。本次的早竹丛枝病的调查结果与陈建寅等[5]和刘军等[25]的调查结果相比,浙江德清的早竹发病较轻,这可能与目前的早竹林地的经营方式有关。通过比较样方的病情指数与各样方感病株的平均病情指数,发现两者之间并不完全一致。样方的病情指数反映的是样方的感病水平,表现为样方的总体感病情况,其在调查统计时只考虑发病枝条的数量多少,而忽略了发病株不同枝条上的丛枝病的严重程度的差异性。而本研究依据竹丛枝病的病害表观症状的发展进行分级,对感病株的各盘枝条的发病程度进行逐一统计,并计算样方中感病株的病情指数,详细地记录病害在单株早竹上的严重程度。故两种病情分级的综合能够更全面地反映丛枝病在早竹上的危害状况和严重程度。
-
本研究采用细菌和真菌保守序列的PCR引物对早竹丛枝病的病原物进行分子鉴定,结果表明,早竹丛枝病的病原物为竹针孢座囊菌;通过对病害进行调查和统计分析,发现丛枝病在浙江德清集约经营林地的早竹上轻度危害,尚不会对生产经营造成重大的经济损失。本文研究结果可为早竹丛枝病的病害调查、诊断、防治以及防治效果的评价提供科学依据。







 DownLoad:
DownLoad:

