-
从全球来看,水分短缺一直是限制农林业发展的主要因素之一。土壤水分不仅决定了植物空间和时间的分布,也在植物种子萌发、形态形成、干物质积累、花芽分化等多种生长发育阶段起到决定性作用[1-2]。干旱条件下,植物的细胞、组织、器官都会受到不同程度的损伤,同时植物也会通过自身的生长策略和生理适应性来抵御干旱环境[3-5]。种子萌发阶段是植物生长发育的重要阶段,是植物成株的基础,同时也是极为脆弱的阶段[6]。种子在萌发的过程中,往往会受到外界环境的影响[7]。有研究发现,在干旱条件下,种子发芽率和发芽势均会降低[7-8]。持续高强度的干旱胁迫还会显著地抑制幼苗的生长[9-10],尤其是在干旱和半干旱地区,干旱已经成为阻碍种子萌发的主要因素[11-12]。因此,开展对种子萌发期及幼苗期抗旱特性的研究显得尤为重要。
毛竹(Phyllostachys edulis (Carrière) J. Houz.)隶属禾本科(Poaceae)刚竹属(Phyllostachys Sieb. et Zucc.),在我国分布广泛,是重要的竹子资源,具有适应性强、生长迅速、易繁殖、材性好等特点,同时毛竹还兼有材用、药用、食用、环保等多种功能,具有较高的经济价值和生态服务价值[13-14]。鉴于毛竹独特的繁殖和生长方式,国内外对毛竹的研究侧重于竹子的生长规律[15-17]以及毛竹的生长对生态环境的影响方面[18],毛竹种子萌发及幼苗对环境适应性方面的研究相对较少,仅限于光照[19-20]、温度[21]、重金属[22]、土壤肥力[23-24]等,而毛竹对水分的利用以及对干旱条件的适应性两个方面的研究相对匮乏。随着全球气候变化加剧,极端干旱事件发生越来越频繁,强度越来越大,对包括竹林在内的森林植物生长和更新带来严重挑战。因此,本试验以聚乙二醇(PEG-6000)作为水分胁迫剂,模拟不同程度的干旱胁迫,研究毛竹在种子萌发时期对不同程度干旱条件的生理响应,分析毛竹发育初期对干旱胁迫的响应机制,以期提高毛竹种子的萌发率、成苗率,为毛竹的水分管理提供科学依据。
HTML
-
毛竹种子于2016年9月采自广西壮族自治区桂林市灵川县。选取籽粒饱满,大小基本一致的种子,小心剥去颖壳备用,种子千粒质量为23.019 4±0.047 6 g。
-
随机选取优质的毛竹种子,在质量分数为3‰的KMnO4溶液中消毒10 min,无菌水冲洗8次,保证无消毒液残留,均匀平摊于干燥滤纸上自然风干表面水分。培养皿和滤纸使用前高温消毒20 min,试验设置6个处理,在培养皿加入10 mL浓度(质量分数)分别为5%、10%、15%、20%,25%的PEG-6000溶液,以等量的蒸馏水作为对照,每个培养皿中垫4层滤纸作为发芽床,将供试种子均匀排放于发芽床中,每皿100粒,重复3次。去盖后准确称量培养皿质量,加盖放置于25℃、相对湿度60%的人工气候箱中进行暗培养,每天定时观察统计种子的萌发数以及胚根长度(萌发标准为胚根达到种子长度的1/2)并称量培养皿质量,每日测定完毕加入损失质量的无菌水,每4 d更换一次发芽床。2 d内无种子发芽视为发芽结束,计算各项发芽指标:发芽率(GP)=(发芽种子数/供试种子数)×100%;发芽势(GE)=(发芽过程中日发芽种子数达到高峰时的发芽数/供试种子数)×100%;发芽指数(GI)=∑(Gt/Dt),其中,Gt为第t天的种子发芽数,Dt为发芽天数;活力指数(VI)=GP×(LR + LS),其中,LR为幼苗胚根平均长(cm),LR=(测量当日所有发芽种子胚根长的总和/测量当日发芽种子总数),LS为幼苗胚芽平均长(cm),LS=(测量当日所有发芽种子胚芽长的总和/测量当日发芽种子总数)。
耐旱临界值与极限值:首先对关键指标和PEG胁迫浓度进行相关性分析,若存在相关性,则进行回归分析,根据回归方程利用单变量求解出耐旱临界值与极限值。耐旱临界值与极限值分别为与干旱胁迫强度呈负相关的指标降低到对照的50%、25%时所对应的浓度[25-26]。
-
发芽试验结束后,随机抽取部分幼苗的胚根,对胚根中的保护酶活性、渗透调节物质含量等指标进行测定,试验重复3次。
超氧化物歧化酶(SOD)活性采用氮蓝四唑法(NBT法)测定;超氧化物酶(POD)活性采用愈创木酚法测定;过氧化氢酶(CAT)活性采用紫外吸收法测定;丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法测定;可溶性蛋白含量(SPC)采用考马斯亮蓝染色法测定[27]。
-
发芽率、生长量以及生理等指标用SPSS 17.0进行单因素和双因素方差分析(ANOVA),并对所有指标进行相关性分析。运用Origin 9和Excel 2003程序进行图表绘制。图表中显示数据均为所有重复的平均值和标准差。
1.1. 试验材料
1.2. 试验方法
1.2.1. 种子萌发试验
1.2.2. 生理指标的测定
1.3. 数据分析
-
毛竹种子萌发试验显示:所有处理在试验开始后3 d内均无发芽。在第4天时,对照组(CK)和5%处理组开始发芽,其余各处理组的发芽起始时间随处理浓度的升高逐渐延迟,10%处理组、15%处理组和20%处理组发芽起始时间分别为5、7、11 d,而25%处理组不发芽。由图 1可以看出:最终发芽率在PEG浓度为5%时达到最大(51.33%),且显著大于对照组,随着浓度的不断升高, 发芽率迅速降低,且均显著小于对照组(P<0.05)。另外,对照组和5%处理组的发芽率随时间变化曲线存在唯一交叉点,出现在9~10 d之间,在第9天之前对照组发芽率显著大于5%处理组。单因素方差分析结果显示:浓度间的最终发芽率差异显著(F=89.158;P<0.01)。另外,毛竹种子发芽率与PEG浓度呈显著负相关(P<0.05)。由回归方程得出毛竹种子在PEG胁迫下的萌发临界值和极限值分别为14.49%和19.27%(表 1)。
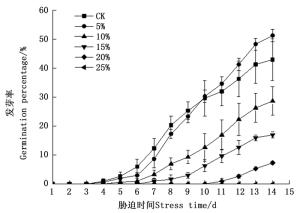
Figure 1. The daily germination percentage of Ph. edulis seeds under different concentration of PEG stress
指标Indicators 回归方程Regression equation 相关系数R2 临界值Critical value/% 极限值Maximum value/% GP y=-0.000 2x2-0.015 8x+0.486 1 0.909 0 14.49 19.27 Lr y=-0.007 4x2+0.083 7x+2.616 4 0.923 7 20.43 23.01 Ls y=-0.001 8x2+0.019 0x+0.658 8 0.974 1 20.05 22.79 Table 1. The regression analysis of the indicators of seed germination and growth
-
由表 2可知:毛竹种子发芽指数随处理浓度的升高呈现先上升后下降的趋势。5%处理组发芽指数最大(24.08),但5%处理组和对照组间差异不显著(P=0.990),5%处理组和对照组的发芽指数显著大于其它处理组,20%处理组和25%处理组间差异不显著(P=0.464),其余各处理组间差异显著(P<0.05)。
PEG浓度
PEG concentration/%发芽率
Germination percentage/%发芽指数
Germination index发芽势
Germination energy/%活力指数
Vigor index0 43.00±7.211b 24.06±4.305a 41.33±6.506b 75.72±24.195b 5 51.33±2.082a 24.08±0.582a 48.33±2.082a 98.89±2.695a 10 28.67±4.933c 11.43±2.073b 26.33±5.033c 33.85±11.71c 15 17.00±1.000d 5.70±1.157c 16.00±1.000d 17.55±5.574cd 20 7.33±0.577e 1.25±0.137e 5.33±0.577e 2.35±0.04d 25 0f 0e 0e 0d 注:同列数据后不同小写字母代表各处理之间在P<0.05水平上差异显著,下同。
Note: Different lowercase letters in each column show significant difference among different PEG concentrations at P<0.05, the same below.Table 2. The seed germination index, germination energy and vigor index of Ph. edulis under different concentration of PEG stress
各处理组第13天的发芽势随浓度升高呈现先上升后下降的趋势,5%处理组的发芽势(48.33%)显著大于其它处理组(P<0.05),随后发芽势随浓度升高逐渐减小,且显著小于对照组(41.33%)。20%处理组和25%处理组差异不显著(P=0.086),其余处理组间差异显著(P<0.05)。
由表 2可知:各处理组种子的活力指数随浓度的增加呈现先升高后下降的趋势,5%处理组活力指数显著大于其它处理组(P<0.05),对照组显著大于其余4个处理组(P<0.05)。10%处理组之后种子活力指数迅速降低,10%处理组下降幅度最大,达到55.04,在15%处理组以后种子活力虽逐渐下降,但差异不显著。
-
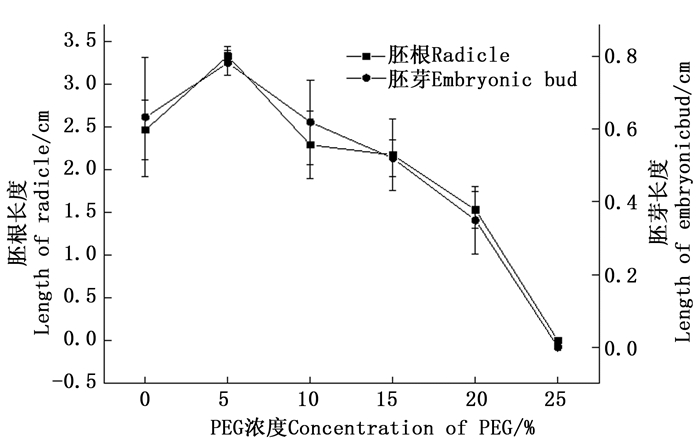
不同干旱条件下毛竹胚根长度日变化见图 2。在不同浓度PEG胁迫下,发芽试验结束时胚根平均长度差异显著(F=12.335;P=0.001),并随浓度的不断升高而呈现先增大后减小的趋势。5%处理组的胚根平均长度最大(3.33 cm),并显著大于其它处理组(P<0.05),20%处理组胚根平均长度(1.53 cm)显著小于其它处理组。对照组(2.46 cm)、10%处理组(2.29 cm)和15%处理组(2.17 cm)的胚根平均长度虽逐渐减小,但彼此间差异不显著。另外,从整个胚根生长过程看,对照组和5%处理组的胚根平均长度日变化曲线存在交叉点,出现在89 d之间,在此之前对照组胚根平均长度始终大于5%处理组。
不同浓度PEG胁迫下毛竹胚根和胚芽平均长度见图 3。由图 3看出:发芽试验结束时胚芽的平均长随浓度的不断升高呈先增大后减小的趋势。5%处理组的胚芽平均长度最大(0.78 cm),对照组的(0.63 cm)次之,随后的10%处理组、15%处理组和20%处理组胚芽平均长逐渐减小。单因素方差分析显示:浓度间差异显著(F=27.779;P<0.05)。相关性分析显示,胚芽和胚根平均长度具显著正相关(表 3)。另外,毛竹种子胚根和胚芽生长与PEG浓度呈显著负相关(P<0.05),由回归方程得出胚根在PEG胁迫下的生长临界值和极限值分别为20.43%和23.01%,胚芽生长的临界值为20.05%和22.79%(表 1)。
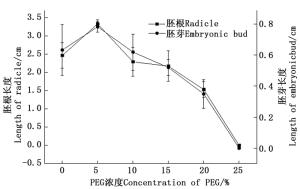
Figure 3. The radicle lengths and embryonic bud lengths of Ph. edulis seeds under different concentration of PEG stress
项目Item GP VI GI GE LR LS SOD POD CAT MDA SPC GP 1 VI 0.978** 1 GI 0.980** 0.975** 1 GE 0.997** 0.979** 0.983** 1 LR 0.807** 0.824** 0.743** 0.810** 1 LS 0.866** 0.874** 0.831** 0.882** 0.836** 1 SOD 0.852** 0.788** 0.759** 0.842** 0.819** 0.830** 1 POD 0.198 0.102 0.034 0.186 0.367 0.391 0.558* 1 CAT 0.594* 0.446 0.495 0.583** 0.387 0.552** 0.685** 0.681** 1 MDA -0.900** -0.816** -0.873** -0.905** -0.740** -0.812** -0.843** -0.322 -0.708** 1 SPC -0.886** -0.849** -0.933** -0.886** -0.497 -0.638* -0.627* 0.146 -0.491 0.815** 1 注:**表示相关性在P < 0.01水平上显著,*表示相关性在P < 0.05水平上显著。
Note: ** Correlation is significant at the 0.01 level, * correlation is significant at the 0.05 level.Table 3. Analysis of Pearson correlation
-
植物的抗氧化酶系统包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等。由表 4可知:3种抗氧化酶活性随PEG浓度的不断升高呈现先上升后下降的趋势,但3种酶活性达到峰值的浓度不同。5%处理组的SOD活性最大,且显著大于其它处理组(P<0.05),另外10%处理组>对照组>15%处理组>20%处理组,但对照组与10%处理组和15%处理间差异不显著。20%处理组SOD活性最低(1 861.64 U·g-1),且显著小于其它处理组(P<0.05)。POD活性随浓度的升高逐渐增大,10%处理组POD活性最大(13 066.67 U·g-1),此后随浓度的升高POD活性逐渐降低,且显著小于5%处理组,但均大于对照组;单因素方差分析显示,除对照组和20%处理组外(P =0.053),其余处理间差异显著(P<0.05)。CAT活性随浓度的升高逐渐增大,10%处理组CAT活性最大(1 511.11 U·g-1);之后随浓度不断升高逐渐降低,20%处理组CAT活性最小(933.33 U·g-1)。单因素方差分析显示,10%处理组和5%处理组间以及5%处理组和对照组间差异不显著,20%处理组与15%处理组差异不显著(P=0.145),但与其它各处理间差异显著。相关性分析显示,3种抗氧化酶活性间具有显著的相关性。
PEG浓度
PEG concentration/%SOD活性
SOD activity/(U·g-1)POD活性
POD activity/(U·g-1)CAT活性
CAT activity/(U·g-1)MDA含量
MDA content/(nmol·g-1)可溶性蛋白含量
Soluble protein content/(mg·g-1)0 3 203.35±161.74b 8 488.89±384.90d 1 244.44±76.98b 38.37±3.51c 1.508±0.077d 5 4 343.62±176.70a 11 822.00±335.55b 1 377.78±203.67ab 42.04±6.13c 1.812±0.091c 10 3 538.78±203.34b 13 066.67±581.19a 1 511.11±76.98a 51.84±8.96c 2.236±0.102b 15 2 884.70±248.20b 10 444.44±468.25c 1 111.11±153.96bc 79.73±4.94b 2.508±0.098a 20 1 861.64±201.26d 9 288.89±428.61d 933.33±133.33c 120.94±7.05a 2.614±0.118a 25 — — — — — Table 4. Activities of antioxidant enzymes and contents of soluble protein and MDA in Ph. edulis radicle under different concentration of PEG stress
可溶性蛋白是植物组织中重要的渗透调节物质。由表 4可知:可溶性蛋白含量(SPC)随PEG浓度的增加呈现逐渐升高的趋势,10%处理组SPC增幅最大,随后增幅逐渐减小,且15%处理组和20%处理组间差异不显著(P=0.215),其余各处理组间差异显著(P<0.05)。
丙二醛(MDA)是植物细胞膜系统过氧化程度的指示物。由表 4可知:MDA含量随PEG浓度的增加呈现逐渐增大的趋势,20%处理组MDA含量最大(120.94 nmol·g-1)。从对照组至10%处理组3个处理间MDA含量增幅较小,彼此间差异不显著,但随PEG浓度的不断提高,MDA含量显著增大,10%处理组、15%处理组和20%处理组3个处理间差异显著(P<0.05),20%处理组MDA含量增幅最大,达到41.21 nmol·g-1。
2.1. 干旱胁迫对毛竹种子萌发的影响
2.2. 干旱胁迫对毛竹种子发芽指数、发芽势及活力指数的影响
2.3. 干旱胁迫对毛竹胚根、胚芽生长的影响
2.4. 干旱胁迫对毛竹胚根中抗氧化酶活性活性及MDA、可溶性蛋白含量的影响
-
水分在种子萌发的过程中起到决定性的作用,它直接参与种子的吸水膨胀、胚萌发等一系列生理生化过程。高强度的干旱胁迫会显著降低种子活力、发芽率[28-29]以及发芽势[30]。本研究的结果表明,在低浓度PEG(5%浓度)胁迫下,毛竹种子发芽率显著升高,而随PEG浓度的不断升高,发芽率迅速降低,且浓度间差异显著。这说明低浓度PEG促进了毛竹种子的萌发,而在高浓度PEG胁迫下种子萌发受到抑制。这种现象在其它树种的干旱胁迫试验中大量出现[30-31]; 但与前人的研究结果不同的是,本研究通过观察干旱胁迫下毛竹种子发芽率日变化曲线发现,对照组和5%处理组两条曲线之间存在唯一交叉点,即在交叉点之前对照组中种子的平均发芽率始终大于5%处理组,而在发芽试验第10天时被5%处理组超越。这表明低浓度PEG干旱胁迫延迟毛竹种子发芽,降低发芽前期的发芽率,但有效提高了毛竹种子的最终发芽率; 而高浓度PEG干旱胁迫延迟毛竹种子发芽; 降低整个发芽时期的发芽率。低浓度干旱胁迫激活种子内部抗性机制,以度过干旱环境,而经过逆境锻炼的种子细胞中原生质浓度发生变化,提高了种子吸水能力,这可能最终影响种子的发芽率[32-34]。因此, 生产中可用低浓度PEG干旱处理毛竹种子来提高发芽率。
-
植物根系具有支撑、锚固植物体、吸收生长介质中营养和水分、维持种群繁衍等功能的关键器官。根系的生长发育直接影响植物的生长量,而胚芽的生长则直接反应了植物幼苗时期的生长速度[25]。有研究表明,低浓度PEG胁迫可促进胚根的生长,而高浓度则显著抑制了胚根的生长[25, 31]。在本研究中,胚根平均长度在5%浓度PEG胁迫下达到最大,随PEG浓度的不断升高, 胚根长度逐渐降低。通过观察胚根生长的日变化曲线可以发现,对照组和5%处理组两条曲线同样存在唯一交叉点。这种类似于发芽率曲线的现象说明,低浓度PEG抑制了发芽早期胚根的形成,却促进了后期胚根的生长。这可能是由于轻度干旱胁迫使同化物大量地向根部转运的结果。在本研究中, 5%浓度PEG胁迫下, 胚芽长度显著大于对照组,但随浓度的不断升高胚芽长度迅速减小,说明低浓度干旱胁迫促进了胚芽的生长,而高浓度干旱胁迫抑制胚芽的生长。另外,根据耐旱临界值的比较分析可以发现,相对于胚根胚芽的生长种子萌发对干旱胁迫更敏感,这与前人的研究结果不同[35]。结合胚根生长与保护酶活性的相关性分析结果,这可能是由于经受适当干旱锻炼后萌发的种子,其胚根中的SOD活性显著升高,提升了保护酶系统对羟自由基的清除能力,从而提高了对水分胁迫的适应能力[36]。
-
干旱胁迫下,植物体内产生大量的氧自由基,从而使抗氧化酶系统发生变化。抗氧化酶系统包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等[4, 20]。植物通过SOD将组织中的O2-转化为H2O2和O2,再由POD、CAT两种酶将H2O2转化成H2O和O2,从而有效地降低自由基对植物体的伤害[37]。有研究表明, 3种酶的活性与干旱胁迫的程度以及胁迫时间密切相关[38-39]。在本研究中,3种抗氧化酶活性随PEG浓度的不断升高均呈现先上升后下降的趋势。低浓度PEG胁迫下,植物通过提高3种酶的活性来清除组织中大量产生的氧自由基; 但随PEG浓度的不断升高,SOD、POD和CAT 3种酶相继达到自身的忍耐限度,活性迅速降低。SOD活性在5%浓度时达到峰值,而POD和CAT则在10%浓度时达到峰值。这说明相对于POD和CAT,SOD对干旱胁迫更敏感[40]。
渗透调节是植物适应干旱胁迫的重要策略,增加可溶性蛋白的合成是渗透调节的重要途径之一[4, 41]。本研究中,胚根中可溶性蛋白含量随PEG浓度的升高而升高,但15%、20%两个浓度之间差异不显著。这说明低强度干旱胁迫促进了蛋白质的合成,但高浓度PEG也促进了可溶性蛋白的降解。在低强度干旱胁迫下,蛋白质的合成得到促进,降低了细胞渗透势,提高了胚根的水分利用效率,从而也促进了胚根胚芽的生长[42]。但在高浓度时,干旱胁迫达到了胚根生长的极限,蛋白合成酶钝化,代谢受阻,蛋白质分解加剧,致使含量迅速下降,渗透势升高,胚根的生长受到抑制[30]。
丙二醛(MDA)是膜脂过氧化的主要副产物,通常被作为植物细胞膜损伤程度的指示物[4, 40]。有研究表明,植物组织中MDA含量与干旱胁迫程度密切相关,并且随干旱胁迫的加剧而持续上升[43-44]。本研究的结果显示,毛竹胚根中MDA含量随PEG浓度的升高而不断升高,但在对照组、5%处理组和10%处理组间的差异不显著。这说明在PEG浓度小于10%时对胚根膜系统的伤害并不显著;而随浓度的升高MDA含量也迅速升高,差异显著。说明在PEG浓度大于15%后,胚根膜系统受到了严重损伤。相关性分析结果显示,MDA含量与SOD、CAT活性以及胚根胚芽长呈显著负相关,这也进一步印证了抗氧化酶活性的降低打破了植物组织内部O2-的动态平衡,使植物组织的膜系统过氧化产生大量的MDA,从而抑制了植物幼苗的生长发育。
3.1. 干旱胁迫对毛竹种子萌发的影响
3.2. 干旱胁迫对毛竹种子胚根、胚芽生长的影响
3.3. 干旱胁迫对毛竹胚根生理指标的影响
-
本文研究表明,低浓度PEG干旱胁迫抑制发芽前期毛竹种子萌发以及胚根的形成,但显著提高毛竹种子的最终发芽率并促进胚根后期的生长;而高浓度PEG干旱胁迫延迟毛竹发芽,降低整个发芽时期的发芽率以及幼苗的生长。相对于胚根胚芽的生长,种子萌发对干旱胁迫更敏感。PEG浓度高于15%的干旱胁迫使毛竹的抗氧化酶系统发生紊乱,并对组织膜系统造成显著伤害。由于植物在其生活史的不同阶段对干旱环境的适应性存在差异,因此,在后续的试验中将进一步研究毛竹其它生长阶段对干旱环境的适应情况。







 DownLoad:
DownLoad: