-
松材线虫病(Pine wilt disease)的病原为松材线虫Bursaphelenchus xylophilus (Steiner and Buhrer) Nickle (Nematoda: Aphelenchoididae),在中国其主要传播媒介昆虫为松墨天牛Monochamus alternatus Hope,主要危害马尾松(Pinus massoniana Lamb.)、黑松(P. thunbergii Parl.)、赤松(P. densiflora Sieb. et Zucc.)等植物。感染松材线虫后,寄主植物的针叶会由绿变黄,继而变萎蔫、红褐色,23个月即可导致整株树死亡[1]。松材线虫病是国际上公认重要的植物检疫林木病害,我国自1982年秋季在江苏省南京市中山陵首次发现以来,其危害面积不断扩大。截止到2017年初,松材线虫病疫情已经扩散到我国16个省(自治区)的247个县(市、区)[2],其中仅2016年就新添加了45个松材线虫病新的发生县级行政区,对我国生态环境和森林资源带来严重的威胁和破坏[3-7],已经被我国列入了对内、对外重要的森林植物检疫对象[8]。
绿色植物的光合作用是其自身利用光能同化二氧化碳和水,制造有机物质并释放氧气[9],它是受外界环境条件和内部机理S结构限制的复杂的生物、物理、化学过程,同时也是生物固碳、森林生态系统能量流动和物质循环的基础[10-12]。马尾松是我国南方19个省区荒山造林绿化的先锋树种和主要工业用材树种[13]。入侵健康马尾松树后,松材线虫种群密度在短时间内会急剧增加,从而导致寄主松树的木质部和管胞功能紊乱,阻止树体内部液流上升和水分的运输,影响植物根部与上部组织所必需的营养物质和水分的运输与交换。总体而言,松材线虫入侵对健康寄主松树光合作用有以下两种影响:1)直接影响:由于寄主针叶水分缺失,直接影响参加光合反应的细胞结构和酶活性;2)间接影响:松材线虫入侵健康寄主松树后,由于种群数量在短时间内急剧增加,会导致植物器官及组织生理生化功能紊乱,从而间接影响寄主松树的光合作用[14]。先前亦有文献报道,寄主松树感染松材线虫病后其光合特性及相应的光合生理参数会发生快速、敏感、显著地变化[15-17]。Woo等人研究报道,韩国赤松幼苗人工接种松材线虫10天后,赤松幼苗的瞬时净光合速率和蒸腾速率均显著下降[18]。
绿色植物光合作用的光响应曲线是研究植物光合生理过程对外界环境响应的基础[19-20],它描述的是植物净光合速率和外界光照辐射之间的关系,可反映在一定生物或非生物干扰刺激条件下,绿色植物对外界生长环境的适应性和自身潜在的光合能力[21]。通过该曲线也可以求出植物的最大净光合速率、光饱和点、光补偿点和暗呼吸速率等光合指标[22],反映绿色植物在特定环境条件下的光合生理特性及光合能力大小的情况。此外,绿色植物叶片的δ13C是反映植物与外界环境因素相互关系的重要指标[23-24],其可表征绿色植物叶片的长期水分利用效率[25-30]。
目前国内外针对松材线虫病进行了大量、深入的研究,但是针对于感病寄主松树光合特性的研究相对较少且不全面[14-18]。本研究将测定感染松材线虫病不同感病阶段马尾松光合特性、光合响应曲线及针叶碳氮元素含量的变化情况,旨在分析松材线虫入侵对马尾松树光合特性的影响,以期在光合生理水平上提供松材线虫病的早期快速诊断技术,为林业管理者对感染松材线虫病寄主的马尾松采取快速防治措施提供科学的理论依据。
HTML
-
试验地位于湖北省宜昌市夷陵区,地理坐标为30°32′31°28′N和110°51′111°39′E,年均气温为16.6℃,年均降水量在9971 370 mm之间。夷陵区于2006年首次发现松材线虫病的危害,当年全区有29 110株马尾松感病而死。随后几年,区内松材线虫病危害程度一直高居不下,在2013年松材线虫病又达到了一个大的爆发时期。
-
根据寄主松树感染松材线虫病之后的外部症状(松针颜色、树脂分泌),内部机构变化(细胞、边材液流)以及松材线虫分离情况,将研究区域内感染松材线虫病的马尾松树分为6个阶段[11, 14, 31],分别为:健康期、感病初期、感病早期、感病中期、感病重期和感病末期。
-
根据松材线虫病害分级标准,本研究选取健康期、感病中期和感病末期的马尾松为研究对象,每个感病阶段分别选取3株胸径在15 cm左右的马尾松树(表 1),于2014年7―8月晴朗无云的天气时,利用LI-6400XT便携式光合测定仪(LI-COR Biosciences, Lincoln, NE, U.S.A.)及自身携带的LI-6400-2B LED红蓝光源叶室对其进行光合特性测定。测量时,每株马尾松随机测定3个枝条,每个枝条设置3个重复,结果取其平均值,所测量的结果表示单位面积马尾松针叶的光合生理指标。此外,测量时要尽可能保持马尾松针叶自然生长状态,将马尾松针叶并排排满红蓝光源叶室,针叶之间不留任何缝隙,所测叶片的有效面积即为LI-6400-2B红蓝光源叶室的面积。
感病阶段
Infection phase胸径
DBH/cm树高
Tree height/m树龄
Tree age/a健康期Control 14.5 8.5 22 15.1 8.8 20 16.0 9.1 25 感病中期Middle phase 13.5 8.1 21 17.1 8.9 26 15.0 8.3 23 感病末期Terminal phase 17.6 10.8 32 18.7 9.8 28 15.4 10.1 24 Table 1. Selected Masson pine sample trees for the measurement of photosynthetic characteristics
测量马尾松光合特性日变化指标时,采用开放气路,以大气中的CO2为气源,使用2.5 L自制缓冲瓶从而保持CO2浓度处于相对稳定状态。测量时,每天7:00—19:00进行马尾松光合测定,每隔2 h测定1次。光合测定参数包括叶片净光合速率Pn、细胞间CO2浓度Ci、蒸腾速率Tr、气孔导度Gs等光合因子。
测量马尾松光合响应曲线时,采用开放气路,手动设置光量子通量密度(由强到弱)为:2 000,1 700,1 500,1 200,1 000,900,700,500,600,200,150,100,50,20,0 μmol m-2s-1。为了保持测定过程中其它环境因子的稳定,设定叶室温度为25℃,空气相对湿度为60%,利用CO2注入系统设定CO2浓度为400 μmol mol-1。每个测量之间设置120~200 s的等待时间,当所测叶片净光合速率稳定时,开始测量。
-
测量完马尾松光合响应曲线后,立即采集所测枝条所有针叶,装入密封袋中,按顺序编号、记录,并将其带回实验室内放置于75℃恒温烘箱内烘干至恒质量,粉碎、研磨至大约1 μm粒径,采用稳定同位素质谱仪(IsoPrime100, IsoPrime Corporation, Manchester, UK)测定样品的C%、N%和δ13C含量。其中,δ13C含量测量公式如下:
式中,Rsample为所测针叶样品13C/12C的比值,Rstandard为国际通用碳同位素标准物质PDB(Pee Dee Belemnite,一种碳酸盐陨石)13C/12C的比值。
-
本研究采用叶子飘构建的植物光合作用光响应“直角双曲线修改模型”[32]来拟合处理光合响应曲线,并根据所测得光合响应曲线计算马尾松树针叶的最大净光合速率(Pmax)、光补偿点(LCP)和光饱和点(LSP),计算公式如下:
1.直角双曲线修改模型:
2.最大净光合速率:
3.光补偿点:
4.光饱和点:
式中,α为光合响应曲线的初始量子效率,β为曲线的修正系数,γ为光合响应曲线的初始斜率与植物最大光合速率之比,PAR为光量子通量密度(μmol·m-2·s-1),Pn为对应光合有效辐射条件下的净光合速率值(μmol·m-2·s-1),Rd为暗呼吸速率(μmol·m-2·s-1)。
-
在SPSS系统中,采用单因素方差分析(ANOVA)和最小显著差法(LSD)相结合,分析感染松材线虫病不同阶段马尾松光合响应指标的变化及差异情况。当P < 0.05时,定义两个变量之间差异达到显著水平;当P < 0.01时,定义两个变量之间差异达到极显著水平。数据的统计分析与作图采用Microsoft Excel 2010、SPSS 22.0和Graphpad Prism 6.0软件来完成。
1.1. 试验样地概况
1.2. 松材线虫病害分级标准
1.3. 马尾松光合特性日变化及光合响应曲线测定
1.4. 马尾松针叶碳、氮元素测定
1.5. 光合响应曲线拟合及光合相应指标计算
1.6. 数据的检验和统计
-
由图 1可知,健康马尾松净光合速率的日变化趋势表现出明显的“双峰”曲线,即在11:00和15:00时,马尾松净光合速率出现“峰值”,在13:00时,马尾松的净光合速率值短暂下降。感病中期马尾松净光合速率的日变化趋势呈现出“单峰”曲线,净光合速率明显下降,在13:00左右出现最大值,其余各个时间点净光合速率值均低于健康期马尾松对应值。感病末期马尾松净光合速率在各个时间点时均小于0 μmol·m-2·s-1,说明此阶段光合速率要小于呼吸速率;此外,该阶段马尾松针叶净光合速率的日变化趋于直线,与健康期和感病中期马尾松对应时间点净光合速率值之间的差异也达到了极显著水平(P < 0.01)。
-
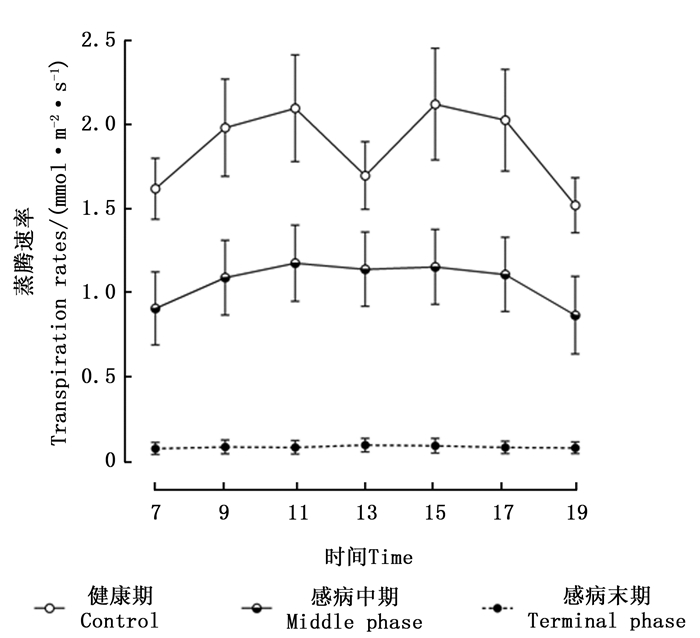
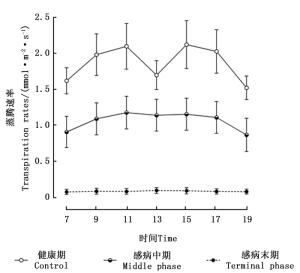
由感染松材线虫病不同阶段马尾松针叶蒸腾速率的日变化(图 2)可知,健康期马尾松蒸腾速率的日变化趋势呈现出“双峰”变化曲线,在11:00和15:00左右时分别出现“峰值”。处于感病中期的马尾松,其蒸腾速率变化呈现出“单峰”曲线,7:00—9:00时蒸腾速率缓慢增加,在13:00左右达到峰值,随后其蒸腾速率的数值开始逐渐降低。感病末期的马尾松,其蒸腾速率日变化趋势不明显,各个时间点的蒸腾速率值接近于0 mmol· m-2·s-1,与其他2个感病阶段马尾松对应数值之间的差异均达到了极显著水平(P < 0.01)。
-
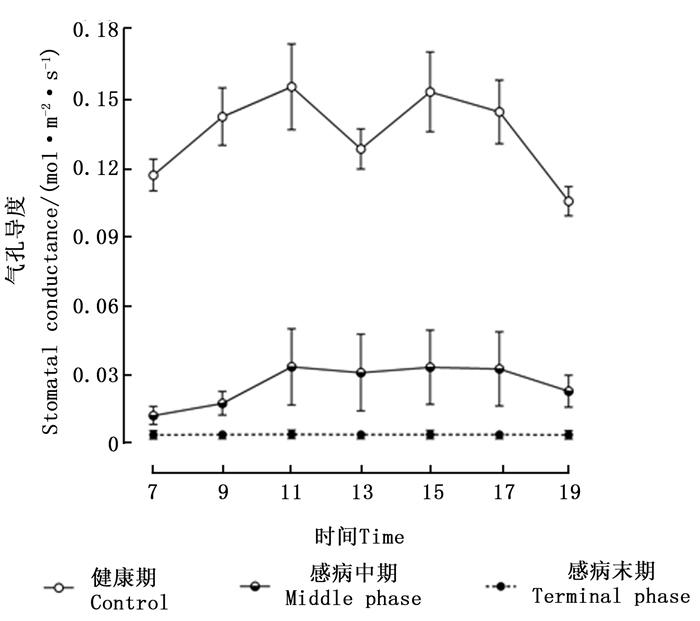
由图 3可知,松材线虫病危害健康马尾松树后,可导致其针叶气孔导度急剧下降,且不同感病阶段对应数值之间的差异均达到极显著水平(P < 0.01)。处于健康期的马尾松树针叶的气孔导度日变化呈现出“双峰”变化曲线。处于感病中期的马尾松树,气孔导度值在7:00时,几乎为0 mol·m-2·s-1,在7:00—9:00时呈现增加趋势,11:00—17:00时,气孔导度值保持平稳,其数值大约为0.035 mol·m-2·s-1,17:00时后其值逐渐下降。处于感病末期的马尾松树,气孔导度的日变化不明显,各时间点的气孔导度数值几乎均为0 mol·m-2·s-1。
-
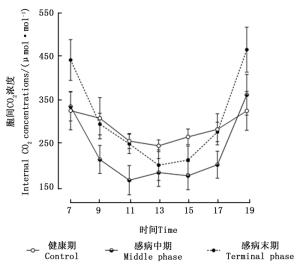
由图 4可知,感染松材线虫病不同阶段马尾松针叶细胞间CO2浓度的日变化曲线表现出较大的差异。健康马尾松针叶细胞间CO2浓度的日变化趋势呈现出“V”型曲线,即在7:00时细胞间CO2浓度较高,7:00—13:00时细胞间CO2浓度变化曲线呈现下降的趋势,并在13:00左右时达到最低值,随后胞间CO2浓度的变化曲线呈现升高趋势,并在19:00左右时达到最大值。随着松材线虫病危害程度的增加,感病中期马尾松细胞间CO2浓度的日变化曲线呈现出不同程度的下降,在9:00—11:00和15:00—17:00时,其与健康期对应数值之间的差异均达到了极显著水平(P < 0.01)。处于感病末期马尾松的日变化为先下降后升高,最低值同样出现在13:00左右,但变化幅度大于健康期。
-
图 5为感染松材线虫病不同阶段马尾松树的光合响应曲线变化图。由图可知,当光量子通量密度为0~50 μmol·m-2·s-1时,不同感病阶段马尾松树的净光合速率数值之间的差异不明显;当光量子通量密度在50~2 000 μmol·m-2·s-1时,处于感病中期和感病末期马尾松的净光合速率的数值显著低于健康期马尾松对应光照强度的数值(P < 0.05),且处于感病末期马尾松在各个光量子通量密度下其净光合速率数值均小于0 μmol· m-2·s-1。
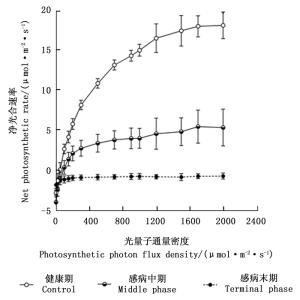
Figure 5. Changes in photosynthetic response curves in Masson pine trees foliage among different phases of pine wilt disease infected Masson pine across the PPFD levels.
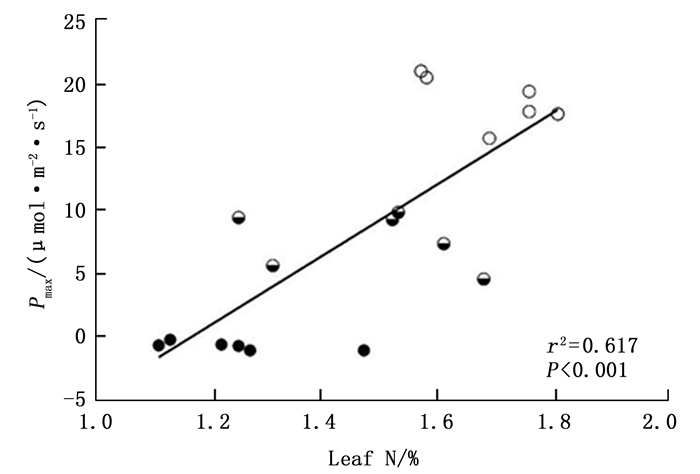
由表 2可知,感染松材线虫病不同阶段马尾松的最大净光合速率数值之间的差异到达到极显著水平(F=190.07,P < 0.01),其中,建康期马尾松树的最大净光合速率为18.71 μmol·m-2·s-1,感病中期和感病末期最大净光合速率分别为7.73 μmol·m-2·s-1和-0.66 μmol·m-2·s-1。不同感病阶段马尾松的最大净光合速率与叶片N%之间呈现极显著的正相关性(图 6, Adj.r2=0.617, P < 0.001),说明感病马尾松针叶最大净光合速率数值的降低可能与马尾松针叶N%下降有关。此外,不同感病阶段马尾松的暗呼吸速率数值之间的差异也达到极显著水平(F=146.459,P < 0.01),其数值的大小表现为:感病中期(3.99 μmol·m-2·s-1)>健康期(2.81 μmol·m-2·s-1)>感病末期(3.99 μmol·m-2·s-1)。健康期马尾松的光补偿点为59.33 μmol·m-2·s-1,显著低于感病中期的光补偿点82.00 μmol·m-2·s-1,但是其光饱和点1 202.67μmol·m-2·s-1显著高感病中期的光饱和点431.33 μmol·m-2·s-1。
光合指标
Photosynthetic variables健康期
Control感病中期
Middle phase感病末期
Terminal phase最大净光合速率Maximum net photosynthetic rate/(μmol·m-2·s-1) 18.71±1.99a 7.73±2.21b -0.66±0.32c 暗呼吸速率Dark respiration rate/(μmol·m-2·s-1) 2.81±0.52a 3.99±0.87b 1.85±0.67c 光补偿点Light compensating points/(μmol·m-2·s-1) 59.33±7.77a 82.00±17.84b 光饱和点Light saturation points/(μmol·m-2·s-1) 1 202.67±299.13a 431.33±207.84b 表中同行不同小写字母分别表示差异显著(P < 0.05). Table 2. Photosynthetic characteristics for foliage on intact branches of Masson pine trees among different phases of pine wilt disease infected Masson pine trees
-
分析感染松材线虫病不同阶段马尾松针叶的碳氮含量可知(表 3),不同感病阶段马尾松针叶的平均碳素含量比较稳定,约为51.50%左右。与之相反,不同感病阶段马尾松针叶的平均氮素含量变化较大,其数值之间的差异达到极显著水平(F=16.74,P < 0.01);与健康期马尾松树相比,感病中期和感病末期针叶的氮素损失量分别大约为12.94%和27.06%左右。随着松材线虫病危害程度的增加,马尾松针叶C:N的比值也呈现升高趋势,且不同感病阶段间其值的组间差异达到了极显著水平(F=14.114,P < 0.01)。此外,处于健康期马尾松针叶的δ13C含量约为-25.27‰,感病中期和感病末期马尾松针叶δ13C含量约为-27.75‰,针叶δ13C损失量约为2.5‰左右。
养分含量
Nutrient content健康期
Control感病中期
Middle phase感病末期
Terminal phaseCmass/% 51.52±0.95a 51.82±0.68a 51.41±0.78a Nmass/% 1.70±0.11a 1.48±0.17b 1.24±0.13c C:N 30.50±2.16a 35.32±4.18b 41.77±4.32c δ13C/‰ -25.27±0.63a -27.69±0.56b -27.83±0.50b 表中同行不同小写字母分别表示差异显著(P < 0.05). Table 3. Nutrient content and isotope abundance for foliage on intact branches of Masson pine trees among different phases of pine wilt disease infected Masson pine trees
2.1. 马尾松净光合速率的日变化
2.2. 马尾松蒸腾速率的日变化
2.3. 马尾松气孔导度的日变化
2.4. 马尾松细胞间CO2浓度的日变化
2.5. 马尾松光合响应曲线及主要光合相应指标
2.6. 马尾松针叶碳、氮及δ13C含量
-
在外界环境因素的干扰刺激下,绿色植物的光合特性可以做出快速、敏感的反应[16-17]。分析感染松材线虫病不同阶段马尾松光合指标日变化情况可知,松材线虫入侵健康马尾松后,可导致其针叶的净光合速率、细胞间CO2浓度、蒸腾速率和气孔导度等相关光合因子发生显著变化。造成这一变化的主要原因为:健康的寄主松树感染松材线虫病后,病原线虫可以导致寄主松树的木质部和管胞功能紊乱,阻止树体内部液流上升和水分的运输[14]。当寄主松树冠部组织得不到所需水分时,可导致叶肉细胞脱水,致使针叶表面的气孔部分或者全部关闭,减少了叶肉细胞内部与外界水分和CO2的交换[16-17],从而导致针叶光合作用受到不同程度的影响,光合指标的数值也呈现不同程度下降。此外,感病马尾松针叶内水分的缺失,可导致叶肉细胞内与光合作用相关的二磷酸羧化酶和与卡尔文循环相关的关键酶活性失活,这也是导致寄主松树光合能力显著下降的主要原因之一[16]。
根据本研究结果可知,当感染松材线虫病后,马尾松针叶的净光合速率开始急剧下降,这也是马尾松对生存环境生态适应和自我调节机制的表现[33]。处于感病末期马尾松的净光合速率要小于呼吸速率,马尾松趋向于死亡状态。此外,感染松材线虫病不同阶段马尾松针叶的蒸腾速率、气孔导度和净光合速率日变化相似,均表现为健康期>感病中期>感病末期。此结果与先前文献报道一致,即植物在不同生长期,其净光合速率、蒸腾速率和气孔导度的在不同光照辐射条件下的变化趋势相似[16-17, 28, 34]。
本研究采用“直角双曲线修改模型”来拟合处理所测得感染松材线虫病不同阶段马尾松针叶的光合响应曲线,继而可以求出主要的光合相应指标。结果表明:松材线虫侵染健康马尾松后,会显著影响其光合响应曲线和光合响应指标。本研究中,健康期马尾松的光饱和点显著高于感病中期马尾松的光饱和点,但是光补偿点显著低于感病中期的光补偿点,这说明健康马尾松感染松材线虫病后,会显著降低其对外界光照环境的适应能力[12, 35-36]。此外,当健康马尾松感染松材线虫病后,其针叶的暗呼吸速率数值也表现出较大的变化,感病中期马尾松针叶的暗呼吸速率值要大于健康期暗呼吸速率值。究其原因可能为,在松材线虫病侵染健康马尾松初期,寄主松树需要消耗较多的光合作用产物用于支持自身的防御系统抵御松材线虫的入侵和媒介昆虫松墨天牛的取食[14, 37]。先前文献报道亦表明,绿色植物在一定程度的外界因子干扰刺激下,暗呼吸速率值会出现不同程度的增加。如:欧洲防风草(Pastinaca sativa L.)的叶子在人工刺破2小时后,其暗呼吸速率值会增加19%左右[38];菜豆(Phaseolus vulgaris L.)叶片遭受锈菌和碳蛆菌侵染10天左右时间后,其暗呼吸速率的数值也会随着危害程度的增加而呈现线性增大的变化趋势[39]。随着松材线虫病对健康马尾松树干扰程度的持续增加,到了感病末期,寄主松树的树势变得严重衰落,光和生理能力显著下降,其暗呼吸速率数值也降到了较低的水平。
本研究中,当健康的马尾松树感染松材线虫病后,不同感病阶段马尾松针叶的平均碳素含量比较稳定,但是,马尾松针叶氮素损失比较明显。此结果与前人研究一致,Cabrera-Bosquet于2007年发表文献报道,绿色植物在受到生物或者非生物环境因子刺激时,其叶片氮素含量也变得极易损失[40];西部铁杉(Tsuga heterophylla Sarg.)在遭受到矮槲(Arceuthobium spp.)寄生后,其针叶的氮素损失量大约为35%左右[28]。此外,马尾松针叶的N素含量大量损失,也会影响针叶叶肉细胞内与光合作用相关的二磷酸羧化酶的活性,致使其活性降低甚至失活。因此,针叶N素损失也是导致马尾松光合能力显著下降的一个主要原因[30, 41-42]。
本研究中,感病马尾松针叶δ13C损失量约为2.5‰左右。分析其原因可能与感病马尾松针叶气孔导度下降导致细胞间CO2与外界CO2比值下降有关[30, 40, 43]。本研究结果与先前文献亦报道一致,西部铁杉在遭受到矮槲寄生后,其针叶的δ13C含量也显著下降[28, 44]。此外,马尾松是耐干旱贫瘠的造林先锋树种,其针叶对水分利用效率的研究始终是科研工作研究中的热点问题。绿色植物叶片的δ13C大小可表征绿色植物叶片的长期水分利用效率[25-30]。本研究结果表明健康马尾松遭受到松材线虫侵染后,其针叶δ13C的含量会有显著减少,这说明感病马尾松树的长期水分利用效率会发生相应变化,同时本研究亦印证了了同课题组先期研究实验结果[45],即松材线虫的入侵会显著降低马尾松树的水分利用效率。
马尾松是我国南方各省区重要的乡土树种,当遭受到松材线虫侵染刺激时,其光合作用会发生敏感、显著的变化。本研究结果表明,当松材线虫入侵健康马尾松后,可导致其针叶的光合指标日变化、光合相应指标和碳、δ13C含量发生显著变化。因此,本研究结果亦可以在松材线虫病的早期检测诊断中进行应用,即利用便携式光合仪检测寄主松树光合生理指标情况,来判断其是否遭受到松材线虫病的侵染危害。
-
松材线虫侵染健康马尾松树后,可致使其针叶的净光合速率、细胞间CO2浓度、蒸腾速率和气孔导度等相关光合因子光合日变化受到显著影响,同时亦会显著影响其光合响应曲线和主要光合响应指标,这说明健康马尾松感染松材线虫病后,会显著降低其对外界光照环境的适应能力致使其光合特性显著下降。
当健康的马尾松树感染松材线虫病后,不同感病阶段马尾松针叶的平均碳素含量比较稳定,但是,马尾松针叶氮素损失比较明显,这也是导致马尾松光合能力显著下降的一个主要原因。感病马尾松树针叶气孔导度下降可能是导致其针叶δ13C含量下降的主要原因,同时本研究结果亦说明松材线虫的入侵会显著降低马尾松树针叶的水分利用效率。









 DownLoad:
DownLoad: