-
馥郁滇丁香‘香妃’(Luculia gratissima ‘Xiangfei’)属于茜草科(Rubiaceae)常绿灌木或乔木,花期8—12月,属于典型的短日照植物[1]。由于花色粉红、芳香,花期长,是一种具有较高观赏价值的多年生木本花卉[2]。据资料记载,该种野生种群在国内分布于云南西部、西南部和西藏墨脱,生于海拔8002 400 m处的山地林或灌丛中;在国外,分布于印度东北部、尼泊尔、不丹、缅甸、泰国、越南等地[3]。本项目组经过数年系统调查,目前仅在云南找到1个野生种群,数量不足百株,其它有记录的分布区已找不到其踪影,因此,该物种在中国已濒临灭绝。目前,本项目组已从野生种群的突变单株中选育出1个优良无性系,并以‘香妃’为名登记注册为新品种[4]。
植物成花是复杂的形态建成过程,不仅受外界环境因子的影响,还受到体内各种内源物质的调控[5]。可溶性糖除了可作为营养物质被植物直接利用外,还可作为信号物质参与调节植物成花,如蔗糖、葡萄糖及6-磷酸海藻糖等[6]。可溶性蛋白是花器官形态建成的物质基础,主要包括结构蛋白和酶蛋白[7]。结构蛋白可满足花器官的基本结构建成需要,而一些酶蛋白在成花途径中参与调控成花相关基因的表达进而调控成花[8]。内源激素在植物成花过程中也具有重要的调节作用,且其作用在多年生果树中远胜于同化物的作用[9]。许多研究认为,在多年生木本植物成花过程中,脱落酸和细胞分裂素起促进作用[10-11],赤霉素起抑制作用[12-14]。然而,目前有关本属植物内源物质调控成花的研究尚未见报道。
本研究以‘香妃’的主枝顶芽为材料,测定成花过程中不同发育时期的可溶性糖、可溶性蛋白及内源激素含量,旨在通过掌握‘香妃’成花过程中主要内源物质的变化特点,揭示其调控成花的作用,进而为人工化学调控花期提供理论依据。
HTML
-
试验材料的繁殖在中国林业科学研究院资源昆虫研究所滇中高原试验站进行。该试验基地位于云南省楚雄彝族自治州禄丰县和平镇境内,地理位置处于102°12′ E,25°13′ N,平均海拔1 826 m,年平均气温15.5℃,年平均降水量9001 000 mm,年相对湿度66%。试验材料于2017年12月15日从馥郁滇丁香‘香妃’植株上采集具2个茎节且带有顶芽的枝条进行扦插;生根的苗木移植至花盆并置于温室中培养;为防止短日照对幼苗的诱导,当幼苗新长出23个茎节时,去除所有植株的顶端分生组织,并置于非诱导光周期(于22:00—2:00高压钠灯暗中断补光)中培养;同时,为考虑分生个体发育年龄对成花产生的影响,在自然环境中放置部分植株设为对照;当对照植株开始出现花芽分化时,开始进行诱导光周期(光照/黑暗为10 h/14 h)处理。
-
当自然环境中的部分对照植株开始出现花芽分化时,将非诱导光周期中培养的植株移入诱导光周期中进行诱导处理。然后,根据万友名等[1]在‘香妃’成花过程中的形态学观察方法,选取非诱导光周期下营养生长期(S1)以及诱导光周期下未分化期(S2)、总苞原基分化期(S3)、花序原基分化期(S4)和小花原基分化期(S5)5个发育时期。每个时期重复3次取样,每次随机选取10株植株,每株植株上取健壮枝顶芽2个,剥去顶端附带的幼嫩叶片,共20个芽。样品在上午9:00—11:30采集,并液氮速冻后-80℃保存备用。所有样品测定指标包括可溶性糖、可溶性蛋白、生长素(IAA)、玉米素(ZT)、脱落酸(ABA)、赤霉素(GA3)的含量。
可溶性蛋白测定参照王学奎[15]的方法,略有改动。精确称取300 mg的芽置于研钵中并加入2 mL蒸馏水,研磨,匀浆,移入离心管,6 mL水再次冲洗研钵,洗液合并到同一离心管,静置提取0.51 h,4 000 r·min-1离心20 min,取上清液至10 mL容量瓶中并定容,即为待测液。取0.1 mL待测液,加入0.9 mL水和5 mL考马斯亮蓝G-250试剂,混匀,静置2 min,595 nm下测定吸光值并计算出蛋白质的含量。
可溶性总糖测定参照王学奎[15]的方法,略有改动。精确称取300 mg的芽置于研钵中并加入2 mL蒸馏水,研磨,匀浆,移入25 mL试管中,加入510 mL蒸馏水,封口,2次沸水浴提取30 min,反复冲洗试管及残渣,洗液过滤后移入25 mL容量瓶中定容为待测液。取0.5 mL待测液,加入1.5 mL水、0.5 mL蒽酮乙酸乙酯试剂和5 mL浓硫酸,混匀,沸水浴静置1 min,在630 nm下测定吸光值并计算出可溶性糖的含量。
内源激素测定由南京卡文思检测技术有限公司完成。具体方法为:样品液氮研磨后,准确称取1 g,加入10 mL异丙醇/盐酸缓冲液,4℃震荡30 min,再加入20 mL二氯甲烷,4℃震荡30 min,4℃,13 000 r·min-1离心5 min,取下层有机相,避光,氮气吹干有机相,400 μL甲醇(0.1%甲酸)溶解,0.22 μm滤膜过滤,滤液采用安捷伦1290高效液相色谱仪串联AB公司Qtrap6500质谱仪检测(HPLC-MS/MS Q-TRAP)。液相条件为,色谱柱:poroshell 120 SB-C18 (2.1×150, 2.7 μm);柱温:30℃;流动相:A:B=(甲醇/0.1%甲酸):(水/0.1%甲酸);洗脱梯度:01 min(A=20%),19 min(A=80%),910 min(A=80%),1010.1 min(A=20%),10.115 min(A=20%);进样体积:2 μL。质谱条件为,气帘气:15 psi;雾化气压力:65 psi;辅助气压力:70 psi;雾化温度:400℃;喷雾电压:4 500 v。
-
采用Microsoft Excel 2010进行数据处理,SPSS 16.0软件进行方差分析和Duncan多重比较。
1.1. 材料
1.2. 方法
1.3. 数据处理
-
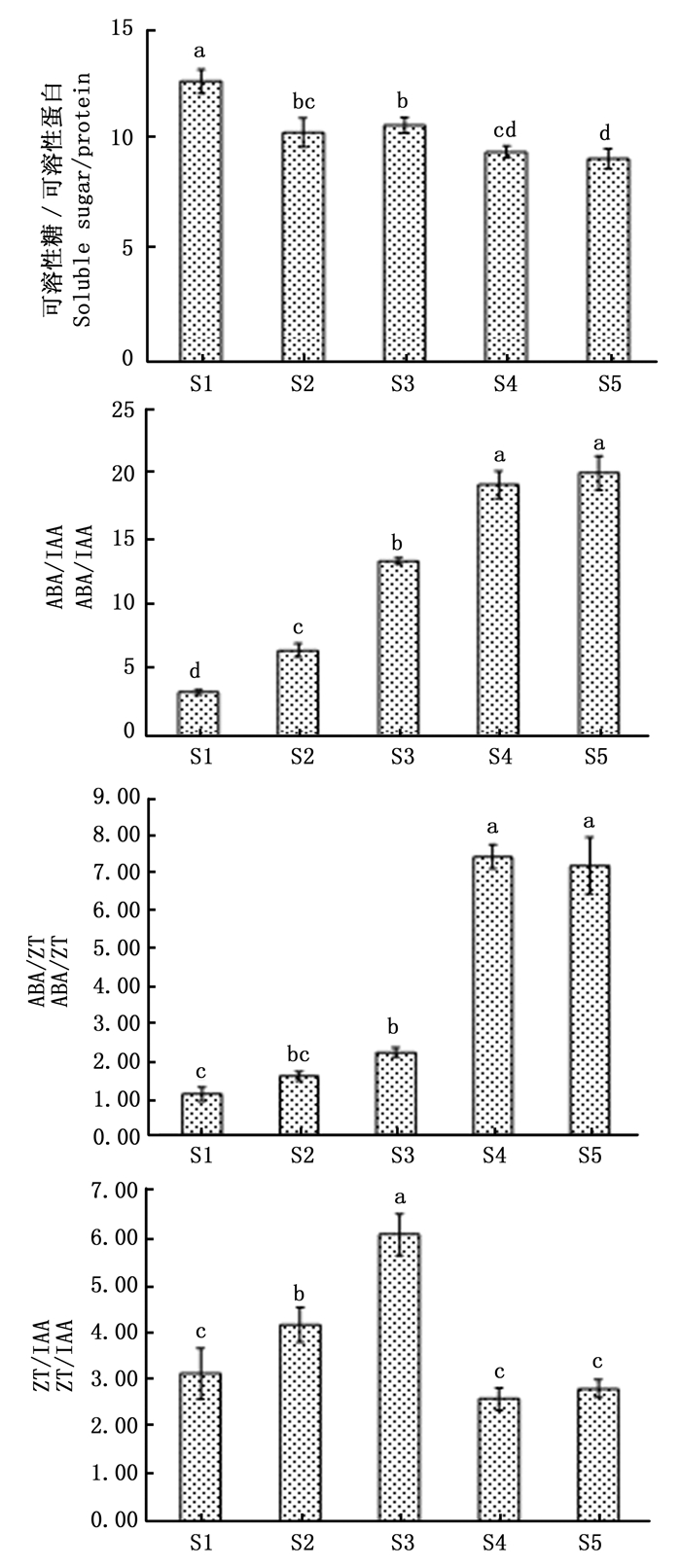
在各发育时期,除GA3因含量低于0.1 ng·mL-1(仪器的最小定量限值)以下未能检出外,其余几种内源物质的含量变化见图 1。

Figure 1. Changes of endogenous substances contents during flowering process in L. gratissima 'Xiangfei'
可溶性糖含量在非诱导光周期的营养生长期(S1)达到最高,随后在诱导光周期的未分化期(S2)开始下降,在总苞原基分化期(S3)和花序原基分化期(S4)持续下降,并且二者的含量水平相当,最后,在小花原基分化期(S5)降至最低含量水平。说明‘香妃’在成花过程中,可溶性糖的含量维持在较低水平。
可溶性蛋白含量在非诱导光周期的营养生长期(S1)处于中等水平。在诱导光周期的未分化期(S2)和花序原基分化期(S4)达到最高,且二者间差异不显著;而在总苞原基分化期(S3)和小花原基分化期(S5)降至最低,且二者间差异不显著。说明‘香妃’在成花过程中,不同发育时期对可溶性蛋白的需求量不同。
IAA含量在非诱导光周期的营养生长期(S1)达到最高,随后在诱导光周期的未分化期(S2)急剧下降,并在总苞原基分化期(S3)持续降至最低;之后,在花序原基分化期(S4)又升高,并在小花原基分化期(S5)又再次降低。说明‘香妃’在成花过程中,IAA含量维持在较低水平,期间虽出现升高,但其水平仍低于非诱导光周期的水平。
ABA含量在非诱导光周期的营养生长期(S1)为最低,随后,在诱导光周期的未分化期(S2)、总苞原基分化期(S3)依次缓慢升高,在花序原基分化期(S4)急剧升高;之后,在小花原基分化期(S5)又急剧降低,但其水平仍高于总苞原基分化期(S3)。说明‘香妃’在成花过程中,ABA含量维持在较高水平。
ZT含量在非诱导光周期的营养生长期(S1)达到最高,随后,在诱导光周期的未分化期(S2)、总苞原基分化期(S3)、花序原基分化期(S4)及小花原基分化期(S5)依次缓慢降低。说明‘香妃’在成花过程中,ZT含量维持在较低水平。
-
馥郁滇丁香‘香妃’成花过程中内源物质比值的变化见图 2。
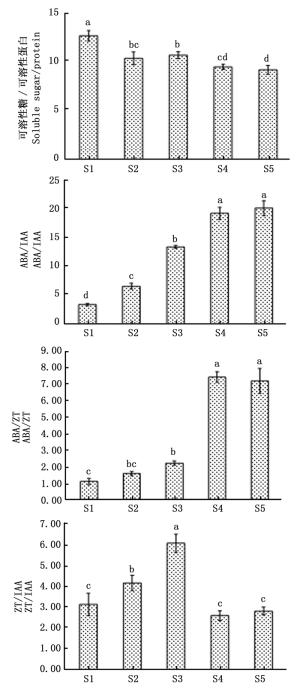
Figure 2. Changes of endogenous substances ratios during flowering process in L. gratissima'Xiangfei'
可溶性糖与可溶性蛋白的比值在非诱导光周期的营养生长期(S1)达到最高,在诱导光周期的未分化期(S2)开始急剧下降,之后,在总苞原基分化期(S3)略有回升后,又再在花序原基分化期(S4)和小花原基分花期(S5)依次缓慢降低。说明‘香妃’在成花过程中,可溶性糖与可溶性蛋白的比值维持在较低水平。
ABA/IAA在非诱导光周期的营养生长期(S1)为最低,随后,在诱导光周期的未分化期(S2)、总苞原基分化期(S3)、花序原基分化期(S4)依次急剧升高,在小花原基分化期(S5)变为缓慢升高。说明‘香妃’在成花过程中,ABA/IAA维持在较高水平。
ABA/ZT在非诱导光周期的营养生长期(S1)为最低,随后,在诱导光周期的未分化期(S2)、总苞原基分化期(S3)依次缓慢升高,在花序原基分化期(S4)急剧升高,之后,在小花原基分化期(S5)略有降低。说明‘香妃’在成花过程中,ABA/ZT维持在较高水平。
ZT/IAA在诱导光周期的总苞原基分花期(S3)之前急剧升高,之后,急剧下降并维持在低于非诱导光周期的营养生长期水平之下。说明ZT/IAA在‘香妃’成花的生理分化期较高,而在形态分化期则较低。
2.1. 成花过程中内源物质含量的变化
2.2. 成花过程中内源物质比值的变化
-
植物的成花不仅直接与糖含量相关,而且还受糖运输流的调节[16]。研究表明,大量蔗糖在菠萝(Ananas comosus (Linn.) Merr.)、金光菊(Rudbeckia laciniata L.)的茎尖积累能促进成花[8];然而,并不是所有的植物在茎尖大量积累蔗糖都能促进成花,如金鱼草(Antirrhinum majus L.),这可能与物种特异性有关[6]。杜鹃红山茶(Camellia azalea Wei)在成花的形态分化开始时可溶性糖的含量达最高,此后逐渐降低,到花瓣原基分花期达到最低,随后又有所回升[17];李(Prunus salicina Lindl.)在成花的生理分化期可溶性糖含量达到最高,而一旦进入形态分化期就被大量消耗降低[18]。在本研究中,可溶性糖的含量在非诱导光周期的营养生长期达最高,而在诱导光周期下,随着发育进程的推进缓慢降低。因此,推断‘香妃’在成花过程中,可溶性糖含量降低一方面可能是由于作为营养物质被消耗所引起,另一方面可能是‘香妃’的特异性所决定。一些研究发现,在糖类物质调控植物成花的过程中,一些重要的糖代谢酶基因起着重要的作用。如己糖激酶除了可以参与己糖磷酸化提供能量外,还参与植物的糖信号感知和转导[19]。另外,己糖激酶还可介导葡萄糖信号诱导脱落酸信号途径,形成一个糖-ABA级联途径调控形态建成[20]。β-葡萄糖苷酶通过激活脱落酸、赤霉素、生长素及细胞分裂素的活性改善植株的生长发育而促进开花,如烟草β-葡萄糖苷酶过量表达的植株,其生物量、株高及叶面积都较对照显著增加,并且开花提早1个月[21]。
-
可溶性蛋白是花器官形成的主要结构物质,在成花过程中的需求量大[7]。在本研究中,可溶性蛋白含量在非诱导光周期的营养生长期处于中等水平;在诱导光周期的未分化期、花序原基分化期达最高水平,说明这两个时期在器官的形态建成上可能对蛋白的需求量较少;在总苞原基、小花原基分化期达最低水平,说明这两个时期在器官的形态建成上可能对蛋白的需求量较大。
-
生长素(IAA)对植物成花的作用,目前观点不一。有的认为,IAA抑制成花,如彭桂群等[22]认为,IAA是平阴玫瑰(Rosa rugose Thunb.)成花的抑制剂;胡盼等[23]认为,IAA能抑制青海云杉(Picea crassifolia Kom.)成花;而有的观点则认为,IAA在成花过程中起促进作用,如牛辉陵等[9]认为,枣(Ziziphus jujuba Mill.)在成花期间需要高水平的IAA;然而,大多数学者认为,高含量的IAA抑制成花,而低含量的IAA有利于成花,如在勒杜鹃(Bougainvillea glabra Choisy.)[12]、油桐(Vernicia fordii (Hemsl.) Airy Shaw)[24]、桂花(Osmanthus fragrans (Thunb.) Lour.)[25]等植物中,成花形态分化之前IAA含量维持在较高的水平,而在成花形态分化期内则维持在较低的水平。在本研究中,IAA含量在非诱导光周期下维持在较高水平,而在诱导光周期下各发育时期均维持在较低水平,虽在一些时期有所回升,但仍低于非诱导光周期下的水平。因此,高水平含量的IAA抑制‘香妃’成花,反之则有利于成花。
-
脱落酸(ABA)对成花过程的作用,当前的观点不一致。罗羽洧等[13]认为,高含量的ABA有利于无花果(Ficus carica L.)成花;郭文丹等[24]认为,油桐成花形态分化前ABA的含量相对较低,形态开始分化后,ABA的含量在前期上升、中期波动、末期上升的变化规律。在本研究中,ABA含量在非诱导光周期下达最低,而在诱导光周期下的各发育时期均较高。说明较高水平的ABA有利于‘香妃’的成花,这与枇杷(Eriobotrva japonica Lindl.)[10]的研究结果一致。
-
许多研究认为,细胞分裂素(CK)在成花中起促进作用。在枇杷成花诱导期和形态分化期相对较高的ZT水平有利于成花[10];在罗汉果(Siraitia grosvenorii Swingle C. Jeffrey)中较高水平的玉米素核苷(ZR)有利于成花[11]。然而,在桂花的成花过程中,ZRs含量在生理分化期呈上升趋势并达到高峰,而在形态分化期下降[25]。在本研究中,玉米素(ZT)含量在非诱导光周期下达最高,而在诱导光周期下随发育进程推进逐渐降低,说明较低水平的ZT含量有利于‘香妃’成花,这与桂花基本一致。一些研究认为,细胞分裂素通过参与成花过程中的重组和细胞编程调控成花诱导[26],其水平与SOC1在成花诱导早期上调表达密切相关[27]。
-
研究表明,赤霉素(GAs)对植物成花的作用因物种而异。在勒杜鹃[12]、无花果[13]、光皮树(Cornus silsoniana Wanager)[14]等木本植物中,GAs对成花具抑制作用;而在青花菜(Brassica oleracea L.)[28]、春石斛(Dendrobium Pretty Ribbon)[29]等草本植物中,GAs对成花则具促进作用。另外,研究发现,不同类型的GAs对植物的成花效应不同,如杜鹃(Rhododendron simsii Planch)较高水平的GA1、GA3和GA20有利于营养生长,而较高水平的GA4、GA7和GA9有利于成花[30]。在本研究中,非诱导和诱导光周期下的芽均未检测到GA3,因此,在‘香妃’成花过程中,赤霉素是否产生作用,以及何种类型的赤霉素产生作用,都还有待进一步研究。赤霉素作为成花调控途径之一,在其它植物中研究较多,其调控机理解析得较为清晰。在赤霉素调控途径中,DELLA蛋白主要起阻遏作用并抑制植物生长发育,而GA促进植物生长发育是通过降解DELLA蛋白,解除DELLA蛋白的抑制作用,进而产生赤霉素效应[31]。研究发现,在拟南芥(Arabidopsis strain Landsberg)中赤霉素通过正向调控成花整合因子LFY表达,进而促进成花[32]。
-
植物成花的调控并不是由某种单一的内源物质所决定,而是各种内源物质相互作用产生的综合结果。各种营养物质(可溶性糖、蛋白质及核酸)的代谢又由多种激素的平衡状态所调控[5]。
-
成花的碳氮比理论认为,碳能促进开花结实,氮能促进营养生长。然而,有研究者指出,成花的碳氮比理论对大多数长日植物或中性植物较为适用,但对短日植物则会出现矛盾现象。短日植物在短日照条件下促进成花,其体内碳氮比值不一定高[12]。在本研究中,相对于非诱导光周期,诱导光周期下可溶性糖/可溶性蛋白的值在成花的各时期均较低,因此,‘香妃’成花不一定要求很高水平的碳水化合物,而更重要的可能涉及碳水化合物的库源方向的交换,也就是,花分生组织部位必须为调运碳水化合物的库[12]。
-
植物成花取决于促花激素与抑花激素间的平衡。在四季花龙眼(Dimocarpus longan Lour.)中,提高ZRs/GA3、ABA/GA3、ZRs/IAA、ABA/IAA的比值有利于成花[33]。在青海云杉中,ZR/GAs、ZR/IAA高比值有利于成花的生理分化,但不是维持形态分化所必须的,而ABA/GAs、ABA/IAA高比值则是成花形态分化能够顺利完成所必须的[23]。本研究中,相对于非诱导光周期,诱导光周期下,ABA/IAA、ABA/ZT升高有利于成花,与上述几种植物的研究结果都一致;而ZT/IAA在生理分化期内(即总苞原基分化之前)升高后,在形态分化期(总苞原基分化之后)维持在较低水平,说明该比值升高有利于形态分化的启动,但不利于形态分化的顺利完成,这与青海云杉的研究结果一致。
3.1. 内源物质在成花过程中的作用
3.1.1. 可溶性糖在成花过程中的作用
3.1.2. 可溶性蛋白在成花过程中的作用
3.1.3. 生长素在成花过程中的作用
3.1.4. 脱落酸在成花过程中的作用
3.1.5. 细胞分裂素在成花中的作用
3.1.6. 赤霉素在成花中的作用
3.2. 内源物质平衡对成花的影响
3.2.1. 可溶性糖与可溶性蛋白比值对成花的影响
3.2.2. 内源激素平衡对成花的影响
-
相对于非诱导光周期,‘香妃’在诱导光周期下内源ABA、ABA/IAA、ABA/ZT维持在较高水平,以及可溶性糖、IAA、ZT、可溶性糖/可溶性蛋白维持在较低水平有利于成花;ZT/IAA维持在较高水平有利于成花的生理分化,而维持在较低水平则有利于成花的形态分化。






 DownLoad:
DownLoad: