-
沉水樟(Cinnamomum micranthum (Hay.) Hay)是我国樟科植物中含油量最高的速生经济树种,在医药、化工方面具有广泛用途,且其木材纤维长,是造纸业的优良原料,同时也是水源涵养和园林绿化的优良树种[1-2]。然而,由于沉水樟种子发育周期长、种子产量低、质量差、病虫害多,果实成熟后空壳率高达75%以上,且种子多油、寿命短、难贮存、发芽率低,沉水樟天然更新极其困难[3]。由于沉水樟资源锐减,1982年被列入国家Ⅲ级重点保护植物。通过有性繁殖获得沉水樟苗木十分有限,极大地限制了沉水樟人工造林的规模[3]。因此,沉水樟扦插育苗技术体系的建立对于培育大量优质沉水樟苗木、扩大沉水樟种群规模都具有十分重要的意。近年来,大量学者对于影响沉水樟扦插繁殖成活率的穗条来源、基质成分、扦插时间、化学药剂处理等因素展开了大量研究[4-9]。目前,沉水樟扦插成活率介于50% ~ 74%间,扦插成活率低始终是困扰沉水樟扦插繁殖技术的关键制约因子。
有研究报道,难生根树种插穗内存在阻碍生根的物质是导致其生根率低的重要因素之一[10]。目前,在许多植物插穗中都已发现了生根抑制物质的存在。李永进等[10]对不同家系马尾松(Pinus massoniana Lamb.)插穗研究发现,马尾松插穗生根率低的内部因素之一是插穗中存在黄酮类、苯酚类和脱落酸类等活性较高的内源抑制物质。王芳等[11]以梭梭(Haloxylon ammodendron (C. A. Mey.) Bunge)嫩枝和硬枝为试验材料,验证了其体内生根抑制物的存在,主要可能存在酸性物质、碱性物质和酚类物质。郭素娟等对难生根树种插穗浸提液进行分析,发现其中大多数都含有类似于有机酸、单宁或有关成分的酸性物质[12]。此外,难生根植物不同部位的生根抑制物活性并不相同,梭梭嫩枝下部的生根抑制物活性较中上部弱,木质部中的活性较韧皮部弱[11]。紫杉(Taxus cuspidata (Pilger) Rehd.)也表现为韧皮部的生根抑制物含量最多,其次是针叶,木质部很少[13]。同时,枝龄也是影响生根抑制物含量的重要因素之一,紫杉1年生插穗中酚类物质含量最高,3年生含量最少[13]。邓恩桉(Eucalyptus dunnii Maiden)[14]则表现为成树茎段提取液的生根抑制强度比萌枝及幼苗的茎段提取液更强。可见,不同难生根植物的体内生根抑制物的种类及分布部位均存在较大差异。
鉴于此,本文对不同枝龄沉水樟穗条的不同组织浸提液进行内含物的非靶向LC-MS检测,明确沉水樟穗条是否存在生根抑制物及其存在部位与枝龄间的差异,并结合扦插试验验证不同枝龄穗条的扦插效果,探讨内源生根抑制物对沉水樟扦插生根的影响,为阐明沉水樟扦插生根的阻碍机制奠定研究基础,从而为提升沉水樟扦插育苗技术提供理论依据。
HTML
-
供试材料取自建瓯市林业推广中心后山的6年生沉水樟母树林,属中亚热带海洋季风气候区,气候温暖,雨水充沛,海拔160 m,年平均气温18.9℃,年降水量1662.5 mm左右,相对湿度81%,无霜期270~290 d。于2017年5月,从同一植株分别剪取1年生、2年生、3年生与多年生4个枝龄的穗条,共重复剪取10株的穗条。剪取的穗条带回实验室后,将各枝龄穗条的韧皮部与木质部分开,放入60℃烘箱中杀青,烘至恒质量。材料烘干后,用剪刀先剪成适宜大小的小段或小片,然后用高速粉碎机磨碎样品,包好放入干燥器中备用。
-
分别称取5 g 的1年生穗条的磨碎样(整根穗条,未区分不同组织部位)放入提取瓶中,加入100 mL蒸馏水,间隔2 h摇匀1次,分别浸提12、24、36、48、72 h后过滤到棕色瓶中,加蒸馏水重新定容到100 mL,放入4℃冰箱中保存备用。利用白菜(Brassica pekinensis (Lour.) Rupr.)种子发芽试验来确定浸提液制备过程中应选择的获得抑制效果最好的浸提时间,白菜种子购于市场。
向垫有2层发芽纸的培养皿(d=15 cm)中加入浸提液(蒸馏水作为对照CK),将50粒白菜种子置于其上,于25℃培养箱中进行发芽试验,每个浸提时间处理3个重复。每天统计白菜种子的发芽率(胚根长度≥0.2 cm,胚芽长度0.5 cm时即为发芽),测定发芽3 d的根长、苗高(从根尖到茎尖),并以此计算发芽指数、活力指数。
发芽指数(GI)=∑(Gt/Dt)
活力指数(VI)=S×GI
式中:Dt为发芽时间,Gt为与Dt相对应的每天发芽种子数,S为根长。
-
在1.2.1确定了浸取液制备的最佳浸提时间的基础上,对不同枝龄(1年、2年、3年与多年生)穗条的木质部与韧皮部2个组织部位进行浸提液的提取。分别称5 g的不同枝龄穗条不同组织部位的磨碎样品,放入提取瓶中,加入100 mL蒸馏水,间隔2 h摇匀1次,浸提48 h(根据1.2.1的测定结果确定)后过滤到棕色瓶中,加蒸馏水重新定容到100 mL,放入5℃冰箱中保存备用,每个样品重复浸提3次。
-
样本冻干后加入1 mL水和4 mL甲醇(默克公司,达姆施塔特,德国),涡旋混匀后取出1 mL混合液,加入10 μL 2.5 mg·mL−1的2-氯苯丙氨酸(GL生物公司,上海,中国)作为内标。涡旋混匀30 s,而后置于4°C离心机中,12 000 rpm离心15 min。吸取200 μL上清液,转入进样小瓶中待LC-MS检测分析。
-
仪器分析平台:LC- MS(Thermo, Ultimate 3000LC, Orbitrap Elite);色谱柱:C18色谱柱(Hypergod C18 (100×4.6 mm, 3 μm));色谱分离条件为:柱温为40°C;流速0.3 mL·min−1;流动相组成A:水(Milli-Q Advantage A10,默克公司,德国)+0.1%甲酸(CNW,上海,中国),B:乙腈(默克公司,达姆施塔特,德国)+0.1%甲酸;进样量为4 μL,自动进样器温度4°C。流动相梯度洗脱程序见表1。质谱检测参数:加热器温度300°C;鞘气流速:45 arb;辅助气流速:15 arb;尾气流速:1 arb;电喷雾电压:3.0 KV;毛细管温度:350°C;S-Lens RF Level:30%。
时间
Time/min流速
Flow rate/(mL·min−1)流动相A
Mobile phase A/%流动相B
Mobile phase/%0 0.3 95 5 2 0.3 95 5 12 0.3 5 95 15 0.3 5 95 17 0.3 95 5 Table 1. The gradient of mobile phase
-
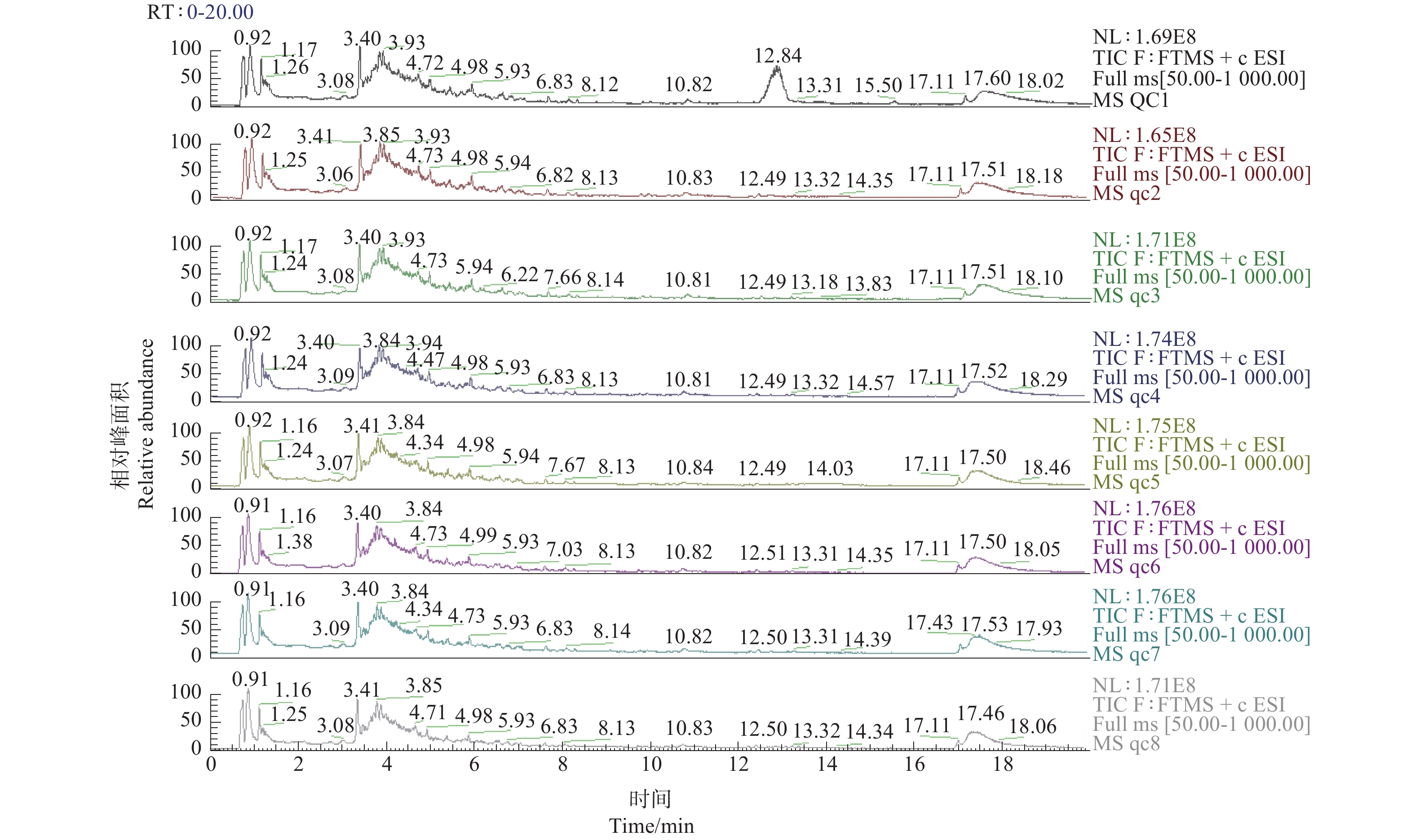
样本提取后,每个样本取 5 μL进行合并,得到 QC(quality control,质量控制)样本,检测时每隔一定数量的样本进一针QC样品,通过QC样品色谱图的重叠情况来检验仪器的稳定性。对QC样品的总离子流色谱图(TIC)进行重叠(图1),可见,仪器的保留时间重现性较好,仪器稳定,仪器分析和数据的结果有较高的可靠性。随机选取不同枝龄的沉水樟穗条不同组织浸提液样本的总离子流色谱图(TIC)见图2,可见不同枝龄的沉水樟穗条不同组织的内含物种类总体相同,但含量存在一定的差异。
-
使用SIEVE软件(Thermo公司)对LC-MS检测数据进行提取和预处理,并在Excel 2010中对数据进行归一化及后期编辑,最后整理成二维数据矩阵形式,包含保留时间(Retention time,RT)、分子量(CompMW)、观察量(样本名称)、可提取物质个数(ID)和峰强度等信息。将编辑后的数据矩阵导入SIMCA-P 13.0(Umetrics AB,Umea,Sweden)软件,采用主成分分析(PCA)、偏最小二乘法判别分析(PLS-DA)及正交偏最小二乘判别分析(OPLS-DA)等数据处理方法对不同枝龄的沉水樟穗条不同组织样本进行分析,进一步确定差异性化合物。
-
采用OPLS-DA模型的VIP(Variable Importance in the Projection)值(阈值>1),并结合t-test的p值(p<0.05)来寻找差异性表达代谢物。差异性代谢物的定性方法为:搜索在线数据库(Metlin数据库、HMDB数据库、Thermo数据库),通过检测到的分子量及二级碎片、保留时间、质量偏差(ppm<10)进行物质定性。
-
同1.1剪取的不同枝龄穗条,剪取时留半片叶、穗条上端至少有1~2个腋芽。穗条基部下切口采取双削的方式,穗条粗度以0.2~0.5 cm,长度以5~8 cm为宜。一个枝龄穗条100根,将穗条置入100 ×10−6(100 mg·L−1)的生根粉ABT-1#中浸泡16 h[4]。扦插基质为黄心土,扦插后60 d进行生根率的调查,计算平均生根率、平均根数与平均根长。
-
采用SPSS(11.5)进行数据的方差分析,Orign8.5软件进行图表的绘制。
1.1. 材料
1.2. 研究方法
1.2.1. 穗条浸提液制备的浸提时间确定
1.2.2. 不同枝龄穗条的不同组织浸提液的制备
1.2.3. 不同枝龄穗条的不同组织浸提液LC-MS分析
1.2.3.1. 样本预处理
1.2.3.2. LC-MS分析
1.2.3.3. 仪器稳定验证
1.2.3.4. 数据分析
1.2.3.5. 差异性内含物的挖掘及鉴定
1.2.4. 不同枝龄穗条的扦插效果调查
1.3. 数据分析
-
利用沉水樟穗条的浸提液对白菜种子进行不同时间长度的处理,同时以清水处理为对照,统计白菜种子的发芽情况。结果(表2)表明:清水处理的白菜种子的发芽率、发芽指数、活力指数及白菜苗的根长均显著优于沉水樟穗条浸提液处理(P<0.05),对照苗高也高于穗条浸提液处理。由此验证了沉水樟穗条中生根抑制物质的存在。不同浸提时间比较可见,穗条浸提液处理12、24、36 h的白菜种子发芽指标间均差异不显著(P>0.05);而浸提液处理48 h的白菜种子的发芽率、发芽指数及活力指数显著降低,发芽后的根长及苗高等生长指标也低于对照与其它处理。随着处理时间的延长,浸提液处理72 h的白菜种子的发芽指标又呈回升趋势。可见,沉水樟穗条浸提液处理白菜种子48 h的发芽抑制作用最明显,说明浸提48 h时穗条内的生根抑制物提取的最为充分。因此,沉水樟不同枝龄穗条不同组织的浸提液制备时可采用浸提时间48 h。
浸提时间
Leaching time/h发芽率
Germination rate/%发芽指数
Germination index活力指数
Vigor index根长
Root length/cm苗高
Shoot height/cmCK 63.00±4.00 a 27.71±0.89 a 43.35±2.82 a 1.56±0.05 a 2.89±0.09 a 12 42.00±5.00 bc 14.94±1.36 b 19.83±4.01 b 1.33±0.28 b 2.53±0.31 ab 24 40.00±6.00 bc 14.94±3.81 b 16.61±5.60 b 1.09±0.13 bc 2.34±0.25 ab 36 46.00±2.00 b 14.77±1.95 b 18.97±4.98 b 1.27±0.15 b 2.59±0.31 a 48 30.00±4.00 c 9.44±1.85 c 8.17±2.98 c 0.84±0.16 c 1.92±0.20 c 72 42.00±8.00 bc 15.11±1.93 b 20.52±4.86 b 1.34±0.16 b 2.65±0.26 a 注:不同小写字母表示代表白菜种子发芽情况的指标在不同浸提时间的差异达到显著水平(P < 0.05)。
Note: Different lowercase letters in the same column indicate significant differences (P < 0.05) of the seed germination indexes of Brassica pekinensis at different leaching time.Table 2. Effect of extracts at different leaching time from cuttings of Cinnamomum micranthum on seed germination of Brassica pekinensis
-
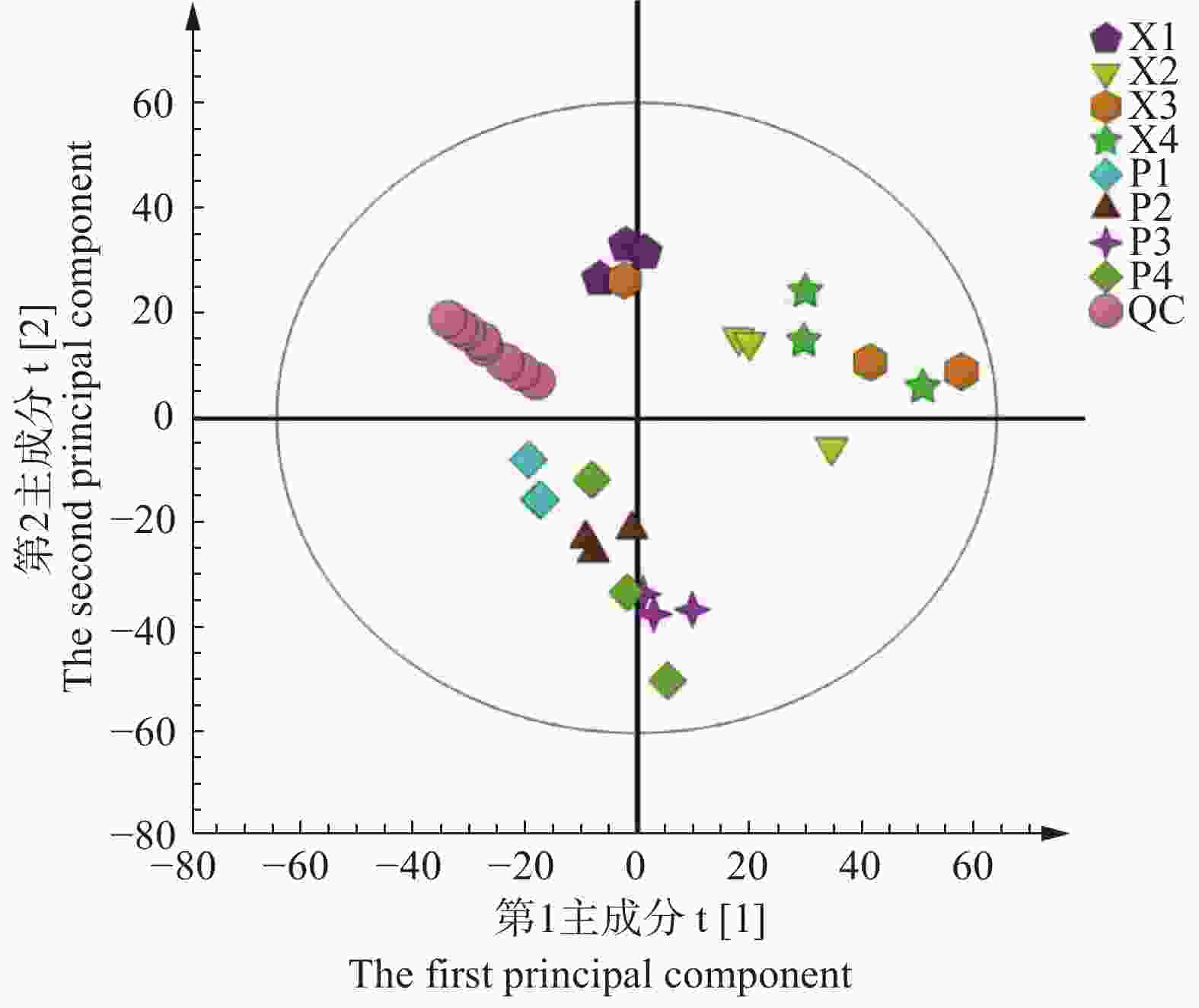
为了判别两组样本之间是否具有差异,采用PCA建模方法对样本进行分析,利用R2X(模型的解释率)与Q2(模型的预测率)判定模型的质量,结果显示:模型的累积R2X=0.836,Q2=0.657,说明该模型稳定可靠。PCA得分图(图3)所示:QC样本没有明显分离,表明本试验重复性好,试验中获得的内含物差异能反映样本间自身的生物学差异。此外,PCA 结果能明显区分韧皮部与木质部的内含物,韧皮部与木质部的内含物分布在不同区域,木质部的内含物位于第1主成分的轴线往正轴方向,位于第2主成分的正轴位置,韧皮部内含物主要位于第1主成分的轴线往负轴方向,位于第2主成分的负轴位置,可见不同组织的内含物有明显差别。
-
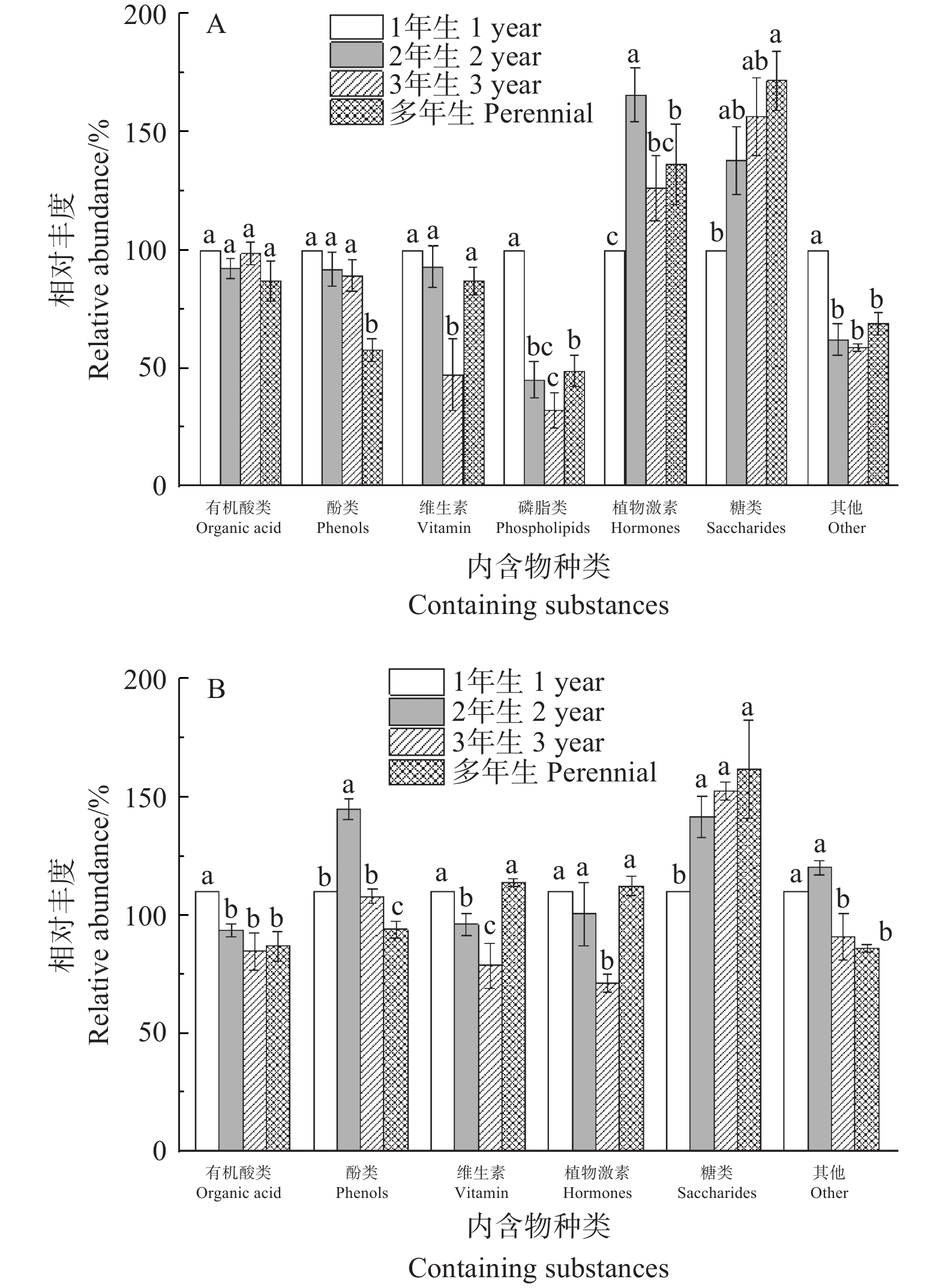
通过非靶向的LC-MS分析沉水樟不同枝龄不同组织的浸提液共检测得到2307个物质信号,对这些信号进行筛选,经过标准样品、数据库和参考文献比对得出,1、2、3年生与多年生穗条的木质部与韧皮部的差异内含物个数分别为94、80、74、76个。对不同差异内含物进行归类,沉水樟同一枝龄穗条不同组织的差异内含物的比较见图4。除了芹菜苷、姜辣素、槲皮素等其他内含物外,在不同枝龄不同组织浸提液中检测出的差异内含物主要有:有机酸类、酚类、维生素、磷脂类、植物激素及糖类等物质。

Figure 4. Comparison of different containing substances in different tissues of Cinnamomum micranthum cuttage
不同差异内含物比较可见,1~3年生枝龄穗条木质部及韧皮部所含的酚类物质及有机酸类物质的相对峰面积均显著高于其他物质(P<0.05),其中,酚类物质的相对峰面积最大。多年生穗条韧皮部的酚类及有机酸类物质的相对峰面积也显著高于其他物质(P<0.05),木质部则表现为有机酸类的相对峰面积最大,酚类的相对峰面积大于维生素、磷脂类、植物激素及糖类等物质,但差异不显著性。不同枝龄穗条木质部及韧皮部所含的维生素、磷脂类、植物激素及糖类等物质的相对峰面积之间的无显著差异(P>0.05)。
不同组织比较可见,不同枝龄穗条韧皮部的酚类物质相对峰面积均表现为显著高于木质部(P<0.05),有机酸类、维生素、磷脂类、植物激素及糖类等物质在韧皮部及木质部的相对峰面积无显著差异(P>0.05)。
-
以1年生穗条的内含物作为对照,2、3年生、多年生穗条木质部与1年生穗条木质部的差异内含物个数分别为53、47、61个,2、3年生、多年生穗条韧皮部与1年生穗条韧皮部的差异内含物个数分别为60、60、68个。对差异内含物进行归类,并以1年生穗条内含物作为对照,不同枝龄穗条的差异内含物的相对丰度比较见图5。可见,除了其他物质外,不同枝龄木质部的差异内含物主要检测到有机酸类、酚类、维生素、植物激素、磷脂类、糖类等物质,韧皮部的差异内含物则主要有有机酸类、酚类、维生素、植物激素、糖类等物质(图5)。

Figure 5. Comparison of different containing substances in the cuttage with different ages of Cinnamomum micranthum
不同枝龄穗条木质部的差异内含物比较可见,不同枝龄穗条木质部的有机酸类及酚类物质的相对丰度均表现为2年生、3年生及多年生的小于1年生的穗条,其中,有机酸类在不同枝龄间的差异不显著(P>0.05),酚类物质则随着枝龄的增加呈减少趋势,多年生穗条木质部的酚类含量显著低于其他年龄的穗条。
韧皮部的有机酸类物质含量也表现为其他枝龄的相对丰度显著低于1年生穗条(P<0.05),酚类物质则表现为2年生穗条的相对丰度显著高于其他枝龄穗条(P<0.05)。此外,沉水樟不同枝龄穗条中的营养物质糖类的变化规律较明显,木质部与韧皮部的糖含量均表现为随着枝龄增加呈逐渐增加趋势。
-
沉水樟不同枝龄穗条的扦插效果比较(表3)可见:1年生穗条的扦插效果最优,其平均生根率与平均根长均显著高于其他枝龄的穗条(P<0.05),平均生根数除与2年生的差异不显著外,显著高于3年生与多年生枝条(P<0.05)。不同枝龄穗条的平均生根率、平均生根数及平均根长总体上均表现为随着枝龄的增加而逐渐减少,其中,多年生的穗条并未生根,扦插成活率为零。可见,与生根抑制物含量的变化规律不同,不同枝龄穗条的扦插效果表现为随着枝龄的增加而减弱。
不同枝龄
Different
ages/a平均生根率
Average rooting
rate/%平均生根数
Average
rootingnumber平均根长
Average root
length/cm1 62.63±3.12 a 6.50±0.30 a 7.20±0.57 a 2 34.78±0.98 b 5.30±0.25 ab 5.50±0.24 b 3 11.24±1.25 c 3.10±0.0 8b 4.80±0.39 b 多年 0.00±0.00 d 0.00±0.00 c 0.00±0.00 c 注:同一列中不同小写字母表示不同枝龄穗条扦插效果的指标差异显著(P < 0.05)。
Note: Different lowercase letters in the same column indicate significant differences (P < 0.05) of the rooting effect indexes ofcuttings with different ages of Cinnamomum micranthum.Table 3. Comparison of the rooting effect of Cinnamomum micranthum cuttage with different ages
2.1. 浸提液制备的浸提时间确定
2.2. 沉水樟不同枝龄穗条不同组织的差异内含物比较
2.2.1. 总体PCA分析
2.2.2. 沉水樟同一枝龄穗条不同组织的差异内含物比较
2.2.3. 沉水樟不同枝龄穗条的同一组织的差异内含物比较
2.3. 沉水樟不同枝龄穗条的扦插效果比较
-
植物不定根的发生是一个极其复杂的生理生化过程,它的诱导、发生和形成与解剖学结构、内源生长素或其他促根物质、内源抑制物等多种生理反应相关[15],其中,内源抑制物的存在成为限制难生根树种插穗不定根形成的关键因素之一。郭素娟综合早期关于林木扦插生根的生理学研究发现,难生根树种插穗浸提液中主要含有类似于有机酸、单宁等成分的生根抑制物[12]。近年来,随着无性系林业的发展,众多学者针对难生根树种的扦插生根机理开展相应研究。季孔庶等[16]对马尾松研究发现,马尾松内源抑制物主要属于黄酮类与苯酚类。除黄酮类与苯酚类外,李永进等[10]在不同家系马尾松中均检测出脱落酸类的存在。刘艳[17]对梭梭种子不同部位的萌发抑制物生物测定表明,梭梭种子浸提液中含有17种可能的发芽抑制物,其中主要为有酚类。王芳等[11]也证实梭梭中存在酸性物质、碱性物质和酚类物质等活性较高的生根抑制物。此外,在紫杉[13]、油茶(Camellia oleifera Abel.)[18-19]、桉树(Eucalyptus robusta Smith)等[14,20-22]树种中均表现为酚类为主要抑制物。综合可见,酸类物质与酚类物质是抑制植物生根的主要物质。本研究发现,沉水樟穗条的韧皮部与木质部的差异内含物中的酚类及有机酸类含量显著高于其他物质,其中,酚类物质的相对峰面积较大。可见,沉水樟穗条中可能存在大量的酚类与酸类生根抑制物。
为进一步探究沉水樟穗条中的生根抑制物种类,本研究结合己报道的生根抑制化合物,选择2年生穗条韧皮部(酚类物质的相对丰度最高)的内含物进行挖掘分析。可见,在沉水樟穗条中主要存在水杨酸、香豆素、对羟基肉桂酸、间苯三酚、苯甲醛、香草酸、绿原酸、脱落酸、丁香酸、没食子酸等生根抑制物,且检测到的各物质峰面积逐渐减小(表4)。有研究认为,多数抑制物质在不同浓度下所起抑制作用不同,通常同一种抑制物在高浓度时表现为发芽抑制作用,而在低浓度时表现为发芽促进作用,如有研究证实,低浓度的水杨酸溶液具有诱导不定根形成和促进根系生长的作用,且在一定范围内随浓度的增加,效应加强[23-25];但高浓度的水杨酸溶液不但会抑制生根,而且对幼苗有伤害作用[26-28]。在沉水樟穗条中检测到的水杨酸峰面积相对较高,其在沉水樟扦插过程中所起的效应还有待进一步的验证。所以,在对沉水樟穗条内源生根抑制物初步探讨的基础上,下一阶段研究应针对主要生根抑制物进行验证试验,进一步明确沉水樟穗条中的内源生根抑制物质种类。
物质名称
Name保留时间
Time/min质核比
m/z质量误差
ppm分子式
Molecular formula峰面积
Peak area分子结构
Molecular structure参考文献 水杨酸
Salicylic acid2.02 171.07 0 C7H6O3 5.58×107 
[17,26-29] 香豆素
Coumarin1.71 147.04 1 C9H6O2 3.50×107 
[17,30-34] 对羟基肉桂酸
Cinnamic acid2.55 165.05 6 C9H8O3 2.43×107 
[35-36] 间苯三酚
Phloroglucinol0.89 127.04 2 C6H6O3 1.24×107 
[17] 苯甲醛
Benzaldehyde2.49 107.04 3 C7H6O 1.01×107 
[37] 香草酸
Vanillic acid3.26 169.05 1 C8H8O4 0.90×107 
[17,29,35] 绿原酸
Chlorogenic acid2.03 355.10 6 C16H18O9 0.85×107 
[35] 脱落酸
Abscisic Acid3.48 265.14 0 C15H20O4 0.71×107 
[32-34,38-41] 丁香酸
Syringate1.16 199.06 0 C9H10O5 0.35×107 
[17,29] 没食子酸
Gallic acid3.36 171.03 0 C7H6O5 0.26×107 
[17,29] Table 4. The variety of rooting inhibitors in Cinnamomum micranthum cuttage
-
研究表明,植物不同部位的生根抑制物活性不同。本研究对沉水樟穗条的不同组织比较发现,不同枝龄穗条韧皮部的酚类物质相对峰面积均表现为显著高于木质部,而有机酸类、维生素、磷脂类、植物激素及糖类等物质在韧皮部及木质部的相对峰面积无显著差异。可见,沉水樟穗条的生根抑制物可能主要分布在韧皮部,这与前人在梭梭[11]、紫杉等[13]的研究结果一致。此外,不同枝龄的穗条比较发现,除韧皮部的酚类物质表现为2年生穗条最高外,韧皮部的有机酸及木质部的有机酸与酚类均表现为1年生穗条显著高于其他枝龄,不同枝龄穗条的有机酸与酚类含量随枝龄增加呈逐渐减少的趋势。程广有[13]对紫杉的生根抑制物鉴定也发现,其不同枝龄的插穗酚类物质表现为1 年生插穗中含量最高,3 年生含量最少。王芳等[11]的研究结果也显示3年生硬枝的生根抑制物质较1年生和2年生硬枝的少。这可能是穗条离体的刺激、激素的调节等作用,促使插穗内的有机物质向有益于生根方向转化,同时插穗内原有的生根抑制物质也相应被转化[13]。笔者推测,沉水樟枝条在由当年萌生枝条至2年生枝条的成熟过程中,枝条中的生根抑制物含量随着枝条的成熟逐渐升高,2年生的枝条生根抑制物含量达到最大,待枝条成熟后,生根抑制物逐渐转移或转化,含量减少并趋于稳定。
本研究通过沉水樟穗条的扦插效果调查发现,沉水樟不同枝龄穗条中,1年生穗条的扦插效果最优,随着枝龄的增加穗条的扦插成活率逐渐降低,多年生穗条的成活率为零。这与邓恩桉[14]、核桃楸(Juglans mandshurica Maxim.)[42]、落叶松(Larix gmelinii (Rupr.) Kuzen.)[43]穗条扦插生根试验结果一致。而与上述酚类与酸类生根抑制物在不同枝龄穗条中的变化规律并无明显的负相关关系。笔者推测虽然沉水樟穗条的枝龄越高其体内酚类与酸类等生根抑制物越少,然而枝龄越高,其木质化程度越高,生理活动弱,且定芽少,在穗条上形成的不定芽萌发能力差,插口不易形成愈伤组织,造成扦插成活率越低[5]。可见,插穗的生根是穗条发育程度、解剖构造与穗条内营养物质、酶活性、激素含量以及生根抑制物质含量等众多因素的综合调控结果,随着枝龄的增加,沉水樟插穗内的生根抑制物含量不再是影响其生根效应的主导因子,而沉水樟的扦插生根机理有待进一步的综合多方面因子深入研究。
3.1. 沉水樟穗条中生根抑制物种类的挖掘与鉴定
3.2. 沉水樟穗条中生根抑制物的分布及其效应分析
-
本研究基于非靶向LC-MS分析方法,对不同枝龄沉水樟穗条的不同组织浸提液进行内含物检测发现:
(1)不同枝龄穗条木质部及韧皮部所含的差异内含物中,总体上表现为酚类及有机酸类物质的相对峰面积显著高于其他物质,其中,除多年生穗条的木质部外,酚类物质的相对峰面积均最大。
(2)不同枝龄穗条的韧皮部的酚类物质相对峰面积均表现为显著高于木质部,不同枝龄比较发现,除韧皮部的酚类物质表现为2年生穗条最高外,韧皮部的有机酸及木质部的有机酸与酚类均表现为1年生穗条显著高于其他枝龄,且不同枝龄穗条的有机酸含量随枝龄增加呈逐渐减少的趋势,酚类也表现为多年生<3年生<1年生。
(3)沉水樟不同枝龄穗条中,1年生穗条的扦插效果最优,且随枝龄的增加扦插成活率逐渐降低。可见,在影响插穗生根的众多因子中,内源生根抑制物的作用随着枝龄的增加呈降低的趋势。由此,下一阶段的研究也将综合各影响因子对沉水樟的扦插生根机理展开更全面的探讨。






 DownLoad:
DownLoad: