-
异斑酷大蚕蛾(Cricula variabilis Naumann & Löffler)隶属于鳞翅目(Lepidoptera)大蚕蛾科(Saturniidae)小字大蚕蛾属(Cricula),该虫于2019年4月在广州市增城区大封门林场爆发危害,是林区的重大阔叶树食叶害虫,其幼虫主要危害中华润楠(Machilus chinensis (Champ. ex Benth.) Hemsl.),此外,还会取食黧蒴锥(Castanopsis fissa(Champion ex Bentham) Rehder et E. H. Wilson)、鸭脚木(Schefflera octophylla (Lour.) Harms)、枇杷叶紫珠(Callicarpa kochiana Makino)等多种阔叶树,严重时可造成林区阔叶乔木大面积枯死[1-2],其中对润楠属树种危害最为严重。润楠属树种在我国种类较多、分布较广,具有干直,速生,木材轻软,纹理直,耐腐等特性,大部分可作为建筑、家具用材、药用树种、园林绿化、工业原料等多种用途,具有显著的经济意义[3]。
目前,昆虫性信息素作为绿色环保高效防治方法之一,不仅可以监测害虫的发生动态,而且还可以大量诱捕害虫,干扰成虫交配。如今,越来越多的昆虫性信息素已应用到农林害虫的无公害绿色防控中[4-8]。昆虫生殖行为学的研究可以更好地了解害虫性信息素的产生和释放节律,为性信息素的提取和鉴定提供参考。国内已有研究人员对六星黑点豹蠹蛾(Zeuzera leuconotum Butler)、褛裳夜蛾(Catocala remissa Staudinger)、枣粘虫(Ancylis sativa Liu)和杨小舟蛾(Micromelalopha sieversi(Staudinger))等鳞翅目害虫的生殖生物学特性进行报道[9-12],但有关大蚕蛾科昆虫的生殖行为研究极少,因此,有必要开展异斑酷大蚕蛾生殖行为学研究,可为其性信息素研究和新型防治策略制定提供技术参考。
HTML
-
供试虫源采自广东省广州市增城区大封门林场(23°36′ N,113°47′ E),然后将其带回实验室暗室内进行饲养(温度27 ± 1℃,相对湿度75% ± 5%,光暗周期L∶D = 12 h∶12 h,其中光期19:00—7:00,暗期7:00—17:00),将幼虫分装在收纳箱(62.5 cm × 45.5 cm × 35 cm)内每天更换新鲜的中华润楠枝叶,饲养至其全部化蛹,按化蛹日期与不同性别分别放置在各个网笼(50 cm × 50 cm × 50 cm)内饲养至羽化。成虫羽化24 h内视为1日龄,以此类推。
-
每天定时观察蛹的羽化情况,直到第1头成虫羽化开始,持续每天观察成虫的羽化行为(在暗期使用红光进行观察),每隔1 h观察记录1次雌雄成虫的羽化数,并收集雌雄成虫放置在新的网笼内分开饲养,直到所有蛹全部羽化。
-
预实验表明:异斑酷大蚕蛾雄蛾没有释放性信息素的能力,但在暗期前1个小时内会表现出兴奋、剧烈振翅等行为;雌蛾求偶行为主要为释放性信息素,通常在光期最后2个小时内开始。为此,将新羽化的处女雌蛾分别单独放在500 mL透明塑料圆形盒中,每天5点(光期10 h)观察其求偶行为,实验设置3组重复,每组10只雌蛾,共观察30只雌蛾求偶始末时间与持续时间,每隔30 min记录1次,直到全部雌蛾求偶结束为止。
-
将同一天新羽化的雌雄成虫1对放入500 mL透明塑料圆形盒中饲养并进行观察记录,共设置3个重复,每个重复10对成虫,共30对成虫,观察方法同1.3。
-
待1.4中的实验组交尾后,将已交尾的雌雄成虫集中在一起,观察其产卵行为,每天记录产卵时间与产卵量,同时以1.3中处女雌蛾为对照,记录其产卵时间与产卵量,直到所有雌蛾死亡为止。
-
将新羽化的雌雄成虫分别单独放置在300 mL透明塑料圆形盒内进行饲养并记录其羽化日期,与1.4中已交尾雌雄成虫实验组作对比,每天观察记录两组的死亡数。
-
交尾率 = 交尾对数/总对数 × 100%,求偶率、产卵率计算方法同上。所有数据采用Excel 2013进行统计整理、SPSS 22.0进行方差分析,使用LSD法进行多重比较。
1.1. 供试虫源
1.2. 羽化行为观察及动态节律
1.3. 求偶行为观察及动态节律
1.4. 交尾行为观察及动态节律
1.5. 产卵行为观察及动态节律
1.6. 成虫寿命
1.7. 数据处理
-
成虫羽化前,蛹体先从背中线处裂开,通过持续不断的蠕动,成虫头部得以完全露出,进而成虫的足开始从蛹体慢慢伸出,此过程通常持续5~10 min。待成虫触角晾干以后,成虫腹部开始进一步扭动,同时借助胸足一起推开腹部蛹壳,成虫得以从蛹壳中完全爬出,此时成虫腹部粗长,翅尚未完全展开。之后成虫开始分泌溶解液,将虫茧顶端的蚕丝化开,成虫爬出即开始寻找空旷处进行展翅(图1),待双翅完全展开晾干后会排泄蛹便,整个羽化过程持续20~30 min。
-
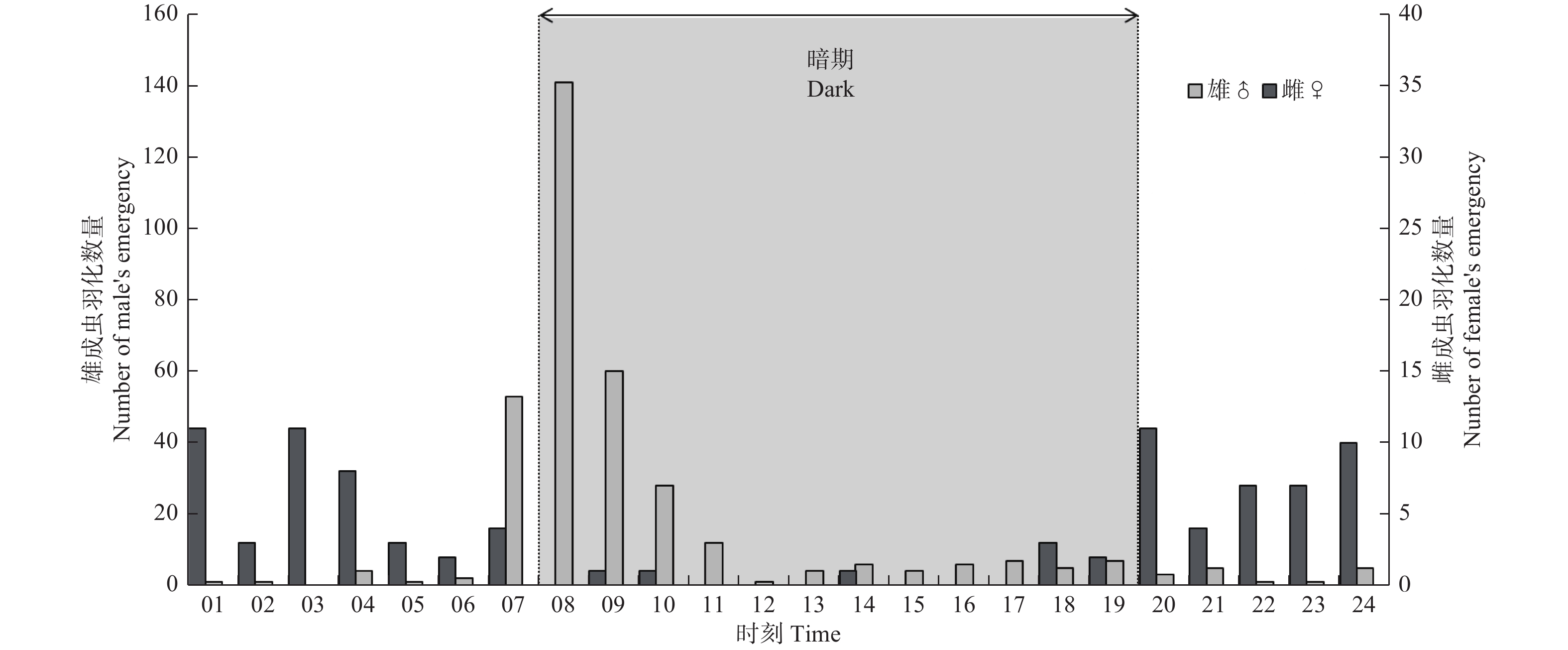
共计观察异斑酷大蚕蛾蛹618个,雌雄蛹比例约为1∶5.24,其中雌蛹99个,羽化率为89.90%;雄蛹519个,羽化率为68.98%。图2显示,异斑酷大蚕蛾在各个时段内均有羽化,但是雌雄成虫羽化时段明显不同。雌成虫主要集中在光期羽化,光期羽化的数量占羽化总数91.01%,其中光期1~9 h为雌蛾的羽化高峰期,占羽化总数的80.90%;雄成虫主要集中在暗期羽化,暗期羽化的数量占羽化总数的78.49%,羽化高峰期为暗期1~4 h,占羽化总数82.12%。
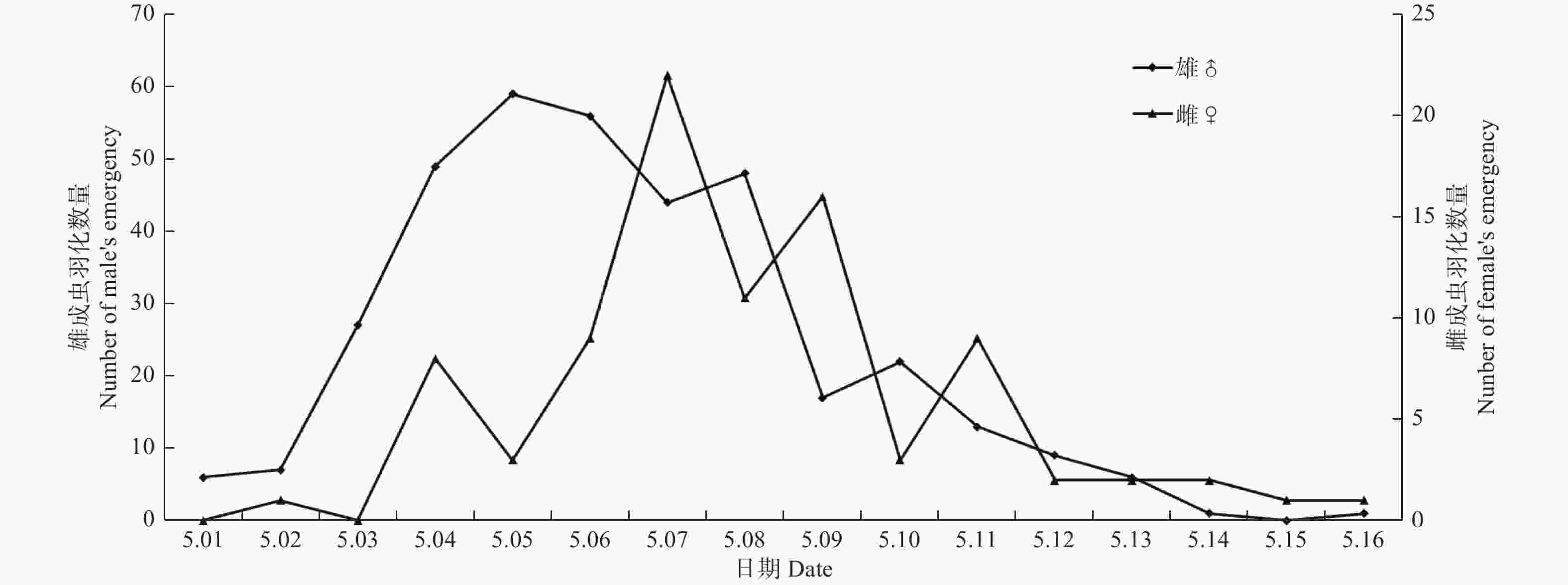
异斑酷大蚕蛾蛹期约为22 d左右,自第一只成虫羽化到最后一头成虫羽化结束,共历时16 d,如图3可见,雄虫主要集中在5月3日到10日羽化,羽化峰值在5日,雌虫主要在5月4日到11日羽化,7日羽化最多。雄虫羽化日动态节律呈单峰性,雌虫羽化峰相比雄虫有明显滞后性,且出现多个峰。
-
观察到异斑酷大蚕蛾雌蛾开始求偶,释放性信息素,雄蛾未发现有求偶行为。雌蛾在进入暗期前即开始求偶,最早求偶时间为5:00,即光期第11 h。雌蛾开始微微振动翅膀,腹部第八、第九节间膜上的性腺表皮开始外翻、膨胀,形成两个半球状黄褐色突起(图4a),持续膨胀与收缩,腹部末端的产卵器外伸并暴露于空气中。雄蛾在此期间,表现为在透明塑料圆形盒内开始剧烈振动翅膀等行为,该过程一般从5点开始,持续到8点左右,即进入暗期1 h内。可以观察到交尾实验组的部分雌蛾会因雄蛾的兴奋状态而影响性信息素的释放,每次中断后一般5~15 min内会继续恢复释放性信息素。
在准备交尾前,雄蛾会飞到雌蛾附近停留,大部分雄蛾会爬到雌蛾体驱,并用足紧抱雌蛾的腹部,开始做交尾准备(图4b),5~10 min后即开始交尾(图4c),少部分雄蛾也会停留在雌蛾附近,采取“一字型”方式交尾,交尾一般持续3 h左右。而未交尾的雌蛾会在11:00以后陆续停止求偶,性腺体慢慢收缩,此时仅仅是第八、第九节间膜被拉长,持续2~3 h后,雌蛾恢复至正常栖息状态。
-
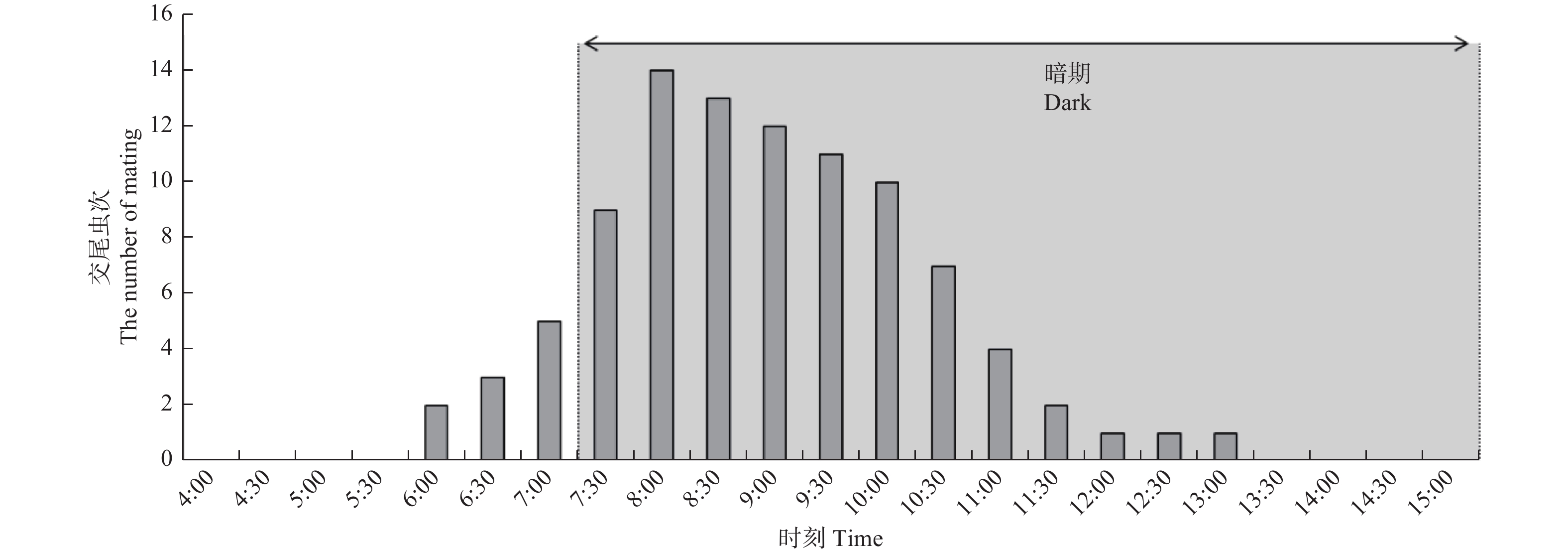
异斑酷大蚕蛾最早雌激素释放时间为4:40左右,从5:00开始雌激素释放的雌蛾逐渐增多(图5),在7:00接近峰值,一直持续到10:30以后雌蛾开始逐渐停止交尾,雌激素释放高峰期在5:30—11:30,该时段释放雌激素的雌蛾占84.48%。雌蛾的激素释放时段主要分布在暗期,暗期雌激素释放虫次占总虫次的74.94%。同时,雌雄成虫交尾时段也是主要分布在暗期(图6),暗期交尾的虫次占89.47%,交尾高峰期在7:00—10:30,该时段交尾虫次占80.00%。
异斑酷大蚕蛾从羽化第1日起即开始释放雌激素,且成虫1日龄雌激素释放率最高,与成虫3~7日龄雌激素释放率差异显著(P < 0.05),1日龄往后的个体雌激素释放率递减。而雌激素释放时长分布呈现M型,5日龄成虫雌激素释放时长最高,2日龄次之,1~6日龄成虫间的雌激素释放时长均无显著性差异。成虫1~3日龄雌激素释放高峰期均在暗期2~3 h内,但1日龄与2日龄差异显著(P < 0.05),其他日龄成虫雌激素释放高峰期均在暗期1~2 h内(表1)。此次实验共有30对成虫,交尾率为46.67%,其中1、2日龄交尾率最高(表2),与4日龄交尾率差异显著(P < 0.05),而交尾时长也是4日龄成虫最低,与1日龄成虫交尾率差异显著(P < 0.05)。在交尾高峰期上,成虫1~4日龄间并无显著性差异,未观察到5日龄以上的成虫有交尾行为(表2)。
日龄 Day-old 雌激素释放高峰期 Peak period of calling/h 雌激素释放率 Ratio of calling/% 雌激素释放时长 Duration of calling/h 1 2.43 ± 0.10 a 93.33 ± 6.67 a 5.44 ± 0.20 a 2 2.07 ± 0.12 b 76.67 ± 8.82 ab 5.62 ± 0.33 a 3 2.10 ± 0.15 ab 70.00 ± 5.77 bc 5.32 ± 0.56 ab 4 1.58 ± 0.17 c 56.67 ± 6.67 cd 4.94 ± 0.67 ab 5 1.72 ± 0.17 bc 40.00 ± 0.00 de 5.74 ± 0.62 a 6 1.48 ± 0.21 c 36.67 ± 3.33 e 4.80 ± 0.73 ab 7 1.12 ± 0.32 c 16.67 ± 3.33 f 3.43 ± 0.41 b 注:表中数值都为平均值 ± 标准误差,同一纵列中不同字母代表差异显著(P < 0.05),下同。雌激素释放高峰期数值均为进入暗期后的时长。
Note: Data in the table are mean ± SE. Data in a column with different letters are significantly different (P < 0.05), the same below. The value of the “Peak period of calling” is the length of time after entering the dark period.Table 1. Calling behavior of female adults at different ages
日龄 Day-old 交尾高峰期 Peak period of mating/h 交尾率 Ratio of mating/% 交尾时长 Duration of mating/h 1 2.04 ± 0.26 a 20.00 ± 5.77 a 3.21 ± 0.60 a 2 1.81 ± 0.22 a 20.00 ± 5.77 a 2.81 ± 0.34 ab 3 1.88 ± 0.27 a 6.67 ± 3.33 ab 3.04 ± 0.04 ab 4 1.75 ± 0.32 a 3.33 ± 3.33 b 1.33 ± 0.17 b Table 2. Mating behavior of adults at different ages
-
雌蛾交尾结束后10~30 min内会进行产卵,数额不定,且产卵通常在暗期进行(图4d)。刚产的卵呈米黄色,之后卵粒逐渐变成乳白色。在野外,交尾后的雌蛾会在寄主叶片背面产卵,产卵方式为聚产,产卵位置在距叶缘4~6 mm处,卵较多时每枚叶片上有70~110粒卵,排列呈“U”字型,卵粒部分堆叠(图7a);卵较少时每枚叶片上有10~30粒卵,呈圆弧状排列。在室内,交尾雌蛾产卵方式为散产,一次产卵较多时卵粒会堆积且无规律性(图7b)。
交尾过的雌蛾一般会在交尾后连续2~3 d产卵,且产卵数呈递减趋势。未交尾的雌蛾通常在寿命即将耗尽的最后几天内产卵,产卵数呈递增趋势。交尾雌蛾最大产卵量为271粒,最长产卵期为6 d,最大日产卵量为191粒。未交尾雌蛾最大产卵量为234粒,最长产卵期为6 d,最大日产卵量为220粒。交尾与未交尾雌蛾产卵情况不同(表3),交尾雌蛾无论产卵率、产卵天数与产卵数均高于未交尾雌蛾,且不同处理雌蛾在产卵数上差异显著(P < 0.05)。
处理
Treatment产卵率
Oviposition rate/%产卵虫数
Number of adults after oviposition产卵期
Ovipositiondays/d产卵量
The egg number交尾雌蛾
Mated female95.24 20 3.30 ± 0.34 a 163.65 ± 16.28 a 未交尾雌蛾
Virgin female74.07 40 2.60 ± 0.26 a 107.45 ± 11.36 b Table 3. Oviposition behavior of female under different treatments
-
异斑酷大蚕蛾成虫寿命与交尾情况有关(表4),成虫平均寿命为5 d左右,未交尾雌(雄)虫平均寿命大于交尾雌(雄)虫,相同生殖状态下雌虫平均寿命大于雄虫,但是不同处理雌雄成虫寿命之间均无显著性差异。
处理
Treatment观察虫数
Number ofsamples最短寿命
Minimum lifespan/d最长寿命
Maximum lifespan/d平均寿命
Mean oflifespan/d未交尾雄 Virgin male 33 2 9 5.02 ± 0.10 a 未交尾雌 Virgin female 33 3 10 5.27 ± 0.34 a 交尾雄 Mated male 14 2 7 4.71 ± 0.41 a 交尾雌 Mated female 14 2 8 4.93 ± 0.46 a Table 4. The lifespan of adults under different treatments
2.1. 羽化过程
2.2. 羽化节律
2.3. 求偶与交尾过程
2.4. 雌激素释放、交尾节律
2.5. 产卵过程与节律
2.6. 成虫寿命
-
蛾类昆虫的生殖过程是从羽化开始的,随着雌蛾性器官发育成熟开始在体内合成性信息素,而后才有成虫求偶、交尾、产卵等一系列生殖行为,其中光照条件、昼夜节律等重要因子,对昆虫的生殖行为及生理代谢都具有显著影响[13-14]。同样,异斑酷大蚕蛾的羽化和生殖行为受昼夜节律影响显著且有明显阶段性,全天可见成虫羽化,但是雄蛾主要在暗期羽化,而雌蛾主要在光期羽化,这种雌雄羽化时段的非一致性不同于其他的蛾类,如褛裳夜蛾(C. remissa)、甜菜夜蛾(Spodoptera exigua(Hodopte))主要在暗期羽化[10, 15],核桃举肢蛾(Atrijuglans hetaohei Yang)、苹果蠹蛾(Cydia pomonella L.)主要在光期羽化[16-17]。且与大多数蛾类羽化规律一样,雄成虫羽化一般要早于雌成虫1~2 d,推测这种羽化日期的差异可以使雄虫更早性成熟,以便于寻找刚羽化的处女雌虫进行交尾。
不同鳞翅目昆虫的性发育时间存在着差异,黄野螟(Heortia vitessoides Moore)需要1 d时间[18],褛裳夜蛾需要2 d时间[10],而异斑酷大蚕蛾羽化当天的1日龄成虫就已经性成熟,可以开始释放雌性激素、交尾、产卵等一系列生殖行为,这与杨扇舟蛾(Clostera anachoreta (Fabricius))、杨小舟蛾(M. sieversi)、黄褐幕枯叶蛾(Malacosoma neustria testacea L.)等蛾类相似[12, 19-20],推测由于异斑酷大蚕蛾成虫寿命较短,所以性成熟的时间缩短,成虫羽化后数小时即可性成熟。成虫生殖行为主要在临近暗期和暗期前段时段内进行,而大部分蛾类天敌(鸟类、蝙蝠)都有着明显的昼夜节律,该生殖行为特点可以使成虫避开大部分天敌的捕食,且成虫求偶、交尾行为的高峰期在前后时间上的延续进行,体现了该虫羽化、求偶、交尾等行为是具有协调性的。随着日龄的增加,雌蛾的求偶率与求偶时长会显著减少,且求偶的时段会逐渐提前,这种生殖行为策略与大多数鳞翅目昆虫相似[21-23],这也符合Swier的观点,高龄雌蛾以提前求偶来增加对低龄雌蛾的交配竞争力[24]。同样地,雌蛾交尾率与交尾时长也与日龄成负相关关系,这与六星黑点豹蠹蛾高龄成虫交尾时长更长不同[25],一般来说,成虫交配时间会受日龄的影响,雄虫可以在交配过程中通过延长交配时间来增加生殖力,以达到占有雌虫,降低其再次交配的几率[26-27],但是由于生命力不足反而会使雌雄双方付出更高的交配价[12]。观察发现通常高龄雌蛾求偶持续时长突然缩短以后,当天就会死亡,说明求偶时长突然缩短主要是由于生命力不足引起。昆虫成虫阶段主要的生存意义即繁衍后代,同样异斑酷大蚕蛾雌蛾交尾结束后会立刻进行产卵,通常产卵持续2~4 d,交尾成虫产卵周期比未交尾成虫长,最长产卵天数可达6 d,与交尾雌蛾寿命相当,且交尾行为会显著影响雌蛾的产卵量(P < 0.05)。另有研究表明,植食性昆虫可以通过视觉、味觉、嗅觉和触觉等行为模式对产卵方式、产卵场所的识别与选择等行为进行调控[28-29],依照“Preference-Performance”学说,植食性昆虫的幼体的环境适应能力通常取决于成虫的寄主选择行为,对于这类昆虫,会优先选择那些能最大限度使其后代存活的植物,导致成虫产卵偏好跟幼虫生长存活、种群参数之间有正相关关系[30-33]。因此异斑酷大蚕蛾才会选择在有利于后代发育生长的最佳寄主上进行产卵,在这个过程中寄主植物的形状、颜色以及挥发性物质都会对昆虫的选择产生影响[34-35],所以异斑酷大蚕蛾在室内与野外采取不同的产卵方式很可能与生境或寄主植物有关。相同生殖情况下雌虫平均寿命大于雄虫,未交尾成虫平均寿命大于交尾成虫,证明交尾行为可以减少成虫的寿命,这一规律已在大部分鳞翅目蛾类昆虫中进行报道[10, 18, 20, 36]。
近些年来,昆虫性信息素因其高效专一、绿色环保、不产生耐药性、对天敌无害等优点,成为害虫防治的一项重要手段[8, 37],因此,掌握成虫的生殖行为节律有利于把握提取性信息素的最佳时机,为下一步研究异斑酷大蚕蛾性信息素活性组分与野外诱捕试验奠定基础,进而通过性信息素引诱法诱杀雄蛾或迷向法干扰雌雄蛾交配等方式降低交配率,从而降低林间异斑酷大蚕蛾的种群密度。
-
异斑酷大蚕蛾雌雄羽化时间有着非一致性,雄蛾主要在暗期羽化,雌蛾主要在光期羽化。成虫生殖行为主要在临近暗期和暗期前段时段内进行,且1日龄成虫生殖行为最为活跃,成虫的求偶(交尾)高峰期、求偶(交尾)率、求偶(交尾)时长均与日龄成负相关关系。交尾会减少雌雄成虫的寿命,无论是否交尾雌蛾都会产卵,但是交尾雌蛾的产卵率、产卵量和产卵天数比未交尾雌蛾都要多。











 DownLoad:
DownLoad: