-
核桃(Juglans regia L.)含有大量易消化的脂肪(60%~75%)、蛋白质(约20%)和糖类(约10%)。此外,还含有其他有益的营养成分,如磷、钾、铁、钙、镁、锰等以及多种维生素、多酚、类黄酮、磷脂、花青素等功效成分,是世界公认的保健食品[1]。近年来,转录组测序、Northen杂交,cDNA文库构建、逆转录PCR、基因克隆等分子生物学手段日益普及,提取总RNA是从基因组学入手研究核桃生长和代谢过程的基础环节[2-3]。诸多研究表明,多糖易与RNA在提取过程中形成共沉淀,使RNA埋在多糖形成的粘稠难溶的胶状物中难于分离,且发生降解,严重影响RNA的产量和质量[4-5];而酚类化合物的含量较高,则极易被氧化为醌类物质,导致RNA失活,产量降低[6]。因此,多糖和多酚等次生代谢物等在核桃体内广泛大量存在,导致一般提取方法效率低下,难以获得可靠核桃RNA。另外,植物组织特异性也会影响提取效果,植物不同时期不同组织,由于上述干扰物质积累不同[7],同一方法提取效果差异巨大。因此,有必要对核桃进行RNA提取方法筛选优化,进而对不同时期不同组织有针对性的改良。
目前,关于核桃总RNA的提取方法已有报道,其研究主要是针对核桃芽[8]、胚[9]、叶片[10]总RNA提取方法的比较,但对于同一组织的不同发育时期以及同一种植物的不同组织总RNA提取方法的筛选和优化还未见报道。本研究采用改良硼砂—CTAB法、改良硼砂—CTAB—异丙醇法、改良SDS法、改良Trizol法Ⅱ以及试剂盒法分别提取核桃幼嫩叶片,成龄叶片和衰老叶片的总RNA,并将筛选出的改良硼砂—CTAB法、改良硼砂—CTAB—异丙醇法分别提取核桃胚、叶柄、韧皮部、雄花的总RNA,以期找到从核桃不同发育时期叶片以及不同组织中提取总RNA的最佳方法,为后续开展核桃的分子生物学等研究工作奠定基础。
HTML
-
供试材料选自河南科技大学林学院实验基地,核桃品种为“晋中2号”,分别于2019年4月下旬、7月中旬、9月下旬随机从树的不同方位挑取幼嫩叶片,成龄叶片和衰老叶片;5月初采集雄花、叶柄和韧皮部;果实发育期采集实验用胚;立即液氮速冻,带回实验室置于−80℃冰箱中保存。
试验所用试剂有CTAB(十六烷基三甲基溴化铵)、SDS(十二烷基苯磺酸钠)、PVP–40 (聚乙烯吡咯烷酮)、DEPC(焦炭酸二乙酯)、LiCl,均来自上海沪试实验室器材股份有限公司。提取RNA的试剂用经高压灭菌的0.1% DEPC水直接配置。Trizol试剂、RNA plant plus Reagent植物总RNA提取试剂盒、PrimeScriptTM 1st Strand cDNA Synthesis Kit反转录试剂盒均购自宝生物工程有限公司。
-
试验中所用的离心管、枪头、枪头盒等塑料器皿经0.1% DEPC水37℃浸泡过夜后于121℃高温高压灭菌40 min后使用,研钵、药匙、玻璃器皿等用锡箔纸包好后置于180℃烘箱中灭菌8 h。试验均设置3次重复,涉及提取方法如下。
-
参照宋艳波等[8]方法提取,并进行了部分优化。将硼砂—CTAB提取缓冲液(0.025 mol·L−1硼砂(pH 8.5);1.5 mol·L−1 NaCl;2% CTAB;0.1% Vc;1% DTT;250 mg·L−1糖原)于65℃水浴中温育30 min,其余步骤相同。
-
参照王艳等[3]方法提取,并进行了部分优化。在1.5 mL离心管中加入1 000 μL提取缓冲液(0.025 mol·L−1硼砂(pH 8.5);1.5 mol·L−1 NaCl;2% CTAB;0.1% Vc;1% DTT;250 mg·L−1糖原)于65℃水浴中温育30 min后加50 μL β-巯基乙醇,其余步骤相同。
-
参照孟晓庆等[11]方法提取。
-
参照王其海等[12]方法提取。
-
按照宝生物工程有限公司的RNA plant plus Reagent植物RNA快速提取试剂盒说明书进行(此试剂盒主要针对多糖多酚类植物设计)。
-
分别取3 μL总RNA在1.0%普通琼脂糖凝胶电泳上进行电泳检测,125 V恒压电泳20 min,EB染色后在紫外凝胶成像系统中观察并拍照记录,根据28S、18S、5S条带的清晰度和相对含量评估总RNA的完整性。
-
取1 μL总RNA样品,用NanoDrop ND–2000c型超微量紫外分光光度计检测RNA浓度以及OD260/OD280、OD260/OD230值和RNA产率。
-
按照PrimeScriptTM 1st Strand cDNA Synthesis Kit反转录试剂盒说明进行反转录。根据内参基因18S核糖体RNA(18S rRNA)基因[13]和核桃翻译起始因子(JreIF1A)序列[14],利用Primer Premier 5.0软件设计引物(表1)。扩增条件:95℃预变性2 min;94℃变性30 s,60℃退火30 s,72℃延伸30 s,35个循环,最后72℃总延伸10 min。将PCR扩增产物在1.0%琼脂糖凝胶上电泳检测。引物合成和基因测序委托上海生工生物工程股份有限公司完成。
基因名称 Gene name 引物序列 Primer sequence 产物长度 Product length/bp 18S rRNA F:5′- AGAGGCCTACAATGGTGGTG - 3′
R:5′- CCAATGGATCCTCGTTA - 3′102 JreIF1A F:5′- ATGCCGAAGAACAAGGGTAAGG - 3′
R:5′- CGATTCTAGTTAGATCTTATCAATATCCTCG - 3′438 Table 1. Primers used for RT-PCR
-
为了进一步验证筛选和优化的提取方法是否也适用于核桃的其他组织。将优选出的改良硼砂—CTAB法、改良硼砂—CTAB—异丙醇法分别提取核桃胚、叶柄、韧皮部、雄花的RNA并进行同上检测。
1.1. 试验材料与试剂
1.2. 试验方法
1.2.1. 改良硼砂—CTAB法
1.2.2. 改良的硼砂—CTAB—异丙醇法
1.2.3. 改良SDS法
1.2.4. 改良Trizol法Ⅱ
1.2.5. 试剂盒法
1.3. 总RNA质量检测
1.3.1. 总RNA完整性检测
1.3.2. 总RNA浓度和纯度的检测
1.3.3. RT–PCR检测
1.4. 筛选出的总RNA提取方法对核桃不同组织RNA的提取效果
-
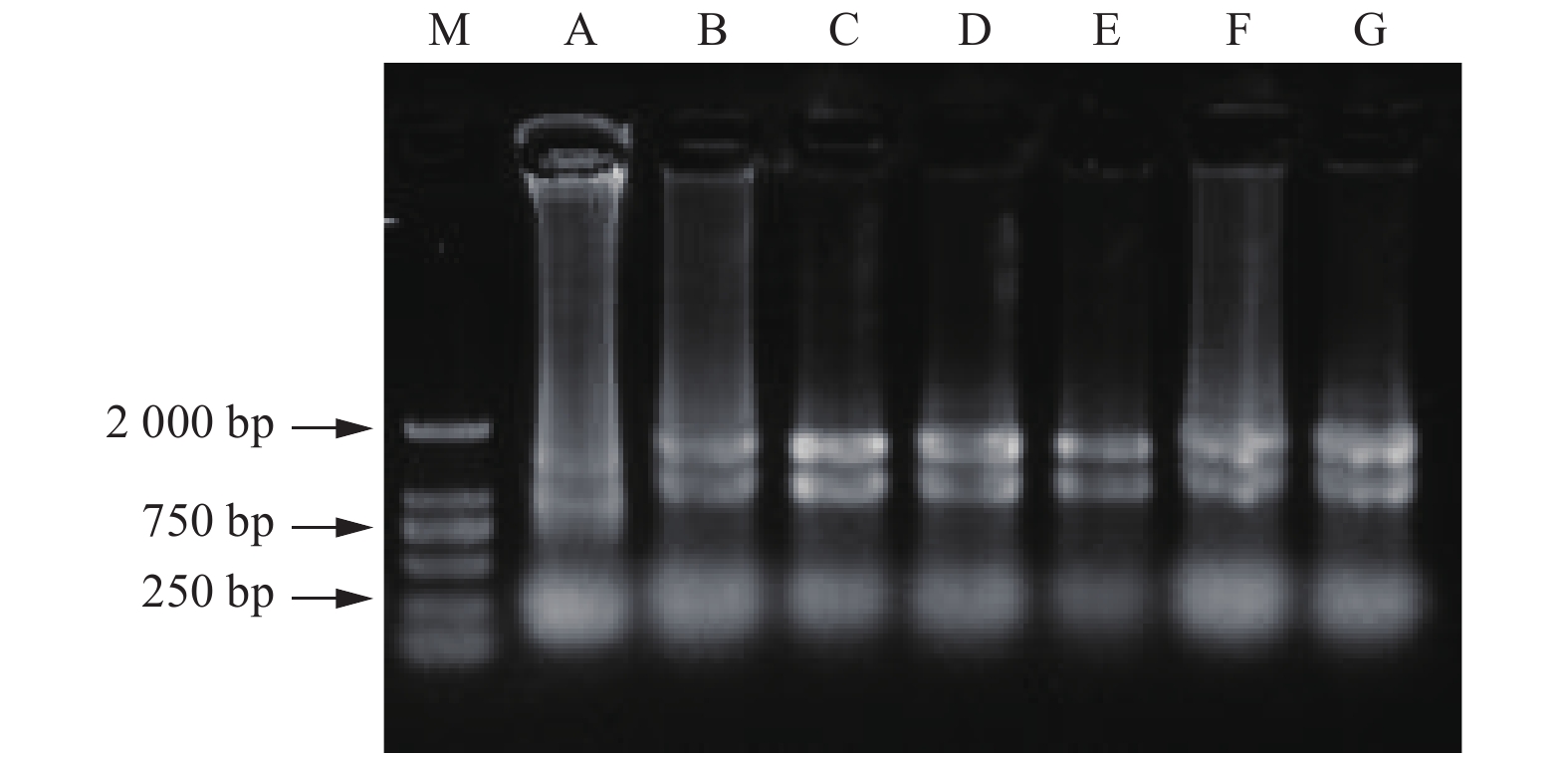
核桃幼嫩叶片中除了改良SDS法,其他方法均获得了不同品质的RNA。改良SDS法虽然操作步骤简单,但实验结果不理想,未提取出RNA(图1E)。改良Trizol法Ⅱ呈现28S rRNA、18S rRNA和5S rRNA 3条带明亮,但条带有拖尾现象,点样孔附近发亮,说明有RNA降解并存在蛋白质和多糖等杂质污染,DEPC处理水溶解沉淀时溶液黏稠(图1A)。试剂盒法提取的RNA条带较暗,且5S rRNA条带不明显(图1B)。改良硼砂—CTAB—异丙醇法和改良硼砂—CTAB法均提出了28S rRNA、18S rRNA和5S rRNA 3条带(图1C、D),相比较而言,改良硼砂—CTAB—异丙醇法的5S rRNA条带亮度较弱,改良硼砂—CTAB法提取的总RNA点样孔干净,且28S rRNA亮度大约是18S rRNA的2倍,说明提取过程中没有降解的发生,DNA和蛋白质、多糖污染少,分析后发现优化的效果很明显。
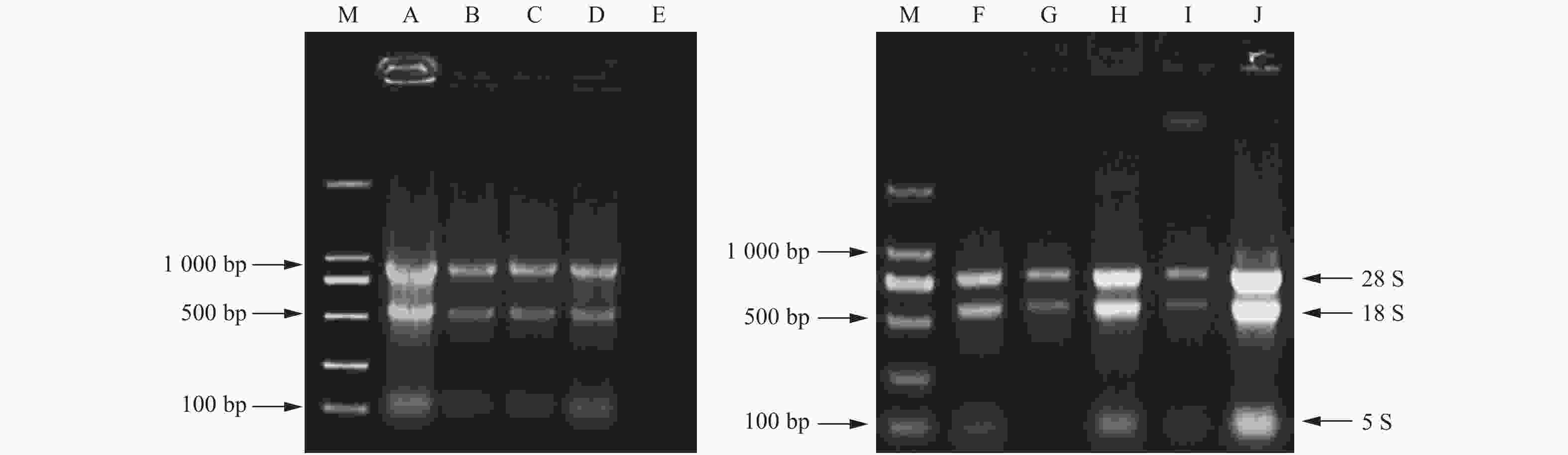
Figure 1. Agarose gel electrophoresis of total RNA extracted from young and mature leaves of Juglans regia L
. by different methods 成龄叶片中5种方法都获得了核桃总RNA,改良Trizol法Ⅱ提取到的28S rRNA和18S rRNA条带最亮,而且两条带宽度相当,但在点样孔处仍然发亮(图1J)。试剂盒法和改良SDS法28S rRNA和18S rRNA 2条带较暗(图1G、I),5S rRNA都不明显。改良SDS法提取物中有DNA残留。改良硼砂—CTAB法28S rRNA、18S rRNA和5S rRNA 3条带明亮、清晰、无拖尾,所提取的总RNA完整性好且无明显降解(图1H)。
-
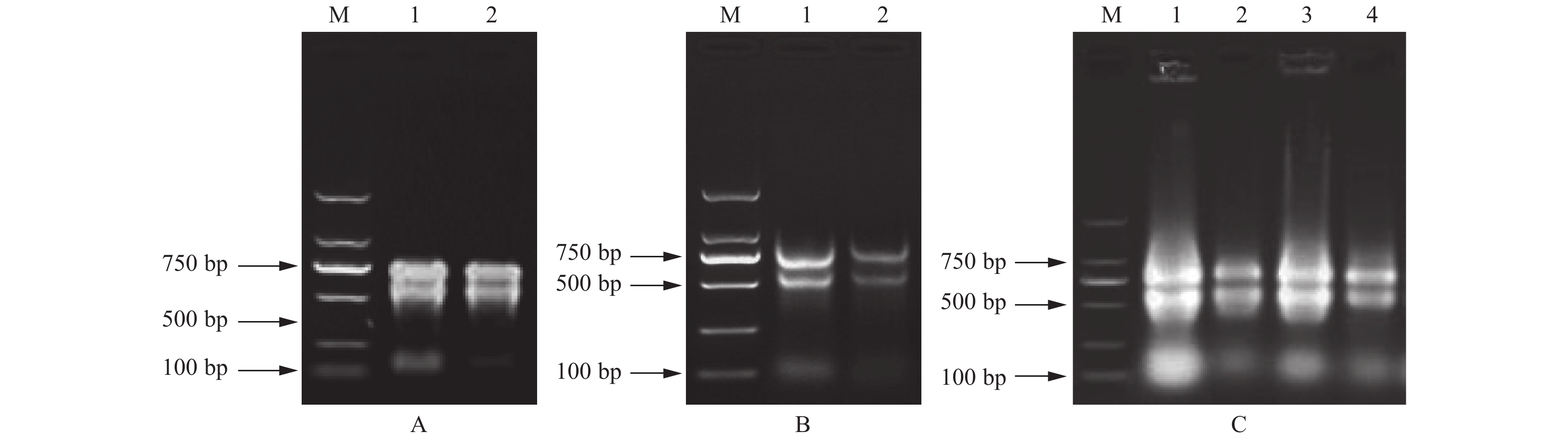
进入衰老期的叶片提取时,通过肉眼观察沉淀发现:改良Trizol法Ⅱ、改良SDS法、改良硼砂—CTAB法提取的RNA沉淀均为浅褐色,并且溶解后溶液黏稠易拉丝状;改良硼砂—CTAB—异丙醇法和试剂盒法沉淀均为白色;改良Trizol法Ⅱ和改良SDS法点样时,都存在不同程度的“漂样”现象。凝胶电泳结果(图2)显示:除改良硼砂—CTAB—异丙醇法(图2C~E)外,其他4种方法(图2A、B、F、G)均有明显的拖尾和降解现象,提取效果差。改良Trizol法Ⅱ(图2F)提取与幼叶、成龄叶片相似,依然存在蛋白质和多糖等杂质污染。
-
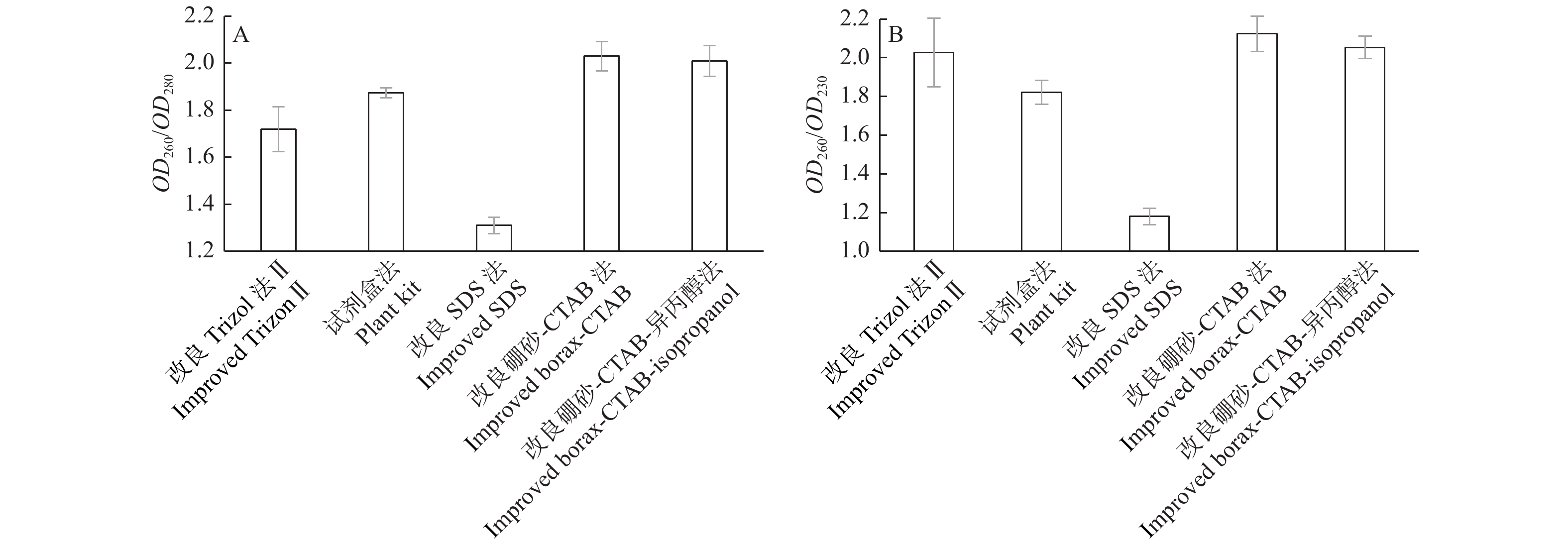
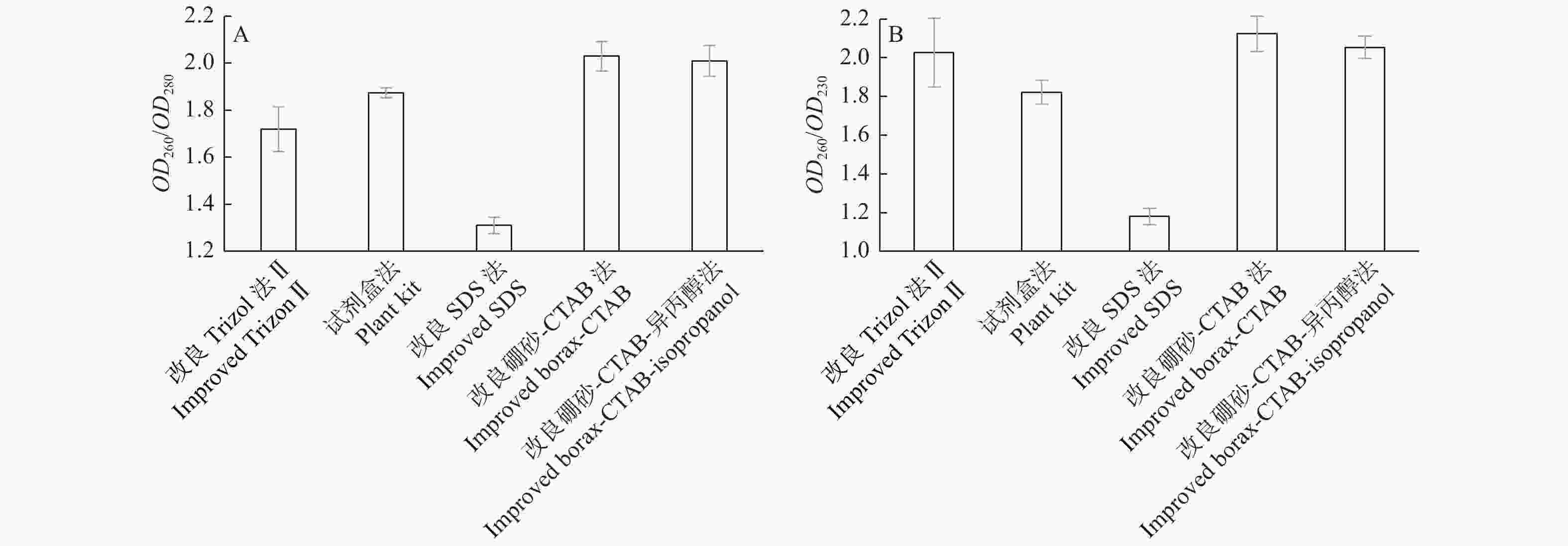
改良硼砂—CTAB法和改良硼砂—CTAB—异丙醇法提取幼嫩叶片和成龄叶片总RNA的OD260/OD280为1.9~2.1,OD260/OD230值大于2.0,说明其纯度较好;相较质量浓度而言,改良硼砂—CTAB法比改良硼砂—CTAB—异丙醇法提取浓度更高(表2);改良Trizol法Ⅱ提取的这2个时期叶片质量浓度最高,但OD260/OD280都小于1.8,说明有蛋白质污染。核桃衰老叶片总RNA的纯度和质量浓度,只有改良硼砂—CTAB—异丙醇法的OD260/OD280和OD260/OD230值在标准范围内,说明杂质去除较为彻底。5种不同方法提取的总RNA纯度通过比较OD260/OD280和OD260/OD230平均值进行评估,如图3所示:改良Trizol法Ⅱ、改良SDS法和试剂盒法提取总RNA的OD260/OD280值均低于2.0;改良硼砂—CTAB法和改良硼砂—CTAB—异丙醇法提取总RNA的OD260/OD280值都超过2.0;改良SDS法和试剂盒法提取总RNA的OD260/OD230值远小于2.0;其他3种方法均超过2.0。因此,综合比较5种方法,改良硼砂—CTAB法和改良硼砂—CTAB—异丙醇法对于不同时期叶片提取平均效果最好,OD260/OD280和OD260/OD230值均在2.0以上,符合RNA提取要求,总RNA纯度更好。
方法
Method不同时期叶片
Leaves in different growth stagesOD260/OD280 OD260/OD230 质量浓度/(ng·μL−1)
RNA concentration改良Trizol法Ⅱ
Improved TrizonⅡmethod幼嫩叶片 Young leaves 1.78 2.25 1 384.9 成龄叶片 Mature leaves 1.77 2.24 1 609.5 衰老叶片 Senescing leaves 1.61 1.59 110.9 试剂盒法
Plant kit method幼嫩叶片 Young leaves 1.89 1.92 699.8 成龄叶片 Mature leaves 1.85 1.74 440.8 衰老叶片 Senescing leaves 1.88 1.80 507.5 改良SDS法
Improved SDS method幼嫩叶片 Young leaves 0.52 0.33 10.9 成龄叶片 Mature leaves 1.76 1.80 445.1 衰老叶片 Senescing leaves 1.87 1.74 524.1 改良硼砂-CTAB法
Improved borax-CTAB method幼嫩叶片 Young leaves 2.01 2.23 996.3 成龄叶片 Mature leaves 2.10 2.19 1 185.2 衰老叶片 Senescing leaves 1.98 1.95 780.8 改良硼砂-CTAB-异丙醇法
Improved borax-CTAB-isopropanol method幼嫩叶片 Young leaves 1.95 2.03 787.6 成龄叶片 Mature leaves 2.00 2.01 940.9 衰老叶片 Senescing leaves 2.08 2.12 1 019.0 Table 2. The purity and concentration of the total RNA with different kinds of RNA extraction method in different tissues
-
利用优选出的改良硼砂—CTAB法和改良硼砂—CTAB—异丙醇法分别提取核桃胚、叶柄、韧皮部、雄花的总RNA,经琼脂糖凝胶电泳检测,结果(图4)显示:改良硼砂—CTAB法最适合叶柄和雄花的提取,获得的条带清晰、完整、无拖尾。对于胚和韧皮部的提取并不理想,28S和18S存在弥散严重、拖尾和降解,多糖和蛋白质等污染。改良硼砂—CTAB—异丙醇法则提取胚和韧皮部的效果较好,点样孔处无亮斑,无DNA的污染,条带的亮度与清晰度达到要求。
-
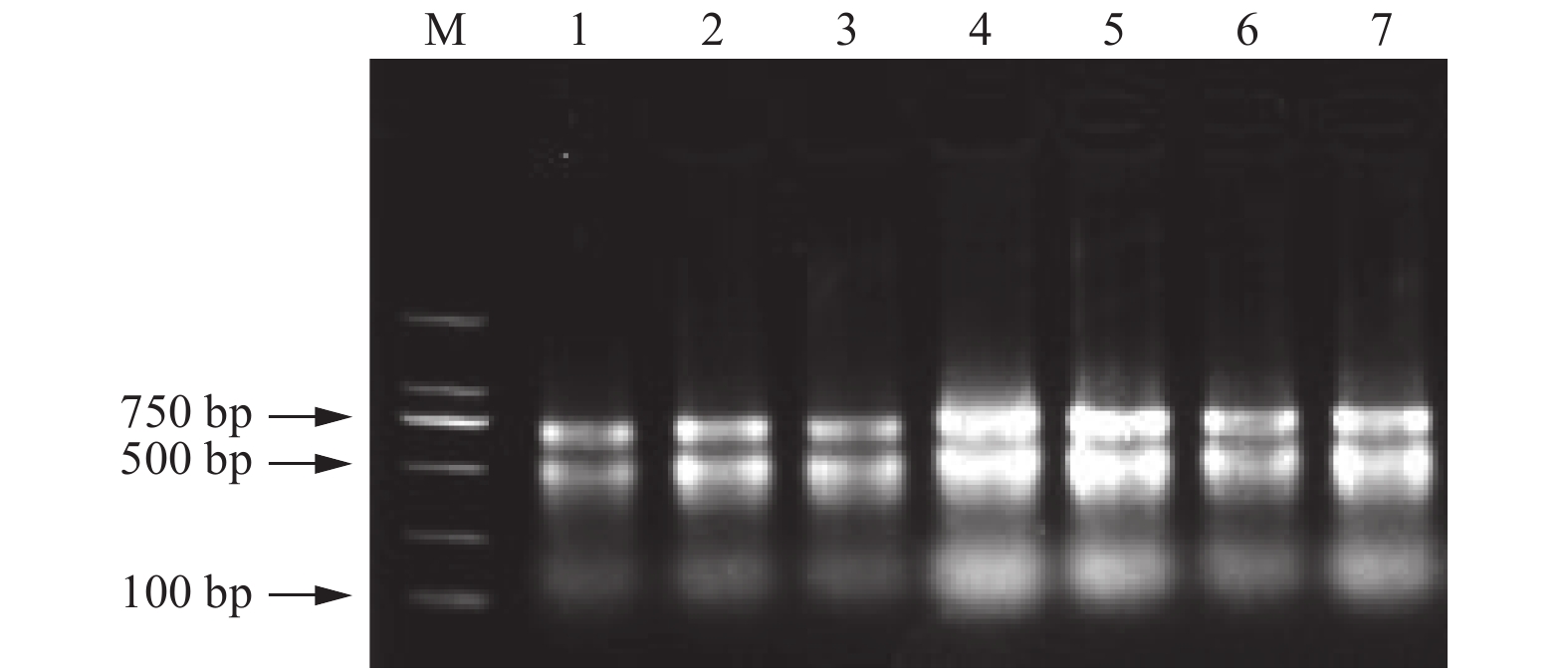
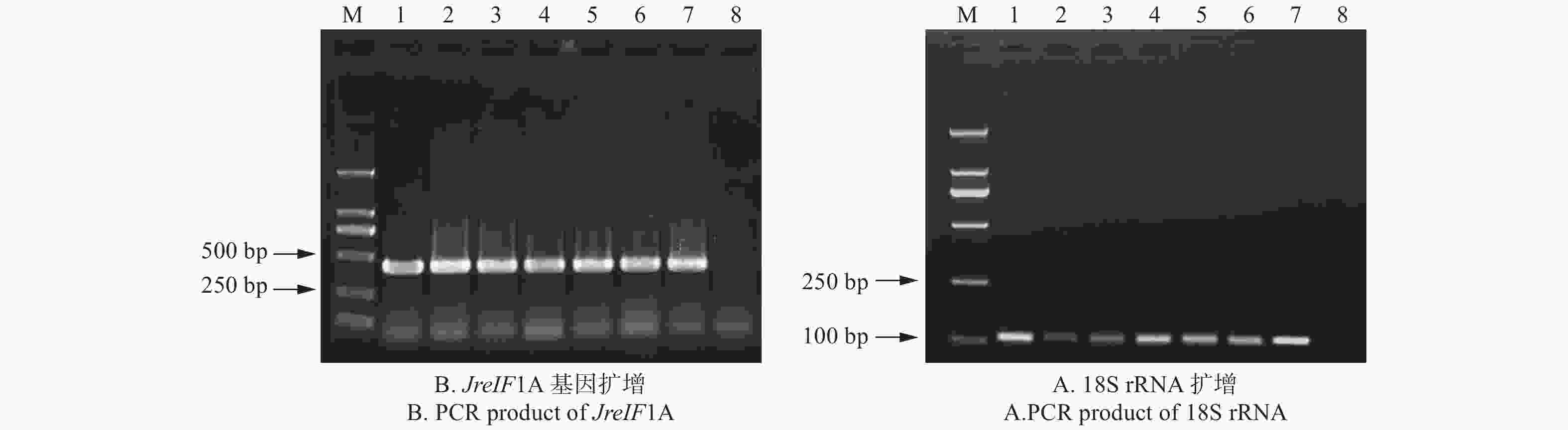
将改良硼砂—CTAB法提取的核桃幼嫩叶片、成龄叶片、叶柄和雄花;改良硼砂—CTAB—异丙醇法提取的核桃衰老叶片、胚和韧皮部总RNA进行电泳检测,如图5所示:28S、18S、5S条带明亮。经反转录,并设计内参基因18S核糖体RNA基因(18S rRNA)和核桃翻译起始因子(JreIF1A)引物,以反转录产物为模板进行扩增后电泳检测,验证所提RNA能否满足后续试验要求。PCR产物电泳结果(图6),在Mark 500 bp附近获得明亮的特异目的条带,与预期的基因片段大小一致。为进一步保证试验结果的准确性,将JreIF1A引物所扩增片段测序经比对与JreIF1A(NCBI基因号:XM018972344.1)的ORF基因序列完全一致,说明这2种方法提取的总RNA能用于后期的分子生物学试验。
2.1. 不同发育时期核桃叶片总RNA的完整性比较
2.1.1. 幼嫩叶片和成龄叶片
2.1.2. 衰老叶片
2.2. 不同发育时期核桃叶片总RNA质量浓度和纯度的比较
2.3. 筛选与优化的2种方法对核桃其他组织总RNA的提取效果
2.4. 核桃总RNA的RT—PCR检测
-
目前,关于如何获得高质量木本植物总RNA的方法已经有大量的探索与研究,但实践证明没有一种方法是通用的。主要因为不同RNA提取方法对不同发育时期,不同器官及不同组织的提取效率不尽相同[15]。核桃属于多年生木本植物,且不同时期组织结构和组成上存在异质性,特别是多糖、多酚、蛋白质等次生代谢物在不同组织中互有差异,且随着个体不断成熟,同一组织内源、外源RNA酶含量逐渐丰富,各种水解酶大量积累,多酚和多糖的含量也随之增加[16]。在完整的植物细胞中,这些物质与核酸是分离的,但在提取过程中细胞碎裂,即与RNA相互作用以复合体形式存在,导致各组织RNA提取过程中出现质量差、产量低、容易降解等问题[17-18]。因此,为确保获得高质量的RNA以应用于后续分子生物学试验,有必要针对核桃不同发育时期及组织筛选出最佳RNA提取方法。
研究发现,改良硼砂—CTAB法对于幼嫩叶片和成龄叶片均有较好的RNA提取效果;而改良SDS法仅适用于成龄叶片,未能提取幼嫩叶片中的RNA。改良SDS法步骤简单,在去除核桃多糖干扰方面效果较好,但对于解决幼嫩叶多酚物质的干扰能力方面较弱,从而无法从组织中提取出完整的RNA[19]。而改良硼砂—CTAB法,不仅可以高效去除多糖干扰,对幼叶当中的酚类等干扰物也有很好的清除作用。改良硼砂—CTAB提取液中1.5 mol·L−1的高浓度NaCl和CTAB共同作用可以高效除去多糖杂质,避免在溶解时易与RNA一起沉淀,溶解后呈黏稠状的胶质溶液[20-21];而在研磨过程中加入PVPP,可以主动吸附酚类、蛋白质等,形成螯合物,避免酚类与RNA结合,同时Vc和DTT也可以防止提取过程中酚类物质氧化的发生[8]。另外,CTAB是一种强烈的去垢剂,可以很好的打破植物细胞,释放核酸,并对蛋白的变性凝聚有很强的效果[9],进一步提高提取效率。
改良硼砂—CTAB—异丙醇法更适用于对衰老叶片的提取,其他4种方法不同程度地存在降解或多糖、蛋白质污染等现象。多数落叶树种在生长季的后期会积累更多的糖类物质[22],组织衰老后会比幼嫩组织积累更多的酚类物质,因此,改良硼砂—CTAB—异丙醇法在操作过程中,除改良硼砂—CTAB的干扰物质的去除办法外,另外加入了大量的抗氧化剂β-巯基乙醇,避免氧化,同时增加多次加氯仿抽提,这样使得组织更充分地分散在试剂中使乳化更充分,有效抑制RNA酶RNA降解作用,并且可以更好地去除蛋白质和杂质[23]。改良硼砂—CTAB—异丙醇提取液在低温存放时易形成白色固体颗粒,加长65℃水浴中温育时间,可以使白色固体颗粒充分溶解,样品更充分地分散在试剂中,很好的发挥其药效。
改良硼砂—CTAB—异丙醇法对于胚、韧皮部也有较高的提取效率。核桃胚因富含多糖、油脂(含量高于其他组织)和蛋白质以及其它次生代谢物质,多酚、色素等物质在提取过程中易被氧化导致褐变,导致RNA失去活性[24-25],改良硼砂—CTAB—异丙醇法通过螯合剂、抗氧化、表面活性剂(CTAB)、选择性沉淀RNA(LiCl)[26-27]、多次抽提等措施可以很好解决。果树韧皮部的组织木质化程度高,细胞壁较厚[28],导致细胞裂解不完全,可能是提取效率低下的重要原因,因此,改良硼砂—CTAB—异丙醇提取液中加入10% PVPP,β-巯基乙醇与材料共研磨,多次抽提、加长裂解时间,避免氧化同时完全裂解[29],最终取得较好的提取效果。另外,改良硼砂—CTAB法操作时间相对较短,提取叶柄和雄花的RNA条带清晰,品质佳;而改良硼砂—CTAB—异丙醇法虽然也能提取出完整的RNA,但质量浓度较小,可能主要是由于多次抽提,操作时间相对较长导致RNA产量降低。
改良硼砂—CTAB法与改良硼砂—CTAB—异丙醇法,针对文中不同核桃组织多糖、酚类、蛋白质等干扰物含量高、组织结构差异性等特点,有针对性的进行了改良,有较好的普遍适用性,而且相对经济高效。二者有较高的相似性,改良硼砂—CTAB—异丙醇法耗时更长,操作更复杂,但对于难提取的胚、韧皮部等部位有更好的提取效果,实际操作可以同时多组进行,提高效率。本研究筛选优化的2种方法创新性尤其在于考虑到同一组织不同时期组织的特异性提取需求。试剂盒法虽然基于多糖植物组织开发,操作简单便捷且耗时较短,但因为上述各种核桃组织存在不同的组织结构特异性,不同的发育程度以及不同的内含干扰物种类及含量,决定了试剂盒法不可能适用于所有植物组织的高效提取要求,其成本也较高,大约是改良硼砂—CTAB试剂的3倍。采用试剂盒法提取的样品普遍存在质量浓度较低的现象,试验结果表明提取浓度只有2种CTAB方法的1/2左右,后期降解,不利于后续实验。
-
综上所述,在核桃总RNA提取时以改良硼砂—CTAB法和改良硼砂—CTAB—异丙醇法为宜,但同时要根据不同发育时期叶片及不同组织的生理特性选择适宜的方法,才能更好为后续的分子生物学研究奠定基础。







 DownLoad:
DownLoad: