-
杨小舟蛾(Micromelalopha sieversi(Staudinger)),属鳞翅目(Lepidoptera)舟蛾科(Notodontidae)小舟蛾属(Micromelalopha),分布于中国、日本和朝鲜半岛。在我国,杨小舟蛾分布范围广,在吉林、黑龙江、河南、山东、安徽、浙江、上海、江苏、江西和四川等地发生[1-3]。杨小舟蛾是杨、柳树的重要害虫,由幼虫取食杨、柳树叶片,严重时,叶片常被取食殆尽,形似火烧,严重影响林木的正常生长发育。国家林业和草原局(2019年第20号文公告)将杨小舟蛾列入三级危害性林业有害生物,同时也列入我国发生面积超过100万亩的林业有害生物名单中。2012年统计,杨小舟蛾在山东鲁西平原危害7市48县,并在齐河、滕州、商河等24个县局部爆发成灾,发生面积达16.71万hm2,占该地区杨树种植总面积的28.58% [4-5]。2018年,杨小舟蛾在河南省南阳市危害杨树纯林面积达3.33多万hm2 [6]。2021年,杨小舟蛾仅在河南省扶沟县一个村的危害面积达6.80万hm2(扶沟县韮园镇里村)。杨小舟蛾繁殖量大,其发生世代主要取决于光照、温度和湿度。在河南漯河地区一年发生6代,以2、3、4代为成灾世代;在江苏徐州一年发生5代,主要以3、4代成灾[7]。杨小舟蛾在每年的4—9月份都对杨树造成危害,该时期繁殖力强,取食量大,且危害时间长。研究表明,杨树的失叶率在60%、80%和100%时,材积损失率分别为11.9%、41.1%和56.5% [8]。因此,杨小舟蛾的防治至关重要。
化学农药因其易于加工、高效杀死大量个体等特点在杨小舟蛾防治中发挥了重要作用。但化学防治的大量使用会带来负面影响,如环境污染、生态失衡、产品安全、人类健康等一系列的问题,这使林业害虫的生物防治显得尤为重要。昆虫杆状病毒是联合国粮农组织(FAO)和世界卫生组织(WHO)一致推荐用于农林害虫的生物防治安全药剂[9]。其优点在于对寄主有很强的专化性,对人、植物和天敌均无危害,是有效和持续控制林业害虫的最佳生物药剂之一[10]。
据文献资料记载,在杨小舟蛾体内只发现一种病毒,即为杨小舟蛾质型多角体病毒(Micromelalopha sieversi cypovirus, MisiCPV),该病毒于1984年10月在湖北省嘉鱼县林区的自然病死的杨小舟蛾虫尸中分离获得[11]。但有关MitrCPV的形态特征、生物活性等未见详细报道。本研究从河北省秦皇岛市采集的杨小舟蛾病死虫中分离纯化出一株新病毒,经超微结构鉴定,其为颗粒体病毒,命名为杨小舟蛾颗粒体病毒(Micromelalopha sieversi granulovirus, MisiGV),生物活性测定了MisiGV对3龄幼虫的半致死浓度LC50和半致死时间LT50、对不同龄期幼虫毒力,以及对存活幼虫化蛹率和羽化率的影响。
-
杨小舟蛾病毒(秦皇岛株)由中国林业科学研究院昆虫病原微生物实验室提供,采用梯度离心的方法得到纯净的病毒并于本实验室4℃保存待用。杨小舟蛾各龄期幼虫采自河南省周口市扶沟县韮园镇的里村(114.18 E°, 34.6 N°),并于温度(25 ± 1)℃,相对湿度(60 ± 10)%,光周期16 L∶8 D的昆虫饲养室中饲养。
-
MisiGV的复制,将MisiGV(秦皇岛株)刷到新鲜杨树(欧美杨107)叶片上,接入健康的杨小舟蛾3龄幼虫,待5 d后收集死虫并分离病毒。MisiGV的分离纯化方法参考王承锐等[12]方法,并将过程进一步优化。具体步骤如下:将感染杨小舟蛾病毒的虫尸放入研钵,加入2/3体积的无菌水研磨虫尸至匀浆,用两层纱布过滤除去大的组织块。滤液装入干净的离心管(1.5 mL),用差速离心法,分别为9 600 g,离心10 min,弃上清;20 g,离心5 min,弃沉淀;60 g,离心3 min,弃沉淀再将上清用9 600 g,离心10 min,弃上清后将沉淀悬浮,获得较纯病毒液。为了获得更纯的病毒液,利用蔗糖梯度法进一步纯化。将60%、55%、50%和40%蔗糖溶液依次加入50 mL离心管静置过夜,然后加入上述较纯病毒液,2 504 g,离心40 min。纯净病毒在50%~55%蔗糖梯度区,吸取纯净病毒用无菌水清洗3次。血球计数板计数后,4 ℃保存待用。纯净的病毒悬浮液用于后续超微结构观察和生物活性测定等试验。
-
a. 扫描电镜样品制样:将300 μL的MisiGV(3.0 × 107 OBs·mL−1)悬浮液加入1.5 mL离心管内,用无菌水洗涤2次,12 800 g,离心5 min,弃上清,尽量吸去多余的无菌水,在沉淀中加入2.5 %戊二醛,悬浮沉淀,常温固定6 h以上。将固定好的病毒液用12 800 g,离心2 min,弃戊二醛上清液;用去离子水浸泡样品6 min,12 800 g,2 min离心后吸去去离子水,此步骤重复3次,每次浸泡时间比前一步延长1 min。然后分别用50%、70%和85%乙醇脱水14 min,再用95%和100%乙醇浸泡15 min,其中100%乙醇脱水3次,以上脱水过程从70%乙醇脱水开始,将病毒样品装入滤纸包进行的。将样品放入临界点干燥仪(LEICA EM CPD300)2 h后取出,并粘至金属台,用离子镀膜仪(E-1045 IDN SPUTTTER)喷金后,放入扫描电镜(HITACHI SU8010)观察并拍照。
b. 透射电镜样品制样:取纯净的MisiGV(3.0 × 107 OBs·mL−1)悬浮液300 μL,用2.5%的戊二醛常温固定6 h以上。将固定好的病毒液12 800 g,离心2 min吸去多余的戊二醛,用去离子水清洗3次。沉淀中加入500 μL溶解的琼脂后离心,切取底部样品放入1.5 mL离心管中,用1倍的磷酸缓冲液(pH 7.0)充分清洗3~5次,每次3~5 min。沉淀中加入1%的饿酸固定1 h,并用1倍的磷酸缓冲液(pH 7.0)充分清洗3次以除去饿酸。用梯度丙酮(30%、50%、70%、85%和95%)在冰上脱水各5~7 min,再用100%丙酮常温下脱水3次。然后用不同比例的丙酮和树脂渗透样品,丙酮∶树脂= 3∶1,45 min;1∶1,1.5 h和1∶3,2 h。以上渗透样品结束后,吸出上清加入纯树脂包埋,并放入干燥器(AP 9925N)内保存。使用Leica uc7 型切片机超薄切片,再用醋酸双氧铀染30 min和柠檬酸铅15 min双染色后,放入透射电镜(JEOL JEM-1400)观察后拍照。
-
a. 毒力的测定 挑选健康的杨小舟蛾3龄幼虫放入圆柱型的养虫筒中(Φ10 cm × 14 cm),饥饿24 h后,放入含有病毒液的速生杨叶片。带毒的叶片是用毛笔均匀刷上不同浓度梯度的病毒液各1 mL,晾干后喂食幼虫。空白对照为刷有等量无菌水的新鲜叶片。实验设置6个处理,1个空白对照和5个浓度梯度杨小舟蛾病毒:1.2 × 107、4.0 × 106、4.0 × 105、1.2 × 105和4.0 × 104 OBs·mL−1。每个处理30头幼虫,3次重复。昆虫饲养室条件为温度(25 ± 1)℃,相对湿度(60 ± 10)%,光周期16 L∶8 D。2 d后叶片基本取食完全,换无毒的新鲜叶片。每天观察记录各处理的幼虫死亡数和死亡症状。
b. 不同虫龄幼虫对MisiGV的敏感性测定 选用带有不同浓度梯度的MisiGV叶片分别喂食杨小舟蛾2龄、3龄和4龄的健康幼虫,每个处理30头幼虫,3次重复,病毒浓度为4.0 × 106和4.0 × 104 OBs·mL−1,给毒方法和幼虫饲养条件同上述a,每天观察记录各龄幼虫的死亡数[13]。
c. MisiGV对幼虫化蛹率和羽化率的影响 每个处理选用健康的杨小舟蛾4龄幼虫30头,3次重复。病毒浓度为4.0 × 106、4.0 × 105和4.0 × 104 OBs·mL−1,给毒方法和饲养条件同上述a,每天观察幼虫状态并记录化蛹数和羽化数[14]。
-
运用Excel和SPSS 22.0软件的概率回归分析计算出致死中浓度LC50和半致死天数LT50 [15-17],计算病毒液对不同龄期幼虫的累计死亡率和4龄幼虫的化蛹率、羽化率[18]。
-
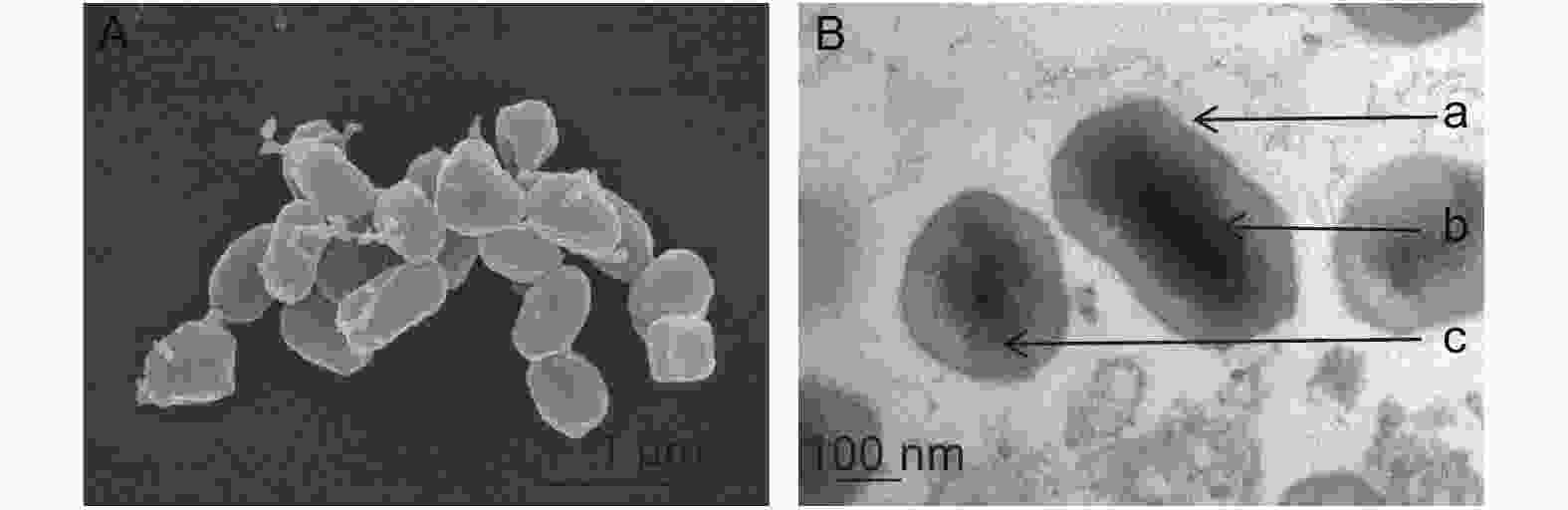
MisiGV超微结构如图1所示。扫描电镜观察,该病毒形态大多呈椭圆形,也有的呈卵圆形或不规则形,形似颗粒体,其平均大小为0.43 × 0.21 μm,但变化范围较大,为(0.18~0.76) × (0.20~0.23) μm,(图1A)。从透射电镜可观察到该病毒内部的详细结构,颗粒体的周围颜色较深的一层为颗粒体膜,膜内一层为颗粒体的蛋白质,颗粒体中包埋着单个单粒的病毒粒子,横切为颗粒状,纵切为杆状,病毒粒子位于颗粒体的中央,其平均大小为0.03 × 0.20 μm。(图1B)
-
当MisiGV浓度为1.2 × 107、 4.0 ×106、4.0 × 105、1.2 × 105和4.0 × 104 OBs·mL−1时对3龄幼虫都有致死作用。MisiGV对3龄幼虫的回归方程为:y=−3.945 + 0.734x,LC50为2.37 × 105 OBs·mL−1(95%置信区间为1.13 × 105~4.34 × 105)(表1)。表1中皮尔逊拟合优度显著性值(P)大于0.05,则模型能较好的拟合数据。
虫龄
InstarProbit 回归方程
Probit structural equation regression
y=a+bx皮尔逊拟合优度显著性值
Pearson goodness of
fit significance values(P)LC50 /
(OBs·mL−1)95%置信区间
95% CL上限
Upper limit下限
Lower limit3龄 y=−3.945 + 0.734x 0.240 2.37 × 105 1.13 × 105 4.34 × 105 Table 1. Different concentrations of MisiGV to the 3rd instar larvae of M. sieversi (17 d)
不同浓度的MisiGV对幼虫致死速度有一定差异(表2)。LT50数据表明,当病毒浓度为1.2 × 107和4.0 × 106 OBs·mL−1时,半致死时间LT50分别为7.55 d和11.61 d,LT50相比缩短了4.06 d。当病毒浓度为4.0 × 105、1.2 × 105和4.0 × 104 OBs·mL−1,LT50分别为14.69、16.06和17.62 d,该病毒浓度间相比分别相差10倍和3倍时,LT50分别缩短了2.93 d和1.56 d。即随着MisiGV浓度的提高,LT50值缩短。表2中皮尔逊拟合优度显著性值(P)均大于0.05,则模型能较好的拟合数据。
浓度
Treatment /(OBs·mL−1)Probit 回归方程
Probit structural equation regression
y=a+bx皮尔逊拟合优度显著性值
Pearson goodness of fit
significance values(P)LT50 /d 95%置信区间
95% CL上限
Upper limit下限
Lower limit1.2 × 107 y=−5.036 + 5.735x 0.115 7.55 7.067 8.030 4.0 × 106 y=−3.221 + 3.025x 0.374 11.61 10.803 12.531 4.0 × 105 y=−4.772 + 4.089x 0.138 14.69 13.558 16.366 1.2 × 105 y=−4.235 + 4.224x 0.089 16.06 15.475 16.790 4.0 × 104 y=−3.832 + 3.075x 0.441 17.62 16.040 19.930 Table 2. Different concentrations of MisiGV on time-mortality of the 3rd instar larvae of M. sieversi (17 d)
-
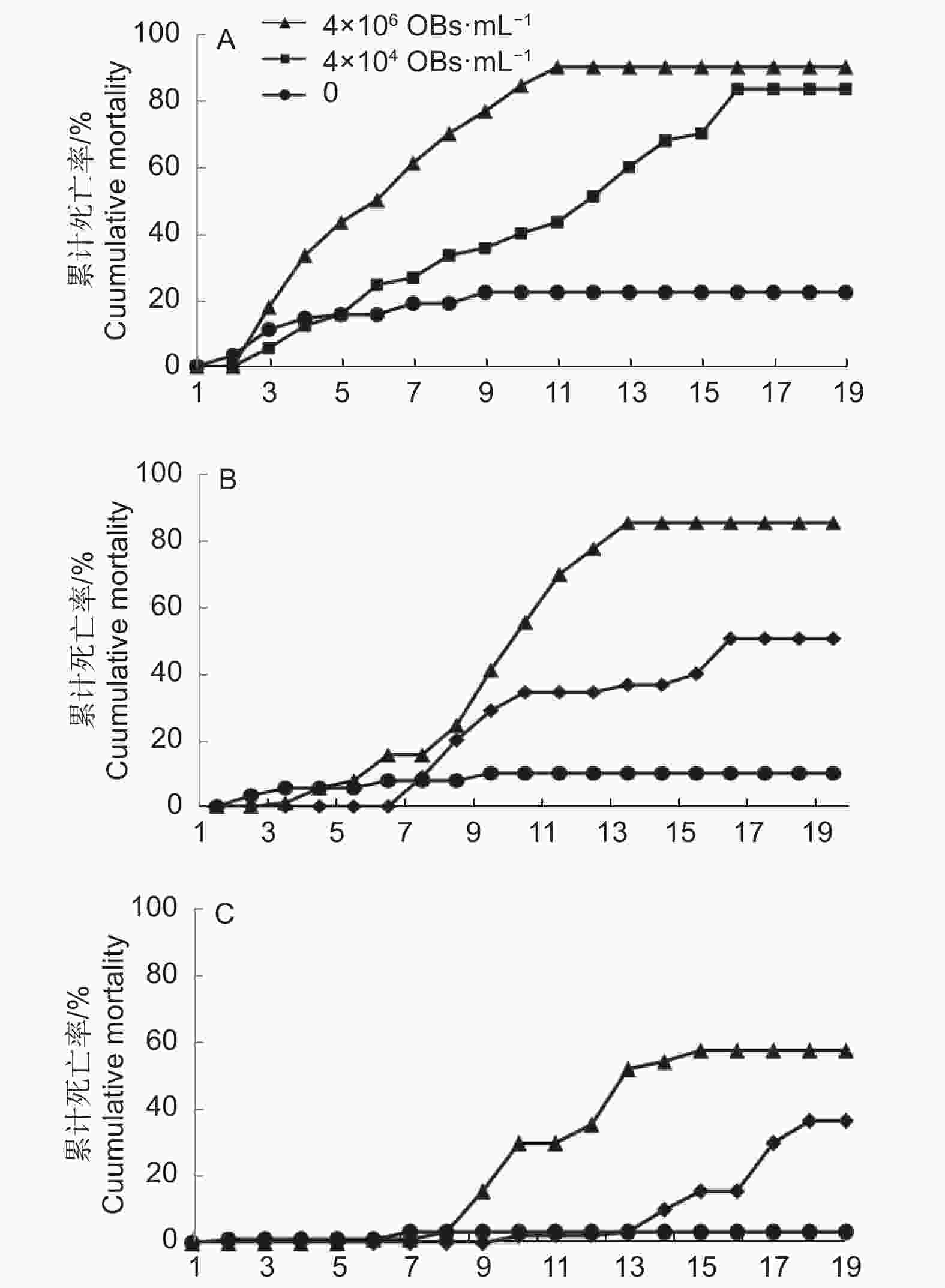
图2显示,在MisiGV浓度为4.0 × 106和4.0 × 104 OBs·mL−1时,其对2~4龄幼虫都表现出一定的毒力。在这2个浓度下,2龄幼虫的最高累计死亡率分别为90.00%和83.33%(图2A),3龄幼虫的最高累计死亡率分别为85.56%和50.58%(图2B),4龄幼虫的最高累计死亡率分别为57.78%和36.67%(图2C)。也就是说,在同一龄期不同病毒浓度下,病毒液浓度越高,幼虫的死亡率随之增加。
当浓度为4.0 × 106 OBs·mL−1时,2龄幼虫的累计死亡率在2~10 d呈显著上升趋势,且在第11 d达最高累积死亡率,11 d之后呈稳定趋势;3龄幼虫在5~8 d内累计死亡率缓慢增大,而在8~13 d内累计死亡率呈显著上升趋势,且在13 d时累计死亡率达最高值,之后几天趋于稳定;而4龄幼虫的累计死亡率在9 d之内没有显著性的变化,第15 d累计死亡率达到最大,而往后天数里死亡率几乎维持不变。当浓度为4.0 × 104 OBs·mL−1时,2龄幼虫在3~15 d内累计死亡率呈显著上升,第15 d时达最高累计死亡率并往后几天内趋于稳定;3龄幼虫在6~10 d的累计死亡率缓慢增大,11~14 d内呈缓慢增长,无明显变化,16~19 d时累积死亡率达最高值并趋于稳定;4龄幼虫在第10~13 d时增长缓慢,累计死亡率在15~18 d内随之上升,且18 d时达最高累计死亡率。
同一剂量病毒,杀死相同比例的杨小舟蛾幼虫,高龄比低龄幼虫的所需的时间长。在浓度为4.0 × 106 OBs·mL−1时,2和3龄幼虫LT50值分别为≈6.81 d和≈11.61 d,而杀死50%的4龄幼虫所需时间为≈12.89 d(表3)。当病毒浓度为4.0 × 104 OBs·mL−1时,杀死50%的2龄幼虫的所需时间≈11.91 d、3龄≈17.62 d,4龄≈25.65 d(表3)。采用时间-剂量-死亡率模型进行模拟分析发现,在这两个病毒浓度下,皮尔逊拟合优度显著性值(P)均大于0.05,拟合线性回归方程,则模型能较好的拟合数据。
浓度
Treatment /(OBs·mL−1)虫龄
InstarProbit 回归方程
Probit structural equation regression
y=a+bx皮尔逊拟合优度显著性值
Pearson goodness of fit
significance valuess(P)LT50 /d 95%置信区间
95% CL上限
Upper limit下限
Lower limit4.0 × 106 2 y=−3.273 + 3.927x 0.230 6.81 6.476 7.145 3 y=−3.221 + 3.025x 0.374 11.61 10.803 12.531 4 y=−3.848 + 3.466x 0.460 12.89 11.923 14.059 4.0 × 104 2 y=−3.741 + 3.477x 0.395 11.91 11.474 12.500 3 y=−3.832 + 3.075x 0.441 17.62 16.040 19.930 4 y=−3.451 + 2.890x 0.487 25.65 24.672 26.864 Table 3. Different concentrations of MisiGV on time-mortality of larvae at different instars
在测试3个龄期的幼虫中,两个剂量的病毒的LT50显著不同。对于2和3龄幼虫而言,在浓度4.0 × 104 OBs·mL−1和4.0 × 106 OBs·mL−1时,两者的LT50分别相差≈5.10 d和≈6.01 d。而对于4龄幼虫而言,低浓度比高浓度病毒的LT50增加≈12.76 d。可见,对于虫龄小的幼虫而言,浓度之间的差异,导致其LT50变化不大,而对于虫龄大幼虫而言,病毒浓度的变化,导致LT50差异显著。尽管4.0 × 104 OBs·mL−1较4.0 × 106 OBs·mL−1稀释了100倍,但对于2龄幼虫而言,其浓度还是很高,以至于他们的死亡率都在80%以上。
-
不同浓度的MisiGV喂食4龄幼虫后,存活幼虫化蛹率和羽化率如表4所示。当病毒液浓度为4.0 × 106、4.0 × 105和4.0 × 104 OBs·mL−1时,幼虫的化蛹率分别为30.00% ± 2.65%、51.11% ± 0.33%和62.22% ± 1.20%,较对照组相比,化蛹率分别减少52.27%、31.16%和20.05%。因此,不同浓度的MisiGV对化蛹率有影响,化蛹率随着病毒液浓度的提高而减弱。
浓度
Treatment /(OBs•mL-1)死亡率 ± 标准误差
Mortality rate ± SE /%化蛹率 ± 标准误差
Pupation rate ± SE /%羽化率 ± 标准误差
Emergence rate ± SE /%4.0 × 106 57.58 ± 2.85 b 30.00 ± 2.65 a 73.97 ± 2.06 a 4.0 × 105 50.00 ± 0.58 b 51.11 ± 0.33 b 82.64 ± 2.05 b 4.0 × 104 47.78 ± 0.33 b 62.22 ± 1.20 b 92.20 ± 0.47 c 0 12.22 ± 0.88 a 82.27 ± 1.33 c 93.54 ± 1.41 c 注:表中的数据为平均数±标准误,不同小字母表示在不同浓度的病毒条件下p<0.05水平差异显著。
Note: The data is average ± standard error in the table, different small letters indicate that the p<0.05 level is significantly different under different concentrations of virus conditions.Table 4. Effects of different concentrations of MisiGV on the pupation rate and emergence rate of larvae
当病毒液浓度为4.0 × 106和4.0 × 105 OBs·mL−1时,幼虫的羽化率分别为73.97% ± 2.06%和82.64% ± 2.05%,较对照组相比,羽化率分别减少了19.57%和10.90%。不同浓度的MisiGV对其羽化率有影响,病毒液浓度越高,羽化率越低。而当4.0 × 104 OBs·mL−1时,幼虫的羽化率为92.20% ± 0.47%,较对照组相比,羽化率减少了1.34%。因此,在较低浓度下,对幼虫羽化率的影响不明显。
-
本研究分离的新病毒株为杨小舟蛾颗粒体病毒MisiGV,其在主要形态特征方面与GVs一致。杨小舟蛾(Micromelalopha sieversi (Staudinger))和杨扇舟蛾(Clostera anachoreta (Fabricius))同为舟蛾科,且两者常混合发生,是危害杨树的重大害虫。1966年蔡秀玉等[19]首次发现杨扇舟蛾颗粒体病毒(Clostera anachoreta granulovirus, ClanGV),1981年,报道了与杨扇舟蛾同属的分月扇舟蛾颗粒体病毒(Clostera anastomosis L. granulovirus, CaLGV) [20]。通过MisiGV与ClanGV、CaLGV相比较发现,三者在超微结构和生物活性方面有一些不同。首先,在颗粒体直径方面,ClanGV平均直径大小为0.44 × 0.22 μm,CaLGV为0.43 × 0.24 μm [21-22],MisiGV为0.43 × 0.21 μm。其次,病毒粒子存在差异,ClanGV病毒粒子平均大小约为0.15~0.04 μm,CaLGV为0.22 × 0.06 μm,而MisiGV的大小约为0.20 × 0.03 μm。最后,3者在毒力方面存在差异。ClanGV感染杨扇舟蛾4龄幼虫后,其LC50为1.25 × 106 OBs·mL−1 [23];李海霞等[24]发现CaLGV感染分月扇舟蛾2龄幼虫,LC50为2.97 × 105 OBs·mL−1;MisiGV对杨小舟蛾3龄幼虫的LC50为2.37 × 105 OBs·mL−1。因测试虫和虫龄的不同三者的LC50值的无法比较毒力大小。当CaLGV浓度为1.0 × 107 OBs·mL−1时,感染分月扇舟蛾3龄幼虫后,LT50值为7.74 d [21];而当MisiGV浓度为1.2 × 107 OBs·mL−1时,感染杨小舟蛾3龄幼虫的LT50为7.55 d(表2)。可见,在CaLGV和MisiGV浓度相差不大时,MisiGV在杀死50%的3龄幼虫所需的时间与CaLGV的时间无明显差异。另外,MisiGV与ClanGV在LT50值的比较上,当ClanGV浓度为3.0 × 105 OBs·mL−1时,对3~4龄杨扇舟蛾幼虫LT50值为12.20 d [24-25];而MisiGV浓度为1.2 × 105 OBs·mL−1对3龄杨小舟蛾幼虫LT50值为16.06 d。此外,CaLGV对杨扇舟蛾和分月扇舟蛾的幼虫都具有致病性[24]。MisiGV是否能够感染杨扇舟蛾和分月扇舟蛾幼虫,其LC50与LT50的结果是否与感染原寄主存在差异性,还有待开展后续试验进一步验证。
致死时间的长短是判断病毒能否作为一种有潜力的生物防治制剂的一个关键因素[26]。如果病毒能够提高杀虫速度,缩短寄主致死时间,就能够在一定程度上提高病毒水平传播速度[25]。文中数据显示,致死时间随着虫龄和病毒浓度的增加而减少(表2,3)。对于杀死50%的2~3龄幼虫而言,当浓度为4.0 × 106 OBs·mL−1时,3龄的致死时间≈11.61 d,而4龄LT50为12.89 d。在致死时间保持不变的条件下,在幼虫发生的早期进行野外喷洒病毒,这样在很大程度上会增加病毒在幼虫之间的水平传播。考虑到防治成本和防治效果,应在幼虫1龄至3龄期间,最好在孵化始期施用,此时幼虫对病毒较敏感,对杨树的为害尚轻,喜群聚取食,易于疾病的流行,施用病毒制剂时也较节省劳力,防治效果好。
昆虫杆状病毒因专一性强、可持续控制的优点,越来越受到人们的重视并应用于防治农林害虫[27]。本研究获得的MisiGV新病毒株对杨小舟蛾幼虫有极强的致病性,在高剂量病毒下,幼虫可在相对较短时间死亡。即使在低剂量浓度下,存活幼虫的化蛹率降低,可见,MisiGV可作为防控杨小舟蛾的一理想生物因子。
-
本文报道的MisiGV新病毒对杨小舟蛾幼虫有很强致病性,为该害虫的生物防治提供新病毒资源。
Identification and Biological Activity of a New Virus of Micromelalopha sieversi (Staudinger) (Lepidoptera: Notodontidae)
- Received Date: 2021-09-06
- Accepted Date: 2021-10-16
- Available Online: 2022-04-20
Abstract:






 DownLoad:
DownLoad:
