-
杨树因具有速生、易繁殖、耐干旱等优点,通常被作为重要的公益林及用材林树种广泛的种植[1]。但是随着大范围、大面积杨树人工林的发展,诸多病虫害随之流行为害,给杨树的生长造成了重大影响。尤其是落叶松-杨栅锈菌(Melampsora larici-populina Kleb., 简称MLP)导致的叶锈病最为普遍。叶锈病是杨树上的最严重病害之一,它可导致杨树过早的落叶,缩短发育期,显著降低杨树的生长量及蓄积量,其大面积流行造成了巨大的经济和生态损失[2-4]。因此,研究杨树的潜在抗锈病机制对病害防治和杨树育种具有重要意义。
目前,甲基化分析被广泛地用于探索植物、人类、昆虫中各种各样的潜在的遗传机制[5-6]。甲基化是一种重要的表观遗传修饰,常见的有DNA甲基化和组蛋白甲基化两种类型。其中DNA甲基化一般发生在CpG位点(胞嘧啶-磷酸-鸟嘌呤位点)经DNA甲基转移酶催化胞嘧啶转化为5-甲基胞嘧啶;组蛋白甲基化可以发生在蛋白的赖氨酸和精氨酸的残基上,而且赖氨酸残基可以发生单、双、三甲基化,精氨酸残基可以发生单、双甲基化[7-8]。这些不同形式及程度的甲基化在转座子沉默、基因表达调控等生物学过程中起到重要的作用,常常会导致发育异常、癌症、重大疾病的发生,但同时也伴随着一些潜在促生长、抗疾病等优良基因的激活[9]。因此,研究甲基化对于深入理解基因表达、个体发育及抵抗疾病侵染等机制具有重要意义。
通过甲基磺酸甲醛(methyl methane sulfonate简写为MMS)处理诱导植物基因组DNA甲基化的研究在干旱胁迫、盐胁迫等非生物胁迫方面已进行了许多报道并取得一定成效[10-12],例如:Uthup等人报道橡胶树非生物胁迫下的DNA甲基化图谱并推断出了该树种某些基因表达随生境变化的相关关系[13]。毛果杨(Populus trichocarpa(Torr. & Gray))干旱胁迫下的甲基化分析证明,DNA甲基化可使一些潜在沉默基因得以表达以适应所处的干旱情况,表明了表观遗传机制研究在多年生植物对环境适应方面的重要性[1, 14];虽然对植物的一些病虫害等生物胁迫条件下的甲基化研究仍鲜有报道,但从甲基化处理感染丛枝病的泡桐,可以使其恢复正常生长[15],可以看出甲基化处理在植物抗逆和抗病等方面显示出良好的潜力。太白杨是松杨栅锈菌天然的寄主之一,蕴藏着丰富的抗病遗传资源和较强的生长适应能力,本研究旨在探讨甲基化处理对太白杨幼苗的生长调控是否可以改善其对松杨栅锈菌的抗锈菌能力,以期为杨树的抗锈性育种和抗锈性机制研究提供理论依据。
-
松杨栅锈菌(Melampsoralarici-populina)菌株由西北农林科技大学林学院病理研究组提供;1年生太白杨(Populus purdomii Rehd.)实生苗采自秦岭火地塘西北农林科技大学试验站,后移植于25℃,相对湿度RH=70%的实验温室中进行水培,每天叶面喷水2次,每2天换水1次。
甲基磺酸甲醛(methyl methane sulfonate简写为MMS)从麦克林公司购买所得,用去离子水分别配成浓度0 μmol·L-1,0.2 μmol·L-1,0.5 μmol·L-1,0.7 μmol·L-1备用。
-
水培一段时间后,选取生长健康、长势相似的幼苗移植到0 μmol·L-1,0.2 μmol·L-1,0.5 μmol·L-1,0.7 μmol·L-1的4个浓度梯度的MMS溶液的三角瓶中立即进行人工接菌[16-17],接种后的苗木持续在相应浓度的MMS中培养。接种时,先于叶背面喷洒一层水雾,将1×105·mL-1的夏孢子悬浮液均匀的涂抹到叶片背面,黑暗条件下保湿培养24 h后移入25℃、相对湿度70%80%的温室中培养,光照时间每天约10 h,对照为接种无菌水,每处理15个重复。
-
从接种当天算起到开始发病为止,定义为潜育期[18],计算各重复平均值为各处理潜育期;用带有1 cm×1 cm的透明塑料方框扣于发病叶片,在解剖镜下统计单位面积夏孢子堆数目,每片叶子至少统计5个方框,每棵苗子至少2个叶片,统计各处理发病后第7、9、11天夏孢子堆平均密度和离差、发病抑制率;同时,对各处理下幼苗生长状况,如植株的死亡率、叶片黑斑率、叶卷曲率等进行记录;其中,发病抑制率=(处理组夏孢子堆密度-对照组夏孢子堆密度)/对照组夏孢子堆密度×100%。
-
在接种后第1、3、5、7、9、11天,于每个处理分别取0.5 g叶片置于研钵中加入液氮研磨成粉末,加入5 mL 0.05 mol·mL-1磷酸缓冲溶液(pH=7.8)转移到20 mL离心管,再用0.05 mol·mL-1磷酸缓冲溶液清洗研钵3次并将清洗所得溶液转入离心管中,最后用0.05 mol·mL-1磷酸缓冲溶液定容至15 mL,4℃下(11 000 rpm·min-1)离心15 min,取上清液作为植物防御酶的粗酶提取液,对照为无菌水接种MMS处理的太白杨和水培处理的太白杨,并进行以下不同酶活性测定[17, 19-20]。
(1) 超氧化物歧化酶(SOD)
超氧化物歧化酶(SOD)活性测定采用氮蓝四唑光化还原法(NBT)[21]。在试管中依次加入100 μL的100 μmol·L-1EDTA-Na2、1.5 mL的0.05 mol·mL-1磷酸钠缓冲液(pH7.8)、300 μL 130 mmol·L-1的L-甲硫氨酸,300 μL的750 μmol·L-1氮蓝四唑、500 μL的无菌水、最后加入300 μL 20 μmol·L-1核黄素和100 μL粗酶提取液作为反应液(对照组取)。将其置于室温日光灯下进行光化还原反应15 min,用Multiskan GO酶标仪测定反应液在波长560 nm下的吸光度OD560,并按下式计算SOD活性。
$ {\rm{SOD}}活性 (\text{U}\cdot {{\text{g}}^{-1}}\cdot \text{mi}{{\text{n}}^{-1}})=\left( \left( {{A}_{0}}-{{A}_{S}} \right)\times {{V}_{t}} \right)/ \\ \ \ \ \ \ \ \ \ ({{A}_{0}}\times 0.5\times FW\times {{V}_{S}}\times t) \\ $
式中:A0:对照管反应液吸光度;AS:样品管反应液吸光度;Vt:样品粗酶提取液总体积(mL);VS:测定时所取粗酶液体积(mL);FW:样品鲜质量(g);t:显色反应光照时间;0.5:560 nm下的吸光度OD560每分钟变化0.5记为一个单位U。
(2) 过氧化氢酶(CAT)
在试管中加入1.0 mL 50 mmol·L-1 Tris-HCl缓冲液(pH=7.0)、1.7 mL蒸馏水和0.1 mLCAT酶提取液,于25℃下水浴3 min,最后加入0.2 mL 200 mmol·L-1 H2O2溶液,得到3 mL的CAT最终反应液,立即测定反应液在240 nm处的吸光度OD240,每30 s读1次数,共读取3次[22-23],并按下式计算CAT活性。以240 nm下的吸光度OD240每分钟变化0.01记为一个酶活力单位U。
$ \begin{align} & \ \ \text{CAT}活性(\text{U}\cdot {{\text{g}}^{-1}}\cdot \text{mi}{{\text{n}}^{-1}})= \\ & \left( \Delta {{A}_{240}}\times {{V}_{t}} \right)/(FW\times {{V}_{S}}\times 0.01\times t) \\ \end{align} $
式中:ΔA240:反应时间内(30 s)OD240变化的平均值;Vt:样品粗酶提取液总体积(mL);VS:测定时所取粗酶液体积(mL);FW:样品鲜质量(g);t:反应时间。
(3) 过氧化物酶(POD)
过氧化物酶(POD)活性测定采用愈创木酚法[21]。取100 mL的磷酸缓冲液(0.2 mol·L-1,pH=6.0)加入38 μg愈创木酚加热溶解,冷却后加入56 μL30%H2O2保存于冰箱备用。取上述配制的反应液3 mL加入500 μL粗酶提取液混合,迅速测定混合反应液在470 nm处的吸光度,每30 s测定一次,共测3次[17, 19, 24],并按下式计算POD活性。以470 nm下的吸光度OD470每分钟变化0.1记为一个酶活力单位U。
$ \begin{align} & \ \ \ \ \ \ \ \ \ {\rm{POD}}活性(\text{U}\cdot {{\text{g}}^{-1}}\cdot \text{mi}{{\text{n}}^{-1}})= \\ & \left( \Delta {{A}_{470}}\times {{V}_{t}} \right)/(FW\times {{V}_{S}}\times 0.1\times t) \\ \end{align} $
式中:ΔA470:反应时间内(30 s)OD470变化的平均值;Vt:样品粗酶提取液总体积(mL);VS:测定时所取粗酶液体积(mL);FW:样品鲜质量(g);t:反应时间。
(4) 多酚氧化酶(PPO)
于试管中加入1 mL 0.5 mol·L-1的邻苯二酚和2 mL 0.05 mol·L-1磷酸盐缓冲液(pH=7.0)在25℃下恒温水浴5 min,加入0.5 mL酶液摇匀,立即测定反应液在波长420 nm下的吸光值,每30 s读一次数,共读取3次[25-27],并按下式计算PPO活性。以420 nm下的吸光度OD420每分钟变化0.01记为一个酶活力单位U。
$ {\rm{PPO}}活性 (\text{U}\cdot {{\text{g}}^{-1}}\cdot \text{mi}{{\text{n}}^{-1}})= \\ \left( \Delta {{A}_{420}}\times {{V}_{t}} \right)/(FW\times {{V}_{S}}\times 0.01\times t) \\ $
式中:ΔA420:反应时间内(30 s)OD420变化的平均值;Vt:样品粗酶提取液总体积(mL);VS:测定时所取粗酶液体积(mL);FW:样品鲜质量(g);t:反应时间。
-
数据经EXCEL处理后,运用spss22.0计算person相关系数进行相关分析,采用Origin 8.0进行绘图。
-
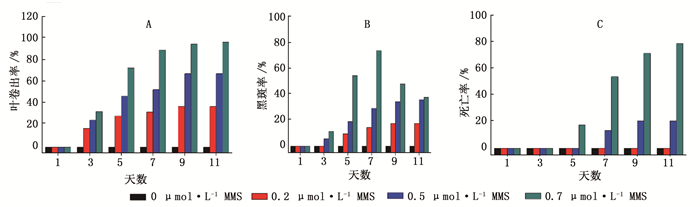
不同浓度的MMS处理对太白杨在第1天均没有显著差异;第3天0.7 μmol·L-1的MMS处理的太白杨32.7%叶片出现卷曲波浪状或叶边缘内收现象,11.2%叶片出现黑色叶斑;0.5 μmol·L-1的MMS也出现了叶片边缘的略微卷曲或边缘内收,但无黑斑出现;0.2 μmol·L-1的MMS无显著的形态变化。第5天0.7 μmol·L-1的MMS处理的太白杨有26.66%开始停止生长叶片出现萎蔫,较严重的已出现死亡,所有植株上都存在具有黑斑的叶片,并且黑斑往往最早出现在叶龄较大的叶片上。第7天时所有MMS处理中植株死亡率、叶卷曲率、黑斑率的增长率达到最大值,随后的第9天及第11天叶片受损情况趋于平缓。总的来说0.5 μmol·L-1与0.7 μmol·L-1的MMS处理的太白杨出现两种极端,初期苗势生长弱的植株叶片出现大量黑斑进而萎蔫死亡,而生长势强的幼苗叶片波浪状卷曲或边缘内收,叶片颜色加深呈深绿色革质变强。但杨树在0.7 μmol·L-1的MMS处理下的适应率远远低于0.5 μmol·L-1MMS的处理。0.2 μmol·L-1的MMS处理没有出现植株的死亡现象,但同样出现了叶边缘内收,叶片颜色加深革质增强(图 1、2)。
-
在不加MMS只接种松杨栅锈菌的太白杨在接种后第6天叶片开始在出现发病症状,叶片正面主叶脉之间出现略微发黄,但背面发病不明显(图 3A、B),加MMS处理苗则无发病症状。在接种锈菌后第7天,0.2 μmol·L-1 MMS与0.5 μmol·L-1 MMS试验组太白杨叶片背面均开始有夏孢子堆形成,但0.7 μmol·L-1 MMS处理的太白杨于第9天才开始有夏孢子堆的产生,潜育期被延长了2天(表 1)。第11天所有处理夏孢子堆密度趋于稳定。MMS处理对落叶松杨栅锈菌具有显著的抑制作用,并且抑制效果随MMS浓度的增加而增强,其中0.2 μmol·L-1 MMS处理对落叶松杨栅锈菌侵染的抑制率为28.14%;经0.5 μmol·L-1 MMS处理发病抑制率为39.68%;经0.7 μmol·L-1 MMS处理发病抑制率为67.33%(表 1)。

图 3 接菌不同阶段各处理组太白杨叶片发病情况
Figure 3. The situation of Populus pudomii leaves at different periods of inoculation
表 1 不同浓度MMS处理下叶片锈病发病情况
Table 1. The situation of leaf rust under different MMS concentrations
MMS浓度MMS concentration/(μmol·L-1) 潜育期Latent period/d 夏孢子堆密度Uredinial density/(个·cm-2) 7dpi 9dpi 11dpi 0.0 6±0.667 11.52±4.894 24.71±4.460 34.68±4.270 0.2 7±0.933 8.00±3.364 20.64±4.803 24.92±2.344 0.5 7±0.599 7.48±3.066 18.00±2.986 20.92±5.716 0.7 9±1.000 0.00 7.48±1.110 11.33±1.797 -
在MMS处理调控杨树生长中,超氧化物歧化酶(SOD)具有一个先上升后下降再上升的相对趋势(图 4)。在第1天所有加入MMS的试验组中SOD都较空白对照呈现上调(高于对照组),且上调幅度与MMS的浓度具有一个正相关关系。在第3天以后所有试验组中SOD酶活性较对照组下调(低于对照),并在第5天达到下调最大值,然后SOD在第7天又出现上升趋势,其中0.2 μmol·L-1 MMS与0.5 μmol·L-1 MMS在随后第9、11天具有一个类似的上升幅度,在11天时SOD活性与对照组基本相同。但在0.7 μmol·L-1 MMS的试验组中SOD在第9天较第7天又出现一定程度下降,而后直至第11天SOD活性基本处于稳定状态且显著低于对照组。过氧化物酶(POD)活性在所有MMS处理的太白杨叶片中较空白对照均呈现下调(低于对照组),并具有一个先下降后上升的相对趋势,其中第5天为变化的转折点即达到下调的最大值。此外POD在0.2 μmol·L-1 MMS与0.5 μmol·L-1 MMS试验组中变化趋势较为相同,在第911天中与对照组没有显著的区别,而0.7 μmol·L-1 MMS的试验组中POD活性在第711天中趋于稳定且远小于对照组。在所有MMS处理的试验组中过氧化氢酶(CAT)活性较对照组在各时间段均呈现上调(高于对照组),在第1天上调幅度最大,而后所有试验组CAT活性均呈现一个下降相对趋势,并于第11天时恢复到对照组水平。多酚氧化酶(PPO)活性总体同样呈现出一个先上升后下降的趋势且整体水平较对照组要高。第1天PPO在不同试验组之间没有显著的差异,但随时间的推移0.2 μmol·L-1 MMS与0.5 μmol·L-1 MMS试验组中PPO分别在第3天和第5天达到一个峰值,0.7 μmol·L-1 MMS的试验组则在第3、7天分别出现一个峰值,且第3天出现的峰值更为显著。在PPO活性出现第一个峰值的时间点上0.7 μmol·L-1MMS与0.5 μmol·L-1MMS试验组都为第3天较0.2 μmol·L-1 MMS试验组的峰值时间(第5天)更早,且0.7 μmol·L-1MMS试验组上调幅度最大。
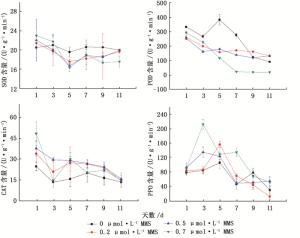
图 4 不同浓度MMS处理中太白杨各防御酶变化趋势
Figure 4. Trends of defense enzymes in Populus pudomii in different MMS concentrations
在锈菌侵染过程中,接种锈菌后前5天所有试验组超氧化物歧化酶(SOD)都较各自未接菌处理具有显著的提高,并且可以看到未接菌MMS处理的叶片较对照组(CK)整体水平处于下调,接菌后SOD整体水平均超过了对照组。接菌的各处理组SOD总体都处于一个相对下降趋势,最终在接菌711天导致接菌组SOD水平显著低于不接菌组。总的来说锈菌的侵入对SOD起到了一个先上调后下调的作用,转折点在第6天左右。过氧化物酶(POD)除0.7 μmol·L-1 MMS试验组在接菌处理后各个时间段较不接菌组呈现稳定上调且在第5天出现一个上调峰值,其他浓度MMS试验组接菌后第1天POD均出现下调,在第3天出现显著上调并达到峰值点,随后POD出现下降趋势至第911天时接菌处理组的POD活性水平低于未接菌组。接菌各组过氧化氢酶(CAT)较不接菌各组整体为先上升后下降的相对趋势,在前5天表现为上调且第3天处于上调最大值,第711出现下调。多酚氧化酶(PPO)与CAT变化规律相似,但在接菌后第1天PPO活性上升不明显,图 5。
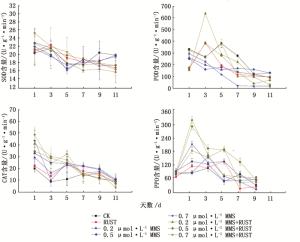
图 5 接菌不同阶段各处理组太白杨防御酶变化趋势
Figure 5. Trends of defense enzymes in Populus pudomii in different periods of inoculation
从第7天产生夏孢子开始,通过夏孢堆密度与生物酶活性的相关性分析,仅多酚氧化酶(PPO)与夏孢子密度呈现一个显著的负相关关系(P=0.024),这说明PPO活性具有一个直接增强杨树抗锈病能力的作用(表 2)。
表 2 不同生物酶活性与孢子密度的相关性分析
Table 2. Correlation analysis of different enzyme activities and urediospore density
组别Group SOD POD CAT PPO 夏孢子密度 Pearson相关系数(r) -0.095 0.136 0.198 -0.309 显著性水平(P) 0.300 0.162 0.241 0.024 -
甲基化是蛋白质和核酸的一种重要的修饰,可以调节基因的表达和沉默[13]。在本研究中,甲基化MMS处理会造成太白杨叶片波浪状卷曲或叶边缘内收等畸形、叶片黑斑、植株死亡,并且随MMS浓度的增加对杨树生长的危害越大,0.20.5 μmol·L-1的浓度可维持太白杨幼苗正常生长。因此MMS甲基化处理可以看似为杨树的一种非生物胁迫,但在对抵抗锈菌侵染的过程中具有重要的作用,显著降低了太白杨受锈病感染后的夏孢子堆密度并延长了潜育期。虽然甲基化处理对防御酶具有一个如结果所述的显著影响,但防御酶活性的高低与处理MMS的浓度并没有一个稳定的相关性,而叶片表面孢子堆密度的抑制率及潜育期的延长情况与处理MMS的浓度具有一个显著的正相关关系。这表明甲基化处理不但对寄主杨树具有一个显著的诱导作用,对病原菌锈菌同时也产生了一定的影响,如甲基化造成的表观调控造成了锈菌部分致病基因的沉默。针对甲基化处理致使杨树抗锈病能力显著提高这一现象,是由MMS对杨树及锈菌混合作用所导致的结果。
当植物受到病原菌侵染,植物的抗病防卫反应将立即启动,而活性氧(ROS)的释放就是一种典型防卫反应[28-29]。活性氧(ROS)具有直接杀死病原菌作用,同时也可以通过提高植物细胞木质化程度,促进富含羟脯酸蛋白的氧化交联等方法抑制病原菌的生长,在植物中活性氧ROS主要由O2-、H2O2组成[30-31]。但是较高ROS也同样会破坏细胞膜结构,破坏植物细胞代谢平衡,对植物造成危害。SOD可以把有害的超氧自由基O2-转化为H2O2,随后CAT和POD酶会立即将H2O2分解为完全无害的水,这3种酶相互协调共同形成一套完整的抗氧化体系,并且POD酶还具有氧化酚类、胺类、烃类等氧化产物,消除其毒性的作用[32-33]。虽然SOD、CAT和POD酶对细胞的生长具有重要的保护作用,但在保护植物本身的情况下对病原菌也起到了一定的保护作用。大量研究表明ROS与植物受病原菌侵染产生的过敏性坏死HR具有直接的关系,而SOD、POD、CAT等生物酶就是调控细胞内ROS的关键因子之一,所以抗氧化酶具有抑制植物过敏性坏死的的作用,这在以往的研究中已证实感病植株中这3种酶的水平较抗病植株具有显著的上升并具有抑制植物过敏性坏死的作用[34-37]。在本研究中,接菌后太白杨所有处理的SOD、CAT和POD酶活性都有一个显著的先上升后下降的相对趋势,并且太白杨属于青杨派是落叶松杨栅锈菌最易感病寄主之一,这与以往研究中感病植株抗氧化酶酶活性的显著上升变化相符[17, 19]。此外在第7天左右即进入夏孢子在叶片爆发性产生阶段,抗氧化酶活性较正常植株酶活性具有一个普遍的下调现象,被大家所普遍接受的原因为在锈菌的潜育期中杨树对锈菌具有一个较强的遏制作用,大量ROS产生,所以相应的抗氧化酶处于一个较高水平,但当锈菌进入爆发期时,叶片中的抗病机制受到严重破坏,ROS含量显著下降,抗氧化酶也随之变化,故呈现一个先上升后下降的趋势[17, 26, 38]。
MMS甲基化处理对抗氧化酶的调控中,SOD与POD较对照组整体处于一个下调水平,这证明MMS对植物具有抑制其活性氧ROS被清除的作用,这对提高杨树的抗锈病性具有重要的意义,并且在MMS处理中发现了太白杨部分叶片也出现了过敏性坏死现象。但CAT在MMS处理中并没有出现下调,反而整体呈现上调,我们推测MMS处理可能会引起叶片内H2O2的大爆发,这从生物酶机理角度很好的解释了MMS处理显著提高了杨树抗锈病性这一现象。除此之外,MMS甲基化处理中多酚氧化酶(PPO)活性较对照组总体呈现出一个先上升后下降的相对趋势且整体水平处于上调。PPO酶在功能上可以催化木质素的形成并且可以将多酚氧化成具有抑菌作用的醌类物质,因此PPO酶活性对病原菌的入侵具有普遍的抑制作用,也常常被用作指示杨树抗锈病能力的指标,MMS对PPO的促进作用在抗锈菌侵染方面也具有积极意义[17, 22-23, 26]。此外,在叶片孢子堆密度与各生物酶活性的相关分析中,多酚氧化酶(PPO)与孢子堆密度显著的负相关性(P=0.024,r=-0.309)在统计学上也充分证明了PPO的抑菌作用。
MMS是一种常见的通过诱导核苷酸烷基化而导致DNA损伤,癌变的化学诱导剂。经过MMS处理主要产生7-烷基鸟嘌呤,3-烷基腺嘌呤, 1-烷基腺嘌呤和3-烷基胞嘧啶,其中在DNA双链中7-甲基鸟嘌呤(m7G)在病变中占主导地位约85%,其次是3-甲基腺嘌呤(m3A)约占10%,在DNA单链中MMS可以使1-甲基腺嘌呤(m1A)和3-甲基胞嘧啶(m3C)分别提高10%和8%[39]。在以往的研究中DNA甲基化修饰常常激发DNA修复中的SOS机制,造成DNA复制过程中复制叉运动停止,使细胞在S期停滞,只有DNA经过复杂修复机制完成后,细胞周期的进程才会恢复,否则则会引起细胞的程序性死亡[40]。这与本研究中经高浓度MMS诱导后杨树叶片出现大量黑斑情况相符。除此之外,在酵母中MMS可以激活Ty1转座子显著提高酵母中的超阴离子(O2-)水平[41],因此本研究中杨树叶片活性氧(ROS)的爆发,不单单是因MMS作用于杨树所导致的,MMS诱导锈菌本身促进超阴离子(O2-)的释放可能也起到了一个重要作用。DNA甲基化同样在基因激活与沉默中可起重要的作用,例如甲基化可以通过修饰CCAAT元件促进NF-YA启动子特异性蛋白与启动子的结合,进一步促进hOGG1基因的过表达[42];在大肠杆菌中3-甲基化胞嘧啶(m3C)可以引起碱基替换突变, 导致部分基因功能丧失[39]。但在MMS增强杨树抗锈病的过程中,是否引起了杨树本身抗病基因的过表达或者锈菌致病基因的功能丧失仍不清楚,有待进一步探索。MMS虽然作为一种强致癌性药剂不适合在大田中广泛适用,但在前期育苗中可作为一种良好的炼苗剂,筛选生长旺盛且抗病性较强的种质具有重要的现实意义。并且本研究为进一步开展杨树抗锈病机理研究提供了新的思路。
-
在甲基化诱导太白杨生长中发现MMS处理会造成叶片波浪状卷曲或叶边缘内收等畸形、叶片黑斑、植株死亡等危害症状,但显著降低了太白杨锈病夏孢子堆密度,并延长了病菌的潜育期,甚至部分叶片出现过敏性坏死现象;在锈菌侵染中SOD、POD、CAT与PPO均呈现一个显著的先上升后下降的相对趋势,除PPO整体水平处于上调,其余3种抗氧化酶在接菌前6天整体处于上调,7天后夏孢子大量爆发而呈现下调;MMS处理使太白杨SOD与POD整体呈现下调,CAT与PPO呈现上调,这对提高杨树抗锈病性都具有积极的调节作用,其中PPO酶活性与夏孢子密度具有显著的负相关关系。本研究揭示了甲基化对杨树生长具有显著的调控作用,并提高了杨树抗锈病能力,为进一步进行太白杨甲基化组学研究和揭示其抗锈病分子机理提供了依据。
甲基磺酸甲醛(MMS)处理对太白杨抗锈性的影响
Effects of Methyl Methane Sulfonate Treatment on Rust Resistance of Populus purdomii
-
摘要:
目的 太白杨是松杨栅锈菌的天然寄主,DNA甲基化有可能改变太白杨抗锈性表观遗传特征,从而为揭示杨树抗锈病机理和抗病品种选育提供理论依据。 方法 通过不同浓度甲基磺酸甲醛(MMS)处理太白杨1年生幼苗和人工接种相同浓度的夏孢子悬液,统计各处理条件下,松杨栅锈菌潜育期和发病期夏孢子密度、植株的死亡率、叶片黑斑率、叶卷曲率等表观性状,分析甲基化处理对太白杨抗锈性影响;同时,采用分光光度法测量各处理在病程不同时期太白杨SOD、POD、CAT、PPO等防御酶活性,分析甲基化处理对太白杨生理的影响。 结果 叶片卷曲或叶边缘内收率、叶片黑斑率、植株死亡率与MMS浓度具有正相关性,但MMS同时对长势较好的植株也起到了炼苗的效果,经MMS处理后叶片颜色加深、革质增强。MMS处理能改变太白杨对松杨栅锈菌的抗性,病菌潜育期较对照延长1~2天,夏孢子堆密度随MMS浓度显著降低,寄主太白杨防御酶活性发生相应改变。MMS诱导杨树生长情况下,SOD与POD较对照组总体趋于下调、CAT与PPO较对照组总体趋于上调,且POD与PPO活性受MMS影响最大。接种锈菌后,在锈菌侵染过程中所测定的4种生物酶均出现先上升后下降的相对趋势,其中PPO与抗锈病能力具有显著的正相关关系(P=0.024)。 结论 甲基化处理可以提高太白杨的抗锈病能力的数量性状,通过延长病菌的潜育期、降低夏孢子堆密度和改变自身防御酶活性等特征,提高抗病能力。 Abstract:Objective Populus purdomii is one of the native host of Melampsora laricio-populina. DNA methylation may change the epigenetic rust resistance of P. purdomii. The purpose of this study is to understand the mechanism of poplar rust resistance. Method Different concentrations of methyl methane sulfonate (MMS) water solutions were applied to culture the 1-year-old P. purdomii seedlings, and urediospore suspensions with the same concentration were artificially inoculated on the abxial of leaves. Hereafter, epigenetic traits under various treatments were recorded consecutively, including the uredial density, the latent period, the plant mortality, the rate of leaf spots and curling symptoms. A spectrophotometric method was employed for monitoring the changes of the defense enzyme activities, involving SOD, CAT, POD and PPO during MMS treatments. Result MMS caused leaf curling, leaf blackness spots and even plant death with a positive correlation between the incidence and the MMS concentration, meanwhile, MMS also provided an chance for health seedlings survival under MMS treatments, the resistant seedlings displayed a more greener leaf and more thicker mesophyll tissues. Importantly, MMS treatment promoted the resistance of P. purdomii to M. larici-populina, the latent period of the pathogens was delayed for 1 to 2 days than that of the control group, the density of uredia decreased significantly with MMS concentration, and the activity of defense enzymes of the poplars changed correspondingly. Under the MMS treatments, the activities of SOD and POD tended to be down-regulated compared with the control group, CAT and PPO tended to be up-regulated, and the activity of POD and PPO was affected the most. However, during the infection of rust disease, all the four kinds of defense enzymes showed a relative trend of rising at first and then falling during MMS treatments. Among them, PPO showed a significant positive correlation with rust disease resistance (P=0.024). Conclusion MMS treatment will change the epigenetics by improving the quantitative rust resistance of Populus purdomii via delaying the latent period, decreasing uredial density and changing self-defense enzyme activity. -
Key words:
- Populus purdomii
- / methylation
- / Melampsora larici-populina
- / latent period
- / uredial density
- / defense enzyme activity
-
表 1 不同浓度MMS处理下叶片锈病发病情况
Table 1. The situation of leaf rust under different MMS concentrations
MMS浓度MMS concentration/(μmol·L-1) 潜育期Latent period/d 夏孢子堆密度Uredinial density/(个·cm-2) 7dpi 9dpi 11dpi 0.0 6±0.667 11.52±4.894 24.71±4.460 34.68±4.270 0.2 7±0.933 8.00±3.364 20.64±4.803 24.92±2.344 0.5 7±0.599 7.48±3.066 18.00±2.986 20.92±5.716 0.7 9±1.000 0.00 7.48±1.110 11.33±1.797 表 2 不同生物酶活性与孢子密度的相关性分析
Table 2. Correlation analysis of different enzyme activities and urediospore density
组别Group SOD POD CAT PPO 夏孢子密度 Pearson相关系数(r) -0.095 0.136 0.198 -0.309 显著性水平(P) 0.300 0.162 0.241 0.024 -
[1] Liang D, Zhang Z J, Wu H L, et al. Single-base-resolution methylomes of populous trichocarpa reveal the association between DNA methylation and drought stress[J]. BMC Genetics, 2014, 15(Suppl 1):S9. doi: 10.1186/1471-2156-15-S1-S9 [2] Stéphane H, David L J, Y Lin, et al. A Comprehensive analysis of genes encoding small secreted proteins identifies candidate effectors in Melampsora larici-populina (Poplar Leaf Rust)[J]. Molecular Plant-microbe Interactions, 2012, 25(3):190-293. [3] Duplessis S, Major I, Martin F, et al. Poplar and pathogen interactions:Insights from Populus genome-wide analyses of resistance and defense gene families and gene expression profiling[J]. Crit Rev Plant Sci, 2009, 28:309-334. doi: 10.1080/07352680903241063 [4] Pei M.H, Bayon C, Ruiz C. Phylogenetic relationships in some Melampsora rusts on Salicaceae assessed using rDNA sequence information[J]. Mycol Res, 2005, 109:401-409. doi: 10.1017/S0953756205002479 [5] Lister R, O'Malley R C, Tonti-Filippini J, et al. Highly integrated single-base resolution maps of the epigenome in Arabidopsis[J]. Cell, 2008, 133(3):523-536. doi: 10.1016/j.cell.2008.03.029 [6] Wang X, Elling A A, Li X, et al. Genome-wide and organ-specific landscapes of epigenetic modifications and their relationships to mRNA and small RNA transcriptomes in maize[J]. The Plant Cell Online, 2009, 21(4):1053-1069. doi: 10.1105/tpc.109.065714 [7] Colaneri A C, Jones A M. Genome-wide quantitative identification of DNA differentially methylated sites in arabidopsis seedlings growing at different water potential[J]. PloS One, 2013, 8(4):e59878. doi: 10.1371/journal.pone.0059878 [8] Wang W S, Pan Y J, Zhao X Q, et al. Drought-induced site-specific DNA methylation and its association with drought tolerance in rice (Oryza sativa L.)[J]. Journal of Experimental Botany, 2011, 62:1951-1960. doi: 10.1093/jxb/erq391 [9] Dowen R H, Pelizzola M, Schmitz R J, et al. Widespread dynamic DNA methylation in response to biotic stress[J]. Proc Natl Acad Sci USA, 2012, 109:E2183-E2191. doi: 10.1073/pnas.1209329109 [10] Labra M, Ghiani A, Citterio S, et al. Analysis of cytosine methylation pattern in response to water deficit in pea root tips[J]. Plant Biology, 2002, 4(6):694-699. doi: 10.1055/s-2002-37398 [11] Yu Y, Yang X, Wang H, et al. Cytosine methylation alteration in natural populations of Leymuschinensis induced by multiple abiotic stresses[J]. PloS One, 2013, 8(2):e55772. doi: 10.1371/journal.pone.0055772 [12] Cao S F, Zheng Y H, Yang Z F, et al. Effect of methyl jasmonate on the inhibition of Colletotrichum acutatum infection in loquat fruit and the possible mechanisms[J]. Postharvest Biol Technol, 2008, 49:301-307. doi: 10.1016/j.postharvbio.2007.12.007 [13] Uthup T K, Ravindran M, Bini K, et al. Divergent DNA methylation patterns associated with abiotic stress in Hevea brasiliensis[J]. Molecular Plant, 2011, 4(6):996-1013. doi: 10.1093/mp/ssr039 [14] Xu J D, Zhou S S, Gong X Q, et al. Single-basemethylome analysis reveals dynamic epigenomic differences associated with water deficit in apple[J]. Plant Biotechnology, 2018, 16:672-687. doi: 10.1111/pbi.12820 [15] Cao X B, Fan G Q, Zhai X Q. Morphological changes of the witches' broom seedlings of Paulownia tomentosa treated with methyl methane sulphonate and SSR analysis[J]. Acta Phytopathol, 2012, 42:214-218. [16] 曹支敏, 余仲东, 潘彦平, 等.中国落叶松-杨栅锈菌(Melampsora laricipopulina Kleb.)生理小种分化[J].植物病理学报, 2005(2):184-186. doi: 10.3321/j.issn:0412-0914.2005.02.015 [17] 陈祖静.杨树对叶锈病的生物化学抗性机制研究[D].杨凌, 西北农林科技大学. 2010. [18] 贺伟, 叶建仁.森林病理学[M].北京:中国林业出版社, 2017:66-70 [19] 刘莉丽.杨树对落叶松-杨栅锈菌的抗性研究[D].杨凌, 西北农林科技大学. 2009. [20] UmakantaSarker, Shinya Oba. Response of nutrients, minerals, antioxidant leaf pigments, vitamins, polyphenol, flavonoid and antioxidant activity in selected vegetable amaranth under four soil water content[J]. Food Chemistry, 2018, 252:72-83. doi: 10.1016/j.foodchem.2018.01.097 [21] Alici E H, Arabaci G. Determination of SOD, POD, PPO and CAT Enzyme. Activities in Rumexobtusifolius L[J]. Science Domain inter, 2016, 11(3):1-7. [22] Duan X F, Yang Q L, Tao N G. Effect of applying cinnamaldehyde incorporated in wax on green mould decay in citrus fruits[J]. Sci Food Agric, 2018, 98:527-533. doi: 10.1002/jsfa.8490 [23] Baohua Feng, Caixia Zhang, Tingting Chen, et al. Salicylic acid reverses pollen abortion of rice caused by heat stress[J]. BMC Plant Biology, 2018, 18:245. doi: 10.1186/s12870-018-1472-5 [24] UmakantaSarker, Shinya Oba. Drought stress enhances nutritional and bioactive compounds, phenolic acids and antioxidant capacity of Amaranthus leafy vegetable[J]. BMC Plant Biology, 2018, 18:258. doi: 10.1186/s12870-018-1484-1 [25] Liu H, Jiang W, Bi Y, et al. Postharvest BTH treatment induces resistance of peach (Prunuspersica L. cv. Jiubao) fruit to infection by Penicillium expansum and enhances activity of fruit defense mechanisms[J]. Postharvest Biology and Tech, 2005, 35:263-269. doi: 10.1016/j.postharvbio.2004.08.006 [26] 杨海燕, 杜宪, 潘淑慧, 等.不同抗锈病杨树品种防御酶活性变化的研究[J].现代农业科技, 2012, 12:139-141. [27] 李庆.镉胁迫下铈对玉米生理特性影响研究[D].雅安, 四川农业大学, 2013. [28] 刘慧英, 朱祝军, 吕国华.低温胁迫对嫁接西瓜耐冷性和活性氧清除系统的影响[J].应用生态学, 2004, 15(4):659-662. doi: 10.3321/j.issn:1001-9332.2004.04.024 [29] 王晨芳, 黄丽丽, 张宏昌, 等.小麦一条锈菌互作过程中活性氧及保护酶系的变化研究[J].植物病理学报, 2009, 39(1):52-60. doi: 10.3321/j.issn:0412-0914.2009.01.008 [30] 徐晓晖, 孙骏威, 郭泽建.植物与病原菌互作中活性氧的检测方法[J].中国计量学院学报, 2007, 18(1):49-53 doi: 10.3969/j.issn.1004-1540.2007.01.011 [31] Glazebrook J. Contrasting mechanisms of defense against biotrophic and necrotrophic pathogens[J]. Phytopathology, 2005, 43:205-227. doi: 10.1146/annurev.phyto.43.040204.135923 [32] Schouten A, Tenberge K B, Vermeer J, et al. Functional analysis of an extracelluar catalase of Botrytis cinerea[J]. Molecular Plant Pathology, 2002, 3(4):227-238. doi: 10.1046/j.1364-3703.2002.00114.x [33] Rolk Y, Liu S J, Quidde T, et al. Functional analysis of H2O2 generating systems in Botrytis cinerea:the major Cu-Zn-superoxide dismutase(BCSOD1)congtributes to virulence on French bean, whereas a glucose oxidase(BCGOD1)is dispensable[J]. Molecular Plant Pathology, 2004, 5(1):17-27. doi: 10.1111/j.1364-3703.2004.00201.x [34] Tenhaken R, Levine A, Brisson L F, et al. Function of the oxidative burst in hypersensitive disease resistance[J]. Proc Natl Acad Sci USA, 1995, 92(10):4158-4163. doi: 10.1073/pnas.92.10.4158 [35] Lamb C, Dixon R A. The oxidative burst in plant disease resistance[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1997, 48:251-275. doi: 10.1146/annurev.arplant.48.1.251 [36] Delledonne M, Murgia I, Ederle D, et al. Reactive oxygen intermediates modulate nitric oxide signaling in the plant hypersensitive disease-resistance response[J]. Plant Physiol Biochem, 2002, 40:605-610. doi: 10.1016/S0981-9428(02)01397-9 [37] Gozzo F. Systemic acquired resistance in crop protection:from nature to a chemical approach[J]. Journal Agricultural Food Chemical, 2003, 51(16):4487-4503. doi: 10.1021/jf030025s [38] 秦琼, 魏淑芳, 杜克云.不同程度的叶锈病对杨树生理代谢的影响[J].四川林业科技, 2016, 37(6):86-90. [39] Fix D, Canugovi C, Bhagwat A S. Transcription increases methylmethane sulfonate-induced mutations in alkB strains of Escherichia coli[J]. DNA Repair, 2008, 7:1289-1297. doi: 10.1016/j.dnarep.2008.04.008 [40] Chang M, Bellaoui M, Boone C, et al. A genome-wide screen for methyl methanesulfonate-sensitive mutants reveals genes required for S phase progression in the presence of DNA damage[J]. P Natl Acad Sci USA. 2002, 99:16934-16939. doi: 10.1073/pnas.262669299 [41] Stoycheva T. Methylmethane sulfonate increases the level of superoxide anions in yeast cells[J]. Biotechnol Biotec Eq, 2009, 23:688-692. doi: 10.1080/13102818.2009.10818518 [42] Lee M R, Kim S H, Cho H J, et al. Transcription factors NF-YA regulate the induction of human OGG1 following DNA-alkylating agent methylmethane sulfonate (MMS) treatment[J]. J Biol Chem, 2004, 279:9857-9866. doi: 10.1074/jbc.M311132200 -




 下载:
下载: