-
枫香(Liquidambar formosana Hance)是一种优良的抗逆树种选育材料,具有良好的生态适应性(抗风、耐水湿等)[1-4]。枫香作为常用的优良彩叶树种,在我国沿海平原地区防护林建设和城镇绿化中发挥了重要作用。北美枫香(L. styraciflua L.)原产于北美地区,生长速度快,树干挺直,在长江流域地区引种栽培成功。但枫香和北美枫香幼苗对盐胁迫均比较敏感[5],一定程度上制约了该类树种在我国沿海滩涂的大面积推广栽培。培育耐盐枫香是进一步提高沿海防护林体系生态效益的重要途径。利用基因工程技术培育耐盐转基因枫香植株取得了一定进展,如利用甘露糖筛选体系和根癌农杆菌介导法获得了转AtNHXI基因的耐盐植株[6]。然而,林木耐盐性是由多个数量性状基因控制的复杂性状,且育种周期长[7]。因此,在林木耐盐常规育种和分子育种研究中仍遇到很多难题。
根系共生菌对提高植物生产力和适应性至关重要[8]。内生真菌是一类栖息在健康植物组织内部、不引起宿主明显症状的共生菌类群。研究表明,在干旱、盐渍化等极端环境中生长的植物,所蕴含的内生真菌往往具有提高宿主生长、营养吸收和抗逆能力等生理生态功能[9-11]。如日本碱蓬(Suaeda japonica Makino.)中分离到的青霉(Penicillium sp.)菌株可显著增加水稻的株长和茎长[12];Qin等发现,从多种盐生植物根系分离的格孢腔目(Pleaporales)内生真菌,在有机氮条件下能有效促进植株生长[11]。作者前期对内陆和沿海滩涂多种盐生植物根系内生真菌资源进行了调查分析,发现镰刀菌(Fusarium spp.)也是常见的内生菌,且遗传多样性丰富。Maciá-Vicente等对地中海地带滩涂和内陆盐碱地24种植物根系内生真菌进行研究[13],发现尖孢镰刀菌(F. oxysporum Schl.)、茄病镰刀菌(F. solani (Mart.) Sacc.)和木贼镰刀菌(F. equiseti (Corda) Sacc.)等都是优势种。国内学者的一些研究也得出类似的结论,在翅碱蓬(S. heteroptera Kitag.)和盐角草(Salicornia bigelovii Torr.)等盐生植物中鉴定出多种内生镰刀菌[14-15]。一般而言,镰刀菌是一类重要的植物病原菌,严重影响经济林木和作物生产。目前对分布在盐碱地环境中的内生镰刀菌的生物学效应(对植株致病、有益,还是中性等)尚缺乏深入认识。本研究以分离自盐生植物滨麦(Leymus mollis (Trin.) Hara)的3株内生镰刀菌为材料,初步研究其基础生物学特性及其对北美枫香幼苗生长和耐盐性的影响,为进一步挖掘共生菌资源应用于林木抗性育苗提供理论基础和技术依据。
-
北美枫香种子由中国林科院亚热带林业研究所生态树种研究室保存。黄色镰刀菌(F. culmorum(Wm.G.Sm.) Sacc.)Class2-1B、假禾谷镰刀菌(F. pseudograminearum(O’Donnell & Aoki))Class2-1C和镰刀菌Class2-3分离自盐生植物滨麦的健康植株,由华盛顿大学Rodriguez博士馈赠。毒素测定试验中使用的禾谷镰刀菌(F. graminearum Schwabe)(FG-1)分离自玉米(Zea mays L.)病株根系,假禾谷镰刀菌野生强毒株(WZ2-8A)分离自小麦(Triticum aestivum L.)病株根系,2株病原镰刀菌分别由沈阳农业大学白庆荣副教授和河南农业大学李洪连教授馈赠。
-
将3株菌株分别接种在合成低营养琼脂SNA培养基(SNA)或康乃馨叶片培养基(CLA)平板上,25℃黑暗培养14 d后,用光学显微镜(Axio Scope A1,Zeiss公司)观察孢子形态并拍照;用马铃薯葡萄糖琼脂培养基(PDA)培养菌株7 d后观察记录菌落特征。根据镰刀菌鉴定手册对菌株的形态学特征进行描述[16]。
翻译延长因子(TEF-1α)被认为是区分镰刀菌种间差异的有效分子标记。使用真菌基因组DNA快速提取试剂盒(北京艾德莱生物科技有限公司)提取3株内生镰刀菌株的基因组DNA。利用引物EF1-983F(5’-GCYCCYGGHCAYCGTGAYTTYAT-3’)和EF1-2218R(5’-ATGACACCRACRGCRACRGTYTG-3’)扩增TEF-1α基因片段[17]。采用50 μL PCR扩增体系,具体反应条件参照Qin等的方法[11]。纯化后的产物送往擎科生物技术有限公司(杭州)测序。
使用EditSeq软件编辑TEF-1α序列并翻译出正确的氨基酸序列后,用Sequin软件将3种内生镰刀菌的TEF-1α序列及翻译的氨基酸序列上传至GenBank数据库,Class2-1B、Class2-1C和Class2-3的TEF-1α序列登录号分别为MF807227、MF807228和MF807229。使用BLAST搜索程序找到与已知3株镰刀菌TEF-1α序列相似性较高的匹配记录。使用ClustX 1.81软件进行多序列比对,再用GeneDoc软件进行序列头尾修饰,最后在PHYLIP软件包中使用Neighbor-joining法构建系统发育树。
-
为更准确地反映和比较3株内生镰刀菌的产毒素能力,选用2株强毒力病原镰刀菌禾谷镰刀菌FG-1和假禾谷镰刀菌野生强毒株WZ2-8A为阳性对照。用0.85%无菌生理盐水倒在PDA平板上洗脱孢子,配制浓度为1×105个·mL-1的5种镰刀菌孢子悬浮液。将100 g市售大麦粒与100 mL蒸馏水混合均匀后装入250 mL三角瓶内,121℃高压灭菌30 min。对照组每瓶加入0.85%无菌生理盐水1 mL,处理组每瓶加孢子悬浮液1 mL,每组设置3个重复。25℃黑暗培养14 d至菌丝充分侵染大麦粒后,将样品从三角瓶取出后风干、粉碎。处理后的样品送至江苏省农业科学院食品质量安全与检测研究所进行毒素检测分析。
-
北美枫香种子表面消毒后播种于育苗床,土壤基质组成为泥炭土:珍珠岩:蛭石:有机肥=1:2:2:2(121℃高压灭菌30 min),置于光照培养箱,保持85%相对湿度,光照条件为14 h光照/10 h黑暗,25℃恒温培养。21 d后,种子萌发并长成株高约3~4 cm的幼苗时,将幼苗从土壤基质中取出,剪去根部并放入体积分数为0.1%的升汞中消毒12 min,再用无菌水清洗4次。将表面消毒处理后的幼苗移入含WPM培养基(林木专用生根培养基)的试管中,1株·管-1。7 d后幼苗开始生根,21 d后幼苗株高约5~6 cm。随后将生长一致的幼苗转移到含有70 mL改良MS[18]培养基(蔗糖浓度调整为2 g·L-1)的PhytatrayTM Ⅱ无菌培养容器(规格11.4 cm×8.6 cm×10.2 cm,Sigma公司)中培养10 d后用于接种试验,每盒移植10株。
-
菌株在PDA平板上25℃培养14 d后,用0.85%无菌生理盐水倒在平板上洗脱孢子,制备终浓度为1×105个·mL-1的Class2-1B、lass2-1C和Class2-3菌株孢子悬浮液。吸取1 mL孢子液接种至无菌幼苗根部周围,对照组幼苗只加入0.85%无菌生理盐水,放置于组培架上培养,光照和温度条件同方法1.4。10 d后取接种内生镰刀菌的北美枫香幼苗根系,参照Padamsee等[19]的方法,以台盼蓝为染料,对根系样品进行染色。以50%甘油为浮载剂压片后,在光学显微镜下观察侵染结构。
-
接种处理同方法1.5。除3个菌株单独接种外,还设置混合接种处理组(含有等量3个菌株分生孢子),每个处理设置4个重复,10株·重复-1。共培养25 d后,将幼苗从培养容器中取出,测定生物量、株高、根长、叶片数等表型指标。随后将幼苗移植至经高压灭菌处理的栽培基质中,栽培基质组成为PPC(Profile porous ceramic):有机肥=4:1,每个PhytatrayTM Ⅱ培养容器中含土壤基质约350 g。刚移植的幼苗需盖上培养容器盖子以维持高湿度保证幼苗成活,7 d后揭开盖子。每周施加2次Hoagland营养液(5 mL·株-1),保证幼苗健康生长。移植后14 d,使用以Hoagland营养液为溶剂配制的质量浓度10 g·L-1的海盐溶液,对幼苗进行盐胁迫处理(5 mL·株-1),隔4 d进行第2次盐胁迫处理。至少进行2次独立重复试验,选择其中1次试验的数据进行统计分析。
-
盐胁迫处理10 d后收获所有实验幼苗,统计全株生物量、地上部分生物量、地下部分生物量、根冠比、株高、根长、叶片数。盐害指数受害分级标准如下:0级,叶片正常;1级,少量叶尖、叶缘或叶脉干枯或黄化;2级,50%叶片及少量茎段干枯或黄化;3级,80%以上叶片黄化,50%以上茎段干枯;4级,完全死亡。
盐害指数=∑(代表级数×株数)/(最高级值×总株数)×100% [20]。
叶绿素含量测定方法为:称取0.2 g新鲜叶片,用95%乙醇定容到25 mL,浸泡48 h,使用GENESYS 20分光光度计(Thermo公司, 美国),以95%乙醇为空白,分别测定470、649、665 nm的吸光值A470、A649和A665,计算叶绿素a、叶绿素b和类胡萝卜素等含量。
-
试验数据采用Excel 2013和SPSS 13.0软件分析处理,LSD法进行多重比较(P < 0.05)。
-
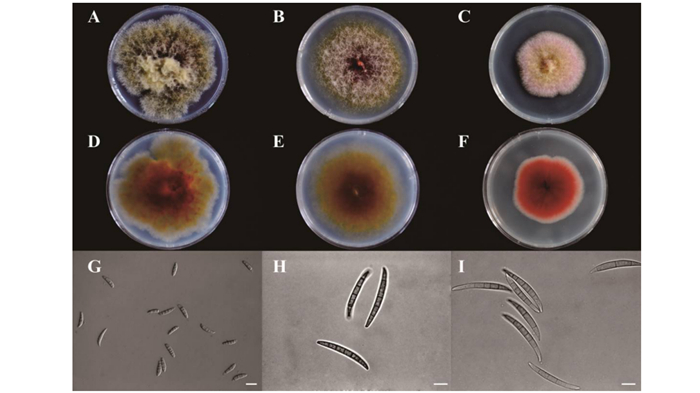
从图 1可以看出:3株镰刀菌菌株在PDA平板上培养后均能产生红色色素,其中,Class2-1B和Class2-1C生长速度较快,Class2-1B气生菌丝极其发达,Class2-3生长速度最慢。Class2-1B大型分生孢子较短,无明显弯曲,成熟孢子具34个隔膜,未观察到小型分生孢子。Class2-1C分生孢子较长无明显弯曲,成熟孢子具5~6个隔膜,未观察到小型分生孢子。Class2-3孢子顶端细胞明显变窄或呈喙状,3~5个隔膜,未观察到小型分生孢子。
图 1 3株内生镰刀菌菌落特征及孢子形态
Figure 1. Colony and conidia morphology of the three endophytic Fusarium isolates
为进一步探明3株内生镰刀菌的分类学地位,基于TEF-1α基因构建了部分镰刀菌物种的系统发育树。从图 2可以看出:Class2-1B和Class2-1C的遗传关系较近,而Class2-3与Class2-1B、Class2-1C遗传关系较远,并形成了一个独立的分支。其Class2-1B与2株黄色镰刀菌在同一分支,且bootstrap值(自展值)达到100;Class2-1B与假禾谷镰刀菌遗传关系最近,bootstrap值也为100;同时,参考镰刀菌物种鉴定手册[16],发现Class2-1B和Class2-1C分别与黄色镰刀菌和假禾谷镰刀菌的培养特征和产孢结构吻合,故将Class2-1B鉴定为黄色镰刀菌,Class2-1C鉴定为假禾谷镰刀菌。虽然BLAST搜索结果表明,与Class2-3的TEF-1α序列匹配度较高为禾谷镰刀菌与假禾谷镰刀菌,形态学特征与禾谷镰刀菌也较相近,但在系统发育树中,Class2-3处在禾谷镰刀菌、假禾谷镰刀菌和黄色镰刀菌进化分支的基部,且分支较长,推测可能是潜在的新种,故在本研究中,尚未将其鉴定到种。
-
从表 1可以看出:测试的5株镰刀菌都能产生毒素,且毒素类型不同,主要检测到8种毒素,痕量的毒素种类未列出。Class2-1B能产生4种毒素,包括3-乙酰基脱氧雪腐镰刀菌烯醇、15-乙酰基脱氧雪腐镰刀菌烯醇、玉米赤酶烯酮和腾毒素;Class2-1C只产生前2种毒素,除Class2-1B产生的玉米赤酶烯酮浓度接近100 μg·L-1外,其余毒素含量都极低(少于10 μg·L-1)。相反,Class2-3虽然产生毒素类型较少,但恩镰孢菌素含量极高,浓度接近8 000 μg·L-1,同时也产生少量的串珠镰刀菌素。2株病原镰刀菌均产生极高量的玉米赤酶烯酮,其中,WZ2-8A毒株产生的毒素种类较多。
表 1 5株镰刀菌产毒素类型及含量测定
Table 1. In vitro toxin production of five Fusarium isolates
毒素种类
Types of mycotoxinClass2-1B Class2-1C Class2-3 FG-1 WZ2-8A 脱氧雪腐镰刀菌烯醇
Deoxynivalenol/(μg·L-1)- - - - 77.91±45.18 3-乙酰基脱氧雪腐镰刀菌烯醇
3-Acetyldeoxynivalenol/(μg·L-1)9.90±0.64 4.07±2.65 - - 44.43±23.45 15-乙酰基脱氧雪腐镰刀菌烯醇
15-Acetyldeoxynivalenol/(μg·L-1)3.14±2.10 4.68±0.91 - 2.93±1.80 146.41±62.35 玉米赤酶烯酮Zearalenone/(μg·L-1) 95.79±35.22 - - 4 549.43±432.65 8 249.15±1 763.04 伏马毒素B1Fumonisin B1/(μg·L-1) - - - 138.78±4.13 - 恩镰孢菌素Enniatin/(μg·L-1) - - 7 892.20±348.53 - - 腾毒素Tentoxin/(μg·L-1) 1.095±0.54 - - 5.96±0.97 5.09±0.77 串珠镰刀菌素Moniliformin/(μg·L-1) - - 47.75±25.41 - - -
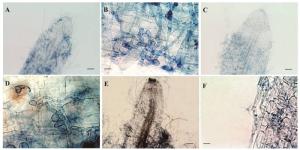
图 3为利用台盼蓝组织染色法观察3株内生镰刀菌侵染幼苗根系后形成的结构特征。从图 3可以看出:Class2-1B、Class2-1C能顺利进入根部皮层细胞并形成明显侵染结构,且侵染强度高,菌丝分化成串珠状的膨大细胞;而Class2-3菌丝多数只在根表定殖,在皮层细胞组织中几乎观察不到菌丝的结构,且根系组织出现褐化现象。
-
从接种试验结果(图 4、图 5A~E)可以看出:共培养25 d后,3株内生镰刀菌对北美枫香幼苗生长的调控存在正负效应,其中,Class2-1B和Class2-1C对幼苗表现出明显的促生效应,而Class2-3对幼苗的生长具有明显的抑制作用,表现出强致病性。在培养后期,Class2-3菌丝可逐渐蔓延至幼苗地上部分,最终导致幼苗萎蔫死亡,这与Class2-3产生大量恩镰孢菌素有直接关系。Class2-1B和Class2-1C虽然菌丝生长旺盛(在MS培养基上产生红色色素),却不能侵染幼苗地上部分。混合孢子接种的幼苗长势也良好,推测混合接种后,Class2-3未能成为优势菌,可能与Class2-1B和Class2-1C较快的生长速度有关。

图 4 共培养体系下不同处理组幼苗生长情况比较
Figure 4. Comparison of seedling growth between five treatments under co-culture system

图 5 盐胁迫前后各处理组幼苗生长情况对比
Figure 5. Comparison of seedling growth between treatments under normal and saline conditions.
由表 2中表型指标可以看出:接种Class2-1B、Class2-1C和混合接种的幼苗生物量显著高于对照组幼苗和Class2-3接种的幼苗。与对照组相比,Class2-1B、Class2-1C接种幼苗的株高、根长和单株的叶片数量均有增加,多数差异显著(P < 0.05)。Class2-1B促进幼苗生物量积累的能力最优,Class2-1C主要促进幼苗叶片数、株高和根长的增加,混合接种对幼苗生长有一定的促进作用,但不如Class2-1B和Class2-1C处理组效果明显。
表 2 盐胁迫前接种内生镰刀菌对北美枫香幼苗表型的影响
Table 2. Phenotypic indicators of L.styraciflua seedlings under normal condition after inoculation with three endophytic Fusarium isolates
处理
Treatments生物量
Fresh weight /mg叶片数
Number of leaves株高
Seedling height/mm根长
Root length/mm对照组Control 114.00±23.99 c 7.43±1.43 b 34.71±5.29 b 19.43±8.20 b Class2-1B 158.43±36.01 a 7.75±1.45 ab 39.98±5.50 a 20.23±4.91 b Class2-1C 147.90±26.66 ab 8.10±0.81 a 41.08±5.52 a 24.43±6.77 a Class2-3 87.28±19.42 d 5.72±1.61 c 31.01±4.84 c 13.81±3.45 c 混合接种Mixed inoculation 142.74±29.19 b 7.87±1.38 ab 35.97±6.28 b 18.67±6.66 b 注:同列数据后不同小写字母表示处理间在0.05水平差异显著,下同。
Note: values followed by different letters in the same column are significantly different among the treatments at the 0.05 level, the same below.由于接种Class2-3的北美枫香幼苗后期全部死亡,故在盐胁迫试验中并未设置Class2-3接种处理组。盐胁迫处理10 d后,测定植株表型指标、盐害指数和叶绿素含量(表 3、4)。经盐胁迫处理后,Class2-1B接种的幼苗株高显著高于对照组和混合接种组,比对照组株高增加了约22%。3个处理组幼苗的整株生物量和地上生物量均高于对照组,但差异不显著。Class2-1B处理组幼苗的盐害指数最低,与对照组相比,差异显著(P=0.016 6)。叶绿素含量的测定结果(表 4)显示,各处理组与对照组叶片叶绿素含量并无显著性差异。
表 3 盐胁迫后接种内生镰刀菌对北美枫香幼苗表型的影响
Table 3. Phenotypic indicators of Liquidambar styraciflua seedlings under saline condition after inoculation with three endophytic Fusarium isolates
组别 全株生物量
Total freshweight/mg地上生物量
Abovegroundfresh weight/mg地下生物量
Belowgroundfresh weight/mg根冠比
Root-canopy ratio株高
Seedling height/mm根长
Root length/mm叶片数
Numberof leaves盐害指数
Salt injuryindex对照组
Control126.95±55.05 a 94.59±42.98 a 32.36±18.87 a 0.38±0.24 a 40.95±7.82 c 22.09±7.41 b 6.86±1.81 a 59.02±0.54 a Class2-1B 151.26±58.84 a 115.19±51.14 a 36.06±16.68 a 0.35±0.17 a 50.16±7.97 a 23.29±10.75 b 6.87±2.25 a 33.22±3.23 b Class2-1C 140.73±53.14 a 116.20±42.13 a 24.53±17.46 b 0.21±0.13 b 47.63±9.60 ab 21.07±10.65 b 7.23±1.75 a 36.20±5.59 b 混合接种
Mixed inoculation140.96±60.63 a 105.00±45.75 a 35.96±19.61 a 0.35±0.19 a 45.39±7.58 bc 33.61±15.23 a 7.17±2.04 a 66.90±12.86 a 表 4 盐胁迫后接种内生镰刀菌对北美枫香幼苗叶绿体色素含量的影响
Table 4. Chloroplast pigment contents of L. styraciflua seedlings between four treatments under saline condition
组别 叶绿素a含量
Chl a content /(mg·g-1)叶绿素b含量
Chl b content /(mg·g-1)类胡萝卜素含量
Carotenoid content/(mg·g-1)叶绿素含量
Chl content /(mg·g-1)类胡萝卜素/
叶绿素Car/Chl叶绿素a /叶绿素b
Chl a/Chl b对照组Control 1.837 5±0.185 7 a 0.836 1±0.113 6 a 0.320 8±0.029 3 a 2.673 6±0.299 1 a 0.120 2±0.003 2 a 2.205 1±0.072 5 a Class2-1B 1.719 2±0.213 2 a 0.775 9±0.126 3 a 0.294 4±0.034 5 a 2.495 1±0.338 5 a 0.118 2±0.002 4 a 2.227 0±0.096 6 a Class2-1C 1.780 3±0.197 5 a 0.812 6±0.118 1 a 0.306 9±0.033 2 a 2.592 9±0.315 4 a 0.118 6±0.001 9 a 2.198 9±0.076 3 a 混合接种
Mixed inoculation1.992 9±0.217 2 a 0.903 0±0.142 3 a 0.341 4±0.031 6 a 2.896 0±0.359 6 a 0.118 2±0.004 2 a 2.218 6±0.098 5 a -
本研究比较了3株盐碱地内生镰刀菌产毒素能力及其调控北美枫香幼苗生长和耐盐性的差异。综合分析试验数据,表明Class2-1B和Class2-1C对北美枫香幼苗具有较明显的促生和耐盐功效,而Class2-3菌株对幼苗生长具有抑制作用。考虑到Class2-1B和Class2-1C菌株生长速度较快,可能会导致在菌丝根系组织中侵染量过大而伤害植株,作者曾尝试以低碳源(蔗糖浓度调整为0.2 g·L-1)的MS培养基进行共培养,接种的孢子液浓度也降至1×104 个·mL-1,在该条件下,3个菌株生长缓慢,基质表面菌丝生长稀疏,也无色素形成,对幼苗生长无显著促进或抑制效应(结果未列出)。这表明Class2-1B和Class2-1C对苗木发挥有益功效可能需要在高剂量接种条件下才能实现。2个菌株在根部皮层细胞形成的高强度侵染结构也佐证了上述推断。但多数研究认为,无论是菌根真菌还是内生真菌,菌丝过度侵染根系会抑制植物生长。如Kaldorf等研究发现,将杂交杨(Populus tremula × P. tremuloides)幼苗移植至预先培养好的内生真菌-印度梨形孢(Serendipita indica ((Sav. Verma, Aj. Varma, Rexer, G. Kost & P. Franken) M. Wei, Waller, A. Zuccaro & Selosse))培养基质中,幼苗生长明显迟缓;相反,待苗木生长一段时间后再接种该菌株,则表现出显著的促生效应[21]。
毒素被认为是植物病原真菌的主要致病因子之一[22]。镰刀菌能产生近20种毒素[23-24],除了作为重要的林木和农作物病原菌,镰刀菌也是常见的植物内生菌[13, 25-26]。此外,从抑病型土壤中分离到的某些非致病性镰刀菌可以诱导植物产生抗病性[27-28]。如非致病性木贼镰刀菌接种黄瓜(Cucumis sativus L.)后能抑制炭疽病的发生[29]。这些能诱导植物抗病性的镰刀菌往往不产生高浓度毒素[30-32]。本研究结果支持了上述结论,3株内生镰刀菌对北美枫香幼苗生长和耐盐性的正负调控效应与其毒素类型或含量相关。Class2-1B和Class2-1C 2株菌株产生毒素类型和含量均较少,推测镰刀菌与宿主(盐生植物)在协同进化过程中,可能丢失了部分毒素合成基因或功能基因拷贝数减少。因此,作者认为,通过体外检测毒素可初筛具有促生和增强苗木适应性的镰刀菌菌株。同时,本研究结果也说明极端环境中的内生镰刀菌也具有致病性,主要取决于菌株的毒素浓度。
如前所述,尽管Class2-1B和Class2-1C对苗木生长和耐盐性均有促进作用,但二者发挥功能的程度和方式有一定差异:Class2-1B主要促进植株生物量的积累,而Class2-1C能显著提高植株叶片数、株高和根长。毒素检测结果表明,Class2-1C产生的毒素类型和含量比Class2-1B更少,推测2个菌株在基础生物学性状方面可能有较大差异。目前,病原镰刀菌全基因组测序进展很快[33],黄色镰刀菌、假禾谷镰刀菌和禾谷镰刀菌等物种全基因组数据已陆续公布。作者实验室正在开展2个菌株的基因组重测序及核心/泛基因组分析,有望找到菌株特异性功能基因,为揭示互作的分子机制提供重要线索。
此外,Class2-1B和Class2-1C促进苗木生长和耐盐性的生理与分子机制有待进一步探究。如2株镰刀菌能否生产植物激素类物质?如何影响苗木矿质元素吸收?在盐胁迫下如何维持K+/Na+离子平衡?抗氧化酶系统和渗透物质的变化规律及Class2-1B和Class2-1C对苗木耐盐能力是否具有协同增益等,均是下一步需要探索的重要问题。从应用角度看,今后还需开展大规模盆栽及野外接种试验,选择杨树(Populus spp.)、栎树(Quercus spp.)等多个沿海防护林造林树种,研究内生镰刀菌提高苗木的耐盐碱能力,为将内生菌生物技术应用于林木抗性育苗提供理论基础。
-
3株内生镰刀菌菌株对北美枫香幼苗生长和耐盐的调控作用存在显著差异,其中,Class2-1B和Class2-1C能有效促进苗木生长和耐盐性,而Class2-3严重抑制苗木生长。这种林木根系-内生真菌互作的正负效应可能与镰刀菌产毒素类型及含量有密切关系。
3株滨麦内生镰刀菌毒素积累及对北美枫香幼苗生长和耐盐性的影响
Toxin Accumulation of Three Leymus mollis-associated Endophytic Fusarium Isolates and Their Effects on Growth and Salt Tolerance of Liquidambar styraciflua Seedlings
-
摘要:
目的 探讨3株源于滨麦的内生镰刀菌对北美枫香幼苗生长和耐盐性的调控效应,为开发极端环境中内生菌资源应用于林木抗性育苗提供理论基础。 方法 结合形态学和分子系统学方法鉴定内生镰刀菌并体外检测其毒素种类及含量,建立内生镰刀菌与无菌北美枫香实生幼苗共培养体系;利用台盼蓝染色观察菌株在根系组织中形成的侵染结构;在正常和盐胁迫条件下,研究内生镰刀菌对幼苗生长和耐盐性的影响。 结果 3个菌株分别为黄色镰刀菌(Class2-1B)、假禾谷镰刀菌(Class2-1C)和1株未鉴定到种的镰刀菌(Class2-3)。与2株强毒力农作物病原镰刀菌相比,Class2-1B、Class2-1C产毒素类型和含量极少,而Class2-3能产生大量恩镰孢菌素。Class2-1B、Class2-1C菌丝能顺利进入根部皮层细胞并形成串珠状的膨大细胞,Class2-3菌丝几乎只在根表定殖。接种试验表明:Class2-1B、Class2-1C接种幼苗的生物量、株高、根长和叶片数等多数指标显著高于对照组(P < 0.05),而Class2-3对幼苗生长有明显的抑制和毒害作用。3个菌株孢子混合接种也对幼苗表现出一定的促生效应。在海盐溶液胁迫处理下,Class2-1B处理组幼苗盐害指数显著低于对照组(P < 0.05),但处理组幼苗叶绿素体色素含量与对照组相比并无显著差异。 结论 3株内生镰刀菌菌株对北美枫香幼苗生长和耐盐的调控存在显著差异,正负效应可能与镰刀菌产毒素类型及含量有密切关系。 Abstract:Objective To evaluate the potential use of endophytes from extreme conditions as novel probiotics in improving salt tolerance of tree seedlings. Method The effects of three endophytic Fusarium isolates, recovering from the halophytic Leymus mollis, on the growth and salt tolerance of Liquidambar styraciflua seedlings were investigated. The three isolates were identified through morphological description and molecular phylogeny. In vitro toxin production of the endophytic Fusarium isolates were analyzed. The co-culturing system was used to investigate the binary interactions between gnotobiotic seedlings and Fusarium isolates under normal and saline conditions. Tissue staining method was applied to examine the fungal infection structures formed in roots. Result Two Fusarium isolates were identified to F. culmorum (Class2-1B) and F. pseudograminearum (Class2-1C), and the other one (Class2-3) was not currently identified to the species level. In comparison to two pathogenic Fusarium species, the Class2-1B and Class2-1C only produced very low level of several toxins, while the Class2-3 produced a large amount of enniatine. Both Class2-1B and Class2-1C exhibited an extensive colonization pattern in roots, but the hyphae of the Class2-3 seldom entered the inner root tissues and just distributed around the root surface. Inoculation experiment confirmed that the biomass, seedling height, root length and number of leaves in plants treated with either Class2-1B or Class2-1C were higher than the control group, although not all differences reached the significant level. In contrast, the plant growth was obvious inhibited in the presence of the Class2-3. Under salinity stress, it appeared that most seedlings inoculated with either the Class2-1B or Class2-1C were more salt tolerant, particularly for the Class2-1B treatment, than the control and mixed inoculation groups as evidence by the salt injury index. However, the chlorophyll contents in all treatments did not differ significantly. Conclusion The degree of endophytic Fusarium-mediated plant growth and salt tolerance mainly depends on different Fusarium species. The result of the study, at least in part, demonstrates that the positive or negative effect of endophytic Fusarium on plants might be related to the type and content of the toxins they produced. -
Key words:
- endophytic fungi
- / salt tolerance
- / symbiosis
-
表 1 5株镰刀菌产毒素类型及含量测定
Table 1. In vitro toxin production of five Fusarium isolates
毒素种类
Types of mycotoxinClass2-1B Class2-1C Class2-3 FG-1 WZ2-8A 脱氧雪腐镰刀菌烯醇
Deoxynivalenol/(μg·L-1)- - - - 77.91±45.18 3-乙酰基脱氧雪腐镰刀菌烯醇
3-Acetyldeoxynivalenol/(μg·L-1)9.90±0.64 4.07±2.65 - - 44.43±23.45 15-乙酰基脱氧雪腐镰刀菌烯醇
15-Acetyldeoxynivalenol/(μg·L-1)3.14±2.10 4.68±0.91 - 2.93±1.80 146.41±62.35 玉米赤酶烯酮Zearalenone/(μg·L-1) 95.79±35.22 - - 4 549.43±432.65 8 249.15±1 763.04 伏马毒素B1Fumonisin B1/(μg·L-1) - - - 138.78±4.13 - 恩镰孢菌素Enniatin/(μg·L-1) - - 7 892.20±348.53 - - 腾毒素Tentoxin/(μg·L-1) 1.095±0.54 - - 5.96±0.97 5.09±0.77 串珠镰刀菌素Moniliformin/(μg·L-1) - - 47.75±25.41 - - 表 2 盐胁迫前接种内生镰刀菌对北美枫香幼苗表型的影响
Table 2. Phenotypic indicators of L.styraciflua seedlings under normal condition after inoculation with three endophytic Fusarium isolates
处理
Treatments生物量
Fresh weight /mg叶片数
Number of leaves株高
Seedling height/mm根长
Root length/mm对照组Control 114.00±23.99 c 7.43±1.43 b 34.71±5.29 b 19.43±8.20 b Class2-1B 158.43±36.01 a 7.75±1.45 ab 39.98±5.50 a 20.23±4.91 b Class2-1C 147.90±26.66 ab 8.10±0.81 a 41.08±5.52 a 24.43±6.77 a Class2-3 87.28±19.42 d 5.72±1.61 c 31.01±4.84 c 13.81±3.45 c 混合接种Mixed inoculation 142.74±29.19 b 7.87±1.38 ab 35.97±6.28 b 18.67±6.66 b 注:同列数据后不同小写字母表示处理间在0.05水平差异显著,下同。
Note: values followed by different letters in the same column are significantly different among the treatments at the 0.05 level, the same below.表 3 盐胁迫后接种内生镰刀菌对北美枫香幼苗表型的影响
Table 3. Phenotypic indicators of Liquidambar styraciflua seedlings under saline condition after inoculation with three endophytic Fusarium isolates
组别 全株生物量
Total freshweight/mg地上生物量
Abovegroundfresh weight/mg地下生物量
Belowgroundfresh weight/mg根冠比
Root-canopy ratio株高
Seedling height/mm根长
Root length/mm叶片数
Numberof leaves盐害指数
Salt injuryindex对照组
Control126.95±55.05 a 94.59±42.98 a 32.36±18.87 a 0.38±0.24 a 40.95±7.82 c 22.09±7.41 b 6.86±1.81 a 59.02±0.54 a Class2-1B 151.26±58.84 a 115.19±51.14 a 36.06±16.68 a 0.35±0.17 a 50.16±7.97 a 23.29±10.75 b 6.87±2.25 a 33.22±3.23 b Class2-1C 140.73±53.14 a 116.20±42.13 a 24.53±17.46 b 0.21±0.13 b 47.63±9.60 ab 21.07±10.65 b 7.23±1.75 a 36.20±5.59 b 混合接种
Mixed inoculation140.96±60.63 a 105.00±45.75 a 35.96±19.61 a 0.35±0.19 a 45.39±7.58 bc 33.61±15.23 a 7.17±2.04 a 66.90±12.86 a 表 4 盐胁迫后接种内生镰刀菌对北美枫香幼苗叶绿体色素含量的影响
Table 4. Chloroplast pigment contents of L. styraciflua seedlings between four treatments under saline condition
组别 叶绿素a含量
Chl a content /(mg·g-1)叶绿素b含量
Chl b content /(mg·g-1)类胡萝卜素含量
Carotenoid content/(mg·g-1)叶绿素含量
Chl content /(mg·g-1)类胡萝卜素/
叶绿素Car/Chl叶绿素a /叶绿素b
Chl a/Chl b对照组Control 1.837 5±0.185 7 a 0.836 1±0.113 6 a 0.320 8±0.029 3 a 2.673 6±0.299 1 a 0.120 2±0.003 2 a 2.205 1±0.072 5 a Class2-1B 1.719 2±0.213 2 a 0.775 9±0.126 3 a 0.294 4±0.034 5 a 2.495 1±0.338 5 a 0.118 2±0.002 4 a 2.227 0±0.096 6 a Class2-1C 1.780 3±0.197 5 a 0.812 6±0.118 1 a 0.306 9±0.033 2 a 2.592 9±0.315 4 a 0.118 6±0.001 9 a 2.198 9±0.076 3 a 混合接种
Mixed inoculation1.992 9±0.217 2 a 0.903 0±0.142 3 a 0.341 4±0.031 6 a 2.896 0±0.359 6 a 0.118 2±0.004 2 a 2.218 6±0.098 5 a -
[1] 刘述河, 丁朋松, 金丽凤, 等.上海地区国外树种引种调查分析[J].中国农学通报, 2011, 27(31):305-309. [2] 孙海菁, 王树凤, 陈益泰.不同枫香种源对淹水胁迫的响应[J].南京林业大学学报:自然科学版, 2012, 36(3):43-48. [3] 张玲, 王树凤, 陈益泰, 等. 3种枫香的根系构型及功能特征对干旱的响应[J].土壤, 2013, 45(6):1119-1126. [4] 冷华妮, 陈益泰, 段红平, 等.磷胁迫对不同种源枫香生长及氮、磷吸收利用率的影响[J].应用生态学报, 2009, 20(4):754-760. [5] Miyamoto S, Martinez I, Padilla M, et al. Landscape plant lists for salt tolerance assessment[R]. El Paso: Texas A&M University Agricultural Research and Extension Cente, Texas Agricultural Experiment Station, 2004. [6] Qiao G, Zhou J, Jiang J, et al. Transformation of Liquidambar formosana L. via Agrobacterium tumefaciens using a mannose selection system and recovery of salt tolerant lines[J]. Plant Cell, Tissue and Organ Culture, 2010, 102(2):163-170. doi: 10.1007/s11240-010-9717-5 [7] Coleman-Derr D, Tringe S G. Building the crops of tomorrow:advantages of symbiont-based approaches to improving abiotic stress tolerance[J]. Frontiers in Microbiology, 2014, 6:283. doi:10.3389/fmicb.2014.00283. [8] Qin Y, Druzhinina I S, Pan X, et al. Microbially mediated plant salt tolerance and microbiome-based solutions for saline agriculture[J]. Biotechnology Advances, 2016, 34(7):1245-1259. doi: 10.1016/j.biotechadv.2016.08.005 [9] Marasco R, Rolli E, Ettoumi B, et al. A drought resistance-promoting microbiome is selected by root system under desert farming[J]. PLoS One, 2012, 7(10):e48479. doi: 10.1371/journal.pone.0048479 [10] Yuan Z L, Druzhinina I S, Labbé J, et al. Specialized microbiome of a halophyte and its role in helping non-host plants to withstand salinity[J]. Scientific Reports, 2016, 6:32467. doi:10.1038/srep32467. [11] Qin Y, Pan X, Kubicek C, et al. Diverse plant-associated Pleosporalean fungi from saline areas:ecological tolerance and nitrogen-status dependent effects on plant growth[J]. Frontiers in Microbiology, 2017, 8:158. doi:10.3389/fmicb.2017.00158. [12] You Y H, Yoon H, Kang S M, et al. Fungal diversity and plant growth promotion of endophytic fungi from six halophytes in Suncheon Bay[J]. Journal of Microbiology and Biotechnology, 2012, 22(11):1549-1556. doi: 10.4014/jmb [13] Maciá-Vicente J G, Jansson H B, Abdullah S K, et al. Fungal root endophytes from natural vegetation in Mediterranean environments with special reference to Fusarium spp[J]. FEMS Microbiology Ecology, 2008, 64(1):90-105. [14] 钮旭光, 宋立超, 韩梅, 等.盐生植物翅碱蓬的内生真菌多样性分析[J].微生物学通报, 2012, 39(10):1388-1395. [15] 赵育卉, 李连强, 湛东锐, 等.盐生海芦笋内生真菌S19的分离鉴定与抗氧化发酵条件优化[J].南京农业大学学报, 2013, 36(2):137-144. [16] Leslie J F, Summerell B A. The Fusarium laboratory manual[M]. Ausralia:Blackwell Publishing, 2008. [17] Rehner S A, Buckley E. A Beauveria phylogeny inferred from nuclear ITS and EF1-α sequences:evidence for cryptic diversification and links to Cordyceps teleomorphs[J]. Mycologia, 2005, 97(1):84-98. [18] Murashige T, Skoog F. A revised medium for rapid growth and bio assays with tobacco tissue cultures[J]. Physiologia Plantarum, 1962, 15(3):473-497. doi: 10.1111/ppl.1962.15.issue-3 [19] Padamsee M, Johansen R B, Stuckey S A, et al. The arbuscular mycorrhizal fungi colonising roots and root nodules of New Zealand kauri Agathis australis[J]. Fungal Biology, 2016, 120(5):807-817. doi: 10.1016/j.funbio.2016.01.015 [20] 孙仲序, 杨红花, 崔得才, 等.转基因杨树的抗盐性分析[J].生物工程学报, 2002, 18(4):481-485. doi: 10.3321/j.issn:1000-3061.2002.04.017 [21] Kaldorf M, Koch B, Rexer K H, et al. Patterns of interaction between Populus Esch5 and Piriformospora indica:a transition from mutualism to antagonism[J]. Plant Biology, 2005, 7(2):210-218. doi: 10.1055/s-2005-837470 [22] Pusztahelyi T, Holb I J, Pócsi I. Secondary metabolites in fungus-plant interactions[J]. Frontiers in Plant Science, 2015, 6:573. [23] Bacon C W, Porter J K, Norred W P, et al. Production of fusaric acid by Fusarium species[J]. Applied and Environmental Microbiology, 1996, 62(11):4039-4043. [24] 张岳平.镰刀菌真菌毒素产生与调控机制研究进展[J].生命科学, 2011, 23(3):311-316. [25] Yates I E, Bacon C W, Hinton D M. Effects of endophytic infection by Fusarium moniliforme on corn growth and cellular morphology[J]. Plant Disease, 1997, 81(7):723-728. doi: 10.1094/PDIS.1997.81.7.723 [26] Imazaki I, Kadota I. Molecular phylogeny and diversity of Fusarium endophytes isolated from tomato stems[J]. FEMS Microbiology Ecology, 2015, 91(9):fiv098. doi: 10.1093/femsec/fiv098 [27] Fuchs J G, Moënne-Loccoz Y, Défago G. Nonpathogenic Fusarium oxysporum strain Fo47 induces resistance to Fusarium wilt in tomato[J]. Plant Disease, 1997, 81(5):492-496. doi: 10.1094/PDIS.1997.81.5.492 [28] Edel V, Steinberg C, Gautheron N, et al. Populations of nonpathogenic Fusarium oxysporum associated with roots of four plant species compared to soilborne populations[J]. Phytopathology, 1997, 87(7):693-697. doi: 10.1094/PHYTO.1997.87.7.693 [29] Saldajeno M G B, Hyakumachi M. The plant growth-promoting fungus Fusarium equiseti and the arbuscular mycorrhizal fungus Glomus mosseae stimulate plant growth and reduce severity of anthracnose and damping-off diseases in cucumber (Cucumis sativus) seedlings[J]. Annals of Applied Biology, 2011, 159(1):28-40. doi: 10.1111/aab.2011.159.issue-1 [30] Bacon C W, Hinton D M. Symptomless endophytic colonization of maize by Fusarium moniliforme[J]. Canadian Journal of Botany, 1996, 74(8):1195-1202. doi: 10.1139/b96-144 [31] Freeman S, Zveibil A, Vintal H, et al. Isolation of nonpathogenic mutants of Fusarium oxysporum f. sp. melonis for biological control of Fusarium wilt in cucurbits[J]. Phytopathology, 2002, 92(2):164-168. doi: 10.1094/PHYTO.2002.92.2.164 [32] Paparu P, Dubois T, Gold C S, et al. Screenhouse and field persistence of nonpathogenic endophytic Fusarium oxysporum in Musa tissue culture plants[J]. Microbial Ecology, 2008, 55(3):561-568. doi: 10.1007/s00248-007-9301-7 [33] Ma L J, Geiser D M, Proctor R H, et al. Fusarium pathogenomics[J]. Annual Review of Microbiology, 2013, 67:399-416. doi: 10.1146/annurev-micro-092412-155650 -




 下载:
下载: